JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
소분자 억제제 스크리닝을 위한 NADH 결합 ATPase 분석의 반 높은 처리량 적응
요약
니코틴아미드 아데닌 디뉴클레오티드(NADH)-결합 된 ATPase 분석제는 소분자 미오신 억제제의 반고 처리량 스크리닝에 적응되었다. 이 운동 분석은 384웰 마이크로플레이트 형식으로 실행되며 총 반응량은 웰당 20 μL에 불과합니다. 이 플랫폼은 거의 모든 ADP 생산 효소에 적용되어야 합니다.
초록
ATPase 효소는 아데노신 삼인산에 저장된 자유 에너지를 활용하여 자발적으로 발생하지 않는 생체 내 다양한 엔더고닉 생화학 적 과정을 촉매합니다. 이 단백질은 물질 대사, 세포 분열, 환경 변화 및 운동에 대한 반응을 포함하여 세포 생활의 본질적으로 모든 측면에 중요합니다. 여기서 제시된 프로토콜은 소분자 ATPase 억제제의 반높은 처리량 스크리닝에 적응된 니코틴아미드 아데닌 디뉴클레오티드(NADH)-결합된 ATPase 분석법을 기술한다. 이 분석법은 심장 및 골격 근 myosin II의, 원리의 증거로, 2개의 액틴 기지를 둔 분자 모터 ATPases에 적용되었습니다. ATP의 가수분해는 분석에서 효소 반응에 의해 NADH의 산화에 결합된다. 먼저, ATPase에 의해 생성된 ADP는 피루바테 키나아제(PK)에 의해 ATP로 재생성된다. PK는 포스포네놀피루바트(PEP)의 전이를 병렬로 피루브화로 촉매한다. 그 후, 피루브산은 젖산 탈수소 효소 (LDH)에 의해 젖산으로 감소되어 NADH의 산화를 병렬로 촉매합니다. 따라서, ATP 농도의 감소는 NADH 농도의 감소와 직접적으로 상관되며, 이는 NADH의 본질적인 형광에 대한 변화에 뒤따른다. PEP가 반응 시스템에서 사용할 수 있는 한, ADP 농도는 매우 낮게 유지되어 자체 제품에 의한 ATPase 효소의 억제를 피합니다. 또한 ATP 농도는 거의 일정하게 유지되어 선형 시간 코스를 생성합니다. 형광은 지속적으로 모니터링되어 데이터 품질을 쉽게 추정할 수 있으며 잠재적인 아티팩트(예: 복합 침전 또는 열 변화로 인한)를 필터링하는 데 도움이 됩니다.
서문
묘신은 진핵생물1,2에서액틴 세포골격의 필라멘트를 따라 방향운동을 생성하기 위해 아데노신 트리포스페이트(ATP)를 가수분해하는 메카노케미컬 에너지 트랜스듀서이다. 그(것)들은 세포기관의 수송, 근육 수축 또는 세포골격 긴장의 생성과 같은 그들의 각종 세포내 기능에 구조적으로 그리고 운동적으로 적응한1,2. 상기 미오신 수퍼패밀리는 인간 게놈3,4에서~12개의 뚜렷한 묘신 클래스에 속하는 ~40개의 미오신 유전자로 나타난다. 미오신 클래스의 구성원은 여러 암, 신경 장애, 골격 근병증 및 비대성 심근병증5,6과같은 매우 다양한 장애 세트에서 다양한 역할을 한다. 이러한 분자 모터의 많은 생리적 및 병리학적 기능을 감안할 때, 다양한 조건에 대한 약물 표적으로 점점인식되고 있는 것은 놀라운 일이 아니다 7. 최근 새로운 미오신 억제제8,9,10 및 활성제11의발견에 상당한 진전이 이루어졌으며, 기존 12의 특성을개선하고, 13세 , 14세 , 15.
니코틴아미드 아데닌 디뉴클레오티드(NADH)-결합 ATPase 분석기는 오랫동안 사르코플라스 망상 Ca2+ 펌프 ATPase16,DNA 수리 ATPase Rad5417,AAA+와 같은 다양한 효소의 ATPase 활성을 측정하는 데 사용되어 왔습니다. ATPase p9718 또는 미세소관 모터 키네신19. 이 분석은 ATP 재생 주기를 사용합니다. ATPase에 의해 생성된 아데노신 디포스페이트(ADP)는 피루바테 키나아제(PK)에 의해 ATP로 재생되며, 이는 인산피루바트(PEP)의 한 분자를 병렬로 피루베이트로 변형시킵니다. 그 후, 피루브산염은 젖산 탈수소 효소 (LDH)에 의해 젖산으로 감소됩니다. 즉, 차례로, NAD에 NADH의 한 분자를 산화. 따라서, 시간의 함수로서 NADH 농도의 감소는 ATP 가수분해 속도와 같다. ATP 재생 주기는 PEP를 사용할 수 있는 한 ATP 농도를 거의 일정하게 유지하고 ADP 농도를 낮게 유지합니다. 이것은 선형 시간 과정을 초래, 쉽게 초기 반응 속도를 결정하고 ADP19에의해 제품 억제를 방지하는 데 도움이. NADH 결합 ATPase 분석은 이미 96 웰 포맷20에적응되었지만, 높은 반응 량 (~150 μL)은 시약의 높은 수요로 인해 상대적으로 비싸므로 많은 수의 빠른 스크리닝이 덜 가능합니다. 화합물. ATPase 효소에 의해 생성된 인산염의 검출에 의존하는 말라카이트 녹색 분석법19,21과같은 대체 방법은 소형화 및 고처리량 스크리닝(22)에 더 적합한 것으로 입증되었습니다. , 23세 , 24. 그러나 끝점 분석기는 풀 타임 과정이 없는 상태에서 발견되지 않은 상태로 남아있을 수있는 여러 유물 (아래에 설명됨)의 영향을받을 가능성이 높습니다.
여기서, NADH-결합 된 ATPase 분석기는 소분자 억제제의 반 높은 처리량 스크리닝에 최적화되었습니다. 골격 및 심장 근육 myosin II와 myosin 억제제 blebbistatin8, 파라-aminoblebbistatin13 및 파라-nitroblebbistatin12 는 NADH에 의존하는 분석의 힘을 입증하기 위하여 이용됩니다 판독으로 형광. 이 프로토콜은 모든 ADP 생산 효소에 초점을 맞춘 스크리닝 프로젝트에 사용할 수 있습니다.
프로토콜
1. 재고 솔루션 및 시약 준비
- 증류수에서 결정성 DTT를 1000 mM의 최종 농도로 용해시킴으로써 디티오트레이톨(DTT) 스톡 용액을 준비한다. 1 M NaOH 용액으로 pH를 7.0으로 조정합니다. 알리쿼트 및 -20 °C에서 저장합니다.
- 증류수에서 결정성 ATP를 100 mM의 최종 농도로 용해시켜 ATP 스톡 솔루션을 준비합니다. 1 M NaOH 용액으로 pH를 7.0으로 조정합니다. 알리쿼트 및 -20 °C에서 저장합니다.
- 70 mM 3-(N-morpholino)를 함유하는 10x NADH 완충제를 준비하여 프로판설포닉산(MOPS), 10 mM MgCl 2, 0.9 mM 에틸렌 글리콜-비스(β-aminoethyl ether)-N,N,N,N,N′, N′, N′,테트라아세트산(EGTA) 및 3 mMNaN을준비합니다. 1 M NaOH 용액으로 pH를 7.0으로 조정합니다. 4 °C에서 보관하십시오.
- 10 mM MOPS 및 0.1 mM EGTA를 포함하는 1x 미오신 완충액을 준비합니다. 1 M NaOH 용액으로 pH를 7.0으로 조정합니다. 4 °C에서 보관하십시오. 소 혈청 알부민 (BSA) 및 DTT를 0.1 %의 최종 농도에 추가 (w / v %) 사용하기 전에 각각 1 mM.
- 4 mM MOPS, 0.1 mM EGTA, 2 mM MgCl2및 3 mM NaN3를포함하는 1x 액틴 버퍼를 준비합니다. 1 M NaOH 용액으로 pH를 7.0으로 조정합니다. 4 °C에서 보관하십시오. 최종 농도0.1%(w/v%)에 BSA 및 DTT 추가 사용하기 전에 각각 1 mM.
- 결정성 NADH를 10x NADH 완충액에서 5.5 mM의 최종 농도로 용해시킴으로써 NADH 스톡 용액을 준비한다. 알리쿼트 및 -20 °C에서 저장합니다.
- 10x NADH 버퍼에서 결정성 PEP를 50 mM의 최종 농도로 용해시킴으로써 PEP 스톡 용액을 준비한다. 알리쿼트 및 -20 °C에서 저장합니다.
- 글리세롤과 10x NADH 버퍼(50%:50%)의 혼합물에 호우필화된 LDH 분말을 용해시켜 LDH 스톡 용액을 준비합니다. 2000 U/mL의 최종 농도로 결정됩니다. 용액을 존재하지 않은 단백질(7,197 x g, 20°C, 10분)을 제거한다. 상급체를 깨끗한 원심분리기 튜브로 조심스럽게 옮김을 옮김으로 옮김을 조심스럽게 옮김을 넣습니다. 알리쿼트 및 -20 °C에서 저장합니다.
- 글리세롤과 10x NADH 버퍼(50%:50%)를 혼합하여 호우필화된 PK 분말을 용해시켜 PK 스톡 용액을 준비합니다. 10000 U/mL의 최종 농도로 결정됩니다. 용액을 존재하지 않은 단백질(7,197 x g, 20°C, 10분)을 제거한다. 상급체를 깨끗한 원심분리기 튜브로 조심스럽게 옮김을 옮김으로 옮김을 조심스럽게 옮김을 넣습니다. 알리쿼트 및 -20 °C에서 저장합니다.
- 100 μL 증류수를 첨가하여 동구성 심장 및 골격 근미오신 II 샘플을 재구성하여 각각 ~37.9 μM 및 ~40.8 μm myosin 농도 (단모름)에 해당하는 10 mg/mL 스톡 솔루션을 얻습니다. 자세한 내용은 제조업체의 지침을 참조하십시오.
- 파르디와 스푸디치25에의해 설명 된 대로 토끼 근육 아세톤 분말에서 F-액틴을 준비합니다.
2. 작은 분자 억제제의 ATPase 활동 및 억제 효과 측정
- 컴파운드 플레이트를 준비합니다.
- 고품질 디메틸설산화물(DMSO)에 관심 있는 화합물을 용해시다.
- DMSO에서 10 mM 화합물 농도에서 시작하여 15 단계 직렬 1:2 희석을 생성합니다.
- 다중 채널 파이펫을 사용하여 샘플을 384 웰 폴리프로필렌 플레이트에 삼중항(각각 12.5 μL)으로 옮김을 전달합니다. 에지 효과의 영향을 받을 수 있는 웰 수를 최소화하려면 하나의 컴파운드(3개의 열 대신)에 대해 컴파운드 플레이트에 두 행을 사용합니다. 각 화합물에 대한 두 번째 행의 마지막 세 웰을 음수 제어(DMSO만)로 사용합니다. 화합물 희석을 위해 플레이트의 첫 번째 행과 마지막 행을 사용하지 마십시오.
- 순수 한 DMSO를 첫 번째 행의 우물로 전송합니다 (NADH 교정용으로 예약됨).
- 양수 제어를 위해 마지막 행을 사용합니다.
참고: DMSO에서 4 mM 농도에서 파라-아미노블레비스타틴을 여기에서 사용하였습니다.
- 액틴 스톡 용액을 액틴 완충액으로 희석하여 각 분석판(384웰 블랙월 폴리스티렌 마이크로플레이트)에 대해 20 μM 희석액의 4500 μL을 준비한다. 5mL 파이펫을 사용하여 30x 위아래로 파이펫팅하여 액틴 필라멘트를 파괴하여 점도와 이질성을 줄임으로써 솔루션을 철저히 혼합합니다. 존재하는 임의의 침전된 단백질을 제거하는 용액을 원심분리기(7,197 x g,20°C, 10분). 조심스럽게 깨끗한 원심 분리튜브에 상급을 옮김을 옮김을 옮김.
- LDH와 PK 효소("효소 믹스")를 함유한 마스터 믹스를 준비합니다. 각 분석판에 대해, 171.4 μL의 LDH 용액, 171.4 μL의 PK 용액 및 3189.3 μL 또는 3252.9 μl의 미오신 완충액을 각각 15 mL 간선 원심 분리튜브에 결합합니다. 집계 및 강수량을 피하기 위해이 시점에서 myosin을 추가 하지 마십시오.
- 모든 기판("기판 혼합")을 포함하는 마스터 믹스를 준비합니다. 각 플레이트마다 ATP 162.1 μL, PEP 162.1 μL, NADH 용액 324.1 μL을 15 mL 원소 원심분리튜브에 결합합니다. 집계 및 강수량을 피하기 위해 이 시점에서 액틴을 추가하지 마십시오.
- 250 μM부터 교정을 위해 NADH의 7단계 직렬 1:2 희석을 생성합니다.
- 1.5 mL 미세 원심 분리튜브에 257.7 μL의 미오신 완충액과 NADH 스톡 용액 12.3 μL을 혼합합니다.
- 7 개의 1.5 mL 미세 원심 분리튜브에 미오신 완충액의 Aliquot 135 μL.
- 제1 튜브에서 제2 튜브로 용액 135 μL을 전달하고 파이펫팅하여 혼합합니다. 7번째 튜브에 도달할 때까지 반복합니다.
- 마지막 튜브를 NADH 없음 제어(버퍼만 사용)로 사용합니다.
- 8채널 파이펫을 사용하여 NADH 교정 솔루션의 20 μL을 삼중 분석 판의 첫 번째 행으로 이송합니다.
- 효소 믹스에 68 μL의 심장 또는 4.2 μL의 골격 근 미오신 II를 추가합니다. 소용돌이 짧게.
- 첫 번째 행을 제외하고, 자동 디스펜서를 사용하여 제조된 미오신 효소 혼합물의 8.4 μL을 분석 판의 각 웰내로 분배한다.
- 100 nL 핀 툴 헤드가 장착된 자동 액체 처리 시스템을 사용하여 화합물 플레이트에서 효소 혼합을 함유하는 분석 판으로 100 nL의 용액을 전달합니다.
- 마이크로 플레이트 셰이커를 사용하여 실온에서 1200 rpm에서 1 분 동안 분석 판을 흔들어줍니다.
- 기판 혼합물에 원심 분리 된 액틴 용액의 4,052 μL을 추가하십시오. 소용돌이 짧게.
- 11.6 μL의 액틴 기판 혼합물을 분석판의 각 웰(제1열 제외)에 분배하여 자동 디스펜서를 사용하여 효소 반응을 개시한다.
- 마이크로 플레이트 셰이커를 사용하여 실온에서 1200 rpm에서 1 분 동안 분석 판을 흔들어줍니다.
- 30s에 대한 101 x g에서 분석 판을 원심 분리기.
- 플레이트 리더의 내부 온도가 25°C에서 안정화되었는지 확인합니다. 접시를로드하고 다른 30 s를 위해 흔들어. 이 흔들림 단계는 각 우물에서 액체 표면의 모양을 유사하게 하고 플레이트가 측정 온도에 도달할 수 있는 시간을 허용하기 위해 필요합니다.
- NADH 형광을 45초 간격으로 플레이트를 스캐닝하는 30분 동안 기록합니다. 425 nm 컷오프 이색 미러와 함께 380 nm, 10nm 대역폭 여기 필터 및 470 nm, 24 nm 대역폭 방출 필터를 사용합니다. 고농도 모드에서 측정을 실행합니다. 검정을 실행하기 전에 플래시, 검출기 게인, 플레이트 치수 및 측정 높이를 최적화합니다.
참고: 최종 분석 조건은 300 nM 심장/20 nM 골격 근 myosin II, 10 μM actin, 40 U/mL LDH, 200 μM NADH, 1 mM PEP, 1mM ATP를 포함하는 완충제에서 10 mM MPS (pH = 7.0), m2M2M , 0.15 mM EGTA, 0.1 mg/mL BSA, 0.5% (v/v) DMSO 및 1 mM DTT. 총 부피는 20 μL / 웰입니다. 가장 높은 최종 화합물 농도는 50 μM. 20 μM파라-아미노블비스타틴에서 0.5% DMSO로 양성 대조군역할을 하며, 0.5% DMSO만이 음성 대조군이다. 모든 측정은 삼중 항으로 수행됩니다.
3. 데이터 분석
- 각 웰에 대한 시간에 대해 관찰된 형광 강도를 플로팅합니다.
- 간단한 선형 회귀를 수행하여 각 웰에 대한 형광 반응의 기울기 및 절편을 결정합니다. 경사는 ATP(NADH) 소비율에 비례하며, 절편은 측정 시작 시 NADH 농도에 비례합니다(t= 0s).
- NADH의 농도에 대하여 플레이트의 첫 번째 행에 대해 얻어진 절편을 플로팅하여 NADH에 대한 교정 곡선을 구성한다. 요격이 NADH 농도에 선형으로 종속되는지 확인합니다.
참고: 인터셉트는 t°C에서 읽는 원시 형광 강도의 평균보다 훨씬 더 자신감을 가지고 t=0s에서 실제 형광 강도를 추정합니다. - 간단한 선형 회귀를 수행하여 NADH 교정 선의 경사 및 절편을 가져옵니다.
참고: 절편은 형광 배경 신호(NADH 존재 없음)를 설명하고 경사는 특정 실험에서 1M NADH 용액의 추정/이론적 형광 강도에 해당합니다. - NADH 교정 라인의 기울기에 의해 웰의 나머지 부분에 대해 얻어진 형광 반응의 경사를 나누어 형광 변화를 ATP 소비율로 변환합니다.
- 억제제의 농도에 대해 ATP 소비율을 플로팅합니다.
- 억제 상수를 결정하려면 간단한 일대일 바인딩 평형 모델에 해당하는 다음 이차 방정식에 용량 응답 데이터를 맞추기 위해 적절한 통계 소프트웨어를 사용합니다.
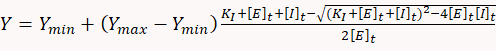
여기서 Y는 ATP 소비율이, Y민은 ATP 소비율이 억제제의 부재를 int, Ymax는 이론적 ATP 소비율이 100% 억제, KI는 저해상수 , [E]t 및 [I]t는 각각 효소(myosin) 및 억제제의 총 농도이다.
결과
선별 실험에 사용되는 일반적인 플레이트 레이아웃 맵은 그림1에 나와 있습니다. 첫 번째 행과 마지막 행은 NADH 교정 및 양성 제어(각각 20 μM para-aminoblebbistatin, 0.5% DMSO)를 위해 예약되어 있습니다. 나머지 행(B~O)은 화합물의 억제 활성을 테스트하는 데 사용된다. 여기서, 15단계 직렬 1:2 희석은 DMSO에서 10 mM 화합물 농도로부터 시작하여 화합물 ?...
토론
프로토콜의 중요한 단계
음의 제어만 있는 여러 플레이트(억제제 없는 ATPase 반응)를 실행하여 플레이트 레이아웃을 최적화합니다. 반응 속도의 패턴을 신중하게 검사합니다. 예를 들어, 이들은 "비 바인딩"플레이트의 친수성 표면 코팅의 가장자리 효과 및 / 또는 결함에서 발생할 수 있습니다. 패턴이 관찰되면 아티팩트를 최소화하기 위해 플레이트 유형 및/또는 ...
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품은 약물 남용 NS096833 (CAM)에 대한 신경 장애 및 뇌졸중및 국립 연구소의 보조금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 384-well Low Flange Black Flat Bottom Polystyrene NBS Microplate | Corning | 3575 | |
| ATP (Adenosine 5′-triphosphate disodium salt hydrate) | Sigma | A7699 | |
| Aurora FRD-IB Dispenser | Aurora Discovery, Inc. | 00017425 | |
| Biomek NXP Multichannel Laboratory Automation Workstation | Beckman Coulter | A31841 | |
| Blebbistatin | AMRI | N/A | Custom synthesis |
| BSA (Bovine Serum Albumin, Protease-Free) | Akron Biotech | AK1391 | |
| Centrifuge 5430 R, refrigerated, with Rotor FA-35-6-30 | Eppendorf | 022620663 | |
| Centrifuge 5430, non-refrigerated, with Rotor A-2-MTP | Eppendorf | 022620568 | |
| DMSO (Dimethyl sulfoxide) | Sigma | D2650 | |
| DTT (DL-Dithiothreitol) | Sigma | D5545 | |
| E1 ClipTip Multichannel Pipette; 384-format; 8-channel | Thermo Scientific | 4672010 | |
| E1 ClipTip Multichannel Pipette; 96-format; 8-channel | Thermo Scientific | 4672080 | |
| EGTA (Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid) | Sigma | E3889 | |
| EnVision 2104 Multilabel Plate Reader | PerkinElmer | 2104-0010 | |
| Glycerol | Sigma | G2025 | |
| LDH (L-Lactic Dehydrogenase from rabbit muscle) | Sigma | L1254 | |
| MgCl2.6H2O (Magnesium chloride hexahydrate) | Sigma | M2670 | |
| Microplate Shaker | VWR | 12620-926 | |
| Microplate, 384 well, PP, Small Volume, Deep Well, Natural | Greiner Bio-One | 784201 | |
| MOPS (3-(N-Morpholino)propanesulfonic acid) | Sigma | M1254 | |
| Myosin Motor Protein (full length) (Bovine cardiac muscle) | Cytoskeleton | MY03 | |
| Myosin Motor Protein (full length) (Rabbit skeletal muscle) | Cytoskeleton | MY02 | |
| NADH (β-Nicotinamide adenine dinucleotide, reduced disodium salt hydrate) | Sigma | N8129 | |
| NaN3 (Sodium azide) | Sigma | 71289 | |
| NaOH (Sodium hydroxide) | Sigma | S8045 | |
| Optical Filter CFP 470/24nm (Emission) | PerkinElmer | 2100-5850 | Barcode 240 |
| Optical Filter Fura2 380/10nm (Excitation) | PerkinElmer | 2100-5390 | Barcode 112 |
| Optical Module: Beta Lactamase | PerkinElmer | 2100-4270 | Barcode 418 |
| OriginPro 2017 software | OriginLab | N/A | |
| para-Aminoblebbistatin | AMRI | N/A | Custom synthesis |
| para-Nitroblebbistatin | AMRI | N/A | Custom synthesis |
| PEP (Phospho(enol)pyruvic acid monopotassium salt) | Sigma | P7127 | |
| PK (Pyruvate Kinase from rabbit muscle) | Sigma | P9136 | |
| Rabbit Muscle Acetone Powder | Pel Freez Biologicals | 41995-2 |
참고문헌
- Heissler, S. M., Sellers, J. R. Kinetic Adaptations of Myosins for Their Diverse Cellular Functions. Traffic. 17 (8), 839-859 (2016).
- Hartman, M. A., Spudich, J. A. The myosin superfamily at a glance. Journal of Cell Science. 125 (Pt 7), 1627-1632 (2012).
- Berg, J. S., Powell, B. C., Cheney, R. E. A millennial myosin census. Molecular Biology of the Cell. 12 (4), 780-794 (2001).
- Sebe-Pedros, A., Grau-Bove, X., Richards, T. A., Ruiz-Trillo, I. Evolution and classification of myosins, a paneukaryotic whole-genome approach. Genome Biology and Evolution. 6 (2), 290-305 (2014).
- Newell-Litwa, K. A., Horwitz, R., Lamers, M. L. Non-muscle myosin II in disease: mechanisms and therapeutic opportunities. Disease Models & Mechanisms. 8 (12), 1495-1515 (2015).
- He, Y. M., Gu, M. M. Research progress of myosin heavy chain genes in human genetic diseases. Yi Chuan. 39 (10), 877-887 (2017).
- Rauscher, A. A., Gyimesi, M., Kovacs, M., Malnasi-Csizmadia, A. Targeting Myosin by Blebbistatin Derivatives: Optimization and Pharmacological Potential. Trends in Biochemical Sciences. 43 (9), 700-713 (2018).
- Straight, A. F., et al. Dissecting temporal and spatial control of cytokinesis with a myosin II Inhibitor. Science. 299 (5613), 1743-1747 (2003).
- Sirigu, S., et al. Highly selective inhibition of myosin motors provides the basis of potential therapeutic application. Proceedings of the National Academy of Sciences of the United States of America. 113 (47), E7448-E7455 (2016).
- Green, E. M., et al. A small-molecule inhibitor of sarcomere contractility suppresses hypertrophic cardiomyopathy in mice. Science. 351 (6273), 617-621 (2016).
- Morgan, B. P., et al. Discovery of omecamtiv mecarbil the first, selective, small molecule activator of cardiac Myosin. ACS Medicinal Chemistry Letters. 1 (9), 472-477 (2010).
- Kepiro, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable myosin II inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).
- Varkuti, B. H., et al. A highly soluble, non-phototoxic, non-fluorescent blebbistatin derivative. Scientific Reports. 6, 26141 (2016).
- Verhasselt, S., et al. Discovery of (S)-3'-hydroxyblebbistatin and (S)-3'-aminoblebbistatin: polar myosin II inhibitors with superior research tool properties. Organic and Biomolecular Chemistry. 15 (9), 2104-2118 (2017).
- Verhasselt, S., Roman, B. I., Bracke, M. E., Stevens, C. V. Improved synthesis and comparative analysis of the tool properties of new and existing D-ring modified (S)-blebbistatin analogs. European Journal of Medicinal Chemistry. 136, 85-103 (2017).
- Warren, G. B., Toon, P. A., Birdsall, N. J., Lee, A. G., Metcalfe, J. C. Reconstitution of a calcium pump using defined membrane components. Proceedings of the National Academy of Sciences of the United States of America. 71 (3), 622-626 (1974).
- Kiianitsa, K., Solinger, J. A., Heyer, W. D. Rad54 protein exerts diverse modes of ATPase activity on duplex DNA partially and fully covered with Rad51 protein. Journal of Biological Chemistry. 277 (48), 46205-46215 (2002).
- Hanzelmann, P., Schindelin, H. Structural Basis of ATP Hydrolysis and Intersubunit Signaling in the AAA+ ATPase p97. Structure. 24 (1), 127-139 (2016).
- Hackney, D. D., Jiang, W. Assays for kinesin microtubule-stimulated ATPase activity. Methods in Molecular Biology. 164, 65-71 (2001).
- Kiianitsa, K., Solinger, J. A., Heyer, W. D. NADH-coupled microplate photometric assay for kinetic studies of ATP-hydrolyzing enzymes with low and high specific activities. Analytical Biochemistry. 321 (2), 266-271 (2003).
- Carter, S. G., Karl, D. W. Inorganic phosphate assay with malachite green: an improvement and evaluation. Journal of Biochemical and Biophysical Methods. 7 (1), 7-13 (1982).
- Henkel, R. D., VandeBerg, J. L., Walsh, R. A. A microassay for ATPase. Analytical Biochemistry. 169 (2), 312-318 (1988).
- Rowlands, M. G., et al. High-throughput screening assay for inhibitors of heat-shock protein 90 ATPase activity. Analytical Biochemistry. 327 (2), 176-183 (2004).
- Rule, C. S., Patrick, M., Sandkvist, M. Measuring In Vitro ATPase Activity for Enzymatic Characterization. Journal of Visualized Experiments. (114), 54305 (2016).
- Pardee, J. D., Spudich, J. A. Purification of muscle actin. Methods in Cell Biology. 24, 271-289 (1982).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Kovacs, M., Toth, J., Hetenyi, C., Malnasi-Csizmadia, A., Sellers, J. R. Mechanism of blebbistatin inhibition of myosin II. Chem Journal of Biological Chemistry. 279 (34), 35557-35563 (2004).
- Allingham, J. S., Smith, R., Rayment, I. The structural basis of blebbistatin inhibition and specificity for myosin II. Nature Structural & Molecular Biology. 12 (4), 378-379 (2005).
- Kettlun, A. M., et al. Purification and Characterization of 2 Isoapyrases from Solanum-Tuberosum Var Ultimus. Phytochemistry. 31 (11), 3691-3696 (1992).
- Hulme, E. C., Trevethick, M. A. Ligand binding assays at equilibrium: validation and interpretation. British Journal of Pharmacology. 161 (6), 1219-1237 (2010).
- Motulsky, H. J., Neubig, R. R. Analyzing binding data. Current Protocols in Neuroscience. 52 (1), 7.5.1-7.5.65 (2010).
- Sehgal, P., Olesen, C., Moller, J. V. ATPase Activity Measurements by an Enzyme-Coupled Spectrophotometric Assay. Methods in Molecular Biology. 1377, 105-109 (2016).
- Solinger, J. A., Lutz, G., Sugiyama, T., Kowalczykowski, S. C., Heyer, W. D. Rad54 protein stimulates heteroduplex DNA formation in the synaptic phase of DNA strand exchange via specific interactions with the presynaptic Rad51 nucleoprotein filament. Journal of Molecular Biology. 307 (5), 1207-1221 (2001).
- Banik, U., Roy, S. A continuous fluorimetric assay for ATPase activity. Biochemistry Journal. 266 (2), 611-614 (1990).
- Xiao, Y. X., Yang, W. X. KIFC1: a promising chemotherapy target for cancer treatment?. Oncotarget. 7 (30), 48656-48670 (2016).
- See, S. K., et al. Cytoplasmic Dynein Antagonists with Improved Potency and Isoform Selectivity. ACS Chemical Biology. 11 (1), 53-60 (2016).
- Datta, A., Brosh, R. M. New Insights Into DNA Helicases as Druggable Targets for Cancer Therapy. Frontiers in Molecular Biosciences. 5, 59 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유