Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Küçük Molekül Inhibitörlerinin Taranması için NADH-Coupled ATPase Tsay'ın Yarı-Yüksek İş-İşLenme Adaptasyonu
Bu Makalede
Özet
Bir nikotinamid adenin dinükleotid (NADH)-birleştirilmiş ATPaz tsay küçük molekül miyozin inhibitörleri yarı yüksek iş lenme taraması için adapte edilmiştir. Bu kinetik teşbit, kuyu başına sadece 20 μL toplam reaksiyon hacmine sahip 384 kuyulu bir mikroplaka formatında çalıştırılır. Platform hemen hemen tüm ADP üreten enzimler için geçerli olmalıdır.
Özet
ATPaz enzimleri, adenozin trifosfatta depolanan serbest enerjiyi vivo'da kendiliğinden oluşmayan çok çeşitli endergonik biyokimyasal süreçleri katalize etmek için kullanırlar. Bu proteinler metabolizma, hücre bölünmesi, çevresel değişikliklere ve harekete tepkiler de dahil olmak üzere hücre yaşamının esasen tüm yönleri için çok önemlidir. Burada sunulan protokol, küçük molekül ATPaz inhibitörlerinin yarı-yüksek iş lenme taramasına adapte edilmiş bir nikotinamid adenin dinükleotid (NADH) ile birleştirilmiş ATPaz testini tanımlar. Test, prensip kanıtı olarak iki aktin bazlı moleküler motor ATP'ler olan kardiyak ve iskelet kası miyozin II'sine uygulanmıştır. ATP'nin hidrolizi, nadh'ın oksidasyonu ile birleştiğinde, analizdeki enzimatik reaksiyonlar ile biraraya gelindiğinde. İlk olarak, ATP'ler tarafından oluşturulan ADP, pirüuvat kiaz (PK) ile ATP'ye yenilenir. PK paralel olarak piruvate fosfoenolpyruvate (PEP) geçiş katalizler. Daha sonra, pirüuvat laktat dehidrogenaz tarafından azalır (LDH), paralel olarak NADH oksidasyon katalizler. Böylece, ATP konsantrasyonundaki azalma nadh konsantrasyonundaki azalma ile doğrudan ilişkilidir ve bunu NADH'ın içsel floresansında değişim takip eder. PEP reaksiyon sisteminde mevcut olduğu sürece, ADP konsantrasyonu çok düşük kalır, kendi ürünü tarafından ATPase enziminin inhibisyonu kaçınarak. Ayrıca, ATP konsantrasyonu neredeyse sabit kalır, doğrusal zaman kursları verimli. Floresan sürekli olarak izlenir, bu da veri kalitesinin kolayca tahmin edilmesine olanak tanır ve potansiyel eserlerin (örneğin, bileşik yağış veya termal değişikliklerden kaynaklanan) filtrelenmesine yardımcı olur.
Giriş
Miyozinler ökaryotlar da aktin sitoskeleton filamentleri boyunca yönlü hareket oluşturmak için adenozin trifosfat (ATP) hidrolize mekanokimyasal enerji transdüserler vardır1,2. Onlar hem yapısal hem de kinetically çeşitli hücre içi fonksiyonları adapte var, organellerin taşınması gibi, kas kasılması veya sitoskelet alçit üretimi1,2. Miyozin süper familyası insan genomundaki ~12 farklı miyozin sınıflarına ait ~40 miyozin geni ile temsil edilir3,4. Miyozin sınıflarının üyeleri çeşitli kanserler, nörolojik bozukluklar, iskelet miyopatileri ve hipertrofik kardiyomiyopati5,6gibi çok çeşitli bozukluklar kümesinde çeşitli roller oynamaktadır. Bu moleküler motorların fizyolojik ve patolojik fonksiyonları çok sayıda göz önüne alındığında, bu koşullar çeşitli için giderek ilaç hedefleri olarak kabul ediliyor şaşırtıcı değildir7. Önemli ilerleme son zamanlarda yeni miyozin inhibitörleri keşfi yapılmıştır8,9,10 ve aktivatörler11, ve mevcut olanların özelliklerini geliştirmek için12, 13.000 , 14.000 , 15. yıl.
Nikotinamid adenin dinükleotid (NADH)-birleştirilmiş ATPaz testi uzun sarcoplasmic reticulum Ca2 + pompa ATPase 16 gibiçeşitli enzimlerin ATPase aktivitesini ölçmek için kullanılmıştır , DNA onarım ATPase Rad5417, AAA + ATPaz p9718 veya mikrotübül motor kinesin19. Tne bir ATP rejenerasyon döngüsü kullanır. ATPaz tarafından üretilen adenozin difosfat (ADP), fosfoenolpiriuvat (PEP) molekülünü paralel olarak pirüvetmeye dönüştüren pirüvat kinaz (PK) ile ATP'ye yenilenir. Daha sonra, pirüuvat laktat dehidrogenaz (LDH) tarafından laktat azalır. Bu da NADH molekülünün bir molekülünü NAD'a oksitler. Bu nedenle, zaman fonksiyonu olarak NADH konsantrasyonunun azalması ATP hidroliz hızına eşittir. ATP rejenerasyon döngüsü ATP konsantrasyonu neredeyse sabit ve PEP mevcut olduğu sürece ADP konsantrasyonu düşük tutar. Bu, doğrusal zaman dersleri ile sonuçlanır, bu da ilk reaksiyon oranlarını belirlemeyi kolaylaştırır ve ADP19tarafından ürün inhibisyonunun önlenmesine yardımcı olur. NADH-birleştirilmiş ATPase testi zaten 96-iyiformat20adapte edilmiş olmasına rağmen, yüksek tepki hacimleri (~ 150 μL) reaktiflerin yüksek talep nedeniyle nispeten pahalı hale, daha az çok sayıda hızlı tarama için uygun hale Bileşik. ATPaz enzimi tarafından üretilen fosfatın saptanması nda dayanan malakit yeşili çıktı19,21gibi alternatif yöntemler, minyatürleştirme ve yüksek iş lenme taraması için daha uygun olduğu kanıtlanmıştır22 , 23.000 , 24- Ancak, bir uç nokta teşbit birkaç eserler (aşağıda ele) tarafından etkilenecek tir, tam zamanlı dersler yokluğunda keşfedilmemiş kalabilir.
Burada, NADH-birleştirilmiş ATPase tsay küçük molekül inhibitörleri yarı-yüksek iş taranması için optimize edilmiştir. İskelet ve kardiyak kas miyozin II ve miyozin inhibitörleri blebbistatin8, para-aminoblebbistatin13 ve para-nitroblebbistatin12 NADH dayanır tasnif gücünü göstermek için kullanılır bir okuma olarak floresan. Bu protokol, enzim üreten herhangi bir ADP'ye odaklanan projelerin taranmasına olanak sağlamaktadır.
Protokol
1. Stok çözümleri nin ve reaktiflerin hazırlanması
- Distile suda 1000 mM'lik son konsantrasyona kristal DTT eriterek dithiothreitol (DTT) stok çözeltisini hazırlayın. 1 M NaOH çözeltisi ile pH'ı 7.0'a ayarlayın. Aliquot ve -20 °C'de saklayın.
- Distile suda 100 mM'lik son konsantrasyona kristal ATP eriterek ATP stok çözeltisini hazırlayın. 1 M NaOH çözeltisi ile pH'ı 7.0'a ayarlayın. Aliquot ve -20 °C'de saklayın.
- 70 mM 3-(N-morfolino)propanülfonik asit (MOPS), 10 mM MgCl2, 0.9 mM etilen glikol-bis(β-aminoetil eter)-N,N,N′,N-tetraasetik asit (EGTA) içeren 10x NADH tampon hazırlayın 3 mM NaN3. 1 M NaOH çözeltisi ile pH'ı 7.0'a ayarlayın. 4 °C'de saklayın.
- 10 mM MOPS ve 0,1 mM EGTA içeren 1x miyozin tampon hazırlayın. 1 M NaOH çözeltisi ile pH'ı 7.0'a ayarlayın. 4 °C'de saklayın. %0.1 (w/v) son konsantrasyonuna büyükbaş hayvan serum albumini (BSA) ve DTT ekleyin ve 1 mM, sırasıyla, kullanmadan önce.
- 4 mM MOPS, 0.1 mM EGTA, 2 mM MgCl2ve 3 mM NaN3içeren 1x aktin tampon hazırlayın. 1 M NaOH çözeltisi ile pH'ı 7.0'a ayarlayın. 4 °C'de saklayın. %0,1 'lik son konsantrasyona BSA ve DTT ekleyin (w/v%) ve 1 mM, sırasıyla, kullanmadan önce.
- 10x NADH tamponundaki kristal NADH'yi 5,5 mM'lik son konsantrasyona eriterek NADH stok çözeltisini hazırlayın. Aliquot ve -20 °C'de saklayın.
- 50 mM son konsantrasyona 10x NADH tampon kristal PEP eriterek PEP stok çözüm hazırlayın. Aliquot ve -20 °C'de saklayın.
- Gliserol ve 10x NADH tampon (%50:50) karışımı nda lyophilized LDH tozu eriterek LDH stok çözeltisi hazırlayın 2000 U/mL'lik son konsantrasyona kadar. Çözünmemiş proteinleri (7.197 x g, 20 °C, 10 dk) çıkarmak için çözeltiyi santrifüj edin. Supernatant'ı temiz bir santrifüj tüpüne dikkatlice aktarın. Aliquot ve -20 °C'de saklayın.
- Gliserol ve 10x NADH tampon (%50:50) karışımı nda lyophilized PK tozu eriterek PK stok çözeltisi hazırlayın 10000 U/mL'lik son konsantrasyona kadar. Çözünmemiş proteinleri (7.197 x g, 20 °C, 10 dk) çıkarmak için çözeltiyi santrifüj edin. Supernatant'ı temiz bir santrifüj tüpüne dikkatlice aktarın. Aliquot ve -20 °C'de saklayın.
- Sırasıyla ~37.9 μM ve ~40.8 μM miyozin konsantrasyonlarına (monomerik) karşılık gelen 10mg/mL stok çözeltisi elde etmek için 100 μL distile su ekleyerek liyofilize kardiyak ve iskelet kası miyozin II örneklerini yeniden oluşturabilirsiniz. Daha fazla bilgi için üreticinin talimatlarına bakın.
- Pardee ve Spudich25tarafından açıklandığı gibi tavşan kas aseton tozu F-actin hazırlayın.
2. Küçük molekül inhibitörlerinin ATPaz aktivitelerinin ve inhibitör etkilerinin ölçülmesi
- Bileşik plaka hazırlayın.
- Yüksek kaliteli dimetilsülfoksit (DMSO) ilgi bileşikleri çözün.
- DMSO'da 10 mM bileşik konsantrasyonundan başlayarak on beş adımlı seri 1:2 seyreltmeler oluşturun.
- Örnekleri çok kanallı pipet kullanarak triplicatelerde (her biri 12,5°L) 384 kuyulu polipropilen plakaya aktarın. Kenar etkilerinden etkilenecek kuyu sayısını en aza indirmek için bir bileşik (üç sütun yerine) için bileşik plakaüzerinde iki satır kullanın. Her bileşik için ikinci satırdaki son üç kuyuyu negatif kontrol (yalnızca DMSO) olarak kullanın. Bileşik seyreltmeler için plakanın ilk ve son sırasını kullanmayın.
- Saf DMSO'yu ilk sıranın kuyularına aktarın (NADH kalibrasyonu için ayrılmıştır).
- Pozitif denetim için son satırı kullanın.
NOT: Burada DMSO'da 4 mM konsantrasyonda para-aminoblebbistatin kullanılmıştır.
- Actin tamponunda actin stok çözeltisini seyrelterek her bir asay plakası (384 kuyulu siyah duvar polistiren mikroplaka) için 4500 μL 20 μL seyreltilmiş actin çözeltisini hazırlayın. Aktin filamentleri kırarak viskoziteyi ve heterojenliği azaltmak için 5 mL'lik pipet kullanarak 30x yukarı ve aşağı boru lar kullanarak çözeltiyi iyice karıştırın. Herhangi bir çökelmiş protein mevcut (7.197 x g, 20 °C, 10 dk) kaldırmak için çözelti santrifüj. Supernatant'ı temiz bir santrifüj tüpüne dikkatlice aktarın.
- LDH ve PK enzimleri içeren ana karışımı ("enzim karışımı") hazırlayın. Her tahlil plakası için, 171.4 μL LDH çözeltisi, 171.4 μL PK çözeltisi ve 3189.3 μL veya 3252.9 μL miyozin tamponunu sırasıyla kardiyak veya iskelet kası miyozin II'sini içeren tahliller için 15 mL konik santrifüj tüpünde birleştirin. Toplama ve yağış önlemek için bu noktada herhangi bir miyozin eklemeyin.
- Tüm substratları ("substrat karışımı") içeren ana karışımı hazırlayın. Her plaka için 15 mL konik santrifüj tüpte 162,1 μL ATP, 162,1 μL PEP ve 324,1 μL NADH çözeltisini birleştirin. Toplama ve yağış önlemek için bu noktada aktin eklemeyin.
- 250 μM'den başlayan kalibrasyon için YEDI adımlı seri 1:2 seyreltmelerini oluşturun.
- 1,5 mL mikrosentrifüge tüpte 257,7 μL miyozin tamponu ile 12,3 μL NADH stok çözeltisini karıştırın.
- Aliquot 135 μL miyozin tampon yedi 1.5 mL mikrosantrifüj tüpler içine.
- İlk tüpten 135 μL çözeltiyi ikinci tüpe aktarın ve pipetleme ile karıştırın. 7tüp ulaşana kadar tekrarlayın.
- Son tüpü NO-NADH denetimi (yalnızca arabellek) olarak kullanın.
- 8 kanallı pipet kullanarak, NADH kalibrasyon çözeltilerinin 20 μL'sini triplicates'teki elektif plakanın ilk satırına aktarın.
- Enzim karışımına 68 μL kardiyak veya 4.2 μL iskelet kası miyozin II ekleyin. Girdap kısaca.
- İlk sıra dışında, otomatik bir dağıtıcı kullanarak, hazırlanan miyozin-enzim karışımının 8,4 μL'sini, otomatik bir dağıtıcı kullanarak, hesap plakasının her kuyusuna dağıtın.
- 100 nL pin alet kafası ile donatılmış otomatik sıvı taşıma sistemi kullanarak enzim karışımı içeren hesap plakasına bileşik plakadan 100 nL çözelti aktarın.
- Bir mikroplaka shaker kullanarak 1200 rpm oda sıcaklığında 1 dakika için titret plakası çalkalayın.
- Substrat karışımına santrifüjlü aktin çözeltisinin 4.052 μL'sini ekleyin. Girdap kısaca.
- Otomatik bir dağıtıcı kullanarak enzimatik reaksiyonu başlatmak için 11,6 μL actin-substrat karışımını hesap plakasının her kuyusuna (ilk sıra hariç) dağıtın.
- Bir mikroplaka shaker kullanarak 1200 rpm oda sıcaklığında 1 dakika için titret plakası çalkalayın.
- 30 s için 101 x g de saymanlık plaka santrifüj.
- Plaka okuyucusunun iç sıcaklığının 25 °C'de stabilize olduğundan emin olun. Plakayı yükleyin ve 30 s daha çalkalayın. Bu sallayarak adım her kuyuda benzer sıvı yüzeyşekli yapmak için gereklidir ve plaka ölçüm sıcaklığına ulaşmak için zaman sağlar.
- Plakayı 45 s aralıklarla tarayan 30 dk için NADH floresansını kaydedin. 425 nm kesme dikroik ayna ile birlikte 380 nm, 10 nm bant genişliği uyarma filtresi ve 470 nm, 24 nm bant genişliği emisyon filtresi kullanın. Ölçümü yüksek konsantrasyon modunda çalıştırın. Tahlilleri çalıştırmadan önce yanıp söner sayısını, dedektör kazancını, plaka boyutlarını ve ölçüm yüksekliğini optimize edin.
NOT: Son tahlil koşulları 300 nM kardiyak/20 nM iskelet kası miyozin II, 10 μM aktin, 40 U/mL LDH, 200 U/mL PK, 220 μM NADH, 1 mM PEP, 1 mM ATP içeren bir tamponda 10 mM MOPS (pH = 7.0), 2 mMg MgCl2 , 0.15 mM EGTA, 0.1 mg/mL BSA, %0.5 (v/v) DMSO ve 1 mM DTT. Toplam hacim 20 μL/iyidir. En yüksek son bileşik konsantrasyonu 50 μM. 20 μM para-aminoblebbistatin % 0.5 DMSO pozitif kontrol olarak hizmet vermektedir ve 0.5% DMSO tek başına negatif kontrol. Tüm ölçümler triplicates yapılır.
3. Verileri analiz etme
- Her kuyu için zamana karşı gözlenen floresan yoğunluğunu çizin.
- Her kuyu için floresan yanıtlarının eğimini ve yolunu kesmek için basit doğrusal regresyon gerçekleştirin. Eğim ATP (NADH) tüketim oranıyla orantılıiken, kesişme ölçümün başındaki NADH konsantrasyonuyla orantılıdır (t = 0 s).
- PLAKANıN ilk satırı için elde edilen kesitleri NADH konsantrasyonuna karşı çizerek NADH için bir kalibrasyon eğrisi oluşturun. Kesişmelerin DOĞRUSAL OLARAK NADH konsantrasyonuna bağlı olduğundan emin olun.
NOT: Keserler t = 0 s'deki gerçek floresan yoğunluklarını tahmin eder ve ham floresan yoğunluğunun ortalamasından çok daha fazla güven ile t ≤ 0 s'de okunur. - NADH kalibrasyon hattının eğimini ve yolunu kesmek için basit doğrusal regresyon gerçekleştirin.
NOT: Kesişme, floresan arka plan sinyalini açıklar (NADH yok), eğim ise o deneydeki 1 M NADH çözeltisinin ekstrapolated/teorik floresan yoğunluğuna karşılık gelir. - Floresan değişikliklerini ATP tüketim oranlarına dönüştürmek için NADH kalibrasyon hattının eğimi ile kuyuların geri kalanı için elde edilen floresan tepkisinin eğimini bölün.
- ATP tüketim oranlarını inhibitörün konsantrasyonuna göre çizin.
- İnhibisyon sabitlerini belirlemek için, doz-yanıt verilerini basit bire bir bağlayıcı denge modeline karşılık gelen aşağıdaki kuadratik denkleme sığdırmak için uygun istatistiksel yazılım kullanın:
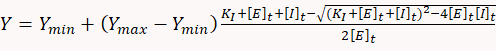
nerede Y ATP tüketim oranı, Ymin atp tüketim oranı int inhibitör yokluğu, Ymax teorik ATP tüketim oranı% 100 inhibisyon, KI inhibitör sabittir , [E]t ve [I]t sırasıyla enzim (miyozin) ve inhibitör toplam konsantrasyonu vardır.
Sonuçlar
Tarama deneyleri için kullanılan tipik plaka düzeni haritası Şekil1'de gösterilmiştir. İlk ve son satırlar sırasıyla NADH kalibrasyonu ve pozitif kontrol (20 μM para-aminoblebbistatin, %0.5 DMSO) için ayrılmıştır. Kalan satırlar (B'den O'ya) bileşiklerin inhibitör aktivitesini test etmek için kullanılır. Burada, DMSO'daki 10 mM bileşik konsantrasyonundan başlayarak on beş adımlı seri 1:2 seyreltmeler hazırlanır ve bileş...
Tartışmalar
Protokoldeki kritik adımlar
Plaka düzenini yalnızca negatif kontrole sahip birkaç plaka çalıştırarak optimize edin (inhibitör olmadan ATPaz reaksiyonu). Reaksiyon oranlarındaki desenler için sonuçları dikkatle inceleyin. Örneğin, bunlar "bağlayıcı olmayan" plakaların hidrofilik yüzey kaplamasındaki kenar etkileri ve/veya kusurlardan kaynaklanabilir. Bir desen gözlenirse, yapıları en aza indirmek için plaka türünü ve/veya plaka düzenini değiştirin...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma, Ulusal Nörolojik Bozukluklar ve İnme Enstitüsü ve Ulusal Uyuşturucu Bağımlılığı Enstitüsü NS096833 (CAM) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 384-well Low Flange Black Flat Bottom Polystyrene NBS Microplate | Corning | 3575 | |
| ATP (Adenosine 5′-triphosphate disodium salt hydrate) | Sigma | A7699 | |
| Aurora FRD-IB Dispenser | Aurora Discovery, Inc. | 00017425 | |
| Biomek NXP Multichannel Laboratory Automation Workstation | Beckman Coulter | A31841 | |
| Blebbistatin | AMRI | N/A | Custom synthesis |
| BSA (Bovine Serum Albumin, Protease-Free) | Akron Biotech | AK1391 | |
| Centrifuge 5430 R, refrigerated, with Rotor FA-35-6-30 | Eppendorf | 022620663 | |
| Centrifuge 5430, non-refrigerated, with Rotor A-2-MTP | Eppendorf | 022620568 | |
| DMSO (Dimethyl sulfoxide) | Sigma | D2650 | |
| DTT (DL-Dithiothreitol) | Sigma | D5545 | |
| E1 ClipTip Multichannel Pipette; 384-format; 8-channel | Thermo Scientific | 4672010 | |
| E1 ClipTip Multichannel Pipette; 96-format; 8-channel | Thermo Scientific | 4672080 | |
| EGTA (Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid) | Sigma | E3889 | |
| EnVision 2104 Multilabel Plate Reader | PerkinElmer | 2104-0010 | |
| Glycerol | Sigma | G2025 | |
| LDH (L-Lactic Dehydrogenase from rabbit muscle) | Sigma | L1254 | |
| MgCl2.6H2O (Magnesium chloride hexahydrate) | Sigma | M2670 | |
| Microplate Shaker | VWR | 12620-926 | |
| Microplate, 384 well, PP, Small Volume, Deep Well, Natural | Greiner Bio-One | 784201 | |
| MOPS (3-(N-Morpholino)propanesulfonic acid) | Sigma | M1254 | |
| Myosin Motor Protein (full length) (Bovine cardiac muscle) | Cytoskeleton | MY03 | |
| Myosin Motor Protein (full length) (Rabbit skeletal muscle) | Cytoskeleton | MY02 | |
| NADH (β-Nicotinamide adenine dinucleotide, reduced disodium salt hydrate) | Sigma | N8129 | |
| NaN3 (Sodium azide) | Sigma | 71289 | |
| NaOH (Sodium hydroxide) | Sigma | S8045 | |
| Optical Filter CFP 470/24nm (Emission) | PerkinElmer | 2100-5850 | Barcode 240 |
| Optical Filter Fura2 380/10nm (Excitation) | PerkinElmer | 2100-5390 | Barcode 112 |
| Optical Module: Beta Lactamase | PerkinElmer | 2100-4270 | Barcode 418 |
| OriginPro 2017 software | OriginLab | N/A | |
| para-Aminoblebbistatin | AMRI | N/A | Custom synthesis |
| para-Nitroblebbistatin | AMRI | N/A | Custom synthesis |
| PEP (Phospho(enol)pyruvic acid monopotassium salt) | Sigma | P7127 | |
| PK (Pyruvate Kinase from rabbit muscle) | Sigma | P9136 | |
| Rabbit Muscle Acetone Powder | Pel Freez Biologicals | 41995-2 |
Referanslar
- Heissler, S. M., Sellers, J. R. Kinetic Adaptations of Myosins for Their Diverse Cellular Functions. Traffic. 17 (8), 839-859 (2016).
- Hartman, M. A., Spudich, J. A. The myosin superfamily at a glance. Journal of Cell Science. 125 (Pt 7), 1627-1632 (2012).
- Berg, J. S., Powell, B. C., Cheney, R. E. A millennial myosin census. Molecular Biology of the Cell. 12 (4), 780-794 (2001).
- Sebe-Pedros, A., Grau-Bove, X., Richards, T. A., Ruiz-Trillo, I. Evolution and classification of myosins, a paneukaryotic whole-genome approach. Genome Biology and Evolution. 6 (2), 290-305 (2014).
- Newell-Litwa, K. A., Horwitz, R., Lamers, M. L. Non-muscle myosin II in disease: mechanisms and therapeutic opportunities. Disease Models & Mechanisms. 8 (12), 1495-1515 (2015).
- He, Y. M., Gu, M. M. Research progress of myosin heavy chain genes in human genetic diseases. Yi Chuan. 39 (10), 877-887 (2017).
- Rauscher, A. A., Gyimesi, M., Kovacs, M., Malnasi-Csizmadia, A. Targeting Myosin by Blebbistatin Derivatives: Optimization and Pharmacological Potential. Trends in Biochemical Sciences. 43 (9), 700-713 (2018).
- Straight, A. F., et al. Dissecting temporal and spatial control of cytokinesis with a myosin II Inhibitor. Science. 299 (5613), 1743-1747 (2003).
- Sirigu, S., et al. Highly selective inhibition of myosin motors provides the basis of potential therapeutic application. Proceedings of the National Academy of Sciences of the United States of America. 113 (47), E7448-E7455 (2016).
- Green, E. M., et al. A small-molecule inhibitor of sarcomere contractility suppresses hypertrophic cardiomyopathy in mice. Science. 351 (6273), 617-621 (2016).
- Morgan, B. P., et al. Discovery of omecamtiv mecarbil the first, selective, small molecule activator of cardiac Myosin. ACS Medicinal Chemistry Letters. 1 (9), 472-477 (2010).
- Kepiro, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable myosin II inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).
- Varkuti, B. H., et al. A highly soluble, non-phototoxic, non-fluorescent blebbistatin derivative. Scientific Reports. 6, 26141 (2016).
- Verhasselt, S., et al. Discovery of (S)-3'-hydroxyblebbistatin and (S)-3'-aminoblebbistatin: polar myosin II inhibitors with superior research tool properties. Organic and Biomolecular Chemistry. 15 (9), 2104-2118 (2017).
- Verhasselt, S., Roman, B. I., Bracke, M. E., Stevens, C. V. Improved synthesis and comparative analysis of the tool properties of new and existing D-ring modified (S)-blebbistatin analogs. European Journal of Medicinal Chemistry. 136, 85-103 (2017).
- Warren, G. B., Toon, P. A., Birdsall, N. J., Lee, A. G., Metcalfe, J. C. Reconstitution of a calcium pump using defined membrane components. Proceedings of the National Academy of Sciences of the United States of America. 71 (3), 622-626 (1974).
- Kiianitsa, K., Solinger, J. A., Heyer, W. D. Rad54 protein exerts diverse modes of ATPase activity on duplex DNA partially and fully covered with Rad51 protein. Journal of Biological Chemistry. 277 (48), 46205-46215 (2002).
- Hanzelmann, P., Schindelin, H. Structural Basis of ATP Hydrolysis and Intersubunit Signaling in the AAA+ ATPase p97. Structure. 24 (1), 127-139 (2016).
- Hackney, D. D., Jiang, W. Assays for kinesin microtubule-stimulated ATPase activity. Methods in Molecular Biology. 164, 65-71 (2001).
- Kiianitsa, K., Solinger, J. A., Heyer, W. D. NADH-coupled microplate photometric assay for kinetic studies of ATP-hydrolyzing enzymes with low and high specific activities. Analytical Biochemistry. 321 (2), 266-271 (2003).
- Carter, S. G., Karl, D. W. Inorganic phosphate assay with malachite green: an improvement and evaluation. Journal of Biochemical and Biophysical Methods. 7 (1), 7-13 (1982).
- Henkel, R. D., VandeBerg, J. L., Walsh, R. A. A microassay for ATPase. Analytical Biochemistry. 169 (2), 312-318 (1988).
- Rowlands, M. G., et al. High-throughput screening assay for inhibitors of heat-shock protein 90 ATPase activity. Analytical Biochemistry. 327 (2), 176-183 (2004).
- Rule, C. S., Patrick, M., Sandkvist, M. Measuring In Vitro ATPase Activity for Enzymatic Characterization. Journal of Visualized Experiments. (114), 54305 (2016).
- Pardee, J. D., Spudich, J. A. Purification of muscle actin. Methods in Cell Biology. 24, 271-289 (1982).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Kovacs, M., Toth, J., Hetenyi, C., Malnasi-Csizmadia, A., Sellers, J. R. Mechanism of blebbistatin inhibition of myosin II. Chem Journal of Biological Chemistry. 279 (34), 35557-35563 (2004).
- Allingham, J. S., Smith, R., Rayment, I. The structural basis of blebbistatin inhibition and specificity for myosin II. Nature Structural & Molecular Biology. 12 (4), 378-379 (2005).
- Kettlun, A. M., et al. Purification and Characterization of 2 Isoapyrases from Solanum-Tuberosum Var Ultimus. Phytochemistry. 31 (11), 3691-3696 (1992).
- Hulme, E. C., Trevethick, M. A. Ligand binding assays at equilibrium: validation and interpretation. British Journal of Pharmacology. 161 (6), 1219-1237 (2010).
- Motulsky, H. J., Neubig, R. R. Analyzing binding data. Current Protocols in Neuroscience. 52 (1), 7.5.1-7.5.65 (2010).
- Sehgal, P., Olesen, C., Moller, J. V. ATPase Activity Measurements by an Enzyme-Coupled Spectrophotometric Assay. Methods in Molecular Biology. 1377, 105-109 (2016).
- Solinger, J. A., Lutz, G., Sugiyama, T., Kowalczykowski, S. C., Heyer, W. D. Rad54 protein stimulates heteroduplex DNA formation in the synaptic phase of DNA strand exchange via specific interactions with the presynaptic Rad51 nucleoprotein filament. Journal of Molecular Biology. 307 (5), 1207-1221 (2001).
- Banik, U., Roy, S. A continuous fluorimetric assay for ATPase activity. Biochemistry Journal. 266 (2), 611-614 (1990).
- Xiao, Y. X., Yang, W. X. KIFC1: a promising chemotherapy target for cancer treatment?. Oncotarget. 7 (30), 48656-48670 (2016).
- See, S. K., et al. Cytoplasmic Dynein Antagonists with Improved Potency and Isoform Selectivity. ACS Chemical Biology. 11 (1), 53-60 (2016).
- Datta, A., Brosh, R. M. New Insights Into DNA Helicases as Druggable Targets for Cancer Therapy. Frontiers in Molecular Biosciences. 5, 59 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır