Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Полу-высокой пропускной адаптации NADH-связанных АТПас анализ для скрининга малых ингибиторы молекулы
В этой статье
Резюме
Никотинамид аденин динуклеотид (NADH) -связанный анализ ATPase был адаптирован к полувысокой пропускной скрининга малых ингибиторов миозина молекулы. Этот кинетический анализ проводится в формате микроплиты 384 колодца с общими объемами реакции всего 20 Лл на скважину. Платформа должна быть применима практически к любому ферменту ADP.
Аннотация
Ферменты ATPase используют свободную энергию, хранящуюся в аденозинтрифосфате, чтобы катализировать широкий спектр эндергонных биохимических процессов in vivo, которые не будут происходить спонтанно. Эти белки имеют решающее значение для практически всех аспектов клеточной жизни, включая обмен веществ, деление клеток, реакцию на изменения окружающей среды и движение. Протокол, представленный здесь, описывает никотинамид аденин динуклеотид (NADH)-связанный анализ ATPase, который был адаптирован к полувысокой пропускной скрининг абиторы малых молекул АТПасе. Анализ был применен к сердечной и скелетной мышцы миозина II, два актин основе молекулярного двигателя ATPases, в качестве доказательства принципа. Гидролиз АТФ связан с окислением NADH ферментативными реакциями в ходе асссея. Во-первых, ADP, генерируемый ATPase, регенерируется в АТФ пирувате киназой (PK). ПК катализает переход фосфоненолпирувата (PEP) в пируват параллельно. Впоследствии пируват сводится к лактату при лактате дегидрогеназы (ЛДГ), которая катализает окисление NADH параллельно. Таким образом, снижение концентрации АТФ напрямую коррелирует со снижением концентрации NADH, за которым следует изменение внутренней флуоресценции NADH. До тех пор, как PEP доступна в системе реакции, концентрация ADP остается очень низкой, избегая ингибирования фермента ATPase своим собственным продуктом. Кроме того, концентрация АТС остается почти постоянной, что дает линейные временные курсы. Флуоресценция постоянно контролируется, что позволяет легко оценить качество данных и помогает отфильтровывать потенциальные артефакты (например, в результате сложных осадков или тепловых изменений).
Введение
Миозины механохимических преобразователей энергии, которые гидролизуют аденозин трифосфат (АТФ) для генерации направленного движения вдоль нитей актина цитоскелета в эукариотах1,2. Они имеют как структурно, так и кинетически адаптированы к их различных внутриклеточных функций, таких как транспорт органелл, сокращение мышц или генерации цитоскелетного напряжения1,2. Суперсемейка миозина представлена 40 генами миозина, принадлежащими к классумиосинов No12 в геноме человека 3,4. Члены классов миозина играют различные роли в весьма разнообразный набор расстройств, таких как несколько раковых заболеваний, неврологических расстройств, скелетных миопатий, и гипертрофической кардиомиопатии5,6. Учитывая большое количество физиологических и патологических функций этих молекулярных двигателей, неудивительно, что они становятся все более узнаваемыми в качестве лекарственных мишеней для различных условий7. Значительный прогресс был достигнут в последнее время воткрытии новых ингибиторов миозина 8,9,10 и активаторов11, и для улучшения свойств существующих12, 13 Год , 14 Год , 15.
Никотинамид аденин динуклеотид (NADH)-связанный анализ ATPase уже давно используется для измерения активности ATPase различных ферментов, таких как саркоплазма ретикулум Ca2 "насос ATPase16, РЕПАВ ATPase Rad5417, AAA ATPase p9718 или микротрубоум моторный кинезин19. В ассе используется цикл регенерации АТС. Аденозин дифосфат (ADP), генерируемый АТП, регенерируется аТФ с помощью пирувате киназы (PK), который параллельно преобразует одну молекулу фосфоненолпиррубвата (PEP). Впоследствии пируват е сводится к лактату при лактатной дигидрогеназе (LDH). Это, в свою очередь, окисляет одну молекулу NADH в NAD. Таким образом, снижение концентрации NADH как функции времени равно скорости гидролизу АТФ. Цикл регенерации АТС сохраняет концентрацию АТС почти постоянной, а концентрация ADP на низком уровне до тех пор, пока есть Pep. Это приводит к линейным курсам времени, что делает его простым, чтобы определить начальные показатели реакции и помогает избежать ингибирования продукта ADP19. Несмотря на то, что анализ ATPase, связанный с NADH, уже был адаптирован к формату 96 скважин20,высокие объемы реакции (150 л) делают его относительно дорогим из-за высокого спроса на реагенты, что делает его менее поддающимся быстрому скринингу большого количества Соединений. Альтернативные методы, такие как малахит зеленый анализ19,21, который опирается на обнаружение фосфатов, производимых ферментом ATPase, оказались более подходящими для миниатюризации и высокой пропускной платы скрининга22 , 23 , 24. Однако, конечной точки асссы, скорее всего, будут затронуты несколько артефактов (обсуждается ниже), которые могут оставаться неоткрытыми в отсутствие полный рабочий день курсов.
Здесь анализ NADH-связанных ATPase был оптимизирован для полувысокого скрининга пропускной записи малых ингибиторов молекулы. Скелетные и сердечные мышцы миозина II и ингибиторымиозина blebbistatin 8, para-aminoblebbistatin13 и пара-nitroblebbistatin12 используются для демонстрации силы анализа, который опирается на NADH флуоресценция как считывание. Этот протокол поддается скринингу проектов, ориентированных на любые ADP производства ферментов.
протокол
1. Подготовка фондовых растворов и реагентов
- Подготовка дитиотрейтол (DTT) бульонный раствор путем растворения кристаллического DTT в дистиллированной воде до конечной концентрации 1000 мм. Отрегулируйте рН до 7.0 с помощью 1 M NaOH. Aliquot и хранить при -20 градусах по Цельсию.
- Подготовьте штучное решение АТС, растворив кристаллический АТС в дистиллированной воде до конечной концентрации 100 мМ. Отрегулируйте рН до 7.0 с помощью 1 M NaOH. Aliquot и хранить при -20 градусах по Цельсию.
- Подготовка 10x NADH буфер, содержащий 70 мМ 3-(N-морфолино) пропанесульфоновой кислоты (MOPS), 10 мм MgCl2, 0,9 мМ этилен гликоль-бис (З-аминоэтил эфир)-N, N, N,N-тетраацетической кислоты (EGTA), и 3 мм На. . Отрегулируйте рН до 7.0 с помощью 1 M NaOH. Хранить при 4 градусах по Цельсию.
- Приготовьте 1x миозинный буфер, содержащий 10 мМ MOPS и 0,1 мм EGTA. Отрегулируйте рН до 7.0 с помощью 1 M NaOH. Хранить при 4 градусах по Цельсию. Добавьте бычий сывороточный альбомин (BSA) и DTT до конечной концентрации 0,1% (w/v%) и 1 мМ, соответственно, перед использованием.
- Подготовка 1x актина буфера, содержащего 4 mM MOPS, 0,1 мМ EGTA, 2 мМ MgCl2, и 3 мМ NaN3. Отрегулируйте рН до 7.0 с помощью 1 M NaOH. Хранить при 4 градусах по Цельсию. Добавьте BSA и DTT к конечной концентрации 0,1% (w/v%) и 1 мМ, соответственно, перед использованием.
- Подготовка nADH фондового раствора путем растворения кристаллического NADH в 10x NADH буфера до конечной концентрации 5,5 мм. Aliquot и хранить при -20 градусах по Цельсию.
- Подготовьте штепситное решение PEP, растворив кристаллический PEP в 10x nADH буфере до конечной концентрации 50 мМ. Aliquot и хранить при -20 градусах по Цельсию.
- Подготовка LDH фондового раствора путем растворения лиофилизированного порошка LDH в смеси глицерола и 10x NADH буфера (50%:50%) до конечной концентрации 2000 U/mL. Centrifuge раствор для удаления любого нерастворенного белка настоящее время (7,197 х г, 20 КК, 10 мин). Тщательно перенесите супернатант в чистую центрифужную трубку. Aliquot и хранить при -20 градусах по Цельсию.
- Подготовка PK фондовых решение путем растворения лиофилизированного pK порошок в смеси глицерола и 10x NADH буфера (50%:50%) до конечной концентрации 10000 U/mL. Centrifuge раствор для удаления любого нерастворенного белка настоящее время (7,197 х г, 20 КК, 10 мин). Тщательно перенесите супернатант в чистую центрифужную трубку. Aliquot и хранить при -20 градусах по Цельсию.
- Восстановите лиофилизированные образцы миозина миозина миозина ii сердечной и скелетной мышц, добавив 100 л дистиллированной воды для получения 10 мг/мл стоковых растворов, соответствующих концентрации миозина в размере 37,9 евро и 40,8 мкм мл. Для получения более подробной информации, см инструкции производителя.
- Подготовка F-актин из кролика мышечной ацетон порошок, как описано Парди и Spudich25.
2. Измерение активности АТПаз и ингибирующих эффектов малых молекулных ингибиторов
- Приготовить составную тарелку.
- Растворить соединения, представляющие интерес к высококачественным диметилсульфодоксиду (ДМСО).
- Создайте пятнадцатиступенчатые серийные 1:2 разбавления, начиная с концентрации соединения 10 мМ в DMSO.
- Перенесите образцы на 384-колодую полипропиленовые пластины в триплицяти (по 12,5 л каждый) с помощью многоканальной пипетки. Используйте два ряда на составной пластине для одного соединения (вместо трех столбцов), чтобы свести к минимуму количество скважин, потенциально пострадавших от эффектов края. Используйте последние три скважины во втором ряду для каждого соединения в качестве отрицательного контроля (только DMSO). Не используйте первый и последний ряд на пластине для соединения разбавления.
- Передача чистого DMSO в скважины первого ряда (зарезервированы для калибровки NADH).
- Используйте последний ряд для положительного контроля.
ПРИМЕЧАНИЕ: Пара-аминоблббистатин при концентрации 4 мМ в ДМСО был использован здесь.
- Приготовьте 4500 л из 20 разбавленного раствора актина для каждой панели анализов (384-ну хорошо черностенная микроплита полистирола) путем разбавления актина в актиневом буфере. Тщательно смешайте раствор, прокладывая вверх и вниз 30x с помощью пипетки 5 мл, чтобы уменьшить вязкость и неоднородность, разбив атинниг. Centrifuge раствор для удаления любого осажденного белка настоящее время (7,197 х г, 20 КС, 10 мин). Аккуратно перенесите супернатант в чистую центрифужную трубку.
- Подготовка мастер-микс, содержащий ферменты LDH и PK ("ферментная смесь"). Для каждой пластины асссея, объединить 171,4 л раствора LdH, 171,4 л pK раствора и 3189,3 Л или 3252,9 л буфера миозина для анализов с участием сердечной или скелетной мышцы миозина II, соответственно, в 15 мл конической центрифуги трубки. Не добавляйте миозин в этот момент, чтобы избежать агрегации и осадков.
- Подготовка мастер-микс, содержащий все субстраты ("субстратная смесь"). Для каждой пластины смешайте 162,1 л АТФ, 162,1 л ПЭП и 324,1 л раствора NADH в конической центрифуге 15 мл в трубе конической центрифуги 15 мл. Не добавляйте актин в этот момент, чтобы избежать агрегации и осадков.
- Создайте семиступенчатые серийные 1:2 разбавления NADH для калибровки, начиная с 250 мкм.
- Смешайте 12,3 л бульонного раствора NADH с 257,7 л буфера миозина в микроцентрифуговой трубке объемом 1,5 мл.
- Aliquot 135 л буфера миозина в семь микроцентрифуговых труб 1,5 мл.
- Перенесите 135 л раствора из первой трубки во вторую и смешайте путем трубачирования. Повторяйте до достижения7-й трубки.
- Используйте последнюю трубку в качестве управления без NADH (только буфер).
- Используя 8-канальный пипетку, перенесите 20 зликатовых растворов NADH в первый ряд пластины асссея в трипликатах.
- Добавьте 68 л сердечной или 4,2 л скелетной мышцы миозина II в ферментную смесь. Вихрь кратко.
- За исключением первого ряда, распределяйте 8,4 л приготовленного миозина-фермента в каждую скважину пластины асссея с помощью автоматизированного дозатора.
- Перенесите 100 нл растворов из сложной пластины в пластину, содержащую ферментную смесь с помощью автоматизированной системы обработки жидкости, оснащенной головкой пин-инструмента 100 нл.
- Встряхните тарелку асссея в течение 1 мин при комнатной температуре при температуре 1200 об/мин с помощью микроплитного шейкера.
- Добавьте 4052 л из центрифуге смутообразного действия в субстратную смесь. Вихрь кратко.
- Распределить 11,6 л актин-субстрата смесь в каждый колодец пластины ассея (за исключением первого ряда), чтобы начать ферментативную реакцию с помощью автоматизированного дозатора.
- Встряхните тарелку асссея в течение 1 мин при комнатной температуре при температуре 1200 об/мин с помощью микроплитного шейкера.
- Центрифуга ассеа пластины на 101 х г для 30 с.
- Убедитесь, что внутренняя температура считывателя пластин ы стабилизировалась при температуре 25 градусов по Цельсию. Загрузите тарелку и встряхните еще 30 с. Этот шаг встряхивания необходим, чтобы сделать форму жидкой поверхности одинаковой в каждой скважине и позволяет времени для пластины достичь температуры измерения.
- Запись NADH флуоресценции в течение 30 минут сканирования пластины в 45 с интервалами. Используйте фильтр для возбуждения пропускной способности в 380 нм, 10 нм и 470 нм, 24 нм пропускного моды в сочетании с дихроическим зеркалом на 425 нм. Выполнить измерение в режиме высокой концентрации. Оптимизируйте количество вспышек, увеличение детектора, размеры пластины и высоту измерения перед запуском анализов.
ПРИМЕЧАНИЕ: Окончательный ассоциатив ные: 300 нМ сердечного/20 нм скелетной мышцы миозин II, 10 мкм актин, 40 U/mL LDH, 200 U/mL PK, 220 мкм NADH, 1 ММ ПЭП, 1 мМ АТП в буфере, содержащем 10 мМ ММ MOPS (pH 7.0), 2 мм МГК2 , 0,15 мМ EGTA, 0,1 мг/мл BSA, 0,5% (v/v) DMSO и 1 мМ DTT. Общий объем составляет 20 л/ну. Самая высокая конечная концентрация соединения составляет 50 км. 20 мкм пара-аминоблббистатин в 0,5% DMSO служит положительным контролем и 0,5% DMSO только отрицательный контроль. Все измерения проводятся в триплицах.
3. Анализ данных
- Участок наблюдается интенсивность флуоресценции против времени для каждого колодца.
- Выполните простую линейную регрессию, чтобы определить наклон и перехват флуоресценции ответы для каждого колодца. Склон пропорциональн коэффициенту потребления АТС (NADH), в то время как перехват пропорциональен концентрации NADH в начале измерения (т 0 с).
- Постройте кривую калибровки для NADH, построив перехваты, полученные для первого ряда пластины, против концентрации NADH. Убедитесь, что перехваты зависят линейно от концентрации NADH.
ПРИМЕЧАНИЕ: Перехваты оценивают реальную интенсивность флуоресценции на т 0 с с гораздо большей уверенностью, чем в среднем интенсивность сырой флуоресценции читается на т з0 с. - Выполните простую линейную регрессию, чтобы получить наклон и перехват линии калибровки NADH.
ПРИМЕЧАНИЕ: Перехват описывает фоновый сигнал флуоресценции (нет NADH настоящее время), в то время как склон соответствует экстраполированных / теоретической интенсивности флуоресценции 1 M NADH решение в этом конкретном эксперименте. - Разделите наклон флуоресценции ответ, полученный для остальной части скважин по склону линии калибровки NADH для преобразования флуоресценции изменения в атлетпотребления.
- Участок аттестовые нормы потребления против концентрации ингибитора.
- Для определения ингибирующих констант используйте соответствующее статистическое программное обеспечение, чтобы соответствовать данным доза-ответа к следующему квадратному уравнению, соответствующему простой модели обязательного равновесия один на один:
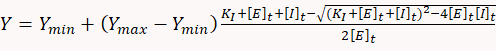
где Y является скорость потребления АТФ, Yмин является скорость потребления АТФ Int отсутствие ингибитора, Yмакс является теоретическая норма потребления АТФ на 100% ингибирование, KI является ингибиторной постоянной , «E»t и «Я»т являются общей концентрацией фермента (миозина) и ингибитора, соответственно.
Результаты
Типичная карта макета пластин, используемая для скрининговых экспериментов, показана на рисунке 1. Первая и последняя строки зарезервированы для калибровки NADH и положительного контроля (20 мкм пара-аминоблббистатин, 0,5% DMSO), соответственно. Остальн?...
Обсуждение
Критические шаги в протоколе
Оптимизируйте расположение пластин, запустив несколько пластин только с отрицательным контролем (реакция ATPase без ингибитора). Тщательно проверяйте результаты на наличие закономерностей в темпах реакции. Например, они могут возник?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантом Национального института неврологических расстройств и инсульта и Национального института по злоупотреблению наркотиками NS096833 (CAM).
Материалы
| Name | Company | Catalog Number | Comments |
| 384-well Low Flange Black Flat Bottom Polystyrene NBS Microplate | Corning | 3575 | |
| ATP (Adenosine 5′-triphosphate disodium salt hydrate) | Sigma | A7699 | |
| Aurora FRD-IB Dispenser | Aurora Discovery, Inc. | 00017425 | |
| Biomek NXP Multichannel Laboratory Automation Workstation | Beckman Coulter | A31841 | |
| Blebbistatin | AMRI | N/A | Custom synthesis |
| BSA (Bovine Serum Albumin, Protease-Free) | Akron Biotech | AK1391 | |
| Centrifuge 5430 R, refrigerated, with Rotor FA-35-6-30 | Eppendorf | 022620663 | |
| Centrifuge 5430, non-refrigerated, with Rotor A-2-MTP | Eppendorf | 022620568 | |
| DMSO (Dimethyl sulfoxide) | Sigma | D2650 | |
| DTT (DL-Dithiothreitol) | Sigma | D5545 | |
| E1 ClipTip Multichannel Pipette; 384-format; 8-channel | Thermo Scientific | 4672010 | |
| E1 ClipTip Multichannel Pipette; 96-format; 8-channel | Thermo Scientific | 4672080 | |
| EGTA (Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid) | Sigma | E3889 | |
| EnVision 2104 Multilabel Plate Reader | PerkinElmer | 2104-0010 | |
| Glycerol | Sigma | G2025 | |
| LDH (L-Lactic Dehydrogenase from rabbit muscle) | Sigma | L1254 | |
| MgCl2.6H2O (Magnesium chloride hexahydrate) | Sigma | M2670 | |
| Microplate Shaker | VWR | 12620-926 | |
| Microplate, 384 well, PP, Small Volume, Deep Well, Natural | Greiner Bio-One | 784201 | |
| MOPS (3-(N-Morpholino)propanesulfonic acid) | Sigma | M1254 | |
| Myosin Motor Protein (full length) (Bovine cardiac muscle) | Cytoskeleton | MY03 | |
| Myosin Motor Protein (full length) (Rabbit skeletal muscle) | Cytoskeleton | MY02 | |
| NADH (β-Nicotinamide adenine dinucleotide, reduced disodium salt hydrate) | Sigma | N8129 | |
| NaN3 (Sodium azide) | Sigma | 71289 | |
| NaOH (Sodium hydroxide) | Sigma | S8045 | |
| Optical Filter CFP 470/24nm (Emission) | PerkinElmer | 2100-5850 | Barcode 240 |
| Optical Filter Fura2 380/10nm (Excitation) | PerkinElmer | 2100-5390 | Barcode 112 |
| Optical Module: Beta Lactamase | PerkinElmer | 2100-4270 | Barcode 418 |
| OriginPro 2017 software | OriginLab | N/A | |
| para-Aminoblebbistatin | AMRI | N/A | Custom synthesis |
| para-Nitroblebbistatin | AMRI | N/A | Custom synthesis |
| PEP (Phospho(enol)pyruvic acid monopotassium salt) | Sigma | P7127 | |
| PK (Pyruvate Kinase from rabbit muscle) | Sigma | P9136 | |
| Rabbit Muscle Acetone Powder | Pel Freez Biologicals | 41995-2 |
Ссылки
- Heissler, S. M., Sellers, J. R. Kinetic Adaptations of Myosins for Their Diverse Cellular Functions. Traffic. 17 (8), 839-859 (2016).
- Hartman, M. A., Spudich, J. A. The myosin superfamily at a glance. Journal of Cell Science. 125 (Pt 7), 1627-1632 (2012).
- Berg, J. S., Powell, B. C., Cheney, R. E. A millennial myosin census. Molecular Biology of the Cell. 12 (4), 780-794 (2001).
- Sebe-Pedros, A., Grau-Bove, X., Richards, T. A., Ruiz-Trillo, I. Evolution and classification of myosins, a paneukaryotic whole-genome approach. Genome Biology and Evolution. 6 (2), 290-305 (2014).
- Newell-Litwa, K. A., Horwitz, R., Lamers, M. L. Non-muscle myosin II in disease: mechanisms and therapeutic opportunities. Disease Models & Mechanisms. 8 (12), 1495-1515 (2015).
- He, Y. M., Gu, M. M. Research progress of myosin heavy chain genes in human genetic diseases. Yi Chuan. 39 (10), 877-887 (2017).
- Rauscher, A. A., Gyimesi, M., Kovacs, M., Malnasi-Csizmadia, A. Targeting Myosin by Blebbistatin Derivatives: Optimization and Pharmacological Potential. Trends in Biochemical Sciences. 43 (9), 700-713 (2018).
- Straight, A. F., et al. Dissecting temporal and spatial control of cytokinesis with a myosin II Inhibitor. Science. 299 (5613), 1743-1747 (2003).
- Sirigu, S., et al. Highly selective inhibition of myosin motors provides the basis of potential therapeutic application. Proceedings of the National Academy of Sciences of the United States of America. 113 (47), E7448-E7455 (2016).
- Green, E. M., et al. A small-molecule inhibitor of sarcomere contractility suppresses hypertrophic cardiomyopathy in mice. Science. 351 (6273), 617-621 (2016).
- Morgan, B. P., et al. Discovery of omecamtiv mecarbil the first, selective, small molecule activator of cardiac Myosin. ACS Medicinal Chemistry Letters. 1 (9), 472-477 (2010).
- Kepiro, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable myosin II inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).
- Varkuti, B. H., et al. A highly soluble, non-phototoxic, non-fluorescent blebbistatin derivative. Scientific Reports. 6, 26141 (2016).
- Verhasselt, S., et al. Discovery of (S)-3'-hydroxyblebbistatin and (S)-3'-aminoblebbistatin: polar myosin II inhibitors with superior research tool properties. Organic and Biomolecular Chemistry. 15 (9), 2104-2118 (2017).
- Verhasselt, S., Roman, B. I., Bracke, M. E., Stevens, C. V. Improved synthesis and comparative analysis of the tool properties of new and existing D-ring modified (S)-blebbistatin analogs. European Journal of Medicinal Chemistry. 136, 85-103 (2017).
- Warren, G. B., Toon, P. A., Birdsall, N. J., Lee, A. G., Metcalfe, J. C. Reconstitution of a calcium pump using defined membrane components. Proceedings of the National Academy of Sciences of the United States of America. 71 (3), 622-626 (1974).
- Kiianitsa, K., Solinger, J. A., Heyer, W. D. Rad54 protein exerts diverse modes of ATPase activity on duplex DNA partially and fully covered with Rad51 protein. Journal of Biological Chemistry. 277 (48), 46205-46215 (2002).
- Hanzelmann, P., Schindelin, H. Structural Basis of ATP Hydrolysis and Intersubunit Signaling in the AAA+ ATPase p97. Structure. 24 (1), 127-139 (2016).
- Hackney, D. D., Jiang, W. Assays for kinesin microtubule-stimulated ATPase activity. Methods in Molecular Biology. 164, 65-71 (2001).
- Kiianitsa, K., Solinger, J. A., Heyer, W. D. NADH-coupled microplate photometric assay for kinetic studies of ATP-hydrolyzing enzymes with low and high specific activities. Analytical Biochemistry. 321 (2), 266-271 (2003).
- Carter, S. G., Karl, D. W. Inorganic phosphate assay with malachite green: an improvement and evaluation. Journal of Biochemical and Biophysical Methods. 7 (1), 7-13 (1982).
- Henkel, R. D., VandeBerg, J. L., Walsh, R. A. A microassay for ATPase. Analytical Biochemistry. 169 (2), 312-318 (1988).
- Rowlands, M. G., et al. High-throughput screening assay for inhibitors of heat-shock protein 90 ATPase activity. Analytical Biochemistry. 327 (2), 176-183 (2004).
- Rule, C. S., Patrick, M., Sandkvist, M. Measuring In Vitro ATPase Activity for Enzymatic Characterization. Journal of Visualized Experiments. (114), 54305 (2016).
- Pardee, J. D., Spudich, J. A. Purification of muscle actin. Methods in Cell Biology. 24, 271-289 (1982).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Kovacs, M., Toth, J., Hetenyi, C., Malnasi-Csizmadia, A., Sellers, J. R. Mechanism of blebbistatin inhibition of myosin II. Chem Journal of Biological Chemistry. 279 (34), 35557-35563 (2004).
- Allingham, J. S., Smith, R., Rayment, I. The structural basis of blebbistatin inhibition and specificity for myosin II. Nature Structural & Molecular Biology. 12 (4), 378-379 (2005).
- Kettlun, A. M., et al. Purification and Characterization of 2 Isoapyrases from Solanum-Tuberosum Var Ultimus. Phytochemistry. 31 (11), 3691-3696 (1992).
- Hulme, E. C., Trevethick, M. A. Ligand binding assays at equilibrium: validation and interpretation. British Journal of Pharmacology. 161 (6), 1219-1237 (2010).
- Motulsky, H. J., Neubig, R. R. Analyzing binding data. Current Protocols in Neuroscience. 52 (1), 7.5.1-7.5.65 (2010).
- Sehgal, P., Olesen, C., Moller, J. V. ATPase Activity Measurements by an Enzyme-Coupled Spectrophotometric Assay. Methods in Molecular Biology. 1377, 105-109 (2016).
- Solinger, J. A., Lutz, G., Sugiyama, T., Kowalczykowski, S. C., Heyer, W. D. Rad54 protein stimulates heteroduplex DNA formation in the synaptic phase of DNA strand exchange via specific interactions with the presynaptic Rad51 nucleoprotein filament. Journal of Molecular Biology. 307 (5), 1207-1221 (2001).
- Banik, U., Roy, S. A continuous fluorimetric assay for ATPase activity. Biochemistry Journal. 266 (2), 611-614 (1990).
- Xiao, Y. X., Yang, W. X. KIFC1: a promising chemotherapy target for cancer treatment?. Oncotarget. 7 (30), 48656-48670 (2016).
- See, S. K., et al. Cytoplasmic Dynein Antagonists with Improved Potency and Isoform Selectivity. ACS Chemical Biology. 11 (1), 53-60 (2016).
- Datta, A., Brosh, R. M. New Insights Into DNA Helicases as Druggable Targets for Cancer Therapy. Frontiers in Molecular Biosciences. 5, 59 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены