A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الكشف عن تطور ورم الرئة في الفئران عن طريق التصوير بالموجات فوق الصوتية
In This Article
Summary
يصف هذا البروتوكول الخطوات المتخذة للحث على أورام الرئة في الفئران ، وكذلك القياس الكمي للأورام المشكّلة عن طريق التصوير بالموجات فوق الصوتية. يتم تصور الأورام الصغيرة في النقاط الزمنية المبكرة كخطوط B. في وقت لاحق، يتم تحقيق قياسات حجم الورم النسبي من خلال أداة القياس في برنامج الموجات فوق الصوتية.
Abstract
مع حوالي 1.6 مليون ضحية سنويا، سرطان الرئة يساهم بشكل كبير في عبء السرطان في جميع أنحاء العالم. سرطان الرئة مدفوع جزئيا بالتغيرات الوراثية في الأورام مثل الأورام الأورام، الذي يشكل ~ 25٪ من حالات سرطان الرئة. الصعوبة في استهداف علاجيا سرطان الرئة التي تحركها KRAS تنبع جزئيا من وجود نماذج الفقراء التي يمكن أن تحاكي تطور المرض في المختبر. نحن نصف طريقة تسمح بالقياس الكمي النسبي لأورام الرئة الأولية KRAS في نموذج الماوس LSL-KRAS G12D من خلال التصوير بالموجات فوق الصوتية. تعتمد هذه الطريقة على السطوع (B) وضع اقتناء parenchyma الرئة. يتم تصور الأورام التي تتشكل في البداية في هذا النموذج كخطوط B ويمكن قياسها كمياً عن طريق حساب عدد خطوط B الموجودة في الصور المكتسبة. هذه تمثل عدد الورم النسبي الذي تم تشكيله على سطح رئة الماوس. مع تطور الأورام المشكّلة مع مرور الوقت، يُنظر إليها على أنها شقوق عميقة داخل الرئة. نظرًا لأن محيط الورم المتكون محدد جيدًا ، يتم حساب حجم الورم النسبي عن طريق قياس طول وعرض الورم وتطبيقه في الصيغة المستخدمة لقياسات فرجار الورم. التصوير بالموجات فوق الصوتية هو تقنية غير الغازية وسريعة وسهلة الاستعمال التي غالبا ما تستخدم لقياس الأورام في الفئران. على الرغم من أن القطع الأثرية قد تظهر عند الحصول على صور الموجات فوق الصوتية ، فقد ثبت أن تقنية التصوير هذه أكثر فائدة للتحديدالكمي للورم في الفئران مقارنة بتقنيات التصوير الأخرى مثل التصوير المقطعي المحوسب (CT) والتصوير و التصوير الحيوي (BLI). يمكن للباحثين التحقيق في أهداف علاجية جديدة باستخدام هذه التقنية من خلال مقارنة بدء ورم الرئة والتقدم بين مجموعات مختلفة من الفئران.
Introduction
كسبب رئيسي للوفيات المرتبطة بالسرطان في جميع أنحاء العالم ، لا يزال سرطان الرئة انكسارًا للعلاجات ، ويرجع ذلك بشكل رئيسي إلى عدم وجود نماذج ما قبل السريرية ذات الصلة التي يمكن أن تُلخص المرض في المختبر1. حوالي 25٪ من حالات سرطان الرئة هي بسبب الطفرات في الأورام الأورام KRAS2. غالبًا ما يرتبط سرطان الرئة الذي يحركه KRAS بسوء التكهن وانخفاض الاستجابة للعلاج ، مما يسلط الضوء على أهمية إجراء مزيد من الدراسات في هذا المرض2.
لقد قمنا بتحسين طريقة تسمح بالتقييم النسبي لنمو ورم الرئة في الوقت الحقيقي في الفئران الكفؤة من المناعة الناجمة عن سرطان الرئة. نحن نستخدم Lox-Stop-Lox KRAS G12D (LSL-KRAS G12D) الفئران التي يمكن التعبير عن الأوكوجين KRAS G12D بواسطة ناقلات اللافيروسية Cre3،4. وتحرك هذه النواقل بواسطة الانهيرجس الكربوني 2، مما يسمح للعدوى الفيروسية أن تحدث على وجه التحديد في الخلايا الظهارية السنخية5. وبالإضافة إلى ذلك، لتسريع بدء وتطور أورام الرئة، ويبني lentiviral أيضا يعبر P53 شرنا من المروج U6/H1 (سيتم الإشارة إلى بناء lentiviral هنا باسم Ca2Cre-shp53)6. الأهمية البيولوجية لهذه الطريقة تكمن في المسار الطبيعي لتطور ورم الرئة في الفئران بدلا من xenografts من الأورام غير تقويم العظام في الفئران. عقبة باستخدام طريقة تقويم العظام هو رصد نمو ورم الرئة دون التضحية الماوس. للتغلب على هذا القيد، قمنا بتحسين التصوير بالموجات فوق الصوتية للسماح بتحليل تطور ورم الرئة في وضع ثنائي الأبعاد (2D) في نموذج الماوس هذا. وتنعكس بدء الأورام في 7 أسابيع بعد العدوى كخطوط B في صور الموجات فوق الصوتية ، والتي يمكن عدها ، ولكنها لن تعكس العدد الدقيق للأورام الموجودة على الرئة. تتميز خطوط B بخطوط بيضاء عمودية تشبه الليزر الناشئة عن الخط الجنبي في الرئة parenchyma7،8. يمكن تصور الأورام الكبيرة بعد 18 أسبوعًا من العدوى. يتم قياس الحجم النسبي لهذه الأورام من خلال القياسات 2D القيام به على الموجات فوق الصوتية.
هذه الطريقة هي الأمثل للباحثين التحقيق في تأثير الأدوية الدوائية على نمو ورم الرئة في نموذج الماوس LSL-KRAS G12D. بالإضافة إلى ذلك ، يمكن مقارنة تطور ورم الرئة بين الفئران ذات الأنساب الوراثية المختلفة ، لدراسة أهمية وجود أو عدم وجود جينات / بروتينات معينة على تطور حجم ورم الرئة.
Access restricted. Please log in or start a trial to view this content.
Protocol
أجريت الدراسات الحيوانية وفقا للجنة المؤسسية لرعاية الحيوانات واستخدامها (IACUC) من جامعة ماكغيل وتمت الموافقة على الإجراءات من قبل لجنة رعاية الحيوان في جامعة ماكغيل (بروتوكول استخدام الحيوان # 2009-5754).
1. جيل من CA2Cre-shp53 اللينتيفير تاندريه
ملاحظة: البروتوكول التالي هو نفسه الذي وصفه في شيا وآخرون6، مع تعديلات طفيفة.
- إعداد فيروس اللاني (لأطباق 15 سم × 10 سم)
- في اليوم 1، لوحة صحية HEK293T الخلايا (7.5 × 106 خلايا لكل طبق 10 سم) مع 10 مل من متوسط النسر المعدلة دولبيكو) (DMEM)، 10٪ مصل الأبقار الجنين (FBS)، و 1٪ القلم / العقدية. الثقافة في حاضنة 37 درجة مئوية، 5٪CO2.
- إعداد مزيج للتغف الكالسيوم والفوسفات (خليط ل15 لوحة). إعداد أنبوب يحتوي على 225 ميكروغرام (15 ميكروغرام/لوحة) من ناقلات اللافيرالفيروسية (Ca2Cre-shp53)، 75 ميكروغرام (5 ميكروغرام/لوحة) من PsPAX2 plasmid (تحتوي على فيروس نقص المناعة البشرية-1 هفوة وفيروس نقص المناعة البشرية-1 الجينات بول)، 75 ميكروغرام (5 ميكروغرام/لوحة) من pMD2.G plasmid (التي تحتوي على جين VSV-G) للتغليف، تركيز نهائي من 0.15 م من CaCl2 وملء أنبوب مع المقطر H2O تصل إلى 3.75 مل. إعداد أنبوب B يحتوي على 3.75 مل من 2x HEPES- ملاين buffered المالحة (HBS; 50 mM HEPES, درجة الحموضة 7.05, 280 mM NaCl, 10 mM KCl, 1.5 mM Na2HPO4·2H2O, و 12 mM D-dextrose).
- دوامة أنبوب A وإضافته إلى دروبروايز إلى أنبوب B تحت دوامة مستمرة.
ملاحظة: سيكون الحجم الإجمالي 7.5 مل. - احتضان في درجة حرارة الغرفة في الظلام لمدة 20-30 دقيقة.
- حوالي 9 ساعة بعد طلاء الخلايا، إضافة 500 ميكرولتر من خليط transfection dropwise في وسط الخلية (7.5 مل / 15 أطباق: 0.5 مل لكل طبق).
- دوامة بلطف كل طبق لخلط، واحتضان جميع الأطباق في 37 درجة مئوية، 5٪ CO2.
- في اليوم الثاني، 12-18 ساعة بعد الترانزفيشن، استبدل الوسائط بـ 10 مل من وسائط المصل المخفضة الخالية من المضادات الحيوية(جدول المواد)لكل طبق يبلغ طولها 10 سم. ضع الأطباق مرة أخرى فيحاضنة 37 درجة مئوية، 5٪ من ثاني أكسيد الكربون.
- في اليوم 3، وجمع وسائل الإعلام التي تحتوي على فيروسات اللينتي ة التعبير عن Ca2Cre-shp53 وتصفية من خلال مرشحات 0.45 ميكرومتر. تجديد وسائل الإعلام مع وسائل الإعلام مصل مخفضة خالية من المضادات الحيوية جديدة.
ملاحظة: يمكن الاحتفاظ الوسائط التي تم جمعها عند 4 °C لمدة لا تزيد عن 3 أيام. - في اليوم الرابع، اجمع، للمرة الثانية، الوسائط التي تحتوي على الفيروس اللينتي وفلتر من خلال مرشح 0.45 ميكرومتر. يُحفظ عند درجة حرارة 4 درجات مئوية (لمدة لا تزيد عن 3 أيام).
- الجمع بين supernatants الفيروس من الخطوات 1.1.8 و 1.1.9. ركزها من خلال وحدات تصفية الطرد المركزي(جدول المواد)عن طريق الطرد المركزي عند 1,372 × ز لمدة 30 دقيقة عند 4 درجات مئوية. كرر العملية حتى تمر جميع الوسائط التي تم جمعها عبر الأعمدة.
ملاحظة: بعد كل عملية مركزية، يمكن حصاد 100-200 ميكرولتر من الفيلارات المركزة. - جمع وخلط الفيلاتات المركزة في أنبوب الجليد الباردة 15 مل. اخلط الفيروسات اللينتية المركزة جيدًا ثم أإقتناط (على سبيل المثال، 100 ميكرولتر/ أنبوب). تخزين في -80 درجة مئوية.
- معايرة اللينتيفية
ملاحظة: تستخدم الخلايا الليفية الجنينية الجنينية للفئران الخالدة (MEFs) التي تعبر عن أليل محاط بـ loxP من البروتين الفلوري الأخضر (GFP) في هذا البروتوكول للقياس الكمي للتتر الفيروسي. ومع ذلك، يجب أن يكون أي خط خلية مع أليل loxP-GFP مناسبة لهذه الخطوة.- خلايا الثقافة التي تعبر عن أليل loxP يحيط بها GFP مع DMEM ، 10٪ FBS و 1٪ قلم / بكتيريا عند 37 درجة مئوية ، 5٪ CO2.
- لوحة 2 × 105 خلايا في بئرين 50 ملم من لوحة 6-well.
ملاحظة: سيتم استخدام خلايا بئر واحد للعدوى اللافيروسية في حين أن الآخر سيتم استخدامه كتحكم سلبي. - في اليوم التالي، وتجديد الخلايا مع 2 مل من DMEM، 10٪ FBS، و 1٪ القلم / العقدية 2 ساعة قبل العدوى اللافيروسية.
- إضافة 20 ميكرولتر من فيروس اللابتي CA2Cre-shp53 (قد يختلف الحجم عند الحاجة) في العدوى اللافيروسية بشكل جيد.
- بعد 3 أيام في الثقافة ، حدد تردد الخلايا الإيجابية GFP الناجمة عن Cre عن طريق قياس التدفق الخلوي ، كما هو موضح في الشكل 1. غسل الخلايا مع الفوسفات العازلة المالحة (PBS)، وفصل عن طريق التربسينات وجمع الخلايا عن طريق الطرد المركزي في 112 × ز.
- غسل الخلايا مرتين مع برنامج تلفزيوني. وأخيراً، تعليق الخلايا في 100 ميكرولتر من برنامج تلفزيوني. تحديد النسبة المئوية للخلايا الإيجابية GFP بواسطة محلل الخلية(جدول المواد).
- حساب التتر المعدية lentivirus / وظيفية باستخدام الصيغة التالية:

حيث F هو تردد الخلايا الإيجابية GFP ومحسوبة عن طريق طرح تردد GFP -الخلايا الإيجابية بعد العدوى (Fi) من تردد الخلايا إيجابية GFP (الخلفية) قبل العدوى (Fc) كما هو موضح في الشكل 1 (F = Fi-Fc) ، Cn هو عدد الخلايا المطلية (2 × 105)، V هو حجم inoculum (mL) ، وDF هو عامل تخفيف الفيروس.
ملاحظة: التركيز المعدي / الوظيفي = ~ 2 × 106 TU / مل.
2. التنبيب داخل الرمقت من الفيروسات اللينتية في الفئران LSL-KRASG12D
ملاحظة: تم استخدام طريقة التنبيب داخل الرتج كما هو موضح في البروتوكول المنشور من قبل Vandivort وآخرون9. في هذا البروتوكول، يتم استخدام الفئران LSL-KRASG12D في خلفية C57BL/6 في سن 6-8 أسابيع. ويستخدم مجلس إجراءات العمل محلية الصنع على النحو المبين في Vandivort وآخرون9. يتم وضع المجلس أمام المجرب في مساحة عمل مريحة (حوالي 1 م2).
- إعداد مقياس التنفس عن طريق إزالة المكبس من حقنة 1 مل وتحميل 60 ميكرولتر من برنامج تلفزيوني في الحقنة.
- نعلق طرف قسطرة 22 G في الحقنة وتوضع جانبا.
- تهوّن الفئران عن طريق الحقن داخل البلاموس ية لـ 1 ميكرولتر/غرام من وزن جسم الفأر من الكيتامين (50 ملغم/مل) /xylazine (5 ملغ/مل)/acepromazine (1 ملغ/مل) كوكتيل. ضمان التطفل السليم للفأرة عن طريق انخفاض معدل التنفس (1 التنفس كل 2 ق).
- تستنشق 20 ميكرولتر من CA2Cre-shp53 lentivirus في pipettor وتوضع جانبا.
- ضع الماوس المُسَّر على لوحة إجراءات العمل عن طريق ربط قواطعه العلوية في خيط اللوحة.
ملاحظة: يجب أن يكون دورسوم الماوس مسطحة ضد النظام الأساسي. - الشريط الجزء caudal من تجويف الصدر إلى منصة لضمان محاذاة الماوس أثناء الإجراء.
- ضبط مضيئة gooseneck بين 80-100% كثافة ووضع ضوء 1-2 سم من سطح الجلد.
- من وراء المنصة ، رسم اللسان من تجويف الفم من الماوس باستخدام ملقط معقمة.
- أثناء تأمين اللسان ، أدخل مثبطًا في تجويف الفم للفأرة ثم حرر اللسان.
- وضع gooseneck على القصبات الهوائية الجذعية الرئيسية لإلقاء الضوء على القصبة الهوائية.
ملاحظة: قد تكون القصبة الهوائية مرئية من خلال عمل التنفس، مما تسبب في تذبذب الضوء. - عندما ينظر إلى القصبة الهوائية بوضوح, أدخل مقياس التنفس أعدت (حقنة مع برنامج تلفزيوني والقسطرة) في مسار القصبة الهوائية.
- إزالة الاكتئاب ومراقبة ارتفاع وهبوط برنامج تلفزيوني في الحقنة مع كل نفس.
ملاحظة: هذا مؤشر على أن القسطرة يتم وضعها بشكل صحيح في القصبة الهوائية. - إزالة الحقنة التي تحتوي على برنامج تلفزيوني مع الحفاظ على القسطرة داخل القصبة الهوائية كما الموقف السابق.
- إيداع 20 μL CA2Cre-shp53 lentivirus في وسط القسطرة.
- مع الحفاظ على القسطرة في مكانها، قم بحقن 300 ميكرولتر من الهواء في القسطرة باستخدام حقنة فارغة لضمان التوزيع السليم للفيروس اللابتي في الرئتين.
- حافظ على القسطرة في مكانها وأعد إدخال مقياس التنفس في القسطرة.
ملاحظة: سيؤدي ارتفاع وهبوط فقاعة PBS إلى ضمان نجاح الإجراء. - إزالة القسطرة والشريط. ضع الحيوان في مكان دافئ وجاف حتى يتم إحياؤه.
3. التصوير بالموجات فوق الصوتية لأورام الرئة في الفئران
ملاحظة: تم إجراء التصوير بالموجات فوق الصوتية بعد 7 و 18 أسبوعا من التنبيب اللابتروفيلي باستخدام النظام المدرج في جدول المواد؛ ومع ذلك، يمكن استخدام أي نموذج للتحليل.
- يوم واحد قبل التصوير، وإزالة الفراء من منطقة الصدر من الماوس التنبيب.
ملاحظة: يجب أن يكون مُسَنَّث ًا للماوس أثناء هذه الخطوة عن طريق وضعها في غرفة تعريفية من 3% isoflurane و 2L/minute O2. - في يوم التصوير، قم بإعداد مساحة العمل كما هو موضح في الشكل 2. قم بتشغيل مضخة التدفئة لجل الموجات فوق الصوتية وشاشة درجة الحرارة.
- قم بإعداد حاضنة دافئة 33 درجة مئوية لوضع الفئران في مرحلة ما بعد التصوير.
- ضع المحرك ثلاثي الأبعاد (3D)(الشكل 2F)على نظام السكك الحديدية المتكامل.
- تأكد من أن المحرك ثلاثي الأبعاد ونظام تركيب المحول في مكانهما بشكل آمن.
- توصيل محول مفضل (التردد: 40 ميغاهرتز؛ الشكل 2E وجدول المواد)لقياسات الورم عمودي على المحرك 3D.
- بدء دراسة جديدة على برنامج الموجات فوق الصوتية.
- حدد متصفح الدراسة، ثم حدد جديد ًا في أسفل الشاشة.
- اختر دراسة جديدة، ستظهر نافذة جديدة تمكن من إضافة اسم الدراسة بالإضافة إلى مزيد من المعلومات حول الدراسة ، أي تاريخ الدراسة ، واسم الباحث ، إلخ.
- ملء المعلومات في اسم السلسلة، أي معرف الحيوان ، والإجهاد ، والوزن ، وتاريخ الميلاد ، وما إلى ذلك.
- حدد "تم"،سيتغير البرنامج لوضع B.
- وضع مصباح التدفئة في موقف مناسب فوق منصة الحيوان.
- ضع الماوس في غرفة الحث (3.5٪ isoflurane).
ملاحظة: يتم تأكيد عملية التمسيد السليم عن طريق فقدان الوعي للفأر، ومعدل التنفس أبطأ من حوالي 1 نفسا لكل ثانيتين. - عندما يتم تخدير الماوس، تغيير اتصال الجهاز مخدر ليتم توجيهها نحو منصة الحيوان، والحد من isoflurane إلى 2.5٪.
- ضع الفأر على منصة الحيوان في البطن الديكوبيت، مع تجويف الفم الموجه نحو أنبوب التخدير.
- تطبيق مواد التشحيم على عيون الماوس.
- وضع الماوس في dcubitus الظهر والشريط يديه وقدميه بحزم على منصة الحيوان.
- تطبيق طبقة صغيرة من هلام الموجات فوق الصوتية على صدر الماوس.
- خفض التحقيق اقتناء باستخدام مقبض التحكم في الارتفاع للمس سطح الصدر الماوس. ضع المسبار بحيث يتركز قلب الماوس تقريبًا.
- استخدام المقابض الصغيرة للحصول على صور للصدر كله، من كلا الطرفين، في الاتجاه العرضي جمع مثالي 500 لقطة لكل فأرة (عدد من الإطارات قد تختلف تبعا للاختيار الشخصي).
- بمجرد الانتهاء من التصوير ، قم بإزالة الجل من صدر الماوس ووضع الماوس في الحاضنة الدافئة.
4. تحليل 2D من صور الموجات فوق الصوتية
- بعد فتح الإطارات المكتسبة على برنامج الموجات فوق الصوتية، تفحص الإطارات للأورام.
- بالنسبة للأورام الصغيرة التي تبدأ، عد عدد خطوط B بشكل دوري كل 10 إطارات للطول الكامل للإطارات الـ 500 التي تم الحصول عليها.
لذلك ، يتم حساب خطوط B في ما مجموعه 50 صورة ، يتم فصل كل صورة من قبل 10 إطارات. تتميز خطوط B بخطوط مستقيمة بيضاء طولية تعبر الشاشة بالكامل. - للقياسات 2D من الأورام الكبيرة، حدد الأداة الخطية وقياس عرض وطول الورم الحالي.
- لحساب حجم الأورام، استخدم الصيغة التالية:
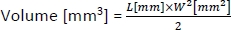
حيث L و W هما طول وعرض الورم، على التوالي.
Access restricted. Please log in or start a trial to view this content.
النتائج
بعد الحصول على تتر معدي للبروسي روسي من ~ 2 × 106 TU /mL(الشكل 1)، تم حقن الفيروس اللابتي Ca2Cre-shp53 داخل الرخاث عندما وصلت فئران LSL-KRAS G12D إلى سن مناسب (6-8 أسابيع)9. تم إجراء التصوير بالموجات فوق الصوتية بعد 7 أسابيع من العدوى عند بدء الأورام(الشكل 3...
Access restricted. Please log in or start a trial to view this content.
Discussion
نحن نبين طريقة يمكن أن تقيّم نمو ورم الرئة في نموذج الماوس LSL-KRAS G12D القابل للاختزال عن طريق الموجات فوق الصوتية. يمكن استخدام هذه الطريقة لتقييم تأثير مثبطات الأدوية على نمو ورم الرئة. ويمكن أيضا أن تستخدم لمقارنة نمو ورم الرئة بين الفئران من خلفيات وراثية مختلفة. استخدام هذه التقنية لا يتط...
Access restricted. Please log in or start a trial to view this content.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
نشكر الدكتور I. فيرما لناقلات Ca2Cre-shp53 اللافيروسية. تم دعم العمل من خلال أموال من المعاهد الكندية للبحوث الصحية (CIHR MOP 137113) إلى AEK.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.45 μm Acrodisc Syringe Filters | Pall Corporation | PN 4614 | |
| 100-mm Cell Cultre Plate | CELLSTAR | 664 160 | |
| 6-well Cell Culture Plate | CELLSTAR | 657 160 | |
| Amicon Ultra - 15 Centrifugal Filter Units | Merck Millipore Ltd. | UFC910024 | |
| BD LSR-Fortessa | BD Biosciences | 649225B 3024 | |
| CA2Cre-shp53 lentiviral vector | From Dr. I Verma Laboratory | ||
| DMEM | Multicell | 319-005-CL | |
| FBS | Multicell | 80450 | |
| LSL-KRASG12D mouse | JAX Mice | 8179 | |
| MX550S; Centre Transmit: 40 MHz | FUJIFILM VisualSonics | 51070 | |
| OptiMEM | gibco | 11058-021 | |
| Pen/strep | Multicell | 450-201-EL | |
| pMD2.G | Addgene | 12259 | |
| PsPAX2 | Addgene | 12260 | |
| VEVO-3100 | FUJIFILM VisualSonics | 51072-50 |
References
- Eisenstein, M. Personalized medicine: Special treatment. Nature. 513, 8(2014).
- Karachaliou, N., et al. KRAS mutations in lung cancer. Clinical Lung Cancer. 14 (3), 205-214 (2013).
- Jackson, E. L., et al. Analysis of lung tumor initiation and progression using conditional expression of oncogenic K-ras. Genes & Development. 15 (24), 3243-3248 (2001).
- DuPage, M., Dooley, A. L., Jacks, T. Conditional mouse lung cancer models using adenoviral or lentiviral delivery of Cre recombinase. Nature Protocol. 4 (7), 1064-1072 (2009).
- Chen, J., Lecuona, E., Briva, A., Welch, L. C., Sznajder, J. I. Carbonic anhydrase II and alveolar fluid reabsorption during hypercapnia. American Journal of Respiratory Cell and Molecular Biology. 38 (1), 32-37 (2008).
- Xia, Y., et al. Reduced cell proliferation by IKK2 depletion in a mouse lung-cancer model. Nature Cell Biology. 17 (4), 532(2015).
- Demi, L., et al. Determination of a potential quantitative measure of the state of the lung using lung ultrasound spectroscopy. Scientific Reports. 7, 12746(2017).
- Mohanty, K., et al. Characterization of the Lung Parenchyma Using Ultrasound Multiple Scattering. Ultrasound in Medicine and Biology. 43, 993-1003 (2017).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771(2016).
- Saraogi, A. Lung ultrasound: Present and future. Lung India. 32 (3), 250-257 (2015).
- Gargani, L., Volpicelli, G. How I do it: lung ultrasound. Cardiovascular Ultrasound. 12, 25(2014).
- Soldati, G., et al. On the Physical Basis of Pulmonary Sonographic Interstitial Syndrome. Journal of Ultrasound in Medicine. 35 (10), 2975(2016).
- Raes, F., et al. High-Resolution Ultrasound and Photoacoustic Imaging of Orthotopic Lung Cancer in Mice: New Perspectives for Onco-Pharmacology. PLoS One. 11 (4), 15(2016).
- Lakshman, M., Needles, A. Screening and quantification of the tumor microenvironment with micro-ultrasound and photoacoustic imaging. Nature Methods. 12 (4), 372(2015).
- Chichra, A., Makaryus, M., Chaudhri, P., Narasimhan, M. Ultrasound for the Pulmonary Consultant. Clinical Medicine Insights: Circulatory Respiratory and Pulmonary Medicine. 10, 9(2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved