Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Ultrason Görüntüleme ile Farelerde Akciğer Tümörü İlerlemesinin Saptanması
Bu Makalede
Özet
Bu protokol, farelerde KRAS akciğer tümörlerini indüklemek için atılan adımları ve ultrason görüntüleme ile oluşan tümörlerin sayısallaştırılmasını açıklamaktadır. Küçük tümörler erken zaman noktalarında B-çizgileri olarak görselleştirilir. Daha sonraki zaman noktalarında ultrason yazılımında ölçüm aracı ile nispi tümör hacmi ölçümleri yapılır.
Özet
Yılda ~ 1.6 milyon kurban ile, akciğer kanseri kanserin dünya çapında yüke muazzam katkıda bulunur. Akciğer kanseri kısmen kras onkogen gibi onkogenlerde genetik değişiklikler tarafından tahrik edilir, hangi akciğer kanseri vakalarının ~ 25% oluşturmaktadır. Terapötik KRAS güdümlü akciğer kanseri hedefleme zorluk kısmen laboratuvarda hastalığın ilerlemesini taklit edebilir kötü modellere sahip kaynaklanmaktadır. Biz ultrason görüntüleme ile Cre-indükleyici LSL-KRAS G12D fare modelinde primer KRAS akciğer tümörlerinin göreceli nicelik izin veren bir yöntem açıklayın. Bu yöntem, akciğer parankiminin parlaklık (B) modu edinimine dayanır. Başlangıçta bu modelde oluşan tümörler B-çizgileri olarak görselleştirilerek elde edilen görüntülerde bulunan B-çizgilerinin sayısı sayılarak ölçülebilir. Bunlar fare akciğer yüzeyinde oluşan göreceli tümör numarasını temsil eder. Oluşan tümörler zamanla geliştikçe, akciğer parankim içinde derin yarıklar olarak algılanır. Oluşan tümörün çevresi iyi tanımlanmış olduğundan, tümörün uzunluğu ve genişliği ölçülmesi ve tümör kaliper ölçümleri için kullanılan formülde uygulanması ile göreceli tümör hacminin hesaplanması sağlanır. Ultrason görüntüleme genellikle farelerde tümör nicelikleri için kullanılan non-invaziv, hızlı ve kullanıcı dostu bir tekniktir. Ultrason görüntüleri elde edilirken objeler ortaya çıksa da, bu görüntüleme tekniğinin farelerde tümör nicelikleri için bilgisayarlı tomografi (BT) görüntüleme ve biyolüminesans görüntüleme (BLI). Araştırmacılar, farklı fare grupları arasında akciğer tümörü inisiyasyonu ve ilerlemesini karşılaştırarak bu tekniği kullanarak yeni terapötik hedefleri araştırabilirler.
Giriş
Kansere bağlı ölümlerin önde gelen nedeni olarak dünya çapında, akciğer kanseri tedavileri için refrakter kalır, özellikle laboratuvarda hastalığı özetleyebilir ilgili pre-klinik modellerin eksikliği nedeniyle1. Akciğer kanseri vakalarının yaklaşık %25'i KRAS onkogen2'dekimutasyonlara bağlıdır. KRAS güdümlü akciğer kanseri genellikle kötü prognoz ve tedaviye düşük yanıt ile ilişkilidir, Bu hastalıkta daha fazla çalışmanın önemini vurgulayarak2.
KRAS akciğer kanserine bağlı immün yetkİli farelerde akciğer tümörü büyümesinin gerçek zamanlı olarak değerlendirilmesini sağlayan bir yöntem optimize ettik. Biz Lox-Stop-Lox KRAS G12D (LSL-KRAS G12D) fareler hangi KRAS G12D onkogen Cre lentiviral vektörler3,4ile ifade edilebilir kullanın. Bu vektörler karbonik anhidraz tarafından tahrik edilir 2, viral enfeksiyon özellikle alveoler epitel hücrelerinde yer almak için izin5. Buna ek olarak, akciğer tümörlerinin başlatılması ve ilerlemesini hızlandırmak için, lentiviral yapı da bir U6/H1 organizatörü p53 shRNA ifade eder (burada lentiviral yapı Ca2Cre-shp53 olarak anılacaktır)6. Bu yöntemin biyolojik önemi farelerde ortotopik olmayan tümörlerin ksenogreftlerinin aksine farelerde akciğer tümörü gelişiminin doğal seyrinde yatmaktadır. Ortotopik yöntemi kullanan bir engel fareden ödün vermeden akciğer tümörü büyümesini izlemektir. Bu sınırlamayı aşmak için ultrason görüntülemeyi, bu fare modelinde iki boyutlu (2D) modda akciğer tümörü progresyonunun analizine izin vermek için optimize ettik. Enfeksiyon sonrası 7 hafta tümörlerin başlatılması ultrason görüntülerinde B-hatları olarak yansıtılır, hangi sayılabilir, ancak akciğerde mevcut tümörlerin tam sayısını yansıtmaz. B-hatları akciğer parankim7plevral çizgi kaynaklanan lazer benzeri dikey beyaz çizgiler ile karakterizedir7 ,8. Büyük tümörler 18 haftalık enfeksiyondan sonra görüntülenebilir. Bu tümörlerin göreceli hacmi ultrasonda yapılan 2B ölçümlerile ölçülür.
Bu yöntem, Farmakolojik ilaçların LSL-KRAS G12D fare modelinde akciğer tümörü büyümesi üzerine etkisini araştıran araştırmacılar için en uygun yöntemdir. Buna ek olarak, akciğer tümörü progresyonu farklı genetik soylara sahip fareler arasında karşılaştırılabilir, varlığı veya bazı genlerin yokluğu / proteinlerin varlığı veya yokluğu akciğer tümör hacminin gelişimi üzerinde incelenmesi için.
Access restricted. Please log in or start a trial to view this content.
Protokol
McGill Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) uyarınca hayvan çalışmaları yapıldı ve prosedürler McGill Üniversitesi Hayvan Refahı Komitesi (hayvan kullanım protokolü # 2009-5754) tarafından onaylandı.
1. NESIL CA2Cre-shp53 Lentiviral Titre
NOT: Aşağıdaki protokol, Xia ve ark.6'daküçük değişikliklerle açıklananla aynıdır.
- Lentivirus hazırlanması (15 cm x 10 cm tabaklar için)
- 1. günde, sağlıklı HEK293T hücreleri (10 cm çanak başına 7,5 x 106 hücre) 10 mL Dulbecco modifiye Kartal orta) (DMEM), 10% fetal sığır serumu (FBS) ve% 1 kalem / strep. Kültür 37 °C, 5% CO2 kuluçka makinesi.
- Karışımı kalsiyum-fosfat transfeksiyonu (15 tabak için karışım) için hazırlayın. Hazırlamak Tüp 225 μg (15 g /plaka) lentiviral vektör (Ca2Cre-shp53), 75 μg (5 g/ plaka) PsPAX2 plazmid (HIV-1 gag ve HIV-1 pol genleri içeren), 75 μg (5 μg/plaka) pMD2.G plazmid (VSV-G geni içeren) ambalaj için, 0,15 M CaCl2 son konsantrasyonu ve distile H2O ile 3,75 mL kadar tüp doldurun. 2x HEPES tamponlu salinin 3,75 mL içeren B tüpünü hazırlayın (HBS; 50 mM HEPES, pH 7.05, 280 mM NaCl, 10 mM KCl, 1.5 mM Na2HPO4·2H2O ve 12 mM D-dekstroz).
- Girdap tüpü A ve sürekli girdap altında tüp B damla akıllıca ekleyin.
NOT: Toplam hacim 7,5 mL olacaktır. - 20−30 dakika karanlıkta oda sıcaklığında kuluçka.
- Hücreleri kaplamadan yaklaşık 9 saat sonra, transfeksiyon karışımının 500 μL'sini hücre ortamına damlacık ekleyin (7,5 mL/15 tabak: yemek başına 0,5 mL).
- Karıştırmak için her yemeği hafifçe döndürün ve tüm yemekleri 37 °C, %5 CO2'dekuluçkaya yatırın.
- Transfeksiyondan sonra 2. Yemekleri 37 °C, %5 CO2 kuluçka makinesine yerleştirin.
- 3. günde, Ca2Cre-shp53'u ifade eden lentivirüsler içeren medyayı toplayın ve 0,45 μm filtrelerden filtreleyin. Taze antibiyotiksiz azaltılmış serum ortamı ile medya doldurmak.
NOT: Toplanan ortamlar en fazla 3 gün 4 °C'de tutulabilir. - 4. günde, lentivirus içeren ortamı ikinci kez toplayın ve 0,45 μm'lik bir filtreden filtre uygulayın. 4 °C'de (en fazla 3 gün) tutun.
- 1.1.8 ve 1.1.9 adımlarından virüs supernatants birleştirin. 4 °C'de 30 dk için 1.372 x g'de santrifüj süzgeç üniteleri(Malzeme Tablosu)ile yoğunlaştırın. Toplanan tüm ortam sütunlardan geçene kadar işlemi yineleyin.
NOT: Her santrifüjden sonra 100−200 μL konsantre filtrasyon hasat edilebilir. - Konsantre filtratları 15 mL buz gibi bir tüpte toplayın ve karıştırın. Konsantre lentivirüsleri iyice karıştırın ve sonra aliquot (örn. 100 μL/ tüp). -80 °C'de saklayın.
- Lentiviral titrasyon
NOT: Viral titrenin nicelleştirilmesi için bu protokolde yeşil floresan proteinin (GFP) loxP yanlı alelini ifade eden ölümsüzleştirilmiş fare embriyonik fibroblastlar (MEFs) kullanılmaktadır. Ancak, loxP-GFP alel içeren herhangi bir hücre hattı bu adım için uygun olmalıdır.- DMEM ile GFP loxP kanatlı alel ifade Kültür hücreleri, % 10 FBS ve% 1 kalem / strep 37 °C, 5% CO2.
- Plaka 2 x 105 hücreleri iki 50 mm kuyularda 6-well plaka.
NOT: Bir kuyunun hücreleri lentiviral enfeksiyon için, diğeri ise negatif kontrol olarak kullanılacaktır. - Ertesi gün, lentiviral enfeksiyon dan önce 2 mL DMEM, %10 FBS ve %1 kalem/strep 2 saat ile hücreleri yeniler.
- Lentiviral enfeksiyonda 20 μL'lik CA2Cre-shp53 lentivirus (gerektiğinde hacim değişebilir) ekleyin.
- Kültürde 3 gün sonra, Şekil 1'degösterildiği gibi, akış sitometrisi ile Cre'ye bağlı GFP-pozitif hücrelerin sıklığını belirleyin. Fosfat tamponlu salin (PBS) ile hücreleri yıkayın, trypsinizasyon ile ayırmak ve 112 x gsantrifüj ile hücreleri toplamak .
- Hücreleri PBS ile iki kez yıkayın. Son olarak, PBS 100 μL hücreleri askıya. GFP pozitif hücrelerinin bir hücre çözümleyicisi(Malzeme Tablosu) ile yüzdesini belirleyin.
- Aşağıdaki formülü kullanarak lentivirus enfeksiyöz /fonksiyonel titreyi hesaplayın:

F GFP-pozitif hücrelerin sıklığı ve enfeksiyon sonrası GFP -pozitif hücrelerin frekansı (Fi) bulaşmasının (Arka plan) öncesinde GFP-pozitif hücrelerin frekansından (arka plan) Şekil 1'de (F = Fi-Fc) gösterildiği gibi hesaplanırken, Cn kaplamalı hücre sayısıdır (2 x 105),V inoculumun hacmidir (mL), DF ise virüs seyreltme faktörüdür.
NOT: Enfeksiyöz/fonksiyonel konsantrasyon = ~2 x 106 TU/mL.
2. LSL-KRASG12D Farelerde Lentivirüslerin İntratrakeal Entübasyonu
NOT: Vandivort ve ark.9tarafından yayınlanan protokolde açıklandığı gibi intratrakeal entübasyon yöntemi kullanılmıştır. Bu protokolde, C57BL/6 arka plandaki LSL-KRASG12D fareler 6−8 haftalıkken kullanılmaktadır. Vandivort ve ark.9'daaçıklandığı gibi ev yapımı bir çalışma prosedürü kurulu kullanılmaktadır. Pano uygun bir çalışma alanında (yaklaşık 1 m2)deneycinin önünde konumlandırılır.
- 1 mL şırınganın pistonunu çıkararak ve şırıngaya 60 μL PBS yükleyerek bir spirometre hazırlayın.
- Şırınganın içine 22 G kateter ucu takın ve bir kenara koyun.
- Ketaminin (50 mg/mL)/xylazine (5 mg/mL)/asetpromazin (1 mg/mL) kokteylinin fare vücut ağırlığının 1 μL/g'lik intraperitoneal enjeksiyonu ile fareleri anestezik. Farenin düşük solunum hızıyla düzgün bir şekilde sedasyon alabilmesini sağlayın (her 2 s'de 1 nefes).
- Bir pipettor içine CA2Cre-shp53 lentivirus 20 μL aspire ve bir kenara koyun.
- Yatıştırıcı fareyi, üst kesici dişleri tahtanın ipine bağlayarak çalışma prosedürü panosuna yerleştirin.
NOT: Farenin dorsum platforma karşı düz olmalıdır. - İşlem sırasında farenin hizalanmasını sağlamak için torasik boşluğun kaudal kısmını platforma bantlayın.
- Bir kaz yakalı aydınlatıcıyı %80−100 yoğunlukta ayarlayın ve ışığı cilt yüzeyinden 1−2 cm yerleştirin.
- Platformun arkasından, steril forceps kullanarak farenin ağız boşluğundan dil çekin.
- Dili emniyete alırken, farenin ağız boşluğuna bir depresör yerleştirin ve dili bırakın.
- Nefes borusunu aydınlatmak için kaz yakasını ana kök bronşlarına yerleştirin.
NOT: Nefes borusu solunum eylemi ile görülebilir ve ışığın dalgalanmasına neden olabilir. - Trakea net bir şekilde görüntülendiğinde, hazırlanan spirometreyi (PBS ve kateter ile şırınga) trakeal yola yerleştirin.
- Depresörü çıkarın ve her nefeste şırıngadaki PBS'nin yükselişini ve düşüşünü gözlemleyin.
NOT: Bu kateterin nefes borusuna doğru konumlandırılmış olduğunun bir göstergesidir. - Önceki pozisyonda olduğu gibi trakea nın içindeki kateteri korurken PBS içeren şırıngayı çıkarın.
- 20 μL CA2Cre-shp53 lentivirüs kateterin ortasına yatırın.
- Kateteri yerinde tutarken, akciğerlerde lentivirüsün doğru dağılımını sağlamak için boş bir şırınga kullanarak katetere 300°L hava enjekte edin.
- Kateteri yerinde tutun ve spirometreyi katetere tekrar takın.
NOT: PBS balonunun yükselişi ve düşmesi işlemin başarılı olmasını sağlayacaktır. - Kateteri ve bandı çıkarın. Hayvanı canlanana kadar ılık ve kuru bir yere yerleştirin.
3. Farelerde Akciğer Tümörlerinin Ultrasonla Görüntülenmesi
NOT: Ultrason görüntüleme, 7 ve 18 haftalık lentiviral entübasyon dan sonra Malzeme Tablosu'ndalistelenen sistem kullanılarak gerçekleştirildi; ancak, herhangi bir model analiz için kullanılabilir.
- Görüntülemeden bir gün önce, entübe edilmiş farenin göğüs bölgesinden kürk çıkarın.
NOT: Fare bu adımda %3 izofluran ve 2L/dakika O2'likbir indüksiyon odasına yerleştirilerek uyutulmalıdır. - Görüntüleme gününde, Şekil 2'degösterildiği gibi çalışma alanını ayarlayın. Ultrason jeli ve sıcaklık monitörü için ısıtma pompasını açın.
- Fareleri görüntüleme sonrası yerleştirmek için 33 °C'lik sıcak bir kuluçka makinesi ayarlayın.
- Üç boyutlu (3D) motoru(Şekil 2F)entegre raylı sisteme yerleştirin.
- 3D motor ve transdüser montaj sisteminin güvenli bir şekilde yerleştirdiğinden emin olun.
- Tercih edilen bir dönüştürücü (frekans: 40 MHz; Şekil 2E ve Malzeme Tablosu) 3D motora dik tümör ölçümleri için.
- Ultrason yazılımı üzerinde yeni bir çalışma başlatın.
- Çalışma Tarayıcısı'nıseçin, ardından ekranın alt kısmında Yeni'yi seçin.
- Yeni Çalışmaseçin , çalışma hakkında daha fazla bilgi ek olarak bir Çalışma Adı eklenmesini sağlayan yeni bir pencere görünecektir, yani, çalışma tarihi, araştırmacı nın adı, vb.
- Seri Adı,yani, Hayvan Kimliği, Gerginlik, Ağırlık, Doğum Tarihi, vb. bilgileri doldurun.
- Bitti'yiseçin, program B modu için değişecektir.
- Hayvan platformu üzerinde uygun bir pozisyonda bir ısıtma lambası koyun.
- Fareyi indüksiyon odasına yerleştirin (%3.5 isoflurane).
NOT: Uygun anestezi farenin bilinçsizliği ve 2 saniyede yaklaşık 1 nefes yavaş solunum hızı ile doğrulanır. - Fare uyuşturulduğunda, anestezi makinesinin bağlantısını değiştirerek hayvan platformuna yönlendirilir, izofluranı %2,5'e düşürün.
- Fareyi dekübitus ventral'daki hayvan platformuna yerleştirin, oral boşluğu anestezi tüpüne doğru yönlendirilir.
- Farenin gözlerine yağ layıcı uygulayın.
- Fareyi decubitus dorsal'a yerleştirin ve ellerini ve ayaklarını hayvan platformuna sıkıca bantlayın.
- Fare göğsüne küçük bir ultrason jeli tabakası uygulayın.
- Fare göğsünün yüzeyine dokunmak için yükseklik kontrol tonunu kullanarak edinme sondasını düşürün. Sondayı farenin kalbinin yaklaşık ortalanmış olacak şekilde yerleştirin.
- Fare başına ideal olarak 500 kare toplayan enine yönde, her iki ekstremiteden tüm göğsün görüntülerini elde etmek için mikro tonlamaları kullanın (kare sayısı kişisel tercihe bağlı olarak değişebilir).
- Görüntüleme yapıldıktan sonra, farenin göğsünden jelçıkarın ve sıcak kuluçka makinesinde fare yerleştirin.
4. Ultrason Görüntülerinin 2D Analizi
- Ultrason yazılımı nda kazanılmış çerçeveleri açtıktan sonra, tümörler için çerçeveleri tarar.
- Küçük başlayan tümörler için, elde edilen 500 kare tam uzunluğu için periyodik olarak her 10 kare B-hatları sayısını saymak.
Bu nedenle, B-çizgileri toplam 50 görüntü sayılır, her görüntü 10 kare ile ayrılır. B-çizgileri, ekrana tam olarak geçen uzunlamasına beyaz düz çizgiler ile karakterizedir. - Büyük tümörlerin 2B ölçümleri için doğrusal aleti seçin ve mevcut tümörün genişliğini ve uzunluğunu ölçün.
- Tümörlerin hacmini hesaplamak için aşağıdaki formülü kullanın:
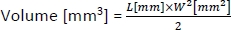
L ve W tümör uzunluğu ve genişliği, sırasıyla vardır.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
~2 x 106 TU/mL(Şekil 1)bir lentiviral enfeksiyöz titer elde edildikten sonra, LSL-KRAS G12D fareler uygun bir yaşa ulaştığında (6−8 hafta)9. Ultrason görüntüleme tümörlerin başlaması üzerine enfeksiyon 7 hafta sonra yapıldı(Şekil 3B). 8 haftalık enfeksiyon dan sonra Şekil 4 A'da gösterildiğigibi, LSL-KRASG12D
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Cre-indüklenebilir LSL-KRAS G12D fare modelinde akciğer tümörü büyümesini ultrason ile değerlendirebilen bir yöntem gösterdik. Bu yöntem farmakolojik inhibitörlerin akciğer tümörü büyümesi üzerindeki etkisini değerlendirmek için kullanılabilir. Aynı zamanda farklı genetik geçmişe sahip fareler arasında akciğer tümörü büyümesini karşılaştırmak için kullanılabilir. Bu tekniğin kullanılması özel hesaplama becerileri gerektirmez, ancak, yöntem farelerin farklı grupları karşıla?...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Biz lentiviral Ca2Cre-shp53 vektör için Dr I. Verma teşekkür ederiz. Çalışma, Kanada Sağlık Araştırmaları Enstitüleri'nden (CIHR MOP 137113) AEK'e yapılan fonlar tarafından desteklendi.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.45 μm Acrodisc Syringe Filters | Pall Corporation | PN 4614 | |
| 100-mm Cell Cultre Plate | CELLSTAR | 664 160 | |
| 6-well Cell Culture Plate | CELLSTAR | 657 160 | |
| Amicon Ultra - 15 Centrifugal Filter Units | Merck Millipore Ltd. | UFC910024 | |
| BD LSR-Fortessa | BD Biosciences | 649225B 3024 | |
| CA2Cre-shp53 lentiviral vector | From Dr. I Verma Laboratory | ||
| DMEM | Multicell | 319-005-CL | |
| FBS | Multicell | 80450 | |
| LSL-KRASG12D mouse | JAX Mice | 8179 | |
| MX550S; Centre Transmit: 40 MHz | FUJIFILM VisualSonics | 51070 | |
| OptiMEM | gibco | 11058-021 | |
| Pen/strep | Multicell | 450-201-EL | |
| pMD2.G | Addgene | 12259 | |
| PsPAX2 | Addgene | 12260 | |
| VEVO-3100 | FUJIFILM VisualSonics | 51072-50 |
Referanslar
- Eisenstein, M. Personalized medicine: Special treatment. Nature. 513, 8(2014).
- Karachaliou, N., et al. KRAS mutations in lung cancer. Clinical Lung Cancer. 14 (3), 205-214 (2013).
- Jackson, E. L., et al. Analysis of lung tumor initiation and progression using conditional expression of oncogenic K-ras. Genes & Development. 15 (24), 3243-3248 (2001).
- DuPage, M., Dooley, A. L., Jacks, T. Conditional mouse lung cancer models using adenoviral or lentiviral delivery of Cre recombinase. Nature Protocol. 4 (7), 1064-1072 (2009).
- Chen, J., Lecuona, E., Briva, A., Welch, L. C., Sznajder, J. I. Carbonic anhydrase II and alveolar fluid reabsorption during hypercapnia. American Journal of Respiratory Cell and Molecular Biology. 38 (1), 32-37 (2008).
- Xia, Y., et al. Reduced cell proliferation by IKK2 depletion in a mouse lung-cancer model. Nature Cell Biology. 17 (4), 532(2015).
- Demi, L., et al. Determination of a potential quantitative measure of the state of the lung using lung ultrasound spectroscopy. Scientific Reports. 7, 12746(2017).
- Mohanty, K., et al. Characterization of the Lung Parenchyma Using Ultrasound Multiple Scattering. Ultrasound in Medicine and Biology. 43, 993-1003 (2017).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771(2016).
- Saraogi, A. Lung ultrasound: Present and future. Lung India. 32 (3), 250-257 (2015).
- Gargani, L., Volpicelli, G. How I do it: lung ultrasound. Cardiovascular Ultrasound. 12, 25(2014).
- Soldati, G., et al. On the Physical Basis of Pulmonary Sonographic Interstitial Syndrome. Journal of Ultrasound in Medicine. 35 (10), 2975(2016).
- Raes, F., et al. High-Resolution Ultrasound and Photoacoustic Imaging of Orthotopic Lung Cancer in Mice: New Perspectives for Onco-Pharmacology. PLoS One. 11 (4), 15(2016).
- Lakshman, M., Needles, A. Screening and quantification of the tumor microenvironment with micro-ultrasound and photoacoustic imaging. Nature Methods. 12 (4), 372(2015).
- Chichra, A., Makaryus, M., Chaudhri, P., Narasimhan, M. Ultrasound for the Pulmonary Consultant. Clinical Medicine Insights: Circulatory Respiratory and Pulmonary Medicine. 10, 9(2016).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır