Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Détection de la progression des tumeurs pulmonaires chez les souris par imagerie par ultrasons
Dans cet article
Résumé
Ce protocole décrit les étapes prises pour induire des tumeurs pulmonaires de KRAS chez les souris aussi bien que la quantification des tumeurs formées par l’imagerie d’ultrason. Les petites tumeurs sont visualisées dans les premiers temps comme des lignes B. À des moments plus tard, des mesures relatives de volume de tumeur sont réalisées par l’outil de mesure dans le logiciel d’ultrason.
Résumé
Avec 1,6 million de victimes par an, le cancer du poumon contribue énormément au fardeau mondial du cancer. Le cancer du poumon est en partie entraîné par des altérations génétiques chez les oncogènes tels que l’oncogène KRAS, qui représente environ 25 % des cas de cancer du poumon. La difficulté de cibler thérapeutiquement le cancer du poumon à base de KRAS provient en partie d’avoir de mauvais modèles qui peuvent imiter la progression de la maladie en laboratoire. Nous décrivons une méthode qui permet la quantification relative des tumeurs pulmonaires primaires de KRAS dans un modèle de souris DeL-KRAS G12D cre-inductible par l’intermédiaire de l’imagerie par ultrasons. Cette méthode repose sur l’acquisition de la luminosité (B)-mode du parenchyme pulmonaire. Les tumeurs qui sont initialement formées dans ce modèle sont visualisées comme des lignes B et peuvent être quantifiées en comptant le nombre de lignes B présentes dans les images acquises. Ceux-ci représenteraient le nombre relatif de tumeur formé sur la surface du poumon de souris. Pendant que les tumeurs formées se développent avec le temps, elles sont perçues comme fissures profondes dans le parenchyme de poumon. Puisque la circonférence de la tumeur formée est bien définie, le calcul du volume relatif de tumeur est réalisé en mesurant la longueur et la largeur de la tumeur et en les appliquant dans la formule utilisée pour des mesures de calibrage de tumeur. L’imagerie par ultrasons est une technique non invasive, rapide et conviviale qui est souvent utilisée pour les quantifications tumorales chez la souris. Bien que des artefacts puissent apparaître lors de l’obtention d’images à ultrasons, il a été démontré que cette technique d’imagerie est plus avantageuse pour les quantifications tumorales chez la souris que pour d’autres techniques d’imagerie telles que l’imagerie par tomodensitométrie (TDM) et l’imagerie par bioluminescence (BLI). Les chercheurs peuvent étudier de nouvelles cibles thérapeutiques en utilisant cette technique en comparant l’initiation et la progression des tumeurs pulmonaires entre différents groupes de souris.
Introduction
En tant que principale cause de décès liés au cancer dans le monde, le cancer du poumon reste réfractaire aux traitements, principalement en raison de l’absence de modèles précliniques pertinents qui peuvent récapituler la maladie en laboratoire1. Environ 25% des cas de cancer du poumon sont dus à des mutations dans l’oncogène KRAS2. Le cancer du poumon kraS-conduit est souvent associé au pronostic pauvre et à la basse réponse au traitement, soulignant l’importance de plus amples études dans cette maladie2.
Nous avons optimisé une méthode qui permet l’évaluation relative de la croissance de tumeur de poumon en temps réel dans les souris immunisées-compétentes cancer-induites de KRAS de CANCER- Nous utilisons des souris Lox-Stop-Lox KRAS G12D (LSL-KRAS G12D) dans lesquelles l’oncogène KRAS G12D peut être exprimé par les vecteurs lentiviraux Cre3,4. Ces vecteurs sont entraînés par l’anhydrase carbonique 2, permettant à l’infection virale de se produire spécifiquement dans les cellules épithéliales alvéolaires5. En outre, pour accélérer l’initiation et la progression des tumeurs pulmonaires, la construction lentiviral exprime également P53 shRNA d’un promoteur U6/H1 (la construction lentiviral ici sera dénommée Ca2Cre-shp53)6. La pertinence biologique de cette méthode réside dans le cours naturel du développement de tumeur pulmonaire chez les souris par opposition aux xénogreffes des tumeurs non orthotopiques chez les souris. Un obstacle utilisant la méthode orthotopic surveille la croissance de tumeur de poumon sans sacrifier la souris. Pour surmonter cette limitation, nous avons optimisé l’imagerie par ultrasons pour permettre l’analyse de la progression des tumeurs pulmonaires en mode bidimensionnel (2D) dans ce modèle de souris. Les tumeurs initiatrices à 7 semaines après l’infection sont reflétées comme B-lignes dans les images d’ultrason, qui peuvent être comptées, mais ne refléteront pas le nombre exact de tumeurs présentes sur le poumon. Les lignes B sont caractérisées par des lignes blanches verticales de laser provenant de la ligne pleurale dans le parenchyme pulmonaire7,8. Les grandes tumeurs peuvent être visualisées après 18 semaines d’infection. Le volume relatif de ces tumeurs est quantifié par des mesures 2D faites sur l’ultrason.
Cette méthode est optimale pour les chercheurs qui étudient l’effet des médicaments pharmacologiques sur la croissance des tumeurs pulmonaires dans le modèle de souris LSL-KRAS G12D. En outre, la progression de tumeur de poumon peut être comparée entre les souris avec différentes lignées génétiques, pour examiner l’importance de la présence ou de l’absence de certains gènes/protéines sur le développement du volume de tumeur de poumon.
Protocole
Les études sur les animaux ont été réalisées conformément au Comité institutionnel de soins et d’utilisation des animaux (CCIO) de l’Université McGill et les procédures ont été approuvées par le Comité du bien-être animal de l’Université McGill (protocole d’utilisation des animaux no 2009-5754).
1. Génération de CA2Cre-shp53 Titre lentiviral
REMARQUE: Le protocole suivant est le même que celui décrit dans Xia et al.6, avec des modifications mineures.
- Préparation du lentivirus (pour 15 cm x 10 cm plats)
- Le jour 1, plaque zona les cellules HEK293T saines (7,5 x 106 cellules par plat de 10 cm) avec 10 ml du milieu Eagle modifié de Dulbecco (DMEM), 10 % de sérum bovin fœtal (SFB) et 1 % de stylo/streptocoque. Culture dans un incubateur de CO2 à 37 oC et 5 %.
- Préparer le mélange pour la transfection calcium-phosphate (mélange pour 15 plaques). Préparer le tube A contenant 225 g (15 g/plaque) du vecteur lentiviral (Ca2Cre-shp53), 75 g (5 g/plaque) de plasmide PsPAX2 (contenant des gènes HIV-1 gag et HIV-1 pol), 75 g (5 g/plaque) de plasmique spLD (contenant du gène VSV-G) pour l’emballage, une concentration finale de 0,15 M de CaCl2 et remplir le tube de H2O distillé jusqu’à 3,75 ml. Préparer le tube B contenant 3,75 ml de 2x hePES-tamponné saline (HBS; 50 mM HEPES, pH 7.05, 280 mM NaCl, 10 mM KCl, 1.5 mM Na2HPO4'2H2O, et 12 mM D-dextrose).
- Vortex tube A et l’ajouter dans le sens déroulant au tube B sous le vortex continu.
REMARQUE : Le volume total sera de 7,5 ml. - Incuber à température ambiante dans l’obscurité pendant 20 à 30 min.
- Environ 9 h après le placage des cellules, ajouter 500 l du mélange de transfection dans le milieu cellulaire (7,5 mL/15 plats : 0,5 ml par plat).
- Faire tourbillonner doucement chaque plat pour mélanger, et couver tous les plats à 37 oC, 5% CO2.
- Le jour 2, 12 à 18 h après la transfection, remplacez les médias par 10 ml de sérirum réduit sans antibiotiques (Tableau des matériaux) par plat de 10 cm. Remettre la vaisselle dans l’incubateur de CO2 à 37 oC et 5 %.
- Le jour 3, collectez les supports contenant des lentivirus exprimant Ca2Cre-shp53 et filtrez à travers des filtres de 0,45 m. Réapprovisionnez les médias avec des supports sériques réduits sans antibiotiques frais.
REMARQUE : Les supports collectés peuvent être conservés à 4 oC pendant au plus 3 jours. - Le jour 4, collectez, pour la deuxième fois, le support contenant le lentivirus et filtrez à travers un filtre de 0,45 m. Conserver à 4 oC (pour une température ne pas plus de 3 jours).
- Combinez les supernatants de virus à partir des étapes 1.1.8 et 1.1.9. Concentrez-les à travers des unités de filtre centrifuges(Tableau des matériaux)en centrifugeant à 1 372 x g pendant 30 min à 4 oC. Répétez le processus jusqu’à ce que tous les supports collectés soient passés dans les colonnes.
REMARQUE : Après chaque centrifugation, 100 à 200 l de filtrate concentré peuvent être récoltés. - Recueillir et mélanger les filtrates concentrés dans un tube glace de 15 ml. Bien mélanger les lentivirus concentrés, puis aliquot (p. ex., 100 l/tube). Conserver à -80 oC.
- Titration lentivirale
REMARQUE : Des fibroblastes embryonnaires immortalisés de souris (MEF) exprimant un allèle loxP-flanked de protéine fluorescente verte (GFP) sont employés dans ce protocole pour la quantification du titer viral. Cependant, n’importe quelle ligne de cellule avec un allele de loxP-GFP devrait être appropriée pour cette étape.- Cellules de culture exprimant un allele loxP-flanked de GFP avec DMEM, 10% FBS et 1% stylo/strep torat à 37 oC, 5% CO2.
- Plaque 2 x 105 cellules dans deux puits de 50 mm d’une plaque de 6 puits.
REMARQUE : Les cellules d’un puits seront utilisées pour l’infection lentivirale tandis que celle de l’autre sera utilisée comme contrôle négatif. - Le lendemain, réapprovisionnez les cellules avec 2 ml de DMEM, 10% FBS, et 1% stylo/streptocoque 2 h avant l’infection lentivirale.
- Ajouter 20 ll du lentivirus CA2Cre-shp53 (le volume peut varier au besoin) dans l’infection lentivirale bien.
- Après 3 jours de culture, déterminez la fréquence des cellules GFP-positives induites par la Cre par cytométrie d’écoulement, comme indiqué dans la figure 1. Laver les cellules avec de la saline tamponnée par le phosphate (PBS), détacher par trypsinisation et recueillir les cellules par centrifugation à 112 x g.
- Laver les cellules deux fois avec du PBS. Enfin, suspendez les cellules dans 100 'L de PBS. Déterminer le pourcentage de cellules positives GFP par un analyseur de cellules (Tableau des matériaux).
- Calculez le téter infectieux/fonctionnel de lentivirus en utilisant la formule suivante :

où F est la fréquence des cellules GFP-positives et calculée en soustrayant la fréquence des cellules GFP-positives après l’infection (Fi) de la fréquence des cellules GFP-positives (arrière-plan) avant l’infection (Fc) comme indiqué dans la figure 1 (F - Fi-Fc), Cn est le nombre de cellules plaquées (2 x 105), V est le volume de l’inoculum (mL), et DF est le facteur de dilution du virus.
REMARQUE : La concentration infectieuse/fonctionnelle est de 2 x 106 TU/mL.
2. Intubation intratrachéale des lentivirus chez les souris LSL-KRASG12D
REMARQUE : La méthode d’intubation intratrachéale a été utilisée comme décrit dans le protocole publié par Vandivort et autres9. Dans ce protocole, les souris LSL-KRASG12D souris dans C57BL/6 fond sont utilisés à l’âge de 6 à 8 semaines. Un tableau de procédure de travail fait maison est utilisé comme décrit dans Vandivort et al.9. Le tableau est placé devant l’expérimentateur dans un espace de travail pratique (environ 1 m2).
- Préparer un spiromètre en enlevant le piston d’une seringue de 1 ml et en chargeant 60 ll de PBS dans la seringue.
- Fixer une pointe de cathéter de 22 G dans la seringue et réserver.
- Anesthésier les souris par injection intrapéritonéale d’un cocktail de 1 l/g de poids corporel de la souris de la kétamine (50 mg/mL)/xylazine (5 mg/mL)/acepromazine (1 mg/mL). Assurer une sédation adéquate de la souris par un faible taux respiratoire (1 respiration tous les 2 s).
- Aspirez 20 l de lentivirus CA2Cre-shp53 dans un pipettor et réservez.
- Placez la souris sous sédatif sur le tableau de procédure de travail en accrochant ses incisifs supérieurs dans le fil de la planche.
REMARQUE : Le dorsum de la souris doit être plat contre la plate-forme. - Tapez la partie caudale de la cavité thoracique sur la plate-forme pour assurer l’alignement de la souris pendant la procédure.
- Ajuster un enlumineur à col de chair de poule entre 80 et 100 % d’intensité et placer la lumière à 1 2 cm de la surface de la peau.
- De derrière la plate-forme, tirer la langue hors de la cavité buccale de la souris à l’aide de forceps stériles.
- Tout en fixant la langue, insérez un dépresseur dans la cavité buccale de la souris, puis relâchez la langue.
- Placez le gooseneck sur les bronches de la tige principale pour éclairer la trachée.
REMARQUE : La trachée peut être visible par l’action de la respiration, causant la fluctuation de la lumière. - Lorsque la trachée est clairement vue, insérez le spiromètre préparé (seringue avec PBS et cathéter) dans le chemin trachéal.
- Retirez le dépresseur et observez la montée et la chute de PBS dans la seringue à chaque respiration.
REMARQUE : Il s’agit d’un indicateur indiquant que le cathéter est correctement positionné dans la trachée. - Retirez la seringue contenant du PBS tout en maintenant le cathéter à l’intérieur de la trachée comme position précédente.
- Déposez le lentivirus CA2Cre-shp53 de 20 L au centre du cathéter.
- Tout en maintenant le cathéter en place, injectez 300 L d’air dans le cathéter à l’aide d’une seringue vide pour assurer une bonne distribution du lentivirus dans les poumons.
- Maintenez le cathéter en place et réinsérez le spiromètre dans le cathéter.
REMARQUE : L’élévation et la chute de la bulle PBS assureront le succès de la procédure. - Retirer le cathéter et le ruban adhésif. Placer l’animal dans un endroit chaud et sec jusqu’à ce qu’il soit relancé.
3. Imagerie par ultrasons des tumeurs pulmonaires chez les souris
REMARQUE : L’imagerie par ultrasons a été réalisée après 7 et 18 semaines d’intubation lentivirale à l’aide du système énuméré dans le Tableau des matériaux; cependant, n’importe quel modèle peut être utilisé pour l’analyse.
- Un jour avant l’imagerie, retirez la fourrure de la poitrine de la souris intubée.
REMARQUE: La souris doit être sédative au cours de cette étape en les plaçant dans une chambre d’induction de 3% isoflurane et 2L/minute O2. - Le jour de l’imagerie, configurez l’espace de travail comme le montre la figure 2. Allumez la pompe chauffante pour le gel à ultrasons et le moniteur de température.
- Mettre en place un incubateur chaud de 33 oC pour placer les souris en post-imagerie.
- Placez le moteur tridimensionnel (3D)(figure 2F) sur le système ferroviaire intégré.
- Assurez-vous que le moteur 3D et le système de montage transducteur sont en place en toute sécurité.
- Connectez un transducteur préféré (fréquence : 40 MHz ; Figure 2E et Tableau des matériaux) pour les mesures tumorales perpendiculaires au moteur 3D.
- Démarrer une nouvelle étude sur le logiciel d’échographie.
- Sélectionnez Navigateur d’étude, puis sélectionnez Nouveau en bas de l’écran.
- Sélectionnez Nouvelle étude, une nouvelle fenêtre apparaîtra qui permet l’ajout d’un nom d’étude en plus de plus d’informations sur l’étude, c’est-à-dire la date de l’étude, le nom du chercheur, etc.
- Remplissez l’information dans le nom de la série,c.-à-d. l’iD animal, la souche, le poids, la date de naissance, etc.
- Sélectionnez Done, le programme changera pour le mode B.
- Placez une lampe chauffante dans une position pratique au-dessus de la plate-forme animale.
- Placez la souris dans la chambre d’induction (3,5% isoflurane).
REMARQUE : L’anesthésiation appropriée est confirmée par l’inconscience de la souris, et le taux respiratoire plus lent d’environ 1 souffle par 2 secondes. - Lorsque la souris est sous sédatif, changer la connexion de la machine anesthésique à diriger vers la plate-forme animale, réduire l’isoflurane à 2,5%.
- Placez la souris sur la plate-forme animale en decubitus ventral, avec sa cavité buccale dirigée vers le tube anesthésique.
- Appliquer du lubrifiant sur les yeux de la souris.
- Placez la souris dans le dorsal decubitus et collez ses mains et ses pieds fermement sur la plate-forme animale.
- Appliquer une petite couche de gel à ultrasons sur le coffre de la souris.
- Abaissez la sonde d’acquisition à l’aide du bouton de commande de hauteur pour toucher la surface de la poitrine de la souris. Placez la sonde de telle sorte que le cœur de la souris soit approximativement centré.
- Utilisez les micro-boutons pour acquérir des images de tout le coffre, des deux extrémités, dans l’orientation transversale idéalement la collecte de 500 images par souris (le nombre d’images peut varier en fonction du choix personnel).
- Une fois l’imagerie terminée, retirer le gel de la poitrine de la souris et placer la souris dans l’incubateur chaud.
4. Analyse 2D des images échographiques
- Après l’ouverture des cadres acquis sur le logiciel d’ultrason, scannez les cadres pour les tumeurs.
- Pour les petites tumeurs initiatrices, comptez périodiquement le nombre de lignes B toutes les 10 images pour toute la longueur des 500 images acquises.
Par conséquent, les lignes B sont comptées dans un total de 50 images, chaque image est séparée par 10 images. Les lignes B sont caractérisées par des lignes droites blanches longitudinales traversant entièrement l’écran. - Pour les mesures 2D des grandes tumeurs, sélectionnez l’outil linéaire et mesurez la largeur et la longueur de la tumeur présente.
- Pour calculer le volume des tumeurs, utilisez la formule suivante :
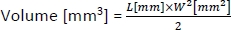
où L et W sont la longueur et la largeur de la tumeur, respectivement.
Résultats
Après l’obtention d’un taquet infectieux lentiviral de 2 x 106 TU/mL (figure 1), le lentivirus Ca2Cre-shp53 a été injecté par voie intratrachéque lorsque les souris LSL-KRAS G12D ont atteint un âge approprié (6 à 8 semaines)9. L’imagerie par ultrasons a été réalisée après 7 semaines d’infection lors de l’initiation des tumeurs (Figure 3B). L’imagerie a été faite à 7 semaines afin d?...
Discussion
Nous démontrons une méthode qui peut évaluer la croissance de tumeur de poumon dans le modèle de souris de LSL-KRAS G12D de Cre-inductible par ultrason. Cette méthode peut être utilisée pour évaluer l’effet des inhibiteurs pharmacologiques sur la croissance des tumeurs pulmonaires. Il peut également être utilisé pour comparer la croissance des tumeurs pulmonaires entre les souris de différents milieux génétiques. L’utilisation de cette technique ne nécessite pas de compétences informatiques spécialis...
Déclarations de divulgation
Les auteurs n’ont rien à révéler.
Remerciements
Nous remercions le Dr I. Verma pour le vecteur lentiviral Ca2Cre-shp53. Les travaux ont été appuyés par des fonds des Instituts de recherche en santé du Canada (BSI13) à l’AEK.
matériels
| Name | Company | Catalog Number | Comments |
| 0.45 μm Acrodisc Syringe Filters | Pall Corporation | PN 4614 | |
| 100-mm Cell Cultre Plate | CELLSTAR | 664 160 | |
| 6-well Cell Culture Plate | CELLSTAR | 657 160 | |
| Amicon Ultra - 15 Centrifugal Filter Units | Merck Millipore Ltd. | UFC910024 | |
| BD LSR-Fortessa | BD Biosciences | 649225B 3024 | |
| CA2Cre-shp53 lentiviral vector | From Dr. I Verma Laboratory | ||
| DMEM | Multicell | 319-005-CL | |
| FBS | Multicell | 80450 | |
| LSL-KRASG12D mouse | JAX Mice | 8179 | |
| MX550S; Centre Transmit: 40 MHz | FUJIFILM VisualSonics | 51070 | |
| OptiMEM | gibco | 11058-021 | |
| Pen/strep | Multicell | 450-201-EL | |
| pMD2.G | Addgene | 12259 | |
| PsPAX2 | Addgene | 12260 | |
| VEVO-3100 | FUJIFILM VisualSonics | 51072-50 |
Références
- Eisenstein, M. Personalized medicine: Special treatment. Nature. 513, 8 (2014).
- Karachaliou, N., et al. KRAS mutations in lung cancer. Clinical Lung Cancer. 14 (3), 205-214 (2013).
- Jackson, E. L., et al. Analysis of lung tumor initiation and progression using conditional expression of oncogenic K-ras. Genes & Development. 15 (24), 3243-3248 (2001).
- DuPage, M., Dooley, A. L., Jacks, T. Conditional mouse lung cancer models using adenoviral or lentiviral delivery of Cre recombinase. Nature Protocol. 4 (7), 1064-1072 (2009).
- Chen, J., Lecuona, E., Briva, A., Welch, L. C., Sznajder, J. I. Carbonic anhydrase II and alveolar fluid reabsorption during hypercapnia. American Journal of Respiratory Cell and Molecular Biology. 38 (1), 32-37 (2008).
- Xia, Y., et al. Reduced cell proliferation by IKK2 depletion in a mouse lung-cancer model. Nature Cell Biology. 17 (4), 532 (2015).
- Demi, L., et al. Determination of a potential quantitative measure of the state of the lung using lung ultrasound spectroscopy. Scientific Reports. 7, 12746 (2017).
- Mohanty, K., et al. Characterization of the Lung Parenchyma Using Ultrasound Multiple Scattering. Ultrasound in Medicine and Biology. 43, 993-1003 (2017).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771 (2016).
- Saraogi, A. Lung ultrasound: Present and future. Lung India. 32 (3), 250-257 (2015).
- Gargani, L., Volpicelli, G. How I do it: lung ultrasound. Cardiovascular Ultrasound. 12, 25 (2014).
- Soldati, G., et al. On the Physical Basis of Pulmonary Sonographic Interstitial Syndrome. Journal of Ultrasound in Medicine. 35 (10), 2975 (2016).
- Raes, F., et al. High-Resolution Ultrasound and Photoacoustic Imaging of Orthotopic Lung Cancer in Mice: New Perspectives for Onco-Pharmacology. PLoS One. 11 (4), 15 (2016).
- Lakshman, M., Needles, A. Screening and quantification of the tumor microenvironment with micro-ultrasound and photoacoustic imaging. Nature Methods. 12 (4), 372 (2015).
- Chichra, A., Makaryus, M., Chaudhri, P., Narasimhan, M. Ultrasound for the Pulmonary Consultant. Clinical Medicine Insights: Circulatory Respiratory and Pulmonary Medicine. 10, 9 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon