A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זיהוי של התקדמות הגידול ריאה בעכברים על ידי הדמיה אולטרסאונד
In This Article
Summary
פרוטוקול זה מתאר את השלבים שננקטו כדי לגרום לגידולים קראס ריאות בעכברים, כמו גם כימות של גידולים שנוצרו על ידי הדמיה אולטרסאונד. גידולים קטנים הם דמיינו בזמן מוקדם נקודות כמו B-קווים. בנקודות זמן מאוחרות יותר, המידות היחסיות של נפח הגידול מושגת על ידי כלי המדידה בתוכנת האולטרסאונד.
Abstract
עם ~ 1,600,000 קורבנות בשנה, סרטן ריאות תורם מאוד את הנטל העולמי של סרטן. סרטן ריאות הוא מונע בחלקו על ידי שינויים גנטיים אונגנים כגון אונקראס גן, אשר מהווה ~ 25% ממקרי סרטן ריאות. הקושי של מיקוד רפואי קראס מונחה סרטן הריאות בחלקו נובע בעל מודלים עניים שיכולים לחקות את ההתקדמות של המחלה במעבדה. אנו מתארים שיטה המאפשרת את הקוונפיקציה היחסית של גידולים קראס ריאה הראשי ב-inducible LSL-קראס G12D מודל העכבר באמצעות הדמיה אולטרסאונד. שיטה זו מסתמכת על בהירות (ב)-רכישת מצב של הריאה בתוך כימומה. גידולים שנוצרו בתחילה במודל זה הם דמיינו כמו B-lines ניתן לכמת על ידי ספירת מספר ה-B-lines הנמצאים תמונות שנרכשו. אלה ייצגו את מספר הגידול היחסי שנוצר על פני השטח של ריאה העכבר. כמו גידולים שנוצרו להתפתח עם הזמן, הם נתפסים כמו בתרי עמוק בתוך הריאה מבכיצ'ימה. מאז היקף הגידול נוצר הוא מוגדר היטב, חישוב נפח הגידול היחסי מושגת על ידי מדידת האורך והרוחב של הגידול ויישום אותם בנוסחה המשמשת עבור מדידות הגידול קליבר. הדמיה אולטרסאונד היא טכניקה לא פולשנית, מהיר וידידותי למשתמש המשמש לעתים קרובות עבור כימות הגידול בעכברים. למרות שפריטים מסוימים עשויים להופיע בעת קבלת תמונות אולטרסאונד, זה הוכח כי טכניקה זו הדמיה היא יתרון יותר עבור כימות הגידול בעכברים לעומת טכניקות דימות אחרות כגון טומוגרפיה ממוחשבת (CT) הדמיה הדמיה ביולומינסנציה (בלי). חוקרים יכולים לחקור מטרות טיפוליות הרומן באמצעות טכניקה זו על ידי השוואת ייזום הגידול ריאות התקדמות בין קבוצות שונות של עכברים.
Introduction
כמו הגורם המוביל של מקרי מוות הקשורים לסרטן ברחבי העולם, סרטן הריאות נשאר עקשן לטיפולים, בעיקר בשל חוסר מודלים רלוונטיים טרום קליניים שיכולים ללכוד את המחלה במעבדה1. סביב 25% ממקרי סרטן הריאות הם בשל מוטציות ב-קראס אונגן2. סרטן ריאות מונחה קראס משויך לעתים קרובות עם פרוגנוזה גרועה תגובה נמוכה לטיפול, הדגשת החשיבות של מחקרים נוספים במחלה זו2.
אנו אופטימיזציה שיטה המאפשרת את ההערכה היחסית של גידול בריאות הגידול בזמן אמת ב-קראס סרטן ריאות המושרה עכברים המוסמכים. אנו משתמשים ב-לקס-Stop-קראס G12D (lsl-קראס G12D) עכברים שבהם הקראס G12D אונגן ניתן לבטא על ידי וקטורים מבוססי ויראלי3,4. וקטורים אלה מונעים על ידי הידרלאוס 2, המאפשר זיהום נגיפי להתקיים במיוחד מכתשיים תאים אפיתל5. בנוסף, כדי להאיץ את החניכה ואת ההתקדמות של גידולים בריאה, המבנה לויראלי מבטא גם P53 רין מיזם U6/H1 (המבנה הננגיפי להלן יהיה מכונה Ca2Cre-shp53)6. הרלוונטיות הביולוגית של שיטה זו טמונה בקורס הטבעי של התפתחות הגידול בריאות בעכברים בניגוד ל-xenografts של גידולים שאינם אורתודעיים בעכברים. מכשול באמצעות שיטת אורתוטופית מפקחת על גידול הגידול בריאות מבלי להקריב את העכבר. כדי להתגבר על מגבלה זו, אנו אופטימיזציה הדמיה אולטרסאונד כדי לאפשר ניתוח של התקדמות הגידול בריאות במצב דו מימדי (2D) במודל העכבר הזה. התחלת גידולים ב 7 שבועות לאחר ההדבקה משתקפים כמו B-lines בתמונות אולטרסאונד, אשר ניתן לספור, אבל לא ישקף את המספר המדויק של גידולים הנמצאים על הריאה. הקווים הלבנים מאופיינים בקווים אנכיים לבנים, הנובעים מהקו הפלאורלי בתוך הריאה,8. גידולים גדולים ניתן לדמיין לאחר 18 שבועות של זיהום. הנפח היחסי של גידולים אלה הוא כימות על ידי מדידות 2D שנעשו באולטרסאונד.
שיטה זו היא אופטימלית עבור החוקרים לחקור את ההשפעה של תרופות תרופתי על גידול הגידול בריאות במודל העכבר LSL-קראס G12D. בנוסף, התקדמות הגידול בריאות ניתן להשוות בין עכברים עם לשונות גנטית שונים, כדי לבחון את החשיבות של נוכחות או העדר של גנים מסוימים/חלבונים על פיתוח נפח הגידול בריאות.
Protocol
מחקרים בעלי חיים נערכו בהתאם לטיפול בעלי חיים מוסדיים והוועדה השתמש (IACUC) של אוניברסיטת מקגיל והליכים אושרו על ידי ועדת הרווחה בעלי החיים של אוניברסיטת מקגיל (השימוש בעלי חיים פרוטוקול 2009-5754).
1. הדור של CA2Cre-shp53 לנטינגירה
הערה: הפרוטוקול הבא זהה לזה שמתואר בשיה ואח '6, עם שינויים קלים.
- הכנת הנגיף (בעבור 15 ס"מ x 10 ס"מ מנות)
- ביום 1, צלחת HEK293T תאים בריאים (7.5 x 106 תאים לכל 10 ס"מ צלחת) עם 10 מ ל של מדיום שונה של Dulbecco של הנשר (dmem), 10% סרום של שור עוברי (fbs), ו 1% עט/דלקת. תרבות ב37 ° c, 5% חממה2 .
- הכינו את תערובת הסידן-פוספט (תערובת ל -15 צלחות). הכנת צינור A המכיל 225 μg (15 μg/צלחת) של וקטור לויראלי (Ca2Cre-shp53), 75 μg (5 μg/צלחת) של PsPAX2 פלמיד (המכיל HIV-1 מחסום ואיידס-1 פול גנים), 75 μg (5 μg/צלחת) של pMD2. G פלמיד (המכיל את גן VSV-G) לאריזה, ריכוז סופי של 0.15 M של CaCl2 ולמלא את הצינור עם H מזוקקים2O עד 3.75 mL. הכנת צינור B המכיל 3.75 mL של מלוחים 2x המלח באגירה (HBS; 50 mM HEPES, pH 7.05, 280 mM הנאל, 10 מ"מ KCl, 1.5 mM Na2hbs4· 2x2O, ו 12 מ"מ D-דקסטרוז).
- שפופרת וורטקס A ולהוסיף אותו dropwise כדי צינור B תחת vortexing רציפה.
הערה: אמצעי האחסון הכולל יהיה 7.5 mL. - מודקון בטמפרטורת החדר בחשכה עבור 20-30 דקות.
- כ 9 שעות לאחר ציפוי התאים, להוסיף 500 μL של התערובת הגלגול הופך לתוך המדיום התא (7.5 mL/15 מנות: 0.5 mL לכל מנה).
- מערבולת בעדינות כל צלחת לערבב, ו מודחת כל הכלים ב 37 ° c, 5% CO2.
- ביום 2, 12 על 18 לאחר החצייה, החליפו את המדיה עם 10 מ ל של מדיה סרום מופחת ללא אנטיביוטיקה (טבלת חומרים) לכל 10 ס מ. מניחים מנות בחזרה 37 ° c, 5% חממה2 .
- ביום 3, לאסוף את המדיה המכילה וירוסים המבטא Ca2Cre-shp53 ולסנן דרך מסננים 0.45 יקרומטר. מלאו את התקשורת עם מדיה טרייה מופחתת בנסיוב אנטיביוטי ללא אנטיביוטיקה.
הערה: ניתן לשמור את המדיה שנאספה ב-4 ° צ' במשך לא יותר מ -3 ימים. - ביום 4, לאסוף, בפעם השנייה, את התקשורת המכילה את הווירוס ולסנן באמצעות מסנן 0.45 יקרומטר. שמרו על 4 ° צ' (לא יותר מ -3 ימים).
- לשלב את הנגיף supernatants משלבים 1.1.8 ו 1.1.9. רכזו אותם באמצעות יחידות סינון צנטריפוגליים (טבלת חומרים) על-ידי תפרידו ב-1,372 x g עבור 30 דקות ב-4 ° c. חזור על התהליך עד שכל אמצעי האחסון שנאספו עברו את העמודות.
הערה: לאחר כל צנטריפוגה, 100-200 μl של פילטרט מרוכזת ניתן לקצור. - לאסוף ולערבב את filtrates מרוכז ב 15 מ"ל צינור קרח קר. לערבב את מרוכז וירוסים היטב ולאחר מכן סדרת מחלקים (למשל, 100 μl/שפופרת). חנות ב-80 ° c.
- טיטור לנטינגיציה
הערה: באמצעות פרוטוקול זה לקוונפיקציה של הנגיף הנגיפי (GFP), משתמשים בפרוטומה של חלבון פלורסנט ירוק. עם זאת, כל קו תא עם loxp-gfp אלל צריך להיות מתאים לשלב זה.- תאי התרבות המבטאים את החברה הראשונה של GFP עם DMEM, 10% FBS ו 1% עט/דלקת ב 37 ° c, 5% CO2.
- צלחת 2 x 105 תאים ב 2 50 מ"מ בארות של 6-היטב צלחת.
הערה: התאים של הבאר האחת ישמשו לזיהום ויראלי בעוד זה של האחר ישמש כפקד שלילי. - למחרת, לחדש את התאים עם 2 מ ל של DMEM, 10% FBS, ו 1% עט/דלקת 2 h לפני זיהום ויראלי.
- הוסף 20 μL של CA2Cre-shp53 הנגיף (הנפח עשוי להשתנות בעת הצורך) בזיהום היטב לזיהומים.
- לאחר 3 ימים בתרבות, לקבוע את התדירות של תאים GFP-חיוביים המושרה על ידי הזרמת cy, כפי שמוצג באיור 1. רוחצים את התאים עם תמיסת מלח מוזרמת פוספט (PBS), מתנתק על ידי טריסיזציה ולאסוף תאים על ידי צנטריפוגה ב 112 x g.
- רחץ את התאים פעמיים באמצעות הערוץ הPBS. לבסוף, להשעות את התאים ב 100 μL של PBS. קבע את אחוז התאים החיוביים של GFP על-ידי מנתח תאים (טבלת חומרים).
- לחשב את הנגיף הזיהומיות/פונקציונלי המדבק באמצעות הנוסחה הבאה:

כאשר F הוא תדירות של תאים GFP-חיוביים מחושב על ידי הפחתת תדירות של התאים GFP-חיוביים לאחר זיהום (Fi) מן התדר של תאים GFP-חיוביים (רקע) לפני זיהום (Fc) כפי שמוצג באיור 1 (F = Fi-Fc), Cn הוא מספר התאים המשורכים (2 x 105), V הוא הנפח של האירשת (mL), ו-DF הוא גורם דילול הווירוס.
הערה: ריכוז זיהומיות/פונקציונלי = ~ 2 x 106 TU/mL.
2. צנרור בלתי מנווירוסים ב-LSL-קראסG12D עכברים
הערה: השיטה של צנרור intratracheal שימש כמתואר בפרוטוקול שפורסם על ידי Vandivort ואח '9. בפרוטוקול זה, עכברים LSL-קראסG12D עכברים ברקע C57BL/6 משמשים בגיל 6 או 8 שבועות. לוח הליכי עבודה מתוצרת בית משמש כמתואר בוונדיבורט ואח '9. מועצת המנהלים ממוקמת מול הנסבית בסביבת עבודה נוחה (כ 1 מ'2).
- הכן ספירומטרים על ידי הסרת הבוכנה של מזרק 1 מ"ל וטעינת 60 μL של PBS לתוך המזרק.
- הצמד את טיפ הצנתר 22 G לתוך המזרק והגדר בצד.
- הרדים העכברים על ידי הזרקת הצפק של 1 μL/g של משקל גוף העכבר של קטמין (50 mg/mL)/xylazine (5 מ"ג/mL)/אספרומאזין (1 מ"ג/mL) קוקטייל. להבטיח הרגעה נאותה של העכבר על ידי שיעור נשימה נמוך (1 נשימה כל 2 s).
- מנושף 20 μL של CA2Cre-shp53 הנגיף לתוך פיפטורים ולהגדיר בצד.
- הצב את העכבר מסומם על לוח השגרה העבודה על ידי הזנות חותכות העליון שלה לתוך החוט של הלוח.
הערה: הדורסום של העכבר צריך להיות שטוח נגד הפלטפורמה. - הקלטת את החלק caudal של חלל החזה לפלטפורמה כדי להבטיח יישור של העכבר במהלך ההליך.
- התאימו את מואר הגוסנאק בין 80 ל-100% והניחו את האור 1-2 ס מ ממשטח העור.
- מאחורי הפלטפורמה, לצייר את הלשון מתוך חלל הפה של העכבר באמצעות מלקחיים סטרילי.
- בזמן אבטחת הלשון, הכנס מדכא או לתוך חלל הפה של העכבר ואז לשחרר את הלשון.
- מקמו את הגוסנאק על ברונזה הגבעול הראשי כדי להאיר את קנה הנשימה.
הערה: קנה הנשימה עשוי להיות גלוי דרך פעולת הנשימה, גרימת תנודות של האור. - כאשר קנה הנשימה מוצג בבירור, הכנס את הספילומטר המוכן (מזרק עם PBS ו קטטר) לתוך השביל אל הקנה.
- הסר את הדיכאון או התבונן בעלייתה ונפילתה של ה-PBS במזרק עם כל נשימה.
הערה: זהו מחוון כי הצנתר ממוקם כראוי לתוך קנה הנשימה. - הסר את המזרק המכיל את ה-PBS תוך שמירה על הקטטר שבתוך קנה הנשימה כמיקום הקודם.
- הפקדה את 20 μL CA2Cre-shp53 וירוס לתוך מרכז הקטטר.
- בעוד שמירה על הקטטר במקום, להזריק 300 μL של האוויר לתוך הקטטר באמצעות מזרק ריק כדי להבטיח הפצה נכונה של הנגיף לראות את הריאות.
- השאר את הקטטר במקום והכנס את הספימטר לתוך הצנתר.
הערה: עליית ונפילתה של בועת ה-PBS תבטיח כי ההליך מוצלח. - . הסר את הצנתר והקלטת מניחים את החיה במקום חמים ויבש עד שהיא קמה לתחייה.
3. אולטרסאונד הדמיה של גידולים בריאות בעכברים
הערה: הדמיה אולטרסאונד בוצעה לאחר 7 ו -18 שבועות של צנרור ויראלי באמצעות המערכת המופיעה בטבלת חומרים; עם זאת, ניתן להשתמש בכל דגם עבור הניתוח.
- יום אחד לפני הדמיה, להסיר פרווה מאזור החזה של העכבר באמצעות צנרור.
הערה: העכבר צריך להיות מסומם במהלך שלב זה על ידי הצבת אותם בחדר אינדוקציה של 3% isof, ו 2L/דקה O2. - ביום ההדמיה, הגדר את מרחב העבודה כמוצג באיור 2. הפעל את משאבת החימום לג'ל אולטרסאונד ולצג הטמפרטורה.
- הגדר חממה חמה 33 ° c כדי למקם את העכברים לאחר הדמיה.
- מניחים את מנוע תלת-מימדי (3D) (איור 2F) במערכת המעקה המשולבת.
- ודא כי מנוע תלת-ממד ומערכת הרכבה מתמר מאובטחים במקומם.
- חבר מתמר מועדף (תדר: 40 MHz; איור 2E וטבלה של חומרים) עבור מדידות הגידול בניצב למנוע 3d.
- התחל מחקר חדש על תוכנת האולטרסאונד.
- בחר דפדפן מחקרולאחר מכן בחר באפשרות חדשה בתחתית המסך.
- בחר מחקר חדש, חלון חדש יופיע המאפשר את התוספת של שם המחקר בנוסף למידע נוסף על המחקר, כלומר, תאריך הלימוד, שם החוקר, וכו '.
- מלא את המידע בסדרה שם, כלומר, מזהה בעלי חיים, זן, משקל, תאריך לידה וכו '.
- בחירה בוצע, התוכנית תשתנה עבור מצב B.
- שימו מנורת חימום במיקום נוח מעל פלטפורמת החיות.
- מניחים את העכבר בתא אינדוקציה (3.5% isofלוריאן).
הערה: ההרדמה המתאימה מאושרת על-ידי חוסר הכרה של העכבר, וקצב הנשימה האיטי של סביב נשימה אחת לכל 2 שניות. - כאשר העכבר הוא הרגעה, לשנות את החיבור של מכונת ההרדמה להיות מכוון לכיוון פלטפורמת בעלי חיים, להפחית isof, כדי 2.5%.
- הניחו את העכבר על מצע החיות בלחץ דם, כאשר חלל הפה שלו מופנה לעבר צינור ההרדמה.
- החלת חומר סיכה על העיניים של העכבר.
- הניחו את העכבר בתוך הלחץ והעלו את הידיים והרגליים בחוזקה על פלטפורמת החיות.
- להחיל שכבה קטנה של ג'ל אולטרסאונד על החזה של העכבר.
- הנמך את לווין הרכישה באמצעות כפתור בקרת הגובה כדי לגעת במשטח החזה של העכבר. מיקום החללית כך שהלב של העכבר הוא כ ממורכז.
- השתמש מיקרו ידיות להשיג תמונות של החזה כולו, משני הגפיים, בכיוון רוחבי לאסוף באופן אידיאלי 500 מסגרות לכל עכבר (מספר מסגרות עשוי להשתנות בהתאם לבחירה אישית).
- לאחר הדמיה נעשה, להסיר את הג מהחזה של העכבר ולמקם את העכבר בחממה חם.
4.2D ניתוח של תמונות אולטרסאונד
- לאחר פתיחת מסגרות נרכש על תוכנת אולטרסאונד, לסרוק את המסגרות עבור גידולים.
- עבור גידולים בייזום קטן, לספור את מספר הקווים B מדי פעם כל 10 מסגרות לאורך מלא של 500 מסגרות שנרכשו.
לכן, קווים ב' נספרים בסכום כולל של 50 תמונות, כל תמונה מופרדת ב-10 מסגרות. קו ב' מאופיין בקווים ישרים לאורך המסך החוצה באופן מלא. - עבור מדידות 2D של גידולים גדולים, בחר את הכלי ליניארי ולמדוד את הרוחב והאורך של הגידול מהווה.
- כדי לחשב את נפח הגידולים, השתמש בנוסחה הבאה:
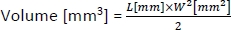
שבו L ו-W הם האורך והרוחב של הגידול, בהתאמה.
תוצאות
לאחר קבלת סיכוייו זיהומיות מדבקת של ~ 2 x 106 TU/mL (איור 1), Ca2Cre-shp53 הנגיף היה intratracheally מוזרק כאשר העכברים lsl-קראס G12D הגיעו לגיל המתאים (6-8 שבועות)9. הדמיה אולטרסאונד בוצעה לאחר 7 שבועות של זיהום בעת חניכה של גידולים (איור 3ב). הדמיה נעשה ב 7 ש...
Discussion
אנו מדגימים שיטה שיכולה להעריך גידול ריאות הצמיחה בinducible LSL-קראס G12D העכבר מודל על ידי אולטרסאונד. שיטה זו יכולה לשמש להערכת ההשפעה של מעכבי פרמקולוגית על גידול הגידול בריאות. זה יכול לשמש גם כדי להשוות את גידול הגידול בריאות בין עכברים של רקעים גנטיים שונים. השימוש בטכניקה זו אינו דורש מיומ...
Disclosures
. למחברים אין מה לגלות
Acknowledgements
אנו מודים ד ר I. Verma עבור וקטור Ca2Cre-shp53 לנטינגיי. העבודה נתמכת על ידי כספים מן המכונים הקנדיים לחקר בריאות (מנקה CIHR 137113) ל-AEK.
Materials
| Name | Company | Catalog Number | Comments |
| 0.45 μm Acrodisc Syringe Filters | Pall Corporation | PN 4614 | |
| 100-mm Cell Cultre Plate | CELLSTAR | 664 160 | |
| 6-well Cell Culture Plate | CELLSTAR | 657 160 | |
| Amicon Ultra - 15 Centrifugal Filter Units | Merck Millipore Ltd. | UFC910024 | |
| BD LSR-Fortessa | BD Biosciences | 649225B 3024 | |
| CA2Cre-shp53 lentiviral vector | From Dr. I Verma Laboratory | ||
| DMEM | Multicell | 319-005-CL | |
| FBS | Multicell | 80450 | |
| LSL-KRASG12D mouse | JAX Mice | 8179 | |
| MX550S; Centre Transmit: 40 MHz | FUJIFILM VisualSonics | 51070 | |
| OptiMEM | gibco | 11058-021 | |
| Pen/strep | Multicell | 450-201-EL | |
| pMD2.G | Addgene | 12259 | |
| PsPAX2 | Addgene | 12260 | |
| VEVO-3100 | FUJIFILM VisualSonics | 51072-50 |
References
- Eisenstein, M. Personalized medicine: Special treatment. Nature. 513, 8 (2014).
- Karachaliou, N., et al. KRAS mutations in lung cancer. Clinical Lung Cancer. 14 (3), 205-214 (2013).
- Jackson, E. L., et al. Analysis of lung tumor initiation and progression using conditional expression of oncogenic K-ras. Genes & Development. 15 (24), 3243-3248 (2001).
- DuPage, M., Dooley, A. L., Jacks, T. Conditional mouse lung cancer models using adenoviral or lentiviral delivery of Cre recombinase. Nature Protocol. 4 (7), 1064-1072 (2009).
- Chen, J., Lecuona, E., Briva, A., Welch, L. C., Sznajder, J. I. Carbonic anhydrase II and alveolar fluid reabsorption during hypercapnia. American Journal of Respiratory Cell and Molecular Biology. 38 (1), 32-37 (2008).
- Xia, Y., et al. Reduced cell proliferation by IKK2 depletion in a mouse lung-cancer model. Nature Cell Biology. 17 (4), 532 (2015).
- Demi, L., et al. Determination of a potential quantitative measure of the state of the lung using lung ultrasound spectroscopy. Scientific Reports. 7, 12746 (2017).
- Mohanty, K., et al. Characterization of the Lung Parenchyma Using Ultrasound Multiple Scattering. Ultrasound in Medicine and Biology. 43, 993-1003 (2017).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771 (2016).
- Saraogi, A. Lung ultrasound: Present and future. Lung India. 32 (3), 250-257 (2015).
- Gargani, L., Volpicelli, G. How I do it: lung ultrasound. Cardiovascular Ultrasound. 12, 25 (2014).
- Soldati, G., et al. On the Physical Basis of Pulmonary Sonographic Interstitial Syndrome. Journal of Ultrasound in Medicine. 35 (10), 2975 (2016).
- Raes, F., et al. High-Resolution Ultrasound and Photoacoustic Imaging of Orthotopic Lung Cancer in Mice: New Perspectives for Onco-Pharmacology. PLoS One. 11 (4), 15 (2016).
- Lakshman, M., Needles, A. Screening and quantification of the tumor microenvironment with micro-ultrasound and photoacoustic imaging. Nature Methods. 12 (4), 372 (2015).
- Chichra, A., Makaryus, M., Chaudhri, P., Narasimhan, M. Ultrasound for the Pulmonary Consultant. Clinical Medicine Insights: Circulatory Respiratory and Pulmonary Medicine. 10, 9 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved