È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Rilevamento della progressione del tumore del polmone nei topi mediante Ultrasound Imaging
In questo articolo
Riepilogo
Questo protocollo descrive i passi adottati per indurre i tumori polmonari KRAS nei topi e la quantificazione dei tumori formati mediante l'imaging ad ultrasuoni. I piccoli tumori sono visualizzati nei primi tempi come linee B. In momenti successivi, le misurazioni relative del volume del tumore vengono ottenute dallo strumento di misurazione nel software a ultrasuoni.
Abstract
Con 1,6 milioni di dollari di vittime all'anno, il cancro ai polmoni contribuisce enormemente al peso mondiale del cancro. Il cancro del polmone è in parte guidato da alterazioni genetiche in oncogeni come l'oncogene KRAS, che costituisce il 25% dei casi di cancro del polmone. La difficoltà nel colpire terapeuticamente il cancro del polmone guidato da KRAS deriva in parte dall'avere modelli poveri che possono imitare la progressione della malattia in laboratorio. Descriviamo un metodo che permette la quantificazione relativa dei tumori polmonari KRAS primari in un modello di topo LSL-KRAS G12D inducibile in una creme. Questo metodo si basa sull'acquisizione in modalità luminosità (B) del parenchyma polmonare. I tumori che si formano inizialmente in questo modello sono visualizzati come linee B e possono essere quantificati contando il numero di linee B presenti nelle immagini acquisite. Questi rappresenterebbero il numero di tumore relativo formato sulla superficie del polmone del topo. Man mano che i tumori formati si sviluppano con il tempo, sono percepiti come profonde fessure all'interno del parenchyma polmonare. Poiché la circonferenza del tumore formato è ben definita, il calcolo del volume del tumore relativo si ottiene misurando la lunghezza e la larghezza del tumore e applicandole nella formula utilizzata per le misurazioni della pinza del tumore. L'imaging ad ultrasuoni è una tecnica non invasiva, veloce e user-friendly che viene spesso utilizzata per le quantificazioni tumorali nei topi. Sebbene possano apparire artefatti quando si ottengono immagini a ultrasuoni, è stato dimostrato che questa tecnica di imaging è più vantaggiosa per le quantificazioni tumorali nei topi rispetto ad altre tecniche di imaging come l'imaging di tomografia computerizzata (TC) e bioluminescenza (BLI). I ricercatori possono studiare nuovi bersagli terapeutici utilizzando questa tecnica confrontando l'inizio e la progressione del tumore del polmone tra diversi gruppi di topi.
Introduzione
Poiché la principale causa di decessi correlati al cancro in tutto il mondo, il cancro del polmone rimane refrattario ai trattamenti, principalmente a causa della mancanza di modelli preclinici rilevanti che possono ricapitolare la malattia nel laboratorio1. Circa il 25% dei casi di cancro al polmone è dovuto a mutazioni nell'oncogene KRAS2. Il cancro del polmone guidato da KRAS è spesso associato a prognosi infagiola e bassa risposta alla terapia, evidenziando l'importanza di ulteriori studi in questa malattia2.
Abbiamo ottimizzato un metodo che permette la valutazione relativa della crescita del tumore polmonare in tempo reale in topi immuno-competenti indotti dal cancro del polmone KRAS. Usiamo topi Lox-Stop-Lox KRAS G12D (LSL-KRAS G12D) in cui l'oncogene KRAS G12D può essere espresso dai vettori lentivirali Cre3,4. Questi vettori sono guidati da anhydraside carbonica 2, permettendo l'infezione virale a prendere posto specificamente nelle cellule epiteliali alveolare5. Inoltre, per accelerare l'inizio e la progressione dei tumori polmonari, il costrutto lentivirale esprime anche lo shRNA P53 da un promotore U6/H1 (il costrutto lentivirale qui sarà indicato come Ca2Cre-shp53)6. La rilevanza biologica di questo metodo sta nel corso naturale dello sviluppo del tumore polmonare nei topi rispetto agli xenografti di tumori non ortotopici nei topi. Un ostacolo che utilizza il metodo ortotopico sta monitorando la crescita del tumore del polmone senza sacrificare il mouse. Per superare questa limitazione, abbiamo ottimizzato l'imaging a ultrasuoni per consentire l'analisi della progressione del tumore polmonare in modalità bidimensionale (2D) in questo modello murino. L'incitamento ai tumori a 7 settimane dopo l'infezione si riflette come linee B in immagini ad ultrasuoni, che possono essere conteggiate, ma non rifletteranno il numero esatto di tumori presenti sul polmone. Le linee B sono caratterizzate da linee bianche verticali simili a laser derivanti dalla linea pleurica nel parenchyma polmonare7,8. I tumori di grandi dimensioni possono essere visualizzati dopo 18 settimane di infezione. Il volume relativo di questi tumori è quantificato da misurazioni 2D fatte su ultrasuoni.
Questo metodo è ottimale per i ricercatori che studiano l'effetto dei farmaci farmacologici sulla crescita del tumore del polmone nel modello murino LSL-KRAS G12D. Inoltre, la progressione del tumore polmonare può essere confrontata tra topi con diversi lignaggi genetici, per esaminare l'importanza della presenza o dell'assenza di alcuni geni/proteine sullo sviluppo del volume del tumore del polmone.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Gli studi sugli animali sono stati effettuati in conformità con l'Institutional Animal Care and Use Committee (IACUC) della McGill University e le procedure sono state approvate dall'Animal Welfare Committee della McGill University (protocollo per l'uso degli animali n. 2009-5754).
1. Generazione di CA2Cre-shp53 Lentiviral Titre
NOTA: il seguente protocollo è lo stesso descritto in Xia et al.6, con piccole modifiche.
- Preparazione del lentivirus (per piatti 15 cm x 10 cm)
- Il primo giorno platoni celle HEK293T sane (7,5 x 106 cellule per piatto da 10 cm) con 10 mL del mezzo Eagle medio modificato di Dulbecco) (DMEM), 10% siero bovino fetale (FBS) e 1% penna/strep. Cultura in un incubatore di 37 gradi centigradi, 5% di CO2.
- Preparare il mix per la trasfezione calcio-fosfato (miscela per 15 piastre). Preparare il tubo A contenente 225 g di g/piastra del vettore lentivirale (Ca2Cre-shp53), 75 g di plasmide PsPAX2 (contenente hiv-1 gag e HIV-1 polgeni), 75 g (5 g/piastra) di pMD2.G plasmide (contenente il gene VSV-G) per l'imballaggio, una concentrazione finale di 0,15 M di CaCl2 e riempire il tubo con distillato H2O fino a 3,75 mL. Preparare il tubo B contenente 3,75 mL di 2 x di salina tamponati HEPES (HBS; 50 mM HEPES, pH 7.05, 280 mM NaCl, 10 mM KCl, 1,5 mM Na2HPO42H2O e 12 mM D-dexth).
- Vortice tubo A e aggiungerlo dropwise al tubo B sotto vortice continuo.
NOTA: il volume totale sarà di 7,5 mL. - Incubare a temperatura ambiente al buio per 20-30 min.
- Circa 9 h dopo aver placcato le cellule, aggiungere 500 l'l della miscela di trasfezione dropwise nel mezzo cellulare (7,5 mL/15 piatti: 0,5 mL per piatto).
- Girare delicatamente ogni piatto per mescolare, e incubare tutti i piatti a 37 gradi centigradi, 5% CO2.
- Il giorno 2, 12-18 h dopo la trasfezione, sostituire i supporti con 10 mL di mezzi di siero a ridotto(Tabella dei materiali)senza antibiotici per piatto di 10 cm. Rimettere i piatti nella 37, 5% CO2 incubatrice.
- Il terzo giorno, raccogliere i supporti contenenti lentivirus che esprimono Ca2Cre-shp53 e filtrare attraverso i filtri 0,45 m. Rifornire i media con supporti di siero ridotti senza antibiotici.
NOTA: I supporti raccolti possono essere conservati a 4 gradi centigradi per non più di 3 giorni. - Il giorno 4, raccogliere, per la seconda volta, il supporto contenente il lentivirus e filtrare attraverso un filtro di 0,45 m. Tenere a 4 gradi centigradi (per non più di 3 giorni).
- Combinare i supernatanti antivirus dai passaggi 1.1.8 e 1.1.9. Concentrarli attraverso unità filtranti centrifughe (Tabella dei materiali) centrifusando a 1.372 x g per 30 min a 4 gradi centigradi. Ripetere il processo fino a quando tutti i supporti raccolti sono passati attraverso le colonne.
NOTA: Dopo ogni centrifugazione, è possibile raccogliere 100-200 l di filtrata concentrata. - Raccogliere e mescolare i filtrati concentrati in un tubo ghiacciato da 15 mL. Mescolare bene i lentivirus concentrati e poi (ad es. 100 aliquote/tubi). Conservare a -80 gradi centigradi.
- Titorazione di lentivirale
NOTA: in questo protocollo vengono utilizzati fibroblasti embrionali di topo immortalati (MEF) che esprimono un allelo di proteine fluorescenti verdi (GFP) che esprimono un allelo di proteine fluorescenti verdi (GFP) per la quantificazione del tibo virale. Tuttavia, qualsiasi linea cellulare con un allelo loxP-GFP dovrebbe essere adatta per questo passaggio.- Cellule di coltura che esprimono un allele con fianco a LoxP di GFP con DMEM, 10% FBS e 1% penna / strep a 37 gradi centigradi, 5% CO2.
- Piastra 2 x 105 celle in due pozze da 50 mm di una piastra di 6 pozze.
NOTA: Le cellule di un pozzo saranno utilizzate per l'infezione lentivirale mentre quella dell'altro verrà utilizzata come controllo negativo. - Il giorno successivo, ricostituire le cellule con 2 mL di DMEM, 10% FBS, e 1% penna / strep 2 h prima dell'infezione lentivirale.
- Aggiungere 20 -L del lentivirus CA2Cre-shp53 (il volume può variare quando necessario) nell'infezione lentivirale bene.
- Dopo 3 giorni di coltura, determinare la frequenza delle cellule GFP-positive indotte da Cre per citometria di flusso, come illustrato nella Figura 1. Lavare le cellule con salina (PBS) tampone fosfato, staccarsi per metripsinizzazione e raccogliere le cellule mediante centrifugazione a 112 x g.
- Lavare le cellule due volte con PBS. Infine, sospendere le celle in 100 gradi L di PBS. Determinare la percentuale di celle positive GFP da un analizzatore di celle (Tabella dei materiali).
- Calcolare il tibore infettivo/funzionale del lentivirus utilizzando la seguente formula:

dove F è la frequenza delle cellule GFP-positive e calcolata sottraendo la frequenza delle cellule positive GFP dopo l'infezione (Fi) dalla frequenza delle cellule positive GFP (sfondo) prima dell'infezione (Fc) come mostrato nella Figura 1 (F - Fi-Fc), Cn è il numero di cellule placcate (2 x 105), V è il volume dell'inoculum (mL), e DF è il fattore di diluizione del virus.
NOTA: La concentrazione infettiva/funzionale è 2 x 106 TU/mL.
2. Intubazione intratracheale dei lentivirus nei topi LSL-KRASG12D
NOTA: Il metodo di intubazione intratracheale è stato utilizzato come descritto nel protocollo pubblicato da Vandivort etal. In questo protocollo, i topi l'lSL-KRASG12D mouse in sfondo C57BL/6 vengono utilizzati all'età 6-8 settimane. Una scheda di procedura di lavoro fatta in casa è utilizzata come descritto in Vandivort etal. La scheda è posizionata davanti allo sperimentatore in un comodo spazio di lavoro (circa 1 m2).
- Preparare uno spirometro rimuovendo lo stantuffo di una siringa da 1 mL e caricando nella siringa 60-L di PBS.
- Attaccare una punta di catetere da 22 G nella siringa e mettere da parte.
- Anestesizzare i topi mediante iniezione intraperitoneale di un cocktail di 1 luna/g di peso corporeo del topo di ketamina (50 mg/mL)/xylazina (5 mg/mL)/acepromazine (1 mg/mL). Garantire una corretta sedazione del topo di una bassa frequenza respiratoria (1 respiro ogni 2 s).
- Aspirate 20 -L di CA2Cre-shp53 lentivirus in un pipettor e mettere da parte.
- Posizionare il mouse sedato sulla scheda di procedura di lavoro agganciando i suoi incisivi superiori nel filo della scheda.
NOTA: il dorsum del mouse deve essere piatto contro la piattaforma. - Nastro la parte caudale della cavità toracica alla piattaforma per garantire l'allineamento del mouse durante la procedura.
- Regolare un illuminatore a collo d'oca tra l'80-100% intensità e posizionare la luce a 1/2 cm dalla superficie della pelle.
- Da dietro la piattaforma, disegnare la lingua dalla cavità orale del topo utilizzando pinze sterili.
- Mentre si fissa la lingua, inserire un depressore nella cavità orale del mouse e quindi rilasciare la lingua.
- Posizionare il collo d'oca sui bronchi stelo principale per illuminare la trachea.
NOTA: La trachea può essere visibile attraverso l'azione della respirazione, causando la fluttuazione della luce. - Quando la trachea è chiaramente visualizzata, inserire lo spirometro preparato (siringa con PBS e catetere) nel percorso tracheale.
- Rimuovere il depressore e osservare l'ascesa e la caduta di PBS nella siringa ad ogni respiro.
NOTA: Questo è un indicatore che il catetere è posizionato correttamente nella trachea. - Rimuovere la siringa contenente PBS mantenendo il catetere all'interno della trachea come posizione precedente.
- Depositare il lentivirus 20-L CA2Cre-shp53 al centro del catetere.
- Mantenendo il catetere in posizione, iniettare 300 l'aria nel catetere utilizzando una siringa vuota per garantire una corretta distribuzione del lentivirus nei polmoni.
- Tenere il catetere in posizione e reinserire lo spirometro nel catetere.
NOTA: L'aumento e la caduta della bolla PBS garantiranno che la procedura abbia successo. - Rimuovere il catetere e il nastro. Mettere l'animale in un luogo caldo e asciutto fino a quando non viene rianimato.
3. Immagini ad ultrasuoni di tumori polmonari nei topi
NOTA: L'imaging ad ultrasuoni è stato eseguito dopo 7 e 18 settimane di intubazione lentivirale utilizzando il sistema elencato nella Tabella dei Materiali; tuttavia, qualsiasi modello può essere utilizzato per l'analisi.
- Un giorno prima dell'imaging, rimuovere la pelliccia dalla zona del torace del topo intubato.
NOTA: Il mouse deve essere sedato durante questo passaggio mettendoli in una camera di induzione del 3% isoflurane e 2L/minuto O2. - Il giorno della creazione di immagini, impostare l'area di lavoro come illustrato nella Figura 2. Accendere la pompa di riscaldamento per gel ad ultrasuoni e il monitor della temperatura.
- Impostare un'incubatrice calda a 33 gradi centigradi per posizionare i topi nel post-imaging.
- Posizionare il motore tridimensionale (3D) (Figura 2F) sul sistema ferroviario integrato.
- Assicurarsi che il motore 3D e il sistema di montaggio del trasduttore siano in posizione salda.
- Collegare un trasduttore preferito (frequenza: 40 MHz; Figura 2E e Tabella dei materiali) per le misurazioni tumorali perpendicolarmente al motore 3D.
- Inizia un nuovo studio sul software a ultrasuoni.
- Seleziona Browser studio, quindi nuovo nella parte inferiore dello schermo.
- Selezionare Nuovo studio, apparirà una nuova finestra che consente l'aggiunta di un nome di studio oltre a ulteriori informazioni sullo studio, cioè, data di studio, nome del ricercatore, ecc.
- Inserisci le informazioni in Nome serie,cioè Id animale, Deformazione, Peso, Data di nascita, ecc.
- Selezionare Fatto, il programma cambierà per la modalità B.
- Mettere una lampada di riscaldamento in una posizione comoda sopra la piattaforma animale.
- Posizionare il topo nella camera di induzione (3,5% isoflurane).
NOTA: l'anestesizzazione corretta è confermata dall'incoscienza del topo e da una frequenza respiratoria più lenta di circa 1 respiro per 2 secondi. - Quando il mouse è sedato, cambiare la connessione della macchina anestetica da indirizzare verso la piattaforma animale, ridurre l'isoflurane al 2,5%.
- Posizionare il topo sulla piattaforma animale in decubito ventrale, con la sua cavità orale diretta verso il tubo anestetico.
- Applicare il lubrificante sugli occhi del mouse.
- Posizionare il topo in decubito dorsale e nastro le mani ei piedi saldamente sulla piattaforma animale.
- Applicare un piccolo strato di gel ad ultrasuoni sul petto del mouse.
- Abbassare la sonda di acquisizione utilizzando la manopola di controllo dell'altezza per toccare la superficie del torace del mouse. Posizionare la sonda in modo che il cuore del mouse sia approssimativamente centrato.
- Utilizzare le micro-manopole per acquisire immagini di tutto il torace, da entrambe le estremità, nell'orientamento trasversale idealmente raccogliendo 500 fotogrammi per mouse (il numero di fotogrammi può variare a seconda della scelta personale).
- Una volta che l'imaging è fatto, rimuovere il gel dal torace del mouse e posizionare il mouse nell'incubatrice calda.
4. Analisi 2D delle immagini ad ultrasuoni
- Dopo aver aperto i fotogrammi acquisiti sul software ad ultrasuoni, eseguire la scansione dei fotogrammi alla ricerca di tumori.
- Per i piccoli tumori che entrano in atto, contare il numero di linee B periodicamente ogni 10 fotogrammi per l'intera lunghezza dei 500 fotogrammi acquisiti.
Pertanto, le linee B vengono conteggiate in un totale di 50 immagini, ogni immagine è separata da 10 fotogrammi. Le linee B sono caratterizzate da linee rette bianche longitudinali che attraversano completamente lo schermo. - Per le misurazioni 2D di tumori di grandi dimensioni, selezionare lo strumento lineare e misurare la larghezza e la lunghezza del tumore presenti.
- Per calcolare il volume dei tumori, utilizzare la seguente formula:
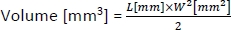
dove L e W sono rispettivamente la lunghezza e la larghezza del tumore.
Access restricted. Please log in or start a trial to view this content.
Risultati
Dopo aver ottenuto un titro infettivo lentivirale di 2 x 106 TU/mL (Figura 1), il lentivirus Ca2Cre-shp53 è stato iniettato intrachealmente quando i topi LSL-KRAS G12D hanno raggiunto un'età appropriata (6 8 settimane)9. L'imaging ad ultrasuoni è stato eseguito dopo 7 settimane di infezione all'avvio dei tumori(Figura 3B). L'imaging è stato fatto a 7 settimane al fine di includere i vari tipi di lesioni pre...
Access restricted. Please log in or start a trial to view this content.
Discussione
Dimostriamo un metodo in grado di valutare la crescita del tumore polmonare nel modello di topo LSL-KRAS G12D cre-inducibile tramite ultrasuoni. Questo metodo può essere utilizzato per valutare l'effetto degli inibitori farmacologici sulla crescita del tumore del polmone. Può anche essere utilizzato per confrontare la crescita del tumore polmonare tra topi di diversi background genetici. L'utilizzo di questa tecnica non richiede competenze computazionali specializzate, tuttavia, è importante essere sistematico nel num...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo il Dottor I. Verma per il vettore lentivirale Ca2Cre-shp53. Il lavoro è stato sostenuto da fondi dal Canadian Institutes of Health Research (CIHR MOP 137113) ad AEK.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.45 μm Acrodisc Syringe Filters | Pall Corporation | PN 4614 | |
| 100-mm Cell Cultre Plate | CELLSTAR | 664 160 | |
| 6-well Cell Culture Plate | CELLSTAR | 657 160 | |
| Amicon Ultra - 15 Centrifugal Filter Units | Merck Millipore Ltd. | UFC910024 | |
| BD LSR-Fortessa | BD Biosciences | 649225B 3024 | |
| CA2Cre-shp53 lentiviral vector | From Dr. I Verma Laboratory | ||
| DMEM | Multicell | 319-005-CL | |
| FBS | Multicell | 80450 | |
| LSL-KRASG12D mouse | JAX Mice | 8179 | |
| MX550S; Centre Transmit: 40 MHz | FUJIFILM VisualSonics | 51070 | |
| OptiMEM | gibco | 11058-021 | |
| Pen/strep | Multicell | 450-201-EL | |
| pMD2.G | Addgene | 12259 | |
| PsPAX2 | Addgene | 12260 | |
| VEVO-3100 | FUJIFILM VisualSonics | 51072-50 |
Riferimenti
- Eisenstein, M. Personalized medicine: Special treatment. Nature. 513, 8(2014).
- Karachaliou, N., et al. KRAS mutations in lung cancer. Clinical Lung Cancer. 14 (3), 205-214 (2013).
- Jackson, E. L., et al. Analysis of lung tumor initiation and progression using conditional expression of oncogenic K-ras. Genes & Development. 15 (24), 3243-3248 (2001).
- DuPage, M., Dooley, A. L., Jacks, T. Conditional mouse lung cancer models using adenoviral or lentiviral delivery of Cre recombinase. Nature Protocol. 4 (7), 1064-1072 (2009).
- Chen, J., Lecuona, E., Briva, A., Welch, L. C., Sznajder, J. I. Carbonic anhydrase II and alveolar fluid reabsorption during hypercapnia. American Journal of Respiratory Cell and Molecular Biology. 38 (1), 32-37 (2008).
- Xia, Y., et al. Reduced cell proliferation by IKK2 depletion in a mouse lung-cancer model. Nature Cell Biology. 17 (4), 532(2015).
- Demi, L., et al. Determination of a potential quantitative measure of the state of the lung using lung ultrasound spectroscopy. Scientific Reports. 7, 12746(2017).
- Mohanty, K., et al. Characterization of the Lung Parenchyma Using Ultrasound Multiple Scattering. Ultrasound in Medicine and Biology. 43, 993-1003 (2017).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771(2016).
- Saraogi, A. Lung ultrasound: Present and future. Lung India. 32 (3), 250-257 (2015).
- Gargani, L., Volpicelli, G. How I do it: lung ultrasound. Cardiovascular Ultrasound. 12, 25(2014).
- Soldati, G., et al. On the Physical Basis of Pulmonary Sonographic Interstitial Syndrome. Journal of Ultrasound in Medicine. 35 (10), 2975(2016).
- Raes, F., et al. High-Resolution Ultrasound and Photoacoustic Imaging of Orthotopic Lung Cancer in Mice: New Perspectives for Onco-Pharmacology. PLoS One. 11 (4), 15(2016).
- Lakshman, M., Needles, A. Screening and quantification of the tumor microenvironment with micro-ultrasound and photoacoustic imaging. Nature Methods. 12 (4), 372(2015).
- Chichra, A., Makaryus, M., Chaudhri, P., Narasimhan, M. Ultrasound for the Pulmonary Consultant. Clinical Medicine Insights: Circulatory Respiratory and Pulmonary Medicine. 10, 9(2016).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon