Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Nachweis der Lungentumorprogression bei Mäusen durch Ultraschall-Bildgebung
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Schritte, die unternommen wurden, um KRAS-Lungentumoren bei Mäusen zu induzieren, sowie die Quantifizierung gebildeter Tumoren durch Ultraschallbildgebung. Kleine Tumoren werden in frühen Zeitpunkten als B-Linien visualisiert. Zu späteren Zeitpunkten werden relative Tumorvolumenmessungen durch das Messwerkzeug in der Ultraschallsoftware durchgeführt.
Zusammenfassung
Mit 1,6 Millionen Us-Dollar pro Jahr trägt Lungenkrebs enorm zur weltweiten Belastung durch Krebs bei. Lungenkrebs wird zum Teil durch genetische Veränderungen in Onkogenen wie dem KRAS-Onkogen verursacht, das 25 % der Lungenkrebsfälle ausmacht. Die Schwierigkeit, kraS-getriebenen Lungenkrebs therapeutisch anzusprechen, ist zum Teil darauf zurückzuführen, dass schlechte Modelle das Fortschreiten der Krankheit im Labor nachahmen können. Wir beschreiben eine Methode, die die relative Quantifizierung von primären KRAS-Lungentumoren in einem creinduzierbaren LSL-KRAS G12D-Mausmodell mittels Ultraschallbildgebung ermöglicht. Diese Methode beruht auf der Helligkeit (B)-Modus Erfassung des Lungenparenchyms. Tumoren, die zunächst in diesem Modell gebildet werden, werden als B-Linien visualisiert und können durch Zählen der Anzahl der In-B-Linien, die in den erfassten Bildern vorhanden sind, quantifiziert werden. Diese würden die relative Tumorzahl darstellen, die auf der Oberfläche der Mauslunge gebildet wird. Wenn sich die gebildeten Tumoren mit der Zeit entwickeln, werden sie als tiefe Spalten im Lungenparenchym wahrgenommen. Da der Umfang des gebildeten Tumors klar definiert ist, wird die Berechnung des relativen Tumorvolumens erreicht, indem die Länge und Breite des Tumors gemessen und in der Für tumorsättelweite Verwendete formelangewendet wird. Ultraschall-Bildgebung ist eine nicht-invasive, schnelle und benutzerfreundliche Technik, die oft für Tumorquantifizierungen bei Mäusen verwendet wird. Obwohl Artefakte auftreten können, wenn Ultraschallbilder erhalten, hat sich gezeigt, dass diese bildgebende Technik für Tumorquantifizierungen bei Mäusen vorteilhafter ist als bei anderen bildgebenden Verfahren wie Computertomographie (CT) Biolumineszenz-Bildgebung (BLI). Forscher können neue therapeutische Ziele mit dieser Technik untersuchen, indem sie die Initiation und Progression von Lungentumoren zwischen verschiedenen Gruppen von Mäusen vergleichen.
Einleitung
Als weltweit führende Ursache für krebsbedingte Todesfälle bleibt Lungenkrebs für Behandlungen refraktär, vor allem aufgrund des Fehlens relevanter präklinischer Modelle, die die Krankheit im Labor rekapitulieren können1. Rund 25% der Lungenkrebsfälle sind auf Mutationen im KRAS-Onkogen2zurückzuführen. KRAS-getriebener Lungenkrebs ist oft mit schlechter Prognose und geringer Reaktion auf die Therapie verbunden, was die Bedeutung weiterer Studien bei dieser Krankheit unterstreicht2.
Wir haben eine Methode optimiert, die die relative Bewertung des Lungentumorwachstums in Echtzeit bei KRAS Lungenkrebs-induzierten immunkompetenten Mäusen ermöglicht. Wir verwenden Lox-Stop-Lox KRAS G12D (LSL-KRAS G12D) Mäuse, bei denen das KRAS G12D Onkogen durch Cre lentivirale Vektoren3,4ausgedrückt werden kann. Diese Vektoren werden durch Kohlensäureanhydrase 2 angetrieben, so dass die Virusinfektion speziell in Alveolar-Epithelzellen5stattfinden kann. Um die Initiierung und das Fortschreiten von Lungentumoren zu beschleunigen, drückt das lentivirale Konstrukt auch P53 shRNA von einem U6/H1-Promotor aus (das lentivirale Konstrukt wird hierals Ca2Cre-shp53 bezeichnet)6. Die biologische Relevanz dieser Methode liegt im natürlichen Verlauf der Lungentumorentwicklung bei Mäusen im Gegensatz zu Xenografts von nicht-orthotopischen Tumoren bei Mäusen. Ein Hindernis mit der orthotopischen Methode ist die Überwachung des Lungentumorwachstums, ohne die Maus zu opfern. Um diese Einschränkung zu überwinden, haben wir die Ultraschall-Bildgebung optimiert, um die Analyse der Lungentumorprogression im zweidimensionalen (2D) Modus in diesem Mausmodell zu ermöglichen. Die Initiierung von Tumoren nach 7 Wochen nach der Infektion wird als B-Linien in Ultraschallbildern reflektiert, die gezählt werden können, aber nicht die genaue Anzahl der Tumoren in der Lunge widerspiegeln. B-Linien zeichnen sich durch laserartige vertikale weiße Linien aus der Pleuralinie im Lungenparenchym7,8aus. Große Tumore können nach 18 Wochen Der Infektion visualisiert werden. Das relative Volumen dieser Tumoren wird durch 2D-Messungen am Ultraschall quantifiziert.
Diese Methode ist optimal für Forscher, die die Wirkung von pharmakologischen Medikamenten auf das Wachstum des Lungentumors im LSL-KRAS G12D-Mausmodell untersuchen. Darüber hinaus kann die Progression des Lungentumors zwischen Mäusen mit unterschiedlichen genetischen Abstammungslinien verglichen werden, um die Bedeutung des Vorhandenseins oder Fehlens bestimmter Gene/Proteine für die Entwicklung des Lungentumorvolumens zu untersuchen.
Protokoll
Tierexperimentelle Studien wurden in Übereinstimmung mit dem Institutional Animal Care and Use Committee (IACUC) der McGill University durchgeführt und die Verfahren wurden vom Animal Welfare Committee der McGill University genehmigt (Tiernutzungsprotokoll Nr. 2009-5754).
1. Erzeugung von CA2Cre-shp53 Lentiviral Titre
HINWEIS: Das folgende Protokoll ist das gleiche wie das in Xia et al.6beschriebene protokollmit kleineren Änderungen.
- Zubereitung von Lentivirus (für 15 cm x 10 cm Geschirr)
- Am ersten Tag, Platte gesunde HEK293T Zellen (7,5 x 106 Zellen pro 10 cm Schale) mit 10 ml Dulbecco modifiziert eagle medium) (DMEM), 10% fetales Rinderserum (FBS) und 1% Stift/Strep. Kultur in einem 37 °C, 5% CO2-Inkubator.
- Bereiten Sie die Mischung für die Calcium-Phosphat-Transfektion (Mischung für 15 Platten) vor. Bereiten Sie das Röhrchen A vor, das 225 g (15 g/Platte) des lentiviralen Vektors (Ca2Cre-shp53), 75 g (5 g/Platte) des PsPAX2-Plasmids (mit HIV-1-Gag und HIV-1-Polgenen), 75 g (5 g/Platte) pMD2.G-Plasmid (mit VSV-G-Gen) für die Verpackung enthält, eine Endkonzentration von 0,15 m caCl2 und füllen Sie das Rohr mit destilliertenH2O bis zu 3,75 ml. Rohr B mit 3,75 ml 2x HEPES-gepufferter Kochnische (HBS; 50 mM HEPES, pH 7,05, 280 mM NaCl, 10 mM KCl, 1,5 mM Na2HPO42H2O und 12 mM D-Dextrose) vorbereiten.
- Wirbelrohr A und fügen Sie es tropfenweise zu Rohr B unter kontinuierlichem Wirbel hinzu.
HINWEIS: Das Gesamtvolumen beträgt 7,5 ml. - Bei Raumtemperatur im Dunkeln für 20 bis 30 min inkubieren.
- Etwa 9 h nach der Beschichtung der Zellen 500 l des Transfektionsgemisches tropfenweise in das Zellmedium geben (7,5 ml/15 Gerichte: 0,5 ml pro Schale).
- Wirbeln Sie sanft jedes Gericht zu mischen, und inkubieren alle Gerichte bei 37 °C, 5% CO2.
- Ersetzen Sie am 2. Tag, 12-18 h nach der Transfektion die Medien durch 10 ml antibiotikafreies reduziertes Serummedium (Materialtabelle) pro 10 cm Schale. Legen Sie gerichte zurück in den 37 °C, 5% CO2-Inkubator.
- Sammeln Sie am 3. Tag die Medien, die Lentiviren enthalten, die Ca2Cre-shp53 exdrücken, und filtern Sie sie durch 0,45 m Filter. Füllen Sie die Medien mit frischen antibiotikafreien reduzierten Serummedien auf.
HINWEIS: Die gesammelten Medien können nicht mehr als 3 Tage bei 4 °C aufbewahrt werden. - Sammeln Sie am 4. Tag ein zweites Mal die Medien, die das Lentivirus enthalten, und filtern Sie durch einen 0,45 m-Filter. Bei 4 °C (nicht mehr als 3 Tage) aufbewahren.
- Kombinieren Sie die Virusüberstandmittel aus den Schritten 1.1.8 und 1.1.9. Konzentrieren Sie sie durch Zentrifugalfiltereinheiten (Materialtabelle) durch Zentrifugieren bei 1.372 x g für 30 min bei 4 °C. Wiederholen Sie den Vorgang, bis alle gesammelten Medien durch die Spalten gegangen sind.
HINWEIS: Nach jeder Zentrifugation können 100 bis 200 L konzentriertes Filtrat geerntet werden. - Sammeln und mischen Sie die konzentrierten Filtrate in einem 15 ml eiskalten Rohr. Mischen Sie die konzentrierten Lentiviren gut und dann aliquot (z.B. 100 l/ Tube). Bei -80 °C lagern.
- Lentivirale Titration
HINWEIS: In diesem Protokoll werden verewigte embryonale Fibroblasten (MEFs), die ein loxP-flankiertes Allel aus grünem fluoreszierendem Protein (GFP) exzieren, in diesem Protokoll zur Quantifizierung von viralem Titer verwendet. Für diesen Schritt sollte jedoch jede Zelllinie mit einem LoxP-GFP-Allel geeignet sein.- Kulturzellen, die ein loxP-flankiertes Alll gfP mit DMEM, 10% FBS und 1% Pen/Strep bei 37 °C, 5%CO2exemiten.
- Platte 2 x 105 Zellen in zwei 50 mm Brunnen einer 6-Well-Platte.
HINWEIS: Die Zellen eines Brunnens werden für lentivirale Infektionen verwendet werden, während die des anderen als Negativkontrolle verwendet werden. - Füllen Sie die Zellen am nächsten Tag mit 2 ml DMEM, 10% FBS und 1% Pen/Strep 2 h vor einer lentiviralen Infektion auf.
- Fügen Sie 20 L des CA2Cre-shp53 lentivirus (das Volumen kann bei Bedarf variieren) in der lentiviralen Infektion gut hinzu.
- Nach 3 Tagen in kultur, bestimmen Sie die Häufigkeit der Cre-induzierten GFP-positiven Zellen durch Durchflusszytometrie, wie in Abbildung 1dargestellt. Zellen mit phosphatgepufferter Saline (PBS) waschen, durch Trypsinisierung lösen und Zellen durch Zentrifugation bei 112 x gsammeln.
- Waschen Sie die Zellen zweimal mit PBS. Setzen Sie schließlich die Zellen in 100 l PBS aus. Bestimmen Sie den Prozentsatz der GFP-positiven Zellen durch einen Zellanalysator (Materialtabelle).
- Berechnen Sie den Lentivirus-Infektiin/funktionellen Titer mit der folgenden Formel:

wobei F die Häufigkeit von GFP-positiven Zellen ist und berechnet wird, indem die Häufigkeit von GFP-positiven Zellen nach einer Infektion (Fi) von der Häufigkeit von GFP-positiven Zellen (Hintergrund) vor der Infektion (Fc) subtrahiert wird, wie in Abbildung 1 (F = Fi-Fc) dargestellt, Cn ist die Anzahl der plattierten Zellen (2 x 105), V ist das Volumen des Inokulums (ml), und DF ist der Virus-Dilutionsfaktor.
HINWEIS: Die infektiöse/funktionelle Konzentration = 2 x 106 TU/ml.
2. Intratracheale Intubation von Lentiviren bei LSL-KRASG12D Mäusen
HINWEIS: Die Methode der intratrachealen Intubation wurde verwendet, wie im veröffentlichten Protokoll von Vandivort et al.9beschrieben. In diesem Protokoll werden Mäuse LSL-KRASG12D-Mäuse im C57BL/6-Hintergrund im Alter von 6 bis 8 Wochen verwendet. Ein hausgemachtes Arbeitsverfahren Wird verwendet, wie in Vandivort et al.9beschrieben. Das Board befindet sich vor dem Experimentator in einem bequemen Arbeitsbereich (ca. 1 m2).
- Bereiten Sie ein Spirometer vor, indem Sie den Kolben einer 1 ml Spritze entfernen und 60 l PBS in die Spritze laden.
- Eine 22 G Katheterspitze in die Spritze stecken und beiseite stellen.
- Anästhesisieren Sie die Mäuse durch intraperitoneale Injektion eines Cocktails mit einem Mauskörpergewicht von Ketamin (50 mg/ml)/Xylazin (5 mg/ml)/Acepromazin (1 mg/ml). Achten Sie auf die richtige Sedierung der Maus durch eine niedrige Atemfrequenz (1 Atemzug alle 2 s).
- Aspirieren Sie 20 l CA2Cre-shp53 lentivirus in einen Pipettor und beiseite stellen.
- Positionieren Sie die sedierte Maus auf der Arbeitsprozedurplatine, indem Sie ihre oberen Schneidezähne in den Faden der Platine einhaken.
HINWEIS: Das Dorsum der Maus sollte flach gegenüber der Plattform sein. - Verkleben Sie den kaudalen Teil der Brusthöhle auf die Plattform, um die Ausrichtung der Maus während des Eingriffs zu gewährleisten.
- Stellen Sie einen Schwanenhals-Beleuchtungskörper zwischen 80 und 100 % Intensität ein und platzieren Sie das Licht 1 x 2 cm von der Hautoberfläche entfernt.
- Ziehen Sie die Zunge hinter der Plattform mit sterilen Zangen aus der Mundhöhle der Maus.
- Während der Sicherung der Zunge, legen Sie einen Druckmittel in die Mundhöhle der Maus dann die Zunge los.
- Positionieren Sie den Schwanenhals auf dem Hauptstamm Bronchien, um Luftröhre zu beleuchten.
HINWEIS: Die Luftröhre kann durch die Atmung sichtbar sein, was zu Schwankungen des Lichts führt. - Wenn die Luftröhre deutlich sichtbar ist, legen Sie das vorbereitete Spirometer (Spritze mit PBS und Katheter) in den Luftröhralpfad ein.
- Entfernen Sie den Druckmittel und beobachten Sie den Anstieg und Fall von PBS in der Spritze mit jedem Atemzug.
HINWEIS: Dies ist ein Indikator dafür, dass der Katheter richtig in der Luftröhre positioniert ist. - Entfernen Sie die Spritze, die PBS enthält, während Sie den Katheter in der Luftröhre wie die vorherige Position beibehalten.
- Legen Sie das 20 L CA2Cre-shp53 lentivirus in die Mitte des Katheters.
- Während Sie den Katheter an Ort und Stelle halten, injizieren Sie 300 l Luft in den Katheter mit einer leeren Spritze, um eine ordnungsgemäße Verteilung des Lentivirus in der Lunge zu gewährleisten.
- Halten Sie den Katheter an Ort und Stelle und setzen Sie das Spirometer wieder in den Katheter ein.
HINWEIS: Das Auf- und Absinken der PBS-Blase stellt sicher, dass das Verfahren erfolgreich ist. - Entfernen Sie den Katheter und das Band. Das Tier an einen warmen und trockenen Ort geben, bis es wiederbelebt wird.
3. Ultraschall-Bildgebung von Lungentumoren bei Mäusen
ANMERKUNG: Die Ultraschall-Bildgebung wurde nach 7 und 18 Wochen lentiviraler Intubation mit dem in der Materialtabelleaufgeführten System durchgeführt; Für die Analyse kann jedoch jedes Modell verwendet werden.
- Entfernen Sie einen Tag vor der Bildgebung Fell aus dem Brustbereich der intubierten Maus.
HINWEIS: Die Maus sollte während dieses Schritts sediert werden, indem sie in eine Induktionskammer von 3% Isofluran und 2L/Minute O2platziert werden. - Richten Sie am Tag der Bildgebung den Arbeitsbereich wie in Abbildung 2dargestellt ein. Schalten Sie die Heizpumpe für Ultraschallgel und den Temperaturmonitor ein.
- Richten Sie einen warmen 33 °C-Inkubator ein, um die Mäuse in der Nachbildgebung zu platzieren.
- Platzieren Sie den dreidimensionalen (3D) Motor (Abbildung 2F) auf dem integrierten Schienensystem.
- Stellen Sie sicher, dass der 3D-Motor und das Wandler-Montagesystem sicher an Ort und Stelle sind.
- Schließen Sie einen bevorzugten Messumformer an (Frequenz: 40 MHz; Abbildung 2E und Materialtabelle) für Tumormessungen senkrecht zum 3D-Motor.
- Starten Sie eine neue Studie über die Ultraschall-Software.
- Wählen Sie Studienbrowseraus , und wählen Sie dann unten auf dem Bildschirm Neu aus.
- Wählen Sie Neue Studieaus, ein neues Fenster wird erscheinen, das das Hinzufügen eines Studiennamens zusätzlich zu weiteren Informationen über die Studie, d. h. Studiendatum, Name des Forschers usw. ermöglicht.
- Geben Sie die Informationen in Serienname, d. h. Animal ID, Strain, Weight, Date of Birth, etc. ein.
- Wählen Sie Fertig, das Programm ändert sich für den B-Modus.
- Setzen Sie eine Heizlampe in eine bequeme Position über der Tierplattform.
- Legen Sie die Maus in die Induktionskammer (3,5% Isofluran).
HINWEIS: Die richtige Anästhesisierung wird durch bewusste Maus und langsamere Atemfrequenz von etwa 1 Atemweg pro 2 Sekunden bestätigt. - Wenn die Maus sediert ist, ändern Sie die Verbindung der Anästhesiemaschine, um auf die Tierplattform gerichtet werden, reduzieren Isofluran auf 2,5%.
- Legen Sie die Maus auf die Tierplattform in decubitus ventral, mit seiner Mundhöhle in Richtung der Anästhetika Rohr gerichtet.
- Schmiermittel auf die Augen der Maus auftragen.
- Legen Sie die Maus in decubitus dorsal und band seine Hände und Füße fest auf die Tierplattform.
- Tragen Sie eine kleine Schicht Ultraschallgel auf die Brust der Maus auf.
- Senken Sie die Erfassungssonde mit dem Höhenregler, um die Oberfläche der Mausbrust zu berühren. Positionieren Sie die Sonde so, dass das Herz der Maus ungefähr zentriert ist.
- Verwenden Sie die Mikroknöpfe, um Bilder der gesamten Brust, von beiden Extremitäten, in der Querausrichtung idealerweise 500 Bilder pro Maus zu sammeln (Anzahl der Bilder kann je nach persönlicher Wahl variieren).
- Sobald die Bildgebung abgeschlossen ist, entfernen Sie das Gel aus der Brust der Maus und legen Sie die Maus in den warmen Inkubator.
4. 2D-Analyse von Ultraschallbildern
- Nach dem Öffnen erworbener Rahmen auf der Ultraschall-Software, scannen Sie die Rahmen auf Tumore.
- Bei kleinen anitiierenden Tumoren sollte die Anzahl der B-Linien periodisch alle 10 Frames für die gesamte Länge der 500 erhaltenen Frames gezählt werden.
Daher werden B-Linien in insgesamt 50 Bildern gezählt, jedes Bild ist durch 10 Frames getrennt. B-Linien zeichnen sich durch längsweiße gerade Linien aus, die den Bildschirm vollständig durchqueren. - Für 2D-Messungen großer Tumoren wählen Sie das LineareWerkzeug aus und messen die Breite und Länge des vorhandenen Tumors.
- Um das Volumen der Tumoren zu berechnen, verwenden Sie die folgende Formel:
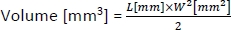
wobei L und W die Länge bzw. Breite des Tumors sind.
Ergebnisse
Nach Der Erlangung eines lentiviralen infektiösen Titers von 2 x 106 TU/ml (Abbildung 1) wurde das Ca2Cre-shp53 lentivirus intratracheal injiziert, wenn LSL-KRAS G12D-Mäuse ein angemessenes Alter erreichten (6-8 Wochen)9. Ultraschall-Bildgebung wurde nach 7 Wochen der Infektion nach Beginn der Tumoren durchgeführt (Abbildung 3B). Die Bildgebung wurde nach 7 Wochen durchgeführt, um die verschiedenen Arten vo...
Diskussion
Wir zeigen eine Methode, die das Lungentumorwachstum im creinduziblen Mausmodell LSL-KRAS G12D per Ultraschall bewerten kann. Diese Methode kann zur Bewertung der Wirkung von pharmakologischen Inhibitoren auf das Wachstum des Lungentumors verwendet werden. Es kann auch verwendet werden, um Lungentumorwachstum zwischen Mäusen mit unterschiedlichem genetischen Hintergrund zu vergleichen. Die Verwendung dieser Technik erfordert keine speziellen Rechenfertigkeiten, es ist jedoch wichtig, systematisch in der Anzahl der für ...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken Dr. I. Verma für den lentiviralen Ca2Cre-shp53 Vektor. Die Arbeit wurde durch Mittel der Canadian Institutes of Health Research (CIHR MOP 137113) an AEK unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.45 μm Acrodisc Syringe Filters | Pall Corporation | PN 4614 | |
| 100-mm Cell Cultre Plate | CELLSTAR | 664 160 | |
| 6-well Cell Culture Plate | CELLSTAR | 657 160 | |
| Amicon Ultra - 15 Centrifugal Filter Units | Merck Millipore Ltd. | UFC910024 | |
| BD LSR-Fortessa | BD Biosciences | 649225B 3024 | |
| CA2Cre-shp53 lentiviral vector | From Dr. I Verma Laboratory | ||
| DMEM | Multicell | 319-005-CL | |
| FBS | Multicell | 80450 | |
| LSL-KRASG12D mouse | JAX Mice | 8179 | |
| MX550S; Centre Transmit: 40 MHz | FUJIFILM VisualSonics | 51070 | |
| OptiMEM | gibco | 11058-021 | |
| Pen/strep | Multicell | 450-201-EL | |
| pMD2.G | Addgene | 12259 | |
| PsPAX2 | Addgene | 12260 | |
| VEVO-3100 | FUJIFILM VisualSonics | 51072-50 |
Referenzen
- Eisenstein, M. Personalized medicine: Special treatment. Nature. 513, 8 (2014).
- Karachaliou, N., et al. KRAS mutations in lung cancer. Clinical Lung Cancer. 14 (3), 205-214 (2013).
- Jackson, E. L., et al. Analysis of lung tumor initiation and progression using conditional expression of oncogenic K-ras. Genes & Development. 15 (24), 3243-3248 (2001).
- DuPage, M., Dooley, A. L., Jacks, T. Conditional mouse lung cancer models using adenoviral or lentiviral delivery of Cre recombinase. Nature Protocol. 4 (7), 1064-1072 (2009).
- Chen, J., Lecuona, E., Briva, A., Welch, L. C., Sznajder, J. I. Carbonic anhydrase II and alveolar fluid reabsorption during hypercapnia. American Journal of Respiratory Cell and Molecular Biology. 38 (1), 32-37 (2008).
- Xia, Y., et al. Reduced cell proliferation by IKK2 depletion in a mouse lung-cancer model. Nature Cell Biology. 17 (4), 532 (2015).
- Demi, L., et al. Determination of a potential quantitative measure of the state of the lung using lung ultrasound spectroscopy. Scientific Reports. 7, 12746 (2017).
- Mohanty, K., et al. Characterization of the Lung Parenchyma Using Ultrasound Multiple Scattering. Ultrasound in Medicine and Biology. 43, 993-1003 (2017).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771 (2016).
- Saraogi, A. Lung ultrasound: Present and future. Lung India. 32 (3), 250-257 (2015).
- Gargani, L., Volpicelli, G. How I do it: lung ultrasound. Cardiovascular Ultrasound. 12, 25 (2014).
- Soldati, G., et al. On the Physical Basis of Pulmonary Sonographic Interstitial Syndrome. Journal of Ultrasound in Medicine. 35 (10), 2975 (2016).
- Raes, F., et al. High-Resolution Ultrasound and Photoacoustic Imaging of Orthotopic Lung Cancer in Mice: New Perspectives for Onco-Pharmacology. PLoS One. 11 (4), 15 (2016).
- Lakshman, M., Needles, A. Screening and quantification of the tumor microenvironment with micro-ultrasound and photoacoustic imaging. Nature Methods. 12 (4), 372 (2015).
- Chichra, A., Makaryus, M., Chaudhri, P., Narasimhan, M. Ultrasound for the Pulmonary Consultant. Clinical Medicine Insights: Circulatory Respiratory and Pulmonary Medicine. 10, 9 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten