Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Обнаружение прогрессирования опухоли легких у мышей с помощью ультразвуковой визуализации
В этой статье
Резюме
Этот протокол описывает шаги, предпринятые для индуцирования KRAS опухолей легких у мышей, а также количественной оценки сформированных опухолей с помощью ультразвуковой визуализации. Небольшие опухоли визуализированы в ранних точках времени как B-линии. В более поздние временные точки, относительные измерения объема опухоли достигаются с помощью инструмента измерения в ультразвуковом программном обеспечении.
Аннотация
С 1,6 миллиона жертв в год, рак легких вносит огромный вклад в мировое бремя рака. Рак легких частично обусловлен генетическими изменениями в онкогенах, таких как онкоген KRAS, который составляет 25% случаев рака легких. Трудность в терапевтической ориентации KRAS-управляемый рак легких отчасти проистекает из бедных моделей, которые могут имитировать прогрессирование болезни в лаборатории. Мы описываем метод, который позволяет относительную количественную оценку первичных опухолей легких KRAS в Cre-индуцируемой модели мыши LSL-KRAS G12D с помощью ультразвуковой визуализации. Этот метод опирается на яркость (B)-режим приобретения легких паренхимы. Опухоли, которые первоначально формируются в этой модели, визуализироваться как B-линии и могут быть количественно путем подсчета количества B-линий, присутствующих в приобретенных изображений. Они будут представлять относительное число опухолей, образовавшихся на поверхности мышиного легкого. Как сформированные опухоли развиваются со временем, они воспринимаются как глубокие расщелины в легких parenchyma. Поскольку окружность сформированной опухоли четко определена, вычисление относительного объема опухоли достигается путем измерения длины и ширины опухоли и применения их в формуле, используемой для измерений калибровки опухоли. Ультразвуковая томография является неинвазивным, быстрым и удобным методом, который часто используется для количественных изображений опухолей у мышей. Хотя артефакты могут появляться при получении ультразвуковых изображений, было показано, что этот метод визуализации является более выгодным для количественных показаний опухолей у мышей по сравнению с другими методами визуализации, такими как компьютерная томография (КТ) изображений и биолюминесценционной томографии (BLI). Исследователи могут исследовать новые терапевтические цели, используя этот метод, сравнивая инициацию опухоли легких и прогрессирование между различными группами мышей.
Введение
В качестве основной причины смерти, связанных с раком во всем мире, рак легких остается огнеупорным для лечения, в основном из-за отсутствия соответствующих доклинических моделей, которые могут резюмировать болезнь в лаборатории1. Около 25% случаев рака легких связаны с мутациями в онкогене KRAS2. РАК легких, управляемый KRAS, часто ассоциируется с плохим прогнозом и низкой реакцией на терапию, подчеркивая важность дальнейших исследований в этом заболевании2.
Мы оптимизировали метод, который позволяет относительную оценку роста опухоли легких в режиме реального времени у раков легких, вызванных иммунными компетентами. Мы используем мышей Lox-Stop-Lox KRAS G12D (LSL-KRAS G12D), в которых онкоген KRAS G12D может быть выражен криовирусными векторами3,4. Эти переносчики обусловлены углеродной ангидразой 2, что позволяет вирусной инфекции происходит именно в альвеолярных эпителиальных клеток5. Кроме того, для ускорения инициации и прогрессирования опухолей легких, лентивирусная конструкция также выражает P53 shRNA от промоутера U6/H1 (лентивирусная конструкция здесь будет называться Ca2Cre-shp53)6. Биологическая значимость этого метода заключается в естественном течении развития опухолей легких у мышей, в отличие от ксенотрансвтатов неортогадляических опухолей у мышей. Препятствием с помощью ортотопического метода является мониторинг роста опухоли легких без ущерба для мыши. Чтобы преодолеть это ограничение, мы оптимизировали ультразвуковую визуализацию, чтобы позволить анализировать прогрессирование опухоли легких в двумерном (2D) режиме в этой модели мыши. Иначины опухолей на 7 недель после инфекции отражаются как B-линии в ультразвуковых изображениях, которые могут быть подсчитаны, но не будут отражать точное количество опухолей, присутствующих на легких. B-линии характеризуются лазероподобными вертикальными белыми линиями, вытекающими из плевральной линии в легкей паренхиме7,8. Большие опухоли могут быть визуализированы после 18 недель инфекции. Относительный объем этих опухолей количественно с помощью 2D измерений, проводимых на УЗИ.
Этот метод является оптимальным для исследователей, исследующих влияние фармакологических препаратов на рост опухолей легких в модели мыши LSL-KRAS G12D. Кроме того, прогрессирование опухоли легких можно сравнить между мышами с различными генетическими линиями, чтобы изучить важность наличия или отсутствия определенных генов/белков на развитие объема опухоли легких.
протокол
Исследования на животных проводились в соответствии с Институциональным комитетом по уходу за животными и использованию (IACUC) Университета Макгилла, и процедуры были одобрены Комитетом по защите животных Университета Макгилла (протокол использования животных No 2009-5754).
1. Поколение CA2Cre-shp53 Лентивиртивир Титр
ПРИМЕЧАНИЕ: Следующий протокол такой же, как описано в Xia et al.6, с незначительными изменениями.
- Приготовление лентивирусной (для 15 см х 10 см)
- На 1-й день, пластины здоровых HEK293T клеток (7,5 х 106 клеток на 10 см блюдо) с 10 мл dulbecco в модифицированных Eagle среды) (DMEM), 10% плода бычьей сыворотки (FBS), и 1% пера / стрептококка. Культура в инкубаторе 37 градусов по Цельсию, 5% CO2.
- Приготовьте смесь для трансфекции кальция-фосфата (смесь для 15 пластин). Подготовка трубки А, содержащей 225 мкг (15 мкг/пластина) лентивирусного вектора (Ca2Cre-shp53), 75 мкг (5 мкг/пластина) плазмида PsPAX2 (содержащий ВИЧ-1 кляп и гены ВИЧ-1), 75 мкг (5 мкг/пластина) pMD2.G плазмида (содержащий ген VSV-G) для упаковки окончательная концентрация 0,15 М CaCl2 и заполнить трубку дистиллированной H2O до 3,75 мл. Подготовка трубки B, содержащей 3,75 мл 2x HEPES-буферный солен (HBS; 50 мМ HEPES, pH 7.05, 280 мМ NaCl, 10 мм KCl, 1,5 мм Na2HPO42H2O, и 12 мМ D-декстроза).
- Vortex трубки и добавить его dropwise в трубку B под непрерывным вихрем.
ПРИМЕЧАНИЕ: Общий объем составит 7,5 мл. - Инкубировать при комнатной температуре в темное время суток в течение 20-30 мин.
- Приблизительно 9 ч после покрытия клеток, добавить 500 л трансфекционной смеси dropwise в клеточной среде (7,5 мл/15 блюд: 0,5 мл на блюдо).
- Вихрь мягко каждое блюдо, чтобы смешать, и инкубировать все блюда при 37 градусах Цельсия, 5% CO2.
- На 2-й день, 12/18 ч после трансфекции, заменить средства массовой информации с 10 мл без антибиотиков снижение сыворотки(Таблица материалов) на 10 см блюдо. Поместите блюда обратно в 37 градусов по Цельсию, 5% CO2 инкубатор.
- На 3-й день соберите средства массовой информации, содержащие лентивирусы, выражающие Ca2Cre-shp53, и процедите фильтры 0,45 мкм. Пополнить средства массовой информации со свежими антибиотиками, свободной снижение сыворотки.
ПРИМЕЧАНИЕ: Собранные носители могут храниться при 4 градусах Цельсия не более 3 дней. - На 4-й день соберите, во второй раз, средства массовой информации, содержащие лентивирус и фильтр через фильтр 0,45 мкм. Хранить при 4 градусах по Цельсию (не более 3 дней).
- Объедините супернационты вируса со ступеней 1.1.8 и 1.1.9. Сосредоточьтесь на них через центробежные фильтровальные блоки(Таблица материалов)путем центрифуги при 1372 х г в течение 30 минут при 4 градусах Цельсия. Повторяйте этот процесс до тех пор, пока все собранные носители не проходят через столбцы.
ПРИМЕЧАНИЕ: После каждой центрифугации можно собрать 100-200 л концентрированного фильтрата. - Соберите и смешайте концентрированные фильтры в ледяной трубке длиной 15 мл. Хорошо смешайте концентрированные лентивирусы, а затем и аликвот (например, 100 л/т. трубка). Хранить при -80 градусах по Цельсию.
- Лентивирная титрование
ПРИМЕЧАНИЕ: Увековеченная мышь эмбриональных фибробластов (MEFs), выражающих loxP-фланговый аллель зеленого флуоресцентного белка (GFP) используются в этом протоколе для количественной оценки вирусного титра. Тем не менее, любая клеточная линия с аллелем loxP-GFP должна быть подходящей для этого шага.- Культурные ячейки, выражающие локспон-фланговый аллель GFP с DMEM, 10% FBS и 1% пером/стрептоном при 37-C, 5% CO2.
- Плита 2 х 105 ячеек в двух 50 мм скважин 6-колодец пластины.
ПРИМЕЧАНИЕ: Клетки одной скважины будут использоваться для лецивирусной инфекции, в то время как клетки другой будут использоваться в качестве отрицательного контроля. - На следующий день, пополнить клетки с 2 мл DMEM, 10% FBS, и 1% пера / стрептококка 2 ч до лентивирусной инфекции.
- Добавьте 20 зЛ лецивируса CA2Cre-shp53 (объем может варьироваться при необходимости) в lentiviral инфекции хорошо.
- После 3 дней в культуре, определить частоту Cre-индуцированных GFP-положительных клеток потока цитометрии, как показано на рисунке 1. Вымойте клетки фосфат-буфером солевой раствор (PBS), отсоедините путем трипсинизации и соберите клетки центрифугированием при 112 х г.
- Вымойте клетки дважды с ПОМОЩЬю PBS. Наконец, приостановить клетки в 100 Л ПБС. Определить процент Положительных клеток GFP с помощью клеточного анализатора(Таблица материалов).
- Рассчитайте лентивирусный инфекционный/функциональный титр с помощью следующей формулы:

где F частота GFP-положительных клеток и рассчитывается путем вычитания частоты GFP-положительных клеток после инфекции (Fi) от частоты GFP-положительных клеток (фон) до инфекции (Fc), как показано на рисунке 1 (F и Fi-Fc), Cn является число мелок (2 х 105), V является объемом inoculum (мЛ), DF и является фактором разбавления вируса.
ПРИМЕЧАНИЕ: Инфекционная/функциональная концентрация - 2 х 106 ТУ/мл.
2. Интрахеальная интубация лентивирусов у мышей LSL-KRASG12D
ПРИМЕЧАНИЕ: Метод интубации внутричехальной был использован, как описано в опубликованном протоколе Vandivort et al.9. В этом протоколе мыши LSL-KRASG12D мыши на фоне C57BL/6 используются в возрасте от 6 до 8 недель. Домашняя рабочая процедура используется, как описано в Vandivort и др.9. Доска расположена перед экспериментатором в удобном рабочем пространстве (примерно 1 м2).
- Подготовьте спирометр, удалив поршень шприца 1 мл и загрузив в шприц 60 Л Л ПБС.
- Прикрепите кончик катетера 22 G в шприц и отложите в сторону.
- Анестезия мышей путем интраперитонеальной инъекции 1 л/г мыши тела вес кетамина (50 мг/мл) / ксилазин (5 мг/мл) / ацепромазин (1 мг/мл) коктейль. Обеспечить правильное успокоивание мыши с низким уровнем дыхания (1 дыхание каждые 2 с).
- Аспир 20 зл CA2Cre-shp53 lentivirus в пипетатор и отложите в сторону.
- Расположите успокоительное мышь на рабочей доске, зацепив ее верхние резцы в нить доски.
ПРИМЕЧАНИЕ: Тсум мыши должен быть плоским против платформы. - Лента каудальной части грудной полости на платформу для обеспечения выравнивания мыши во время процедуры.
- Отрегулируйте лагусный светотелитель между интенсивностью от 80 до 100% и поместите свет на поверхность кожи в 1,2 см.
- Из-за платформы, вытянуть язык из полости рта мыши с помощью стерильных щипкетов.
- При обеспечении языка, вставьте депрессор в полости рта мыши, а затем освободить язык.
- Расположите гусиную шею на основных стволовых бронхах для освещения трахеи.
ПРИМЕЧАНИЕ: Трахея может быть видна через действие дыхания, вызывая колебания света. - Когда трахея четко просматривается, вставьте подготовленный спирометр (шприц с PBS и катетером) в трахеальную траекторию.
- Снимите депрессор и наблюдать рост и падение PBS в шприце с каждым вдохом.
ПРИМЕЧАНИЕ: Это показатель того, что катетер правильно расположен в трахееею. - Удалите шприц, содержащий PBS, сохраняя катетер внутри трахеи в качестве предыдущего положения.
- Депозит 20 л. CA2Cre-shp53 лентивирус в центре катетера.
- Сохраняя катетер на месте, введите 300 л воздуха в катетер с помощью пустого шприца для обеспечения надлежащего распределения лецивируса в легких.
- Держите катетер на месте и повторно вставьте спирометр в катетер.
ПРИМЕЧАНИЕ: Подъем и падение пузыря PBS обеспечит успех процедуры. - Снимите катетер и ленту. Поместите животное в теплое и сухое место, пока оно не возродится.
3. Ультразвуковая визуализация опухолей легких у мышей
ПРИМЕЧАНИЕ: Ультразвуковая визуализация была проведена после 7 и 18 недель лентивирусной интубации с использованием системы, перечисленной в таблице материалов; однако для анализа можно использовать любую модель.
- За день до визуализации удалите мех из области грудной клетки интубированной мыши.
ПРИМЕЧАНИЕ: Мышь должна быть седативным во время этого шага, поместив их в индукционной камере 3% изолюран и 2L/minute O2. - В день визуализации, настроить рабочее пространство, как показано на рисунке 2. Включите нагревательный насос для ультразвукового геля и монитора температуры.
- Навязайте теплый инкубатор 33 градусов по Цельсию, чтобы поместить мышей в пост-изображение.
- Поместите трехмерный (3D) двигатель(рисунок 2F)на интегрированную железнодорожную систему.
- Убедитесь, что 3D двигатель и система крепления преобразователя надежно на месте.
- Подключите предпочтительный преобразователь (частота: 40 МГц; Рисунок 2E и таблица материалов) для измерения опухоли перпендикулярно 3D-двигателю.
- Начните новое исследование ультразвукового программного обеспечения.
- Выберите Исследование браузера, а затем выбрать новый в нижней части экрана.
- Выберите новое исследование, появится новое окно, которое позволяет добавить название исследования в дополнение к дополнительной информации об исследовании, т.е. дата исследования, имя исследователя и т.д.
- Заполните информацию в названии серии, т.е., Animal ID, Штамм, Вес, Дата рождения и т.д.
- Выберите Done, программа будет меняться на B-режим.
- Поместите отопительную лампу в удобное положение над животной платформой.
- Поместите мышь в индукционную камеру (3,5% изолюран).
ПРИМЕЧАНИЕ: Правильная анестезия подтверждается бессознательность мыши, и медленнее дыхательных скорость около 1 дыхание в 2 секунды. - Когда мышь успокоительно, изменить соединение анестезии машины, которые будут направлены к животному платформы, уменьшить изофруран до 2,5%.
- Поместите мышь на животной платформе в decubitus ventral, с ее полостью рта направлены на анестезию трубки.
- Нанесите смазку на глаза мыши.
- Поместите мышь в decubitus dorsal и ленты руки и ноги твердо на животных платформы.
- Нанесите небольшой слой ультразвукового геля на грудную клетку мыши.
- Нижняя приобретение зонда с помощью высоты управления ручкой коснуться поверхности мыши груди. Расположите зонд таким образом, чтобы сердце мыши было примерно по центру.
- Используйте микро-ручки для получения изображений всей груди, от обеих конечностей, в поперечной ориентации идеально собирает 500 кадров на мышь (количество кадров может варьироваться в зависимости от личного выбора).
- Как только изображение сделано, удалить гель из груди мыши и поместить мышь в теплый инкубатор.
4. 2D Анализ ультразвуковых изображений
- После открытия приобретенные кадры на ультразвуковом программном обеспечении, сканировать кадры на опухоли.
- Для небольших опухолей, искривляющих, подсчитайте количество B-линий периодически каждые 10 кадров для полной длины 500 рам приобретенных.
Таким образом, B-линии учитываются в общей сложности 50 изображений, каждое изображение разделено на 10 кадров. B-линии характеризуются продольными белыми прямыми линиями, полностью пересекающими экран. - Для 2D измерений больших опухолей выберите линейный инструмент и измерьте ширину и длину присутствуют опухоли.
- Для расчета объема опухолей используйте следующую формулу:
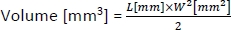
где L и W являются длина и ширина опухоли, соответственно.
Результаты
После получения лентивирусного инфекционного титра в размере 2 х 106 ТУ/мл(рисунок 1),лентивирус Ca2Cre-shp53 был внутричечеально введен, когда мыши LSL-KRAS G12D достигли соответствующего возраста (6-8 недель)9. Ультразвуковая томография была проведена после 7 недел...
Обсуждение
Мы демонстрируем метод, который может оценить рост опухоли легких в Cre-индуцируемой модели мыши LSL-KRAS G12D с помощью ультразвука. Этот метод может быть использован для оценки влияния фармакологических ингибиторов на рост опухоли легких. Он также может быть использован для сравнения роста...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим доктора И. Верму за вектор лентивирного Ca2Cre-shp53. Работа была поддержана за счет средств Канадских институтов исследований в области здравоохранения (CIHR MOP 137113) в АЕК.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.45 μm Acrodisc Syringe Filters | Pall Corporation | PN 4614 | |
| 100-mm Cell Cultre Plate | CELLSTAR | 664 160 | |
| 6-well Cell Culture Plate | CELLSTAR | 657 160 | |
| Amicon Ultra - 15 Centrifugal Filter Units | Merck Millipore Ltd. | UFC910024 | |
| BD LSR-Fortessa | BD Biosciences | 649225B 3024 | |
| CA2Cre-shp53 lentiviral vector | From Dr. I Verma Laboratory | ||
| DMEM | Multicell | 319-005-CL | |
| FBS | Multicell | 80450 | |
| LSL-KRASG12D mouse | JAX Mice | 8179 | |
| MX550S; Centre Transmit: 40 MHz | FUJIFILM VisualSonics | 51070 | |
| OptiMEM | gibco | 11058-021 | |
| Pen/strep | Multicell | 450-201-EL | |
| pMD2.G | Addgene | 12259 | |
| PsPAX2 | Addgene | 12260 | |
| VEVO-3100 | FUJIFILM VisualSonics | 51072-50 |
Ссылки
- Eisenstein, M. Personalized medicine: Special treatment. Nature. 513, 8 (2014).
- Karachaliou, N., et al. KRAS mutations in lung cancer. Clinical Lung Cancer. 14 (3), 205-214 (2013).
- Jackson, E. L., et al. Analysis of lung tumor initiation and progression using conditional expression of oncogenic K-ras. Genes & Development. 15 (24), 3243-3248 (2001).
- DuPage, M., Dooley, A. L., Jacks, T. Conditional mouse lung cancer models using adenoviral or lentiviral delivery of Cre recombinase. Nature Protocol. 4 (7), 1064-1072 (2009).
- Chen, J., Lecuona, E., Briva, A., Welch, L. C., Sznajder, J. I. Carbonic anhydrase II and alveolar fluid reabsorption during hypercapnia. American Journal of Respiratory Cell and Molecular Biology. 38 (1), 32-37 (2008).
- Xia, Y., et al. Reduced cell proliferation by IKK2 depletion in a mouse lung-cancer model. Nature Cell Biology. 17 (4), 532 (2015).
- Demi, L., et al. Determination of a potential quantitative measure of the state of the lung using lung ultrasound spectroscopy. Scientific Reports. 7, 12746 (2017).
- Mohanty, K., et al. Characterization of the Lung Parenchyma Using Ultrasound Multiple Scattering. Ultrasound in Medicine and Biology. 43, 993-1003 (2017).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771 (2016).
- Saraogi, A. Lung ultrasound: Present and future. Lung India. 32 (3), 250-257 (2015).
- Gargani, L., Volpicelli, G. How I do it: lung ultrasound. Cardiovascular Ultrasound. 12, 25 (2014).
- Soldati, G., et al. On the Physical Basis of Pulmonary Sonographic Interstitial Syndrome. Journal of Ultrasound in Medicine. 35 (10), 2975 (2016).
- Raes, F., et al. High-Resolution Ultrasound and Photoacoustic Imaging of Orthotopic Lung Cancer in Mice: New Perspectives for Onco-Pharmacology. PLoS One. 11 (4), 15 (2016).
- Lakshman, M., Needles, A. Screening and quantification of the tumor microenvironment with micro-ultrasound and photoacoustic imaging. Nature Methods. 12 (4), 372 (2015).
- Chichra, A., Makaryus, M., Chaudhri, P., Narasimhan, M. Ultrasound for the Pulmonary Consultant. Clinical Medicine Insights: Circulatory Respiratory and Pulmonary Medicine. 10, 9 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены