Method Article
تطبيق غشاء وجدار الخلية الاصباغ الفلورية الانتقائية لتصوير الخلايا الحية من الفطريات الخيطية
In This Article
Summary
الاصباغ الفلورية الحيوية هي أدوات أساسيه لتحليلات التصوير بالخلايا الحية في بيولوجيا الخلايا الفطرية الحديثة. هذه الورقة تفاصيل تطبيق الاصباغ الفلورية الثابتة والمعروفة لتتبع ديناميات غشاء البلازما ، اندو-/الندرات والخلايا الجدارية تخلق في الفطريات الخيطية.
Abstract
تطبيق الغشاء وجدار الخلية الاصباغ الفلورية الانتقائية لتحليلات التصوير الخلية الحية من ديناميات عضيه في الخلايا الفطرية بدات قبل عقدين من الزمن ، ومنذ ذلك الحين لا تزال تسهم إلى حد كبير في فهمنا للفطريات الفطرية نمط الحياه. تقدم هذه الورقة دليلا عمليا لاستخدام اثنين من الاصباغ الغشاء FM 1-43 fm 4-64 والبقع جدار الخلية الاربعه Calcofluor الأبيض M2R ، سولوفينيل فلافون 7GFE 500 ، Pontamine سريع القرمزي 48 والكونغو الأحمر. وينصب التركيز علي تطبيق الجرعات المنخفضة الخاصة بهم للتاكد من التلطيخ الخالي من الحرفية ، وخصائص التصوير المشترك ، وتقييمهم الكمي. الطرق المعروضة قابله للتطبيق علي جميع العينات الفطرية الخيطية التي يمكن اعدادها بالطرق الموصوفة. ويمكن ان تكون نهوج التلطيخ الاساسيه بمثابه نقاط انطلاق للتكيف مع الأنواع التي قد تتطلب ظروفا مختلفه للزراعة. أولا ، يتم استعراض الخصائص البيوفيزيائية والبيوكيميائية لان فهمها ضروري لاستخدام هذه الاصباغ كبقع فلورية حيوية حقا. ثانيا ، يتم عرض البروتوكولات خطوه بخطوه التي بالتفصيل اعداد مختلف أنواع العينات الفطرية للتصوير بالخلايا الحية الفلورسنت. وأخيرا ، توضح التجارب التي أجريت علي سبيل المثال النهج المختلفة لما يلي: (1) تحديد العيوب في التنظيم المكاني-الزماني لندره المحببات في المسوخ الجينية ، (2) تميز نسبيا المشتركة والمتميزة لتوطين البروتينات المستهدفة المسمية GFP في مسار الخلايا العصبية ، (3) تحديد العيوب جدار الخلية الخلقية في متحولة وراثيه ، و (4) رصد التكوين الحيوي جدار الخلية في الوقت الحقيقي.
Introduction
قبل عشرين عاما ، كانت الطريقة التي خوطي فيها الفطريات الجزيئية الكامنة والبيولوجيا الاساسيه الخلية التي يمكن تصورها في الفطريات الخيطية ثوره من تطبيق الغشاء الفلوري الانتقائي فاي ماو صبغ FM 4-641. فيما بعد, الفائدة من ال [كيتين-كدينغ] صبغ [كلكوفلور] ابيض كعلامة حيوية فلورية من فطريه خليه جدار ديناميات كان حققت2. ومنذ ذلك الحين ، أصبحت كل من الاصباغ والمتغيرات منها جزءا لا يتجزا من التحليلات التصويرية للخلايا الحية في الفطريات ، والاستمرار في تقديم رؤى غير مسبوقة في نمط الحياة الفطرية الخيطية. هذه الورقة تفاصيل تطبيق الاصباغ الفلورية الثابتة والمعروفة لتتبع ديناميات غشاء البلازما ، اندو-وكثرة والخلايا الجدارية في الفطريات الخيطية. اختبارات تتبع الكثرة تسمح بتناول العديد من الاسئله البيولوجية المتعلقة بالدراسة العامة لندره الخلايا التي يجب معالجتها3. لهذا ، يتم تسجيل التعريب والسرعة والخلافة من المقصورات الملونة علي أضافه صبغه FM بواسطة المجهر الزمني الفاصل والكمية مقارنه بين سلالات الفطرية اختبار4. يرسم جدار الخلية الاصباغ الحدود الخارجية للخلية والسماح بتتبع الاحداث الموفوجينيه ، بما في ذلك الاستقطاب خوطي tip النمو2، خوطي المتفرعة5، خوطي فيوجن6،7 وتشكيل الحاجز8. وعلاوة علي ذلك ، فانها تسهل القياس الكمي لترسب الجدار الخلوي الموضعي وتحديد العيوب اثناء التكوين الحيوي لجدار الخلية9. لان المعرفة التفصيلية للخصائص البيوكيميائية والفيزيائية الحيوية لأي علامة الفلورسنت هو شرط أساسي لنجاحها في تطبيق المجرية ، وتلخص هذه الخصائص لأول مره لصبغات سته وارده في هذه المقالة.
غشاء الاصباغ الانتقائية
FM (فاي ماو) الاصباغ styryl هي جزيئات البرمائيات الصغيرة التي لا يمكن ان تمر من خلال المنتسبين ولكن بعكس النشرة الخارجية من الدهن الاغشيه البيولوجية10. فهي تقريبا غير فلورية في محلول مائي ، ولكن تصبح الفلورسنت بشكل مكثف علي التكامل غشاء البلازما ، وتوليد ممتازة اشاره إلى الضوضاء (S/N)-النسب11. هذه الخصائص تجعلها مناسبه بشكل مثالي لتصور غشاء البلازما وديناميكيات عضيه داخل الخلايا ، بما في ذلك تتبع اندو-وكثرة المحببات12. الأخضر-الفلورسنت FM 1-43 والأحمر-الفلورسنت FM 4-64 هي الأكثر استخداما علي نطاق واسع علامات غشاء الفلورسنت لهذه الأغراض. المشبكان C4 و سينابتوريد C2 هما جزيئات عامه من الموردين البديلة التي يمكن استخدامها بالتبادل بدلا من FM 1-43 و FM 4-64 ، علي التوالي.
الاصباغ styryl تتالف من ثلاثه المناطق الهيكلية الرئيسية: (1) الذيل محبه للدهون الذي يسهل إدخال الصبغة في الطبقة الدهنية ، (2) الاساسيه فلوكوفيري التي تحدد الخصائص الطيفية للصبغة وتتكون من حلقتين العطرية متصلة من قبل واحد إلى ثلاثه سندات مزدوجة ، و (3) رئيس هيدروفيلييك مشحونة إيجابيا يمنع الادراج الكامل وتخلل الصبغة من خلال الغشاء (الشكل 1a).
ويعد الذيل محبه للدهون ، واعلي هو هيدروفوبيسيتي صبغ التالي تقارب ملزمه لغشاء ، ولكن الأقل هو الذوبان في الماء والغشاء معدل دي تلطيخ. التالي ، مختلف المتغيرات FM صبغ تنتج ديناميات تلطيخ مختلفه وأنماط. هيدروفوبيسيتي اعلي من 1-43 FM الذيل C4 يوفر اشاره فلوري اقوي وأكثر استقرارا في اغشيه البلازما والعضوية الداخلية أسرع من أقصر C2-الذيل FM 4-64, عند تطبيقها في تركيزات متساوي (الشكل 2).
والاهم من ذلك ، فان معدلات الاقتران/التفكك الثابتة والعالية لكل من صبغات FM11 مع متوسط أوقات الاستبقاء من 1 إلى 6 ثانيه لكل جزيء صبغ فردي13 تقلل من فرص التعطيل الموضعي لوظيفة الغشاء ، علي سبيل المثال ، من خلال تعديل سيوله الغشاء أو التفاعل الدائم القسري للبروتينات. هذا هو علي الأرجح السبب الرئيسي لماذا يمكن استخدام هذه الجزيئات والاصباغ الحيوية. ومع ذلك, تركيزات صبغ fm أعلاه 50 μM هي سامه للفطريات والخلايا النباتية2,14, والادله من قبل-2 التبغ بروتوبليازيات يشير إلى ان أكثر من 20 ميكرومتر fm صبغ يؤدي إلى تشبع غشاء البلازما14. التالي ، فانه من المستحسن عدم تجاوز هذا الحد ، وخاصه نظرا لحقيقة ان التصوير الممتاز قد تحقق مع اقل من 2-5 μM15،16.
ومن الجدير بالاهتمام ان الخواص الطيفية لاصباغ FM تختلف اختلافا كبيرا تبعا للبيئة المجهرية الغشائية الخاصة (التي تم استعراضها14). عموما ، تختلف أطياف الاثاره والانبعاثات من الاصباغ FM في حلول المذيبات النقية (كما هو منصوص عليه عاده في معلومات المنتج) بشكل كبير من ذلك في البيئات الخلوية ويمكن ، في معظم الحالات ، لا يمكن استشارتها مباشره لاختيار إعدادات التصوير الخلية الحية. الاثاره/الانبعاثات ماكسيما من FM 1-43 و FM 4-64 ، علي سبيل المثال ، تصبح الأزرق-تحولت من قبل 37/46 nm و 43/64 nm ، علي التوالي ، عندما ملزمه إلى الاغشيه الفطرية بالمقارنة مع حلولها في الميثانول (الجدول 1).
أساسيات كسر الأرض لاستخدام fm 4-64 و fm 1-43 لتتبع غشاء البلازما, اندو-/الندرات وديناميكيات عضيه, بما في ذلك سبيزنكربر والميتوكوندريا, وقد تم بالفعل موثقه بشكل شامل لمجموعه واسعه من الأنواع الفطرية الخيطية سابقا2,4,17,18,19. ويصور إعدادات التصوير الموصي بها لكل من الاصباغ FM التي تعمل في مختلف الأنواع الفطرية الخيطية في الشكل 1B. غير ان القيود التقنية المفروضة علي المعدات المتاحة أو الظروف الخلوية والتجريبية الخاصة ، مثل متوسط الثقافة أو درجه الحموضة أو درجات الحرارة ، قد تتطلب بعض التعديلات. لحسن الحظ ، الاصباغ FM تعمل علي نطاق واسع الطيفية ، ويتم تحقيق نتائج جيده جدا التصوير عن طريق مثيره FM 1-43 مع 514 nm أو FM 4-64 مع 488 nm. التالي ، يجب تحديد إعدادات التصوير الأمثل بشكل فردي لكل نوع نموذج والتطبيق المقصود.
التحول الكبير في ستوك من أكثر من 135 nm من FM 4-64 يسمح ممتازة ، والتصوير المشترك في وقت واحد مع الفلوروبيورس ينبعث منها الضوء الأخضر. وكثيرا ما يتم استغلال هذا لتقييم ديناميات التعريب داخل الخلايا من البروتين الفلوري الأخضر (gfp)-المسمي البروتينات الانصهار بالنسبة لغشاء البلازما والمسار اندوسيتيك9,20.
خليه الاصباغ الانتقائي الجدار
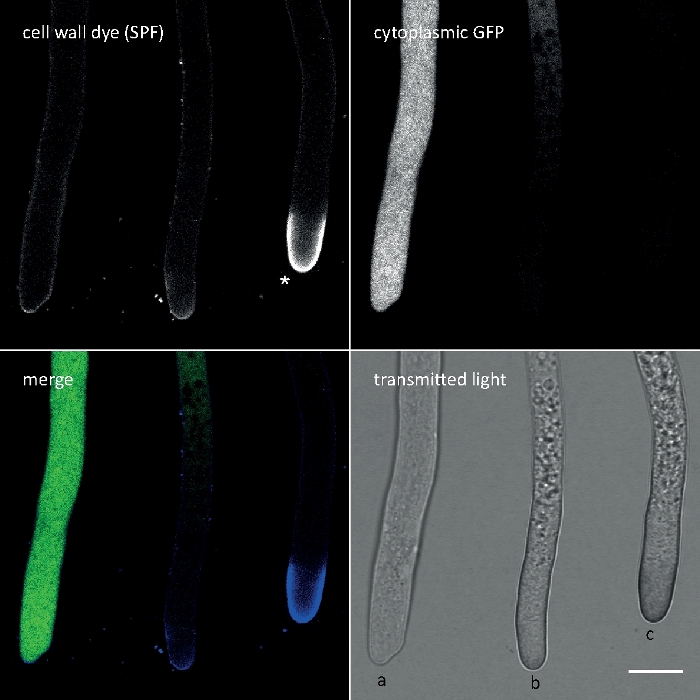
Calcofluor الأبيض M2R (CFW) ، وتسويقها أيضا باسم منير الفلورسنت 28 ، هو علي الأرجح الصبغة الفلورية الأكثر شهره المستخدمة لوصمه عار جدران الخلايا من البكتيريا والفطريات والطحالب والنباتات العالية والحشرات. تستخدم في البداية كعامل تبييض الضوئية في صناعه الورق والنسيج والمنظفات ، وقد تحققت فوائدها للتشخيص السريري للعدوى الفطرية في وقت مبكر في21،22. لان [كفو] [اينتركليتس] بشكل لا رجعه في ال [شتين] [تشتين] سلسله يزعج هو طبيعيه [تشتين] [ميكروفيريل] تجميع اثناء خليه جدار [بيوجينيسيس] بذلك يلد خليه جدار إجهاد23. هذا بدوره بتشغيل اليه إصلاح تلف جدار الخلية مما يؤدي إلى ارتفاع محليا ترسب جدار الخلية نتيجة غلوكان والتين synthase تفعيل24,25. هذه الظاهرة يمكن ان تحدث مع اي صبغه تعمل بواسطة ملزمه بشكل ثابت إلى البوليمرات جدار الخلية ، هو تركيز الاعتماد وهو الأكثر وضوحا في خوطي نصائح التي تمثل الأكثر غزارة في النمو التالي الأجزاء الأكثر حساسية من ميسليوم (الشكل 3). وقد تم مؤخرا تقديم ملخص شامل للآلات الجزيئية التي تستجيب للاضرار بجدار الخلية26.
يمكن ان يؤدي الصبغة الزائدة في تركيبه مع السمية الضوئية إلى تحلل الخلايا السريعة من مقصورات خوطي (فيلم 1). ومع ذلك, زيادة الحساسية لتركيزات صبغ التي هي "حيوية" في نوع البرية يمكن استغلالها لتحديد العيوب في التركيب الحيوي جدار الخلية من الجينات فقدان الوظيفة المسوخ9. ل cfw والكونغو الأحمر (CR) ، واخر تلوين المنسوجات المعروف أيضا باسم الأحمر المباشر 28 والعاملين بوصفها α-وبتا-كيتين-محدده جدار الخلية وصمه عار للفطريات والحشرات27،28، وقد تم تحديد تركيزات عتبه التي تحفز بقوة synthases مع > 60 μm cfw و > 70 μm CR ، علي التوالي ، في حين ان تركيزات <15 μM من صبغ اما لا يغير أو يمنع نمو الفطرية29،30،31. وضع هيكي وآخرون هذا التركيز عتبه CFW في 25 μM2. ولذلك ، فانه من المستحسن استخدام تركيزات صبغ ≤ 5 μM لاستبعاد الآثار المرتبطة بالإجهاد وضمان استخدام هذه الجزيئات كما حقا "الاصباغ الفلورية الحيوية"2،32. ينطبق هذا أيضا علي سولوفينيل فلافون 7GFE 500 (SPF) و Pontamine Fast القرمزي 4B (PFS) ، مرادفا ل86 الأصفر المباشر والأحمر المباشر 23 ، علي التوالي ، واثنين من الاصباغ الأخرى الخلية المفيدة الجدار الذي تم الإبلاغ عن تطبيق للفطريات للمرة الاولي أكثر من عقد من الزمان33. ولكن علي الرغم من خصائصها الطيفية ملحوظ34،35، واستخدام كل من الاصباغ منذ ذلك الحين كان محدودا جدا36،37. كما هو مبين سابقا ل 1.5 μM CFW2, 2 μm SPF كافيه لحل ديناميات جدار الخلية في ظل الظروف الاصليه مع دقه عاليه جدا الزمنيه (فيلم 2). يمكن الحصول علي نفس النتائج مع 2 μM CR أو PFS.
معا ، تتكون هذه الاصباغ الاربعه ، CFW ، SPF ، PFS و CR ، من مجموعه من علامات الفلورسنت المحددة بجدار الخلية والتي تغطي تقريبا الطيف الضوئي الكامل للانبعاثات المرئية (400 – 700 نانومتر) المستخدم في المجاهر الفلورية الحديثة (الشكل 4). الزيادة الكبيرة في كثافة مضان علي الربط إلى البوليمرات جدار الخلية المتاصله في كل أربعه ويولد ممتازة S/N-النسب. هذا بدوره يسمح للحفاظ علي تركيزات صبغ والاثاره كثافة الضوء منخفضه جدا ويسمح لأداء الخلية تلطيخ الجدار كما "جرعه منخفضه" الحية الخلية تقنيه التصوير2. لان هذه الاصباغ جدار الخلية هي غشاء البلازما غير منفذه ، فانها تعمل في وقت واحد كما البقع الحية/الميتة. وتجدر الاشاره إلى انه نظرا لأطيافها الضوئية الواسعة للغاية ، فان بعض القيود المتعلقة بخصائص التصوير المشترك لمركب CFW وعامل الوقاية من الشمس مع الفلوروبيورس الأخرى تحتاج إلى النظر فيها بعناية.
Protocol
1. اعداد العينات الفطرية
- الفطرية قبل الثقافات
- تطعيم السلالة المطلوبة علي متوسط أجار الصلبة المناسبة ، مثل البطاطا سكر العنب أجار (المساعد الشخصي الرقمي) ل تريهوديرما تروفيرايد أو الحد الأدنى المتوسطة فوغل (VMM) ل عصيباء crassa. أضافه علامة تحديد مناسبه عند العمل مع سلالات التحويلية.
- احتضان ما قبل الثقافة في درجه الحرارة المثلي للكائن الحي. علي سبيل المثال ، t. ضفيرايد في 25 درجه مئوية و n. مبوغه سميكه في 30 درجه مئوية ، و 12 h/12 h الضوء/الظلام دورات حتى وقد وضعت ميسليوم الرياضية ولكن لم تصل بعد إلى حافه لوحه. علي معيار الحجم بيتري طبق (9.2 cm Ø) ، وهذا ياخذ البرية من نوع t. النمط في 4-6 أيام المتوسط ، في حين ان نوع n. مبوغه سميكه البرية تصل إلى هذه المرحلة بعد 3-4 أيام في المتوسط.
- زراعه المستعمرات الفطرية
- باستخدام مشرط معقمه ، وقطع صغيره 3 مم × 3 ملم كتله أجار تحمل غير الرياضية ميسليوم من حافه مستعمره من ما قبل الثقافة.
- ضع كتله أجار في مركز لوحه متوسطه صلبه جديده لتطعيم الثقافة التجريبية.
- احتضان الثقافة التجريبية وفقا للمرحلة التنموية المراد التحقيق فيها. علي سبيل المثال ، يتطلب النوع البرية t. ضموري 20-22 ساعة في 25 درجه مئوية في الظلام لتطوير مستعمرات من حوالي 2 سم قطرها علي المساعد الشخصي الرقمي ، في حين ان النوع البرية n. مبوغه سميكه تصل إلى أقطار مستعمره من حوالي 4 سم بعد 14-16 ح من الحضانة في 30 درجه مئوية في الظلام علي VMM.
ملاحظه: الحضانة في الظلام يمنع تشكيل الاصباغ التي قد إدخال التلقائي. من أجل القضاء علي مضان الخلفية المتوسطة من الثقافة التجريبية ، استبدل أجار مع 1.5 ٪ ث/ف من عامل ترسيخ شفافة (انظر جدول المواد) ، وأي متوسطه معقده مع متوسط الحد الأدنى المحدد.
- زراعه الثقافات الصلبة الجرجم
- استخدام 5 مل من محلول الملح الفسيولوجية المعقمة (0.9 ٪ ث/الخامس كلوريد الصوديوم) لحصاد جراثيم كونديل من لوحه ما قبل الثقافة وجمع الناتجة التعليق بوغ في 15 مل المسمار أنبوب كاب.
- مزيج من التعليق بوغ بشكل جيد من قبل vortexing قويه وبعد ذلك تصفيته أكثر من 1 سم × 5 سم قطاع من النسيج فلتر معقمه (انظر جدول المواد) محشوه بخفه في 1 مل غيض ماصه (علي حد سواء تجميعها وتعقيمها مسبقا) في أنبوب معقمه جديده.
- تحديد كثافة بوغ مع غرفه عد خليه واعداد 1 × 107 خلايا/مل تعليق بوغ مع محلول الملح الفسيولوجية.
ملاحظه: يمكن الاحتفاظ بتعليق بوغ في 4 درجه مئوية لمده تصل إلى أسبوعين. - اعداد طبق بيتري الحجم القياسي (9.2 سم Ø) مع 20 مل من المتوسطة الصلبة وأضافه 15-20 الخرز الزجاجي معقمه (3 مم Ø) علي القمه.
- ماصه 200 μL من تعليق بوغ علي صفيحه متوسطه وتوزيع الخلايا بالتساوي عبر لوحه كامله بواسطة اهتزاز لطيف. جمع الخرز الزجاجي في الكاس مع 70 ٪ الايثانول لأعاده استخدامها.
- احتضان الثقافة التجريبية وفقا للمرحلة التنموية المراد التحقيق فيها. علي سبيل المثال ، ونوع البرية t. يتطلب 5-6 ح في 25 درجه مئوية في الظلام لتطوير كونيديال germlings علي المساعد الشخصي الرقمي ، في حين ان نوع n. مبوغه سميكه البرية يتطور كونيديال germlings بعد 3-4 h من الحضانة في 30 درجه مئوية في الظلام علي VMM.
ملاحظه: من أجل القضاء علي اي مضان الخلفية المتوسطة من الثقافة التجريبية ، استبدل أجار مع 1.5 ٪ ث/ف من عامل ترسيخ شفافة ، وأي متوسطه معقده مع متوسطه الحد الأدنى المحدد.
- زراعه من [غرملينغ] سائله ثقافات
- أملا 190 μL من وسط الثقافة السائلة في كل بئر من الشريحة الصغيرة التي تحتوي علي 8 ابار.
- أضافه 10 μL من 1 × 107 الخلايا/mL محلول بوغ (أعدت في الخطوات 1-4-1 – 1.4.3) وتخلط بلطف الأنابيب صعودا وهبوطا بضع مرات. العدد الإجمالي الناتج من الخلايا هو 1 × 105 لكل بئر.
- احتضان الثقافة التجريبية وفقا للمرحلة التنموية المراد التحقيق فيها. علي سبيل المثال ، يتطلب نوع البرية t. ضموري 5-6 ح في 25 درجه مئوية في الظلام لتطوير كونيديال germlings في مرق البطاطا سكر العنب (PDB) ، في حين ان نوع البرية n. مبوغه سميكه يتطور كونيديال germlings بعد 3-4 h من الحضانة في 30 درجه مئوية في الظلام في VMM السائل.
2. اعداد حلول صبغ العمل
- لضمان الذوبان الكامل لكل صبغه ، واعداد حلول الأوراق المالية 2 مم في سلفوكسيد ثنائي الميثيل (dmso) عن طريق أضافه المبلغ المناسب (انظر الأوزان الدقيقة في الجدول 1) إلى 1 مل من 100 ٪ dmso وتخلط جيدا من قبل vortexing.
تحذير: تاكد من أخذ DMSO من زجاجه مختومه الحاجز. يجب ان يكون سائل شفاف واضح. عند ملامسه الهواء ، يتحول DMSO إلى اللون البني — ربما بسبب أكسده الشوائب النزره — وقد يؤثر سلبا علي نمو الخلايا أو تلطيخ الصبغة. - تصفيه تعقيم الحل الأسهم من خلال فلتر غشاء حقنه 0.2 μm في أنبوب رد فعل معقمه جديده 1.5 mL. لتقليل صبغ التبييض ، التفاف الأنبوب في رقائق ألومنيوم.
ملاحظه: الحل الأسهم صبغ يمكن ان اقتبس إلى احجام أصغر لتجنب ذوبان/تجميد دورات ، وابقي في 4 درجه مئوية لعده أشهر. - اعداد 20 μM محلول مائي صبغ العمل عن طريق حل 2 μL من محلول الأسهم صبغ في 198 μL من الماء المقطر معقمه في أنبوب رد فعل معقمه جديده 1.5 mL. لتقليل صبغ التبييض ، التفاف الأنبوب في رقائق ألومنيوم.
ملاحظه: يجب اعداد الحل صبغ العمل الطازج في يوم التجربة. - اثناء تركيب العينة (انظر القسم 3) ، سيكون محلول صبغ العمل المخفف 1:10 ، مما ادي إلى تركيز الصبغة النهائية من 2 μM و 0.1 ٪ ث/ف تركيز DMSO النهائي.
ملاحظه: اختيار عوامل التخفيف المختلفة ببساطه عن طريق تغيير نسبه حجم بين محلول صبغ العمل والسائل المتصاعد ، يسمح للتكيف بسهوله تركيز الصبغة النهائية المطلوبة.
تحذير: لمنع الآثار غير المرغوب فيها بسبب الصبغة أو سميه DMSO ، يجب ان لا يقع عامل التخفيف تحت 1:4 لنتيجة التركيزات النهائية القصوى من صبغ 5 μM و 0.4 ٪ ث/ف DMSO. تركيزات الصبغة العليا سوف تشبع بسرعة النظام ومنع التحديد الكمي اشاره موثوق بها ، في حين ان أكثر من 0.5 ٪ ث/ف (≥ 62.5 mM) DMSO يمكن ان يضعف تطوير الخلايا38.
3. اعداد عينه لمجهر
- تحميل عينات من مستعمرات فطريه (الخطوة 1.2) أو الثقافات germling الصلبة (الخطوة 1.3) بواسطة طريقه كتله أجار المقلوب.
- الحفاظ علي نظيفه 24 مم × 60 مم الغطاء الزجاجي زلة (#1 = 0.13-0.16 مم سمك) جاهزه وأضافه 18 μL من متوسط السائل الحد الأدنى (VMM أو مسنومكس) أو محلول الملح الفسيولوجية علي المركز.
- أضافه 2 μL من 20 μM صبغ حل العمل إلى 18 μL من السائل وتخلط جيدا عن طريق التنضيد صعودا وهبوطا عده مرات ، مع تجنب إنتاج فقاعات الهواء.
ملاحظه: عند العمل مع عده عينات ، فانه من المستحسن لاعداد مزيج رئيسي من محلول صبغ السائل للجميع من أجل ضمان المساواة في تركيز صبغ طوال التجربة. - مع مشرط نظيفه ، وقطع 15 ملم × 15 ملم عينه من محيط المستعمرة أو الثقافة الصلبة germling ووضعه عموديا بجانب قطره المتوسطة علي زلة الغطاء.
- باستخدام مشرط لدعم الحافة العلوية من كتله واصبع لعقد الجانب الخلفي من كتله في مكان ، وخفض ببطء الجانب تحمل ميسليوم أو germlings علي السائل. العينة جاهزه الآن للانتقال إلى مرحله المجهر.
تنبيه: من الضروري القيام بذلك ببطء وبعناية فائقه من أجل تقليل الضغط الميكانيكي علي الخلايا وتجنب فقاعات الهواء المحاصرة بين العينة وزلة الغطاء.
- جبل الثقافات germling السائل من الخطوة 1.4.
ملاحظه: الأكثر ملائمة ، والثقافات germling السائل في الشرائح الصغيرة البئر التي يمكن نقلها مباشره ومزيد من التلاعب في مرحله المجهر.- أضافه 22 μL من صبغ حل العمل إلى 200 μL من السائل المتوسطة ليؤدي إلى تركيزات النهائية القياسية من 2 μM صبغ و 0.1 ٪ ث/v DMSO.
ملاحظه: الثقافات germling السائل لديها ميزه كبيره ان الاصباغ الفلورية (أو غيرها من المواد الكيميائية ، مثل مثبطات) يمكن ان تضاف في اي نقطه الوقت المطلوب من التجربة ، وأيضا اثناء التسجيل. في هذه الحالة ، يجب توخي الحذر الخاص لأداره قطرات السائل ببطء شديد من أجل عدم إزعاج الخلايا. الاهتزازات النظام والحركة البراونية قد يعرض بالفعل بعض حركه الخلية.
- أضافه 22 μL من صبغ حل العمل إلى 200 μL من السائل المتوسطة ليؤدي إلى تركيزات النهائية القياسية من 2 μM صبغ و 0.1 ٪ ث/v DMSO.
4. المجهرية الخلية الحية
- اضبط إعدادات اكتساب الصور الاساسيه. إعدادات الحصول علي صوره التالية تسمح للتقاط ديناميات تلطيخ في الفردية هيبوهاي وتنطبق علي كل من المقايسات التالية
- تطبيق 5-10 ٪ قوه الليزر من 20 ٪ من قوه الإنتاج الكامل للجهاز.
- استخدام خطه Apo 60x-63x الجلسرين أو المياه الغمر الهدف مع فتحه رقميه عاليه ≥ 1.2.
- تقييد منطقه الحصول علي الصورة إلى الخطوط العريضة لل هيبهاي عن طريق تعيين حجم صوره 1024 x 256 بكسل وباستخدام عامل التكبير البصري من 2 – 3.
- استخدام المسح ثنائي الاتجاه مع 400 هرتز. ضبط حجم الثقب إلى وحده مهواه 1.
- تعيين كسب كاشف الأكثر حساسية إلى 100 ٪.
- لتسجيل لفات الوقت ، بدء اكتساب الصورة مع اطار واحد كل 15 ثانيه للسماح الدقة الزمنيه معقولة دون إنتاج صبغ التبييض أو الإجهاد الصورة.
- للتسجيل الثلاثي الابعاد ، اضبط الحد المكاني العلوي والسفلي علي حدود الأجزاء البصرية للمساحة والمساحة 1 ميكرومتر باستثناء السماح بالدقة المكانية المعقولة.
ملاحظه: نظرا للنمو السريع لل "هيهاي" ، غالبا ما تم التضحية بالدقة المكانية العالية في المحور Z للحصول علي دقه زمنيه عاليه في محور X/Y أو العكس. فقط حديثه جدا المجهر الليزر المسح المجاهر سريعة بما يكفي لتلبيه كل المطالب.
- اختبارات امتصاص الندرة
- استشر الشكل 1 والجدول 1 لتحديد أفضل إعدادات الاثاره/الانبعاثات ل1-43 fm و/أو 4-64 fm المتاحة علي نظام المجهر وضبط وفقا لذلك.
ملاحظه: مع تركيز 2 μM الموصي بها ، دمج صبغه FM في غشاء البلازما هو لحظه في الخلايا السليمة الطبيعية. عاده ما تكتمل العملية برمتها من تلطيخ غشاء البلازما الاولي لصبغ المظهر في فجوات أنبوبي في غضون 30 – 45 دقيقه في درجه حرارة الغرفة. زيادة تركيز الصبغة FM يزيد S/N-نسبه التالي تنتج صور التباين اعلي أسرع. ومع ذلك ، فانه يسرع أيضا عمليه وضع العلامات مما يجعل من الصعب التفريق بين التعاقب الزمني لتلطيخ عضيه. - بدء تسجيل الصورة باستخدام إعدادات الحصول علي الصورة الاساسيه الموصي بها أعلاه وتقييم النتائج.
- تحسين إعدادات الحصول علي الصورة إلى الدقة المكانية والزمانيه المطلوبة للتقاط الجانب من غشاء البلازما أو ديناميات الندرة التي تركز عليها التجربة.
- علي سبيل المثال ، من أجل التقاط ديناميات سريعة جدا في X/Y ، إنقاص حجم الصورة الإجمالي ، صوره واحده فقط المستوي البؤري وزيادة معدل المسح إلى 1 اطارا في الثانية. للحصول علي دقه اعلي في المحور Z ، قلل الدقة في X/Y ، وقلل حجم الصورة وقلل المسافة بين الأقسام البصرية إلى 0.5 ميكرومتر.
- استشر الشكل 1 والجدول 1 لتحديد أفضل إعدادات الاثاره/الانبعاثات ل1-43 fm و/أو 4-64 fm المتاحة علي نظام المجهر وضبط وفقا لذلك.
- ديناميات جدار الخلية
- استشر الشكل 4 والجدول 1 لتحديد أفضل إعدادات الاثاره/الانبعاثات لصبغه جدار الخلية التطبيقية المتاحة علي نظام المجهر والضبط وفقا لذلك.
ملاحظه: نظرا لأطياف الانبعاثات الواسعة ، فان CFW و SPF ليست مناسبه تماما للتصوير المشترك المتزامن مع الفلوروبيورس الأخرى ، في الغالب GFP. بعض القيود حتى تنطبق علي نهج التصوير متتابعة مع هذه الاصباغ ، التالي يجب ان يكون الأمثل بشكل فردي. - بدء تسجيل الصورة باستخدام إعدادات الحصول علي الصورة الاساسيه الموصي بها أعلاه وتقييم النتائج.
ملاحظه: مع تركيز 2 μM الموصي بها ، وإدماج صبغه في جدار الخلية ليست بالضرورة لحظه ولكن بسرعة معقولة. العملية برمتها من تشكيل الحاجز ، علي سبيل المثال ، يستغرق في المتوسط حوالي 5-7 دقيقه في درجه حرارة الغرفة20. زيادة تركيز صبغ جدار الخلية يزيد S/N-نسبه التالي تنتج صور التباين اعلي أسرع. ومع ذلك ، فانه أيضا بسرعة يدخل التحف بسبب إصلاح الضرر جدار الخلية المستحثة. - تحسين إعدادات الحصول علي الصورة إلى الدقة المكانية والزمانيه المطلوبة للتقاط الجانب من الجدار الخلوي الذي تركز التجربة عليه ، كما هو مبين في القسم 4-2.
- استشر الشكل 4 والجدول 1 لتحديد أفضل إعدادات الاثاره/الانبعاثات لصبغه جدار الخلية التطبيقية المتاحة علي نظام المجهر والضبط وفقا لذلك.
النتائج
التحليل الكمي للصور
بالاضافه إلى "مجرد" تصور العمليات الخلوية ، التصوير بالخلايا الحية يسمح لاستخراج المعلومات الكمية من البيانات المسجلة. وعموما ، فان التحليل الكمي للصور هو موضوع معقد تجري مناقشته الصحيحة خارج نطاق هذه المادة ، ومن ثم يحال القارئ إلى الكتب المدرسية المخصصة والمواد39،40،41. ومع ذلك ، يتم توفير بعض المبادئ التوجيهية الاساسيه المرتبطة بالبيانات المثال التالي. ويجب استيفاء العديد من الشروط الاساسيه اللازمة للسماح بتحديد كميه الصورة ، بما في ذلك: (1) يجب تطبيق المعالم المحددة لاصباغ الفلورسنت علي جميع العينات للسماح بالمقارنة النسبية الدقيقة ؛ (2) يجب تعديل إعدادات الحصول علي الصورة بطريقه لا يتم فيها التشبع بالكاشفات الضوئية المنبعثة ، والا فان اقصي درجات الكثافة تقطع ؛ (3) يجب ان تظل إعدادات اكتساب الصور ثابته خلال مجموعه تجريبية متماسكة ، والا يتم إدخال تغييرات الكثافة الاصطناعية ؛ (4) يجب حفظ بيانات الصورة في شكل ملف معلومات غير ضياع إلى جانب المعلومات الوصفية التي تحتوي علي جميع إعدادات الاداات ؛ و (5) ينبغي ان يقتصر تحليل الصورة علي الحد الأدنى من الخطوات اللازمة لتجهيز الوظائف لاستخراج المعلومات الكمية المطلوبة.
وعاده ما تكون المعايير المحددة التي تسمح بالتحديد الكمي المطلق للإشارات المسجلة غير متاحه في الخلية الحية. وهكذا ، في ابسط شكل ، تحليل الصورة الكمية يعتمد علي المقارنة النسبية لكثافة بكسل داخل نفس الصورة أو بين الصور المختلفة المسجلة مع إعدادات متطابقة. برنامج التحكم في المجهر الشركة المصنعة عاده ما يتضمن الاداات الاساسيه للصور مرحله ما بعد المعالجة والتحليل الكمي ، أو يمكن ترقيتها مع وظائف اضافيه لتقسيم الصورة ، الدرس ، نسبه التصوير ، الخ. تتوفر العديد من منصات معالجه الصور المفتوحة المصدر ، والتي تتناسب بشكل مختلف مع أنواع مختلفه من بيانات التصوير ، بما في ذلك ImageJ (https://imagej.net ؛ https://imagej.nih.gov/ij/) ، والجليدية (http://icy.bioimageanalysis.org/) ، والمعلوماتية البيولوجية CMEIAS (http://cme.msu.edu/cmeias/) و Wimasis (https://www.wimasis.com/en/).
تمت معالجه بيانات المثال المعروضة وتحليلها باستخدام منصة ImageJ. باختصار ، يتم وضع علامة علي مناطق محدده في الخلية ، مثل قمة خوطي tip أو الحاجز ، مع أدوات تحديد مساحة كبيره ، وكثافة جميع بكسل الواردة هي قراءات مع البرنامج نفذت "أداه القياس". يتم نقل بيانات الكثافة من عناصر التحكم والعينات التجريبية إلى ملف جدول البيانات ، وتحليلها رياضيا واعدادها كرسم بياني. ويمكن الاطلاع علي مزيد من التفاصيل في المنشورات الاصليه المستشهد بها.
مثال البيانات 1: اختبارات امتصاص FM 4-64
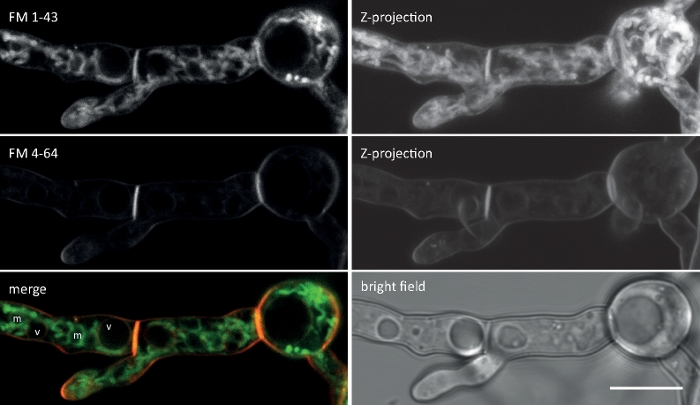
وزرعت عينات فطريه كمستعمرات (الخطوة 1.2) والتي شنتها طريقه كتله أجار المقلوب (الخطوة 3.1). كان التركيز النهائي لل FM 4-64 1.67 μM. إعدادات التصوير: HCX PL APO 63x/1.3 NA الجلسرين الغمر الهدف علي المجهر المسح الضوئي ليزر المحورية (انظر جدول المواد) ؛ FM 4-64 الاثاره في 488 nm والانبعاثات في 600-700 نانومتر; اطار واحد في كل دقيقه لمده تصل إلى 150 دقيقه. وقد حددت اختبارات امتصاص FM 4-64 عيوبا في التنظيم المكاني الزماني لندره المحببات في الحذف الجيني والجينات التي تعبر عن المسوخ من البروتين الفطري الخاص Sur7 2 (Sfp2) الخاص ب t. ضموري9 (الشكل 5).
مثال البيانات 2: FM 4-64 شارك في تلطيخ البروتينات الانصهار الفلورية التي تستهدف مقصورات اللمفاوي
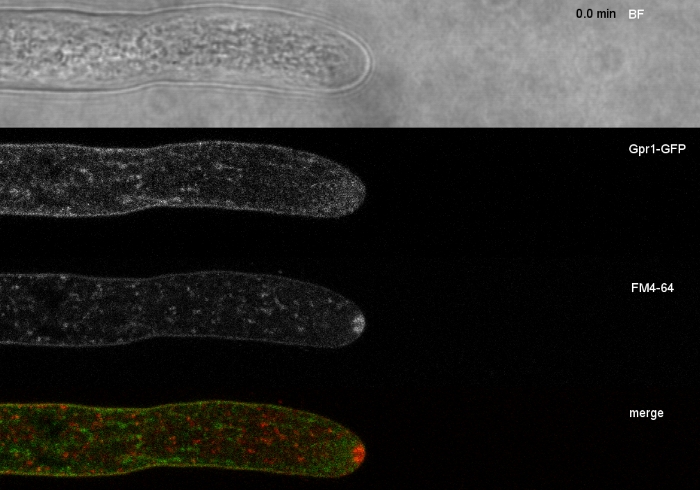
وزرعت عينات فطريه كمستعمرات (الخطوة 1.2) والتي شنتها طريقه كتله أجار المقلوب (الخطوة 3.1). كان التركيز النهائي لل FM 4-64 2 μM. إعدادات التصوير: الخطة المتكاملة للمياه أبو VC 60x/1.2 NA XC الغمر المياه الهدف علي المجهر المسح بالليزر البؤري المقلوب (انظر جدول المواد) ؛ GFP الاثاره في 488 nm والانبعاثات في 500-530 نانومتر ، FM 4-64 الاثاره في 488 nm والانبعاثات في 600-700 نانومتر ، ومشرق الميدان مع كاشف الضوء المرسلة ، وجميع في وقت واحد ؛ تم استخدام اطار واحد كل 15 s لمده تصل إلى 15 دقيقه FM4-64 لربط التوزيع تحت الخلوية من اثنين من البروتين الفلوري الأخضر المعززة (EGFP)-الموسومة البروتينات الغشاء الغشائي Sfp2 و Gpr1 إلى مسار المصل في t. ضموري (الشكل 6، فيلم 3، فيلم 4).
مثال البيانات 3: FM 4-64 شارك في تلطيخ لتحديد الاختلافات الوراثية
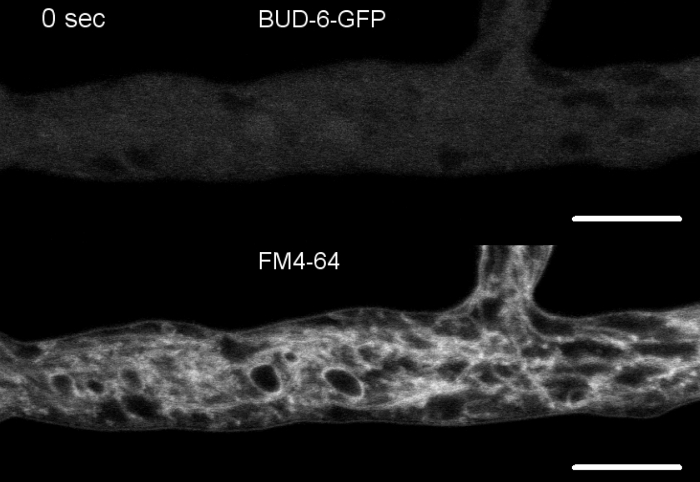
وزرعت عينات فطريه كمستعمرات (الخطوة 1.2) والتي شنتها طريقه كتله أجار المقلوب (الخطوة 3.1). كان التركيز النهائي لل FM 4-64 2 μM. إعدادات التصوير: خطه أبوتشرومات 63x/1.4 NA الغمر النفط الهدف علي المجهر المسح الضوئي بالليزر المحوري (انظر جدول المواد) ؛ GFP الاثاره في 488 nm والانبعاثات في 505-550 نانومتر ، FM 4-62 الاثاره في 488 nm والانبعاثات في 574-691 نانومتر ، ومشرق الميدان مع كاشف الضوء المرسلة ، وجميع في وقت واحد ؛ اطار واحد كل 8.5 s لمده تصل إلى 15 دقيقه. FM4-64 المشاركة في تلطيخ يسمح لربط ديناميات التعريب تحت الخلوية من فلوريسسينتلي المسمي برعم-6 البروتين معقده polarisome إلى العمليات المعتمدة علي الاتجار بالباطنية ، مثل تشكيل الحاجز والاستقطاب خوطي غيض النمو ، وتميزت الاختلافات في المنظمةشبه الخلوية والهندسة الخوطيه
مثال البيانات 4: تلطيخ جدار الخلية يكشف عن الاختلافات الوراثية
وزرعت عينات فطريه كمستعمرات (الخطوة 1.2) والتي شنتها طريقه كتله أجار المقلوب (الخطوة 3.1). واستخدمت تركيزات نهائيه من 2 μM CFW ، 20 μM SPF و 100 μM CR. إعدادات التصوير: الخطة المتكاملة للتخطيط المائي Apo VC 60x/1.2 NA XC الغمر المياه الهدف علي المجهر المسح بالليزر البؤري المحوري (انظر جدول المواد) ؛ CFW و SPF الاثاره في 405 nm والانبعاثات في 430-470 نانومتر ، CR الاثاره في 543 nm والانبعاثات في 580-620 نانومتر. خصائص التفاعل المختلفة من CFW ، SPF و CR مع البوليمرات جدار الخلية تسليط الضوء علي الاختلافات الجينية بين Δsfp2 متحولةوسلاله نوع البرية من تي. زيادة الإجهاد جدار الخلية التي تسببها تركيزات صبغ مرتفعه يحدث أسرع وأكثر وضوحا في متحولة مقارنه مع نوع البرية. الاضافه إلى ذلك ، تسمح نفس الصور لقياس الاختلافات الجينية المتعلقة بالقطر خوطي ومسافة الحاجز بين كلا السلالتين (الشكل 8).
مثال البيانات 5: الرصد في الوقت الحقيقي لتخليق الخلايا الحيوية الجدار
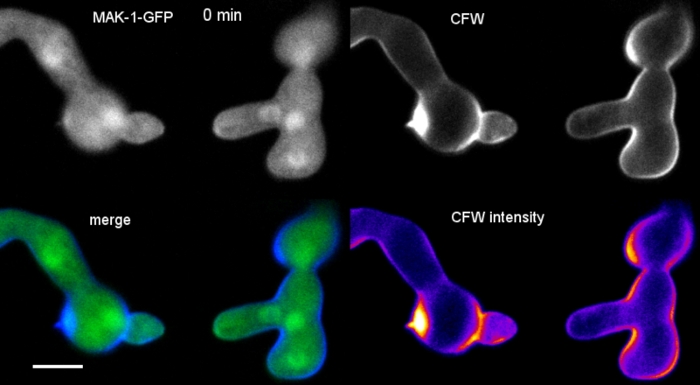
زرعت [غرملينغس] كان كثقافة سائله (خطوه 1.4) في [8-ول] [ملينغ-ول] [ميكرو-جغريد] (خطوه 3.2). وكان تركيز CFW النهائي 0.12 μM. إعدادات التصوير: الخطة المتكاملة للتخطيط المائي Apo VC 60x/1.2 NA XC الغمر المياه الهدف علي المجهر المسح بالليزر البؤري المقلوب; CFW الاثاره في 405 nm والانبعاثات في 420-470 نانومتر ؛ اطار واحد كل 20 ليالي لمده تصل إلى 35 دقيقه. تركيز CFW منخفض جدا يمنع تشبع جدار الخلية مع جزيئات صبغ ويسمح رصد الكمية في الوقت الحقيقي من التركيب الحيوي جدار الخلية. وهذا يكشف ان ترسب المواد الجديدة جدار الخلية ليست موحده ولكن يستجيب بسرعة كبيره للضغوط المادية الموضعية الناجمة عن النزوح النسبي للخلية واحده علي مرفق خليه خليه قبل الانصهار germling في n. مبوغه سميكه (الشكل 9، فيلم 6).
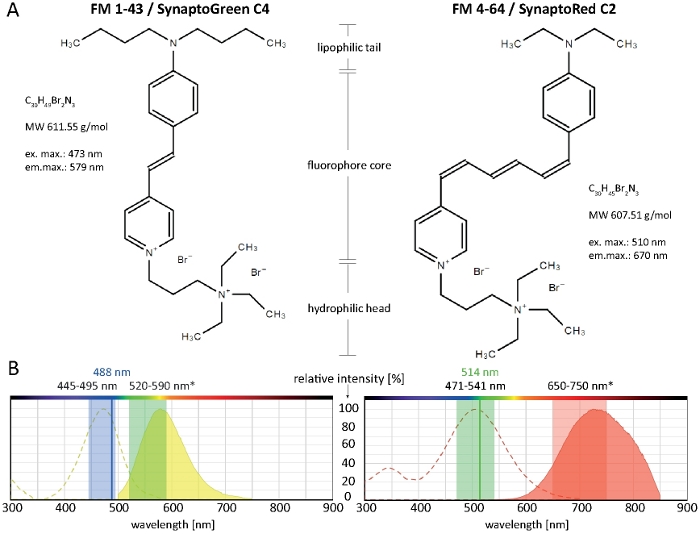
الشكل 1: الخصائص البيوكيميائية والفيزيائية الحيوية لاصباغ FM. (ا) الهياكل الكيميائية لوزير الخارجية 1-43/سينتوبرين C4 و fm 4-64/سينابتوريد C2. (ب) أطياف الامتصاص والانبعاثات لكل من اصباغ FM ، مضافا اليها إعدادات التصوير الأمثل لصبغات الغشاء المربوطة في الفطريات الخيطية: 445-495 نانومتر الضوء الأزرق سوف تثير FM 1-43 مع كفاءه 100-80 ٪ ، في حين 488 nm من ليزر الارجون سوف تثير صبغ مع كفاءه 91 ٪. بسبب التحول الأزرق علي غشاء ملزمه (*) ، ومجموعه الكشف الأمثل من الانبعاثات FM 1-43 بين 520-590 نانومتر. المثل ، فان إعدادات التصوير الأمثل ل FM 4-64 في الفطريات هي 471-541 نانومتر (100-80 ٪ الكفاءة) عند استخدام الاثاره متعدد اللوني مصدر الضوء أو 514 nm (99 ٪ الكفاءة) عند استخدام ليزر الارجون ، و 650-750 نانومتر للكشف عن الانبعاثات الضوئية. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
الشكل 2: التصوير المشترك المتزامن ل1-43 fm و fm 4-64. وأضيف خليط متساوي من كلا الصبغتين إلى ثقافة السائلة germling من n. مبوغه سميكه الغلة تركيز النهائي من 10 μM. في 25 دقيقه بعد أضافه صبغه ، 176 4-64 1-43 شريط مقياس = 10 μm. الرجاء النقر هنا لعرض نسخه أكبر من هذا الرقم.
الشكل 3: الخلايا التي يسببها الإجهاد ترسب البوليمرات جدار الخلية في قمة غيض غالبا ما يستتبع انحلال الخلايا الذاتية. هيهاي من t. التعبير عن البقع الخلوية وكانت ملطخه gfp مع 10 ΜM سولوفينيل فلافون 7GFE 500 (SPF) والذين يعانون مباشره علي تصاعد. شريط مقياس = 10 μm. راجع الفيلم 1 لتسلسل المقرر الدراسي بدوام كامل. لاحظ ان الثلاثة كانت تقع بالفعل بجانب بعضها البعض. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
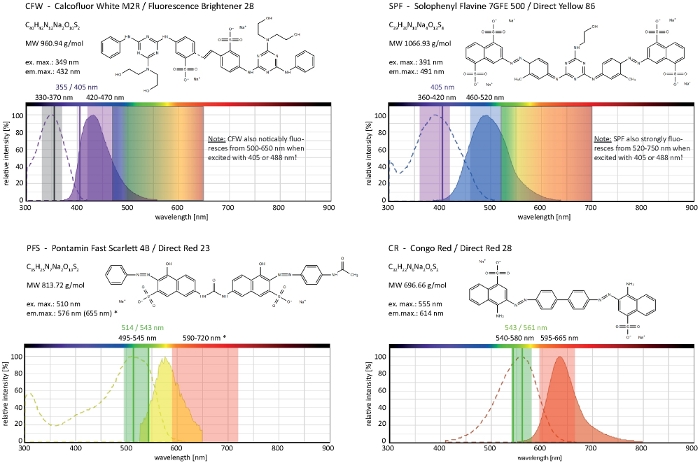
الشكل 4: الخصائص البيوكيميائية والفيزيائية الحيوية لاصباغ جدار الخلية الانتقائية. ميزات كيميائية يعطي ان من الصوديوم أملاح من كل صبغ. وتتوافق أطياف الامتصاص والانبعاثات مع تلك الموجودة في البيئات الخلوية. أشار خطوط الاثاره بالليزر أحاديه اللون (مكتوبه بألوان) ، ونطاقات الاثاره متعدد اللوني المطبقة علي المجاهر الكتابية ، ونطاقات الكشف عن الانبعاثات الضوئية هي تلك الموصي بها للتصوير في الفطريات الخيطية. ويشار إلى اثنين من خطوط الاثاره الليزر عند كل من العمل بشكل جيد علي قدم المساواة. (*) ال [بث طيف] من خليه [ول-ول] [PFS] بشكل ملحوظ أكثر [رد-فل] من سابقا يلاحظ33, مهما, ينتج في جدا جيده [س/ن-نسب] مع [لوور] صبغ تركيزات من يستعمل من قبل. الطيف الكامل من CR غير متوفر حاليا ، التالي ان من النيل الأحمر (CAS No: 7385-67-3) ويظهر كاقرب مباراة. ويمكن الاطلاع علي معلومات مفصله عن الخواص الطيفية لCR في مكان آخر42. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
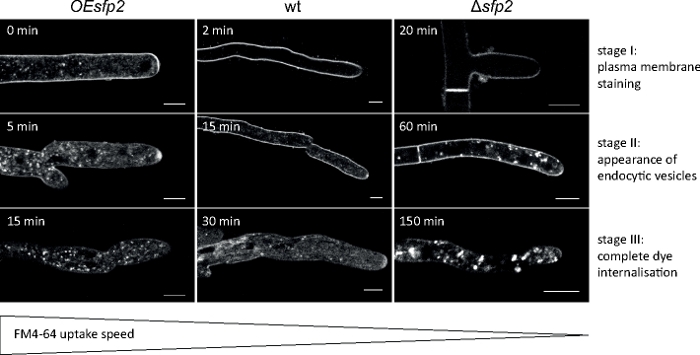
الشكل 5: تاثير الSfp2 علي امتصاص الFM4-64. ثلاث مراحل رئيسيه متعاقبة من امتصاص الصبغة FM يمكن تمييزها بسهوله في نوع البرية (wt). المرحلة الاولي: تلطيخ غشاء البلازما الحصري ، المرحلة الثانية: الظهور الأول لصبغه FM في الحويصلات الخلوية ، والمرحلة الثالثة: التلطيخ الحصري للحويصلات الخلوية و endomembranes. وتظهر أنماط تلطيخ مكافئه في أقرب نقطه زمنيه من مظهرها. بالمقارنة مع نوع البرية t. ، يتم تسريع الندرة قليلا في sfp2 الإفراط في التعبير عن متحولة (OEsfp2) ، في حين يتم تاخير امتصاص الصبغة بشكل كبير في sfp2 الحذف متحولة (Δsfp2). علي سبيل المثال ، امتصاص الصبغة في غشاء البلازما يحدث علي الفور في OEsfp2 ولكن ياخذ 2 دقيقه في نوع البرية. والاستيعاب الكامل لصبغه FM من غشاء البلازما يحدث 10x أسرع في OEsfp2 بالمقارنة مع Δsfp2. قضبان المقياس = 5 μm. الرقم مستنسخ من Atananova et al.9 بالاتفاق مع رخصه المشاع الإبداعي (https://creativecommons.org/licenses/by/4.0/). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
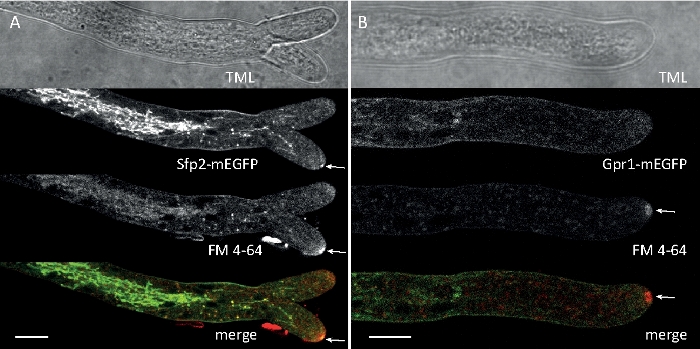
الشكل 6: المشاركة في تلطيخ البروتينات الغشائية المسمية egfp مع FM 4-64 يسهل التفريق بين ديناميات التعريب سوبسيلولار متميزة في t.. (ا) البروتينات الاربعه-الغشائية للمجال Sfp2 التي تشترك مع FM4-64 المسمية العضوية ، بما في ذلك غشاء البلازما والحاجز العصبي ، والفجوات الانبوبيه القابلة للظن (spk ؛ والسهم). (ب) وGpr1 البروتين الذي يشبه الغشاء الغشائي السباعي العابر للحدود مع FM4-64 إلى نفس العضوية Sfp2 ، باستثناء القضبان المقياس spk. ، 10 ميكرومتر. راجع الفيلم 3 والفيلم 4 لتسلسلات المقرر الدراسي بدوام كامل. وقد تم تعديل هذا الرقم من اتاناسوفا وآخرون9 بالاتفاق مع رخصه المشاع الإبداعي. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
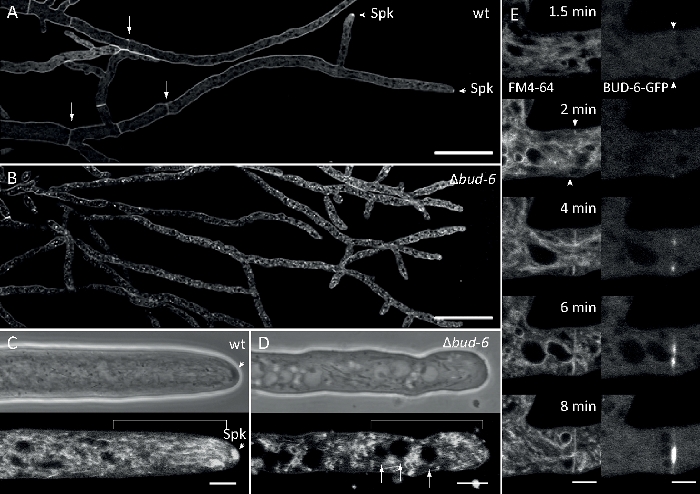
الشكل 7:4-64 تلطيخ FM يميز Δبرعم-6 متحولة من نوع البرية ، وتحديد المواقع برعم-6 في حلقه الحاجز. (ا) 4-64 FM تلطيخ من هيبوهاي من نوع n. مبوغه سميكه البرية (الأسهم تشير إلى الحاجز ؛ نصال تشير إلى spk). (ب) الحاجز و spk غائبان في ∆برعم-6. قضبان المقياس ، 50 μm. (c و D) عن قرب من قمة خوطي وsubapex من نوع البرية (c) و ∆برعم-6 (D). Spk (راس السهم) يميز في نوع البرية ولكن ليس ∆برعم-6. وتشير الأقواس إلى منطقه الاستبعاد النووي التي لم تنشا في ∆برعم-6. قضبان المقياس = 5 μm. (ه) التوظيف من برعم-6-gfp في موقع الحاجز الاولي السابق لغزو غشاء البلازما (نصال) وانقباض الحاجز المصاحب. قضبان المقياس = 5 μm. راجع الفيلم 5a والفيلم 5a لتسلسلات الدورات الزمنيه الكاملة. وقد استنسخ الرقم مع تعديلات من Lichius et al.16 بالاتفاق مع رخصه المشاع الإبداعي. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
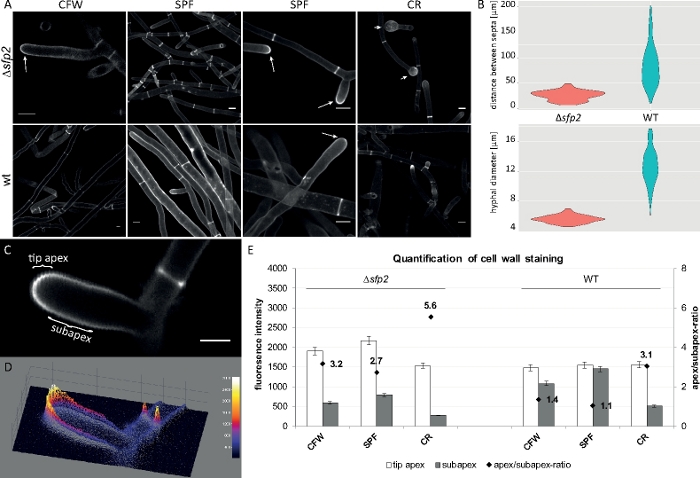
الشكل 8: حذف sfp2 تغيير نمط ترسب المواد جدار الخلية ويؤثر علي التكوين الخوطي لل t. ضموري. (ا) cfw و SPF تلطيخ يكشف زيادة ترسب الجدار الخلوي في Δsfp2 (السهام) مقارنه مع نوع البرية (wt). ويؤدي تلطيخ CR إلى تورم الطرف الكبير فقط في Δsfp2 (نصال). قضبان المقياس = 10 μm. (ب) العيوب الخلقية في Δsfp2 تشمل مسافات الحاجز المنخفضة بشكل ملحوظ (Δsfp2 = 26.0 μm ، النوع البري = 85 μm ؛ n = 60 ؛ ANOVA Pr < 2 − 16) وأقطار أصغر خوطي (∆sfp2 = 5.6 μm ، نوع البرية = 12.6 μm ؛ ن = 100 ؛ ANOVA Pr < 2 − 16). (ج) زيادة الصبغة الفلورية في قمة الطرف مقارنه بالقمة الفرعية. شريط مقياس = 5 μm. (د) الكثافة المشفرة لسطح الأرض ثلاثية الابعاد (C). (ه) القياس الكمي لكثافة الفلورية النسبية في Δsfp2 والنوع البري (ن = 55). وقد استنسخ الرقم من اتاناسوفا وآخرون9 بالاتفاق مع رخصه المشاع الإبداعي. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
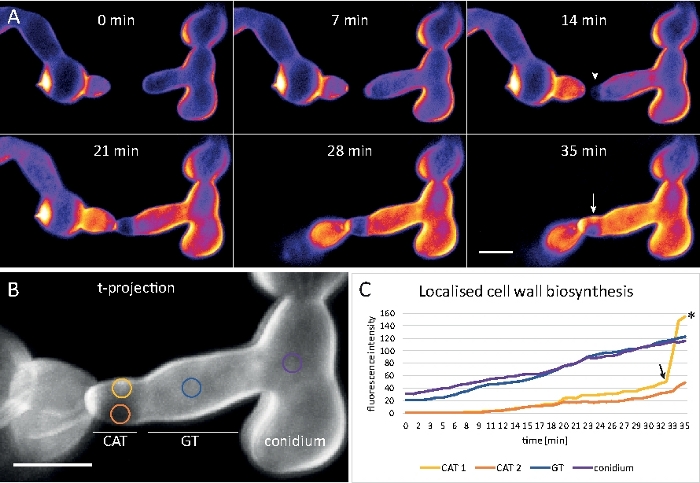
الشكل 9: رصد الوقت الحقيقي لتخليق الخلايا الحيوية. (ا) انصهار أنبوب كونيديال (CAT) بين germlings n. مبوغه سميكه. يصبح التلامس الجسدي ظاهرا بفعل استجابه عزم الدوران التي يتم التعامل معها (21 – 28 دقيقه). كثافة اللون مشفره CFW الفلورية يشير إلى المناطق مع القليل (الأزرق الداكن) ومكثفه (الأصفر) ترسب الجدار الخلية. غيض الموجه غير الملون في البداية (راس السهم) ، والودائع الجديدة المواد جدار الخلية علي الاتصال غيض وفي المنطقة التي تعاني من الإجهاد البدني أكبر (السهم). شريط مقياس = 5 μm. راجع الفيلم 6 لتسلسل الدورات بدوام كامل. الرقم مستنسخ من38 باذن. )ب(إسقاطات) الف (تشير إلى أربع مناطق دائريه تقاس فيها الكثافات الفلورية. شريط مقياس = 5 μm. (ج) مؤامرة من المناطق المشار اليها تبين الزيادة السريعة في التركيب الحيوي لجدار الخلية الموضعي استجابه للإجهاد البدني (CAT 1 ، السهم). في الأنبوب الجرثومي (GT) والجسم بوغ (conidium) ، الخلية جدار التخليق الحيوي يزيد باطراد. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
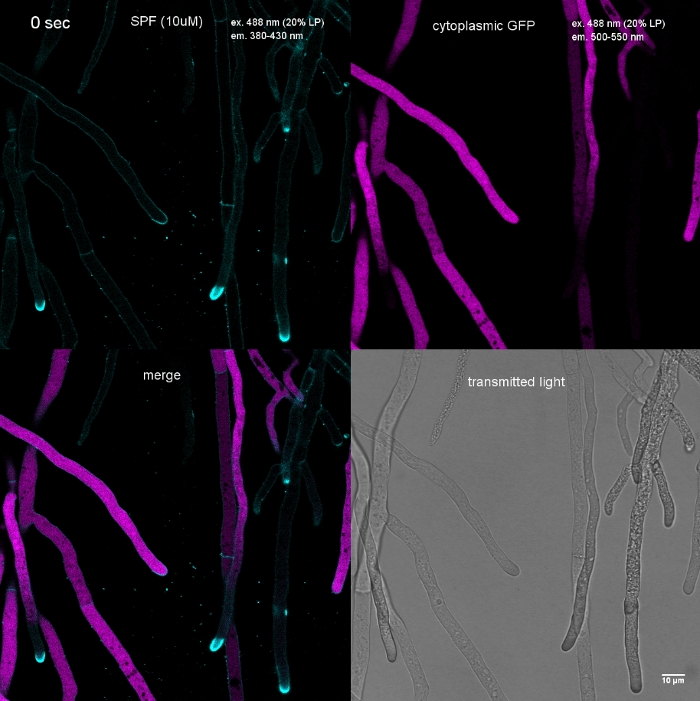
الفيلم 1: الإجهاد الناجم عن صبغ الخلية الجدار. تمت أضافه 10 μM SPF (السماوي) إلى t. الاشعه فوق البنفسجية التعبير عن gfp الخلوية (أرجواني). يحدث تلطيخ الأطراف علي الفور ، تليها التحلل السريعة من مقصورات خوطي في غضون 2 دقيقه. واضح من اختفاء الفلورية GFP. الرجاء الضغط هنا لتحميل هذا الفيلم.
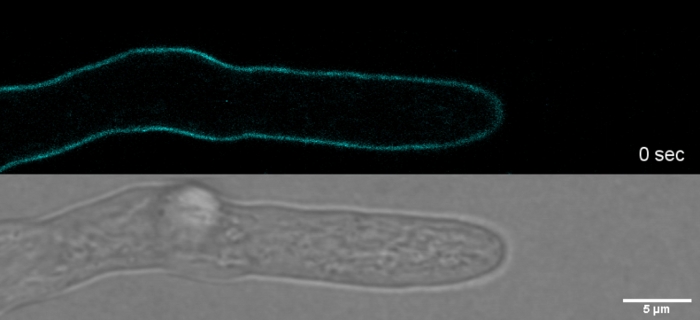
فيلم 2: الحيوية SPF تلطيخ. 2 μM SPF (السماوي) تسمح لتتبع النمو غيض من هيبهاي t. العالية مع دقه المكانية والزمانيه المرتفعة دون حمل التحف الإجهاد جدار الخلية في قمة غيض. الرجاء الضغط هنا لتحميل هذا الفيلم.
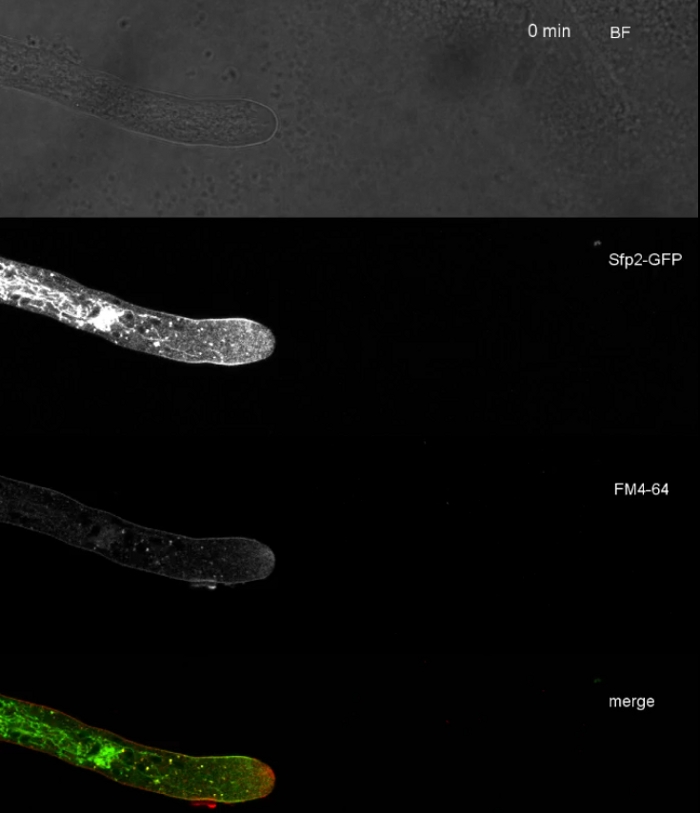
الفيلم 3: FM 4-64 المشارك في تلطيخ Sfp2-GFP. المشاركة في تلطيخ t. التعبير عن Sfp2-megfp (الأخضر) مع 1.67 μM FM 4-64 (الأحمر) تكشف عن التوطين المتداخلة ومتميزة من البروتين الغشاء مع المسار اللمفاوي. الرجاء الضغط هنا لتحميل هذا الفيلم.
الفيلم 4: FM 4-64 شارك في تلطيخ Gpr1-GFP. المشاركة في تلطيخ t. التعبير عن Gpr1-megfp (الأخضر) مع 1.67 μM FM 4-64 (الأحمر) تكشف عن التوطين المتداخلة ومتميزة من البروتين الغشاء مع المسار اللمفاوي. الرجاء الضغط هنا لتحميل هذا الفيلم.
فيلم 5: FM 4-64 شارك في تلطيخ برعم-6-GFP. (5a) المشاركة في تلطيخ n. مبوغه سميكه التعبير عن برعم-6-gfp (الأخضر) مع 2 μM FM 4-64 (الأحمر) تسمح بتتبع ديناميات برعم-6 اثناء تشكيل الحاجز بالنسبة ليغزو غشاء البلازما المرتبطة. (5b) اقتصاص ودمج صوره (5b). الرجاء الضغط هنا لتحميل فيلم 5a
الرجاء الضغط هنا لتحميل فيلم 5b.
الفيلم 6: في الوقت الحقيقي رصد التركيب الحيوي جدار الخلية. N. مبوغه سميكه germlings التعبير عن ماك-1-gfp (الأخضر) كانت مختلطة مع 0.12 μM cfw (الأزرق) للكشف عن التكوين الحيوي جدار الخلية المترجمة خلال الانصهار germlings القط. لاحظ ان هناك بعض النزيف من خلال اشاره CFW في قنوات GFP ، مما يدل علي ان SPF أو CR هي خيارات أفضل مثل الاصباغ المشتركة والتصوير المتزامن لل GFP ، علي التوالي. الرجاء الضغط هنا لتحميل هذا الفيلم.
الجدول 1: خصائص الغشاء وجدار الخلية الاصباغ الفلورية الانتقائية. * = القيم mg/mL تصحيح لانخفاض نقاء/صبغ المحتوي لنتيجة equimolarity في جميع الحلول; n.i.a. = لا توجد معلومات متاحه. يرجى النقر هنا لتحميل هذا الجدول.
Discussion
تواصل هذه المقالة العمل كسر الأرض التي إنشات استخدام الاصباغ الفلورية المختلفة كعلامات عضيه الحيوية للفطريات الفطرية في وقت مبكر 2000s2,4,43, ويحاول مناقشه الخصائص البيولوجية فوتوفيسيكال والخلية من الاصباغ FM والاصباغ خليه الجدار المختارة بمزيد من التفصيل من قبل. خاصه فيما يتعلق بالآثار الخلوية غير المرغوب فيها ، مثل التشبع غشاء أو تلف جدار الخلية ، التي تحدث فوق تركيزات صبغه معينه. ما كان يعتبر سابقا غير سامه علي المستوي الخلوي يعتبر الآن سامه علي المستوي الجزيئي. علي الرغم من ان هذه الآثار قد تكون خفيه جدا وغير واضحة مباشره من التغييرات الواضحة في السلوك العضوي أو الخلية, اي تدخل ممكن من تطبيق صبغ غير التصور يجب ان يكون الحد الأدنى للتحقيق في الوظيفة الجزيئية الاصليه. لحسن الحظ ، وتحسين الحساسية والكفاءة الكم من أجهزه الكشف الحديثة ، مثل كاشفات السليكون الانهيار الضوئي (Si-APDs)44 أو المنطقة Airyscan كاشف45، وتسهيل استخدام كميات اقل حتى من الصبغة من قبل. ومن الأهداف الرئيسية الأخرى لهذه المادة تجسيد خصائص التصوير المشترك لهذه الاصباغ مع الفلوروبيورس الأخرى ، والاهم من ذلك ، تلك التي من GFP باعتبارها البروتين الفلوري الأكثر استخداما في علم الاحياء. هذا ينبغي ان تساعد في تصميم التجارب التصويرية التي تهدف إلى ربط ديناميات التعريب تحت الخلوية من البروتينات الانصهار الفلورسنت إلى تلك التي من جدار الخلية الفطرية ، غشاء البلازما أو المسار اندو-والاكندره الخ.
التصوير تحت ظروف طبيعيه وخاليه من الإجهاد هو المفتاح للحصول علي بيانات موثوق بها. وتهدف بعض الاعتبارات العملية المتعلقة بالثقافة المتوسطة واعداد العينات إلى توفير نقطه انطلاق لإيجاد الظروف المثلي التي تسمح بالمراقبة الدقيقة للخلايا الصحية وغير المجهدة باعلي نسبه S/N الممكنة لأي عينه معينه. ولا توجد طريقه عالميه لتحقيق نتائج تصويريه موثوقه وذات مغزى. ومن المتاصل في النهج ان التنوع البيولوجي للعينه ، والذاتية وتوقعات الميكروسكوبيست ، فضلا عن تجهيز الصورة بعد التصوير ، لهما تاثير كبير علي اكتساب البيانات وتفسيرها ، علي التوالي. التالي ، فان الخبرة العملية لميكروسكوبيست ، لها/له المعرفة الحميمة حول بيولوجيا الخلية من الفطريات تحت التحقيق ، فضلا عن اعداد عينه ماهرا لخلق ظروف "طبيعيه" ودون عائق ممكن في اعداد المختبر ، هي الأهم للحصول علي وتقييم البيانات التصويرية التي تعكس بصدق الظواهر الخلوية درس.
تطبيق الاصباغ الفلورية بسيط ، ولكن خصائصها تتسم بالضعف. القوه الرئيسية لاستخدام الاصباغ الفلورية هي البساطة الاعداديه للبروتوكولات التجريبية. زراعه وأخذ العينات من الفطريات ، أضافه صبغه (ق) ، والمتصاعدة علي مرحله المجهر هي (مع الممارسة) واضحة. تعديل إعدادات التصوير الاساسيه ، بما في ذلك الاثاره والانبعاثات الموجية ، وأوقات التعرض ، وإعدادات الدورة الزمنيه وما إلى ذلك ، اتبع القواعد البيوفيزيائية البسيطة من المجهر والقواعد البيولوجية لاصباغ الفلورسنت المستخدمة داخل الخلايا. ويهدف الجدول 1 إلى دعم تحديد انسب تركيبه صبغيه أو صبغيه لأغراض التجريب. وعلاوة علي ذلك ، يتم تسعير الاصباغ الفلورية بشكل معقول ، وتتوفر بسهوله مع جوده عاليه يمكن الاعتماد عليها ، التالي ضمان تطبيق استنساخه للغاية.
اثنين من القيود الرئيسية لاستخدام الغشاء أو جدار الخلية الاصباغ الفلورية الانتقائية هي (في كثير من الأحيان) معرفه محدوده من خصائصها تلطيخ دقيقه ، والتي في معظم الحالات غير محدده علي المستوي العضوي والجزيئي ، والآثار الجانبية غير المرغوب فيها تعتمد علي التركيز. الاصباغ FM هي محدده لبليرس الدهون المشاركة في اندو-وكثرة. ومع ذلك ، علي وجه التحديد التي العضوية سوبسيلولاره تصبح علي التوالي المسمية تحت ظروف اختبار ليست واضحة علي الفور ويتطلب المقارنة بين مختلف المتغيرات FM صبغ ، والمشاركة في وضع العلامات مع علامات العضيات اضافيه محدده. تفضيل FM 1-43 لاغشيه الميتوكوندريا ، بالمقارنة مع FM 4-64 ، هو مثال واحد. الاصباغ الانتقائية جدار الخلية عرض خصوصية مختلفه لثلاثه البوليمرات الرئيسية للجدار الخلية الفطرية. ويعتقد CFW ان تكون وصمه عار غير محدده ل β-جلوكان والتين ، ويعتقد SPF ان يكون الأكثر انتقائية ل β-1 ، 4-جلوكان ، ويعتقد CR ان تكون انتقائية للغاية ل α-و β-chitins. المعلومات المتعلقة بخصوصية الربط من PFS إلى السكريات الفطرية جدار الخلية غير متوفرة حاليا. إلى اي نسبه الفطرية جدار الخلية البوليمر هو الأكثر فعاليه المسمي في تركيز صبغه معينه في الأنواع الفطرية تحت التحقيق ليست بسهوله الاجابه ، وتطبيق القياسات المفصلة المكتسبة في المختبر أو في الجسم الحي في الكائنات الأخرى أو الأنواع الفطرية الأخرى يجب ان ينظر بعناية فائقه. للأسف ، هذه المعلومات متناثرة ومبعثرة للغاية في الأدب35،42،46. المزيد من السجلات الاخيره التي من شانها ان تتبع الدراسات السابقة33 لتوفير رؤى جديده في خصائص تلطيخ دقيقه من الاصباغ مميزه علي وجه التحديد في الفطريات غير متوفرة حاليا.
ضوابط التصوير ضرورية لتقييم أنماط تلطيخ والاستجابات الخلوية بدقه. لهذا ، من المهم ان يكون هناك ضوابط جيده إلى جانب اي تجربه جديده للتصوير بالخلايا الحية. وتشمل هذه الأنواع البرية غير المعالجة كعنصر تحكم التصوير السلبية لاستبعاد الفلورية الخلفية والضوضاء كاشف من الصورة المكتسبة ، ويكون للمقارنة المورفولوجية عند العمل مع المسوخ. وعلاوة علي ذلك ، ومراقبه التصوير ايجابيه ، علي سبيل المثال سلاله التي تعبر عن GFP أو طلب العروض في سيتوتوبلاسما أو غيرها من البروتين علامة الفلورسنت المعروفة ، أمر ضروري لضبط شده الضوء الاثاره إلى الحد الأدنى المطلوب ولها عنصر تحكم حيوية الخلية. وبمجرد تعيين عناصر التحكم هذه ، لا يقتصر استخدام الاصباغ الفلورية علي مهام التصور فقط ، ولكن ديناميات التلطيخ التي تعتمد علي التركيز ، فضلا عن الآثار الجانبية التي تعتمد علي التركيز يمكن استغلالها بشكل تحليلي ؛ علي سبيل المثال ، للرصد الكمي الحيوي جدار الخلية في الوقت الحقيقي أو لتحديد الظواهر الظاهرية المحددة في اختبارات الحساسية47.
تعتمد التطبيقات المستقبلية المحسنة علي تحليلات وظيفية مفصله لخصائص صبغ الصبغة. ويتمثل أحد التحديات الرئيسية المستمرة في زيادة تحسين وأتمته تحليلات الصور الكمية من أجل النهوض بالتقييم الوظيفي لديناميات الخلايا شبه الخلوية من الاغشيه والاصباغ الفلورية الانتقائية لجدار الخلية في الفطريات الخيطية. لهذا, واسعه, الكمية المشتركة التوطين الدراسات من هذه الاصباغ مع المعروفة عضيه والخلية الجدار علامات البوليمر في تركيبه مع سلالات متحولة ناقصه في مسارات النقل معينه أو التي تفتقر إلى مكونات هيكليه محدده مطلوبه أولا. العديد من علامات الكثرة للتحليلات المقارنة مع الاصباغ FM متاحه48،49، وفيما يتعلق بخصائص ملزمه لا تزال سيئه تتميز الاصباغ جدار الخلية في الفطريات ، وتطبيق الأجسام المضادة جلوكان المسمية فلوريسسينتلي50 يمكن ان توفر امكانيه واحده لمعالجه هذه المسالة.
Disclosures
ويعلن أصحاب البلاغ انه ليست لديهم مصالح مالية متنافسة ولا شيء يكشف عنه.
Acknowledgements
ويرجع الفضل في ذلك إلى صندوق العلوم التيروليه (TWF) لتقديم المنح #256524 إلى صندوق فيينا للعلوم والتكنولوجيا (WWTF) لتقديم منحه #LS13-086 إلى SZ ، والي صندوق المطبوعات التابع لجامعه انسبروك لدعم نشر النفاذ المفتوح. ويشكر المؤلفون أيضا قسم علم العلم من جامعه انسبروك لتوفير المجهر لأيكا الخدمة SP5 الثانية لفحص الليزر كونبؤري.
Materials
| Name | Company | Catalog Number | Comments |
| BRAND cell counting chamber | Merck | BR718005 | Thoma format |
| Calcofluor White M2R | Merck/Sigma-Aldrich | F3543 | cell wall dye |
| CFI Plan Apo VC 60x/1.2 NA XC WI | Nikon | MRD07602 | water immersion objective |
| CFI Plan Apo VC 60x/1.2 NA XC WI | Nikon | MRD07602 | water immersion objective |
| Congo Red | Merck/Sigma-Aldrich | C6277 | cell wall dye |
| Dimethyl sulfoxide | VWR | 8,36,73,230 | organic solvent |
| Eclipse TE2000-E with C1 scanning unit | Nikon | custom configuration | inverted laser scanning confocal microscope used to acquire example data 2 and 4 |
| Eclipse TE2000-U with Bio-Rad Radiance 2100 scannig unit | Nikon | custom configuration | inverted laser scanning confocal microscope used to acquire example data 5 |
| FM 1-43 | Merck/Sigma-Aldrich | S6814 | membrane dye |
| FM 4-64 | Merck/Sigma-Aldrich | S6689 | membrane dye |
| Glass beads | Rettberg | 1340691030 | 3 mm glass beads |
| Glass cover slips | Thermo Fisher Scientific | BB02400600A113MNT0 | 24 x 60 # 1 glass cover slips |
| HCX PL APO 63x/1.3 NA Glyc | Leica | 15506353 | glycerol immersion objective |
| LSM 510 Meta | Zeiss | custom configuration | inverted laser scanning confocal microscope used to acquire example data 3 |
| M9 Minimal Medium | Merck/Sigma-Aldrich | M6030 | generic fungal growth medium |
| Micro-slide 8-well | ibidi | 80826 | ibiTreat #1.5 polymer coverslip |
| Miracloth | Merck/Millipore | 475855-1R | polyester filtration material |
| Petri dish | Sarstedt | 8,21,472 | 92 x 16 mm culture dish w/o cams |
| Phytagel | Merck/Sigma-Aldrich | P8169 | transparent gelling agent |
| Plan Apochromat 63x/1.4 NA Oil DIC | Zeiss | 440762-9904-000 | oil immersion objective |
| Pontamine Fast Scarlet 4B | Merck/Sigma-Aldrich | 212490 | cell wall dye |
| Potato Dextrose Agar (PDA) | BD Difco | 213400 | fungal growth medium for T. atroviride |
| Potato Dextrose Broth (PDB) | BD Difco | 254920 | fungal growth medium for T. atroviride |
| Reaction tube | Sarstedt | 72,706 | 1.5 mL SafeSeal tube |
| Scalpel | B.Braun | 5518016 | Cutfix sterile scalpel #23 |
| Screw cap tube | Sarstedt | 6,25,54,502 | 15 mL polypropylene tube |
| Solophenyl Flavine 7GFE 500 | CIBA | 1485385V6 | cell wall dye |
| SynaptoGreen C4 | Biotum | 70020 | membrane dye |
| SynaptoRed C2 | Biotum | 70021 | membrane dye |
| Syringe membrane filter | Thermo Fisher Scientific | 723-9945 | 0.45 µm SFCA syringe filter |
| TCS SP5 II | Leica | custom configuration | inverted laser scanning confocal microscope used to acquire example data 1 |
| Vogel's Minimal Medium (VMM) | FGSC | Fungal Genetics Stock Centre | fungal growth medium for N. crassa |
References
- Read, N. D., Fischer, S., Parton, R. M. Imaging Spitzenkörper, pH and calcium dynamics in growing fungal hyphae. Pesticide Science. 54 (2), 179-181 (1998).
- Hickey, P. C., Swift, S. R., Roca, M. G., Read, N. D. Live-cell imaging of filamentous fungi using vital fluorescent dyes and confocal microscopy. Microbial Imaging. , 63-87 (2004).
- Jelínková, A., et al. Probing plant membranes with FM dyes: tracking, dragging or blocking. The Plant Journal. 61 (5), 883-892 (2010).
- Fischer-Parton, S., et al. Confocal microscopy of FM4-64 as a tool for analysing endocytosis and vesicle trafficking in living fungal hyphae. Journal of Microscopy. 198 (3), 246-259 (2000).
- Harris, S. D. Branching of fungal hyphae: regulation, mechanisms and comparison with other branching systems. Mycologia. 100 (6), 823-832 (2008).
- Roca, M. G., Arlt, J., Jeffree, C. E., Read, N. D. Cell biology of conidial anastomosis tubes in Neurospora crassa. Eukaryotic Cell. 4 (5), 911-919 (2005).
- Becker, Y., et al. The fungal cell-wall integrity MAPK cascade is crucial for hyphal network formation and maintenance of restrictive growth of Epichloë festucae in symbiosis with Lolium perenne. Molecular Plant-Microbe Interactions. 28 (1), 69-85 (2015).
- Justa-Schuch, D., Heilig, Y., Richthammer, C., Seiler, S. Septum formation is regulated by the RHO4-specific exchange factors BUD3 and RGF3 and by the landmark protein BUD4 in Neurospora crassa. Molecular Microbiology. 76 (1), 220-235 (2010).
- Atanasova, L., et al. The Gpr1-regulated Sur7 family protein Sfp2 is required for hyphal growth and cell wall stability in the mycoparasite Trichoderma atroviride. Scientific Reports. 8 (1), 12064 (2018).
- Betz, W. J., Mao, F., Bewick, G. S. Activity-dependent fluorescent staining and destaining of living vertebrate motor nerve terminals. Journal of Neuroscience. 12 (2), 363-375 (1992).
- Wu, Y., Yeh, F. L., Mao, F., Chapman, E. R. Biophysical characterization of styryl dye-membrane interactions. Biophysical Journal. 97 (1), 101-109 (2009).
- Betz, W. J., Mao, F., B, S. C. Imaging exocytosis and endocytosis. Current Opinion in Neurobiology. 6, 365-371 (1996).
- Hoopmann, P., Rizzoli, S. O., Betz, W. J. Imaging synaptic vesicle recycling by staining and destaining vesicles with FM dyes. Cold Spring Harbor Protocols. 2012 (1), 77-83 (2012).
- Bolte, S., et al. FM-dyes as experimental probes for dissecting vesicle trafficking in living plant cells. Journal of Microscopy. 214, 159-173 (2004).
- Riquelme, M., et al. Spitzenkorper localization and intracellular traffic of green fluorescent protein-labeled CHS-3 and CHS-6 chitin synthases in living hyphae of Neurospora crassa. Eukayotic Cell. 6 (10), 1853-1864 (2007).
- Lichius, A., Yáñez-Gutiérrez, M. E., Read, N. D., Castro-Longoria, E. Comparative live-cell imaging analyses of SPA-2, BUD-6 and BNI-1 in Neurospora crassa reveal novel features of the filamentous fungal polarisome. PloS one. 7 (1), 30372 (2012).
- Peñalva, M. A. Tracing the endocytic pathway of Aspergillus nidulans with FM4-64. Fungal Genetics and Biology. 42 (12), 963-975 (2005).
- Dijksterhuis, J., Molenaar, D. Vesicle trafficking via the Spitzenkörper during hyphal tip growth in Rhizoctonia solani. Antonie van Leeuwenhoek. 103 (4), 921-931 (2013).
- Hickey, P. C., Read, N. D. Imaging living cells of Aspergillus in vitro. Medical Mycology. 47, 110-119 (2009).
- Delgado-Álvarez, D. L., Bartnicki-García, S., Seiler, S., Mouriño-Pérez, R. R. Septum development in Neurospora crassa: the septal actomyosin tangle. PLoS One. 9 (5), 96744 (2014).
- Hageage, G. J., Harrington, B. J. Use of Calcofluor White in clinical mycology. Laboratory Medicine. 15 (2), 109-112 (1984).
- Monheit, J. E., Cowan, D. F., Moore, D. G. Rapid detection of fungi in tissues using Calcofluor White and fluorescence microscopy. Archives of Pathology and Laboratory. 108 (8), 616-618 (1984).
- Herth, W., Schnepf, E. The fluorochrome Calcofluor White binds oriented to structural polysaccharide fibrils. Protoplasma. 105 (1-2), 129-133 (1980).
- Elorza, M. V., Rico, H., Sentandreu, R. Calcofluor White alters the assembly of chitin fibrils in Saccharomyces cerevisiae and Candida albicans cells. Journal of General Microbiology. 129 (5), 1577-1582 (1983).
- Lagorce, A., et al. Genome-wide analysis of the response to cell wall mutations in the yeast Saccharomyces cerevisiae. Journal of Biological Chemistry. 278 (22), 20345-20357 (2003).
- Sanz, A. B., García, R., Rodríguez-Peña, J. M., Arroyo, J. The CWI Pathway: regulation of the transcriptional adaptive response to cell wall stress in yeast. Journal of Fungi. 4 (1), (2017).
- Slifkin, M., Cumbie, R. Congo Red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Michels, J., Büntzow, M. Assessment of Congo Red as a fluorescence marker for the exoskeleton of small crustaceans and the cuticle of polychaetes. Journal of Microscopy. 238 (2), 95-101 (2010).
- Pancaldi, S., Poli, F., Dall'Olio, G., Vannini, G. L. Morphological anomalies induced by Congo Red in Aspergillus niger. Archives of Microbiology. 137 (3), 185-187 (1984).
- Roncero, C., Durán, A. Effect of Calcofluor White and Congo Red on fungal cell wall morphogenesis: in vivo activation of chitin polymerization. Journal of Bacteriology. 163 (3), 1180-1185 (1985).
- Kopeck, M., Gabriel, M. The influence of Congo Red on the cell wall and (1,3)- β-d-glucan microfibril biogenesis in Saccharomyces cerevisiae. Archives of Microbiology. 158 (2), 115-126 (1992).
- Heilmann, C. J., et al. Surface stress induces a conserved cell wall stress response in the pathogenic fungus Candida albicans. Eukayotic Cell. 12 (2), 254-264 (2013).
- Hoch, H. C., Galvani, C. D., Szarowski, D. H., Turner, J. N. Two new fluorescent dyes applicable for visualization of fungal cell walls. Mycologia. 97 (3), 580-588 (2005).
- Liesche, J., Ziomkiewicz, I., Schulz, A. Super-resolution imaging with Pontamine Fast Scarlet 4BS enables direct visualization of cellulose orientation and cell connection architecture in onion epidermis cells. BMC Plant Biology. 13, 226 (2013).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Knight, N. L., Sutherland, M. W. A rapid differential staining technique for Fusarium pseudograminearum in cereal tissues during crown rot infections. Plant Pathology. 60 (6), 1140-1143 (2011).
- Fajardo-Somera, R. A., et al. Dissecting the function of the different chitin synthases in vegetative growth and sexual development in Neurospora crassa. Fungal Genetics and Biology. 75, 30-45 (2015).
- Lichius, A. . Cell Fusion in Neurospora crassa. , (2010).
- Chen, W., Li, W., Dong, X., Pei, J. A Review of Biological Image Analysis. Current Bioinformatisc. 13 (4), 337-343 (2018).
- Goldman, R. D., Swedlow, J., Spector, D. L. . Live cell imaging: A laboratory manual. , (2010).
- Eliceiri, K. W., et al. Biological imaging software tools. Nature methods. 9 (7), 697-710 (2012).
- Zemanek, G., Jagusiak, A., Chłopaś, K., Piekarska, B., Stopa, B. Congo Red fluorescence upon binding to macromolecules - a possible explanation for the enhanced intensity. Bio-Algorithms and Med-Systems. 13 (2), 1187 (2017).
- Hickey, P. C., Jacobson, D. J., Read, N. D., Louise Glass, N. Live-cell imaging of vegetative hyphal fusion in Neurospora crassa. Fungal Genetics and Biology. 37 (1), 109-119 (2002).
- . Hamamatsu Si APD - high sensitivity photodiodes having an internal gain mechanism: Avalanche photodiode selection guide 2019 Available from: https://www.hamamatsu.com/resources/pdf/ssd/si_apd_kapd0001e.pdf (2019)
- Huff, J. The Airyscan detector from ZEISS: confocal imaging with improved signal-to-noise ratio and super-resolution. Nature Methods. 12, 1205 (2015).
- Thomas, J., Idris, N. A., Collings, D. A. Pontamine Fast Scarlet 4B bifluorescence and measurements of cellulose microfibril angles. Journal of Microscopy. 268 (1), 13-27 (2017).
- Ram, A. F. J., Klis, F. M. Identification of fungal cell wall mutants using susceptibility assays based on Calcofluor White and Congo Red. Nature Protocols. 1 (5), 2253-2256 (2006).
- Toshima, J. Y., et al. Spatial dynamics of receptor-mediated endocytic trafficking in budding yeast revealed by using fluorescent alpha-factor derivatives. Proceedings of the National Academy of Science of the USA. 103 (15), 5793-5798 (2006).
- Kilaru, S., Schuster, M., Latz, M., Guo, M., Steinberg, G. Fluorescent markers of the endocytic pathway in Zymoseptoria tritici. Fungal Genetics and Biology. 79, 150-157 (2015).
- Fu, C., Tanaka, A., Free, S. J. Neurospora crassa 1,3-α-glucan synthase, AGS-1, is required for cell wall biosynthesis during macroconidia development. Microbiology. 160, 1618-1627 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved