Method Article
필라멘트 곰팡이의 살아있는 세포 이미징을 위한 막 및 세포벽 선택적 형광 염료의 적용
요약
중요한 형광 염료는 현대 곰팡이 세포 생물학에 있는 살아있는 세포 화상 진찰 분석을 위한 필수적인 공구입니다. 이 논문은 필라멘트 균류에서 플라즈마 막 역학, 내분비 / 외신 세포증 및 세포 벽 형태 형성을 추적하기위한 확립되고 덜 알려진 형광 염료의 응용 프로그램에 대해 자세히 설명합니다.
초록
곰팡이 세포에 있는 세포기관 역학의 살아있는 세포 화상 진찰 분석을 위한 막 과 세포벽 선택적인 형광 염료의 응용은 2십년 전에 시작되고 그 때부터 필라멘트 곰팡이의 우리의 이해에 크게 기여하기 위하여 계속합니다 라이프 스타일. 본 논문은 두 개의 멤브레인 염료 FM 1-43 및 FM 4-64 및 4개의 세포벽 얼룩 칼코플루어 화이트 M2R, 솔로페닐 플라빈 7GFE 500, 폰타민 패스트 스칼렛 48 및 콩고 레드의 활용에 대한 실용적인 가이드를 제공한다. 초점은 유물없는 염색, 그들의 공동 이미징 특성 및 정량적 평가를 확인하기 위해 저용량 응용 프로그램에 있습니다. 제시된 방법은 기재된 방법으로 제조될 수 있는 모든 필라멘트 곰팡이 샘플에 적용 가능하다. 근본적인 염색 접근법은 다른 재배 조건을 필요로 할 수 있는 종에 적응을 위한 출발점으로 작용할 수 있습니다. 첫째, 생물물리학및 생화학적 성질은 이러한 염료를 진정으로 중요한 형광 얼룩으로 사용하기 위해서는 그들의 이해가 필수적이기 때문에 검토됩니다. 둘째, 단계별 프로토콜은 형광 라이브 세포 이미징을 위한 다양한 곰팡이 샘플 유형의 제조를 상세히 제시한다. 마지막으로, 예제 실험은 다른 접근법을 보여줍니다: (1) 유전 돌연변이체내시경의 spatio-temporal 조직에서 결함을 식별하고, (2) GFP 표지된 표적 단백질의 공유및 뚜렷한 공동 국소화를 비교적 특성화 내분비 경로에서, (3) 유전 돌연변이체에서 형태유전학적 세포벽 결함을 식별하고, (4) 세포벽 생물발생을 실시간으로 모니터링한다.
서문
20년 전, 히프 형태 형성과 근본적인 분자 세포 생물학이 필라멘트 균류에서 가시화될 수 있는 방법은 막 선택적 형광 페이 마오 염색 FM 4-641의적용에 의해 혁명을 일으켰습니다. 나중에, 곰팡이 세포벽 역학의 중요한 형광 마커로서 치틴 결합 염료 칼코플루어 화이트의 이점이 실현되었다2. 그 이후로 염료와 변이체 는 곰팡이에서 세포 역학의 살아있는 세포 이미징 분석의 고유 한 부분이되었으며 필라멘트 곰팡이 라이프 스타일에 전례없는 통찰력을 계속 제공합니다. 이 논문은 필라멘트 균류에서 플라즈마 막 역학, 내분비 및 외세포증 및 세포벽 형태 형성을 추적하기 위한 확립되고 덜 알려진 형광 염료의 적용을 자세히 설명합니다. 내분비증 추적 세포 는 내분비증의 일반적인 연구와 관련된 다양한 세포 생물학적 질문을 해결 할 수 있습니다3. 이를 위해, FM 염료 첨가 시 염색구의 국소화, 속도 및 승계는 시험된 곰팡이 균주4간에 시간 경과 현미경 및 정량적으로 비교하여 기록된다. 세포벽 염료는 세포의 외경계를 묘사하고 편광된 하이프 팁 성장2,하이프 분기5,하이프 융합6,7 및 중격 형성8을포함하는 형태유전학적 사건의 추적을 허용한다. 더욱이, 이들은 국지화된 세포벽 증착의 정량화 및 세포벽 생물발생 동안의 결함의 식별을 용이하게한다 9. 어떤 형광 마커의 생화학적 및 생화학적 특성에 대한 상세한 지식이 생체 내 응용 프로그램의 성공적인 전제 조건이기 때문에, 이러한 특성은 이 문서에 등장하는 6개의 염료에 대해 먼저 요약된다.
멤브레인 선택적 염료
FM(Fei Mao) 스타일염료는 생물학적막(10)의지질 이중층의 외부 리플렛과 가역적으로 연관될 수 없는 작은 양과성 분자이다. 이들은 사실상 수성 용액에서 비형광이지만 플라즈마 멤브레인 통합 시 강렬하게 형광이 되어 우수한 신호 대 잡음(S/N)-비11을생성합니다. 이러한 특성은 내도 및 외세포증12의추적을 포함하여 혈장 막 및 세포내 세포 기관 역학을 시각화하는 데 이상적입니다. 녹색 형광 FM 1-43 및 적색 형광 FM 4-64는 이러한 목적을 위해 가장 널리 사용되는 두 가지 형광 막 마커이다. SynaptoGreen C4와 SynaptoRed C2는 각각 FM 1-43 및 FM 4-64 대신 에 상호 교환적으로 사용할 수 있는 대체 공급 업체의 일반 분자입니다.
Styryl 염료는 세 가지 주요 구조 영역을 포함: (1) 지질 이중층으로 염료의 삽입을 용이하게 하는 친유성 꼬리, (2) 염료의 스펙트럼 특성을 결정하고 1~3개의 이중 결합으로 연결된 2개의 방향족 고리에 의해 구성되는 형광코어, (3) 멤브레인을 통한 염료의 완전한 삽입 및 투과를 방지하는 양전하 친수성헤드(도 1A).
친유성 꼬리가 길수록 염료의 소수성및 따라서 멤브레인에 결합친화성이 높지만, 낮은 것은 수용성과 멤브레인 염색률이 낮습니다. 따라서, 다른 FM 염료 변종은 다른 염색 역학및 패턴을 생성합니다. C4 꼬리 FM 1-43의 높은 소수성은 혈장 막 및 내부 소기관에서 더 짧은 C2 꼬리 FM 4-64보다 더 강력하고 안정적인 형광 신호를 제공하며, 등구 농도에서 적용될 때(그림 2).
중요한 것은, 개별 염료 분자 당 1-6 s의 평균 체류 시간을 가진 두 FM 염료 (11)의 일정하고 높은 협회 /해리 비율은 막 유동성의 수정 또는 막 단백질의 강제 영구 상호 작용을 통해, 예를 들어, 막 기능의 국부적 인 중단에 대한 기회를 감소시킵니다. 이것은 아마 이 분자가 중요한 염료로 이용될 수 있는 중요한 이유입니다. 그럼에도 불구하고, 50 μM 이상의 FM 염료 농도는 곰팡이 및 식물 세포2,14에독성이 있으며, BY-2 담배 프로토플라스트로부터의 증거는 20 μM FM 염료 가 혈장 포화로 이어진다는 것을 나타낸다14. 따라서, 특히 우수한 이미징이 2-5 μM15,16만큼적게 달성되었다는 사실을 감안할 때이 한계를 초과하지 않는 것이 바람직하다.
특히, FM 염료의 스펙트럼 특성은 특정 멤브레인 미세환경에 따라 크게 달라집니다(검토된 14). 일반적으로 순수 용매 용액에서 FM 염료의 여기 및 방출 스펙트럼은 (일반적으로 제품 정보에 제공된 대로) 셀룰러 환경에서와 크게 다르며 대부분의 경우 라이브 셀 이미징 설정을 선택하기 위해 직접 상담할 수 없습니다. 예를 들어, FM 1-43 및 FM 4-64의 여기/방출 최대값은 각각 37/46 nm 및 43/64 nm로 청색 이동이 되며, 메탄올 내의 용액과 비교하여 곰팡이 막에 결합될때(표 1).
혈장 막, 내분비증 및 세포역학을 추적하기 위한 FM 4-64 및 FM 1-43의 사용에 대한 획기적인기초는 이미 이전에2,4,17,18,19의 광범위한 필라멘트 곰팡이 종에 대해 포괄적으로 문서화되어 있습니다. 다양한 필라멘트 곰팡이 종에서 작동하는 두 FM 염료에 대한 권장 이미징 설정은 그림 1B에도시되어 있습니다. 그러나 사용 가능한 장비 또는 배양 배지, pH 또는 온도와 같은 특정 셀룰러 및 실험 조건의 기술적 한계는 일부 적응이 필요할 수 있습니다. 다행히도, FM 염료는 넓은 스펙트럼 범위에서 작동하고, 매우 좋은 이미징 결과는 514 nm 또는 FM 4-64와 흥미 진진한 FM 1-43에 의해 달성된다 488 nm. 따라서 최적의 이미징 설정은 각 샘플 유형 및 의도된 적용에 대해 개별적으로 결정해야 합니다.
FM 4-64의 135 nm 이상의 상당한 스토크의 변화는 녹색 빛을 방출 하는 형광단과 우수한 동시 공동 이미징을 허용; 이는 혈장막 및 내분비 경로에비해 녹색 형광 단백질(GFP)표지된 융합 단백질의 세포내 국소화 역학을 평가하기 위해 빈번하게 이용된다9,20.
세포벽 선택적 염료
칼코플루어 화이트 M2R(CFW)은 형광 브라이트너 28로 도래하며, 박테리아, 곰팡이, 조류, 높은 식물 및 곤충의 세포벽을 염색하는 데 사용되는 가장 잘 알려진 형광 염료일 것입니다. 처음에 종이, 섬유 및 세제 산업에서 광학 미백제로 사용되었지만 곰팡이 감염의 임상 진단에 대한 이점은21,22일 일찍 실현되었습니다. CFW는 초기 키틴 사슬내로 비가역적으로 인터케이팅되기 때문에 세포벽 생물발생 시 정상적인 키틴 마이크로피브릴 어셈블리를 방해하여 세포벽응력(23)을발생시게 된다. 이는 글루칸 및 키틴 신타제활성화(24,25)의결과로 국소적으로 고조된 세포벽 침착으로 이어지는 세포벽 손상 수리 메커니즘을 차례로 트리거한다. 이러한 현상은 세포벽 중합체에 안정적으로 결합하여 작동하는 임의의 염료와 함께 발생할 수 있으며, 농도의존적이며, 균사체의 가장 다산적 성장 및 따라서 가장 민감한 부분을 나타내는 하이프 팁에서 가장 두드러집니다(그림3). 세포벽 손상에 대응하는 분자기계에 대한 종합적인 요약이 최근26개제공되고 있다.
광독성과 함께 과다 복용 된 염료는 하이프 구획의 빠른 세포 포염으로 이어질 수 있습니다(영화 1). 그럼에도 불구하고, 야생형에서 "필수적"인 염료 농도에 대한 민감도 증가는 유전자 기능 상실 돌연변이체의 세포벽 생합성의 결함을 규명하는데 이용될 수있다 9. CFW 및 콩고 레드(CR)의 경우, 다이렉트 레드 28로도 알려져 있으며, 곰팡이 및 곤충을 위한 α-및 β-키틴 특이적 세포벽 얼룩으로 사용되는 또 다른 섬유착색제(27,28, 28,키틴 신타제를 강하게 유도하는 임계 농도 >gt;; 60 μM CFW 및 > 70 μM CR은 각각, 반면 염료의 농도 <15 μM은 곰팡이 성장을 변경하거나 억제하지 않았다29,30,31. Hickey 외. 25 μM 2에서 CFW에 대한 이 임계 값농도를배치했습니다. 따라서 염료 농도 ≤ 5 μM을 사용하여 응력 관련 유물을 배제하고 이러한 분자를 진정으로 "중요한 형광염료"2,32로사용하는 것이 좋습니다. 이는 솔로페닐 플라빈 7GFE 500(SPF) 및 폰타민 패스트 스칼렛 4B(PFS)에 동일하게 적용되며, 각각 다이렉트 옐로우 86 및 다이렉트 레드 23의 대명사이며, 곰팡이에 대한 적용이 10년 전33년이전에 처음으로 보고된 두 개의 유용한 세포벽 염료이다. 그러나 그들의 놀라운 스펙트럼 특성에도 불구하고34,35,두 염료의 사용은 그 이후로 매우 제한되었습니다36,37. 앞서 도시된 바와 같이 1.5 μM CFW2,2 μM SPF는 매우 높은 시간분해능(Movie2)으로원어민 조건하에서 세포벽 역학을 해결하기에 충분하다. 동일한 결과를 2 μM CR 또는 PFS로 얻을 수 있다.
함께, 이들 4개의 염료, CFW, SPF, PFS 및 CR은, 현대 형광 현미경에 이용되는 거의 완전한 가시 방출 광 스펙트럼(400-700 nm)을 커버하는 세포벽 선택적 형광 마커 세트를포함한다(그림 4). 세포벽 폴리머에 결합시 형광 강도의 현저한 증가는 네 가지 모두에 내재되어 우수한 S/N 비율을 생성합니다. 이것은 차례차례로 염료 사격량 및 흥분 광 강렬을 아주 낮게 유지하는 것을 허용하고 "저용량" 살아있는 세포 화상 진찰 기술2로세포벽 염색을 능력을 발휘할 수 있습니다. 이 세포벽 염료는 플라즈마 막 불투과성이기 때문에, 그들은 살아있는/죽은 얼룩으로 동시에 작동합니다. 특히, 매우 넓은 방출 광 스펙트럼으로 인해 다른 형광체와 함께 CFW 및 SPF의 공동 이미징 특성에 대한 몇 가지 제한 사항을 신중하게 고려해야 합니다.
프로토콜
1. 곰팡이 샘플 의 준비
- 곰팡이 사전 문화
- 신경스포라 크라사에 대한 트리코데르마 아로비라이드 또는 보겔의 최소 배지(VMM)에 대한 감자 덱스트로스 한천(PDA)과 같은 적절한 고체 한천 배지에 원하는 균주를 접종합니다. 변형 균주로 작업할 때 적절한 선택 마커를 추가합니다.
- 유기체의 최적 온도에서 사전 배양을 배양합니다. 예를 들어, T. 25 °C와 N. crassa에서 30 °C, 그리고 12 시간/12 h 빛/어두운 주기 때 산발성 균사체가 개발되었지만 아직 플레이트의 가장자리에 도달하지 못했습니다. 표준 크기의 페트리 접시 (9.2 cm Ø)에서는 야생 형 T. atroviride를 평균 4-6 일 동안 섭취하는 반면 N. crassa 야생 유형은 평균 3-4 일 후에이 단계에 도달합니다.
- 곰팡이 식민지의 재배
- 멸균 메스를 사용하여, 배양 전의 콜로니 가장자리로부터 비분산 균사체를 운반하는 작은 3 mm x 3 mm 한천 블록을 절단한다.
- 한천 블록을 신선한 고체 배지 플레이트의 중앙에 놓아 실험 배양물을 접종합니다.
- 조사대상 발달 단계에 따라 실험 배양을 배양한다. 예를 들어, 야생형 T. atroviride는 PDA에서 약 2cm 직경의 식민지를 개발하기 위해 어둠 속에서 20-22 시간 에서 20-22 시간이 필요한 반면, 야생 형 N. crassa는 VMM의 어둠 속에서 30 °C에서 14-16 시간 의 배양 후 약 4cm의 식민지 직경에 도달합니다.
참고 : 어둠 속에서 배양은 자가 형광을 유발할 수있는 안료의 형성을 방지합니다. 실험 배양권에서 중간 배경 형광을 제거하기 위해 한천을 투명한 응고제(재료 표참조)의 1.5% w/v로 바꾸고, 정의된 최소 배지로 복잡한 매체를 교체합니다.
- 고체 배아 배양 재배
- 멸균 생리염 용액 5 mL(0.9% w/v NaCl)을 사용하여 배양 전 플레이트에서 코니디얼 포자를 수확하고 15mL 스크류 캡 튜브에서 생성된 포자 현탁액을 수집합니다.
- 포자 현탁액을 활발한 소용돌이에 의해 잘 혼합한 후 멸균 필터 직물의 1cm x 5cm 스트립(재료 표참조)을 가볍게 1mL 파이펫 팁(조립 및 오토클레이브)에 넣고 신선한 멸균 튜브에 걸러냅니다.
- 세포 계수 챔버로 포자 밀도를 결정하고 생리염 용액으로 1 x 107 세포 / mL 포자 현탁액을 준비합니다.
참고: 포자 현탁액은 최대 2주 동안 4°C에서 보관할 수 있습니다. - 20 mL의 단단한 매체로 표준 크기의 페트리 접시 (9.2cm Ø)를 준비하고 상단에 15-20 멸균 유리 구슬 (3mm Ø)을 추가합니다.
- 배지 플레이트상에 포자 현탁액의 피펫 200 μL을 부드럽게 흔들어 전체 플레이트에 균등하게 분배한다. 재사용을 위해 70% 에탄올로 유리 구슬을 비커에 넣습니다.
- 조사대상 발달 단계에 따라 실험 배양을 배양한다. 예를 들어, T. atroviride 야생 유형은 PDA에 코니디얼 세균을 개발하기 위해 어둠 속에서 25 °C에서 5-6 h를 필요로하는 반면, N. crassa 야생 유형은 VMM의 어둠 속에서 3-4 시간 의 배양 후 코니디얼 세균을 개발합니다.
참고: 실험 배양권에서 중간 배경 형광을 제거하기 위해 한천을 투명한 응고제의 1.5% w/v로 바꾸고, 정의된 최소 배지로 복잡한 배지를 바꿉니다.
- 액체 세균 배양 재배
- 액체 배양 배지 의 190 μL을 8 웰 챔버 마이크로 슬라이드의 각 웰에 채웁니다.
- 1x 10 x 107 셀/mL 포자 용액(단계 1.4.1-1.4.3으로 준비)의 10 μL을 추가하고 상하몇 번 부드럽게 파이펫팅하여 혼합합니다. 그 결과 총 셀 수는 웰당 1 x 105입니다.
- 조사대상 발달 단계에 따라 실험 배양을 배양한다. 예를 들어, 야생 형 T. atroviride 감자 덱스트로스 국물 (PDB)에서 음경 세균을 개발하기 위해 어둠 속에서 25 °C에서 5-6 h가 필요한 반면, 야생 형 N. crassa는 액체 VMM의 어두운 30 °C에서 3-4 시간 의 배양 후 음낭 세균을 개발합니다.
2. 염료 작업 솔루션 의 준비
- 각 염료의 완전한 용해도를 보장하기 위해 적절한 양(표 1의정확한 가중치 참조)을 100% DMSO의 1mL에 추가하여 디메틸 설폭사이드(DMSO)에 2mMM 스톡 솔루션을 준비하고 소용돌이에 의해 잘 섞입니다.
주의: 중격 밀봉 병에서 DMSO를 복용하십시오. 투명한 액체여야 합니다. 공기와 접촉하면 DMSO는 미량 불순물의 산화로 인해 갈색으로 변하며 세포 성장이나 염색에 부정적인 영향을 줄 수 있습니다. - 0.2 μm 주사기 멤브레인 필터를 통해 스톡 용액을 신선한 멸균 1.5 mL 반응 튜브로 살균하는 필터. 염료 표백을 최소화하려면 튜브를 알루미늄 호일로 감쌉입니다.
참고: 염료 스톡 용액은 해동/동결 주기를 피하기 위해 더 작은 부피로 아칭할 수 있으며 몇 개월 동안 4 °C로 유지될 수 있습니다. - 신선한 멸균 1.5 mL 반응 튜브에서 멸균 증류수의 198 μL에서 염료 스톡 용액 2 μL을 용해시킴으로써 20 μM 수성 염료 작업 용액을 준비합니다. 염료 표백을 최소화하려면 튜브를 알루미늄 호일로 감쌉입니다.
참고 : 염료 작업 용액은 실험 당일에 신선하게 준비해야합니다. - 시료 장착(섹션 3 참조)에서 염료 작업 용액은 표준으로 1:10 희석되어 최종 염료 농도가 2 μM이고 최종 DMSO 농도는 0.1% 증가합니다.
참고 : 단순히 염료 작업 용액과 장착 액체 사이의 부피 비율을 변경하여 다른 희석 요인을 선택, 쉽게 원하는 최종 염료 농도를 적응 할 수 있습니다.
주의: 염료 또는 DMSO 독성으로 인한 원치 않는 효과를 방지하기 위해 희석 인자는 1:4 미만으로 떨어지지 않아야 하며 최대 최종 농도는 5 μM 염료및 0.4% w/v DMSO입니다. 염료 농도가 높을수록 시스템을 빠르게 포화시키고 신뢰할 수 있는 신호 정량화를 방지하는 반면, 0.5% 이상의 w/v(≥ 62.5 mM) DMSO는 세포발달을 38로손상시킬 수 있습니다.
3. 현미경 검사법에 대한 샘플 준비
- 진균 콜로니로부터 샘플을 마운트 (단계 1.2) 또는 고체 세균 배양 (단계 1.3) 반전 한 천 블록 방법에 의해.
- 깨끗한 24mm x 60mm 유리 커버 슬립(#1 = 0.13-0.16mm 두께)을 준비하고 18 μL의 액체 최소 배지(VMM 또는 M9) 또는 생리용 염 액을 중앙에 추가합니다.
- 20 μM 염료 작업 용액의 2 μL을 18 μL의 액체에 추가하고 기포 생성을 피하면서 여러 번 위아래로 파이펫팅하여 잘 섞습니다.
참고: 여러 샘플로 작업할 때 실험 전반에 걸쳐 동일한 염료 농도를 보장하기 위해 모든 용액을 마스터 믹스하여 준비하는 것이 좋습니다. - 깨끗한 메스로, 식민지 또는 고체 배양의 주변에서 15mm x 15mm 샘플을 잘라 커버 슬립에 중간 방울 옆에 수직으로 배치합니다.
- 메스를 사용하여 블록의 상부 가장자리를 지지하고 손가락으로 블록의 뒤쪽을 제자리에 고정시키고, 균사체 또는 세균을 액체에 운반하는 측면을 천천히 낮춥시다. 견본은 현미경 단계로 전송을 위한 지금 준비되었습니다.
주의: 세포의 기계적 스트레스를 최소화하고 샘플과 커버 슬립 사이에 끼어있는 기포를 피하기 위해 천천히 매우 신중하게 이 작업을 수행하는 것이 필수적입니다.
- 1.4 단계에서 액체 세균 배양액을 장착합니다.
참고 : 가장 편리하게, 챔버 마이크로 웰 슬라이드의 액체 세균 배양은 현미경 단계에서 직접 전송되고 추가로 조작 될 수 있습니다.- 22 μL의 염료 작업 용액을 200 μL의 액체 배지에 첨가하여 표준 최종 농도2 μM 염료및 0.1% w/v DMSO를 생성합니다.
참고: 액체 세균 배양배양은 형광 염료(또는 억제제와 같은 다른 화학물질)가 실험의 원하는 시점에서, 또한 기록 중에 첨가될 수 있다는 큰 장점을 갖는다. 이 경우 세포를 방해하지 않기 위해 액체 방울을 매우 천천히 투여하기 위해 특별한주의를 기울여야합니다. 시스템 진동과 브라운 운동은 이미 일부 세포 움직임을 도입 할 수 있습니다.
- 22 μL의 염료 작업 용액을 200 μL의 액체 배지에 첨가하여 표준 최종 농도2 μM 염료및 0.1% w/v DMSO를 생성합니다.
4. 살아있는 세포 현미경 검사법
- 기본 이미지 수집 설정을 조정합니다. 다음 이미지 수집 설정은 개별 하이픈에서 염색 역학을 캡처 할 수 있으며 다음 의 두 가지 모두에 적용 할 수 있습니다
- 장치의 전체 출력 전력의 20 %의 5-10 % 레이저 전력을 적용하십시오.
- 높은 수치 조리개 ≥ 1.2로 플랜 아포 60x-63x 글리세롤 또는 수몰입 목표를 사용하십시오.
- 이미지 크기를 1024 x 256 픽셀로 설정하고 광학 줌 계수를 2-3으로 설정하여 이미지 수집 영역을 하이픈의 윤곽선으로 제한합니다.
- 400Hz의 양방향 스캐닝을 사용합니다.
- 가장 민감한 검출기의 게인을 100%로 설정합니다.
- 타임 랩 레코딩의 경우, 염료 표백이나 사진 응력 없이 적절한 시간적 해상도를 허용하기 위해 15초마다 한 프레임씩 이미지 수집을 시작합니다.
- 3D 레코딩의 경우, 상한 및 하한 공간 한계를 하이픈 및 공간 광학 섹션의 경계로 설정하여 1 μm 간격으로 하여 합리적인 공간 해상도를 허용합니다.
참고: 하이픈의 빠른 성장으로 인해 Z축의 높은 공간 해상도는 X/Y 축 또는 다른 방법으로 높은 시간 해상도를 위해 희생되는 경우가 많습니다. 매우 현대적인 공초점 레이저 스캐닝 현미경만이 두 가지 요구를 모두 충족할 수 있을 만큼 빠릅니다.
- 내분비증 섭취 아세
- 그림 1 및 표 1을 참조하여 현미경 검사법 시스템에서 사용할 수 있는 FM 1-43 및/또는 FM 4-64에 대한 최상의 여기/방출 설정을 식별하고 그에 따라 조정하십시오.
참고 : 권장 2 μM 농도로, 혈장 막에 FM 염료의 혼입은 정상적인 건강한 세포에서 즉각적입니다. 초기 플라즈마 멤브레인 염색에서 관형 액포에 있는 염색 외관에 전체 프로세스는 일반적으로 실온에서 30-45 분 안에 완료됩니다. FM 염료 농도를 높이면 S/N 비율이 증가하여 더 높은 콘트라스트 이미지를 더 빨리 생성합니다. 그러나, 그것은 또한 소기관 염색의 연대순 승계를 구별하는 것을 더 어렵게 만드는 표지 과정을 가속화합니다. - 위의 권장기본 이미지 수집 설정을 사용하여 이미지 기록을 시작하고 결과를 평가합니다.
- 실험이 집중되는 플라즈마 멤브레인 또는 내분비증 역학의 양상을 포착하는 데 필요한 공간 및 시간적 해상도로 이미지 수집 설정을 최적화합니다.
- 예를 들어 X/Y에서 매우 빠른 역학을 캡처하려면 전체 이미지 크기를 줄이고 하나의 초점 평면만 이미지화하고 스캔 속도를 1fps로 높입니다. Z축에서 더 높은 해상도의 경우 X/Y해상도를 줄이고 이미지 크기를 줄이고 광학 섹션 사이의 거리를 0.5 μm로 줄입니다.
- 그림 1 및 표 1을 참조하여 현미경 검사법 시스템에서 사용할 수 있는 FM 1-43 및/또는 FM 4-64에 대한 최상의 여기/방출 설정을 식별하고 그에 따라 조정하십시오.
- 세포벽 역학
- 그림 4 및 표 1을 참조하여 현미경 검사법 시스템에서 사용할 수 있는 적용된 세포벽 염료에 대한 최상의 여기/방출 설정을 식별하고 그에 따라 조정하십시오.
참고: 광범위한 방출 스펙트럼으로 인해 CFW 및 SPF는 다른 형광체, 주로 GFP와 동시 공동 이미징에 적합하지 않습니다. 몇몇 제한은 이 염료를 가진 순차적인 화상 진찰 접근을 위해 적용하고, 그러므로 개별적으로 최적화되어야 합니다. - 위의 권장기본 이미지 수집 설정을 사용하여 이미지 기록을 시작하고 결과를 평가합니다.
참고 : 권장 2 μM 농도로 염료를 세포벽에 통합하는 것은 반드시 즉각적이지는 않지만 합리적으로 빠릅니다. 중격 형성의 전체 과정, 예를 들어, 실온20에서평균 약 5-7 분 소요. 세포벽 염료 농도를 높이면 S/N 비율이 증가하여 더 높은 콘트라스트 이미지를 더 빨리 생성합니다. 그러나, 또한 유도된 세포벽 손상 수리로 인한 유물을 급속히 도입한다. - 4.2.3절에 설명된 바와 같이 실험이 집중되는 세포벽 형태형성의 양상을 포착하는 데 필요한 공간 적 및 시간적 해상도로 이미지 수집 설정을 최적화한다.
- 그림 4 및 표 1을 참조하여 현미경 검사법 시스템에서 사용할 수 있는 적용된 세포벽 염료에 대한 최상의 여기/방출 설정을 식별하고 그에 따라 조정하십시오.
결과
정량적 이미지 분석
세포 과정을 "그냥" 시각화하는 것 외에도, 라이브 셀 이미징은 기록된 데이터에서 정량적 정보를 추출할 수 있습니다. 일반적으로, 정량적 이미지 분석은 적절한 토론이 이 문서의 범위를 훨씬 벗어난 복잡한 주제이므로 독자는 전용 교과서 및 기사39,40,41로지칭됩니다. 그럼에도 불구하고 다음 예제 데이터와 관련된 몇 가지 기본 지침이 제공됩니다. (1) 형광 염료의 정의된 어금니가 정확한 상대적 비교를 허용하기 위해 모든 샘플에 적용되어야 합니다. (2) 이미지 수집 설정은 방출 광 검출기가 포화되지 않는 방식으로 조정되어야하며, 그렇지 않으면 최대 강도가 차단됩니다. (3) 이미지 수집 설정은 일관된 실험 세트의 과정에서 고정 된 상태로 유지되어야하며, 그렇지 않으면 인공 강도 변화가 도입됩니다. (4) 이미지 데이터는 모든 계측기 설정을 포함하는 메타 정보와 함께 정보 무손실 파일 형식으로 저장되어야 합니다. 및 (5) 이미지 분석은 원하는 정량적 정보를 추출하는 데 필요한 최소한의 사후 처리 단계로 제한되어야 한다.
일반적으로 기록된 신호의 절대 정량화를 허용하는 정의된 표준은 살아있는 셀에서 사용할 수 없습니다. 따라서 가장 간단한 형태로 정량적 이미지 분석은 동일한 이미지 내의 픽셀 강도또는 동일한 설정으로 기록된 다른 이미지 간의 상대적인 비교에 의존합니다. 제조업체의 현미경 제어 소프트웨어는 일반적으로 이미지 후처리 및 정량 분석을 위한 기본 도구를 포함하거나 이미지 세분화, 임계값, 비율 이미징 등을 위한 추가 기능으로 업그레이드할 수 있습니다. 다양한 유형의 이미징 데이터에 다르게 적합한 여러 오픈 소스 이미지 처리 플랫폼을 사용할 수 있으며 ImageJ(https://imagej.net, https://imagej.nih.gov/ij/), 얼음(http://icy.bioimageanalysis.org/), CMEIAS 바이오이미지 정보학(http://cme.msu.edu/cmeias/) 및 Wimasis(https://www.wimasis.com/en/)를 포함합니다.
제시된 예제 데이터는 ImageJ 플랫폼을 사용하여 처리및 분석되었습니다. 간단히, 하이프 정점 또는 septa와 같은 셀의 특정 영역은 상당한 영역 선택 도구로 표시되고, 포함된 모든 픽셀의 강도는 소프트웨어가 구현된 "측정 도구"를 사용하여 판독됩니다. 컨트롤 및 실험 샘플의 강도 데이터는 스프레드시트 파일로 전송되어 수학적으로 분석되고 그래프로 준비됩니다. 자세한 내용은 인용된 원본 간행물에서 찾을 수 있습니다.
예 데이터 1: FM 4-64 섭취 분석
진균 샘플을 콜로니(단계 1.2)로 재배하고 반전된 한천 블록 방법(단계 3.1)에 의해 장착하였다. FM 4-64의 최종 농도는 1.67 μM. 이미징 설정이었다: HCX PL APO 63x/1.3 NA 글리세롤 침지 대물면공포 레이저 스캐닝 현미경(재료 표참조); FM 4-64 488 nm에서 흥분 및 600-700 nm에서 방출; 최대 150분 동안 1개의 프레임마다 FM 4-64 흡수 측정은 T. atroviride9의 진균 특이적 Sur7-family 단백질 2(Sfp2)의 유전자 결실 및 유전자 과발현 돌연변이체에서 내분비증의 내측세포증의 spatio-temporal 조직에서 결함을 확인하였다(그림5).
예시 데이터 2: 내시경 구획을 대상으로 하는 형광 융합 단백질의 FM 4-64 공동 염색
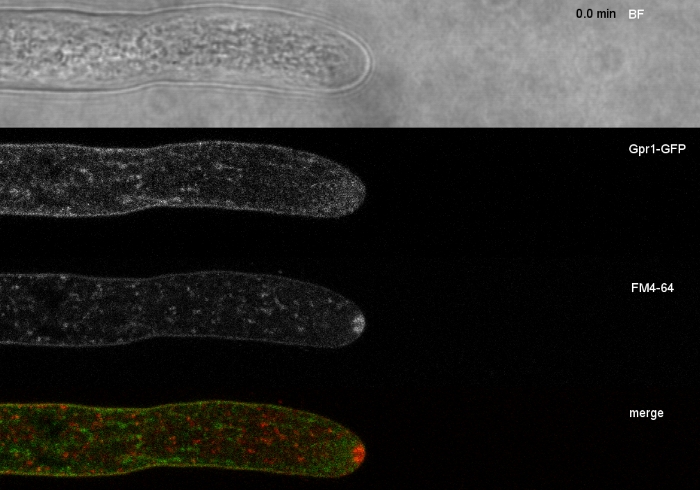
진균 샘플을 콜로니(단계 1.2)로 재배하고 반전된 한천 블록 방법(단계 3.1)에 의해 장착하였다. FM 4-64의 최종 농도는 2 μM. 이미징 설정이었다: CFI 계획 아포 VC 60x/1.2 NA XC 침지 대물 항포 레이저 스캐닝 현미경 (재료 표참조); 488 nm에서 GFP 여기 및 500-530 nm에서 방출, FM 4-64 488 nm에서 여기 및 600-700 nm에서 방출, 및 투과 광 검출기와 밝은 필드, 모두 동시에; 1프레임마다 15s마다 최대 15분. FM4-64 코염색은 2개의 강화된 녹색 형광 단백질(EGFP)-태그된 막막 단백질 Sfp2 및 Gpr1의 세포내외 분포를 T. atroviride의 내분비 통로에 관련시키기 위해 사용되었다(도 6, 영화 3, 영화 4).
예시 데이터 3: 형태유전학적 차이의 식별을 위한 FM 4-64 공동 염색
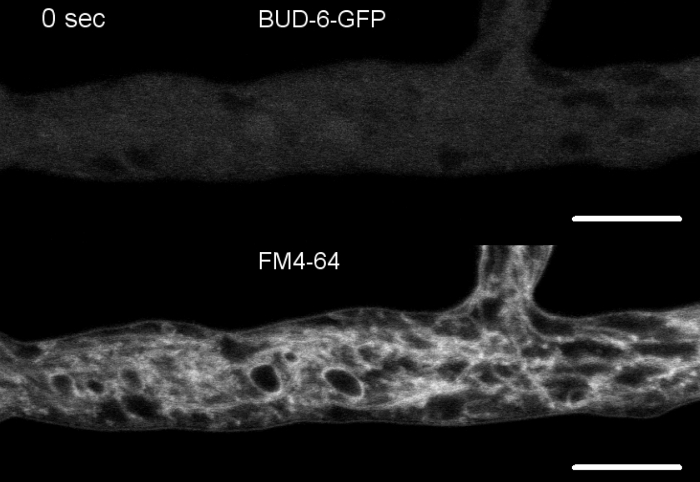
진균 샘플을 콜로니(단계 1.2)로 재배하고 반전된 한천 블록 방법(단계 3.1)에 의해 장착하였다. FM 4-64의 최종 농도는 2 μM. 이미징 설정이었다: 역공초점 레이저 스캐닝 현미경에 대한 계획 Apochromat 63x/1.4 NA 오일 침지 목표 (재료 표참조); 488 nm에서 GFP 여기 및 505-550 nm에서 방출, FM 4-62 488 nm에서 여기 및 574-691 nm에서 방출, 및 투과 광 검출기와 밝은 필드, 모두 동시에; 최대 15분 동안 8.5초마다 한 프레임씩. FM4-64 코염색은 패혈증 및 편광 된 하이프 팁 성장의 형성과 같은 인신 매매 의존적 과정에 형광표지 된 BUD-6 편성 복합 단백질의 세포 내구 국소화 역학을 관련시킬 수 있으며, 야생 형과돌연변이 균주 사이의 세포조직 및 수면 구조의 차이를 특징으로 하는 7.
예시 데이터 4: 세포벽 염색은 형태유전학적 차이를 보여줍니다.
진균 샘플을 콜로니(단계 1.2)로 재배하고 반전된 한천 블록 방법(단계 3.1)에 의해 장착하였다. 2 μM CFW, 20 μM SPF 및 100 μM CR의 최종 농도를 사용했습니다. 이미징 설정: CFI 계획 Apo VC 60x/1.2 NA XC 침지 대물 항공 초점 레이저 스캐닝 현미경(재료 표참조) CFW 및 SPF 여기405 nm및 방출 430-470 nm, CR 여기 543 nm 및 580-620 nm에서 방출. CFW, SPF 및 CR의 상이한 상호작용 특성은 Δsfp2 돌연변이체와 T. atroviride9의야생 형 균주 사이의 형태학적 차이를 강조한다. 상승된 염료 농도에 의해 가해지는 세포벽 응력 증가는 야생 형에 비해 돌연변이체에서 더 빠르고 두드러지게 발생한다. 또한 동일한 이미지는 두 균주 사이의 하이프 직경 및 격막 거리에 관한 형태학적 차이를 정량화할 수있습니다(그림 8).
예시 데이터 5: 세포벽 생합성 실시간 모니터링
세균은 8웰 챔버형 마이크로 슬라이드(단계 3.2)에서 액체 배양물(step 1.4)으로 재배하였다. 최종 CFW 농도는 0.12 μM. 이미징 설정: CFI 플랜 아포 VC 60x/1.2 NA XC 침지 목표와 역전된 공초점 레이저 스캐닝 현미경; 405 nm에서 CFW 여기 및 420-470 nm에서 방출; 최대 35분 동안 20초마다 한 프레임씩. 매우 낮은 CFW 농도는 염료 분자로 세포벽의 포화를 방지하고 세포벽 생합성의 정량적 실시간 모니터링을 가능하게 합니다. 이것은 새로운 세포벽 물질의 증착이 균일하지 않다는 것을 밝혀내지만 N. crassa에서 배닝 융합이전에 세포 부착 시 하나의 세포의 상대적 변위로 인한 국소물리 스트레스에 매우 빠르게 반응한다(그림9, 영화 6).
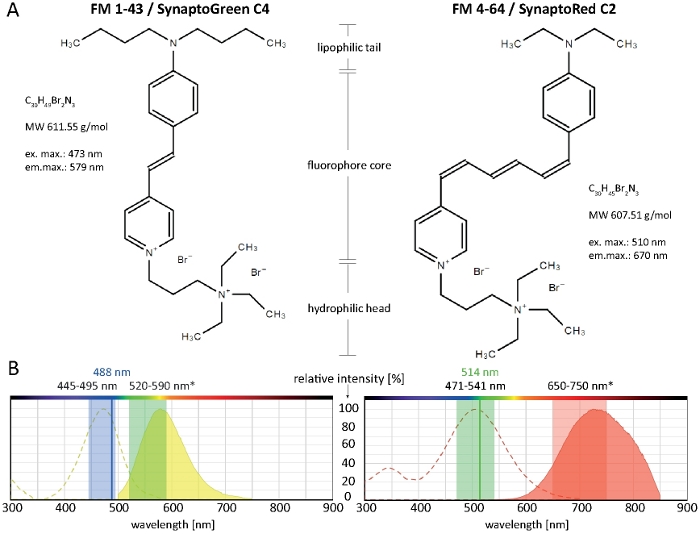
그림 1: FM 염료의 생화학적 및 생화학적 특성. (A)FM 1-43/시냅토그린 C4 및 FM 4-64/시냅토레드 C2의 화학 적 구조. (B)두 FM 염료의 흡수 및 방출 스펙트럼, 필라멘트 곰팡이에 막 바인딩 염료에 대한 최적의 이미징 설정과 오버레이 : 445-495 nm 블루 라이트는 100-80 % 효율로 FM 1-43을 흥분시키는 반면, 아르곤 레이저의 488 nm은 91 % 효율로 염료를 흥분시킵니다. 멤브레인 결합 시 청색 시프트(*)로 인해 FM 1-43 방출의 최적 검출 범위는 520-590 nm 사이입니다. 마찬가지로, 곰팡이의 FM 4-64에 대한 최적의 이미징 설정은 471-541 nm (100-80 % 효율)이며 아르곤 레이저를 사용할 때 다색 여기 광원 또는 514 nm (99 % 효율)을 사용하고 방출 광 검출을위한 650-750 nm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
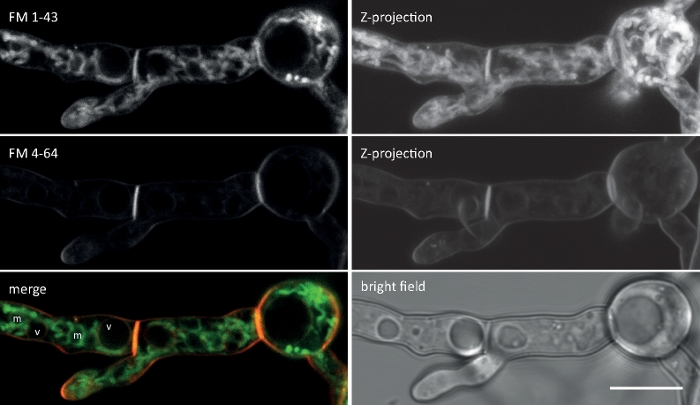
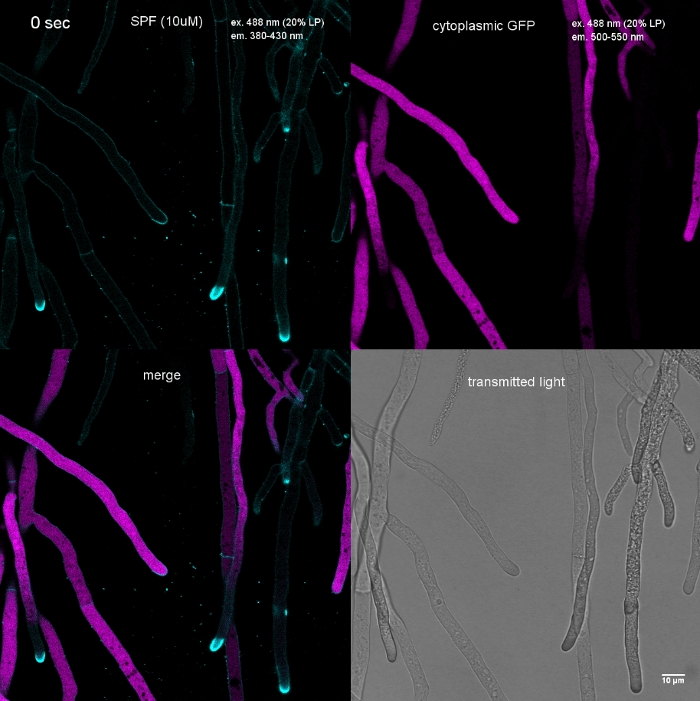
그림 2: FM 1-43 및 FM 4-64의 동시 공동 이미징. 두 염료의 등구 혼합물을 10 μM의 최종 농도를 산출하는 N. crassa의 액체 배양물에 첨가되었다. 염료 첨가 후 25 분, FM 1-43은 플라즈마 멤브레인을 염색하고 이미 내부 멤브레인에 축적되어 있으며, 강하게 염색 된 미토콘드리아 (m)를 포함하지만 크게 백공 막 (v)을 제외하고, FM 4-64 (평균 형광 강도 176 에서 21)에 비해 8 배 이상 강하며, 그 낮은 소수성 / 높은 친수성은 혈장에서 장기간 거주 시간으로 이어지는 내성 속도를 느리게합니다. 배율 표시줄 = 10 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
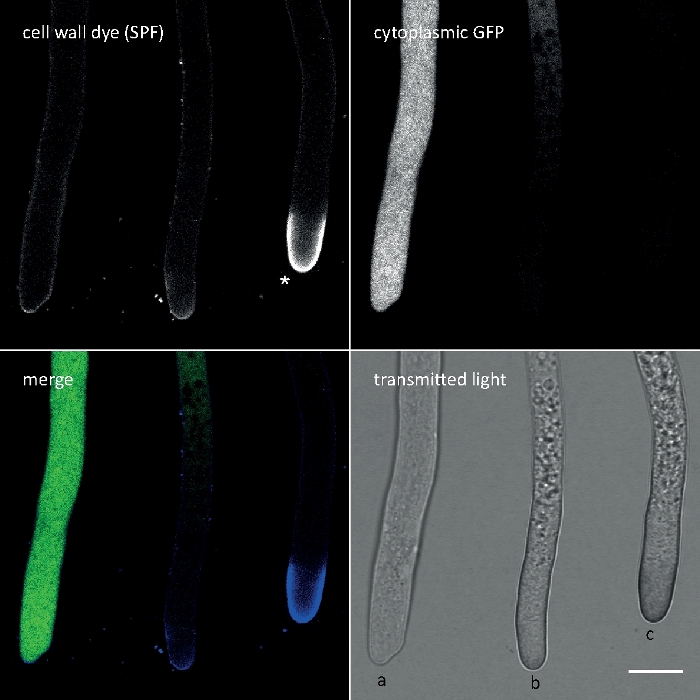
그림 3: 팁 정점에 있는 세포벽 응력 유도 증착은 종종 세포 자동 분해를 수반한다. 세포질 GFP를 발현하는 T. 아로비라이드의 하이페는 10 μM 솔로페닐 플라빈 7GFE 500(SPF)으로 염색하고 장착 시 즉시 이미지화하였다. 비스트레스 하이픈(a), 정점에 글루칸/키틴 증착이 약간 증가하고 자가분해(b)가 진행되고, GFP 형광및 광범위한 진공화의 총 손실에 의해 명백한 정점 글루칸/키틴 캡(별표) 및 말단 자동 분해(c)를 가진 과면을 심하게 응력된 하이픈을 가미한다. 배율 막대 = 10 μm. 풀 타임 코스 순서는 동영상 1을 참조하십시오. 세 개의 하이픈은 실제로 서로 옆에 있었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
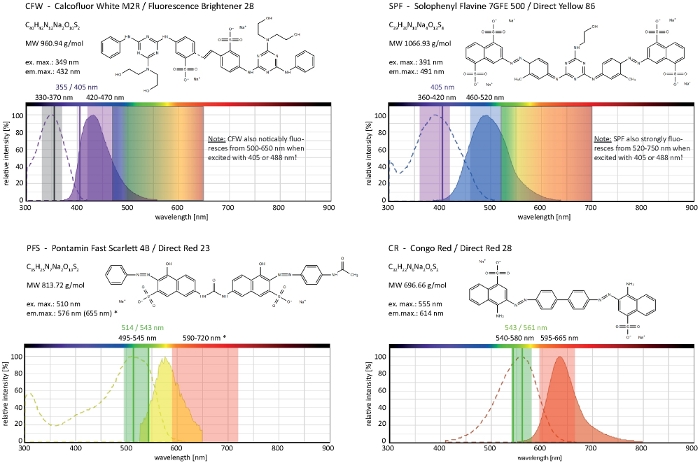
그림 4: 세포벽 선택적 염료의 생화학적 및 생화학적 특성. 주어진 화학적 특징은 각 염료의 나트륨 염입니다. 흡수 및 방출 스펙트럼은 세포 환경의 스펙트럼과 일치합니다. 표색 단색 레이저 여기 선 (색상으로 작성), epifluorescence 현미경에 적용 할 수있는 다색 여기 범위, 및 방출 광 검출 범위는 필라멘트 곰팡이의 이미징에 권장됩니다. 두 레이저 여기 라인 둘 다 동등 하 게 잘 작동 하는 경우 표시 됩니다. (*) 세포 벽 결합 PFS의 방출 스펙트럼은 이전에 언급 한33보다훨씬 더 적색 이동, 그러나, 이전보다 낮은 염료 농도와 매우 좋은 S / N 비율의 결과. CR의 전체 스펙트럼은 현재 사용할 수 없으므로 나일 레드 (CAS 번호 : 7385-67-3)가 가장 가까운 일치로 표시됩니다. CR의 스펙트럼 특성에 대한 자세한 정보는 다른 곳에서 찾을 수 있습니다42. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
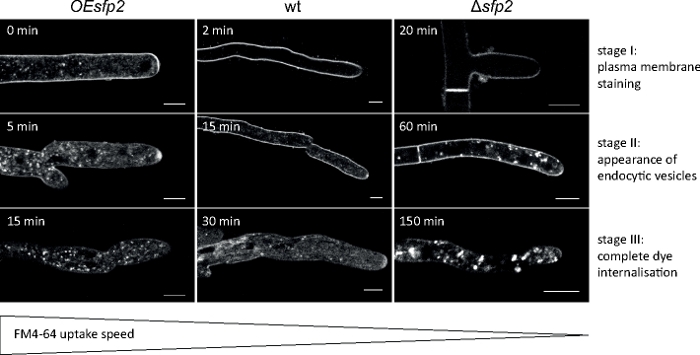
그림 5: FM4-64의 내분비 섭취에 Sfp2의 영향. FM 염료 의 3 개의 연속적인 주요 단계는 야생 형 (wt)에서 쉽게 식별 할 수 있습니다. 단계 I: 배타적 인 혈장 막 염색, 단계 II : 내분비 소포에서 FM 염료의 첫 번째 출현 및 단계 III : 내분비 소포 및 내막의 독점적 인 염색. 등가 염색 패턴은 외관의 초기 시점에 표시됩니다. T. atroviride 야생 형에 비해, 내분비증은 sfp2 과발현 돌연변이체 (OEsfp2)에서약간 가속되는 반면, 염료 흡수는 sfp2 결실 돌연변이체에서 극적으로 지연된다 (Δsfp2). 예를 들어, 혈장 막으로 염료 섭취는 OEsfp2에서 즉시 발생하지만 야생 유형에서는 2 분이 걸립니다. 플라즈마 막에서 FM 염료의 완전한 내화는 Δsfp2에비해 OEsfp2에서 10 배 더 빨리 발생합니다. 배율 막대 = 5 μm. 그림은 크리에이티브 커먼즈 라이선스(https://creativecommons.org/licenses/by/4.0/)와 계약을 맺고 아타나소바외 9에서 재현됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
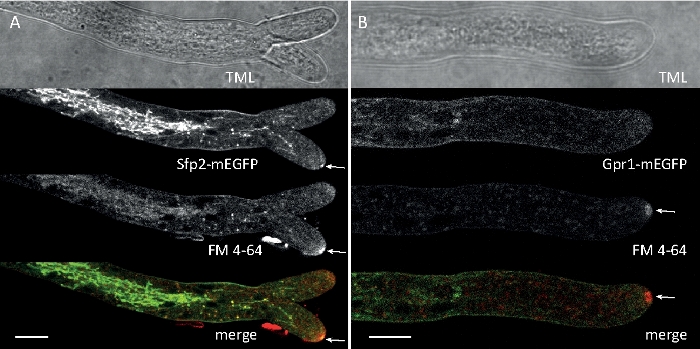
도 6: FM 4-64를 가진 EGFP 표지된 막 단백질의 공동 염색은 T. atroviride에서뚜렷한 세포내 국소화 역학의 분화를 용이하게 한다. (A)4-막 도메인 단백질 Sfp2는 혈장 막 및 패혈증, 스피첸쾨퍼 (Spk; 화살표) 및 아마도 관형 액포를 포함한 FM4-64 표지 된 세포기관과 공동 국소화한다. (B)GPCR 유사 7-막 단백질 Gpr1은 Spk. 스케일 바, 10 μm을 제외하고 Sfp2와 동일한 세포기관에 FM4-64와 공동 국소화한다. 풀 타임 코스 시퀀스는 동영상 3 및 무비 4를 참조하십시오. 이 수치는 크리에이티브 커먼즈 라이선스와 계약을 맺고 아타나소바 외9에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
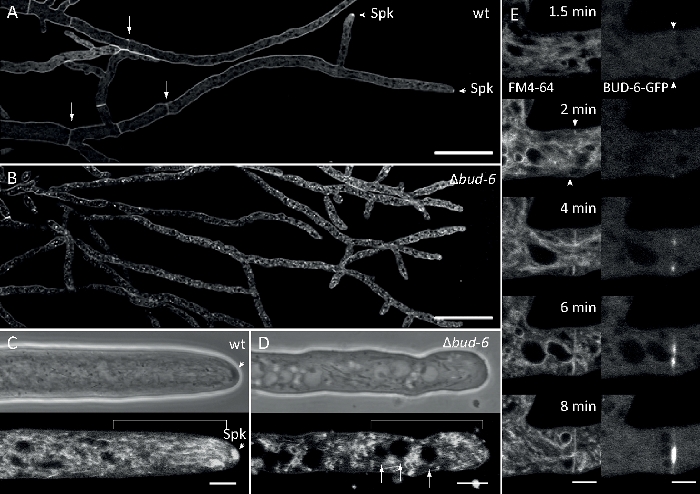
그림 7: FM 4-64 염색은 Δ버드-6 돌연변이체를 야생형과 구별하고, 중격 고리에서 BUD-6을 국소화한다. (A) N. crassa 야생 형의 하이픈의 FM 4-64 염색 (화살표는 셉파를 나타내고 화살촉은 Spk를 나타낸다). (B)Septa와 Spk는 부동부동-6에결석합니다. 스케일 바, 50 μm.(C 및 D)와일드 타입 (C) 및묘싹-6 (D)의 하이포 정점 및 subapex의 클로즈업. Spk (화살촉)는 야생 유형에서 구별되지만싹 -6은아닙니다. 괄호는핵배제 구역이 설치되지 않은 것을 나타냅니다. 스케일 바 = 5 μm.(E)BUD-6-GFP 모집은 플라즈마 막 의 질(arrowheads) 및 수반되는 중격 수축을 선행한다. 배율 막대 = 5 μm. 전체 시간 코스 시퀀스는 동영상 5a 및 무비 5b를 참조하십시오. 그림은 크리에이티드 커먼즈 라이선스와 계약을 맺고 Lichius 등16에서 수정하여 복제되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
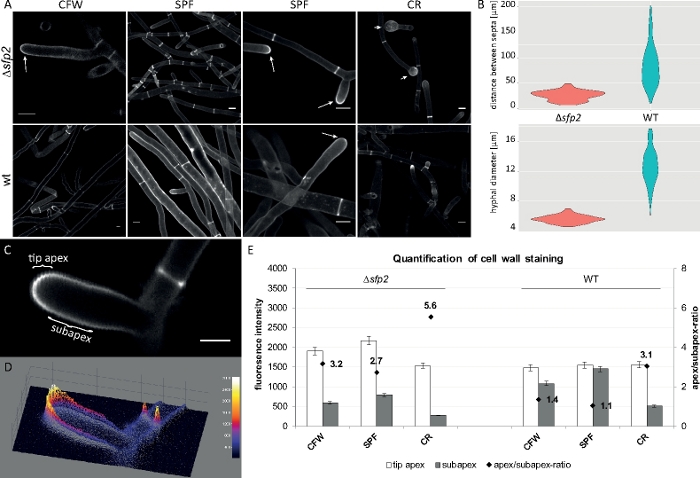
도 8: sfp2의 결실은 세포벽 물질의 증착 패턴을 변경하고 T. atroviride의 하이프 형태 형성에 영향을 미친다. (A)CFW 및 SPF 염색은 야생형(wt)에 비해 Δsfp2(화살표)에서 세포벽 침착이 증가한 것을 보여준다. CR 염색은 Δ sfp2(화살촉)에서만 광범위한 팁 팽창을 유도합니다. 스케일 바 = 10 μm.(B)Δsfp2의 형태유전학적 결함은 현저하게 감소된 격격 거리(Δsfp2 = 26.0 μm, 야생형 = 85 μm; n=60; ANOVA Pr < 2−16) 및 더 작은 하이픈 직경(θsfp2 = 5.6 μm, 야생형 = 12.6 μm; n=100; ANOVA Pr & 2−16). (C)비팁 정점에 있는 염료 형광이 서브아펙스에 비해 증가하였다. 축척 막대 = 5 μm.(D)강도 코드3D 표면 플롯 (C). (E)Δsfp2 및 야생 유형(n =55)에서 상대 형광 강도의 정량화. 그림은 크리에이티브 커먼즈 라이선스와 계약을 맺고 아타나소바 외9에서 재현되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
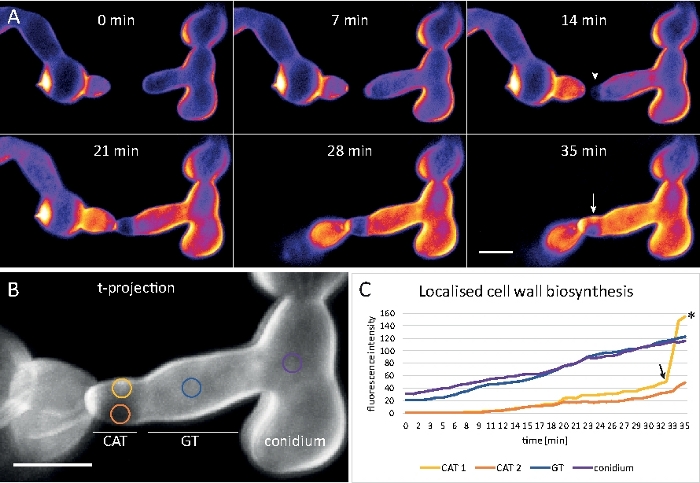
도 9: 세포벽 생합성의 실시간 모니터링. (A)코니디얼 해부학 튜브 (CAT) N. crassa의세균 사이의 융합. 신체 접촉은 세균 토크 반응 (21-28 분)에 의해 명백해집니다. 강도 색으로 구분된 CFW 형광은 (진한 파란색) 및 강렬한(노란색) 세포벽 침착이 있는 영역을 나타냅니다. 처음에는 얼룩지지 않은 호밍 팁(화살촉)이 팁 접촉 시 및 가장 큰 물리적 응력(화살표)을 경험하는 영역에서 새로운 세포벽 재료를 침전시 입금합니다. 배율 막대 = 5 μm. 풀 타임 코스 순서는 동영상 6을 참조하십시오. 38에서 사용 권한으로 재현 된 그림. (B)형광 강도를 측정한 4개의 원형 영역을 나타내는 (A)의 투영. 배율 막대 = 5 μm. (C)물리적 응력에 반응하여 국부적인 세포벽 생합성의 급속한 증가를 나타내는 표시된 영역의 플롯(CAT 1, 화살표). 세균 튜브 (GT)와 포자 체 (코니듐)에서 세포 벽 생합성이 꾸준히 증가합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
동영상 1: 염료 유도 세포벽 응력. 10 μM SPF(시안)를 세포질 GFP(마젠타)를 발현하는 T. 아로비라이드 하이페에 첨가하였다. 광범위한 팁 염색은 즉시 발생하고 2 분 이내에 하이팔 구획의 빠른 림프가 뒤따릅니다. GFP 형광의 실종에 의해 분명. 이 영화를 다운로드하려면 여기를 클릭하십시오.
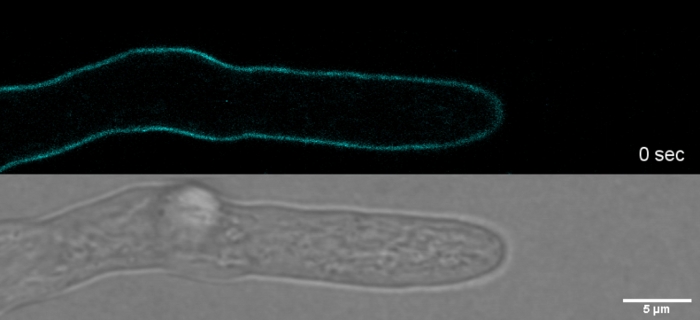
영화 2: 바이탈 SPF 염색. 2 μM SPF(시안)는 팁 정점에 세포벽 응력 아티팩트를 유도하지 않고도 높은 공간 및 시간적 분해능으로 T. atroviride hyphae의 팁 성장을 추적할 수 있게 한다. 이 영화를 다운로드하려면 여기를 클릭하십시오.
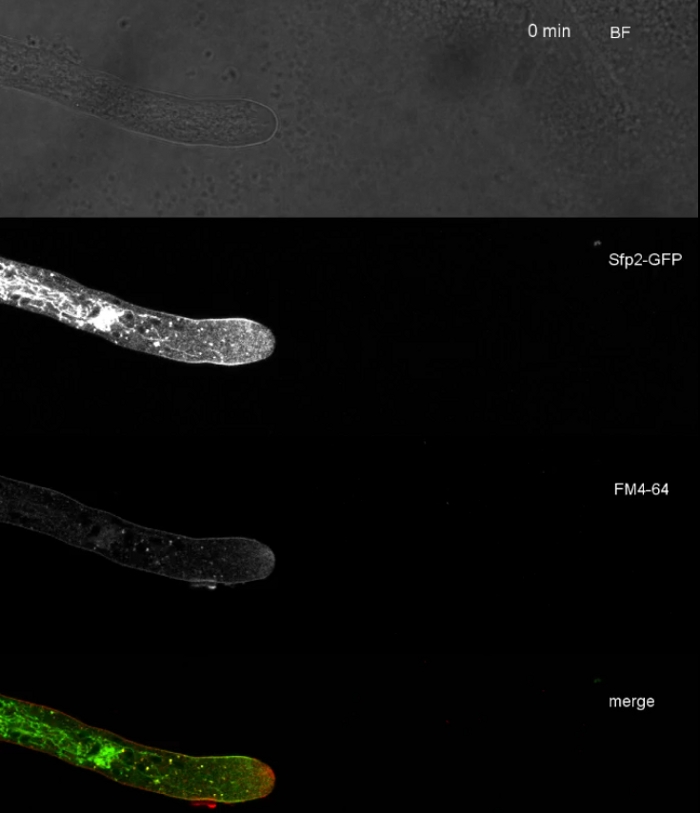
영화 3: Sfp2-GFP의 FM 4-64 공동 염색. 1.67 μM FM 4-64(적색)로 Sfp2-mEGFP(녹색)를 발현하는 T. atroviride의 공동 염색은 내분비 경로와 막 단백질의 중첩 및 뚜렷한 국소화를 나타낸다. 이 영화를 다운로드하려면 여기를 클릭하십시오.
영화 4: Gpr1-GFP의 FM 4-64 공동 염색. 1.67 μM FM 4-64(적색)로 Gpr1-mEGFP(녹색)를 발현하는 T. atroviride의 공동 염색은 내분비 경로와 막 단백질의 중첩 및 뚜렷한 국소화를 나타낸다. 이 영화를 다운로드하려면 여기를 클릭하십시오.
영화 5 : 버드 6-GFP의 FM 4-64 공동 염색. (5a)2 μM FM 4-64 (빨간색)와 함께 BUD-6-GFP (녹색)를 발현하는 N. crassa의 공동 염색은 관련 혈장 막 의 질에 비해 중격 형성 동안 BUD-6 역학의 추적을 허용한다. (5b)(5a)의 이미지를 잘라 병합합니다. 영화 5a를 다운로드하려면 여기를 클릭하십시오.
영화 5b를 다운로드하려면 여기를 클릭하십시오.
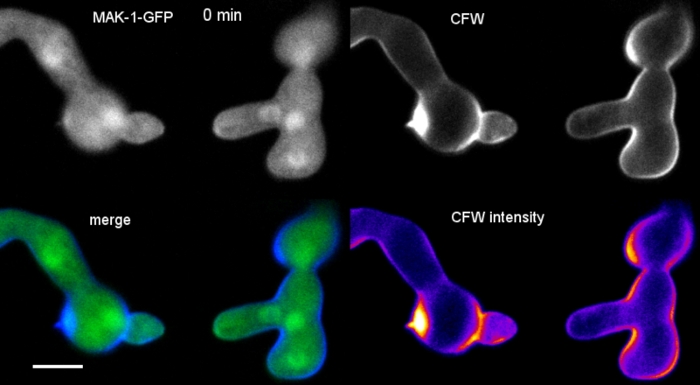
영화 6: 세포벽 생합성의 실시간 모니터링. Mak-1-GFP(녹색)를 발현하는 N. crassa 세균은 0.12 μM CFW(청색)로 공동 염색하여 CAT 매개 세균 융합 동안 국부화된 세포벽 생물발생을 밝혀내도록 하였다. CfW 신호를 통해 GFP 채널에 약간의 출혈이 있으며, SPF 또는 CR이 각각 GFP에 대한 순차적 및 동시 동시 동시 이미징 염료로 더 나은 선택임을 보여줍니다. 이 영화를 다운로드하려면 여기를 클릭하십시오.
표 1: 멤브레인 및 세포벽 선택적 형광 염료의 특성. * = 모든 용액에서 등가성을 초래하기 위해 감소 된 순도 / 염료 함량에 대해 수정 된 mg / mL 값; n.i.a. = 사용 가능한 정보가 없습니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
본 기사는 2000년대 초반2,4,43, 2,4,43,및 FM 염료 및 선택된 세포벽 염료의 광물리및 세포 생물학적 특성에 대해 이전보다 더 자세하게 논의하려고 시도하는 필라멘트 균류에 대한 중요한 소기관 마커로서 다양한 형광 염료의 사용을 확립한 획기적인 작업을 계속한다. 특히 특정 염료 농도 이상으로 발생하는 막 포화 또는 세포벽 손상과 같은 원치 않는 세포 효과에 대하여. 이전에 세포 수준에서 비 독성으로 간주 되 고 무엇 지금 분자 수준에 독성으로 간주 됩니다. 이러한 효과는 매우 미묘하고 세포 기관 또는 세포 행동의 명백한 변화에 의해 직접 적으로 분명하지 않을 수 있지만, 시각화 이외의 염료 응용 프로그램의 가능한 간섭은 네이티브 분자 기능의 조사를 위해 최소화되어야한다. 다행히실리콘 눈사태 광다이오드 검출기(Si-APDs)44 또는 Airyscan 영역검출기(45)와같은 현대 검출기의 감도 및 양자 효율이 개선되어 이전보다 훨씬 낮은 염료 양을 쉽게 사용할 수 있습니다. 이 기사의 또 다른 주요 목적은 생물학에서 가장 자주 사용되는 형광 단백질로서 GFP의 다른 형광단과 이러한 염료의 공동 이미징 특성을 예시하는 것입니다. 이것은 형광 융합 단백질의 세포내구화 역학을 곰팡이 세포벽, 혈장 막 또는 endo- 및 외신세포증 통로 등과 상관시키는 것을 목표로 하는 화상 진찰 실험의 디자인을 원조할 것입니다.
자연적이고 스트레스없는 조건에서 이미징은 신뢰할 수있는 데이터를 수집하기위한 열쇠입니다. 배양 배지 및 시료 준비에 관한 몇 가지 실질적인 고려 사항은 주어진 시료에 대해 가능한 가장 높은 S/N 비율을 가진 건강하고 스트레스없는 세포를 장시간 관찰할 수 있는 최적의 조건을 찾는 출발점을 제공하는 것을 목표로 합니다. 신뢰할 수 있고 의미 있는 이미징 결과를 얻을 수 있는 보편적인 방법은 없습니다. 샘플의 생물학적 변이, 주관성 및 현미경의 기대치뿐만 아니라 이미지 후처리가 각각 데이터 수집 및 해석에 상당한 영향을 미친다는 접근법에 내재되어 있습니다. 따라서, 마이크로 스코피스트의 실제 경험, 조사 중인 곰팡이의 세포 생물학에 대한 그녀의 / 그의 친밀한 지식뿐만 아니라 실험실 환경에서 가능한 한 '자연'과 방해받지 않는 조건을 만드는 숙련 된 샘플 준비는 연구 된 세포 현상을 진실하게 반영하는 이미징 데이터를 획득하고 평가하는 데 가장 중요합니다. 엄지 손가락의 규칙으로, 형광 염료의 원치 않는 부작용의 발생, 미묘하 고 따라서 플라즈마 막 또는 세포 벽 재 모델링 스트레스 응답 경로의 명백 하 게 눈에 띄는 활성화에서 세포 자동 용해의 간단한 세포 독성 유도, 단지 안전 하 게 낮은 염료 농도 적용 하 여 방지할 수 있다 ≤2 μM.
형광 염료의 적용은 간단하지만 특이성은 제대로 특성화되지 않습니다. 형광 염료를 사용하는 주요 강점은 실험 프로토콜의 예비 단순성입니다. 곰팡이의 재배 및 샘플링, 염료의 첨가 및 현미경 단계에 장착하는 것은 간단합니다. 여기 및 방출 파장, 노출 시간, 시간 과정 설정 등을 포함하여 기본적인 화상 진찰 조정은, 세포 안쪽에 사용된 형광 염료의 현미경 및 생물학 규칙의 간단한 생물물리학 규칙을 따릅니다. 표 1은 실험을 위한 가장 적합한 염료 또는 염료 조합의 식별을 지원하기 위한 것입니다. 또한 형광 염료는 합리적인 가격으로 신뢰할 수있는 고품질로 쉽게 사용할 수 있으므로 높은 재현성 적용을 보장합니다.
막 또는 세포벽 선택적 형광 염료를 사용하는 두 가지 주요 제한사항은 (종종) 그들의 정확한 염색 특성에 대한 제한된 지식이며, 대부분의 경우 소기관 및 분자 수준에 비특이적이며, 그들의 농도 의존적 원치 않는 부작용이다. FM 염료는 내분비 및 외세포증에 참여하는 지질 이중층에게 특이적이다. 그러나, 시험된 조건의 밑에 연속적으로 표지되는 정확하게 세포소기관이 즉시 명백하지 않으며, 다른 FM 염료 변이체의 비교를 요구하고, 추가 소기관 특정 마커와 공동 표지를 요구합니다. FM 4-64에 비해 미토콘드리아 멤브레인에 대한 FM 1-43의 선호도가 한 예입니다. 세포벽 선택적 염료는 곰팡이 세포벽의 3대 중합체에 대해 다양한 특이성을 표시한다. CFW는 β-글루칸 및 키틴에 대한 비특이적 얼룩으로 생각되며, SPF는 β-1,4-글루칸에 대해 가장 선택적인 것으로 생각되며, CR은 α-및 β-키틴에 대해 매우 선택적인 것으로 생각된다. 곰팡이 세포벽 다당류에 대한 PFS의 결합 특이성에 대한 정보는 현재 사용할 수 없습니다. 조사 중인 곰팡이 종에서 주어진 염료 농도에서 가장 효과적으로 표지되는 곰팡이 세포벽 중합체의 비율은 쉽게 응답되지 않으며, 다른 유기체 또는 다른 곰팡이 종에서 시험관 내 또는 생체 내에서 획득 된 상세한 측정의 적용은 매우 신중하게 고려되어야합니다. 불행하게도, 이 정보는 희소하고 문헌35,42,46에매우 흩어져 있다. 특히 곰팡이에 있는 추천된 염료의 정확한 염색 특성에 대한 새로운 통찰력을 제공하기 위해 이전 연구33에 따를 최신 기록은 현재 사용할 수 없습니다.
화상 진찰 통제는 염색 패턴 및 세포 반응을 정확하게 평가하기 위하여 필수적입니다. 아마 가장 어려운 부분은, 그러나, 너무 잘 곰팡이의 세포 생물학을 아는 것입니다 막과 세포벽 선택적 형광 염료의 세포 국소화에 기록 된 변화, 세포 구조 또는 hyphal 성장 패턴의 변화는 독점적으로 자신있게 실험 치료의 의도 된 효과와 관련될 수 있습니다. 이를 위해, 어떤 새로운 살아있는 세포 화상 진찰 실험든지 와 더불어 좋은 통제가 있는 것이 중요합니다. 이들은 취득한 심상에서 배경 자동 형광 및 검출기 노이즈를 제외하고, 돌연변이로 작업할 때 형태학적 비교기를 갖기 위하여 음성 화상 진찰 통제로 처리되지 않은 야생 모형을 포함합니다. 더욱이, 양성 이미징 대조군, 예를 들어 세포질 또는 다른 잘 알려진 형광 마커 단백질에서 GFP 또는 RFP를 발현하는 균주, 여기 광 강도를 최소한으로 설정하고 세포 활력 조절을 하는 데 필수적이다. 이러한 컨트롤이 설정되면 형광 염료의 사용은 시각화 작업에만 국한되지 않지만 집중력에 의존하는 염색 역학뿐만 아니라 집중력에 의존하는 부작용이 분석적으로 악용 될 수 있습니다. 예를 들어, 세포벽 생합성을 실시간으로 정량적으로 모니터링하거나 감수성 분석에서 돌연변이 특이적 표현형의 식별을 위해47.
개선된 향후 응용 분야는 염료 염색 특성의 상세한 기능 분석에 의존합니다. 주요 지속적인 과제는 필라멘트 균류에서 막과 세포벽 선택적 형광 염료의 세포내 역학적 평가를 진행하기 위해 정량적 이미지 분석을 더욱 개선하고 자동화하는 것입니다. 이를 위해, 특정 수송 경로에 결핍된 돌연변이 균주와 조합하여 공지된 소기관 및 세포벽 중합체 마커를 사용하거나 특정 구조 성분이 결여된 이들 염료의 광범위한 정량적 공동 국소화 연구가 먼저 요구된다. FM 염료를 가진 비교 분석을 위한 몇몇 내분비증 마커는 유효합니다48,49,및 곰팡이에 있는 세포벽 염료의 아직도 잘못 특성이 없는 결합 특이성에 대하여, 형광 표지된 글루칸 특이적항체(50)의 적용은 이 문제를 해결하기 위하여 1개의 가능성을 제공할 수 있습니다.
공개
저자는 그들이 경쟁 적인 재정적 이익이 없고 공개 할 것이 없다고 선언합니다.
감사의 말
덕분에 티롤리안 과학 기금 (TWF) AL에 교부금 #256524 제공하기위한, 비엔나 과학 기술 기금에 (WWTF) SZ에 교부금 #LS13-086을 제공하기위한, 오픈 액세스 출판을 지원하기위한 인스 브루크 대학의 출판 기금에. 저자는 또한 라이카 TCS SP5 II 공초점 레이저 스캐닝 현미경을 제공하기위한 인스 브루크 대학의 동물학과에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| BRAND cell counting chamber | Merck | BR718005 | Thoma format |
| Calcofluor White M2R | Merck/Sigma-Aldrich | F3543 | cell wall dye |
| CFI Plan Apo VC 60x/1.2 NA XC WI | Nikon | MRD07602 | water immersion objective |
| CFI Plan Apo VC 60x/1.2 NA XC WI | Nikon | MRD07602 | water immersion objective |
| Congo Red | Merck/Sigma-Aldrich | C6277 | cell wall dye |
| Dimethyl sulfoxide | VWR | 8,36,73,230 | organic solvent |
| Eclipse TE2000-E with C1 scanning unit | Nikon | custom configuration | inverted laser scanning confocal microscope used to acquire example data 2 and 4 |
| Eclipse TE2000-U with Bio-Rad Radiance 2100 scannig unit | Nikon | custom configuration | inverted laser scanning confocal microscope used to acquire example data 5 |
| FM 1-43 | Merck/Sigma-Aldrich | S6814 | membrane dye |
| FM 4-64 | Merck/Sigma-Aldrich | S6689 | membrane dye |
| Glass beads | Rettberg | 1340691030 | 3 mm glass beads |
| Glass cover slips | Thermo Fisher Scientific | BB02400600A113MNT0 | 24 x 60 # 1 glass cover slips |
| HCX PL APO 63x/1.3 NA Glyc | Leica | 15506353 | glycerol immersion objective |
| LSM 510 Meta | Zeiss | custom configuration | inverted laser scanning confocal microscope used to acquire example data 3 |
| M9 Minimal Medium | Merck/Sigma-Aldrich | M6030 | generic fungal growth medium |
| Micro-slide 8-well | ibidi | 80826 | ibiTreat #1.5 polymer coverslip |
| Miracloth | Merck/Millipore | 475855-1R | polyester filtration material |
| Petri dish | Sarstedt | 8,21,472 | 92 x 16 mm culture dish w/o cams |
| Phytagel | Merck/Sigma-Aldrich | P8169 | transparent gelling agent |
| Plan Apochromat 63x/1.4 NA Oil DIC | Zeiss | 440762-9904-000 | oil immersion objective |
| Pontamine Fast Scarlet 4B | Merck/Sigma-Aldrich | 212490 | cell wall dye |
| Potato Dextrose Agar (PDA) | BD Difco | 213400 | fungal growth medium for T. atroviride |
| Potato Dextrose Broth (PDB) | BD Difco | 254920 | fungal growth medium for T. atroviride |
| Reaction tube | Sarstedt | 72,706 | 1.5 mL SafeSeal tube |
| Scalpel | B.Braun | 5518016 | Cutfix sterile scalpel #23 |
| Screw cap tube | Sarstedt | 6,25,54,502 | 15 mL polypropylene tube |
| Solophenyl Flavine 7GFE 500 | CIBA | 1485385V6 | cell wall dye |
| SynaptoGreen C4 | Biotum | 70020 | membrane dye |
| SynaptoRed C2 | Biotum | 70021 | membrane dye |
| Syringe membrane filter | Thermo Fisher Scientific | 723-9945 | 0.45 µm SFCA syringe filter |
| TCS SP5 II | Leica | custom configuration | inverted laser scanning confocal microscope used to acquire example data 1 |
| Vogel's Minimal Medium (VMM) | FGSC | Fungal Genetics Stock Centre | fungal growth medium for N. crassa |
참고문헌
- Read, N. D., Fischer, S., Parton, R. M. Imaging Spitzenkörper, pH and calcium dynamics in growing fungal hyphae. Pesticide Science. 54 (2), 179-181 (1998).
- Hickey, P. C., Swift, S. R., Roca, M. G., Read, N. D. Live-cell imaging of filamentous fungi using vital fluorescent dyes and confocal microscopy. Microbial Imaging. , 63-87 (2004).
- Jelínková, A., et al. Probing plant membranes with FM dyes: tracking, dragging or blocking. The Plant Journal. 61 (5), 883-892 (2010).
- Fischer-Parton, S., et al. Confocal microscopy of FM4-64 as a tool for analysing endocytosis and vesicle trafficking in living fungal hyphae. Journal of Microscopy. 198 (3), 246-259 (2000).
- Harris, S. D. Branching of fungal hyphae: regulation, mechanisms and comparison with other branching systems. Mycologia. 100 (6), 823-832 (2008).
- Roca, M. G., Arlt, J., Jeffree, C. E., Read, N. D. Cell biology of conidial anastomosis tubes in Neurospora crassa. Eukaryotic Cell. 4 (5), 911-919 (2005).
- Becker, Y., et al. The fungal cell-wall integrity MAPK cascade is crucial for hyphal network formation and maintenance of restrictive growth of Epichloë festucae in symbiosis with Lolium perenne. Molecular Plant-Microbe Interactions. 28 (1), 69-85 (2015).
- Justa-Schuch, D., Heilig, Y., Richthammer, C., Seiler, S. Septum formation is regulated by the RHO4-specific exchange factors BUD3 and RGF3 and by the landmark protein BUD4 in Neurospora crassa. Molecular Microbiology. 76 (1), 220-235 (2010).
- Atanasova, L., et al. The Gpr1-regulated Sur7 family protein Sfp2 is required for hyphal growth and cell wall stability in the mycoparasite Trichoderma atroviride. Scientific Reports. 8 (1), 12064 (2018).
- Betz, W. J., Mao, F., Bewick, G. S. Activity-dependent fluorescent staining and destaining of living vertebrate motor nerve terminals. Journal of Neuroscience. 12 (2), 363-375 (1992).
- Wu, Y., Yeh, F. L., Mao, F., Chapman, E. R. Biophysical characterization of styryl dye-membrane interactions. Biophysical Journal. 97 (1), 101-109 (2009).
- Betz, W. J., Mao, F., B, S. C. Imaging exocytosis and endocytosis. Current Opinion in Neurobiology. 6, 365-371 (1996).
- Hoopmann, P., Rizzoli, S. O., Betz, W. J. Imaging synaptic vesicle recycling by staining and destaining vesicles with FM dyes. Cold Spring Harbor Protocols. 2012 (1), 77-83 (2012).
- Bolte, S., et al. FM-dyes as experimental probes for dissecting vesicle trafficking in living plant cells. Journal of Microscopy. 214, 159-173 (2004).
- Riquelme, M., et al. Spitzenkorper localization and intracellular traffic of green fluorescent protein-labeled CHS-3 and CHS-6 chitin synthases in living hyphae of Neurospora crassa. Eukayotic Cell. 6 (10), 1853-1864 (2007).
- Lichius, A., Yáñez-Gutiérrez, M. E., Read, N. D., Castro-Longoria, E. Comparative live-cell imaging analyses of SPA-2, BUD-6 and BNI-1 in Neurospora crassa reveal novel features of the filamentous fungal polarisome. PloS one. 7 (1), 30372 (2012).
- Peñalva, M. A. Tracing the endocytic pathway of Aspergillus nidulans with FM4-64. Fungal Genetics and Biology. 42 (12), 963-975 (2005).
- Dijksterhuis, J., Molenaar, D. Vesicle trafficking via the Spitzenkörper during hyphal tip growth in Rhizoctonia solani. Antonie van Leeuwenhoek. 103 (4), 921-931 (2013).
- Hickey, P. C., Read, N. D. Imaging living cells of Aspergillus in vitro. Medical Mycology. 47, 110-119 (2009).
- Delgado-Álvarez, D. L., Bartnicki-García, S., Seiler, S., Mouriño-Pérez, R. R. Septum development in Neurospora crassa: the septal actomyosin tangle. PLoS One. 9 (5), 96744 (2014).
- Hageage, G. J., Harrington, B. J. Use of Calcofluor White in clinical mycology. Laboratory Medicine. 15 (2), 109-112 (1984).
- Monheit, J. E., Cowan, D. F., Moore, D. G. Rapid detection of fungi in tissues using Calcofluor White and fluorescence microscopy. Archives of Pathology and Laboratory. 108 (8), 616-618 (1984).
- Herth, W., Schnepf, E. The fluorochrome Calcofluor White binds oriented to structural polysaccharide fibrils. Protoplasma. 105 (1-2), 129-133 (1980).
- Elorza, M. V., Rico, H., Sentandreu, R. Calcofluor White alters the assembly of chitin fibrils in Saccharomyces cerevisiae and Candida albicans cells. Journal of General Microbiology. 129 (5), 1577-1582 (1983).
- Lagorce, A., et al. Genome-wide analysis of the response to cell wall mutations in the yeast Saccharomyces cerevisiae. Journal of Biological Chemistry. 278 (22), 20345-20357 (2003).
- Sanz, A. B., García, R., Rodríguez-Peña, J. M., Arroyo, J. The CWI Pathway: regulation of the transcriptional adaptive response to cell wall stress in yeast. Journal of Fungi. 4 (1), (2017).
- Slifkin, M., Cumbie, R. Congo Red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Michels, J., Büntzow, M. Assessment of Congo Red as a fluorescence marker for the exoskeleton of small crustaceans and the cuticle of polychaetes. Journal of Microscopy. 238 (2), 95-101 (2010).
- Pancaldi, S., Poli, F., Dall'Olio, G., Vannini, G. L. Morphological anomalies induced by Congo Red in Aspergillus niger. Archives of Microbiology. 137 (3), 185-187 (1984).
- Roncero, C., Durán, A. Effect of Calcofluor White and Congo Red on fungal cell wall morphogenesis: in vivo activation of chitin polymerization. Journal of Bacteriology. 163 (3), 1180-1185 (1985).
- Kopeck, M., Gabriel, M. The influence of Congo Red on the cell wall and (1,3)- β-d-glucan microfibril biogenesis in Saccharomyces cerevisiae. Archives of Microbiology. 158 (2), 115-126 (1992).
- Heilmann, C. J., et al. Surface stress induces a conserved cell wall stress response in the pathogenic fungus Candida albicans. Eukayotic Cell. 12 (2), 254-264 (2013).
- Hoch, H. C., Galvani, C. D., Szarowski, D. H., Turner, J. N. Two new fluorescent dyes applicable for visualization of fungal cell walls. Mycologia. 97 (3), 580-588 (2005).
- Liesche, J., Ziomkiewicz, I., Schulz, A. Super-resolution imaging with Pontamine Fast Scarlet 4BS enables direct visualization of cellulose orientation and cell connection architecture in onion epidermis cells. BMC Plant Biology. 13, 226 (2013).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Knight, N. L., Sutherland, M. W. A rapid differential staining technique for Fusarium pseudograminearum in cereal tissues during crown rot infections. Plant Pathology. 60 (6), 1140-1143 (2011).
- Fajardo-Somera, R. A., et al. Dissecting the function of the different chitin synthases in vegetative growth and sexual development in Neurospora crassa. Fungal Genetics and Biology. 75, 30-45 (2015).
- Lichius, A. . Cell Fusion in Neurospora crassa. , (2010).
- Chen, W., Li, W., Dong, X., Pei, J. A Review of Biological Image Analysis. Current Bioinformatisc. 13 (4), 337-343 (2018).
- Goldman, R. D., Swedlow, J., Spector, D. L. . Live cell imaging: A laboratory manual. , (2010).
- Eliceiri, K. W., et al. Biological imaging software tools. Nature methods. 9 (7), 697-710 (2012).
- Zemanek, G., Jagusiak, A., Chłopaś, K., Piekarska, B., Stopa, B. Congo Red fluorescence upon binding to macromolecules - a possible explanation for the enhanced intensity. Bio-Algorithms and Med-Systems. 13 (2), 1187 (2017).
- Hickey, P. C., Jacobson, D. J., Read, N. D., Louise Glass, N. Live-cell imaging of vegetative hyphal fusion in Neurospora crassa. Fungal Genetics and Biology. 37 (1), 109-119 (2002).
- . Hamamatsu Si APD - high sensitivity photodiodes having an internal gain mechanism: Avalanche photodiode selection guide 2019 Available from: https://www.hamamatsu.com/resources/pdf/ssd/si_apd_kapd0001e.pdf (2019)
- Huff, J. The Airyscan detector from ZEISS: confocal imaging with improved signal-to-noise ratio and super-resolution. Nature Methods. 12, 1205 (2015).
- Thomas, J., Idris, N. A., Collings, D. A. Pontamine Fast Scarlet 4B bifluorescence and measurements of cellulose microfibril angles. Journal of Microscopy. 268 (1), 13-27 (2017).
- Ram, A. F. J., Klis, F. M. Identification of fungal cell wall mutants using susceptibility assays based on Calcofluor White and Congo Red. Nature Protocols. 1 (5), 2253-2256 (2006).
- Toshima, J. Y., et al. Spatial dynamics of receptor-mediated endocytic trafficking in budding yeast revealed by using fluorescent alpha-factor derivatives. Proceedings of the National Academy of Science of the USA. 103 (15), 5793-5798 (2006).
- Kilaru, S., Schuster, M., Latz, M., Guo, M., Steinberg, G. Fluorescent markers of the endocytic pathway in Zymoseptoria tritici. Fungal Genetics and Biology. 79, 150-157 (2015).
- Fu, C., Tanaka, A., Free, S. J. Neurospora crassa 1,3-α-glucan synthase, AGS-1, is required for cell wall biosynthesis during macroconidia development. Microbiology. 160, 1618-1627 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유