Method Article
Application de colorants fluorescents sélectifs de membrane et de mur cellulaire pour l'imagerie de cellules vivantes des champignons filamenteux
Dans cet article
Résumé
Les colorants fluorescents vitaux sont des outils essentiels pour les analyses d'imagerie des cellules vivantes dans la biologie des cellules fongiques modernes. Cet article détaille l'application de colorants fluorescents établis et moins connus pour suivre la dynamique de la membrane plasmatique, l'endo-/exocytose et la morphogénèse de la paroi cellulaire dans les champignons filamenteux.
Résumé
L'application de colorants fluorescents sélectifs de membrane et de paroi cellulaire pour des analyses d'imagerie de cellules vivantes de la dynamique des organlions dans les cellules fongiques a commencé il y a deux décennies et continue depuis de contribuer grandement à notre compréhension du fongique filamenteux Vie. Cet article fournit un guide pratique pour l'utilisation des deux colorants membranaires FM 1-43 et FM 4-64 et les quatre taches de paroi cellulaire Calcofluor White M2R, Solophenyl Flavine 7GFE 500, Pontamine Fast Scarlet 48 et Congo Red. L'accent est mis sur leur application à faible dose pour déterminer la coloration sans artefacts, leurs propriétés de co-imagerie, et leur évaluation quantitative. Les méthodes présentées s'appliquent à tous les échantillons fongiques filamenteux qui peuvent être préparés de la manière décrite. Les approches fondamentales de coloration peuvent servir de points de départ pour l'adaptation à des espèces qui pourraient nécessiter des conditions de culture différentes. Tout d'abord, les propriétés biophysiques et biochimiques sont examinées car leur compréhension est essentielle pour l'utilisation de ces colorants comme taches fluorescentes vraiment vitales. Deuxièmement, des protocoles étape par étape sont présentés qui détaillent la préparation de divers types d'échantillons fongiques pour l'imagerie fluorescente des cellules vivantes. Enfin, des exemples d'expériences illustrent différentes approches pour : (1) identifier les défauts dans l'organisation spatio-temporelle de l'endocytose chez les mutants génétiques, (2) caractériser comparativement la co-localisation partagée et distincte des protéines cibles étiquetées GFP dans la voie endocytique, (3) identifient les défauts morphogénétiques de paroi de cellules dans un mutant génétique, et (4) surveillent la biogenèse de mur cellulaire en temps réel.
Introduction
Il y a vingt ans, la façon dont la morphogénèse hyphaletée et la biologie cellulaire moléculaire sous-jacente pouvaient être visualisées dans les champignons filamenteux a été révolutionnée par l'application de la membrane sélective fluorescente Fei Mao colorant FM 4-641. Plus tard, l'avantage du colorant liant la chitin Calcofluor White comme marqueur fluorescent vital de la dynamique de la paroi cellulaire fongique a été réalisé2. Depuis lors, les colorants et les variantes de ceux-ci sont devenus une partie inhérente des analyses d'imagerie à cellules vivantes de la dynamique des organites chez les champignons, et continuent de fournir des informations sans précédent sur le mode de vie fongique filamenteux. Cet article détaille l'application de colorants fluorescents établis et moins connus pour suivre la dynamique de la membrane plasmatique, l'endo- et l'exocytose et la morphogénèse de la paroi cellulaire dans les champignons filamenteux. Les essais de suivi de l'endocytose permettent d'aborder diverses questions biologiques cellulaires liées à l'étude générale de l'endocytose3. Pour cela, la localisation, la vitesse et la succession des compartiments tachés sur l'ajout de colorant FM est enregistrée par microscopie time lapse et quantitativement comparée entre les souches fongiques testées4. Les colorants de paroi cellulaire délimitent la limite extérieure de la cellule et permettent le suivi des événements morphogenetic, y compris la croissance polarisée de pointe d'hyphal2,ramification d'hyphal5,fusion d'hyphal6,7 et formation de septum8. En outre, ils facilitent la quantification du dépôt localisé de paroi cellulaire et l'identification des défauts pendant la biogenèse de mur cellulaire9. Puisque la connaissance détaillée des propriétés biochimiques et biophysiques de n'importe quel marqueur fluorescent est une condition préalable fondamentale pour son application in vivo réussie, ces caractéristiques sont d'abord résumées pour les six colorants décrits dans cet article.
Colorants sélectifs à membrane
FM (Fei Mao) teintures styryl sont de petites molécules amphiphiles qui ne peuvent pas passer à travers, mais réversiblement associer avec le dépliant externe de la bicouche lipidique des membranes biologiques10. Ils sont pratiquement non fluorescents dans la solution aqueuse, mais deviennent intensément fluorescents lors de l'intégration de la membrane plasmatique, générant d'excellents rapports signal-bruit (S/N)11. Ces propriétés les rendent idéalement adaptées pour visualiser la membrane plasmatique et la dynamique intracellulaire des organites, y compris le suivi de l'endo- et de l'exocytose12. Le FM 1-43 vert-fluorescent et le FM 4-64 rouge-fluorescent sont les deux marqueurs fluorescents les plus utilisés à ces fins. SynaptoGreen C4 et SynaptoRed C2 sont des molécules génériques de fournisseurs alternatifs qui peuvent être utilisées de façon interchangeable au lieu de FM 1-43 et FM 4-64, respectivement.
Les colorants styryles comprennent trois régions structurelles clés : (1) la queue lipophile qui facilite l'insertion du colorant dans la couche lipidique, (2) le noyau fluorophore qui détermine les propriétés spectrales du colorant et est constitué de deux anneaux aromatiques reliés par une à trois liaisons doubles, et (3) la tête hydrophile chargée positivement qui empêche l'insertion complète et la perméation du colorant à travers la membrane(Figure 1A).
Plus la queue lipophile est longue, plus l'hydrophobicité du colorant est élevée et donc l'affinité de liaison à la membrane, mais plus sa solubilité de l'eau et son taux de décoloration de la membrane sont faibles. Par conséquent, différentes variantes de teinture FM produisent différentes dynamiques et modèles de coloration. L'hydrophobicité plus élevée du FM 1-43 à queue C4 fournit un signal de fluorescence plus fort et plus stable aux membranes plasmatiques et aux organites internes plus rapidement que le FM 4-64 à queue C2 plus court, lorsqu'il est appliqué à des concentrations équimolaires (figure 2).
Fait important, les taux constants et élevés d'association/dissociation des deux colorants FM11 avec des temps de rétention moyens de 1 à 6 s par molécule de colorant individuel13 réduisent les chances de perturbation localisée de la fonction membranaire, par exemple, par la modification de la fluidité membranaire ou l'interaction permanente forcée des protéines membranaires. C'est probablement la principale raison pour laquelle ces molécules peuvent être utilisées comme colorants vitaux. Néanmoins, les concentrations de colorant FM au-dessus de 50 M sont toxiques pour les cellules fongiques et végétales2,14, et les preuves de BY-2 protoplastes de tabac indique que plus de 20 M FM colorant conduire à la saturation de la membraneplasmatique 14. Il est donc conseillé de ne pas dépasser cette limite, d'autant plus que l'imagerie a été obtenue avec aussi peu que 2 à 5 M15,16.
Notamment, les propriétés spectrales des colorants FM varient considérablement en fonction du microenvironnement membranaire particulier (révisé14). En général, les spectres d'excitation et d'émission des colorants FM dans les solutions de solvantpur pur (comme cela est habituellement fourni dans les informations sur le produit) diffèrent considérablement de ceux des environnements cellulaires et ne peuvent, dans la plupart des cas, pas directement être consultés pour la sélection des paramètres d'imagerie des cellules vivantes. Les maxima d'excitation/émission de FM 1-43 et FM 4-64, par exemple, deviennent bleus décalés de 37/46 nm et 43/64 nm, respectivement, lorsqu'ils sont liés à des membranes fongiques par rapport à leurs solutions dans le méthanol (tableau 1).
Les principes fondamentaux révolutionnaires pour l'utilisation de FM 4-64 et FM 1-43 pour le suivi de la membrane plasmatique, de l'endo-/exocytose et de la dynamique des organites, y compris le Spitzenkârper et les mitochondries, ont déjà été entièrement documentés pour un large éventail d'espèces fongiques filamentes précédemment2,4,17,18,19. Les paramètres d'imagerie recommandés pour les deux colorants FM qui fonctionnent dans diverses espèces fongiques filamenteuses sont représentés dans la figure 1B. Les limitations techniques de l'équipement disponible ou des conditions cellulaires et expérimentales particulières, telles que le milieu de culture, le pH ou la température, peuvent toutefois nécessiter certaines adaptations. Heureusement, les colorants FM fonctionnent sur une large gamme spectrale, et de très bons résultats d'imagerie sont obtenus par FM 1-43 passionnant avec 514 nm ou FM 4-64 avec 488 nm. Par conséquent, les paramètres d'imagerie optimaux doivent être déterminés individuellement pour chaque type d'échantillon et l'application prévue.
Le déplacement considérable de Stoke de plus de 135 nm de FM 4-64 permet une excellente co-imagerie simultanée avec des fluorophores émettant la lumière verte ; ceci est fréquemment exploité pour évaluer la dynamique intracellulaire de localisation des protéines fluorescentes vertes (GFP)-étiquetées de fusion par rapport à la membrane de plasma et à la voie endocytic9,20.
Colorants sélectifs par parmure cellulaire
Calcofluor White M2R (CFW), également commercialisé sous le nom de Fluorescent Brightener 28, est probablement le colorant fluorescent le plus connu utilisé pour tacher les parois cellulaires des bactéries, des champignons, des algues, des plantes plus élevées et des insectes. Initialement utilisé comme agent de blanchiment optique dans l'industrie du papier, du textile et du détergent, ses avantages pour le diagnostic clinique des infections fongiques ont été réalisés dès le21,22. Parce que CFW intercale de façon irréversible dans la chaîne naissante de chitin il perturbe l'assemblage microfibril de chitin normal pendant la biogenèse de mur cellulaire générant de ce fait l'effort de paroi cellulaire23. Ceci déclenche à son tour un mécanisme de réparation de dommages de paroi cellulaire menant au dépôt localement augmenté de paroi de cellules en raison de l'activation de synthase de glucane et de chitin24,25. Ce phénomène peut se produire avec n'importe quel colorant qui fonctionne en se liant de façon stable aux polymères de la paroi cellulaire, est dépendant de la concentration et est plus perceptible aux pointes d'hyphal qui représentent les parties les plus prolifiques de plus en plus et donc les plus sensibles du mycélium (Figure 3). Un résumé complet de la machinerie moléculaire qui répond aux dommages de la paroi cellulaire a récemment été fourni26.
Teinture surchargée en combinaison avec la phototoxicité peut conduire à une lyse cellulaire rapide des compartiments hyphal (Film 1). Néanmoins, une sensibilité accrue aux concentrations de colorants qui sont « vitales » dans le type sauvage peut être exploitée pour identifier les défauts dans la biosynthèse de la paroi cellulaire des mutants de perte de fonction de gène9. Pour CFW et Congo Red (CR), un autre colorant textile également connu sous le nom direct rouge 28 et employé comme tache de paroi cellulaire spécifique à la chitine pour les champignons et les insectes27,28, concentrations seuils qui induisent fortement les synthases de chitine ont été déterminées avec 'gt; 60 M CFW et 70 M CR, respectivement, tandis que les concentrations de15 m de colorant n'ont pas modifié ou inhibé la croissance fongique29,30,31. Hickey et coll. ont placé cette concentration de seuil pour CFW à 25 M2. Par conséquent, il est conseillé d'utiliser des concentrations de colorants de 5 m pour exclure les artefacts liés au stress et s'assurer d'utiliser ces molécules comme véritables « colorants fluorescents vitaux »2,32. Cela vaut également pour Solophenyl Flavine 7GFE 500 (SPF) et Pontamine Fast Scarlet 4B (PFS), synonyme de Direct Yellow 86 et Direct Red 23, respectivement, deux autres colorants de paroi cellulaire utiles dont l'application pour les champignons a été signalée pour la première fois il ya plus d'une décennie33. Mais malgré leurs remarquables propriétés spectrales34,35, l'utilisation des deux colorants a depuis lors été très limitée36,37. Comme indiqué précédemment pour 1,5 M CFW2, 2 M SPF sont suffisants pour résoudre la dynamique de la paroi cellulaire dans des conditions indigènes avec une résolution temporelle très élevée (Movie 2). Les mêmes résultats peuvent être obtenus avec 2 'M CR ou PFS.
Ensemble, ces quatre colorants, CFW, SPF, PFS et CR, comprennent un ensemble de marqueurs fluorescents sélectifs par mur cellulaire qui couvrent presque le spectre complet de lumière d'émission visible (400 à 700 nm) utilisé sur les microscopes fluorescents modernes(figure 4). L'augmentation significative de l'intensité de fluorescence lors de la liaison aux polymères de paroi cellulaire est inhérente aux quatre et génère d'excellents s/N-ratios. Ceci permet à son tour de maintenir des concentrations de colorant et l'intensité lumineuse d'excitation très basse et permet d'exécuter la coloration de mur cellulaire comme technique de « basse dose » d'imagerie de cellules vivantes2. Puisque ces colorants de paroi cellulaire sont imperméables de membrane de plasma, ils fonctionnent simultanément comme taches vivantes/mortes. Notamment, en raison de leurs spectres de lumière d'émission extrêmement larges, certaines limitations concernant les propriétés de co-imagerie de CFW et SPF avec d'autres fluorophores doivent être soigneusement examinées.
Protocole
1. Préparation d'échantillons fongiques
- Pré-cultures fongiques
- Inoculer la souche désirée sur un milieu d'agar solide approprié, comme l'agar de dextrose de pomme de terre (PDA) pour l'atroviride de Trichoderma ou le milieu minimal de Vogel (VMM) pour Neurospora crassa. Ajoutez un marqueur de sélection approprié lorsque vous travaillez avec des souches de transformateur.
- Incuber la pré-culture à la température optimale de l'organisme. Par exemple, T. atroviride à 25 oC et N. crassa à 30 oC, et 12 h/12 h cycles de lumière/obscurité jusqu'à ce qu'un mycélium sporulating se soit développé mais n'a pas encore atteint le bord de la plaque. Sur un plat Petri de taille standard (9,2 cm), cela prend le type sauvage T. atroviride sur 4-6 jours en moyenne, tandis que le type sauvage N. crassa atteint ce stade après 3-4 jours en moyenne.
- Cultivation de colonies fongiques
- À l'aide d'un scalpel stérile, couper un petit bloc d'agar de 3 mm x 3 mm transportant du mycélium non sporulation du bord de la colonie de la pré-culture.
- Placez le bloc d'agar au centre d'une plaque moyenne solide fraîche pour inoculer la culture expérimentale.
- Incuber la culture expérimentale selon le stade de développement destiné à être étudié. Par exemple, l'atroviride De type sauvage nécessite de 20 à 22 heures à 25 oC dans l'obscurité pour développer des colonies d'environ 2 cm de diamètre sur PDA, tandis que le N. crassa de type sauvage atteint des diamètres de colonie d'environ 4 cm après 14 à 16 h d'incubation à 30 oC dans l'obscurité sur VMM.
REMARQUE : L'incubation dans l'obscurité empêche la formation de pigments qui pourraient introduire l'autofluorescence. Afin d'éliminer la fluorescence moyenne de fond de la culture expérimentale, remplacez l'agar par 1,5 % w/v d'un agent solidificateur transparent (voir la Table des Matériaux),et tout support complexe avec un milieu minimal défini.
- Cultivation de cultures germinantes solides
- Utilisez 5 mL de solution de sel physiologique stérile (0,9 % w/v NaCl) pour récolter les spores coniques de la plaque pré-culture et recueillir la suspension des spores qui en résulte dans un tube à capuchon à vis de 15 ml.
- Bien mélanger la suspension des spores par un vortex vigoureux et la filtrer sur une bande de 1 cm x 5 cm de tissu filtre stérile (voir le tableau des matériaux)légèrement farci dans une pointe de pipette de 1 ml (à la fois assemblée et autoclaved à l'avance) dans un tube stérile frais.
- Déterminez la densité des spores à l'égard d'une chambre de comptage cellulaire et préparez une suspension de 1 x 107 cellules/mL avec solution physiologique de sel.
REMARQUE : La suspension des spores peut être maintenue à 4 oC jusqu'à deux semaines. - Préparer un plat Petri de taille standard (9,2 cm d'euros) avec 20 ml de milieu solide et ajouter 15 à 20 perles de verre stériles (3 mm) sur le dessus.
- Pipette 200 l de la suspension de spore sur la plaque moyenne et répartir uniformément les cellules sur toute la plaque par secousses douces. Recueillir les perles de verre dans un bécher avec 70% d'éthanol pour la réutilisation.
- Incuber la culture expérimentale selon le stade de développement destiné à être étudié. Par exemple, le type sauvage de T. atroviride nécessite de 5 à 6 h à 25 oC dans l'obscurité pour développer des germes coniques sur le PDA, tandis que le type sauvage de N. crassa développe des germes coniques après 3 à 4 h d'incubation à 30 oC dans l'obscurité sur VMM.
REMARQUE : Afin d'éliminer toute fluorescence moyenne de fond de la culture expérimentale, remplacez l'agar par 1,5 % w/v d'un agent solidifiant transparent, et tout milieu complexe avec un milieu minimal défini.
- Cultivation de cultures germinantes liquides
- Remplir 190 l de milieu de culture liquide dans chaque puits d'un micro-glissière à 8 biens.
- Ajouter 10 l d'une solution de sporre de 1 x 107 cellules/mL (préparée à l'étape 1.4.1-1.4.3) et mélanger en tapant doucement de haut en bas à quelques reprises. Le nombre total de cellules qui en résulte est de 1 x 105 par puits.
- Incuber la culture expérimentale selon le stade de développement destiné à être étudié. Par exemple, l'atroviride sauvage de type T. nécessite de 5 à 6 h à 25 oC dans l'obscurité pour développer des germes coniques dans le bouillon de dextrose de pomme de terre (PDB), tandis que le type sauvage N. crassa développe des germes conidial après 3 à 4 h d'incubation à 30 oC dans l'obscurité dans le VMM liquide.
2. Préparation de solutions de travail de teinture
- Pour garantir la solubilité totale de chaque colorant, préparer des solutions de stock de 2 mM en sulfoxide de diméthyle (DMSO) en ajoutant la quantité appropriée (voir les poids exacts dans le tableau 1) à 1 ml de 100% DMSO et bien mélanger par vortexing.
CAUTION: Assurez-vous de prendre le DMSO d'une bouteille septum scellée; il devrait s'agit d'un liquide transparent clair. Au contact de l'air, le DMSO brunit, probablement en raison de l'oxydation des impuretés des traces, et pourrait avoir une incidence négative sur la croissance cellulaire ou la coloration des colorants. - Filtrer la stérilisation de la solution de stock à l'eau à l'eau à l'eau à l'eau dans un tube de réaction stérile de 1,5 ml. Pour minimiser le blanchiment des teintures, envelopper le tube dans du papier d'aluminium.
REMARQUE : La solution de stock de colorant peut être aliquoted dans de plus petits volumes pour éviter des cycles de décongélation/congélation, et maintenue à 4 oC pendant plusieurs mois. - Préparer une solution de travail de colorant aqueux de 20 MM en dissolvant 2 ll de solution de bouillon de colorant dans 198 l d'eau distillée stérile dans un tube de réaction stérile de 1,5 ml. Pour minimiser le blanchiment des teintures, envelopper le tube dans du papier d'aluminium.
REMARQUE : La solution de travail de colorant doit être préparée fraîchement le jour de l'expérience. - Pendant le montage de l'échantillon (voir la section 3), la solution de travail de colorant sera diluée de façon standard 1:10, ce qui se traduira par une concentration finale de colorant de 2 M et de 0,1 % avec une concentration finale de DMSO.
REMARQUE : Le choix de différents facteurs de dilution en modifiant simplement le rapport de volume entre la solution de travail de colorant et le liquide de montage, permet d'adapter facilement la concentration finale désirée de colorant.
CAUTION: Pour prévenir les effets indésirables dus à la teinture ou à la toxicité DMSO, le facteur de dilution ne doit pas tomber en dessous de 1:4 pour entraîner des concentrations finales maximales de colorant de 5 M et de 0,4 % w/v DMSO. Des concentrations plus élevées de colorants satureront rapidement le système et empêcheront la quantification fiable du signal, alors que plus de 0,5 % w/v (62,5 mM) DMSO peut nuire au développement cellulaire38.
3. Préparation d'échantillons pour la microscopie
- Échantillons de mont des colonies fongiques (étape 1.2) ou des cultures germinantes solides (étape 1.3) par la méthode inversée de bloc d'agar.
- Gardez un bordereau de couverture en verre propre de 24 mm x 60 mm (#1'épaisseur de 0,13 à 0,16 mm) et ajoutez 18 l de milieu minimal liquide (VMM ou M9) ou une solution physiologique de sel au centre.
- Ajouter 2 ll de la solution de travail de colorant de 20 M À la 18 L de liquide et bien mélanger en pipetting de haut en bas plusieurs fois, tout en évitant la production de bulles d'air.
REMARQUE : Lorsque vous travaillez avec plusieurs échantillons, il est conseillé de préparer un mélange maître de solution de teinture liquide pour tous afin d'assurer une concentration égale de colorant tout au long de l'expérience. - À l'arme claire, découper un échantillon de 15 mm x 15 mm de la périphérie de la colonie ou de la culture de germling solide et placez-le verticalement à côté de la goutte moyenne sur le bordereau de couverture.
- En utilisant le scalpel pour soutenir le bord supérieur du bloc et un doigt pour maintenir le côté arrière du bloc en place, abaissez lentement le côté portant le mycélium ou les germes sur le liquide. L'échantillon est maintenant prêt pour le transfert sur le stade du microscope.
CAUTION: Il est essentiel de le faire lentement et très soigneusement afin de minimiser le stress mécanique sur les cellules et d'éviter que les bulles d'air sont piégés entre l'échantillon et le glissement de couverture.
- Montez les cultures germantes liquides à partir de l'étape 1.4.
REMARQUE : Plus commodément, les cultures de germination liquide dans les diapositives de micro-puits chambrées peuvent être directement transférées et manipulées davantage au stade du microscope.- Ajouter 22 ll de solution de travail de colorant à 200 l de milieu liquide pour avoir comme conséquence les concentrations finales standard de 2-M de colorant et de 0.1% w/v DMSO.
REMARQUE : Les cultures germées liquides ont le grand avantage que les colorants fluorescents (ou d'autres produits chimiques, tels que les inhibiteurs) peuvent être ajoutés à n'importe quel moment désiré de l'expérience, également pendant l'enregistrement. Dans ce cas, un soin particulier doit être pris pour administrer les gouttes liquides très lentement afin de ne pas déranger les cellules. Les vibrations du système et le mouvement Brownian pourraient déjà introduire un certain mouvement cellulaire.
- Ajouter 22 ll de solution de travail de colorant à 200 l de milieu liquide pour avoir comme conséquence les concentrations finales standard de 2-M de colorant et de 0.1% w/v DMSO.
4. Microscopie à cellules vivantes
- Ajustez les paramètres d'acquisition d'images de base. Les paramètres d'acquisition d'images suivants permettent de capturer la dynamique de coloration dans les hyphes individuels et s'appliquent aux deux tests suivants
- Appliquer 5 à 10% de puissance laser de 20% de la puissance de sortie complète de l'appareil.
- Utilisez un objectif d'immersion en glycérol ou en eau de Plan Apo 60x-63x avec une ouverture numérique élevée de 1,2.
- Limitez la zone d'acquisition d'image au contour des hyphes en définissant une taille d'image de 1024 x 256 pixels et en utilisant un facteur de zoom optique de 2 à 3.
- Utilisez la numérisation bidirectionnelle avec 400 Hz. Ajustez la taille du sténopé à 1 unité Airy.
- Définir le gain du détecteur le plus sensible à 100%.
- Pour l'enregistrement des tours de temps, commencez l'acquisition d'image avec une image tous les 15 s pour permettre une résolution temporelle raisonnable sans produire de blanchiment de colorant ou de stress photo.
- Pour l'enregistrement 3D, fixez la limite spatiale supérieure et inférieure à la limite des hyphes et des sections optiques spatiales à 1 m l'une de l'autre pour permettre une résolution spatiale raisonnable.
REMARQUE : En raison de la croissance rapide des hyphes, la haute résolution spatiale dans l'axe Z a souvent été sacrifiée pour une résolution temporelle élevée dans l'axe X/Y ou dans l'autre sens. Seuls les microscopes à balayage laser confocal très modernes sont assez rapides pour satisfaire les deux demandes.
- Essais d'endocytose d'étude
- Consultez la figure 1 et le tableau 1 afin d'identifier les meilleurs paramètres d'excitation/émission pour les FM 1-43 et/ou FM 4-64 disponibles sur le système de microscopie et de les ajuster en conséquence.
REMARQUE : Avec la concentration recommandée de 2 M, l'incorporation de colorant FM dans la membrane plasmatique est instantanée dans les cellules saines normales. L'ensemble du processus de coloration initiale de la membrane plasmatique à l'apparence de teinture dans les vacuoles tubulaires est généralement terminé dans les 30 à 45 minutes à température ambiante. L'augmentation de la concentration de colorant FM augmente le S/N-ratio et produit ainsi des images de contraste plus élevées plus rapidement. Cependant, il accélère également le processus d'étiquetage, ce qui rend plus difficile de différencier la succession chronologique de la coloration organelle. - Commencez l'enregistrement d'images à l'aide des paramètres d'acquisition d'images de base recommandés ci-dessus et évaluez les résultats.
- Optimisez les paramètres d'acquisition d'image à la résolution spatiale et temporelle requise pour capturer l'aspect de la membrane plasmatique ou de la dynamique de l'endocytose sur la dynamique de l'expérience.
- Par exemple, afin de capturer la dynamique très rapide dans X/Y, diminuer la taille globale de l'image, l'image d'un seul plan focal et augmenter le taux de numérisation à 1 fps. Pour une résolution plus élevée dans l'axe Z, diminuez la résolution dans X/Y, diminuez la taille de l'image et diminuez la distance entre les sections optiques à 0,5 m.
- Consultez la figure 1 et le tableau 1 afin d'identifier les meilleurs paramètres d'excitation/émission pour les FM 1-43 et/ou FM 4-64 disponibles sur le système de microscopie et de les ajuster en conséquence.
- Dynamique de mur cellulaire
- Consultez la figure 4 et le tableau 1 afin d'identifier les meilleurs paramètres d'excitation/émission pour le colorant paroi cellulaire appliqué disponible sur le système de microscopie et ajuster en conséquence.
REMARQUE : En raison de leurs larges spectres d'émission, le CFW et le FPS ne sont pas bien adaptés à la co-imagerie simultanée avec d'autres fluorophores, principalement des GFP. Certaines restrictions s'appliquent même pour les approches d'imagerie séquentielle avec ces colorants, et doivent donc être optimisées individuellement. - Commencez l'enregistrement d'images à l'aide des paramètres d'acquisition d'images de base recommandés ci-dessus et évaluez les résultats.
REMARQUE : Avec la concentration recommandée de 2 M, l'incorporation de colorant dans la paroi cellulaire n'est pas nécessairement instantanée, mais raisonnablement rapide. L'ensemble du processus de formation de septum, par exemple, prend en moyenne environ 5 à 7 min à température ambiante20. L'augmentation de la concentration de colorant de paroi cellulaire augmente le S/N-ratio et produit ainsi des images de contraste plus élevées plus rapidement. Cependant, il introduit également rapidement des artefacts en raison de la réparation induite des dommages de paroi cellulaire. - Optimisez les paramètres d'acquisition d'images à la résolution spatiale et temporelle requise pour capturer l'aspect de la morphogenèse de la paroi cellulaire sur laquelle l'expérience est axée, comme indiqué à la section 4.2.3.
- Consultez la figure 4 et le tableau 1 afin d'identifier les meilleurs paramètres d'excitation/émission pour le colorant paroi cellulaire appliqué disponible sur le système de microscopie et ajuster en conséquence.
Résultats
Analyse quantitative de l'image
En plus de « visualiser » simplement les processus cellulaires, l'imagerie cellulaire vivante permet d'extraire des informations quantitatives à partir des données enregistrées. En général, l'analyse quantitative de l'image est un sujet complexe dont la discussion appropriée est bien au-delà de la portée de cet article, par conséquent, le lecteur est renvoyé à des manuels dédiés et articles39,40,41. Néanmoins, certaines lignes directrices de base associées aux données d'exemple suivantes sont fournies. Plusieurs conditions préalables cruciales doivent être remplies pour permettre la quantification de l'image, notamment : (1) des molarités définies de colorants fluorescents doivent être appliquées à tous les échantillons pour permettre une comparaison relative précise; (2) les paramètres d'acquisition d'image doivent être ajustés de manière à ce que les détecteurs de lumière d'émission ne soient jamais saturés, sinon les intensités maximales sont coupées; (3) les paramètres d'acquisition d'images doivent rester fixés au cours d'un ensemble expérimental cohérent, sinon des changements d'intensité artificielle sont introduits; (4) les données d'image doivent être sauvegardées dans un format de fichier sans perte d'information ainsi que les méta-informations contenant tous les paramètres de l'instrument; et (5) l'analyse d'image devrait être limitée au nombre minimal d'étapes de post-traitement nécessaires pour extraire les informations quantitatives souhaitées.
Habituellement, des normes définies qui permettraient la quantification absolue des signaux enregistrés ne sont pas disponibles dans la cellule vivante. Ainsi, dans sa forme la plus simple, l'analyse quantitative de l'image repose sur la comparaison relative des intensités de pixels au sein d'une même image ou entre différentes images enregistrées avec des paramètres identiques. Le logiciel de contrôle au microscope du fabricant comprend normalement des outils de base pour le post-traitement de l'image et l'analyse quantitative, ou peut être mis à niveau avec des fonctions supplémentaires pour la segmentation de l'image, le seuil, l'imagerie par rapport, etc. Plusieurs plates-formes de traitement d'images open source, adaptées différemment à différents types de données d'imagerie, sont disponibles, dont ImageJ (https://imagej.net; https://imagej.nih.gov/ij/), glacée (http://icy.bioimageanalysis.org/), CMEIAS Bioimage Informatics (http://cme.msu.edu/cmeias/) et Wimasis (https://www.wimasis.com/en/).
Les données présentées par exemple ont été traitées et analysées à l'aide de la plate-forme ImageJ. En bref, des régions spécifiques de la cellule, telles que l'apex de pointe hyphal ou septa, sont marquées avec des outils de sélection de zone important, et l'intensité de tous les pixels contenus est lue avec le logiciel mis en œuvre "outil de mesure". Les données d'intensité des contrôles et des échantillons expérimentaux sont transférées dans un fichier de feuille de calcul, analysées mathématiquement et préparées sous forme de graphique. D'autres détails peuvent être trouvés dans les publications originales citées.
Exemple de données 1 : essais d'auto-prise FM 4-64
Les échantillons fongiques ont été cultivés en colonies (étape 1.2) et montés par la méthode du bloc d'agar inversé (étape 3.1). La concentration finale de FM 4-64 était de 1,67 M. Paramètres d'imagerie : HCX PL APO 63x/1.3 NA glycérol objectif sur un microscope à balayage laser confocal inversé (voir le tableau des matériaux); FM 4-64 excitation à 488 nm et émission à 600 à 700 nm; un cadre chaque minute pendant jusqu'à 150 min. FM 4-64 a identifié des défauts dans l'organisation spatio-temporelle de l'endocytose dans la suppression de gène et les mutants surexprimants de la protéine fongique-spécifique de famille de Sur7 2 (Sfp2) de T. atroviride9 (figure 5).
Exemple de données 2 : CO-coloration FM 4-64 de protéines de fusion fluorescentes ciblées sur les compartiments endocytiques
Les échantillons fongiques ont été cultivés en colonies (étape 1.2) et montés par la méthode du bloc d'agar inversé (étape 3.1). La concentration finale de FM 4-64 était de 2 'M. Paramètres d'imagerie: CFI Plan Apo VC 60x/1.2 NA XC objectif d'immersion en eau sur un microscope à balayage laser confocal inversé (voir le tableau des matériaux); Excitation de GFP à 488 nm et émission à 500-530 nm, FM 4-64 excitation à 488 nm et émission à 600-700 nm, et champ lumineux avec détecteur de lumière transmis, tous simultanément ; un cadre tous les 15 s pour un maximum de 15 min. FM4-64 co-coloration a été utilisé pour relier la distribution subcellulaire des deux protéines fluorescentes vertes améliorées (EGFP) marqués protéines transmembranaires Sfp2 et Gpr1 à la voie endocytique dans T. atroviride (Figure 6, Movie 3, Movie 4).
Exemple de données 3: FM 4-64 co-staining pour l'identification des différences morphogénétiques
Les échantillons fongiques ont été cultivés en colonies (étape 1.2) et montés par la méthode du bloc d'agar inversé (étape 3.1). La concentration finale de FM 4-64 était de 2 'M. Paramètres d'imagerie: Plan Apochromat 63x/1.4 NA objectif d'immersion en huile sur un microscope à balayage laser confocal inversé (voir le tableau des matériaux); Excitation de GFP à 488 nm et émission à 505-550 nm, FM 4-62 excitation à 488 nm et émission à 574-691 nm, et champ lumineux avec détecteur de lumière transmis, tous simultanément ; une image tous les 8,5 s pour un taux de co-coloration FM4-64 jusqu'à 15 min.
Exemple de données 4 : La coloration de la paroi cellulaire révèle des différences morphogénétiques
Les échantillons fongiques ont été cultivés en colonies (étape 1.2) et montés par la méthode du bloc d'agar inversé (étape 3.1). Des concentrations finales de 2 M CFW, 20 M SPF et 100 M CR ont été utilisées. Paramètres d'imagerie : CFI Plan Apo VC 60x/1.2 NA XC water immersion objective on an inverted confocal laser scan microscope (voir le tableau des matériaux); CFW et SPF excitation à 405 nm et émission à 430-470 nm, CR excitation à 543 nm et émission à 580-620 nm. Les différentes propriétés d'interaction de CFW, SPF et CR avec les polymères de paroi cellulaire mettent en évidence les différences morphogénétiques entre le mutantsfp2 et la souche de type sauvage de T. atroviride9. L'augmentation du stress de la paroi cellulaire infligé par des concentrations élevées de colorant se produit plus rapidement et plus prononcée chez le mutant par rapport au type sauvage. De plus, les mêmes images permettent de quantifier les différences morphogénétiques concernant le diamètre hyphaïde et la distance septale entre les deux souches (Figure 8).
Exemple de données 5 : Surveillance en temps réel de la biosynthèse des parois cellulaires
Les germes ont été cultivés comme culture liquide (étape 1.4) dans des micro-glissières à 8 puits (étape 3.2). La concentration finale de CFW était de 0,12 M. Paramètres d'imagerie : CFI Plan Apo VC 60x/1.2 NA XC water immersion objective on an inverted confocal laser scanning microscope; CFW excitation à 405 nm et émission à 420-470 nm; un cadre tous les 20 s jusqu'à 35 min. La très faible concentration de CFW empêche la saturation de la paroi cellulaire avec des molécules de colorant et permet une surveillance quantitative en temps réel de la biosynthèse de la paroi cellulaire. Cela révèle que le dépôt de nouveaux matériaux muraux cellulaires n'est pas uniforme, mais répond très rapidement aux contraintes physiques localisées résultant du déplacement relatif d'une cellule sur l'attachement cellulaire-cellule avant la fusion germinative dans N. crassa (Figure 9, Film 6).
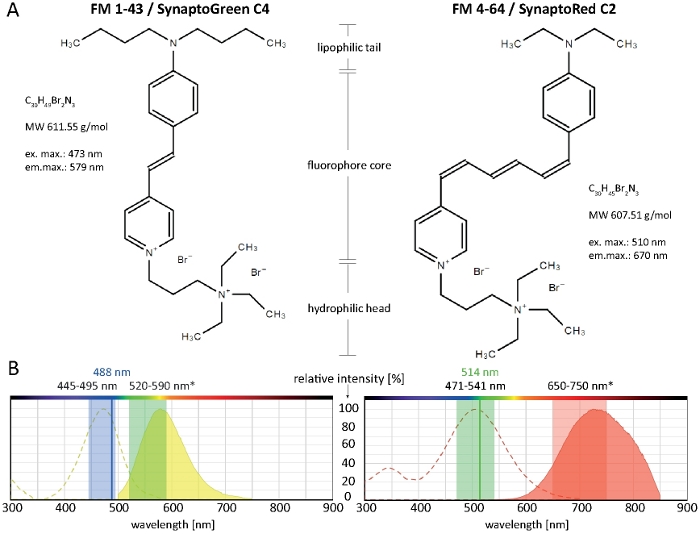
Figure 1 : Propriétés biochimiques et biophysiques des colorants FM. (A) Structures chimiques de FM 1-43/SynaptoGreen C4 et FM 4-64/SynaptoRed C2. (B) Spectres d'absorption et d'émission des deux colorants FM, superposés aux réglages d'imagerie optimaux pour les colorants membranaires dans les champignons filamenteux : 445 à 495 nm de lumière bleue excitera LE FM 1-43 avec une efficacité de 100 à 80 %, tandis que 488 nm d'un laser Argon exciteront le colorant avec une efficacité de 91 %. En raison du décalage bleu sur la liaison de membrane, la plage de détection optimale de l'émission de FM 1-43 se situe entre 520 et 590 nm. De même, les réglages d'imagerie optimaux pour le FM 4-64 chez les champignons sont de 471 à 541 nm (efficacité de 100 à 80 %) lorsqu'on utilise une source d'excitation polychrome ou 514 nm (efficacité de 99 %) lors de l'utilisation d'un laser Argon, et de 650 à 750 nm pour la détection de la lumière des émissions. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
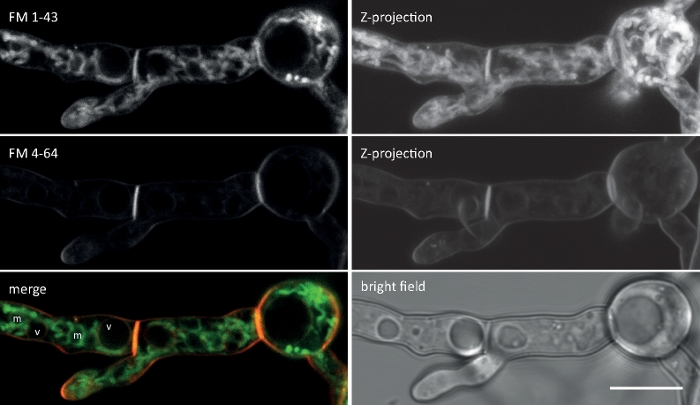
Figure 2 : Co-imagerie simultanée du FM 1-43 et du FM 4-64. Un mélange équimolar des deux colorants a été ajouté à une culture de germling liquide de N. crassa donnant une concentration finale de 10 M. À 25 min après l'ajout de teinture, FM 1-43 a taché la membrane plasmatique et déjà accumulé dans les membranes internes, y compris les mitochondries fortement tachées (m) mais en grande partie à l'exclusion des membranes vacuolaire (v), et est plus de huit fois plus forte par rapport à FM 4-64 (intensités moyennes de fluorescence 176 à 21, respectivement), dont l'hydrophobicité inférieure / hydrophilie supérieure ralentit son taux d'internalisation conduisant à un temps de logement prolongé à la membrane. Barre d'échelle de 10 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
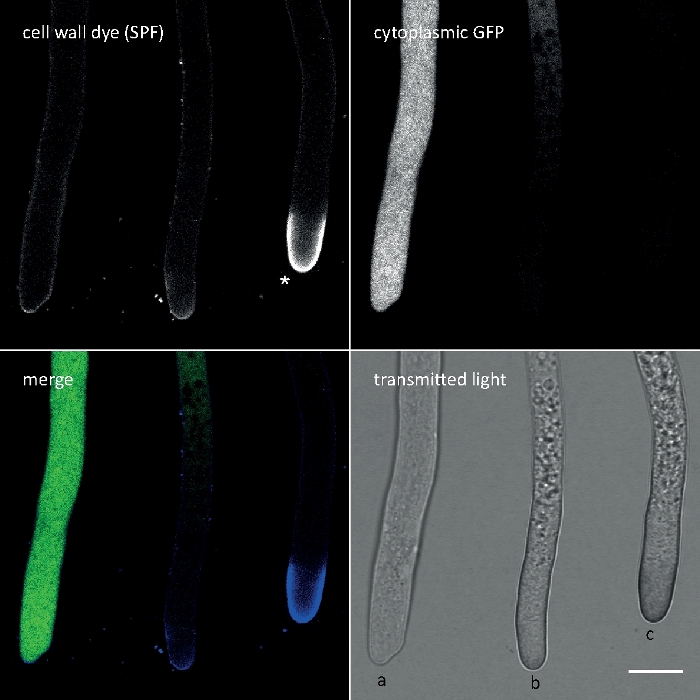
Figure 3 : Le dépôt de polymères de paroi cellulaire induit par le stress de la paroi cellulaire au sommet de la pointe entraîne souvent une autolyse cellulaire. Les Hyphes de T. atroviride exprimant le GFP cytoplasmique ont été souillés avec 10 'M Solophenyl Flavine 7GFE 500 (SPF) et imaged immédiatement après montage. Hyphae non stressé (a), hyphes stressés avec le dépôt légèrement accru de glucane/chitin à l'apex et l'autolyse de progression (b), et les hyphes fortement stressés avec le capuchon aphical prononcé de glucane/chitin (astérisque) et l'autolyse terminale (c) évidente par la perte totale de fluorescence de GFP et de la vacuolisation étendue. Barre d'échelle de 10 m. Voir Le film 1 pour la séquence de cours à temps plein. Notez que les trois hyphes étaient en effet situés à côté de l'autre. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
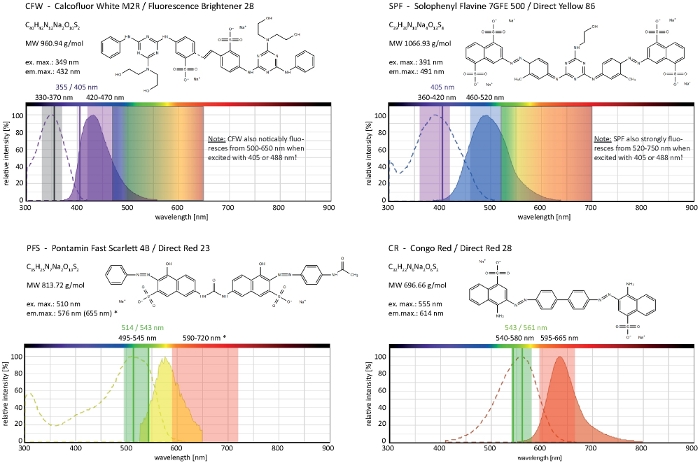
Figure 4 : Propriétés biochimiques et biophysiques des colorants sélectifs de la paroi cellulaire. Les caractéristiques chimiques données sont celle des sels de sodium de chaque colorant. Les spectres d'absorption et d'émission correspondent à ceux des environnements cellulaires. Les lignes d'excitation laser monochromatiques indiquées (écrites en couleur), les plages d'excitation polychromes applicables aux microscopes épifluorescences et les plages de détection de lumière d'émission sont celles recommandées pour l'imagerie chez les champignons filamenteux. Deux lignes d'excitation laser sont indiquées lorsque les deux fonctionnent également bien. (*) Le spectre d'émission du PFS lié à la paroi cellulaire est significativement plus rouge-shifted que précédemment noté33,cependant, ayant pour résultat de très bons S/N-ratios avec des concentrations plus faibles de colorant qu'avant utilisé. Le spectre complet de CR est actuellement indisponible, d'où celui de Nil Red (CAS No: 7385-67-3) est montré comme le match le plus proche. Des informations détaillées sur les propriétés spectrales de CR peuvent être trouvées ailleurs42. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
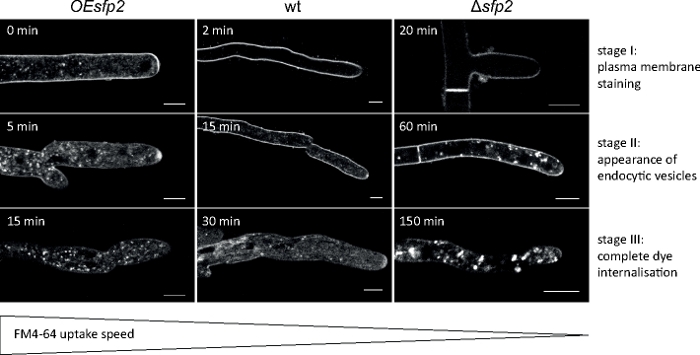
Figure 5 : Influence du Sfp2 sur l'apport endocytique du FM4-64. Trois étapes clés successives de l'utilisation de colorant FM sont facilement discernables dans le type sauvage (wt). Étape I : coloration exclusive de la membrane plasmatique, stade II : première apparition de colorant FM dans des vésicules endocytiques, et stade III : coloration exclusive de vésicules et d'endomembranes endocytiques. Des motifs de coloration équivalents sont montrés au plus tôt de leur apparence. Par rapport au type sauvage de T. atroviride, l'endocytose est légèrement accélérée dans le mutant surexprimant sfp2 (OEsfp2), tandis que l'utilisation de colorant est considérablement retardée dans le mutant de suppression de sfp2 (sfp2 ). Par exemple, l'utilisation de colorant dans la membrane plasmatique se produit instantanément dans OEsfp2 mais prend 2 min dans le type sauvage ; et l'internalisation complète du colorant FM de la membrane plasmatique se produit 10fois plus rapidement dans OEsfp2 par rapport àsfp2. Barres d'échelle de 5 m. Figure est reproduite à partir d'Atanasova et coll.9 en accord avec la licence Creative Commons (https://creativecommons.org/licenses/by/4.0/). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
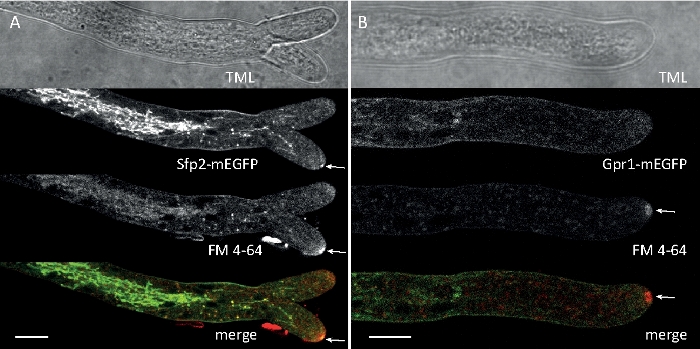
Figure 6 : La co-coloration des protéines membranaires étiquetées EGFP par le FM 4-64 facilite la différenciation de la dynamique de localisation subcellulaire distincte dans T. atroviride. (A) La protéine de domaine à quatre transmembranes Sfp2 colocalise avec des organites étiquetés FM4-64, y compris la membrane plasmatique et la septa, le Spitzenkrper (Spk; flèche) et les vacuoles tubulaires vraisemblablement. (B) La protéine gpr1 à sept transmembranes de type GPCR colocalise avec le FM4-64 aux mêmes organites que Sfp2, à l'exception des barres spk. Scale, 10 m. Voir Movie 3 et Movie 4 pour les séquences de cours à temps plein. Le chiffre a été modifié à partir d'Atanasova et coll.9 en accord avec la licence Creative Commons. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
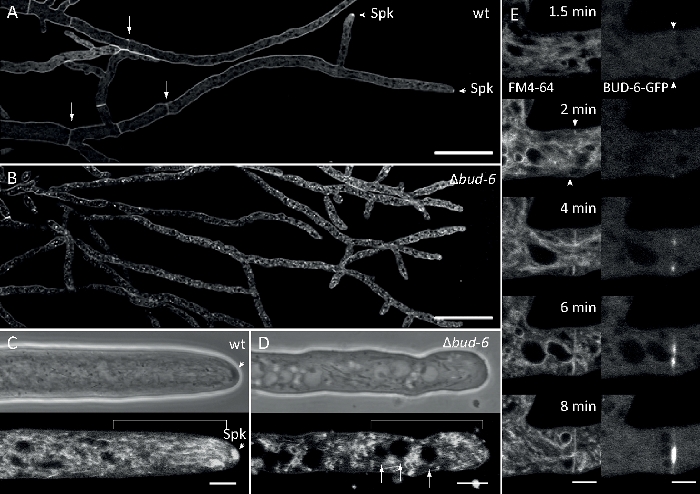
Figure 7 : La coloration FM 4-64 différencie lemutant du bourgeon-6 du type sauvage, et localise BUD-6 à l'anneau septal. (A) FM 4-64 coloration d'hyphes du type sauvage N. crassa (flèches indiquent septa; pointes de flèches indiquent le Spk). (B) Septa et Spk sont absents enbourgeon-6. Barres d'échelle, 50 m. (C et D) Gros plan de l'apex hyphale et du sous-apex de type sauvage (C) etdu bourgeon-6 (D). Spk (arrowhead) se différencie dans le type sauvage, mais pasbourgeon-6. Les supports indiquent la zone d'exclusion nucléaire qui n'est pas établie dans lebourgeon-6. Barres d'échelle de 5 m. (E) RECRUTEMENT BUD-6-GFP au site de septation naissant avant l'invagination de la membrane plasmatique (pointes de flèches) et la constriction septale qui l'accompagne. Barres d'échelle de 5 m. Voir Movie 5a et Movie 5b pour des séquences de cours de temps complètes. Figure a été reproduite avec des modifications de Lichius et coll.16 en accord avec la licence Creative Commons. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
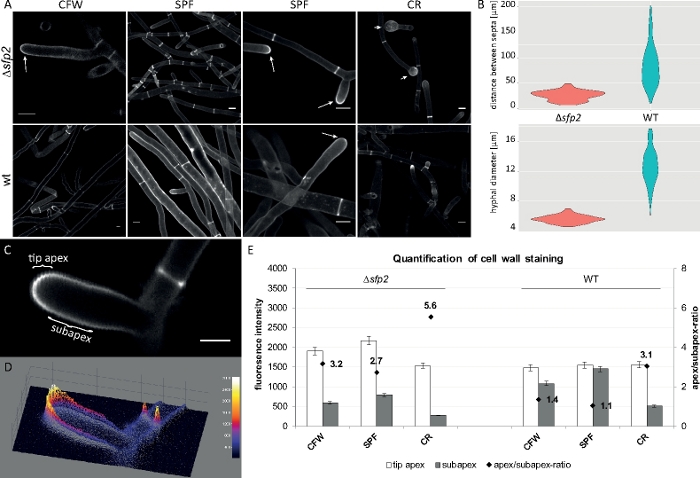
Figure 8 : La suppression du sfp2 modifie le modèle de dépôt du matériau de la paroi cellulaire et affecte la morphogenèse hyphale de T. atroviride. (A) La coloration CFW et SPF révèle une augmentation du dépôt de la paroi cellulaire ensfp2 (flèches) par rapport au type sauvage (wt). La coloration CR induit un gonflement important de la pointe seulement dansle sfp2 (têtes de flèche). Les barres d'échelle de 10 m. (B) Les défauts morphogénétiques dans lesfp2 comprennent des distances septales considérablement réduites (sfp2 et 26,0 m, type sauvage 85 m; n 60; ANOVA Pr 'lt; 2-16) et de plus petits diamètres d'hyphe(sfp2 - 5,6 m, type sauvage ' 12,6 'm; n ' 100; ANOVA Pr et lt; 2-16). (C) Fluorescence de colorant accrue dans le sommet de pointe comparé au sous-apex. Barre d'échelle de 5 m. (D) Parcelle de surface 3D à code d'intensité (C). (E) Quantification des intensités relatives de fluorescence dans le type desfp2 et sauvage (n ' 55). Figure a été reproduite à partir d'Atanasova et coll.9 en accord avec la licence Creative Commons. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
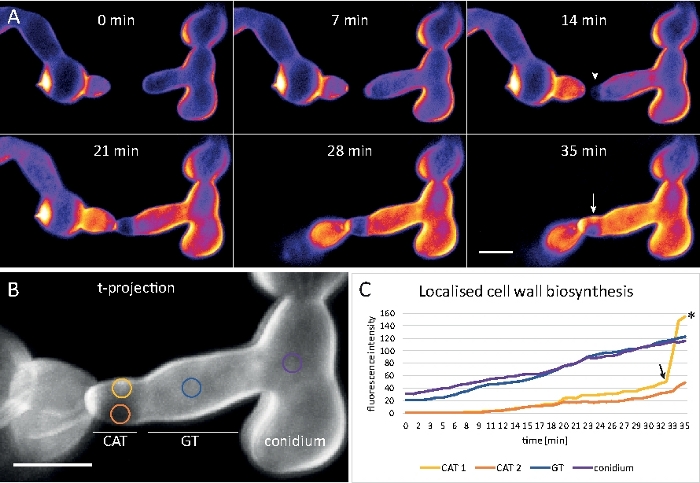
Figure 9 : Surveillance en temps réel de la biosynthèse des parois cellulaires. (A) Conidial anastomosis tube (CAT) fusion entre les germes de N. crassa. Le contact physique devient évident par la réponse de couple de germing (21-28 min). La fluorescence CFW codée par couleur d'intensité indique des régions avec peu (bleu foncé) et dépôt intense (jaune) de paroi cellulaire. L'extrémité de homing d'abord non tachée (tête de flèche), dépose le nouveau matériel de paroi cellulaire au contact de bout et dans le secteur subissant le plus grand effort physique (flèche). Barre d'échelle de 5 m. Voir Movie 6 pour la séquence de cours à temps plein. Figure reproduite à partir de38 avec la permission. (B) Projection de (A) indiquant quatre régions circulaires dans lesquelles des intensités de fluorescence ont été mesurées. Barre d'échelle de 5 m. (C) Terrain des régions indiquées montrant l'augmentation rapide de la biosynthèse localisée de la paroi cellulaire en réponse au stress physique (CAT 1, flèche). Dans le tube germinal (GT) et le corps des spores (conidium), la biosynthèse de la paroi cellulaire augmente régulièrement. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
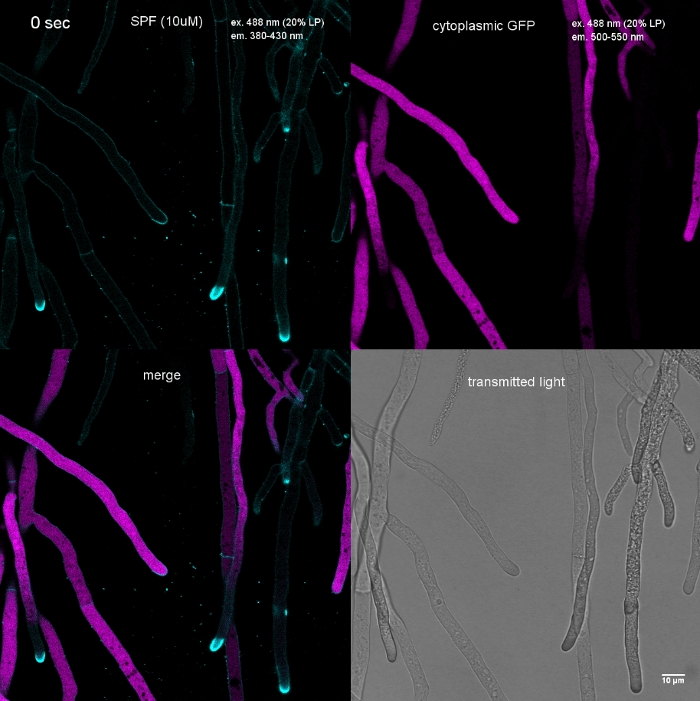
Film 1 : Stress de la paroi cellulaire induit par la teinture. 10 M SPF (cyan) ont été ajoutés à T. atroviride hyphae exprimant GFP cytoplasmique (magenta). La coloration étendue de pointe se produit immédiatement, suivie de la lyse rapide des compartiments d'hyphal dans un délai de 2 min ; par la disparition de la fluorescence du PFG. S'il vous plaît cliquez ici pour télécharger ce film.
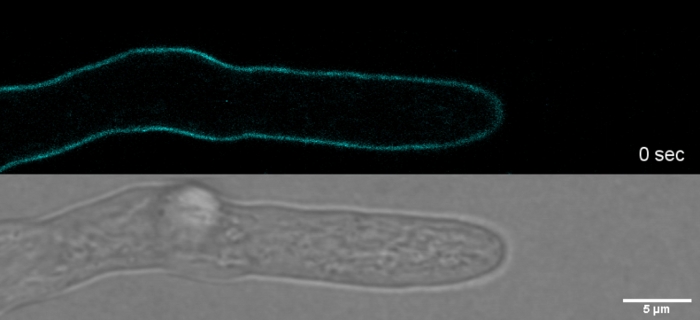
Film 2: Coloration SPF Vital. 2 M SPF (cyan) permettent de suivre la croissance de la pointe de T. atroviride hyphes avec une résolution spatiale et temporelle élevée sans induire des artefacts de stress de la paroi cellulaire au sommet de la pointe. S'il vous plaît cliquez ici pour télécharger ce film.
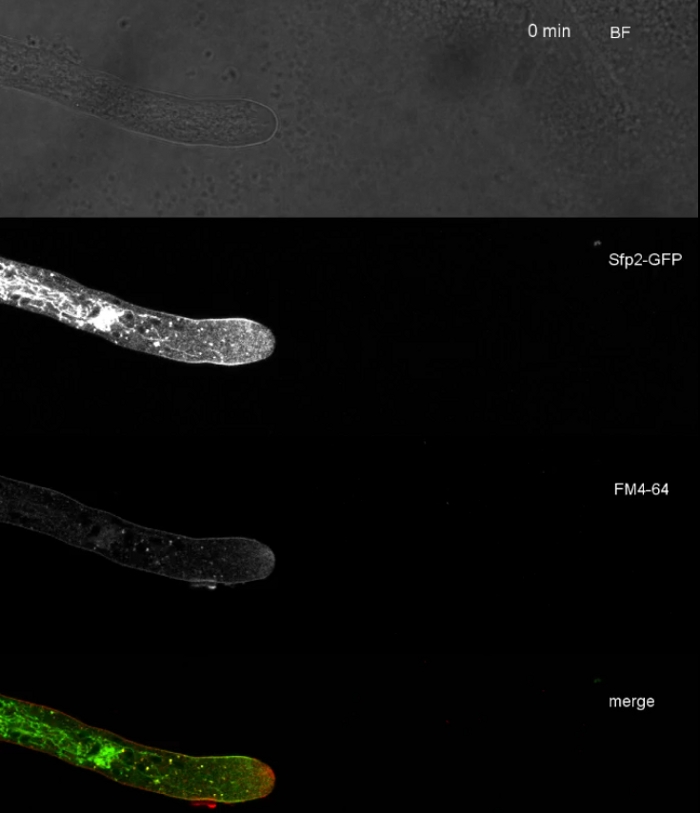
Film 3: FM 4-64 co-staining de Sfp2-GFP. La co-coloration de T. atroviride exprimant Sfp2-mEGFP (vert) avec 1,67 M FM 4-64 (rouge) révèlent la localisation qui se chevauche et distincte de la protéine membranaire avec la voie endocytique. S'il vous plaît cliquez ici pour télécharger ce film.
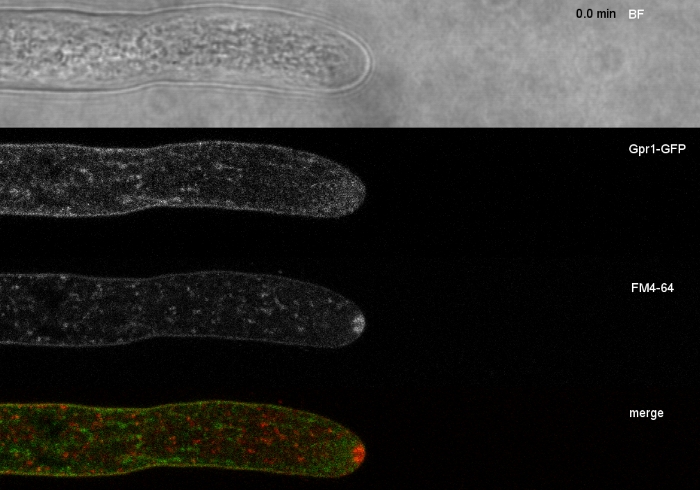
Film 4: FM 4-64 co-staining de Gpr1-GFP. La co-coloration de T. atroviride exprimant Gpr1-mEGFP (vert) avec 1,67 M FM 4-64 (rouge) révèlent la localisation qui se chevauche et distincte de la protéine membranaire avec la voie endocytique. S'il vous plaît cliquez ici pour télécharger ce film.
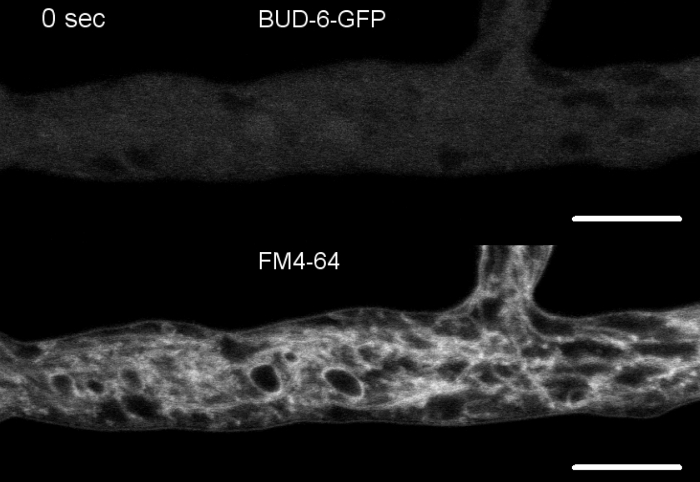
Film 5: FM 4-64 co-staining of BUD-6-GFP. (5a) Co-coloration de N. crassa exprimant BUD-6-GFP (vert) avec 2 M FM 4-64 (rouge) permettent le suivi de la dynamique BUD-6 pendant la formation de septum par rapport à l'invagination de la membrane plasmatique associée. (5b) Cropped et fusionner l'image de (5a). S'il vous plaît cliquez ici pour télécharger Movie 5a
S'il vous plaît cliquez ici pour télécharger Movie 5b.
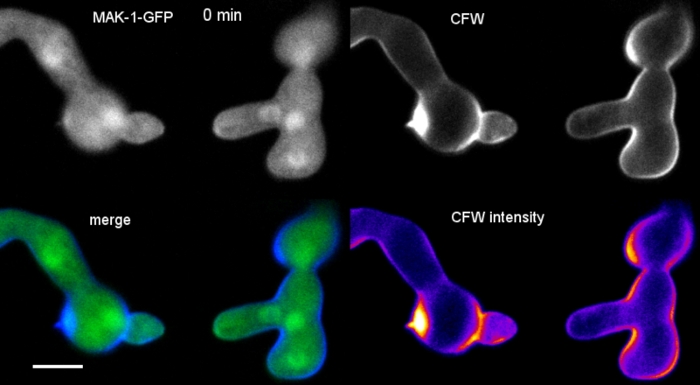
Film 6 : Surveillance en temps réel de la biosynthèse de la paroi cellulaire. Les germes de N. crassa exprimant MAK-1-GFP (vert) ont été co-tachés avec 0,12 M CFW (bleu) pour révéler la biogenèse localisée de la paroi cellulaire pendant la fusion germinale médiée par le CAT. Notez qu'il y a un certain saignement à travers du signal de CFW dans les canaux de GFP, illustrant que SPF ou CR sont de meilleurs choix comme colorants séquentiels et simultanés de co-imagerie pour GFP, respectivement. S'il vous plaît cliquez ici pour télécharger ce film.
Tableau 1 : Propriétés des colorants fluorescents sélectifs de la membrane et de la paroi cellulaire. - valeurs mg/mL corrigées pour la teneur réduite en pureté/teinture pour entraîner l'équimolarité dans toutes les solutions ; n.i.a. - aucune information disponible. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Cet article poursuit le travail novateur qui a établi l'utilisation de divers colorants fluorescents comme marqueurs d'organite essentiels pour les champignons filamenteux au début des années 20002,4,43, et tente de discuter des propriétés physiques et cellulaires biologiques des colorants FM et des colorants de mur cellulaire sélectionnés plus en détail qu'auparavant. Particulièrement en ce qui concerne les effets cellulaires indésirables, tels que la saturation de la membrane ou des dommages à la paroi cellulaire, qui se produisent au-dessus de certaines concentrations de teinture. Ce qui était auparavant considéré comme non toxique au niveau cellulaire est maintenant considéré comme toxique au niveau moléculaire. Même si ces effets peuvent être très subtils et pas directement évidents par des changements évidents dans le comportement des organelles ou des cellules, toute interférence possible de l'application de colorant autre que la visualisation doit être minimisée pour l'étude de la fonction moléculaire indigène. Heureusement, l'amélioration de la sensibilité et de l'efficacité quantique des détecteurs modernes, tels que les détecteurs de photodiode d'avalanche de silicium (Si-APDs)44 ou le détecteur de zone Airyscan45, facilitent l'utilisation de quantités de colorant encore plus faibles qu'auparavant. Un autre objectif clé de l'article est d'illustrer les propriétés de co-imagerie de ces colorants avec d'autres fluorophores, plus important encore, ceux de GFP comme la protéine fluorescente la plus fréquemment utilisée en biologie. Cela devrait faciliter la conception d'expériences d'imagerie qui visent à corréler la dynamique de localisation subcellulaire des protéines de fusion fluorescente à celles de la paroi cellulaire fongique, la membrane plasmatique ou la voie de l'endo-et-exocytose, etc.
L'imagerie dans des conditions naturelles et sans stress est essentielle pour l'acquisition de données fiables. Certaines considérations pratiques concernant le milieu de culture et la préparation de l'échantillon visent à fournir un point de départ pour trouver les conditions optimales qui permettent l'observation à long terme et sans artefacts des cellules saines et non stressées avec le rapport S/N le plus élevé possible pour un échantillon donné. Il n'existe aucun moyen universel d'obtenir des résultats d'imagerie fiables et significatifs. Il est inhérent à l'approche que la variation biologique de l'échantillon, la subjectivité et les attentes du microscopiste, ainsi que le post-traitement d'image ont une influence significative sur l'acquisition et l'interprétation des données, respectivement. Par conséquent, l'expérience pratique du microscopiste, sa connaissance intime de la biologie cellulaire du champignon à l'étude, ainsi que la préparation habile de l'échantillon pour créer des conditions aussi «naturelles» et non perturbées que possible dans un cadre de laboratoire, sont primordiales pour l'acquisition et l'évaluation de données d'imagerie qui reflète honnêtement les phénomènes cellulaires étudiés. En règle générale, l'apparition d'effets secondaires indésirables des colorants fluorescents, allant de l'activation subtile et donc pas visible de la membrane plasmatique ou de la paroi cellulaire remodelant les voies de réponse au stress à l'induction cytotoxique directe de l'autolyse cellulaire, ne peut être évitée en toute sécurité qu'en appliquant de faibles concentrations de colorant s'agitent de 2 m.
L'application de colorants fluorescents est simple, mais leurs spécificités sont mal caractérisées. L'une des principales forces de l'utilisation de colorants fluorescents est la simplicité préparative des protocoles expérimentaux. La culture et l'échantillonnage du champignon, l'ajout du colorant et le montage au stade du microscope sont (avec pratique) simples. Ajustement des paramètres d'imagerie de base, y compris les longueurs d'onde d'excitation et d'émission, les temps d'exposition, les réglages de cours, etc., suivre des règles biophysiques simples du microscope et les règles biologiques des colorants fluorescents utilisés à l'intérieur des cellules. Le tableau 1 vise à appuyer l'identification de la combinaison de colorant ou de teinture la plus appropriée aux fins d'expérimentation. En outre, les colorants fluorescents sont à un prix raisonnable, facilement disponibles avec une haute qualité fiable et assurent ainsi une application hautement reproductible.
Deux restrictions majeures de l'utilisation de colorants fluorescents sélectifs de membrane ou de paroi cellulaire sont la connaissance (souvent) limitée de leurs propriétés précises de coloration, qui dans la plupart des cas sont non spécifiques au niveau d'organelle et moléculaire, et leurs effets secondaires non désirés dépendants de la concentration. Les colorants FM sont spécifiques pour les bicouches lipidiques participant à l'endo- et à l'exocytose. Cependant, précisément quels organites subcellulaires deviennent successivement étiquetés dans les conditions examinées n'est pas immédiatement évident et exige la comparaison de différentes variantes de colorant FM, et le co-étiquetage avec des marqueurs organelle-spécifiques supplémentaires. La préférence de FM 1-43 pour les membranes mitochondriales, par rapport au FM 4-64, est un exemple. Les colorants sélectifs de paroi cellulaire présentent une spécificité variable pour les trois principaux polymères de la paroi cellulaire fongique. CFW est pensé pour être une tache non spécifique pour les glucanes et la chitine, SPF est pensé pour être le plus sélectif pour les -1,4-glucans, et CR est pensé pour être très sélectif pour les chitins et 'et '. Aucune information sur la spécificité de liaison du PFS aux polysaccharides de paroi cellulaire fongique n'est actuellement disponible. À quel rapport le polymère de la paroi cellulaire fongique est le plus efficacement étiqueté à une concentration de colorant donnée chez les espèces fongiques à l'étude n'est pas facilement répondu, et l'application de mesures détaillées acquises in vitro ou in vivo dans d'autres organismes ou d'autres espèces fongiques doit être considérée très attentivement. Malheureusement, cette information est clairsemée et très dispersée dans la littérature35,42,46. Les enregistrements plus récents qui suivraient les études précédentes33 pour fournir de nouvelles informations sur les propriétés précises de coloration des colorants en vedette spécifiquement dans les champignons ne sont pas actuellement disponibles.
Les contrôles d'imagerie sont essentiels pour évaluer avec précision les modèles de coloration et les réponses cellulaires. Probablement la partie la plus difficile, cependant, est de connaître la biologie cellulaire du champignon si bien que les changements enregistrés dans la localisation subcellulaire de la membrane et la paroi cellulaire des colorants fluorescents sélectifs, les altérations de l'architecture cellulaire ou le modèle de croissance hyphal peut exclusivement et en toute confiance être liée aux effets prévus du traitement expérimental. Pour cela, il est crucial d'avoir de bons contrôles en même temps que toute nouvelle expérience d'imagerie cellulaire vivante. Il s'agit notamment du type sauvage non traité comme contrôle d'imagerie négative pour exclure l'autofluorescence de fond et le bruit du détecteur de l'image acquise, et d'avoir un comparateur morphologique lors du travail avec des mutants. En outre, un contrôle d'imagerie positif, par exemple une souche qui exprime gFP ou RFP dans le cytoplasme ou une autre protéine de marqueur fluorescent bien connu, est essentiel pour définir l'intensité lumineuse d'excitation au minimum requis et avoir un contrôle de vitalité cellulaire. Une fois ces contrôles réglés, l'utilisation de colorants fluorescents ne se limite pas aux tâches de visualisation seulement, mais leur dynamique de coloration dépendante de la concentration, ainsi que les effets secondaires dépendants de la concentration peuvent être exploités analytiquement; par exemple, pour la surveillance quantitative de la biosynthèse de la paroi cellulaire en temps réel ou pour l'identification de phénotypes spécifiques aux mutants dans les essais de susceptibilité47.
L'amélioration des applications futures dépend d'une analyse fonctionnelle détaillée des propriétés de coloration des colorants. Un défi permanent majeur consiste à améliorer et à automatiser davantage les analyses quantitatives d'image afin de faire progresser l'évaluation fonctionnelle de la dynamique subcellulaire des colorants fluorescents sélectifs de la membrane et de la paroi cellulaire dans les champignons filamenteux. Pour cela, des études de co-localisation quantitatives approfondies de ces colorants avec des marqueurs connus d'organelle et de polymère de paroi cellulaire en combinaison avec des souches mutantes déficientes dans des voies de transport particulières ou qui manquent de composants structurels spécifiques sont d'abord nécessaires. Plusieurs marqueurs d'endocytose pour des analyses comparatives avec des colorants FM sont disponibles48,49, et en ce qui concerne les spécificités de liaison encore mal caractérisés des colorants de paroi cellulaire dans les champignons, l'application d'anticorps fluorescents spécifiques au glucan50 pourrait fournir une possibilité pour résoudre ce problème.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont pas d'intérêts financiers concurrents et rien à divulguer.
Remerciements
Merci au Fonds des sciences tyroliennes (TWF) d'avoir accordé des subventions #256524 à AL, au Fonds des sciences et de la technologie de Vienne (WWTF) pour avoir accordé une subvention #LS13-086 à SZ, et au Fonds de publication de l'Université d'Innsbruck pour soutenir la publication en libre accès. Les auteurs remercient également le Département de zoologie de l'Université d'Innsbruck d'avoir fourni le microscope à balayage laser confocal Leica TCS SP5 II.
matériels
| Name | Company | Catalog Number | Comments |
| BRAND cell counting chamber | Merck | BR718005 | Thoma format |
| Calcofluor White M2R | Merck/Sigma-Aldrich | F3543 | cell wall dye |
| CFI Plan Apo VC 60x/1.2 NA XC WI | Nikon | MRD07602 | water immersion objective |
| CFI Plan Apo VC 60x/1.2 NA XC WI | Nikon | MRD07602 | water immersion objective |
| Congo Red | Merck/Sigma-Aldrich | C6277 | cell wall dye |
| Dimethyl sulfoxide | VWR | 8,36,73,230 | organic solvent |
| Eclipse TE2000-E with C1 scanning unit | Nikon | custom configuration | inverted laser scanning confocal microscope used to acquire example data 2 and 4 |
| Eclipse TE2000-U with Bio-Rad Radiance 2100 scannig unit | Nikon | custom configuration | inverted laser scanning confocal microscope used to acquire example data 5 |
| FM 1-43 | Merck/Sigma-Aldrich | S6814 | membrane dye |
| FM 4-64 | Merck/Sigma-Aldrich | S6689 | membrane dye |
| Glass beads | Rettberg | 1340691030 | 3 mm glass beads |
| Glass cover slips | Thermo Fisher Scientific | BB02400600A113MNT0 | 24 x 60 # 1 glass cover slips |
| HCX PL APO 63x/1.3 NA Glyc | Leica | 15506353 | glycerol immersion objective |
| LSM 510 Meta | Zeiss | custom configuration | inverted laser scanning confocal microscope used to acquire example data 3 |
| M9 Minimal Medium | Merck/Sigma-Aldrich | M6030 | generic fungal growth medium |
| Micro-slide 8-well | ibidi | 80826 | ibiTreat #1.5 polymer coverslip |
| Miracloth | Merck/Millipore | 475855-1R | polyester filtration material |
| Petri dish | Sarstedt | 8,21,472 | 92 x 16 mm culture dish w/o cams |
| Phytagel | Merck/Sigma-Aldrich | P8169 | transparent gelling agent |
| Plan Apochromat 63x/1.4 NA Oil DIC | Zeiss | 440762-9904-000 | oil immersion objective |
| Pontamine Fast Scarlet 4B | Merck/Sigma-Aldrich | 212490 | cell wall dye |
| Potato Dextrose Agar (PDA) | BD Difco | 213400 | fungal growth medium for T. atroviride |
| Potato Dextrose Broth (PDB) | BD Difco | 254920 | fungal growth medium for T. atroviride |
| Reaction tube | Sarstedt | 72,706 | 1.5 mL SafeSeal tube |
| Scalpel | B.Braun | 5518016 | Cutfix sterile scalpel #23 |
| Screw cap tube | Sarstedt | 6,25,54,502 | 15 mL polypropylene tube |
| Solophenyl Flavine 7GFE 500 | CIBA | 1485385V6 | cell wall dye |
| SynaptoGreen C4 | Biotum | 70020 | membrane dye |
| SynaptoRed C2 | Biotum | 70021 | membrane dye |
| Syringe membrane filter | Thermo Fisher Scientific | 723-9945 | 0.45 µm SFCA syringe filter |
| TCS SP5 II | Leica | custom configuration | inverted laser scanning confocal microscope used to acquire example data 1 |
| Vogel's Minimal Medium (VMM) | FGSC | Fungal Genetics Stock Centre | fungal growth medium for N. crassa |
Références
- Read, N. D., Fischer, S., Parton, R. M. Imaging Spitzenkörper, pH and calcium dynamics in growing fungal hyphae. Pesticide Science. 54 (2), 179-181 (1998).
- Hickey, P. C., Swift, S. R., Roca, M. G., Read, N. D. Live-cell imaging of filamentous fungi using vital fluorescent dyes and confocal microscopy. Microbial Imaging. , 63-87 (2004).
- Jelínková, A., et al. Probing plant membranes with FM dyes: tracking, dragging or blocking. The Plant Journal. 61 (5), 883-892 (2010).
- Fischer-Parton, S., et al. Confocal microscopy of FM4-64 as a tool for analysing endocytosis and vesicle trafficking in living fungal hyphae. Journal of Microscopy. 198 (3), 246-259 (2000).
- Harris, S. D. Branching of fungal hyphae: regulation, mechanisms and comparison with other branching systems. Mycologia. 100 (6), 823-832 (2008).
- Roca, M. G., Arlt, J., Jeffree, C. E., Read, N. D. Cell biology of conidial anastomosis tubes in Neurospora crassa. Eukaryotic Cell. 4 (5), 911-919 (2005).
- Becker, Y., et al. The fungal cell-wall integrity MAPK cascade is crucial for hyphal network formation and maintenance of restrictive growth of Epichloë festucae in symbiosis with Lolium perenne. Molecular Plant-Microbe Interactions. 28 (1), 69-85 (2015).
- Justa-Schuch, D., Heilig, Y., Richthammer, C., Seiler, S. Septum formation is regulated by the RHO4-specific exchange factors BUD3 and RGF3 and by the landmark protein BUD4 in Neurospora crassa. Molecular Microbiology. 76 (1), 220-235 (2010).
- Atanasova, L., et al. The Gpr1-regulated Sur7 family protein Sfp2 is required for hyphal growth and cell wall stability in the mycoparasite Trichoderma atroviride. Scientific Reports. 8 (1), 12064 (2018).
- Betz, W. J., Mao, F., Bewick, G. S. Activity-dependent fluorescent staining and destaining of living vertebrate motor nerve terminals. Journal of Neuroscience. 12 (2), 363-375 (1992).
- Wu, Y., Yeh, F. L., Mao, F., Chapman, E. R. Biophysical characterization of styryl dye-membrane interactions. Biophysical Journal. 97 (1), 101-109 (2009).
- Betz, W. J., Mao, F., B, S. C. Imaging exocytosis and endocytosis. Current Opinion in Neurobiology. 6, 365-371 (1996).
- Hoopmann, P., Rizzoli, S. O., Betz, W. J. Imaging synaptic vesicle recycling by staining and destaining vesicles with FM dyes. Cold Spring Harbor Protocols. 2012 (1), 77-83 (2012).
- Bolte, S., et al. FM-dyes as experimental probes for dissecting vesicle trafficking in living plant cells. Journal of Microscopy. 214, 159-173 (2004).
- Riquelme, M., et al. Spitzenkorper localization and intracellular traffic of green fluorescent protein-labeled CHS-3 and CHS-6 chitin synthases in living hyphae of Neurospora crassa. Eukayotic Cell. 6 (10), 1853-1864 (2007).
- Lichius, A., Yáñez-Gutiérrez, M. E., Read, N. D., Castro-Longoria, E. Comparative live-cell imaging analyses of SPA-2, BUD-6 and BNI-1 in Neurospora crassa reveal novel features of the filamentous fungal polarisome. PloS one. 7 (1), 30372 (2012).
- Peñalva, M. A. Tracing the endocytic pathway of Aspergillus nidulans with FM4-64. Fungal Genetics and Biology. 42 (12), 963-975 (2005).
- Dijksterhuis, J., Molenaar, D. Vesicle trafficking via the Spitzenkörper during hyphal tip growth in Rhizoctonia solani. Antonie van Leeuwenhoek. 103 (4), 921-931 (2013).
- Hickey, P. C., Read, N. D. Imaging living cells of Aspergillus in vitro. Medical Mycology. 47, 110-119 (2009).
- Delgado-Álvarez, D. L., Bartnicki-García, S., Seiler, S., Mouriño-Pérez, R. R. Septum development in Neurospora crassa: the septal actomyosin tangle. PLoS One. 9 (5), 96744 (2014).
- Hageage, G. J., Harrington, B. J. Use of Calcofluor White in clinical mycology. Laboratory Medicine. 15 (2), 109-112 (1984).
- Monheit, J. E., Cowan, D. F., Moore, D. G. Rapid detection of fungi in tissues using Calcofluor White and fluorescence microscopy. Archives of Pathology and Laboratory. 108 (8), 616-618 (1984).
- Herth, W., Schnepf, E. The fluorochrome Calcofluor White binds oriented to structural polysaccharide fibrils. Protoplasma. 105 (1-2), 129-133 (1980).
- Elorza, M. V., Rico, H., Sentandreu, R. Calcofluor White alters the assembly of chitin fibrils in Saccharomyces cerevisiae and Candida albicans cells. Journal of General Microbiology. 129 (5), 1577-1582 (1983).
- Lagorce, A., et al. Genome-wide analysis of the response to cell wall mutations in the yeast Saccharomyces cerevisiae. Journal of Biological Chemistry. 278 (22), 20345-20357 (2003).
- Sanz, A. B., García, R., Rodríguez-Peña, J. M., Arroyo, J. The CWI Pathway: regulation of the transcriptional adaptive response to cell wall stress in yeast. Journal of Fungi. 4 (1), (2017).
- Slifkin, M., Cumbie, R. Congo Red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Michels, J., Büntzow, M. Assessment of Congo Red as a fluorescence marker for the exoskeleton of small crustaceans and the cuticle of polychaetes. Journal of Microscopy. 238 (2), 95-101 (2010).
- Pancaldi, S., Poli, F., Dall'Olio, G., Vannini, G. L. Morphological anomalies induced by Congo Red in Aspergillus niger. Archives of Microbiology. 137 (3), 185-187 (1984).
- Roncero, C., Durán, A. Effect of Calcofluor White and Congo Red on fungal cell wall morphogenesis: in vivo activation of chitin polymerization. Journal of Bacteriology. 163 (3), 1180-1185 (1985).
- Kopeck, M., Gabriel, M. The influence of Congo Red on the cell wall and (1,3)- β-d-glucan microfibril biogenesis in Saccharomyces cerevisiae. Archives of Microbiology. 158 (2), 115-126 (1992).
- Heilmann, C. J., et al. Surface stress induces a conserved cell wall stress response in the pathogenic fungus Candida albicans. Eukayotic Cell. 12 (2), 254-264 (2013).
- Hoch, H. C., Galvani, C. D., Szarowski, D. H., Turner, J. N. Two new fluorescent dyes applicable for visualization of fungal cell walls. Mycologia. 97 (3), 580-588 (2005).
- Liesche, J., Ziomkiewicz, I., Schulz, A. Super-resolution imaging with Pontamine Fast Scarlet 4BS enables direct visualization of cellulose orientation and cell connection architecture in onion epidermis cells. BMC Plant Biology. 13, 226 (2013).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Knight, N. L., Sutherland, M. W. A rapid differential staining technique for Fusarium pseudograminearum in cereal tissues during crown rot infections. Plant Pathology. 60 (6), 1140-1143 (2011).
- Fajardo-Somera, R. A., et al. Dissecting the function of the different chitin synthases in vegetative growth and sexual development in Neurospora crassa. Fungal Genetics and Biology. 75, 30-45 (2015).
- Lichius, A. . Cell Fusion in Neurospora crassa. , (2010).
- Chen, W., Li, W., Dong, X., Pei, J. A Review of Biological Image Analysis. Current Bioinformatisc. 13 (4), 337-343 (2018).
- Goldman, R. D., Swedlow, J., Spector, D. L. . Live cell imaging: A laboratory manual. , (2010).
- Eliceiri, K. W., et al. Biological imaging software tools. Nature methods. 9 (7), 697-710 (2012).
- Zemanek, G., Jagusiak, A., Chłopaś, K., Piekarska, B., Stopa, B. Congo Red fluorescence upon binding to macromolecules - a possible explanation for the enhanced intensity. Bio-Algorithms and Med-Systems. 13 (2), 1187 (2017).
- Hickey, P. C., Jacobson, D. J., Read, N. D., Louise Glass, N. Live-cell imaging of vegetative hyphal fusion in Neurospora crassa. Fungal Genetics and Biology. 37 (1), 109-119 (2002).
- . Hamamatsu Si APD - high sensitivity photodiodes having an internal gain mechanism: Avalanche photodiode selection guide 2019 Available from: https://www.hamamatsu.com/resources/pdf/ssd/si_apd_kapd0001e.pdf (2019)
- Huff, J. The Airyscan detector from ZEISS: confocal imaging with improved signal-to-noise ratio and super-resolution. Nature Methods. 12, 1205 (2015).
- Thomas, J., Idris, N. A., Collings, D. A. Pontamine Fast Scarlet 4B bifluorescence and measurements of cellulose microfibril angles. Journal of Microscopy. 268 (1), 13-27 (2017).
- Ram, A. F. J., Klis, F. M. Identification of fungal cell wall mutants using susceptibility assays based on Calcofluor White and Congo Red. Nature Protocols. 1 (5), 2253-2256 (2006).
- Toshima, J. Y., et al. Spatial dynamics of receptor-mediated endocytic trafficking in budding yeast revealed by using fluorescent alpha-factor derivatives. Proceedings of the National Academy of Science of the USA. 103 (15), 5793-5798 (2006).
- Kilaru, S., Schuster, M., Latz, M., Guo, M., Steinberg, G. Fluorescent markers of the endocytic pathway in Zymoseptoria tritici. Fungal Genetics and Biology. 79, 150-157 (2015).
- Fu, C., Tanaka, A., Free, S. J. Neurospora crassa 1,3-α-glucan synthase, AGS-1, is required for cell wall biosynthesis during macroconidia development. Microbiology. 160, 1618-1627 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon