Method Article
Aplicação de corantes fluorescentes seletivos da membrana e da parede de pilha para a imagem latente da Viver-pilha de fungos de Filamentous
Neste Artigo
Resumo
Corantes fluorescentes vitais são ferramentas essenciais para análises de imagens de células vivas na biologia moderna das células fúngicas. Este artigo detalha a aplicação de corantes fluorescentes estabelecidos e menos conhecidos para rastrear a dinâmica da membrana plasmática, endo-/exocitose e mordogênese da parede celular em fungos filamentous.
Resumo
A aplicação de corantes fluorescentes seletivos da membrana e da parede celular para análises de imagem de células vivas da dinâmica de organela em células fúngicas começou há duas décadas e, desde então, continua a contribuir muito para a nossa compreensão do fungo filamentou Vida. Este artigo fornece um guia prático para a utilização dos dois corantes de membrana FM 1-43 e FM 4-64 e as manchas de parede de quatro células Calcofluor White M2R, Solophenyl Flavine 7GFE 500, Pontamine Fast Scarlet 48 e Congo Red. O foco está em sua aplicação de baixa dose para verificar a coloração livre de artefatos, suas propriedades de co-imagem e sua avaliação quantitativa. Os métodos apresentados são aplicáveis a todas as amostras fúngicas filamentosas que podem ser preparadas das formas descritas. As abordagens fundamentais de coloração podem servir como pontos de partida para adaptações a espécies que podem exigir diferentes condições de cultivo. Primeiramente, as propriedades biofísicas e bioquímicas são revistas porque sua compreensão é essencial para usar estas tinturas como manchas fluorescentes verdadeiramente vitais. Em segundo lugar, são apresentados protocolos passo a passo que detalham a preparação de vários tipos de amostra fúngica para imagens fluorescentes de células vivas. Finalmente, experimentos de exemplo ilustram diferentes abordagens para: (1) identificar defeitos na organização espaço-temporal da endocitose em mutantes genéticos, (2) caracterizam comparativamente a co-localização compartilhada e distinta de proteínas-alvo rotuladas por GFP na via endócitica, (3) identificar defeitos de parede de células morfogenéticas em um mutante genético, e (4) monitorar a biogênese da parede celular em tempo real.
Introdução
Vinte anos atrás, a maneira pela qual a morgênese hipocificana e a biologia celular molecular subjacente poderiam ser visualizadas em fungos filamentosos foi revolucionada pela aplicação da membrana seletiva fluorescente Fei Mao dye FM 4-641. Mais tarde, o benefício da corante de ligação à quitina Calcofluor White como marcador fluorescente vital da dinâmica da parede celular fúngica foi realizado2. Desde então, tanto os corantes quanto as variantes dos mesmos tornaram-se uma parte inerente das análises de imagens de células vivas da dinâmica da organela em fungos e continuam a fornecer insights sem precedentes sobre o estilo de vida fúngico filamentous. Este artigo detalha a aplicação de corantes fluorescentes estabelecidos e menos conhecidos para rastrear a dinâmica da membrana plasmática, endo- e exocitose e mordogênese da parede celular em fungos filamentous. Os ensaios de rastreamento de endocitose permitem que várias questões biológicas celulares relacionadas ao estudo geral da endocitose sejam abordadas3. Para isso, a localização, velocidade e sucessão de compartimentos manchados após a adição de corante FM é registrada por microscopia de lapso de tempo e quantitativamente comparada entre as cepas de fungos testadas4. As tinturas da parede da pilha delineam o limite exterior da pilha e permitem o seguimento de eventos morfogenéticos, incluindo o crescimento polarizado da ponta do hyphal2,hyphal que ramifica5,fusão6,7 do hyphal e formação8do septo. Além disso, facilitam a quantificação da deposição localizada da parede celular e a identificação de defeitos durante a biogênese da parede celular9. Como o conhecimento detalhado das propriedades bioquímicas e biofísicas de qualquer marcador fluorescente é um pré-requisito fundamental para sua aplicação in vivo bem-sucedida, essas características são resumidas pela primeira vez para os seis corantes apresentados neste artigo.
Corantes seletivos da membrana
FM (Fei Mao) corantes de estilingue são pequenas moléculas anfofílicas que não podem passar, mas reversivelmente associar com o folheto externo do bicamada lipídica de membranas biológicas10. Eles são praticamente não fluorescentes em solução aquosa, mas tornam-se intensamente fluorescentes sobre a integração da membrana plasmática, gerando excelentes relações de sinal para ruído (S/N)11. Estas propriedades torná-los ideais para visualizar a membrana plasmática e dinâmica organela intracelular, incluindo o rastreamento de endo- e exocitose12. O FM verde-fluorescente 1-43 e o FM vermelho-fluorescente 4-64 são os dois marcadores fluorescentes os mais extensamente usados da membrana para estas finalidades. SynaptoGreen C4 e SynaptoRed C2 são moléculas genéricas de fornecedores alternativos que podem ser usadas alternadamente em vez de FM 1-43 e FM 4-64, respectivamente.
Os corantes de estilingue compreendem três regiões estruturais chaves: (1) a cauda lipophilic que facilita a inserção da tintura no bilayer lipídico, (2) o núcleo do fluoroforre que determina as propriedades espectrais da tintura e é constituído por dois anéis aromáticos conectados por um a três ligações duplas, e (3) a cabeça hidrofílica positivamente carregada que impede a inserção e permeação completa do corante através da membrana (Figura 1A).
Quanto mais tempo a cauda lipofílica, maior é a hidrofóbica do tintura e, assim, aafinidade de ligação com a membrana, mas menor é a sua solubilidade da água e taxa de descoloração da membrana. Consequentemente, diferentes variantes de corante FM produzem diferentes dinâmicas de coloração e padrões. A maior hidrofóbica da FM 1-43 com cauda C4 fornece um sinal de fluorescência mais forte e mais estável nas membranas plasmáticas e organelas internas mais rapidamente do que a FM 4-64 de cauda C2 mais curta, quando aplicada em concentrações equimolares (Figura 2).
É importante ressaltar que as taxas constantes e altas de associação/dissociação de ambos os corantes FM11 com tempos médios de retenção de 1-6 s por molécula de corantes individuais13 reduzem as chances de ruptura localizada da função da membrana, por exemplo, através da modificação da fluidez da membrana ou interação permanente forçada de proteínas de membrana. Esta é provavelmente a principal razão pela qual essas moléculas podem ser usadas como corantes vitais. No entanto, as concentrações de tintura de FM acima de 50 μM são tóxicas para as células fúngicas e vegetais2,14,e evidências de protoplastos de tabaco BY-2 indicam que mais de 20 μM FM tintura levam à saturação da membrana plasmática14. Assim, é aconselhável não exceder esse limite, especialmente tendo em conta o fato de que excelente imagem foi alcançada com tão pouco quanto 2-5 μM15,16.
Notavelmente, as propriedades espectrais de corantes FM variam muito dependendo do microambiente de membrana particular (revisado14). Geralmente, os espectros de excitação e emissão de corantes FM em soluções solventes puras (como geralmente fornecidos nas informações do produto) diferem significativamente do que em ambientes celulares e podem, na maioria dos casos, não ser consultados diretamente para a seleção de configurações de imagem de células vivas. A máxima de excitação/emissão de FM 1-43 e FM 4-64, por exemplo, torna-se azul-deslocado por 37/46 nm e 43/64 nm, respectivamente, quando vinculado a membranas fúngicas em comparação com suas soluções em metanol (Tabela 1).
Os fundamentos inovadores para o uso de FM 4-64 e FM 1-43 para rastreamento de membrana plasmática, endo-/exocitose dinâmica, incluindo o Spitzenkörper e mitocôndrias, já foram amplamente documentados para uma ampla gama de espécies fúngicas filamentosas anteriormente2,4,17,18,19. Configurações recomendadas de imagem para ambos os corantes FM que funcionam em várias espécies fúngicas filamentosas são retratadas na Figura 1B. Limitações técnicas do equipamento disponível ou determinadas condições celulares e experimentais, como meio de cultura, pH ou temperatura, no entanto, podem exigir algumas adaptações. Felizmente, os corantes FM operam-se sobre uma escala espectral larga, e os resultados muito bons da imagem latente são conseguidos por FM emocionante 1-43 com 514 nm ou FM 4-64 com 488 nm. Consequentemente, as configurações de imagem ideais devem ser determinadas individualmente para cada tipo de amostra e aplicação pretendida.
A mudança considerável stoke de mais de 135 nm de FM 4-64 permite excelente, co-imagem simultânea com fluorofóbicos emitindo luz verde; isto é frequentemente explorado para avaliar a dinâmica de localização intracelular de proteínas de fusão rotuladas por proteínas de fusão rotuladas por proteínas de fusão rotuladas por proteínas de fusão rotuladas por proteínas de fusão rotuladas por proteínas de fusão em relação à membrana plasmática e à via endócitica9,20.
Corantes seletivos da parede celular
Calcofluor White M2R (CFW), também comercializado como Fluorescent Brightener 28, é provavelmente o corante fluorescente mais conhecido usado para manchar as paredes celulares de bactérias, fungos, algas, plantas mais altas e insetos. Inicialmente utilizado como agente de clareamento óptico na indústria de papel, têxteis e detergentes, seus benefícios para o diagnóstico clínico de infecções fúngicas foi realizado no iníciode 21,22. Porque CFW intercalates irreversivelmente na cadeia de chitinas nascente que perturba a montagem normal de microfibrila chitina durante a biogênese da parede celular, gerando assim o estresse da parede celular23. Isso, por sua vez, desencadeia um mecanismo de reparo de danos na parede celular levando à deposição da parede celular localmente elevada como resultado da ativação de glucana e sintetina dechitin24,25. Este fenômeno pode ocorrer com qualquer corante que opera por evigoração de polímeros de parede celular, é dependente da concentração e é mais perceptível em pontas de hílgolo que representam o crescimento mais prolífico e, portanto, as partes mais sensíveis do micélio (Figura 3). Um resumo abrangente da maquinaria molecular que responde aos danos na parede celular foi recentemente fornecido26.
Tinecomum de overdose em combinação com fototoxicidade pode levar a lyse celular rápida de compartimentos de hílmo (Filme 1). No entanto, o aumento da sensibilidade às concentrações de tine que são "vitais" no tipo selvagem pode ser explorado para identificar defeitos na biossíntese da parede celular de mutantes de perda de função de genes9. Para CFW e Congo Red (CR), outro colorante têxtil também conhecido como Red Direto 28 e empregado como α- e β-chitin-specific mancha de parede celular para fungos e insetos27,28, concentrações limiar que induzem fortemente synthases quitina foram determinadas com > 60 μM CFW e > 70 μM CR, respectivamente, enquanto as concentrações <15 μM de qualquer tinqüeta não alterarou ou inibir o crescimento fúngico29,30,31. Hickey et al. colocaram essa concentração limite para CFW em 25 μM2. Portanto, é aconselhável usar concentrações de corante≤ 5 μM para excluir artefatos relacionados ao estresse e garantir o uso dessas moléculas como verdadeiramente "corantes fluorescentes vitais"2,32. Isso se aplica igualmente a Solophenyl Flavine 7GFE 500 (FpS) e Pontamine Fast Scarlet 4B (PFS), sinônimo de Direct Yellow 86 e Direct Red 23, respectivamente, dois outros corantes de parede celular útil cuja aplicação de fungos foi relatada pela primeira vez há mais de uma década33. Mas, apesar de suas notáveis propriedades espectrais34,35, o uso de ambos os corantes tem sido, desde então, muito limitado36,37. Como mostrado anteriormente para 1,5 μM CFW2,2 μM FpS são suficientes para resolver a dinâmica da parede celular em condições nativas com resolução temporal muito alta(Filme 2). Os mesmos resultados podem ser obtidos com 2 μM CR ou PFS.
Juntos, esses quatro corantes, CFW, FpS, PFS e CR, compreendem um conjunto de marcadores fluorescentes seletivos de parede celular que cobrem quase o espectro completo de luz de emissão visível (400-700 nm) utilizado em microscópios fluorescentes modernos (Figura 4). O aumento significativo na intensidade da fluorescência em cima do obrigatório aos polímeros da parede de pilha é inerente a todos os quatro e gera excelentes rácios S/N. Isso, por sua vez, permite manter as concentrações de corante e a intensidade da luz de excitação muito baixa e permite realizar a coloração da parede celular como técnica de imagem de células vivas de "baixa dose"2. Porque estes corantes da parede da pilha são membrana do plasma impermeável, funcionam simultaneamente como manchas vivas/inoperantes. Notavelmente, devido aos seus espectros de luz de emissão extremamente ampla, algumas limitações em relação às propriedades de co-imagem da CFW e SPF com outros fluorofônicos precisam ser cuidadosamente consideradas.
Protocolo
1. Preparação de amostras de fungos
- Pré-culturas fúngicas
- Inocular a tensão desejada em um meio de ágar sólido apropriado, como agar dextrose de batata (PDA) para o atroviride de Trichoderma ou o mínimo médio (VMM) de Vogel para neurospora crassa. Adicione um marcador de seleção apropriado ao trabalhar com cepas transformantes.
- Incubar a pré-cultura à temperatura ideal do organismo. Por exemplo, T. atroviride em 25 °C e N. crassa em 30 °C, e 12 h/12 h ciclos claros/escuros até que um micélio esporuulando se tornou mas ainda não alcançou a borda da placa. Em uma placa de Petri de tamanho padrão (9,2 cm Ø), isso leva o atroz t. do tipo selvagem em média de 4-6 dias, enquanto o n. crassa selvagem tipo atinge esta fase após 3-4 dias, em média.
- Cultivo de colônias fúngicas
- Usando um bisturi estéril, corte um pequeno bloco de ágar de 3 mm x 3 mm que transportava micélio não-esporuantes da borda da colônia da pré-cultura.
- Coloque o bloco de ágar no centro de uma placa média sólida fresca para inocular a cultura experimental.
- Incubar a cultura experimental de acordo com o estágio de desenvolvimento destinado a ser investigado. Por exemplo, o atroviride T. do tipo selvagem requer 20-22 horas a 25 °C no escuro para desenvolver colônias de cerca de 2 cm de diâmetro no PDA, enquanto o selvagem-tipo N. crassa atinge diâmetros de colônia de cerca de 4 cm após 14-16 h de incubação em 30 °C no escuro em VMM.
NOTA: A incubação no escuro impede a formação de pigmentos que possam introduzir a autofluorescência. A fim de eliminar a fluorescência de fundo médio da cultura experimental, substitua ágar por 1,5% w/v de um agente solidificante transparente (ver a Tabela de Materiais),e qualquer meio complexo com um meio mínimo definido.
- Cultivo de culturas germantes sólidas
- Use 5 mL de solução fisiológica estéril de sal (0,9% w/v NaCl) para colher esporos de coniscarantes da placa pré-cultura e coletar a suspensão resultante do esporo em um tubo de tampa de rosca de 15 mL.
- Misture bem a suspensão poreso por vórtice vigoroso e, posteriormente, filtre-a sobre uma tira de 1 cm x 5 cm de tecido de filtro estéril (veja a Mesa de Materiais) levemente enfiada em uma ponta de pipeta de 1 mL (montada e autocllavada de antemão) em um tubo estéril fresco.
- Determine a densidade do esporo com uma câmara de contagem celular e prepare uma suspensão de esporos de 1 x 107 células/mL com solução fisiológica de sal.
NOTA: A suspensão porosa pode ser mantida em 4 °C por até duas semanas. - Prepare uma placa de Petri de tamanho padrão (9,2 cm Ø) com 20 mL de meio sólido e adicione 15-20 contas de vidro estéreis (3 mm Ø) em cima.
- Pipeta 200 μL da suspensão esporo na placa média e distribuir uniformemente as células em toda a placa por agitação suave. Coletar as contas de vidro em um copo com 70% de etanol para reutilização.
- Incubar a cultura experimental de acordo com o estágio de desenvolvimento destinado a ser investigado. Por exemplo, o tipo selvagem do atroviride de T. exige 5-6 h em 25 °C na obscuridade para desenvolver germlings conidial no PDA, visto que o tipo selvagem do crassa de N. desenvolve germlings conidial após 3-4 h da incubação em 30 °C na obscuridade em VMM.
NOTA: A fim eliminar toda a fluorescência média do fundo da cultura experimental, substitua o ágar com o agar de 1.5% w/v de um agente solidifying transparente, e de todo o meio complexo com um meio mínimo definido.
- Cultivo de culturas germantes líquidas
- Preencha 190 μL de meio de cultura líquida em cada poço de um micro-slide com câmara de 8 poços.
- Adicione 10 μL de uma solução de esporos de 1 x 107 células/mL (preparada nos passos 1.4.1-1.4.3) e misture suavemente tubulação para cima e para baixo algumas vezes. O número total resultante de células é de 1 x 105 por poço.
- Incubar a cultura experimental de acordo com o estágio de desenvolvimento destinado a ser investigado. Por exemplo, o tipo selvagem T. atroviride requer 5-6 h a 25 °C no escuro para desenvolver germlings conidial em caldo de dextrose de batata (PDB), enquanto o tipo selvagem N. crassa desenvolve germlings conidial após 3-4 h de incubação em 30 °C no escuro em VMM líquido.
2. Preparação de soluções de trabalho de tinuosidade
- Para garantir a solubilidade total de cada tintura, prepare soluções de estoque 2 mM em dimetil sulfoxide (DMSO), adicionando a quantidade adequada (ver pesos exatos na Tabela 1) a 1 mL de 100% DMSO e misture bem vórtice.
CUIDADO: Certifique-se de tomar o DMSO de uma garrafa selada de septo; deve ser um líquido transparente claro. Após o contato com o ar, DMSO fica marrom, provavelmente devido à oxidação de impurezas traço - e pode afetar negativamente o crescimento celular ou coloração de corante. - Filtro esterilizar a solução de estoque através de um filtro de membrana de seringa de 0,2 μm em um tubo de reação estéril fresco de 1,5 mL. Para minimizar o branqueamento de corantes, envolva o tubo em folha de alumínio.
NOTA: A solução de estoque de tingelo pode ser alicitada em volumes menores para evitar ciclos de descongelamento/congelamento e mantida em 4 °C por vários meses. - Prepare uma solução de trabalho de tine aquosa de 20 μM dissolvendo 2 μL de solução de estoque de tinuoso em 198 μL de água destilada estéril em um tubo de reação estéril fresco de 1,5 mL. Para minimizar o branqueamento de corantes, envolva o tubo em folha de alumínio.
NOTA: A solução de trabalho do tintendência deve ser preparada recentemente no dia da experiência. - Durante a montagem da amostra (ver seção 3), a solução de trabalho de tinuoso será diluída de forma padrão 1:10, resultando em uma concentração final de tine de 2 μM e 0,1% w/v concentração final do DMSO.
NOTA: Escolher diferentes fatores de diluição simplesmente alterando a relação de volume entre a solução de trabalho de corante e o líquido de montagem, permite adaptar facilmente a concentração de corante final desejada.
CUIDADO: Para evitar efeitos indesejados devido à tintura ou toxicidade DMSO, o fator de diluição não deve cair abaixo de 1:4 para resultar concentrações finais máximas de 5 μM corante e 0,4% w/v DMSO. Concentrações mais elevadas de tintura saturarão rapidamente o sistema e evitarão quantificação de sinal confiável, enquanto mais de 0,5% w/v (≥ 62,5 mM) DMSO pode prejudicar o desenvolvimento celular38.
3. Preparação da amostra para a microscopia
- Amostras da montagem das colônias fungosas (etapa 1.2) ou das culturas germling contínuas (etapa 1.3) pelo método invertido do bloco do ágar.
- Mantenha um deslizamento limpo da tampa de vidro de 24 mm x 60 mm (#1 = espessura de 0.13-0.16 mm) pronto e adicione 18 μL do meio mínimo líquido (VMM ou M9) ou da solução fisiológica do sal no centro.
- Adicione 2 μL da solução de trabalho de tine de 20 μM para os 18 μL de líquido e misture bem por pipetting cima e para baixo várias vezes, evitando a produção de bolhas de ar.
NOTA: Ao trabalhar com várias amostras, é aconselhável preparar uma mistura mestra de solução de tinudura líquida para todos, a fim de garantir a concentração de tine igual durante todo o experimento. - Com um bisturi limpo, corte uma amostra de 15 mm x 15 mm da periferia da colônia ou cultura de germe sólido e coloque-a verticalmente ao lado da queda média no deslizamento de cobertura.
- Usando o bisturi para suportar a borda superior do bloco e um dedo para segurar o lado traseiro do bloco no lugar, lentamente abaixe o lado carregando o micélio ou germes sobre o líquido. A amostra está agora pronta para transferência para o estágio do microscópio.
CUIDADO: É essencial fazer isso lenta e com muito cuidado, a fim de minimizar o estresse mecânico nas células e evitar que as bolhas de ar sejam presas entre a amostra e a cobertura.
- Monte as culturas germantes líquidas a partir do passo 1.4.
NOTA: Mais convenientemente, culturas germantes líquidos em lâminas de micropoço com câmara podem ser diretamente transferidas e manipuladas ainda mais no estágio do microscópio.- Adicione 22 μL de solução de trabalho de tinuoso a 200 μL de médio líquido para resultar em concentrações finais padrão de 2 μM tine e 0,1% w/v DMSO.
NOTA: As culturas germantes líquidas têm a grande vantagem de que corantes fluorescentes (ou outros produtos químicos, como inibidores) podem ser adicionados em qualquer ponto de tempo desejado do experimento, também durante o registro. Nesse caso, é preciso tomar cuidados especiais para administrar as gotas líquidas muito lentamente, a fim de não perturbar as células. As vibrações do sistema e o movimento browniano já podem introduzir algum movimento celular.
- Adicione 22 μL de solução de trabalho de tinuoso a 200 μL de médio líquido para resultar em concentrações finais padrão de 2 μM tine e 0,1% w/v DMSO.
4. Microscopia de células vivas
- Ajuste as configurações básicas de aquisição de imagem. As seguintes configurações de aquisição de imagem permitem capturar a dinâmica de coloração em hífens individuais e são aplicáveis a ambos os seguintes ensaios
- Aplique 5-10% de potência laser de 20% da potência de saída total do dispositivo.
- Use um plano Apo 60x-63x glicerol ou objetivo de imersão de água com uma alta abertura numérica ≥ 1.2.
- Restrinja a área de aquisição de imagem ao contorno da pasta, definindo um tamanho de imagem de 1024 x 256 pixels e usando um fator de zoom óptico de 2-3.
- Use a varredura bidirecional com 400 Hz. Ajuste o tamanho do pinhole a 1 unidade airy.
- Definir o ganho do detector mais sensível para 100%.
- Para a gravação de voltas de tempo, iniciar a aquisição de imagem com um quadro a cada 15 s para permitir uma resolução temporal razoável, sem produzir corante branqueamento ou estresse fotográfico.
- Para a gravação 3D, ajuste o limite espacial superior e mais baixo ao limite das seções óticas da hifa e do espaço 1 μm distante para permitir a definição espacial razoável.
NOTA: Devido ao rápido crescimento da pasta, alta resolução espacial no eixo Z tem sido muitas vezes sacrificada por alta resolução temporal no eixo X/Y ou o contrário. Somente os microscópios confocal muito modernos da exploração do laser são rápidos bastante satisfazer ambas as demandas.
- Ensaios de captação de endocitose
- Consulte a Figura 1 e a Tabela 1 para identificar as melhores configurações de excitação/emissão para FM 1-43 e/ou FM 4-64 disponíveis no sistema de microscopia e ajustar em conformidade.
NOTA: Com a concentração recomendada de 2 μM, a incorporação de tinência DE FM na membrana plasmática é instantânea em células saudáveis normais. Todo o processo de coloração inicial da membrana plasmática até a aparência de corante em vacuoles tubulares geralmente é concluído dentro de 30-45 min à temperatura ambiente. Aumentar a concentração da tintendência de FM aumenta a relação S/N e, portanto, produz imagens de maior contraste mais rapidamente. No entanto, também acelera o processo de rotulagem, tornando mais difícil diferenciar a sucessão cronológica da coloração de organelas. - Comece a gravação de imagem usando as configurações de aquisição básicas de imagem acima recomendadas e avalie os resultados.
- Otimizar as configurações de aquisição de imagem para a resolução espacial e temporal necessária para capturar o aspecto da membrana plasmática ou da dinâmica da endocitose em que o experimento está focado.
- Por exemplo, a fim de capturar dinâmicas muito rápidas em X/Y, diminuir o tamanho geral da imagem, imagem apenas um plano focal e aumentar a taxa de digitalização para 1 fps. Para maior resolução no eixo Z, diminua a resolução em X/Y, diminua o tamanho da imagem e diminua a distância entre seções ópticas para 0,5 μm.
- Consulte a Figura 1 e a Tabela 1 para identificar as melhores configurações de excitação/emissão para FM 1-43 e/ou FM 4-64 disponíveis no sistema de microscopia e ajustar em conformidade.
- Dinâmica da parede celular
- Consulte a Figura 4 e a Tabela 1 para identificar as melhores configurações de excitação/emissão para o tintura de parede de celular aplicada disponível no sistema de microscopia e ajustar em conformidade.
NOTA: Devido aos seus espectros de emissão ampla, CFW e FpS não são bem adequados para co-imagem simultânea com outros fluorofosforos, predominantemente GFP. Algumas restrições até se aplicam a abordagens sequenciais de imagem com esses corantes e, portanto, precisam ser otimizadas individualmente. - Comece a gravação de imagem usando as configurações de aquisição básicas de imagem acima recomendadas e avalie os resultados.
NOTA: Com a concentração recomendada de 2 μM, a incorporação de tinência na parede celular não é necessariamente instantânea, mas razoavelmente rápida. Todo o processo de formação de septo, por exemplo, leva em média cerca de 5-7 min à temperatura ambiente20. Aumentar a concentração da tintendência da parede celular aumenta a relação S/N e, portanto, produz imagens de maior contraste mais rapidamente. No entanto, ele também introduz rapidamente artefatos devido ao reparo induzido de danos na parede celular. - Otimizar as configurações de aquisição de imagem para a resolução espacial e temporal necessária para capturar o aspecto da morgênese da parede celular em que o experimento está focado, conforme descrito na seção 4.2.3.
- Consulte a Figura 4 e a Tabela 1 para identificar as melhores configurações de excitação/emissão para o tintura de parede de celular aplicada disponível no sistema de microscopia e ajustar em conformidade.
Resultados
Análise quantitativa de imagens
Além de "apenas" visualizar processos celulares, imagens de células vivas permitem extrair informações quantitativas dos dados gravados. Geralmente, a análise quantitativa de imagens é um tema complexo cuja discussão adequada está muito além do escopo deste artigo, portanto, o leitor é encaminhado para livros didáticos dedicados e artigos39,40,41. No entanto, algumas diretrizes básicas associadas aos seguintes dados de exemplo são fornecidas. Vários pré-requisitos cruciais devem ser cumpridos para permitir a quantificação de imagem, incluindo: (1) molaridades definidas de corantes fluorescentes devem ser aplicadas a todas as amostras para permitir uma comparação relativa precisa; (2) as configurações de aquisição de imagem devem ser ajustadas de uma forma que os detectores de luz de emissão nunca estejam saturados, caso contrário, as intensidades máximas são cortadas; (3) as configurações de aquisição de imagem devem permanecer fixas durante um conjunto experimental coerente, caso contrário, mudanças de intensidade artificial são introduzidas; (4) os dados de imagem devem ser salvos em um formato de arquivo sem perdas de informações, juntamente com as informações meta contendo todas as configurações do instrumento; e (5) a análise de imagem deve ser limitada ao número mínimo de etapas pós-processamento necessárias para extrair as informações quantitativas desejadas.
Normalmente, padrões definidos que permitiriam quantificação absoluta de sinais gravados não estão disponíveis na célula viva. Assim, em sua forma mais simples, a análise quantitativa de imagem depende da comparação relativa de intensidades de pixels dentro da mesma imagem ou entre diferentes imagens registradas com configurações idênticas. O software de controle de microscópio do fabricante normalmente inclui ferramentas básicas para pós-processamento de imagem e análise quantitativa, ou pode ser atualizado com funções adicionais para segmentação de imagem, limite, imagem de proporção, etc. Várias plataformas de processamento de imagem de código aberto, diferentesmente adequadas para vários tipos de dados de imagem, estão disponíveis, incluindo ImageJ (https://imagej.net; https://imagej.nih.gov/ij/), gelada (http://icy.bioimageanalysis.org/), CMEIAS Bioimage Informatics (http://cme.msu.edu/cmeias/) e Wimasis (https://www.wimasis.com/en/).
Os dados de exemplo apresentados foram processados e analisados usando a plataforma ImageJ. Regiões específicas da célula, como o ápice ou septa de ponta de hílgol, são marcadas com ferramentas de seleção de área considerável, e a intensidade de todos os pixels contidos é lida com o software implementado "ferramenta de medição". Os dados de intensidade de controles e amostras experimentais são transferidos para um arquivo de planilha, matematicamente analisados e preparados como gráfico. Mais detalhes podem ser encontrados nas publicações originais citadas.
Exemplo de dados 1: FM 4-64 ensaios de captação
Amostras fúngicas foram cultivadas como colônias (passo 1.2) e montadas pelo método de bloqueio de ágar invertido (passo 3.1). A concentração final de FM 4-64 foi de 1,67 μM. Configurações de imagem: HCX PL APO 63x/1.3 NA glycerol objetivo de imersão em um microscópio de varredura a laser confocal invertido (ver a Tabela de Materiais); FM 4-64 excitação em 488 nm e emissão em 600-700 nm; um quadro a cada minuto para até 150 min. FM 4-64 ensaios de captação identificados defeitos na organização espaço-temporal de endocitose na exclusão gênica e gene overexpressing mutantes da proteína sur7-família específica de fungos 2 (Sfp2) de T. atroviride9 (Figura 5).
Exemplo de dados 2: FM 4-64 co-coloração de proteínas de fusão fluorescente voltadas para compartimentos endóciticos
Amostras fúngicas foram cultivadas como colônias (passo 1.2) e montadas pelo método de bloqueio de ágar invertido (passo 3.1). A concentração final de FM 4-64 foi de 2 μM. Configurações de imagem: CFI Plano Apo VC 60x/1.2 NA XC objetivo de imersão de água em um microscópio de varredura a laser confocal invertido (ver a Tabela de Materiais); GFP excitação em 488 nm e emissão de 500-530 nm, FM 4-64 excitação em 488 nm e emissão de 600-700 nm, e campo brilhante com detector de luz transmitida, tudo simultaneamente; um quadro a cada 15 s por até 15 min. FM4-64 co-coloração foi empregado para relacionar a distribuição subcelular das duas proteínas fluorescentes verdes melhoradas (EGFP) marcadas por proteínas transmembranas Sfp2 e Gpr1 à via endóctica no atroviride t (Figura 6, Filme 3, Filme 4).
Exemplo de dados 3: FM 4-64 co-coloração para a identificação de diferenças morfogenéticas
Amostras fúngicas foram cultivadas como colônias (passo 1.2) e montadas pelo método de bloqueio de ágar invertido (passo 3.1). A concentração final de FM 4-64 foi de 2 μM. Configurações de imagem: Plano Apocromata 63x/1.4 NA objetivo de imersão de óleo em um microscópio de varredura a laser confocal invertido (veja a Tabela de Materiais); GFP excitação em 488 nm e emissão de 505-550 nm, FM 4-62 excitação em 488 nm e emissão em 574-691 nm, e campo brilhante com detector de luz transmitida, tudo simultaneamente; um quadro a cada 8,5 s para até 15 min. FM4-64 co-coloração permitido para relacionar a dinâmica de localização subcelular de fluorescente rotulado BUD-6 polarisome proteína complexa para endosome tráfico de processos dependentes, tais como a formação de septa e polarizado hyphal tip crescimento, e caracterizou as diferenças na organização subcelular e hiphal arquitetura entre o tipo selvagem e cepas mutantes de N crassa (Figura 7, Filme 5).
Exemplo de dados 4: A coloração da parede celular revela diferenças morfogenéticas
Amostras fúngicas foram cultivadas como colônias (passo 1.2) e montadas pelo método de bloqueio de ágar invertido (passo 3.1). Foram utilizadas concentrações finais de 2 μM CFW, 20 μM SPF e 100 μM CR. Configurações de imagem: CFI Plano Apo VC 60x/1.2 NA XC objetivo de imersão de água em um microscópio de varredura a laser confocal invertido (veja a Tabela de Materiais); CFW e SPF excitação em 405 nm e emissão de 430-470 nm, excitação CR em 543 nm e emissão de 580-620 nm. As diferentes propriedades de interação de CFW, FpS e CR com polímeros de parede celular destacam diferenças morfogenéticas entre o mutante Δsfp2 e a cepa selvagem do tipo T. atroviride9. Aumentar o estresse da parede celular infligido por concentrações elevadas de corante ocorre mais rápido e mais pronunciado no mutante em comparação com o tipo selvagem. Além disso, as mesmas imagens permitem quantificar as diferenças morfogenéticas em relação ao diâmetro do híldulo e à distância septal entre ambas as cepas (Figura 8).
Exemplo de dados 5: Monitoramento em tempo real da biossíntese da parede celular
Germlings foram cultivados como cultura líquida (passo 1,4) em 8 bem com câmara micro-slides (passo 3,2). A concentração final de CFW foi de 0,12 μM. Configurações de imagem: CFI Plan Apo VC 60x/1.2 NA XC objetivo de imersão de água em um microscópio de varredura a laser confocal invertido; CFW excitação em 405 nm e emissão em 420-470 nm; um quadro a cada 20 s por até 35 min. A concentração cfw muito baixa impede a saturação da parede celular com moléculas de tintura e permite o monitoramento quantitativo em tempo real da biossíntese da parede celular. Isso revela que a deposição de material novo da parede celular não é uniforme, mas responde muito rapidamente às tensões físicas localizadas resultantes do deslocamento relativo de uma célula sobre o apego celular antes de germe fusão em N. crassa (Figura 9, Filme 6).
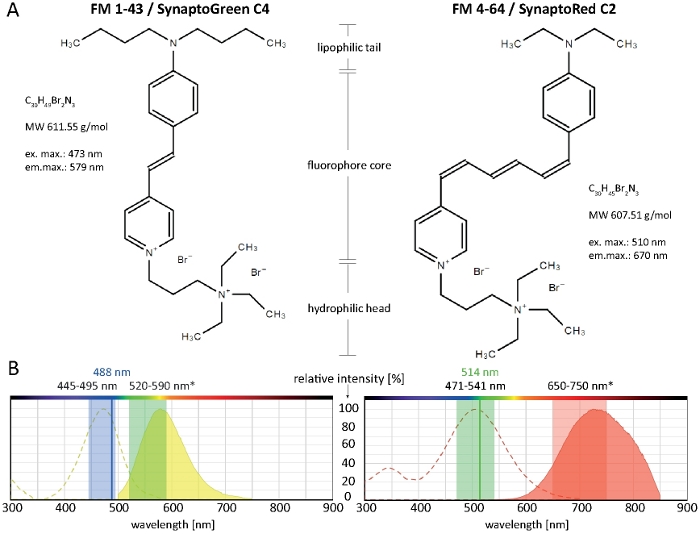
Figura 1: Propriedades bioquímicas e biofísicas de corantes FM. (A) Estruturas químicas de FM 1-43/SynaptoGreen C4 e FM 4-64/SynaptoRed C2. (B) Espectros de absorção e emissão de ambos os corantes FM, sobrepostos com as configurações de imagem ideais para corantes ligados à membrana em fungos filamentous: 445-495 nm luz azul vai excitar FM 1-43 com 100-80% de eficiência, enquanto 488 nm de um laser Argon vai excitar o corante com 91% de eficiência. Devido à mudança azul após a ligação da membrana (*), a faixa de detecção ideal de emissão DE FM 1-43 está entre 520-590 nm. Da mesma forma, as configurações de imagem ideais para FM 4-64 em fungos são 471-541 nm (100-80% de eficiência) ao usar uma fonte de luz de excitação policromática ou 514 nm (99% de eficiência) ao usar um laser Argon e 650-750 nm para detecção de luz de emissão. Clique aqui para ver uma versão maior deste número.
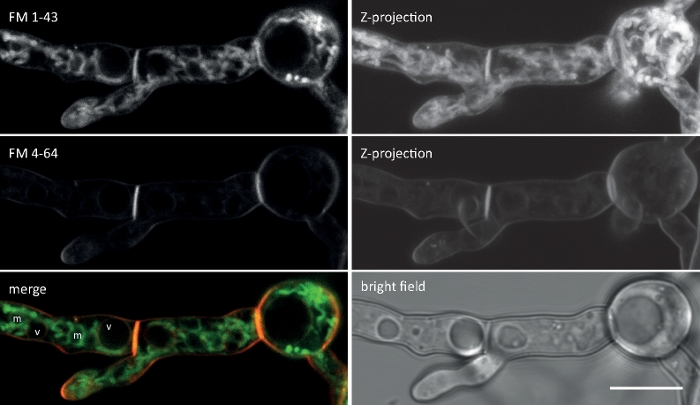
Figura 2: Co-imagem simultânea de FM 1-43 e FM 4-64. Uma mistura equimolar de ambas as corantes foi adicionada a uma cultura germeando líquida de N. crassa que rende uma concentração final de 10 μM. Aos 25 min após a adição de tine, FM 1-43 tem manchado a membrana plasmática e já acumulado em membranas internas, incluindo mitocôndrias fortemente manchadas (m), mas em grande parte excluindo membranas vacuolares (v), e é mais de oito vezes mais forte em comparação com FM 4-64 (intensidades médias de fluorescência 176-21, respectivamente), cuja menor hidrofofia /maior hidrofoficidade retarda sua taxa de internação levando a um tempo prolongado de moradia na membrana de plasma. Barra de escala = 10 μm. Por favor, clique aqui para ver uma versão maior deste número.
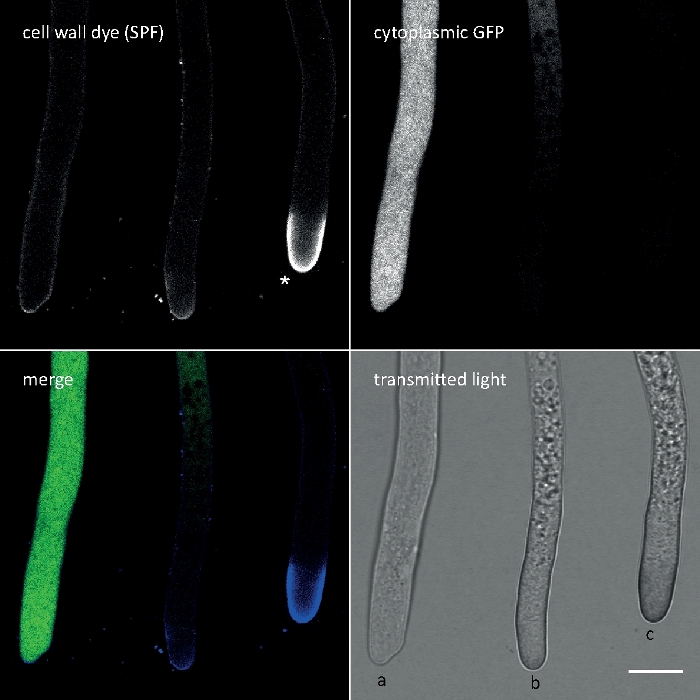
Figura 3: A deposição induzida pelo estresse da parede celular de polímeros da parede celular no ápice da ponta muitas vezes implica a autolise celular. Hída de T. atroviride expressando GFP citoplasmamic foram manchados com 10 μM Solophenyl Flavine 7GFE 500 (SPF) e imaged imediatamente após a montagem. Hícina não estressada (a), hifaça estressada com deposição glucana/chitin ligeiramente aumentada no ápice e autisa em andamento (b), e hifeadura fortemente estressada com cola anticóbica pronunciada de glucano/cáitina (asterisco) e autolíse terminal (c) evidente pela perda total de fluorescência gfp e vacuolização extensiva. Barra de escala = 10 μm. Veja o Filme 1 para a sequência do curso em tempo integral. Note-se que as três hídas foram de fato localizado ao lado do outro. Clique aqui para ver uma versão maior deste número.
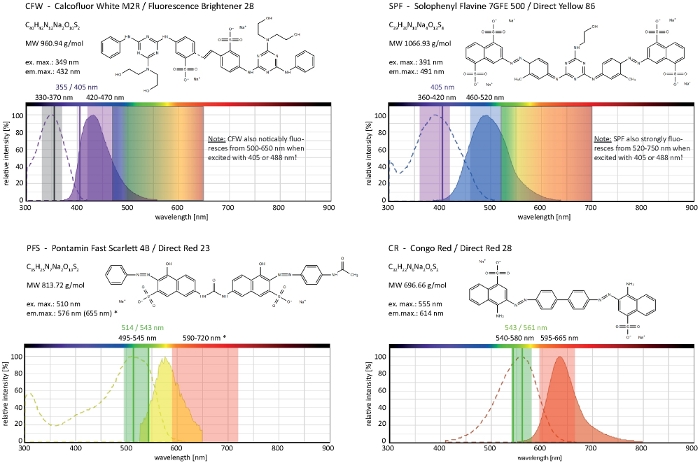
Figura 4: Propriedades bioquímicas e biofísicas de corantes seletivos da parede celular. Características químicas dadas são as dos sais de sódio de cada tinuoso. Os espectros de absorção e emissão correspondem aos em ambientes celulares. Linhas de excitação monocromáticas indicadas por laser (escritas em cores), faixas de excitação policromáticas aplicáveis aos microscópios de epifluorescência e faixas de detecção de luz de emissão são aquelas recomendadas para imagens em fungos filamentosos. Duas linhas de excitação a laser são indicadas quando ambas funcionam igualmente bem. (*) O espectro de emissão de PFS ligado à parede celular é significativamente mais vermelho deslocado do que anteriormente observado33, no entanto, resultando em muito boas rácios S / N com concentrações de tinudura mais baixas do que usado antes. O espectro completo de CR está atualmente indisponível, daí o de Nile Red (CAS No: 7385-67-3) é mostrado como o jogo mais próximo. Informações detalhadas sobre as propriedades espectrais do CR podem ser encontradas em outros lugares42. Clique aqui para ver uma versão maior deste número.
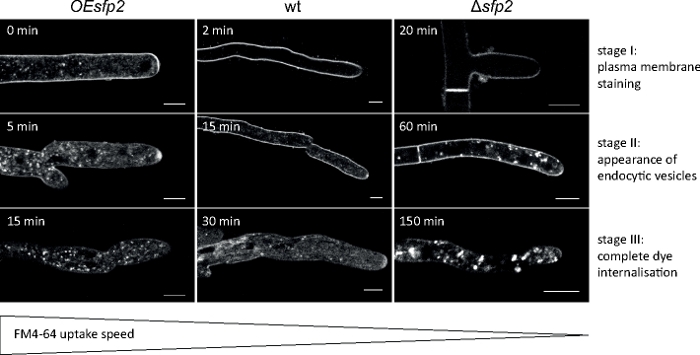
Figura 5: Influência do Sfp2 na captação endócitica de FM4-64. Três estágios chaves sucessivos da captação da tintendência de FM são facilmente discerníveis no tipo selvagem (wt). Estágio I: coloração exclusiva da membrana plasmática, estágio II: primeira aparição de corante FM em vesículas endócticas e estágio III: coloração exclusiva de vesículas e endósticas e endosmembranas. Padrões de coloração equivalentes são mostrados no momento mais cedo de sua aparência. Em comparação com o tipo selvagem do atroviride t., a endocitose é ligeiramente acelerada no mutante superexpressor (OEsfp2),enquanto a absorção de corante é drasticamente adiada no mutante de exclusão sfp2 (Δsfp2). Por exemplo, a captação de corantes na membrana plasmática ocorre instantaneamente no OEsfp2, mas leva 2 min no tipo selvagem; e internalização completa do corante FM da membrana plasmática ocorre 10x mais rápido em OEsfp2 em comparação com Δsfp2. Barras de escala = 5 μm. Figura é reproduzida a partir de Atanasova et al.9 de acordo com a Creative Commons License (https://creativecommons.org/licenses/by/4.0/). Clique aqui para ver uma versão maior deste número.
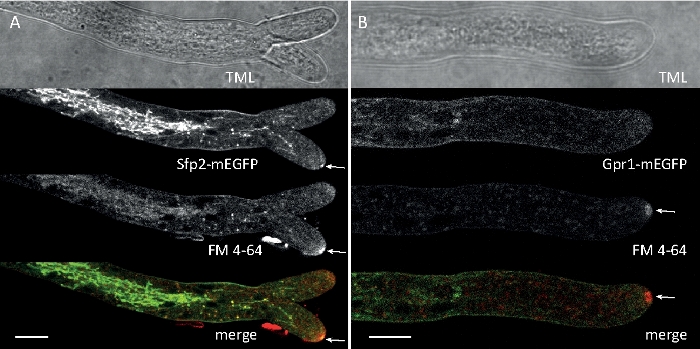
Figura 6: Co-coloração de proteínas de membrana etiquetadas pelo EGFP com FM 4-64 facilita a diferenciação de dinâmica sumida de localização subcelular no atroviride t.. (A) A proteína de domínio de quatro transmembranas Sfp2 co-localiza com organelas rotuladas por FM4-64, incluindo a membrana plasmática e septa, o Spitzenkörper (Spk; seta) e presumivelmente vacuoles tubulares. (B) A proteína Gpr1 de sete transmembranas, semelhante a um GPCR, co-localiza com FM4-64 para as mesmas organelas do Sfp2, exceto as barras Spk. Scale, 10 μm. Veja o Filme 3 e o Filme 4 para sequências de cursos em tempo integral. A figura foi modificada de Atanasova et al.9 de acordo com a Licença Creative Commons. Clique aqui para ver uma versão maior deste número.
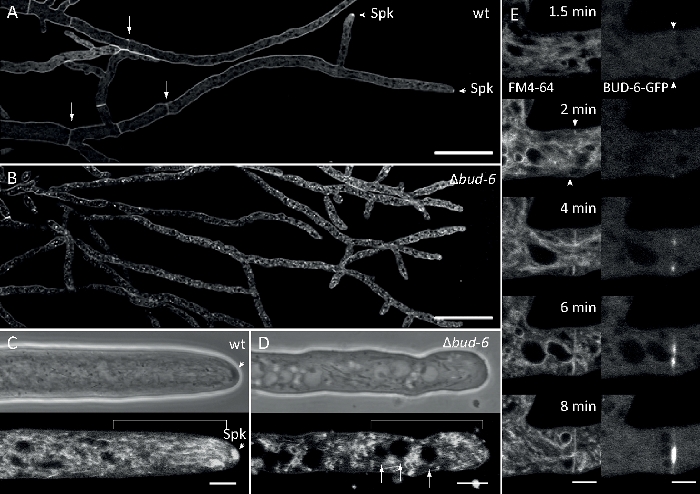
Figura 7: FM 4-64 coloração diferencia Δbud-6 mutante do tipo selvagem, e localiza BUD-6 no anel septal. (A)FM 4-64 manchade hifa do tipo selvagem N. crassa (setas indicam septa; pontas de flecha indicam o Spk). Septae Spk estão ausentes em6. Barras de escala, 50 μm. (C e D)Close-up do ápice e subapex de mhyphal de tipo selvagem (C) e -bud-6 (D). Spk (ponta de flecha) diferencia no tipo selvagem, mas não obotão-6. Os suportes indicam a zona de exclusão nuclear não estabelecida embud-6. Barras de escala = 5 μm. (E)BUD-6-GFP recrutamento para o local de septação incipiente anterior à invaginação da membrana plasmática (pontas de flecha) e constrição septal que acompanha. Barras de escala = 5 μm. Veja o Filme 5a e o Filme 5b para sequências completas do curso de tempo. Figura foi reproduzida com modificações de Lichius et al.16 de acordo com a Creative Commons License. Clique aqui para ver uma versão maior deste número.
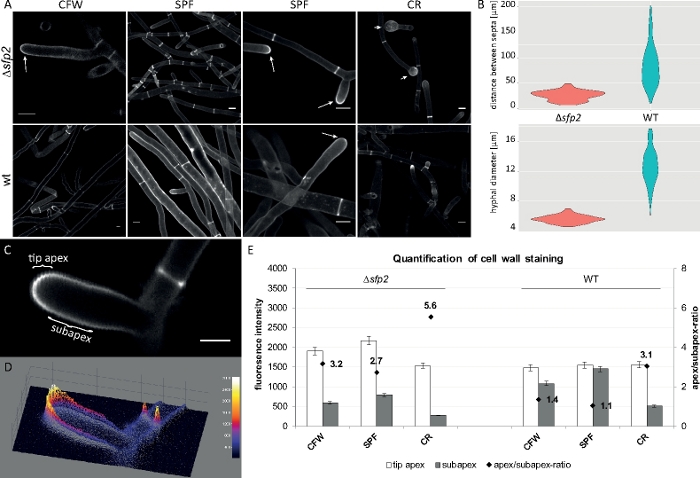
Figura 8: A exclusão do sfp2 altera o padrão de deposição do material da parede celular e afeta a morgênese hipocal do attrviride T. (A)CFW e SPF manchas revela aumento da deposição da parede celular em Δsfp2 (setas) em comparação com o tipo selvagem (wt). A coloração cr induz o inchamento extensivo da ponta somente nosfp2 de Δ (seta). Barras de escala = 10 μm. (B) Os defeitos morfogenéticos no Δsfp2 incluem distâncias septais significativamente reduzidas (Δsfp2 = 26,0 μm, tipo selvagem = 85 μm; n = 60; ANOVA Pr < 2-16) e menores diâmetros de hílnio(sfp2 = 5,6 μm, tipo selvagem = 12,6 μm; n = 100; ANOVA Pr < 2-16). (C)Aumento da fluorescência do corante no ápice da ponta em comparação com o subapex. Barra de escala = 5 μm. (D)Lote de superfície 3D codificado por intensidade (C). (E) Quantificação de intensidades relativas de fluorescência em Δsfp2 e tipo selvagem (n = 55). Figura foi reproduzida a partir de Atanasova et al.9, de acordo com a Licença Creative Commons. Clique aqui para ver uma versão maior deste número.
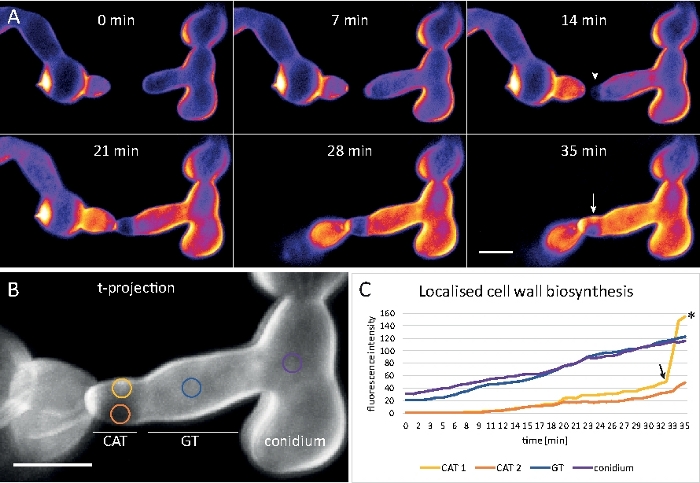
Figura 9: Monitoramento em tempo real da biossíntese da parede celular. (A)Conidial anastomose tubo (CAT) fusão entre germes de N. crassa. O contato físico torna-se aparente pela resposta de torque germe (21-28 min). A fluorescência cfw codificada por cores de intensidade indica regiões com pouco (azul escuro) e deposição intensa da parede celular (amarela). A ponta de homing inicialmente unstained (arrowhead), deposita o material novo da parede de pilha em cima do contato da ponta e na área que experimenta o esforço físico o mais grande (seta). Barra de escala = 5 μm. Veja o Filme 6 para a sequência do curso em tempo integral. Figura reproduzida a partir de38 com permissão. (B) Projeção de (A) indicando quatro regiões circulares em que as intensidades de fluorescência foram medidas. Barra de escala = 5 μm. (C)Parcela das regiões indicadas mostrando o rápido aumento da biossíntese localizada da parede celular em resposta ao estresse físico (CAT 1, seta). No tubo germinal (GT) e no corpo esporo (conídio), a biossíntese da parede celular aumenta de forma constante. Clique aqui para ver uma versão maior deste número.
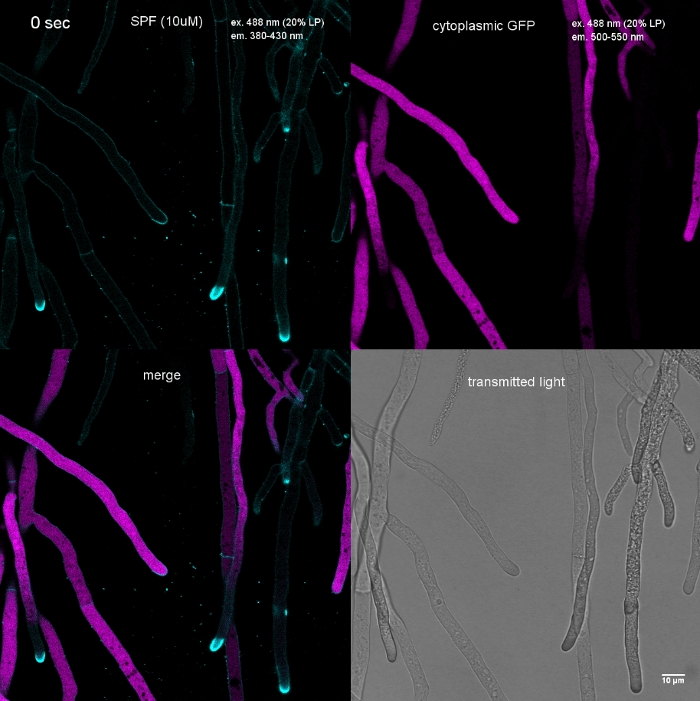
Filme 1: Estresse induzido por tinência da parede celular. 10 μM SPF (ciano) foram adicionados ao t. atroviride hyphae expressando GFP citoplasmamic (magenta). A mancha extensiva da ponta ocorre imediatamente, seguida pela lyse rápida de compartimentos do hyphal dentro de 2 min; evidente pelo desaparecimento da fluorescência da GFP. Por favor, clique aqui para baixar este filme.
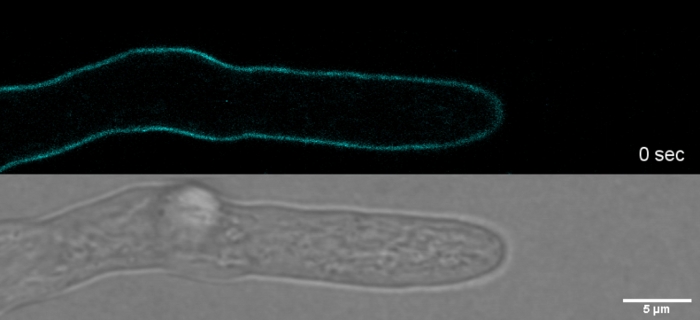
Filme 2: Vital SPF mancha. 2 μM SPF (ciano) permitem acompanhar o crescimento da ponta da pasta de t. atroviride com alta resolução espacial e temporal sem induzir artefatos de estresse da parede celular no ápice da ponta. Por favor, clique aqui para baixar este filme.
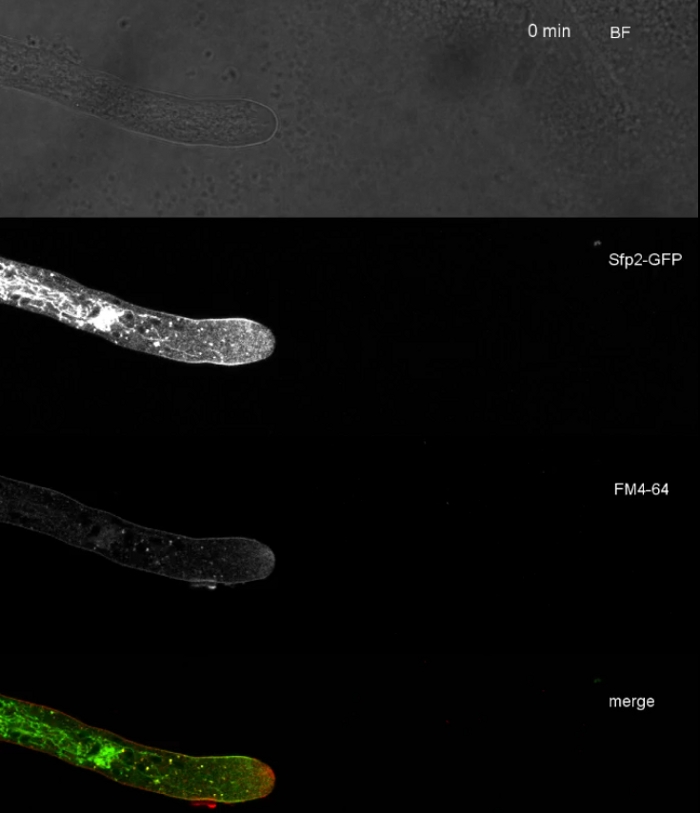
Filme 3: FM 4-64 co-coloração de Sfp2-GFP. A cocoloração do atroviride t. expressando Sfp2-mEGFP (verde) com 1,67 μM FM 4-64 (vermelho) revela a sobreposição e a localização distinta da proteína da membrana com a via endócitica. Por favor, clique aqui para baixar este filme.
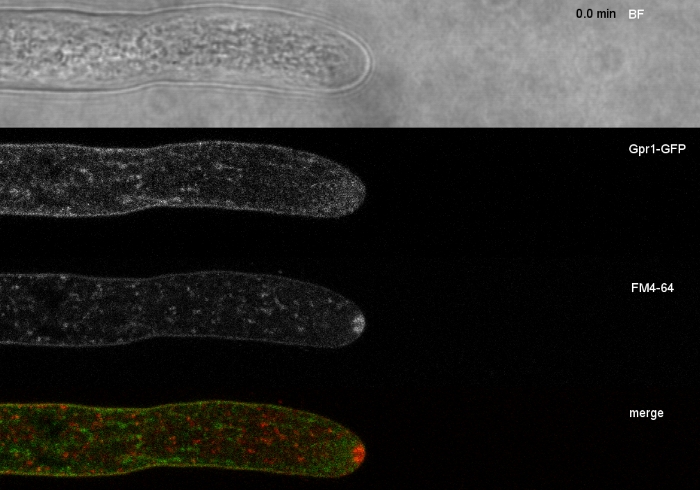
Filme 4: FM 4-64 co-coloração de Gpr1-GFP. A cocoloração do atroviride de T. que expressa Gpr1-mEGFP (verde) com 1.67 μM FM 4-64 (vermelho) revela a localização sobreposta e distinta da proteína da membrana com o caminho endocítico. Por favor, clique aqui para baixar este filme.
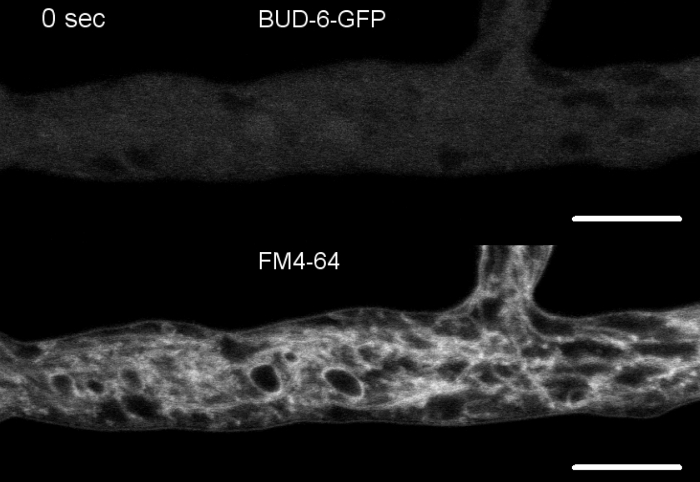
Filme 5: FM 4-64 co-coloração de BUD-6-GFP. (5a) Co-coloração de N. crassa expressando BUD-6-GFP (verde) com 2 μM FM 4-64 (vermelho) permitem o rastreamento da dinâmica BUD-6 durante a formação de septo em relação à invaginação associada à membrana plasmática. (5b) Cortada e mesclar imagem de (5a). Clique aqui para baixar o Filme 5a
Clique aqui para baixar o Filme 5b.
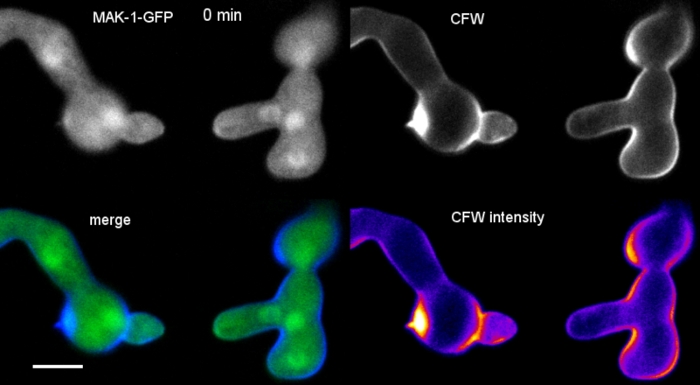
Filme 6: Monitoramento em tempo real da biossíntese da parede celular. Os germes de N. crassa expressando MAK-1-GFP (verde) foram co-manchados com 0.12 μM CFW (azul) para revelar a biogênese localizada da parede celular durante a fusão germeiros mediada pelo CAT. Note-se que há algum sangramento através do sinal CFW nos canais GFP, ilustrando que SPF ou CR são melhores escolhas como corantes sequenciais e simultâneos de co-imagem para GFP, respectivamente. Por favor, clique aqui para baixar este filme.
Tabela 1: Propriedades de membrana e corantes fluorescentes seletivos da parede celular. * = valores mg/mL corrigidos para que o teor reduzido de pureza/corantes resulte em equimolaridade em todas as soluções; n.i.a. = nenhuma informação disponível. Por favor, clique aqui para baixar esta tabela.
Discussão
Este artigo continua o trabalho inovador que estabeleceu o uso de vários corantes fluorescentes como marcadores vitais organela para fungos filamentosos no início dos anos 20002,4,43, e tenta discutir as propriedades fotofísicas e celulares biológicas de corantes FM e corantes de parede celular selecionados em maior detalhe do que antes. Especialmente no que diz respeito aos efeitos celulares indesejados, como a saturação da membrana ou danos na parede celular, que ocorrem acima de certas concentrações de corantes. O que anteriormente tem sido considerado não tóxico no nível celular é agora considerado tóxico no nível molecular. Mesmo que estes efeitos possam ser muito sutis e não diretamente evidentes por mudanças óbvias no comportamento organela ou celular, qualquer possível interferência da aplicação de tinativo que não seja a visualização tem que ser minimizada para a investigação da função molecular nativa. Felizmente, a sensibilidade melhorada e a eficiência quântica dos detectores modernos, como detectores de fotodiodo de avalanche de silício (Si-APDs)44 ou o detector de área airyscan45,facilitam o uso de quantidades de tintura ainda menores do que antes. Outro objetivo fundamental do artigo é exemplificar as propriedades de co-imagem desses corantes com outros fluorofosforos, mais importante, os da GFP como a proteína fluorescente mais utilizada na biologia. Isso deve ajudar o projeto de experimentos de imagem que visam correlacionar a dinâmica de localização subcelular de proteínas de fusão fluorescente com as da parede de células fúngicas, a membrana plasmática ou a via de endôtee e exocitose etc.
A imagem de imagem em condições naturais e livres de estresse é fundamental para a aquisição de dados confiáveis. Algumas considerações práticas em relação ao meio de cultura e preparação de amostras visam fornecer um ponto de partida para encontrar as condições ideais que permitem a observação de células saudáveis e espontícias com a maior relação S/N possível para qualquer amostra. Não há nenhuma maneira universal de alcançar resultados de imagem confiáveis e significativos. É inerente à abordagem que a variação biológica da amostra, subjetividade e expectativas do microscopista, bem como o processamento pós-imagem têm influência significativa na aquisição e interpretação de dados, respectivamente. Assim, a experiência prática do microscopista, seu conhecimento íntimo sobre a biologia celular do fungo investigação, bem como a preparação de amostras hábil para criar condições como natural e imperturbável possível em um ambiente de laboratório, são primordiais para adquirir e avaliar dados de imagem que refletem verdadeiramente os fenômenos celulares estudados. Como regra geral, a ocorrência de efeitos colaterais indesejados de corantes fluorescentes, que vão desde a ativação sutil e, portanto, não obviamente visível da membrana plasmática ou parede celular remodelando as vias de resposta ao estresse até a indução citotóxica direta da autolipise celular, só pode ser seguramente impedida aplicando baixas concentrações de corante ≤2 μM.
A aplicação de corantes fluorescentes é simples, mas suas especificidades são mal caracterizadas. Uma força chave do uso de corantes fluorescentes é a simplicidade preparae dos protocolos experimentais. O cultivo e a amostragem do fungo, a adição do tine (s), e a montagem no estágio do microscópio são (com prática) diretos. O ajuste das configurações básicas de imagem, incluindo excitação e comprimentos de onda de emissão, tempos de exposição, configurações de curso de tempo, etc., siga as regras biofísicas simples do microscópio e as regras biológicas dos corantes fluorescentes usados dentro das células. A tabela 1 pretende apoiar a identificação da combinação de tintura ou tintura mais adequada para experimentação. Além disso, os corantes fluorescentes têm preços razoáveis, prontamente disponíveis com alta qualidade confiável e, assim, garantem a plicação altamente reproduzível.
Duas limitações principais de usar a membrana ou as tinturas fluorescentes seletivas da parede de pilha são (frequentemente) conhecimento limitado de suas propriedades precisas da coloração, que na maioria dos casos são non-specific no organelle e no nível molecular, e seus efeitos secundários não desejados concentração-dependentes. Os corantes de FM são específicos para bilayers lipídicos que participam na endo- e exocitose. No entanto, precisamente quais organelas subcelulares se tornam sucessivamente rotulados as condições testadas não é imediatamente evidente e requer comparação de diferentes variantes de corante FM, e co-rotulagem com marcadores específicos de organela adicionais. A preferência de FM 1-43 para membranas mitocondriais, em comparação com FM 4-64, é um exemplo. As tinturas seletivas da parede de pilha indicam a especificidade de variação para os três polímeros principais da parede fungosa da pilha. CFW é pensado para ser uma mancha não específica para β-glucans e chitina, FpS é pensado para ser mais seletivo para β-1,4-glucans, e CR é pensado para ser altamente seletivo para α- e β-chitins. Atualmente, não estão disponíveis informações sobre a especificidade vinculativa da PFS para polisacarídeos de parede de células fúngicas. Para que razão qual polímero de parede de células fúngicas é mais efetivamente rotulado em uma determinada concentração de tinativo nas espécies fúngicas investigação não é facilmente respondida, e a aplicação de medições detalhadas adquiridas in vitro ou in vivo em outros organismos ou outras espécies fúngicas deve ser considerada com muito cuidado. Infelizmente, esta informação é escassa e altamente dispersa na literatura35,42,46. Registros mais recentes que se seguiriam em estudos anteriores33 para fornecer novos insights sobre as propriedades precisas de coloração dos corantes em destaque especificamente em fungos atualmente não estão disponíveis.
Os controles de imagem são essenciais para avaliar padrões de coloração e respostas celulares com precisão. Provavelmente a parte mais desafiadora, no entanto, é conhecer a biologia celular do fungo tão bem que as mudanças registradas na localização subcelular de corantes fluorescentes seletivos de membrana e parede celular, alterações na arquitetura celular ou no padrão de crescimento do hílogo podem estar relacionadas exclusivamente e com confiança aos efeitos pretendidos do tratamento experimental. Para isso, é crucial ter bons controles ao lado de qualquer novo experimento de imagem de células vivas. Estes incluem o tipo selvagem não tratado como controle de imagem negativo para excluir a autofluorescência de fundo e o ruído do detector da imagem adquirida, e ter um comparador morfológico ao trabalhar com mutantes. Além disso, um controle positivo de imagem, por exemplo, uma cepa que expressa GFP ou RFP no citoplasma ou outra proteína marcador fluorescente bem conhecida, é essencial para definir a intensidade da luz de excitação ao mínimo exigido e ter um controle de vitalidade celular. Uma vez que esses controles são definidos, o uso de corantes fluorescentes não se restringe apenas a tarefas de visualização, mas sua dinâmica de coloração dependente de concentração, bem como efeitos colaterais dependentes da concentração, pode ser explorada analiticamente; por exemplo, para monitorar quantitativamente a biossíntese da parede celular em tempo real ou para a identificação de fenótipos específicos de mutantes na suscetibilidade ensaios47.
Aplicações futuras melhoradas dependem de uma análise funcional detalhada de propriedades de coloração de coloração. Um grande desafio contínuo é melhorar ainda mais e automatizar análises quantitativas de imagem, a fim de avançar a avaliação funcional da dinâmica subcelular da membrana e da parede celular, corantes fluorescentes seletivos, fungos filamentosos. Para isso, extensos estudos de co-localização quantitativa desses corantes com marcadores conhecidos de organela e polímero de parede celular em combinação com cepas mutantes deficientes em vias de transporte particulares ou que carecem de componentes estruturais específicos são necessários. Vários marcadores de endocitose para análises comparativas com corantes FM estão disponíveis48,49,e com relação às especificidades de ligação ainda mal caracterizadas de corantes de parede celular em fungos, a aplicação de anticorpos específicos glucanos fluorescente-rotulados50 pode fornecer uma possibilidade de resolver esta questão.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes e nada a divulgar.
Agradecimentos
Os agradecimentos são devidos ao Fundo de Ciência Tirolês (TWF) para fornecer #256524 de subvenção para AL, para o Fundo de Ciência e Tecnologia de Viena (WWTF) para fornecer subvenção #LS13-086 para SZ, e para o Fundo de Publicação da Universidade de Innsbruck para apoiar a publicação de acesso aberto. Os autores também agradecem ao Departamento de Zoologia da Universidade de Innsbruck por fornecer o microscópio de varredura de laser confocal Leica TCS SP5 II.
Materiais
| Name | Company | Catalog Number | Comments |
| BRAND cell counting chamber | Merck | BR718005 | Thoma format |
| Calcofluor White M2R | Merck/Sigma-Aldrich | F3543 | cell wall dye |
| CFI Plan Apo VC 60x/1.2 NA XC WI | Nikon | MRD07602 | water immersion objective |
| CFI Plan Apo VC 60x/1.2 NA XC WI | Nikon | MRD07602 | water immersion objective |
| Congo Red | Merck/Sigma-Aldrich | C6277 | cell wall dye |
| Dimethyl sulfoxide | VWR | 8,36,73,230 | organic solvent |
| Eclipse TE2000-E with C1 scanning unit | Nikon | custom configuration | inverted laser scanning confocal microscope used to acquire example data 2 and 4 |
| Eclipse TE2000-U with Bio-Rad Radiance 2100 scannig unit | Nikon | custom configuration | inverted laser scanning confocal microscope used to acquire example data 5 |
| FM 1-43 | Merck/Sigma-Aldrich | S6814 | membrane dye |
| FM 4-64 | Merck/Sigma-Aldrich | S6689 | membrane dye |
| Glass beads | Rettberg | 1340691030 | 3 mm glass beads |
| Glass cover slips | Thermo Fisher Scientific | BB02400600A113MNT0 | 24 x 60 # 1 glass cover slips |
| HCX PL APO 63x/1.3 NA Glyc | Leica | 15506353 | glycerol immersion objective |
| LSM 510 Meta | Zeiss | custom configuration | inverted laser scanning confocal microscope used to acquire example data 3 |
| M9 Minimal Medium | Merck/Sigma-Aldrich | M6030 | generic fungal growth medium |
| Micro-slide 8-well | ibidi | 80826 | ibiTreat #1.5 polymer coverslip |
| Miracloth | Merck/Millipore | 475855-1R | polyester filtration material |
| Petri dish | Sarstedt | 8,21,472 | 92 x 16 mm culture dish w/o cams |
| Phytagel | Merck/Sigma-Aldrich | P8169 | transparent gelling agent |
| Plan Apochromat 63x/1.4 NA Oil DIC | Zeiss | 440762-9904-000 | oil immersion objective |
| Pontamine Fast Scarlet 4B | Merck/Sigma-Aldrich | 212490 | cell wall dye |
| Potato Dextrose Agar (PDA) | BD Difco | 213400 | fungal growth medium for T. atroviride |
| Potato Dextrose Broth (PDB) | BD Difco | 254920 | fungal growth medium for T. atroviride |
| Reaction tube | Sarstedt | 72,706 | 1.5 mL SafeSeal tube |
| Scalpel | B.Braun | 5518016 | Cutfix sterile scalpel #23 |
| Screw cap tube | Sarstedt | 6,25,54,502 | 15 mL polypropylene tube |
| Solophenyl Flavine 7GFE 500 | CIBA | 1485385V6 | cell wall dye |
| SynaptoGreen C4 | Biotum | 70020 | membrane dye |
| SynaptoRed C2 | Biotum | 70021 | membrane dye |
| Syringe membrane filter | Thermo Fisher Scientific | 723-9945 | 0.45 µm SFCA syringe filter |
| TCS SP5 II | Leica | custom configuration | inverted laser scanning confocal microscope used to acquire example data 1 |
| Vogel's Minimal Medium (VMM) | FGSC | Fungal Genetics Stock Centre | fungal growth medium for N. crassa |
Referências
- Read, N. D., Fischer, S., Parton, R. M. Imaging Spitzenkörper, pH and calcium dynamics in growing fungal hyphae. Pesticide Science. 54 (2), 179-181 (1998).
- Hickey, P. C., Swift, S. R., Roca, M. G., Read, N. D. Live-cell imaging of filamentous fungi using vital fluorescent dyes and confocal microscopy. Microbial Imaging. , 63-87 (2004).
- Jelínková, A., et al. Probing plant membranes with FM dyes: tracking, dragging or blocking. The Plant Journal. 61 (5), 883-892 (2010).
- Fischer-Parton, S., et al. Confocal microscopy of FM4-64 as a tool for analysing endocytosis and vesicle trafficking in living fungal hyphae. Journal of Microscopy. 198 (3), 246-259 (2000).
- Harris, S. D. Branching of fungal hyphae: regulation, mechanisms and comparison with other branching systems. Mycologia. 100 (6), 823-832 (2008).
- Roca, M. G., Arlt, J., Jeffree, C. E., Read, N. D. Cell biology of conidial anastomosis tubes in Neurospora crassa. Eukaryotic Cell. 4 (5), 911-919 (2005).
- Becker, Y., et al. The fungal cell-wall integrity MAPK cascade is crucial for hyphal network formation and maintenance of restrictive growth of Epichloë festucae in symbiosis with Lolium perenne. Molecular Plant-Microbe Interactions. 28 (1), 69-85 (2015).
- Justa-Schuch, D., Heilig, Y., Richthammer, C., Seiler, S. Septum formation is regulated by the RHO4-specific exchange factors BUD3 and RGF3 and by the landmark protein BUD4 in Neurospora crassa. Molecular Microbiology. 76 (1), 220-235 (2010).
- Atanasova, L., et al. The Gpr1-regulated Sur7 family protein Sfp2 is required for hyphal growth and cell wall stability in the mycoparasite Trichoderma atroviride. Scientific Reports. 8 (1), 12064 (2018).
- Betz, W. J., Mao, F., Bewick, G. S. Activity-dependent fluorescent staining and destaining of living vertebrate motor nerve terminals. Journal of Neuroscience. 12 (2), 363-375 (1992).
- Wu, Y., Yeh, F. L., Mao, F., Chapman, E. R. Biophysical characterization of styryl dye-membrane interactions. Biophysical Journal. 97 (1), 101-109 (2009).
- Betz, W. J., Mao, F., B, S. C. Imaging exocytosis and endocytosis. Current Opinion in Neurobiology. 6, 365-371 (1996).
- Hoopmann, P., Rizzoli, S. O., Betz, W. J. Imaging synaptic vesicle recycling by staining and destaining vesicles with FM dyes. Cold Spring Harbor Protocols. 2012 (1), 77-83 (2012).
- Bolte, S., et al. FM-dyes as experimental probes for dissecting vesicle trafficking in living plant cells. Journal of Microscopy. 214, 159-173 (2004).
- Riquelme, M., et al. Spitzenkorper localization and intracellular traffic of green fluorescent protein-labeled CHS-3 and CHS-6 chitin synthases in living hyphae of Neurospora crassa. Eukayotic Cell. 6 (10), 1853-1864 (2007).
- Lichius, A., Yáñez-Gutiérrez, M. E., Read, N. D., Castro-Longoria, E. Comparative live-cell imaging analyses of SPA-2, BUD-6 and BNI-1 in Neurospora crassa reveal novel features of the filamentous fungal polarisome. PloS one. 7 (1), 30372 (2012).
- Peñalva, M. A. Tracing the endocytic pathway of Aspergillus nidulans with FM4-64. Fungal Genetics and Biology. 42 (12), 963-975 (2005).
- Dijksterhuis, J., Molenaar, D. Vesicle trafficking via the Spitzenkörper during hyphal tip growth in Rhizoctonia solani. Antonie van Leeuwenhoek. 103 (4), 921-931 (2013).
- Hickey, P. C., Read, N. D. Imaging living cells of Aspergillus in vitro. Medical Mycology. 47, 110-119 (2009).
- Delgado-Álvarez, D. L., Bartnicki-García, S., Seiler, S., Mouriño-Pérez, R. R. Septum development in Neurospora crassa: the septal actomyosin tangle. PLoS One. 9 (5), 96744 (2014).
- Hageage, G. J., Harrington, B. J. Use of Calcofluor White in clinical mycology. Laboratory Medicine. 15 (2), 109-112 (1984).
- Monheit, J. E., Cowan, D. F., Moore, D. G. Rapid detection of fungi in tissues using Calcofluor White and fluorescence microscopy. Archives of Pathology and Laboratory. 108 (8), 616-618 (1984).
- Herth, W., Schnepf, E. The fluorochrome Calcofluor White binds oriented to structural polysaccharide fibrils. Protoplasma. 105 (1-2), 129-133 (1980).
- Elorza, M. V., Rico, H., Sentandreu, R. Calcofluor White alters the assembly of chitin fibrils in Saccharomyces cerevisiae and Candida albicans cells. Journal of General Microbiology. 129 (5), 1577-1582 (1983).
- Lagorce, A., et al. Genome-wide analysis of the response to cell wall mutations in the yeast Saccharomyces cerevisiae. Journal of Biological Chemistry. 278 (22), 20345-20357 (2003).
- Sanz, A. B., García, R., Rodríguez-Peña, J. M., Arroyo, J. The CWI Pathway: regulation of the transcriptional adaptive response to cell wall stress in yeast. Journal of Fungi. 4 (1), (2017).
- Slifkin, M., Cumbie, R. Congo Red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Michels, J., Büntzow, M. Assessment of Congo Red as a fluorescence marker for the exoskeleton of small crustaceans and the cuticle of polychaetes. Journal of Microscopy. 238 (2), 95-101 (2010).
- Pancaldi, S., Poli, F., Dall'Olio, G., Vannini, G. L. Morphological anomalies induced by Congo Red in Aspergillus niger. Archives of Microbiology. 137 (3), 185-187 (1984).
- Roncero, C., Durán, A. Effect of Calcofluor White and Congo Red on fungal cell wall morphogenesis: in vivo activation of chitin polymerization. Journal of Bacteriology. 163 (3), 1180-1185 (1985).
- Kopeck, M., Gabriel, M. The influence of Congo Red on the cell wall and (1,3)- β-d-glucan microfibril biogenesis in Saccharomyces cerevisiae. Archives of Microbiology. 158 (2), 115-126 (1992).
- Heilmann, C. J., et al. Surface stress induces a conserved cell wall stress response in the pathogenic fungus Candida albicans. Eukayotic Cell. 12 (2), 254-264 (2013).
- Hoch, H. C., Galvani, C. D., Szarowski, D. H., Turner, J. N. Two new fluorescent dyes applicable for visualization of fungal cell walls. Mycologia. 97 (3), 580-588 (2005).
- Liesche, J., Ziomkiewicz, I., Schulz, A. Super-resolution imaging with Pontamine Fast Scarlet 4BS enables direct visualization of cellulose orientation and cell connection architecture in onion epidermis cells. BMC Plant Biology. 13, 226 (2013).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Knight, N. L., Sutherland, M. W. A rapid differential staining technique for Fusarium pseudograminearum in cereal tissues during crown rot infections. Plant Pathology. 60 (6), 1140-1143 (2011).
- Fajardo-Somera, R. A., et al. Dissecting the function of the different chitin synthases in vegetative growth and sexual development in Neurospora crassa. Fungal Genetics and Biology. 75, 30-45 (2015).
- Lichius, A. . Cell Fusion in Neurospora crassa. , (2010).
- Chen, W., Li, W., Dong, X., Pei, J. A Review of Biological Image Analysis. Current Bioinformatisc. 13 (4), 337-343 (2018).
- Goldman, R. D., Swedlow, J., Spector, D. L. . Live cell imaging: A laboratory manual. , (2010).
- Eliceiri, K. W., et al. Biological imaging software tools. Nature methods. 9 (7), 697-710 (2012).
- Zemanek, G., Jagusiak, A., Chłopaś, K., Piekarska, B., Stopa, B. Congo Red fluorescence upon binding to macromolecules - a possible explanation for the enhanced intensity. Bio-Algorithms and Med-Systems. 13 (2), 1187 (2017).
- Hickey, P. C., Jacobson, D. J., Read, N. D., Louise Glass, N. Live-cell imaging of vegetative hyphal fusion in Neurospora crassa. Fungal Genetics and Biology. 37 (1), 109-119 (2002).
- . Hamamatsu Si APD - high sensitivity photodiodes having an internal gain mechanism: Avalanche photodiode selection guide 2019 Available from: https://www.hamamatsu.com/resources/pdf/ssd/si_apd_kapd0001e.pdf (2019)
- Huff, J. The Airyscan detector from ZEISS: confocal imaging with improved signal-to-noise ratio and super-resolution. Nature Methods. 12, 1205 (2015).
- Thomas, J., Idris, N. A., Collings, D. A. Pontamine Fast Scarlet 4B bifluorescence and measurements of cellulose microfibril angles. Journal of Microscopy. 268 (1), 13-27 (2017).
- Ram, A. F. J., Klis, F. M. Identification of fungal cell wall mutants using susceptibility assays based on Calcofluor White and Congo Red. Nature Protocols. 1 (5), 2253-2256 (2006).
- Toshima, J. Y., et al. Spatial dynamics of receptor-mediated endocytic trafficking in budding yeast revealed by using fluorescent alpha-factor derivatives. Proceedings of the National Academy of Science of the USA. 103 (15), 5793-5798 (2006).
- Kilaru, S., Schuster, M., Latz, M., Guo, M., Steinberg, G. Fluorescent markers of the endocytic pathway in Zymoseptoria tritici. Fungal Genetics and Biology. 79, 150-157 (2015).
- Fu, C., Tanaka, A., Free, S. J. Neurospora crassa 1,3-α-glucan synthase, AGS-1, is required for cell wall biosynthesis during macroconidia development. Microbiology. 160, 1618-1627 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados