Method Article
糸状菌の生細胞イメージングのための膜および細胞壁選択的蛍光色素の応用
要約
重要な蛍光色素は、現代の真菌細胞生物学における生細胞イメージング解析に不可欠なツールです。本論文では、糸状菌における血漿膜動態、エンド/エキソサイトーシスおよび細胞壁形態形成を追跡するための確立された、あまり知られていない蛍光色素の適用について詳しく述べる。
要約
真菌細胞におけるオルガネラダイナミクスの生細胞イメージング解析のための膜および細胞壁選択的蛍光色素の応用は20年前に始まり、それ以来、糸状真菌の理解に大きく貢献し続けているライフ スタイル。本論文では、2つの膜染料FM 1-43およびFM 4-64と4つの細胞壁染色カルコフルオールホワイトM2R、ソロフェニルフラビン7GFE 500、ポンタミンファストスカーレット48およびコンゴレッドの利用のための実用的なガイドを提供する。焦点は、アーティファクトのない染色、その共イメージング特性、および定量的評価を確認するための低用量アプリケーションです。提示された方法は、記載された方法で調製することができるすべての糸状真菌試料に適用可能である。基本的な染色アプローチは、異なる栽培条件を必要とする種への適応の出発点として役立ちます。まず、これらの染料を真に重要な蛍光染色剤として使用するためには、その理解が不可欠であるため、生物物理学的および生化学的特性が見直されます。第二に、蛍光生細胞イメージングのための様々な真菌サンプルタイプの調製を詳細に示すステップバイステッププロトコルが提示される。最後に、実験例は、(1)遺伝的変異体におけるエンドサイトーシスの時空間組織の欠陥を同定し、(2)GFP標識標的タンパク質の共有および明確な共局在を比較的特徴付ける:異なるアプローチを示す。内視鏡経路において、(3)遺伝的変異体における形態形成細胞壁欠損を同定し、(4)細胞壁生体形成をリアルタイムで監視する。
概要
20年前、ヒファル形態形成および基礎となる分子細胞生物学を糸状菌で可視化する方法は、膜選択的蛍光フェイマオ色素FM 4-641の応用によって革命を起こした。その後、真菌細胞壁ダイナミクスの重要な蛍光マーカーとしてキチン結合色素カルコフルオホワイトホワイトの利点が実現された2.それ以来、染料とその変種の両方が、真菌中のオルガネラダイナミクスの生細胞イメージング解析に固有の部分となっており、糸状の真菌の生活様式に対する前例のない洞察を提供し続けています。本論文では、糸状菌における血漿膜動態、内皮症およびエキソサイトーシスおよび細胞壁形態形成を追跡するための確立され、あまり知られていない蛍光色素の適用を詳述する。エンドサイトーシス追跡アッセイは、エンドサイトーシスの一般的な研究に関連する様々な細胞生物学的質問に対処することを可能にする3.このために、FM色素添加時の染色されたコンパートメントの局在化、速度および連続は、時間経過顕微鏡法によって記録され、試験された真菌株4との間で定量的に比較される。細胞壁染料は、細胞の外側境界を線引し、偏光ヒファル先端増殖2、ヒファル分岐5、ヒファル融合6、7および中隔形成8を含む形態形成事象の追跡を可能にする。さらに、それらは、細胞壁の生体形成9の間に局所的な細胞壁堆積および欠陥の同定の定量を促進する。蛍光マーカーの生化学的および生物物理的特性に関する詳細な知識は、生体内アプリケーションを成功させるための基本的な前提条件であるため、これらの特性は、この記事で取り上げた6つの染料について最初に要約されています。
膜選択染料
FM(フェイマオ)スチリル染料は、生物学的膜10の脂質二重層の外側リーフレットと可逆的に関連する通過できない小さな両親媒性分子である。それらは水溶液中では実質的に非蛍光であるが、プラズマ膜統合時に強く蛍光となり、優れた信号対雑音(S/N)比を生成する11。これらの特性は、内因性および外皮症12の追跡を含む形質膜および細胞内小器官動を可視化するのに理想的に適している。緑色蛍光FM 1-43および赤色蛍光FM 4-64は、これらの目的のために最も広く使用されている2つの蛍光膜マーカーである。シナプトグリーンC4とシナプトレッドC2は、それぞれFM 1-43とFM 4-64の代わりに交換可能に使用することができる代替サプライヤーからの一般的な分子です。
スチリル染料は、(1)脂質二重層への色素の挿入を容易にする親油性尾部、(2)色素のスペクトル特性を決定する蛍光コア、1~3個の二重結合で連結された2つの芳香族環で構成される、(3)膜を通る色素の完全な挿入および透過を防止する正に帯電した親水性ヘッドの3つの主要な構造領域を含む。
親油性の尾が長いほど、色素の疎水性が高く、膜に結合親和性が高くなりますが、低い方がその水溶性と膜脱染色速度です。その結果、異なるFM染料変異体は、異なる染色ダイナミクスとパターンを生成します。C4尾FM1-43の疎水性が高いほど、血漿膜や内オルガネラの蛍光シグナルは、短いC2尾FM4-64よりも速く、等モル濃度で適用される場合より速い(図2)。
重要なことに、個々の色素分子13あたり1〜6秒の平均保持時間を有する両方のFM色素11の一定および高い関連/解離率は、例えば膜流動性の改変または膜タンパク質の強制的な永久相互作用を通じて、膜機能の局所的な破壊の可能性を減少させる。これはおそらく、これらの分子が重要な染料として使用することができる主な理由です。それにもかかわらず、50μMを超えるFM色素濃度は、真菌および植物細胞2、14に有毒であり、BY-2タバコプロトプラストからの証拠は、20μM FM色素が血漿膜飽和14につながることを示す。したがって、特に優れたイメージングがわずか2〜5μM15、16で達成されたという事実を考えると、この限界を超えないことをお勧めします。
特に、FM色素のスペクトル特性は、特定の膜微小環境によって大きく異なる(レビュー済み14)。一般に、純粋な溶媒溶液中のFM色素の励起および発光スペクトル(通常は製品情報で提供される)は、細胞環境のそれとは大きく異なり、ほとんどの場合、生細胞イメージング設定を選択するために直接相談することはできません。例えば、FM 1-43およびFM 4-64の励起/発光最大値は、メタノール中の溶液と比較して真菌膜に結合すると、それぞれ37/46nmおよび43/64nmによって青色シフトになる(表1)。
血漿膜、エンド/エキソサイトーシスおよびミトコンドリアを含むオルガネラダイナミクスを追跡するためのFM 4-64およびFM 1-43の使用のための画期的な基礎は、以前にフィラメント真菌種の広い範囲のために既に包括的に文書化されています2,4,17,18,19.様々な糸状真菌種で働く両方のFM染料に対する推奨イメージング設定を図1Bに示す。しかし、培養培地、pH、温度など、利用可能な機器または特定の細胞および実験条件の技術的な制限は、いくつかの適応を必要とする場合があります。幸いなことに、FM染料は広いスペクトル範囲にわたって動作し、非常に良好なイメージング結果は、488 nmの514 nmまたはFM 4-64でエキサイティングなFM 1-43によって達成されます。したがって、最適なイメージング設定は、サンプルの種類および目的のアプリケーションごとに個別に決定する必要があります。
FM 4-64の135 nm以上のかなりのストークのシフトは、緑色の光を放出する蛍光色素との優れた同時イメージングを可能にします。これは、血漿膜およびエンドサイト経路9、20に対する緑色蛍光タンパク質(GFP)標識融合タンパク質の細胞内局在ダイナミクスを評価するために頻繁に利用される。
細胞壁選択色素
カルコフルオアホワイトM2R(CFW)は、蛍光ブライトナー28としても販売され、おそらく細菌、真菌、藻類、高等植物および昆虫の細胞壁を染色するために使用される最もよく知られている蛍光色素である。当初、論文、繊維および洗剤業界で光学美白剤として使用され、真菌感染症の臨床診断のためのその利点は、21、22の早い段階で実現された。CFWは、生臭キチン鎖に不可逆的にインターカレートするので、細胞壁の生体形成中に正常なキチンマイクロフィブリルアセンブリを妨害し、それによって細胞壁応力23を生成する。これは、順番にグルカンおよびチチン合成酵素活性化24、25の結果として局所的に高められた細胞壁堆積につながる細胞壁損傷修復機構をトリガする。この現象は、細胞壁ポリマーに安定に結合することによって作動する任意の色素で起こり得る、濃度に依存し、菌糸体の最も多産成長し、したがって最も敏感な部分を表す子宮内先端で最も顕著である(図3)。細胞壁損傷に反応する分子機械の包括的な要約が最近提供された26.
光毒性と組み合わせた過剰摂取染料は、子宮内区画の急速な細胞リシスにつながる可能性があります(ムービー1)。それにもかかわらず、野生型において「重要」である色素濃度に対する感受性の増加は、遺伝子喪失機能変異体9の細胞壁生合成の欠陥を同定するために利用され得る。CFWおよびコンゴレッド(CR)の場合、ダイレクトレッド28としても知られており、真菌および昆虫27、28のためのα-およびβキチン特異的細胞壁染色として採用された別の織物着色剤は、キチンシンターゼを強く誘導する閾値濃度を> 60μM CFWおよび> 70μM CRは、それぞれ、いずれの色素の濃度<15μMも真菌増殖を変化または阻害しなかったのに対し、29、30、31であった。Hickey et al. は、CFW に対してこの閾値濃度を 25 μM2に置いた。したがって、色素濃度 ≤ 5 μMを使用してストレス関連のアーティファクトを除外し、これらの分子を真に「重要な蛍光色素」2、32として使用することを保証することをお勧めします。これは、ソロフェニルフラビン7GFE 500(SPF)およびポンタミン高速スカーレット4B(PFS)にそれぞれ同義語、ダイレクトイエロー86およびダイレクトレッド23の代名詞であり、真菌の適用が10年以上前に初めて報告されている他の2つの有用な細胞壁染料に同様に適用される。しかし、彼らの顕著なスペクトル特性34、35にもかかわらず、両方の染料の使用はそれ以来非常に限られた36、37である。1.5 μM CFW2で前述したように、2 μM SPF は、非常に高い時間分解能を持つネイティブ条件下でセル壁のダイナミクスを解決するのに十分です (Movie 2)。同じ結果は2 μM CRまたはPFSで得ることができる。
これら4つの染料を合わせると、CFW、SPF、PFSおよびCRは、現代の蛍光顕微鏡で利用されるほぼ完全な可視発光スペクトル(400〜700nm)をカバーする細胞壁選択的蛍光マーカーのセットを含む(図4)。細胞壁ポリマーに結合する際の蛍光強度の有意な増加は、4つすべてに固有であり、優れたS/N比を生成します。これにより、染料濃度及び励起光強度を非常に低く保つことができ、細胞壁染色を「低用量」ライブセルイメージング技術2として行うことができる。これらの細胞壁染料は形質膜不透過性であるため、同時に生きている/死んだ汚れとして機能します。特に、その非常に広い発光光スペクトルのために、他の蛍光色素とCFWおよびSPFの共イメージング特性に関するいくつかの制限を慎重に考慮する必要があります。
プロトコル
1. 真菌試料の調製
- 真菌前培養物
- トリコデルマアトロビライドのジャガイモデキストロース寒天(PDA)やニューロスポラクラッサのためのフォーゲルの最小培地(VMM)などの適切な固体寒天培地に所望の株を接種する。変換形ひずみを操作する場合は、適切な選択マーカーを追加します。
- 生物の最適な温度でプレカルチャーをインキュベートします。例えば、T.アトロビライドは25°Cで、N.クラッサは30°C、12時間/12時間は、胞子性菌糸体が発達するまで光/暗いサイクルが発生するが、プレートの端にはまだ達していない。標準サイズのペトリ皿(9.2cm Ø)では、4~6日の平均で野生型のT.アトロビライドを取るのに対し、N.クラッサ野生型は平均3~4日後にこの段階に達します。
- 真菌コロニーの栽培
- 滅菌メスを使用して、前培養のコロニーエッジから非胞性菌糸体を運ぶ小さな3mm x 3mm寒天ブロックを切断します。
- 寒天ブロックを新鮮な固体培地プレートの中心に置き、実験培養物を接種する。
- 調査を行うことを意図した発達段階に応じて実験培養をインキュベートする。例えば、野生型T.アトロビライドは、PDA上で直径約2cmのコロニーを開発するために暗闇の中で25°Cで20〜22時間を必要としますが、野生型N.クラッサは、VMMの暗闇で30°Cで30°Cでインキュベーションの14〜16時間後に約4cmのコロニー直径に達します。
注:暗闇の中でのインキュベーションは、自己蛍光を導入する可能性のある顔料の形成を防ぎます。実験培養から中程度のバックグラウンド蛍光を排除するには、透明固化剤の1.5%w/vに寒天を置き換えます(材料表参照)。
- 固体発芽培養物の栽培
- 5 mL の無菌生理的塩溶液(0.9%w/v NaCl)を使用して、プレカルチャープレートから心胞子を収穫し、得られた胞子懸濁液を15 mLスクリューキャップチューブで回収します。
- 激しい渦によって胞子懸濁液をよく混ぜ、その後、1 mLピペットチップ(事前に組み立てられ、オートクレーブされた両方)に軽く詰め込まれた1cm x 5cmのストリップ(材料の表を参照)の上にフィルター処理し、新鮮な滅菌チューブに入れます。
- 細胞計数室で胞体密度を決定し、生理的塩溶液を用いて1 x 107細胞/mL胞数懸濁液を調製する。
注:胞状懸濁液は4°Cで2週間まで保つことができます。 - 20 mL の固体媒体を備えた標準サイズのペトリ皿(9.2 cm Ø)を準備し、上に15~20個の滅菌ガラスビーズ(3mm Ø)を加えます。
- スポア懸濁液のピペット200μLを中板上に、穏やかな振り振りによってプレート全体に均等に細胞を分配する。ガラスビーズを70%エタノールでビーカーに回収し、再利用します。
- 調査を行うことを意図した発達段階に応じて実験培養をインキュベートする。例えば、T.アトロビライド野生型は、PDAで心円胚芽を発症するために暗闇の中で25°Cで5〜6時間を必要とし、N.クラッサ野生型は、VMM上の暗闇の中で30°Cで3〜4時間のインキュベーション後に心膜胚芽を発症する。
注:実験培養から中程度のバックグラウンド蛍光を排除するために、寒天を透明固化剤の1.5%w/vに置き換え、任意の複雑な培地を定義された最小培地で置き換えます。
- 液体発芽培養物の栽培
- 液体培養培地の190°Lを8ウェルチャンバーマイクロスライドの各ウェルに充填します。
- 1 x 107セル/mLスポア溶液(ステップ1.4.1~1.4.3で作成)の10 μLを加え、数回上下に軽くピペットで混ぜます。結果として得られるセルの総数は、ウェルあたり 1 x 105 になります。
- 調査を行うことを意図した発達段階に応じて実験培養をインキュベートする。例えば、野生型T.アトロビライドは、ジャガイモデキストロースブロス(PDB)で心状胚芽を発症するために暗闇の中で25°Cで5〜6時間を必要としますが、野生のタイプN.クラッサは、液体中の暗闇で30°Cで3〜4時間のインキュベーションの後に心膜胚芽を発症します。
2. 染料加工ソリューションの作成
- 各色素の完全な溶解性を保証するために、ジメチルスルホキシド(DMSO)に2mMストック溶液を調製し、適切な量(表1の正確な重量を参照)を100%DMSOの1 mLに加え、ボルテックスによってよく混合します。
注意: 中隔密閉ボトルから DMSO を取るようにしてください。それは透明な液体でなければなりません。空気に触れると、DMSOは茶色になり(おそらく微量不純物の酸化が原因で)、細胞の増殖や染料染色に悪影響を及ぼす可能性があります。 - フィルターは、新鮮な滅菌1.5 mL反応管に0.2μmシリンジ膜フィルターを介して原液を殺菌します。染料の漂白を最小限に抑えるには、チューブをアルミホイルで包みます。
注:染料のストックソリューションは、解凍/凍結サイクルを避けるために、より小さなボリュームに引用することができ、数ヶ月間4°Cに保つことができます。 - 新鮮な滅菌蒸留水の198 μLに2μLの染料原液を溶解して、20μM水性染料加工液を調製し、新鮮な滅菌1.5mL反応管に入れます。染料の漂白を最小限に抑えるには、チューブをアルミホイルで包みます。
注:染料加工液は、実験当日に新たに調製する必要があります。 - サンプル取り付け中(セクション3を参照)では、染料加工溶液が標準的に1:10希釈され、最終的な染料濃度は2μMおよび0.1%w/v最終DMSO濃度になります。
注:染料加工液と取り付け液との体積比を変更するだけで異なる希釈係数を選択することで、所望の最終染料濃度を容易に適合させることができます。
注意:染料またはDMSO毒性による望ましくない影響を防ぐために、希釈係数は1:4未満に該当せず、5μM色素と0.4%w/v DMSOの最大最終濃度を得る必要があります。より高い色素濃度は、迅速にシステムを飽和させ、信頼性の高い信号定量を防ぎますが、0.5%w/v(≥62.5 mM)以上のDMSOは、細胞の発達を損なう可能性があります38。
3. 顕微鏡検査用サンプル調製
- 真菌コロニーからのサンプルをマウントする(ステップ1.2)または固体発芽培養物(ステップ1.3)を逆寒器ブロック法によって。
- 清潔な24 mm x 60 mm ガラスカバースリップ (#1 = 0.13 ~0.16 mm の厚さ) を準備し、18 μL の液体最小媒体 (VMM または M9) または生理的塩溶液を中央に追加します。
- 20μM色素加工液の2μLを液体の18°Lに加え、気泡の発生を避けながら、数回上下にピペットを組んでよく混ぜます。
注:いくつかのサンプルを扱う場合は、実験全体を通して等しい色素濃度を確保するために、すべてのための液体染料溶液のマスターミックスを準備することをお勧めします。 - きれいなメスで、コロニーまたは固体発芽培養物の周辺から15mm x 15mmサンプルを切り取り、カバースリップの上にミディアムドロップの横に垂直に配置します。
- メスを使用してブロックの上端を支え、指でブロックの背面を所定の位置に保持し、ミセリウムまたは胚芽を液体に運ぶ側をゆっくりと下げます。サンプルは顕微鏡の段階に移す準備ができている。
注意:細胞の機械的ストレスを最小限に抑え、サンプルとカバースリップの間に気泡が閉じ込められるのを防ぐために、これをゆっくりと非常に慎重に行う必要があります。
- ステップ1.4から液体発芽培養物を取り付けます。
注:最も便利なことに、チャンバーマイクロウェルスライド内の液体発芽培養物は、顕微鏡の段階で直接転送し、さらに操作することができます。- 22 μL の染料加工溶液を液体媒体の 200 μL に加え、標準的な最終濃度が 2 μM 色および 0.1% w/v DMSO になります。
注:液体発芽培養物は、蛍光色素(または阻害剤などの他の化学物質)を、記録中にも、実験の任意の時点で添加できるという大きな利点を有する。その場合、細胞を乱さないために液体の滴を非常にゆっくりと投与するために特別な注意が必要です。システムの振動とブラウン運動は、すでにいくつかの細胞の動きを導入する可能性があります。
- 22 μL の染料加工溶液を液体媒体の 200 μL に加え、標準的な最終濃度が 2 μM 色および 0.1% w/v DMSO になります。
4. 生細胞顕微鏡
- 基本的な画像集録設定を調整します。次の画像取得設定は、個々のヒファで染色ダイナミクスをキャプチャすることを可能にし、次のアッセイの両方に適用可能です
- デバイスの全出力電力の20%の5~10%のレーザーパワーを適用します。
- 高い開口 ≥ 1.2 でプラン Apo 60x-63x グリセロールまたは水浸漬目的を使用します。
- 画像サイズを 1024 x 256 ピクセルに設定し、光学ズーム係数 2 ~ 3 を使用して、画像取得領域をハイファエのアウトラインに制限します。
- 400 Hz で双方向スキャンを使用します。
- 最も敏感な検出器のゲインを100%に設定します。
- タイムラップ記録の場合は、15sごとに1フレームで画像取得を開始し、染料の漂白や写真ストレスを生じることなく合理的な時間分解能を可能にします。
- 3D 記録の場合は、空間の上限と下限をハイファーと空間光学セクション 1 μm の間隔の境界に設定して、妥当な空間分解能を可能にします。
注: ヒファエの急速な成長により、Z 軸の高い空間分解能は、X/Y 軸またはその逆の高い時間分解能のために犠牲になっていることがよくあります。非常に近代的な共焦点レーザー走査顕微鏡だけが両方の要求を満たすのに十分な速さである。
- エンドサイトーシス取り込みアッセイ
- 図1および表1を参照して、顕微鏡システムで利用可能なFM 1-43および/またはFM 4-64に最適な励起/放出設定を特定し、それに応じて調整します。
注:推奨される2μM濃度では、FM色素を形質膜に取り込むことは、正常な健康な細胞において瞬時である。最初の血漿膜染色から管状の液胞内の染料の外観までのプロセス全体は、通常、室温で30〜45分以内に完了します。FM色素濃度を上げるとS/N比が高くなり、コントラスト画像が速くなります。しかし、それはまた、標識プロセスをスピードアップし、オルガネラ染色の時系列的な連続を区別することがより困難になります。 - 上記推奨の基本的な画像取得設定を使用して画像記録を開始し、結果を評価します。
- 実験が焦点を当てたプラズマ膜またはエンドサイトーシスダイナミクスの側面を捕捉するために必要な空間的および時間的な解像度に画像集録設定を最適化します。
- たとえば、X/Y で非常に高速なダイナミクスをキャプチャするために、全体的な画像サイズを小さくし、画像は1つの焦点面のみを小さくし、スキャン速度を1 fpsに増やします。Z 軸の解像度を高くするには、X/Y の解像度を下げ、画像サイズを小さくし、光学セクション間の距離を 0.5 μm に減らします。
- 図1および表1を参照して、顕微鏡システムで利用可能なFM 1-43および/またはFM 4-64に最適な励起/放出設定を特定し、それに応じて調整します。
- 細胞壁ダイナミクス
- 図4と表1を参照して、顕微鏡システムで使用可能な適用された細胞壁色素に最適な励起/放出設定を特定し、それに応じて調整します。
注:広い発光スペクトルにより、CFWとSPFは他の蛍光熱管(主にGFP)との同時共イメージングには適していません。一部の制限は、これらの色素によるシーケンシャルイメージングアプローチにも適用されるため、個別に最適化する必要があります。 - 上記推奨の基本的な画像取得設定を使用して画像記録を開始し、結果を評価します。
注:推奨される2μM濃度では、細胞壁への染料の取り込みは必ずしも瞬時ではなく、合理的に速い。例えば、中隔形成の全過程は、室温20で平均約5〜7分かかります。細胞壁染料濃度を上げるとS/N比が高くなり、コントラスト画像が速くなります。しかし、それはまた、細胞壁損傷修復の誘発によるアーティファクトを急速に導入する。 - 実験が焦点を当てた細胞壁形態形成の側面を捉えるために必要な空間的および時間的な解像度に画像取得設定を最適化します(セクション4.2.3で概説されています)。
- 図4と表1を参照して、顕微鏡システムで使用可能な適用された細胞壁色素に最適な励起/放出設定を特定し、それに応じて調整します。
結果
定量画像解析
細胞プロセスを「ただ」可視化することに加えて、ライブセルイメージングは、記録されたデータから定量的な情報を抽出することを可能にします。一般に、定量的画像解析は、この記事の範囲をはるかに超えた複雑なトピックであり、したがって、読者は専用の教科書と記事39、40、41を参照してください。ただし、次のサンプル データに関連するいくつかの基本的なガイドラインが提供されます。(1)蛍光色素の定義されたモルタン量を正確な相対比較を可能にするために、すべてのサンプルに適用する必要があります。(2)画像集録の設定は、発光光検出器が決して飽和しない方法で調整する必要があり、そうでなければ最大強度が遮断されます。(3)画像取得設定は、一貫した実験セットの過程で固定されたままでなければならない、そうでなければ人工強度の変化が導入される。(4) 画像データは、すべての計測器設定を含むメタ情報とともに、情報ロスレスファイル形式で保存する必要があります。(5)画像解析は、所望の定量情報を抽出するために必要な最小限の後処理ステップに制限されるべきである。
通常、記録されたシグナルの絶対定量を可能にする定義された規格は、生きている細胞では利用できません。したがって、最も単純な形式では、定量的画像分析は、同じ画像内または同じ設定で記録された異なる画像間のピクセル強度の相対的な比較に依存します。メーカーの顕微鏡制御ソフトウェアは、通常、画像後処理および定量分析のための基本的なツールが含まれているか、画像セグメンテーション、閾値、比イメージングなどの追加機能を使用してアップグレードすることができます。ImageJ(https://imagej.net;https://imagej.nih.gov/ij/)、氷(http://icy.bioimageanalysis.org/)、CMEIASバイオイメージ情報学(http://cme.msu.edu/cmeias/)、ウィマシス(https://www.wimasis.com/en/)など、さまざまな種類の画像データに適したオープンソース画像処理プラットフォームがいくつか用意されています。
提示されたサンプルデータは、ImageJプラットフォームを使用して処理および分析されました。簡単に言えば、細胞内の特定の領域(ヒフタル先端頂点またはセプタなど)は、大きな領域選択ツールでマークされ、含まれるすべてのピクセルの強度は、ソフトウェアが実装された「測定ツール」で読み出されます。コントロールと実験サンプルからの強度データは、数学的に分析され、グラフとして準備されたスプレッドシートファイルに転送されます。詳細は、引用された元の出版物に記載されている場合があります。
サンプルデータ1:FM 4-64取り込みアッセイ
真菌試料をコロニーとして栽培し(ステップ1.2)、逆寒天ブロック法により取り付けた(ステップ3.1)。FM 4-64の最終濃度は1.67μMのイメージング設定:HCX PL APO 63x/1.3 NAグリセロール浸漬目標(材料表参照)。488 nmでFM 4-64励起、600-700 nmで放出;1フレーム毎に150分までFM 4-64取り込みアッセイは、T.アトロビライド9の真菌特異的Sur7-ファミリータンパク質2(Sfp2)の変異体を過剰発現する遺伝子欠失および遺伝子過剰のエンドサイトーシスの時空間組織における欠陥を同定した(図5)。
例データ2:エンドサイトーティックコンパートメントを対象とした蛍光融合タンパク質のFM 4-64共染色
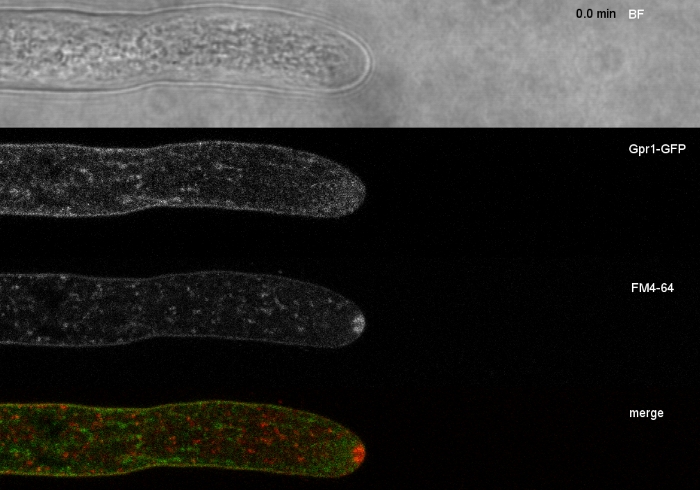
真菌試料をコロニーとして栽培し(ステップ1.2)、逆寒天ブロック法により取り付けた(ステップ3.1)。FM 4-64の最終濃度は2μMのイメージング設定であった:CFIプランApo VC 60x/1.2 NA XC水浸漬目的の反転共焦点レーザー走査顕微鏡(材料表参照)。488 nmでのGFP励起と500~530 nmの発光、488 nmでのFM 4-64励起、600~700 nmの発光、および透過光検出器付きの明視野を同時に使用します。15s毎に1フレーム15分までFM4-64共染色を用いて、2つの強化された緑色蛍光タンパク質(EGFP)タグ付き膜貫通タンパク質Sfp2およびGpr1の細胞内分布をT.アトロビライドのエンドサイト経路に関連付けるために用いた(図6、ムービー3、ムービー4)。
例データ3:形態遺伝学的差異の同定のためのFM 4-64共染色
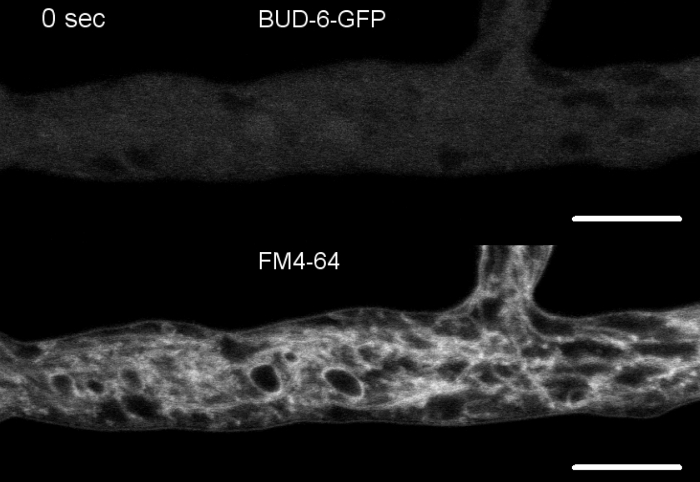
真菌試料をコロニーとして栽培し(ステップ1.2)、逆寒天ブロック法により取り付けた(ステップ3.1)。FM 4-64の最終濃度は2μMのイメージング設定であった:逆共焦点レーザー走査顕微鏡上の計画アポクロマト63x/1.4 NAオイル浸漬目標(材料の表を参照)。488 nmでのGFP励起と505~550 nmの発光、488 nmでのFM 4-62励起、574~691 nmの発光、および透過光検出器付きの明視野を同時に使用します。8.5s毎に1フレーム、最大15分間FM4-64共染色を行い、蛍光標識されたBUD-6ポラリソーム複合タンパク質の細胞内局在ダイナミクスを、中隔および偏光ヒファル先端成長などの内乱の入稿依存過程に関連させ、Nの野生型と変異型の間の細胞下組織とヒュファル建築の違いを特徴とする。
例データ4:細胞壁染色は形態形成の違いを明らかにする
真菌試料をコロニーとして栽培し(ステップ1.2)、逆寒天ブロック法により取り付けた(ステップ3.1)。2μM CFW、20μM SPFおよび100μM CRの最終濃度を使用した。イメージング設定:CFIプランApo VC 60x /1.2 NA XC水浸漬目的は、逆共焦点レーザー走査顕微鏡上で(材料の表を参照)。CFW および SPF は 405 nm で励起し、430 ~ 470 nm で放出し、543 nm で CR 励起、580 ~ 620 nm で放出します。細胞壁ポリマーを用いたCFW、SPFおよびCRの異なる相互作用特性は、Δsfp2変異体とT.アトロビライド9の野生型株との形態学的差異を強調する。高い色素濃度によってもたる細胞壁応力の増加は、野生型と比較して変異体においてより速く、より顕著に起こる。さらに、同じ画像は、両方の株間のヒフス径と中隔距離に関する形態学的差異を定量化することを可能にする(図8)。
サンプルデータ5:細胞壁生合成のリアルタイムモニタリング
胚芽を8ウェルチャンバーマイクロスライドで液体培養(ステップ1.4)として栽培した(ステップ3.2)。最終的なCFW濃度は0.12μMのイメージング設定であった:CFIプランApo VC 60x/1.2 NA XC水浸漬目的は、逆共焦点レーザー走査顕微鏡上で;405 nm での CFW 励起と 420 ~ 470 nm での放出。最大35分間、20sごとに1フレーム。非常に低いCFW濃度は色素分子と細胞壁の飽和を防ぎ、細胞壁の生合成の定量的なリアルタイムの監視を可能にする。これにより、新しい細胞壁材料の堆積は均一ではないが、N.crassaにおける芽細胞融合の前に細胞結合時に1つの細胞の相対的な変位に起因する局所的な物理的応力に非常に迅速に応答することが明らかになる(図9、ムービー6)。
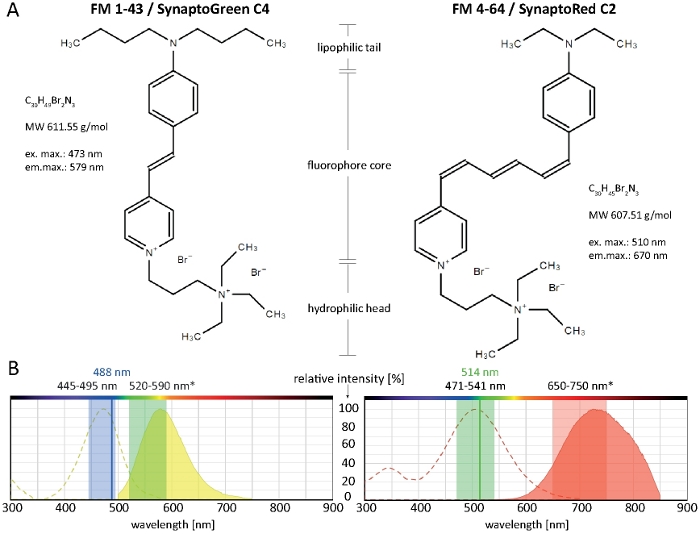
図1:FM染料の生化学的および生物物理的性質(A)FM 1-43/シナプトグリーンC4およびFM 4-64/シナプトレッドC2の化学構造。(B)両方のFM色素の吸収および発光スペクトルは、糸状菌中の膜結合染料の最適なイメージング設定と重なって:445-495 nm青色光は100〜80%の効率でFM 1-43を励起し、アルゴンレーザーの488 nmは91%の効率で色素を励起する。膜結合(*)の青シフトにより、FM 1-43放出の最適な検出範囲は520~590nmです。同様に、真菌中のFM 4-64の最適なイメージング設定は、多色励起光源を使用する場合は471~541nm(100~80%の効率)、アルゴンレーザーを使用する場合は514nm(99%効率)、発光光検出には650~750nmです。この図の大きなバージョンを表示するには、ここをクリックしてください。
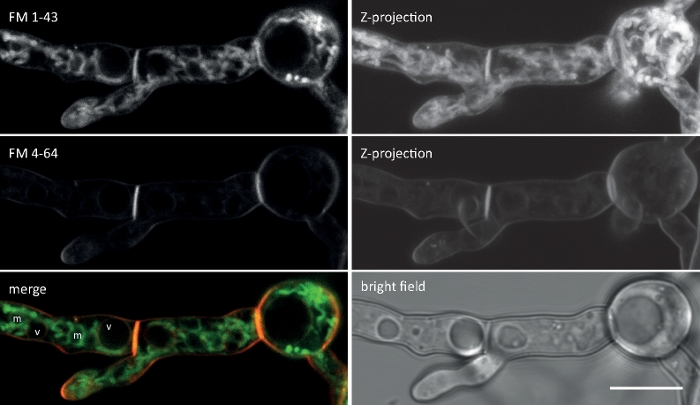
図2:FM 1-43とFM 4-64の同時共イメージング両染料の等モル混合物をN.クラッサの液体発芽培養物に添加し、最終濃度10μMを生み出した。色素添加後25分で、FM 1-43は形質膜を染色し、すでに内膜に蓄積し、 強染色されたミトコンドリア(m)を含むが、主に空胞膜(v)を除き、FM 4-64(平均蛍光強度176〜21)に比べて8倍以上強く、その低い疎水性/高親水性は、血漿膜での長期の住居時間につながるその内在化速度を遅くする。スケール バー = 10 μm.ここをクリックすると、この図の大きなバージョンが表示されます。
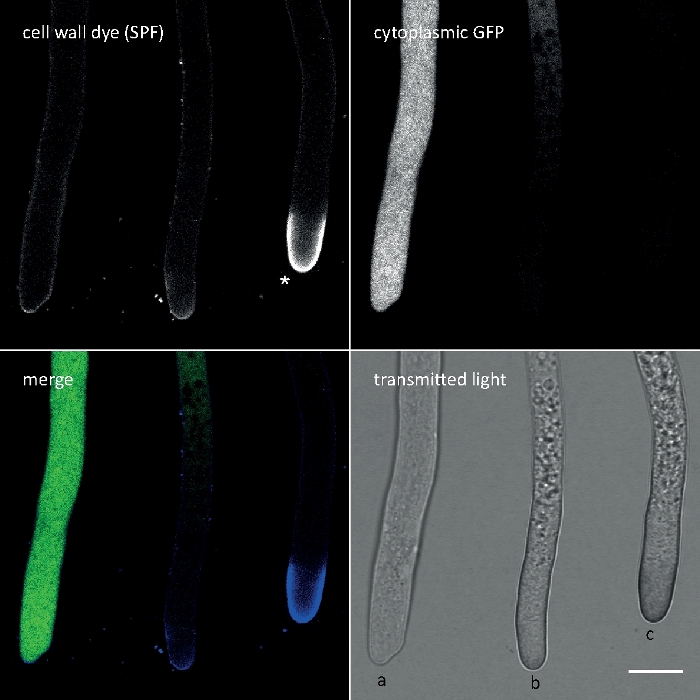
図3:先端頂点における細胞壁ポリマーの細胞壁応力誘発堆積は、しばしば細胞の自己分解を伴う。細胞質GFPを発現するT.アトロビライドのハイファエを10μMソロフェニルフラビン7GFE500(SPF)で染色し、取り付け直し直ちに画像化した。非ストレス性ヒファ(a)、頂点でわずかに増加したグルカン/キチン沈着を有する強調されたヒファエと進行する自己分解(b)、およびGFP蛍光の全損失および広範な空洞化によって明らかな顕著なアピカルグルカン/キチンキャップ(アスタリスク)および末端自己溶解(c)を有する重ストレス性ヒファエ。スケール バー = 10 μm。フルタイムのコースシーケンスについては、ムービー 1を参照してください。3つのヒファは確かに隣り合って配置されていたことに注意してください。この図の大きなバージョンを表示するには、ここをクリックしてください。
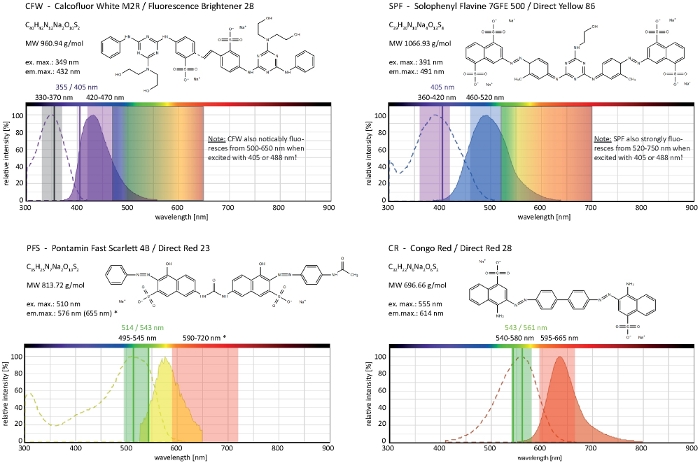
図4:細胞壁選択染料の生化学的および生物物理的特性与えられた化学的特徴は、各色素のナトリウム塩のそれである。吸収および放出スペクトルは細胞環境のそれらに対応する。示された単色レーザー励起ライン(色で書かれている)、エピ蛍光顕微鏡に適用可能な多色励起範囲、および発光光検出範囲は、糸状菌中でのイメージングに推奨されるものである。両方が等しく動作する場合、2つのレーザー励起ラインが示されます。(*)細胞壁結合PFSの発光スペクトルは、前に述べたように33よりも大幅に多く赤色シフトされ、その結果、以前に使用されたよりも低い色素濃度の非常に良好なS/N比をもたらす。CR の完全なスペクトルは現在使用できないため、ナイルレッド(CAS番号:7385-67-3)のスペクトルは最も近い一致として表示されます。CRのスペクトル特性に関する詳細情報は、他の場所で見つけることができます42.この図の大きなバージョンを表示するには、ここをクリックしてください。
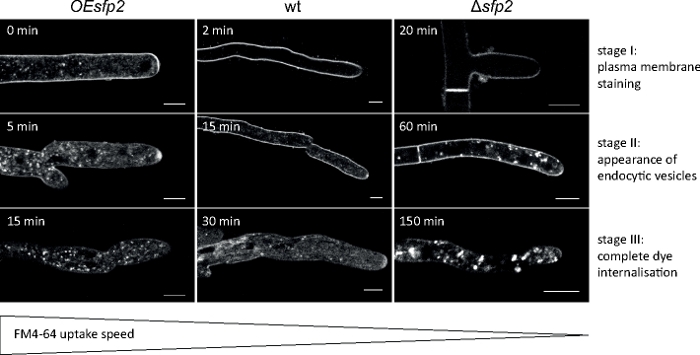
図5:FM4-64のエンドコフィック取り込みに及ぼすSfp2の影響FM色素取り込みの3つの連続した主要な段階は、野生型(wt)で容易に識別可能である。ステージI:排他的血漿膜染色、ステージII:内分泌小胞におけるFM色素の初出現、およびステージIII:エンドサイト小胞および内膜の排他的染色。同等の染色パターンは、その出現の最も早い時点で示される。T.アトロビライド野生型と比較して、エンドサイトーシスはsfp2過剰発現変異体(OEsfp2)でわずかに加速されるのに対し、色素の取り込みはsfp2欠失変異体(Δsfp2)で劇的に遅れる。例えば、形質膜への色素の取り込みはOEsfp2で即座に起こるが、野生のタイプでは2分かかります。プラズマ膜からのFM色素の完全な内在化は、Δsfp2と比較してOEsfp2で10倍速く起こる。スケールバー = 5 μmフィギュアは、クリエイティブ・コモンズ・ライセンス(https://creativecommons.org/licenses/by/4.0/)と合意してアタナソワら9.9から再現。この図の大きなバージョンを表示するには、ここをクリックしてください。
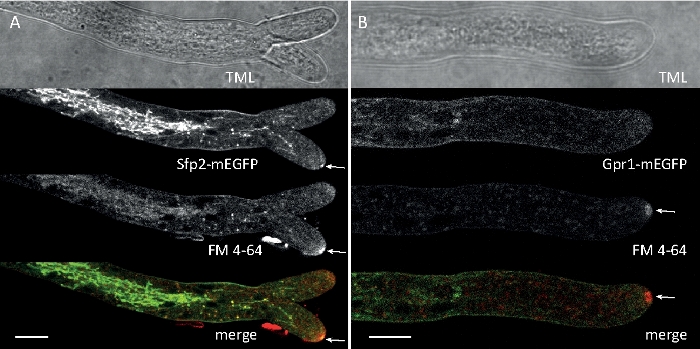
図6:FM 4-64を用いたEGFP標識膜タンパク質の共染色は、T.アトロビライドにおける明確な細胞内局在ダイナミクスの分化を容易にする。(A)4膜貫通ドメインタンパク質Sfp2は、血漿膜およびセプタ、スピッツェンケルパー(Spk;矢印)および推定管状空胞を含むFM4-64標識オルガネラと共に局在する。(B) GPCRのような7膜貫通タンパク質Gpr1は、Spk.スケールバーを除き、FM4-64と同じオルガネラに共在化します。フルタイムのコースシーケンスについては、ムービー 3およびムービー 4を参照してください。この数字は、クリエイティブ・コモンズ・ライセンスに同意してアタナソワら9から変更されました。この図の大きなバージョンを表示するには、ここをクリックしてください。
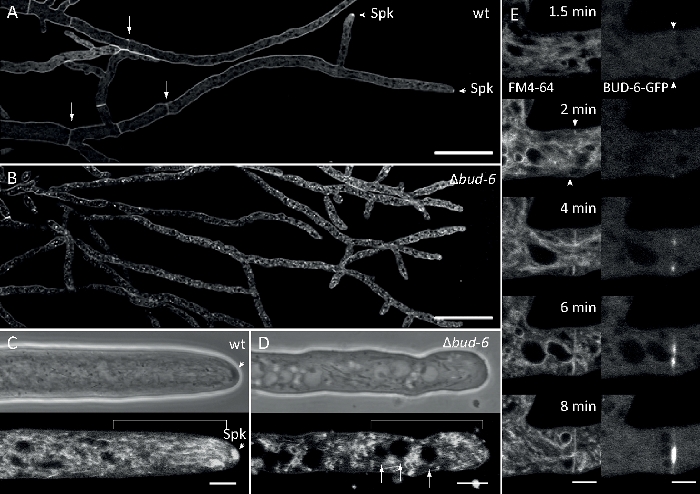
図7:FM 4-64染色は、Δ芽-6変異体を野生型と区別し、中隔環でBUD-6を局在化する。 (A)N.クラッサ野生型のヒファのFM 4-64染色(矢印はセプタを示し、矢印はSPKを示す)。(B) セプタとSPKは、バツ6に存在しない。スケールバー、50μm(CおよびD)野生型のヒファル頂点および亜頂点のクローズアップ(C)および≥bud-6(D)。SPK(矢印)は野生のタイプで区別しますが、芽-6ではありません。括弧は、核排除ゾーンが成立していないことを示します。スケールバー = 5 μm. (E) BUD-6-GFP は、血漿膜の膣内インバシゴに先行する切開性消失部位 (矢印) および付随する中隔収縮に関する募集を行う。スケールバー = 5 μm完全なタイムコースシーケンスについては、ムービー5aとムービー5bを参照してください。フィギュアは、クリエイティブ・コモンズ・ライセンスと合意して、リキウスら16から修正を加えて再現しています。この図の大きなバージョンを表示するには、ここをクリックしてください。
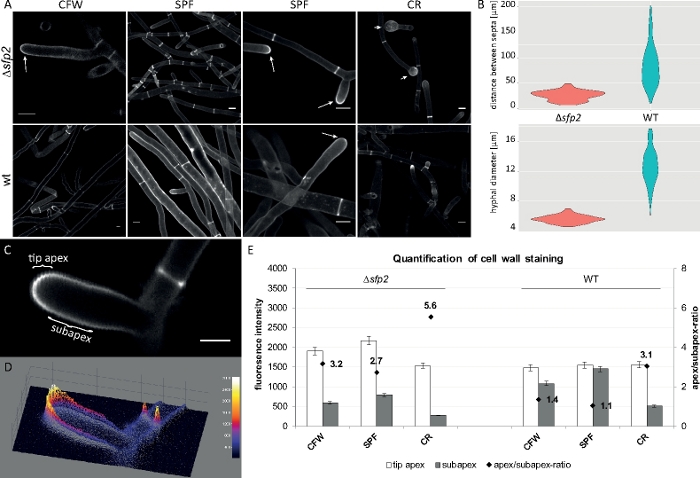
図8:sfp2の欠失は、細胞壁材料の堆積パターンを変化させ、T.アトロビライドのヒファル形態形成に影響を及ぼす。(A)CFWおよびSPF染色は、野生型(wt)と比較してΔsfp2(矢印)における細胞壁堆積の増加を明らかにする。CR染色はΔsfp2(矢印)でのみ広範な先端腫脹を誘発する。スケールバー = 10 μm. (B) Δsfp2の形態学的欠陥には、中隔距離が大幅に減少します (Δsfp2 = 26.0 μm,野生型 = 85 μm; n = 60;ANOVA Pr < 2−16) およびより小さい催眠直径(≥sfp2 = 5.6 μm、野生タイプ = 12.6 μm; n = 100;ANOVA Pr < 2−16)。(C)サブ頂点と比較して先端頂点における色素蛍光の増加。スケールバー = 5 μm(D)(C)の強度コード化3D表面プロット。(E)Δsfp2および野生型における相対蛍光強度の定量(n=55)。フィギュアは、クリエイティブ・コモンズ・ライセンスと合意してアタナソワら9から再現されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
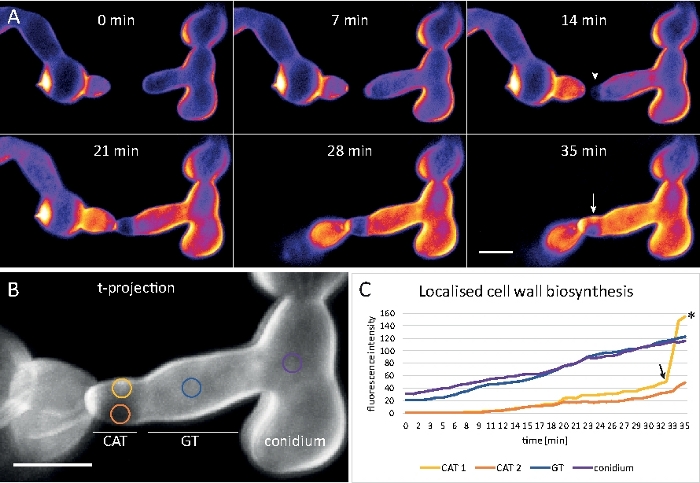
図9:細胞壁生合成のリアルタイムモニタリング(A) N.クラッサの発芽との間の心膜異性筋チューブ(CAT)融合発芽トルク応答(21~28分)により物理的接触が明らかになる。強度色分けされたCFW蛍光は、ほとんど(濃い青色)および強烈な(黄色の)細胞壁堆積を有する領域を示す。最初に染色されていないホーミングチップ(矢印)は、先端接触時および最大の物理的応力を経験する領域(矢印)に新しい細胞壁材料を堆積させる。スケール バー = 5 μmフルタイムのコースシーケンスについては、ムービー6を参照してください。●フィギュアは許可を得て38から再現。(B)蛍光強度を測定した4つの円形領域を示す(A)の突起。スケール バー = 5 μm(C)物理的ストレスに応じた局在細胞壁生合成の急激な増加を示す示された領域のプロット(CAT1,矢印)。生殖管(GT)および胞体体(コニジウム)では、細胞壁生合成が着実に増加する。この図の大きなバージョンを表示するには、ここをクリックしてください。
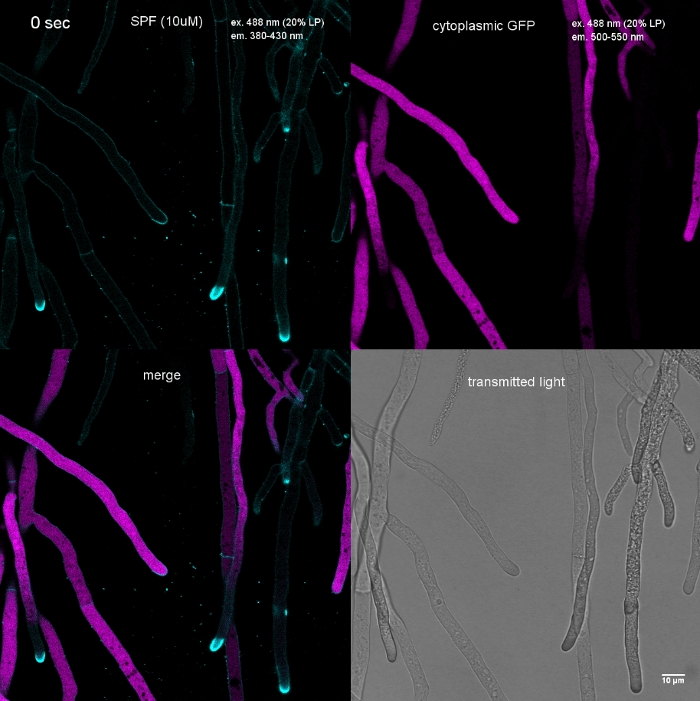
動画1:色素誘発細胞壁応力細胞質GFP(マゼンタ)を発現するT.アトロビライドヒファエに10μM SPF(シアン)を加えた。広範な先端染色はすぐに起こり、その後2分以内に子宮内コンパートメントの急速なリシスが起こる。GFP蛍光の消失によって明らかである。このムービーをダウンロードするには、ここをクリックしてください。
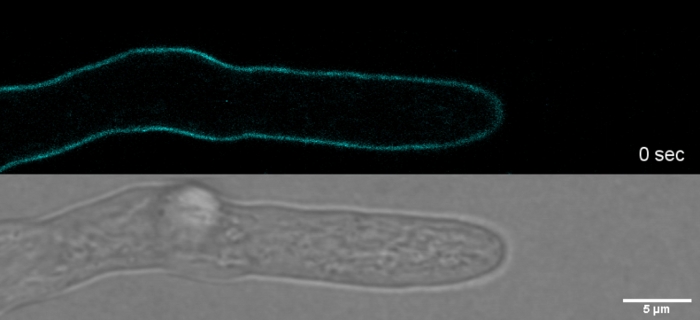
ムービー2:重要なSPF染色。2 μM SPF(シアン)は、先端頂点で細胞壁応力アーティファクトを誘導することなく、高い空間分解能率でT.アトロビライドヒファエの先端成長を追跡することを可能にする。このムービーをダウンロードするには、ここをクリックしてください。
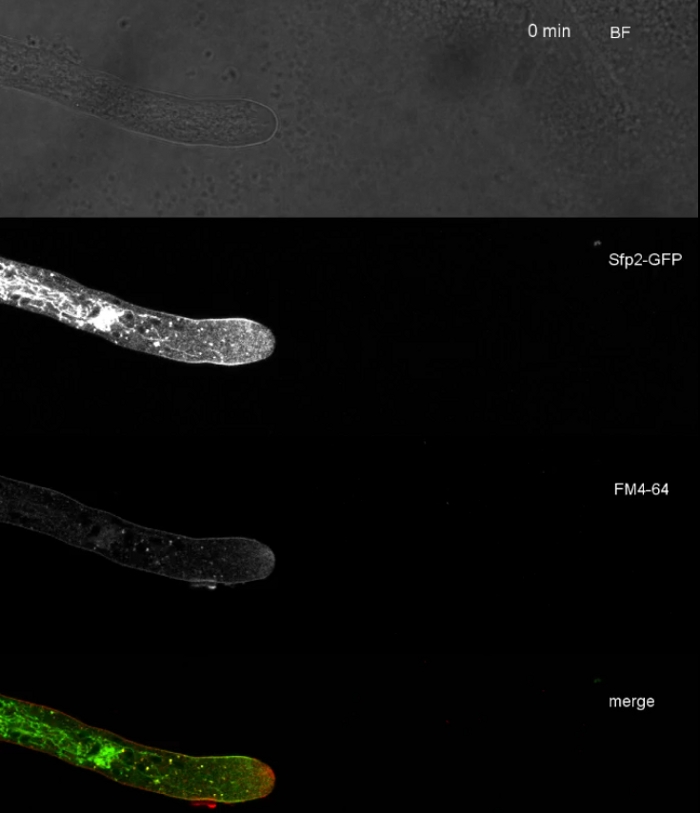
動画3:Sfp2-GFPのFM 4-64共染色。1.67 μM FM 4-64(赤)でSfp2-mEGFP(緑色)を発現するT.アトロビライドの共染色は、エンドサイト経路を有する膜タンパク質の重なりおよび明確な局在を明らかにする。このムービーをダウンロードするには、ここをクリックしてください。
動画4:Gpr1-GFPのFM 4-64共染色。1.67 μM FM 4-64(赤)でGpr1-mEGFP(緑色)を発現するT.アトロビライドの共染色は、エンドサイト経路を有する膜タンパク質の重なりおよび明確な局在を明らかにする。このムービーをダウンロードするには、ここをクリックしてください。
動画5:BUD-6-GFPのFM 4-64共染色。(5a)2 μM FM 4-64(赤)で発芽6-GFP(緑)を発現するN.クラッサの共染色は、関連する血漿膜の膣内に対する中隔形成中のBUD-6ダイナミクスの追跡を可能にする。(5b)(5a) の画像をトリミングしてマージします。映画5aをダウンロードするには、ここをクリックしてください
Movie 5b をダウンロードするには、ここをクリックしてください。
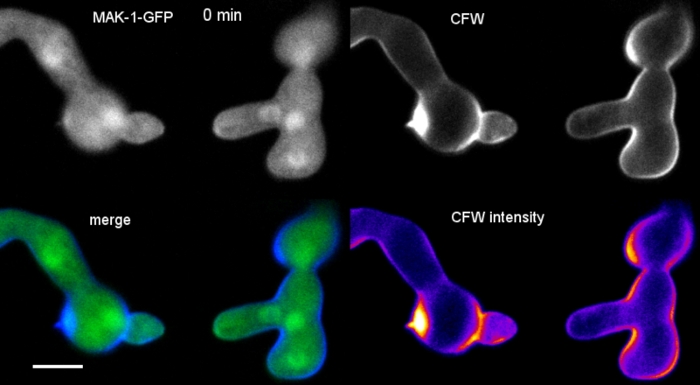
動画6:細胞壁生合成のリアルタイムモニタリングMAK-1-GFP(緑色)を発現するN.クラッサ生殖物を0.12μM CFW(青)と共染色し、CAT媒介性生殖融合中に局所的な細胞壁生体形成を明らかにした。GFP チャネルに CFW 信号を介していくつかのブリードがあることに注意してください。このムービーをダウンロードするには、ここをクリックしてください。
表1:膜および細胞壁の選択的蛍光色素の特性。* = mg/mL 値は、すべての溶液で等大性を得るために、純度/染料含有量の減少のために補正されました。n.i.a. = 情報がありません。このテーブルをダウンロードするには、ここをクリックしてください。
ディスカッション
本稿では、2000年代初頭の糸状菌の重要なオルガネラマーカーとして様々な蛍光色素を確立した画期的な作業を続け、FM染料と選択した細胞壁染料の光物理学的・細胞生物学的性質について、これまでよりも詳細に論じようと試みる。特に、膜飽和や細胞壁損傷などの望ましくない細胞の影響に関しては、特定の色素濃度を超えて発生します。以前に細胞レベルで非毒性と考えられていたものは、現在、分子レベルで毒性とみなされている。これらの効果は非常に微妙であり、オルガネラや細胞の挙動の明らかな変化によって直接明らかではないかもしれませんが、可視化以外の色素アプリケーションの干渉は、ネイティブ分子機能の調査のために最小限に抑える必要があります。幸いなことに、シリコンアバランチフォトダイオード検出器(Si-APD)44またはエアイスキャン領域検出器45などの現代検出器の感度および量子効率の向上は、以前よりもさらに低い色素量の使用を容易にする。この記事のもう一つの重要な目的は、これらの色素の共イメージング特性を他の蛍光色素と例示することであり、最も重要なことは、生物学において最も頻繁に使用される蛍光タンパク質としてGFPのものである。これは、蛍光融合タンパク質の細胞内局在ダイナミクスを真菌細胞壁、形質膜、または内膜およびエキソサイトシス経路などと相関させることを目的としたイメージング実験の設計に役立つはずです。
自然でストレスのない条件下でのイメージングは、信頼性の高いデータを取得するための鍵となります。培養培地およびサンプル調製に関するいくつかの実用的な考慮事項は、任意のサンプルに対して可能な限り高いS/N比を有する健康でストレスのない細胞のアーティファクトフリーで長時間観察を可能にする最適な条件を見つけるための出発点を提供することを目的としています。信頼性が高く、有意義なイメージング結果を得る普遍的な方法はありません。サンプルの生物学的変動、マイクロスコピストの主観性および期待、ならびに画像後処理がそれぞれデータ取得および解釈に大きな影響を与えるアプローチに固有のものです。したがって、顕微鏡の実用的な経験、調査中の真菌の細胞生物学に関する彼女/彼の親密な知識、ならびにラボの設定で可能な限り「自然」と妨げられない状態を作り出すための巧みなサンプル調製は、研究された細胞現象を真実に反映した画像データを取得し、評価するための最も重要です。経験則として、蛍光色素の望ましくない副作用の発生は、血漿膜または細胞壁の微妙かつ明らかに目に見える活性化から、細胞自己解析の簡単な細胞傷害誘導に対するストレス応答経路を再モデル化することから、低色素濃度≤2μMを適用することによってのみ安全に防止することができる。
蛍光色素の塗布は簡単ですが、その特異性は十分に特徴付けが不十分です。蛍光色素を使用する主な強度は、実験プロトコルの調製の簡潔さです。真菌の培養およびサンプリング、色素の添加、および顕微鏡段階への取り付けは(練習と)簡単です。励起および発光波長、露光時間、経時変化の設定など、基本的なイメージング設定の調整は、顕微鏡の単純な生物物理学的ルールと細胞内の使用される蛍光色素の生物学的ルールに従います。表1は、実験に最も適した色素または染料の組み合わせの同定を支持する意図がある。さらに、蛍光色素は手頃な価格で、信頼性の高い高品質で容易に入手でき、非常に再現性の高いアプリケーションを保証します。
膜または細胞壁の選択的蛍光色素を使用する2つの主要な制限は、その正確な染色特性の(多くの場合)限られた知識であり、ほとんどの場合、オルガネラおよび分子レベルに非特異的であり、その濃度依存的な望ましくない副作用である。FM色素は、エンドおよびエキソサイトーシスに関与する脂質二重層に特異的である。しかし、どの細胞下小器官が試験条件下で連続的に標識されるのかは、すぐには明らかではなく、異なるFM色素変異体の比較、および追加のオルガネラ特異的マーカーとの共標識が必要である。ミトコンドリア膜に対するFM1-43の好みは、FM4-64と比較して、一例である。細胞壁選択染料は、真菌細胞壁の3つの主要ポリマーに対して様々な特異性を示す。CFWはβグルカンやキチンに対して非特異的な染色と考え、SPFはβ-1,4-グルカンに対して最も選択的であると考え、CRはα-およびβキチンに対して非常に選択的であると考えられている。真菌細胞壁多糖類に対するPFSの結合特異性に関する情報は、現在利用できない。調査中の真菌種の所定の色素濃度で最も効果的に標識されている真菌細胞壁ポリマーの比率に対しては、容易には答えが得られ、他の生物または他の真菌種におけるインビトロまたはインビボで得られた詳細な測定の適用は非常に慎重に考慮されなければならない。残念ながら、この情報はまばらで、文献35、42、46に非常に散在している。真菌中に特に特徴付された染料の精密な染色特性に関する新しい洞察を提供するために、以前の研究33に続くより最近の記録は、現在利用できない。
撮像制御は、染色パターンおよび細胞応答を正確に評価するために不可欠である。しかし、おそらく最も困難な部分は、真菌の細胞生物学をよく知っているので、膜および細胞壁の選択的蛍光色素の細胞内局在の変化を、細胞構造または催眠成長パターンの変化は、実験的治療の意図した効果に排他的かつ自信を持って関連させることができる。このためには、新しい生細胞イメージング実験と一緒に良好なコントロールを持つことは重要です。これらには、取得した画像からバックグラウンドの自己蛍光および検出器ノイズを除外し、変異体を操作する際に形態学的比較を有する陰性画像制御として未処理の野生型が含まれる。さらに、陽性イメージング制御は、例えば細胞質または他のよく知られた蛍光マーカータンパク質においてGFPまたはRFPを発現する株であり、励起光強度を必要最小限に設定し、細胞活力制御を有することが不可欠である。これらのコントロールが設定されると、蛍光色素の使用は可視化タスクのみに限定されませんが、濃度依存の染色ダイナミクス、ならびに濃度依存的な副作用は分析的に利用され得る。例えば、細胞壁生合成をリアルタイムで定量的にモニタリングするために、または感受性アッセイにおける変異特異的表現型の同定のために47。
改善された将来の適用は染料染色特性の詳細な機能分析に依存する。主な課題は、糸状菌中の膜および細胞壁選択的蛍光色素の細胞内ダイナミクスの機能的評価を進めるために、定量画像解析をさらに改善・自動化することです。このためには、特定の輸送経路に欠損する変異株と組み合わせた既知のオルガネラおよび細胞壁ポリマーマーカーを用いたこれらの色素の広範な定量的共局在化研究が最初に必要とされる。FM色素との比較分析のためのいくつかのエンドサイトーシスマーカーは、48、49、および真菌中の細胞壁色素の依然として十分に特徴付けが悪い結合特異性に関して、蛍光標識グルカン特異的抗体50の適用は、この問題に対処する1つの可能性を提供し得る。
開示事項
著者らは、競合する財政的利益はなく、開示するものも何もないと宣言している。
謝辞
おかげで、チロル科学基金(TWF)は、ALに助成金を提供し、ウィーン科学技術基金(WWTF)に対し、SZに#LS13-086の助成金を提供し、オープンアクセス出版を支援するためのインスブルック大学の出版基金に#256524を提供したおかげです。著者らはまた、ライカTCS SP5 II共焦点レーザー走査顕微鏡を提供したインスブルック大学動物学科に感謝する。
資料
| Name | Company | Catalog Number | Comments |
| BRAND cell counting chamber | Merck | BR718005 | Thoma format |
| Calcofluor White M2R | Merck/Sigma-Aldrich | F3543 | cell wall dye |
| CFI Plan Apo VC 60x/1.2 NA XC WI | Nikon | MRD07602 | water immersion objective |
| CFI Plan Apo VC 60x/1.2 NA XC WI | Nikon | MRD07602 | water immersion objective |
| Congo Red | Merck/Sigma-Aldrich | C6277 | cell wall dye |
| Dimethyl sulfoxide | VWR | 8,36,73,230 | organic solvent |
| Eclipse TE2000-E with C1 scanning unit | Nikon | custom configuration | inverted laser scanning confocal microscope used to acquire example data 2 and 4 |
| Eclipse TE2000-U with Bio-Rad Radiance 2100 scannig unit | Nikon | custom configuration | inverted laser scanning confocal microscope used to acquire example data 5 |
| FM 1-43 | Merck/Sigma-Aldrich | S6814 | membrane dye |
| FM 4-64 | Merck/Sigma-Aldrich | S6689 | membrane dye |
| Glass beads | Rettberg | 1340691030 | 3 mm glass beads |
| Glass cover slips | Thermo Fisher Scientific | BB02400600A113MNT0 | 24 x 60 # 1 glass cover slips |
| HCX PL APO 63x/1.3 NA Glyc | Leica | 15506353 | glycerol immersion objective |
| LSM 510 Meta | Zeiss | custom configuration | inverted laser scanning confocal microscope used to acquire example data 3 |
| M9 Minimal Medium | Merck/Sigma-Aldrich | M6030 | generic fungal growth medium |
| Micro-slide 8-well | ibidi | 80826 | ibiTreat #1.5 polymer coverslip |
| Miracloth | Merck/Millipore | 475855-1R | polyester filtration material |
| Petri dish | Sarstedt | 8,21,472 | 92 x 16 mm culture dish w/o cams |
| Phytagel | Merck/Sigma-Aldrich | P8169 | transparent gelling agent |
| Plan Apochromat 63x/1.4 NA Oil DIC | Zeiss | 440762-9904-000 | oil immersion objective |
| Pontamine Fast Scarlet 4B | Merck/Sigma-Aldrich | 212490 | cell wall dye |
| Potato Dextrose Agar (PDA) | BD Difco | 213400 | fungal growth medium for T. atroviride |
| Potato Dextrose Broth (PDB) | BD Difco | 254920 | fungal growth medium for T. atroviride |
| Reaction tube | Sarstedt | 72,706 | 1.5 mL SafeSeal tube |
| Scalpel | B.Braun | 5518016 | Cutfix sterile scalpel #23 |
| Screw cap tube | Sarstedt | 6,25,54,502 | 15 mL polypropylene tube |
| Solophenyl Flavine 7GFE 500 | CIBA | 1485385V6 | cell wall dye |
| SynaptoGreen C4 | Biotum | 70020 | membrane dye |
| SynaptoRed C2 | Biotum | 70021 | membrane dye |
| Syringe membrane filter | Thermo Fisher Scientific | 723-9945 | 0.45 µm SFCA syringe filter |
| TCS SP5 II | Leica | custom configuration | inverted laser scanning confocal microscope used to acquire example data 1 |
| Vogel's Minimal Medium (VMM) | FGSC | Fungal Genetics Stock Centre | fungal growth medium for N. crassa |
参考文献
- Read, N. D., Fischer, S., Parton, R. M. Imaging Spitzenkörper, pH and calcium dynamics in growing fungal hyphae. Pesticide Science. 54 (2), 179-181 (1998).
- Hickey, P. C., Swift, S. R., Roca, M. G., Read, N. D. Live-cell imaging of filamentous fungi using vital fluorescent dyes and confocal microscopy. Microbial Imaging. , 63-87 (2004).
- Jelínková, A., et al. Probing plant membranes with FM dyes: tracking, dragging or blocking. The Plant Journal. 61 (5), 883-892 (2010).
- Fischer-Parton, S., et al. Confocal microscopy of FM4-64 as a tool for analysing endocytosis and vesicle trafficking in living fungal hyphae. Journal of Microscopy. 198 (3), 246-259 (2000).
- Harris, S. D. Branching of fungal hyphae: regulation, mechanisms and comparison with other branching systems. Mycologia. 100 (6), 823-832 (2008).
- Roca, M. G., Arlt, J., Jeffree, C. E., Read, N. D. Cell biology of conidial anastomosis tubes in Neurospora crassa. Eukaryotic Cell. 4 (5), 911-919 (2005).
- Becker, Y., et al. The fungal cell-wall integrity MAPK cascade is crucial for hyphal network formation and maintenance of restrictive growth of Epichloë festucae in symbiosis with Lolium perenne. Molecular Plant-Microbe Interactions. 28 (1), 69-85 (2015).
- Justa-Schuch, D., Heilig, Y., Richthammer, C., Seiler, S. Septum formation is regulated by the RHO4-specific exchange factors BUD3 and RGF3 and by the landmark protein BUD4 in Neurospora crassa. Molecular Microbiology. 76 (1), 220-235 (2010).
- Atanasova, L., et al. The Gpr1-regulated Sur7 family protein Sfp2 is required for hyphal growth and cell wall stability in the mycoparasite Trichoderma atroviride. Scientific Reports. 8 (1), 12064 (2018).
- Betz, W. J., Mao, F., Bewick, G. S. Activity-dependent fluorescent staining and destaining of living vertebrate motor nerve terminals. Journal of Neuroscience. 12 (2), 363-375 (1992).
- Wu, Y., Yeh, F. L., Mao, F., Chapman, E. R. Biophysical characterization of styryl dye-membrane interactions. Biophysical Journal. 97 (1), 101-109 (2009).
- Betz, W. J., Mao, F., B, S. C. Imaging exocytosis and endocytosis. Current Opinion in Neurobiology. 6, 365-371 (1996).
- Hoopmann, P., Rizzoli, S. O., Betz, W. J. Imaging synaptic vesicle recycling by staining and destaining vesicles with FM dyes. Cold Spring Harbor Protocols. 2012 (1), 77-83 (2012).
- Bolte, S., et al. FM-dyes as experimental probes for dissecting vesicle trafficking in living plant cells. Journal of Microscopy. 214, 159-173 (2004).
- Riquelme, M., et al. Spitzenkorper localization and intracellular traffic of green fluorescent protein-labeled CHS-3 and CHS-6 chitin synthases in living hyphae of Neurospora crassa. Eukayotic Cell. 6 (10), 1853-1864 (2007).
- Lichius, A., Yáñez-Gutiérrez, M. E., Read, N. D., Castro-Longoria, E. Comparative live-cell imaging analyses of SPA-2, BUD-6 and BNI-1 in Neurospora crassa reveal novel features of the filamentous fungal polarisome. PloS one. 7 (1), 30372 (2012).
- Peñalva, M. A. Tracing the endocytic pathway of Aspergillus nidulans with FM4-64. Fungal Genetics and Biology. 42 (12), 963-975 (2005).
- Dijksterhuis, J., Molenaar, D. Vesicle trafficking via the Spitzenkörper during hyphal tip growth in Rhizoctonia solani. Antonie van Leeuwenhoek. 103 (4), 921-931 (2013).
- Hickey, P. C., Read, N. D. Imaging living cells of Aspergillus in vitro. Medical Mycology. 47, 110-119 (2009).
- Delgado-Álvarez, D. L., Bartnicki-García, S., Seiler, S., Mouriño-Pérez, R. R. Septum development in Neurospora crassa: the septal actomyosin tangle. PLoS One. 9 (5), 96744 (2014).
- Hageage, G. J., Harrington, B. J. Use of Calcofluor White in clinical mycology. Laboratory Medicine. 15 (2), 109-112 (1984).
- Monheit, J. E., Cowan, D. F., Moore, D. G. Rapid detection of fungi in tissues using Calcofluor White and fluorescence microscopy. Archives of Pathology and Laboratory. 108 (8), 616-618 (1984).
- Herth, W., Schnepf, E. The fluorochrome Calcofluor White binds oriented to structural polysaccharide fibrils. Protoplasma. 105 (1-2), 129-133 (1980).
- Elorza, M. V., Rico, H., Sentandreu, R. Calcofluor White alters the assembly of chitin fibrils in Saccharomyces cerevisiae and Candida albicans cells. Journal of General Microbiology. 129 (5), 1577-1582 (1983).
- Lagorce, A., et al. Genome-wide analysis of the response to cell wall mutations in the yeast Saccharomyces cerevisiae. Journal of Biological Chemistry. 278 (22), 20345-20357 (2003).
- Sanz, A. B., García, R., Rodríguez-Peña, J. M., Arroyo, J. The CWI Pathway: regulation of the transcriptional adaptive response to cell wall stress in yeast. Journal of Fungi. 4 (1), (2017).
- Slifkin, M., Cumbie, R. Congo Red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Michels, J., Büntzow, M. Assessment of Congo Red as a fluorescence marker for the exoskeleton of small crustaceans and the cuticle of polychaetes. Journal of Microscopy. 238 (2), 95-101 (2010).
- Pancaldi, S., Poli, F., Dall'Olio, G., Vannini, G. L. Morphological anomalies induced by Congo Red in Aspergillus niger. Archives of Microbiology. 137 (3), 185-187 (1984).
- Roncero, C., Durán, A. Effect of Calcofluor White and Congo Red on fungal cell wall morphogenesis: in vivo activation of chitin polymerization. Journal of Bacteriology. 163 (3), 1180-1185 (1985).
- Kopeck, M., Gabriel, M. The influence of Congo Red on the cell wall and (1,3)- β-d-glucan microfibril biogenesis in Saccharomyces cerevisiae. Archives of Microbiology. 158 (2), 115-126 (1992).
- Heilmann, C. J., et al. Surface stress induces a conserved cell wall stress response in the pathogenic fungus Candida albicans. Eukayotic Cell. 12 (2), 254-264 (2013).
- Hoch, H. C., Galvani, C. D., Szarowski, D. H., Turner, J. N. Two new fluorescent dyes applicable for visualization of fungal cell walls. Mycologia. 97 (3), 580-588 (2005).
- Liesche, J., Ziomkiewicz, I., Schulz, A. Super-resolution imaging with Pontamine Fast Scarlet 4BS enables direct visualization of cellulose orientation and cell connection architecture in onion epidermis cells. BMC Plant Biology. 13, 226 (2013).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Knight, N. L., Sutherland, M. W. A rapid differential staining technique for Fusarium pseudograminearum in cereal tissues during crown rot infections. Plant Pathology. 60 (6), 1140-1143 (2011).
- Fajardo-Somera, R. A., et al. Dissecting the function of the different chitin synthases in vegetative growth and sexual development in Neurospora crassa. Fungal Genetics and Biology. 75, 30-45 (2015).
- Lichius, A. . Cell Fusion in Neurospora crassa. , (2010).
- Chen, W., Li, W., Dong, X., Pei, J. A Review of Biological Image Analysis. Current Bioinformatisc. 13 (4), 337-343 (2018).
- Goldman, R. D., Swedlow, J., Spector, D. L. . Live cell imaging: A laboratory manual. , (2010).
- Eliceiri, K. W., et al. Biological imaging software tools. Nature methods. 9 (7), 697-710 (2012).
- Zemanek, G., Jagusiak, A., Chłopaś, K., Piekarska, B., Stopa, B. Congo Red fluorescence upon binding to macromolecules - a possible explanation for the enhanced intensity. Bio-Algorithms and Med-Systems. 13 (2), 1187 (2017).
- Hickey, P. C., Jacobson, D. J., Read, N. D., Louise Glass, N. Live-cell imaging of vegetative hyphal fusion in Neurospora crassa. Fungal Genetics and Biology. 37 (1), 109-119 (2002).
- . Hamamatsu Si APD - high sensitivity photodiodes having an internal gain mechanism: Avalanche photodiode selection guide 2019 Available from: https://www.hamamatsu.com/resources/pdf/ssd/si_apd_kapd0001e.pdf (2019)
- Huff, J. The Airyscan detector from ZEISS: confocal imaging with improved signal-to-noise ratio and super-resolution. Nature Methods. 12, 1205 (2015).
- Thomas, J., Idris, N. A., Collings, D. A. Pontamine Fast Scarlet 4B bifluorescence and measurements of cellulose microfibril angles. Journal of Microscopy. 268 (1), 13-27 (2017).
- Ram, A. F. J., Klis, F. M. Identification of fungal cell wall mutants using susceptibility assays based on Calcofluor White and Congo Red. Nature Protocols. 1 (5), 2253-2256 (2006).
- Toshima, J. Y., et al. Spatial dynamics of receptor-mediated endocytic trafficking in budding yeast revealed by using fluorescent alpha-factor derivatives. Proceedings of the National Academy of Science of the USA. 103 (15), 5793-5798 (2006).
- Kilaru, S., Schuster, M., Latz, M., Guo, M., Steinberg, G. Fluorescent markers of the endocytic pathway in Zymoseptoria tritici. Fungal Genetics and Biology. 79, 150-157 (2015).
- Fu, C., Tanaka, A., Free, S. J. Neurospora crassa 1,3-α-glucan synthase, AGS-1, is required for cell wall biosynthesis during macroconidia development. Microbiology. 160, 1618-1627 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved