Method Article
Applicazione di coloranti fluorescenti selettivi a membrana e a parete cellulare per l'imaging a celle vive di Filamentous Fungi
In questo articolo
Riepilogo
I coloranti fluorescenti vitali sono strumenti essenziali per l'analisi dell'imaging a cellule vive nella moderna biologia delle cellule fungine. Questo documento descrive in dettaglio l'applicazione di coloranti fluorescenti affermati e meno noti per il monitoraggio della dinamica della membrana plasmatica, dell'endo/esocitosi e della morfogenesi delle pareti cellulari nei funghi filamentosi.
Abstract
L'applicazione di coloranti fluorescenti selettivi a membrana e parete cellulare per analisi di imaging a cellule vive della dinamica delle cellule fungine è iniziata due decenni fa e da allora continua a contribuire notevolmente alla nostra comprensione del filamentoso fungino Lifestyle. Questo documento fornisce una guida pratica per l'utilizzo dei due coloranti a membrana FM 1-43 e FM 4-64 e le quattro macchie a parete cellulare Calcofluor White M2R, Solophenyl Flavine 7GFE 500, Pontamine Fast Scarlet 48 e Congo Red. L'attenzione si concentra sulla loro applicazione a basso dosaggio per accertare la colorazione priva di artefatti, le loro proprietà di co-imaging e la loro valutazione quantitativa. I metodi presentati sono applicabili a tutti i campioni di funghi filamentosi che possono essere preparati nei modi descritti. Gli approcci fondamentali di colorazione possono servire come punto di partenza per l'adattamento a specie che potrebbero richiedere condizioni di coltivazione diverse. In primo luogo, le proprietà biofisiche e biochimiche sono riviste in quanto la loro comprensione è essenziale per utilizzare questi coloranti come macchie fluorescenti veramente vitali. In secondo luogo, vengono presentati protocolli passo-passo che descrivono in dettaglio la preparazione di vari tipi di campioni di funghi per l'imaging fluorescente delle cellule vive. Infine, esperimenti di esempio illustrano diversi approcci a: (1) identificare i difetti nell'organizzazione spatio-temporale dell'endocitosi nei mutanti genetici, (2) caratterizzano relativamente la co-localizzazione condivisa e distinta delle proteine bersaglio etichettate TBC nel percorso endocitico, (3) identificare i difetti della parete cellulare morfogenetica in un mutante genetico e (4) monitorare la biogenesi delle pareti cellulari in tempo reale.
Introduzione
Vent'anni fa, il modo in cui la morfogenesi dell'hyphal e la biologia cellulare molecolare sottostante potevano essere visualizzate nei funghi filamentosi è stato rivoluzionato dall'applicazione della membrana fluorescente selettiva Fei Mao colorare FM 4-641. Più tardi, il beneficio del colorante chitina-binding Calcofluor Bianco come marcatore fluorescente vitale della dinamica della parete cellulare fungina è stato realizzato2. Da allora, sia i coloranti che le varianti sono diventati una parte intrinseca delle analisi di imaging delle cellule vive delle dinamiche dell'organello nei funghi e continuano a fornire informazioni senza precedenti sullo stile di vita filante fungino. Questo documento descrive in dettaglio l'applicazione di coloranti fluorescenti affermati e meno noti per tracciare la dinamica della membrana plasmatica, l'endo e l'esocitosi e la morfogenesi delle pareti cellulari nei funghi filamentosi. I saggi di tracciamento dell'endocitosi consentono di affrontare varie questioni biologiche cellulari relative allo studio generale dell'endocitosi3. Per questo, la localizzazione, la velocità e la successione dei compartimenti macchiati sull'aggiunta di coloranti FM sono registrate dalla microscopia time lapse e confrontate quantitativamente tra i ceppi fungini testati4. Coloranti a parete cellulare delineano il confine esterno della cellula e consentono il tracciamento di eventi morfogenetici, tra cui la crescita polarizzata della punta ipforica2, la ramificazione dell'hyphal5, la fusione iphal6,7 e la formazione del setto8. Inoltre, facilitano la quantificazione della deposizione localizzata della parete cellulare e l'identificazione dei difetti durante la biogenesi della parete cellulare9. Poiché la conoscenza dettagliata delle proprietà biochimiche e biofisiche di qualsiasi marcatore fluorescente è un prerequisito fondamentale per la sua applicazione in vivo di successo, queste caratteristiche sono prima riassunte per i sei coloranti presenti in questo articolo.
Coloranti selettivi a membrana
I coloranti stiryl FM (Fei Mao) sono piccole molecole anfifile che non possono passare ma che si associano reversibilmente al volantino esterno del bistrato lipidico delle membrane biologiche10. Sono praticamente non fluorescenti in soluzione acquosa, ma diventano intensamente fluorescenti sull'integrazione della membranaplasmatica, generando eccellenti rapporti segnale-rumore (S/N)-11 . Queste proprietà li rendono ideali per visualizzare la membrana plasmatica e le dinamiche di organelle intracellulari, compreso il monitoraggio dell'endo- e dell'esocitosi12. Il verde-fluorescente FM 1-43 e il rosso-fluorescente FM 4-64 sono i due marcatori di membrana fluorescente più utilizzati per questi scopi. SynaptoGreen C4 e SynaptoRed C2 sono molecole generiche di fornitori alternativi che possono essere utilizzate in modo intercambiabile al posto di FM 1-43 e FM 4-64, rispettivamente.
I coloranti Stiryl comprendono tre regioni strutturali chiave: (1) la coda lipofilica che facilita l'inserimento del colorante nel bistrato lipidico, (2) il nucleo fluoroforo che determina le proprietà spettrali del tinrio ed è costituito da due anelli aromatici collegati da uno a tre doppi legami, e (3) la testa idrofila carica positivamente che impedisce l'inserimento completo e la permeazione del tintura attraverso la membrana (Figura 1A).
Più lunga è la coda lipofila, maggiore è l'idrofobicità del colorante e quindi lega l'affinità alla membrana, ma più bassa è la sua solubilità dell'acqua e il tasso di decolorazione della membrana. Di conseguenza, diverse varianti di colorante FM producono diverse dinamiche e modelli di colorazione. La maggiore idrofobicità del FM 1-43 a coda C4 fornisce un segnale di fluorescenza più forte e più stabile alle membrane plasmatiche e agli organelli interni più velocemente del più corto FM 4-64 a coda C2, se applicato a concentrazioni di equimolar (Figura 2).
È importante sottolineare che i tassi di associazione/dissociazione costanti e elevati di entrambi i coloranti FM11 con tempi di ritenzione medi di 1–6 s per singola molecola colorante13 riducono le probabilità di interruzione localizzata della funzione della membrana, ad esempio attraverso la modifica della fluidità della membrana o l'interazione permanente forzata delle proteine della membrana. Questo è probabilmente il motivo principale per cui queste molecole possono essere utilizzate come coloranti vitali. Tuttavia, le concentrazioni di coloranti FM superiori a 50 m sono tossiche per le cellule fungine e vegetali2,14, e le prove dei protoplasti del tabacco BY-2 indicano che più di 20 coloranti FM m portano alla saturazione della membrana plasmatica14. Pertanto, si consiglia di non superare questo limite, soprattutto in considerazione del fatto che è stata ottenuta un'ottima imaging con un minimo di 2-5 ,15.
In particolare, le proprietà spettrali dei coloranti FM variano notevolmente a seconda del particolare microambiente a membrana (rivisto14). Generalmente, gli spettri di eccitazione ed emissione di coloranti FM in soluzioni solventi puri (come di solito fornite nelle informazioni sul prodotto) differiscono in modo significativo da quello negli ambienti cellulari e, nella maggior parte dei casi, non possono essere consultati direttamente per la selezione delle impostazioni di imaging delle cellule vive. Il massimo di eccitazione/emissione di FM 1-43 e FM 4-64, ad esempio, diventa di 37/46 nm e di 43/64 nm, rispettivamente, quando legato a membrane fungine rispetto alle loro soluzioni nel metanolo (Tabella 1).
I fondamentali fondamentali fondamentali per l'uso di FM 4-64 e FM 1-43 per il monitoraggio della membrana plasmatica, dell'endo/exocitosi e delle dinamiche dell'organelle, tra cui lo Spitzenkàrper e il mitocondri, sono già stati ampiamente documentati per una vasta gamma di specie fungine filamentose precedentemente2,4,17,18,19. Le impostazioni di imaging consigliate per entrambi i coloranti FM che funzionano in varie specie fungine filamentose sono rappresentate nella Figura 1B. Le limitazioni tecniche delle attrezzature disponibili o particolari condizioni cellulari e sperimentali, come il mezzo di coltura, il pH o la temperatura, tuttavia, potrebbero richiedere alcuni adattamenti. Fortunatamente, i coloranti FM operano su un'ampia gamma spettrale e ottimi risultati di imaging si ottengono entusiasmante FM 1-43 con 514 nm o FM 4-64 con 488 nm. Di conseguenza, le impostazioni di imaging ottimali devono essere determinate singolarmente per ogni tipo di campione e applicazione prevista.
Il notevole spostamento di Stoke di oltre 135 nm di FM 4-64 consente un eccellente co-imaging simultaneo con fluorofori che emettono luce verde; questo è spesso sfruttato per valutare la dinamica di localizzazione intracellulare delle proteine di fusione con etichettatura GFP (Proteina fluorescente verde) rispetto alla membrana plasmatica e al percorso endocitico9,20.
Coloranti selettivi a parete cellulare
Calcofluor White M2R (CFW), commercializzato anche come Fluorescent Brightener 28, è probabilmente il colorante fluorescente più noto utilizzato per macchiare le pareti cellulari di batteri, funghi, alghe, piante superiori e insetti. Inizialmente utilizzato come agente di sbiancamento ottico nell'industria carta, tessile e detergente, i suoi benefici per la diagnosi clinica delle infezioni fungine sono stati realizzati presto su21,22. Poiché CFW intercala irreversibilmente nella catena di chitina nascente disturba il normale assemblaggio di microfibrilla di chitina durante la biogenesi della parete cellulare generando così stress da parete cellulare23. Questo a sua volta innesca un meccanismo di riparazione del danno della parete cellulare che porta alla deposizione della parete cellulare accresciuta localmente come risultato dell'attivazione di sintetica gluca e chitina24,25. Questo fenomeno può verificarsi con qualsiasi colorante che opera legandosi stabilmente ai polimeri della parete cellulare, è dipendente dalla concentrazione ed è più evidente sulle punte dell'hyphal che rappresentano le parti più prolifiche e quindi più sensibili del micelio (Figura 3). Una sintesi completa dei macchinari molecolari che rispondo ai danni alla parete cellulare è stata recentemente fornita26.
Il tinrio sovradoso in combinazione con la fototossicità può portare a una rapida lisi cellulare dei compartimenti dell'hyphal (Film 1). Ciò nonostante, una maggiore sensibilità alle concentrazioni di colorante che sono "vitali" nel tipo selvaggio può essere sfruttata per identificare i difetti nella biosintesi delle pareti cellulari dei mutanti di perdita di funzione genica9. Per CFW e Congo Red (CR), un altro colorante tessile noto anche come Direct Red 28 e impiegato come macchia cellulare specifica di chitina e z per funghi e insetti27,28, le concentrazioni di soglia che inducono sintetine fortemente chitina sono state determinate con > 60 - CFW M e > 70 CR, rispettivamente, mentre le concentrazioni <15 M di una delle due tinture non alteravano o inibivano la crescita fungina29,30,31. Hickey ealtri ha posto questa concentrazione di soglia per la CFW a 25 m2. Pertanto, si consiglia di utilizzare le concentrazioni di coloranti 5 M per escludere artefatti legati allo stress e garantire l'utilizzo di queste molecole come veramente "coloranti fluorescenti vitali"2,32. Questo vale anche per Solophenyl Flavine 7GFE 500 (SPF) e Pontamine Fast Scarlet 4B (PFS), sinonimo di Direct Yellow 86 e Direct Red 23, rispettivamente, altri due coloranti cellulari utili la cui applicazione per i funghi è stata segnalata per la prima volta più di dieci anni fa33. Ma nonostante le loro notevoli proprietà spettrali34,35, l'uso di entrambi i coloranti è stato da allora molto limitato36,37. Come indicato in precedenza per 1,5 M CFW2, 2 SPF sono sufficienti per risolvere le dinamiche delle pareti cellulari in condizioni native con una risoluzione temporale molto elevata (Film 2). Gli stessi risultati possono essere ottenuti con 2 : CR o PFS.
Insieme, questi quattro coloranti, CFW, SPF, PFS e CR, comprendono una serie di marcatori fluorescenti selettivi a parete cellulare che coprono quasi lo spettro completo della luce di emissione visibile (400-700 nm) utilizzati sui moderni microscopi fluorescenti(Figura 4). Il significativo aumento dell'intensità della fluorescenza al collegamento ai polimeri della parete cellulare è inerente a tutti e quattro e genera eccellenti rapporti S/N. Questo a sua volta permette di mantenere le concentrazioni di colorante e l'intensità della luce di eccitazione molto bassa e permette di eseguire la colorazione della parete cellulare come tecnica di imaging a cellule vive "a bassa dose"2. Poiché questi coloranti per pareti cellulari sono impermeabili alla membrana plasmatica, funzionano contemporaneamente come macchie vive/morte. In particolare, a causa dei loro spettri di luce di emissione estremamente ampi, alcune limitazioni riguardanti le proprietà di co-imaging di CFW e SPF con altri fluorofori devono essere attentamente considerate.
Protocollo
1. Preparazione di campioni fungini
- Pre-culture fungine
- Inoculare il ceppo desiderato su un mezzo di agar solido appropriato, come l'agar di dextrose di patate (PDA) per Trichoderma alocera o il Medium minimo di Vogel (VMM) per Neurospora crassa. Aggiungere un marcatore di selezione appropriato quando si lavora con ceppi di trasformazione.
- Incubare la pre-coltura alla temperatura ottimale dell'organismo. Ad esempio, T. atroviride a 25 e N. crassa a 30 , e 12 h/12 h cicli di luce/scuro fino a quando un micelio sporulante si è sviluppato ma non ha ancora raggiunto il bordo della piastra. Su un piatto Petri di dimensioni standard (9,2 cm), questo porta il tipo selvaggio T. atroviride su 4-6 giorni in media, mentre il tipo selvatico N. crassa raggiunge questa fase dopo 3-4 giorni in media.
- Coltivazione di colonie fungine
- Utilizzando un bisturi sterile, tagliare un piccolo blocco di agar 3 mm x 3 mm portando il micelio non-sporulante dal bordo della colonia della pre-cultura.
- Posizionare il blocco di agar al centro di una piastra media solida fresca per inoculare la coltura sperimentale.
- Incubare la cultura sperimentale secondo la fase di sviluppo destinata ad essere studiata. Per esempio, il Tipo selvaggio T. atroviride richiede 20–22 ore a 25 gradi centigradi al buio per sviluppare colonie di circa 2 cm di diametro sul PDA, mentre il tipo selvatico N. crassa raggiunge diametri di colonia di circa 4 cm dopo 14-16 h di incubazione a 30 gradi centigradi al buio su VMM.
NOTA: L'incubazione al buio impedisce la formazione di pigmenti che potrebbero introdurre l'autofluorescenza. Per eliminare la fluorescenza di fondo media dalla coltura sperimentale, sostituire agar con 1.5% w/v di un agente solidificio trasparente (vedere la tabella dei materiali) e qualsiasi mezzo complesso con un mezzo minimo definito.
- Coltivazione di solide colture germlanti
- Utilizzare 5 mL di soluzione salare fisiologica sterile (0.9% w/v NaCl) per raccogliere spore conidiali dalla piastra pre-coltura e raccogliere la sospensione spore risultante in un tubo a vite a vite da 15 mL.
- Mescolare bene le sospensioni delle spore con un vortice vigoroso e successivamente filtrarle su una striscia di 1 cm x 5 cm di tessuto sterile (vedi la Tabella dei Materiali) leggermente farcito in una punta di pipetta da 1 mL (sia assemblata che autoclata in anticipo) in un tubo sterile fresco.
- Determinare la densità delle spore con una camera di conteggio cellulare e preparare una sospensione 1 x 107 cellule / spore mL con soluzione salina fisiologica.
NOTA: La sospensione delle spore può essere mantenuta a 4 gradi centigradi per un massimo di due settimane. - Preparare un piatto Petri di dimensioni standard (9,2 cm) con 20 mL di mezzo solido e aggiungere 15-20 perline di vetro sterili (3 mm ) sulla parte superiore.
- Pipette 200 - L della sospensione spore sulla piastra media e distribuire uniformemente le cellule su tutta la piastra agitando delicatamente. Raccogliere le perline di vetro in un bicchiere con 70% etanolo per il riutilizzo.
- Incubare la cultura sperimentale secondo la fase di sviluppo destinata ad essere studiata. Ad esempio, il tipo selvatico Di un racaperdente richiede 5-6 h a 25 gradi centigradi al buio per sviluppare germi conidiali sul PDA, mentre il tipo selvatico Di N. crassa sviluppa germi conidiali dopo 3-4 h di incubazione a 30 gradi centigradi al buio su VMM.
NOTA: Per eliminare qualsiasi media fluorescenza di fondo dalla coltura sperimentale, sostituire agar con 1.5% w/v di un agente solidificio trasparente, e qualsiasi mezzo complesso con un mezzo minimo definito.
- Coltivazione di colture germlanti liquide
- Riempire 190 l di mezzo di coltura liquida in ogni pozzo di un micro-vetrino a 8 camere a 3 vetri.
- Aggiungete 10 l di una soluzione di 1 x 107 celle/mL di spore (preparate nei passaggi 1.4.1–1.4.3) e mescolate con la pipista delicatamente su e giù un paio di volte. Il numero totale risultante di celle è 1 x 105 per pozzo.
- Incubare la cultura sperimentale secondo la fase di sviluppo destinata ad essere studiata. Per esempio, il tipo selvatico T. atroviride richiede 5–6 h a 25 s al buio per sviluppare germi conidiali nel brodo di patate dextrose (PDB), mentre il tipo selvatico N. crassa sviluppa germi conidili dopo 3-4 h di incubazione a 30 gradi centigradi al buio nella VMM liquida.
2. Preparazione delle soluzioni di lavoro a deline
- Per garantire la piena solubilità di ogni tè, preparare 2 soluzioni di stock mM in solfuro dimetile (DMSO) aggiungendo l'importo appropriato (vedi pesi esatti nella tabella 1) a 1 mL di 100% DMSO e mescolare bene vortice.
AVVISO: Assicuratevi di prendere il DMSO da una bottiglia sigillata setto; dovrebbe essere un liquido trasparente chiaro. A contatto con l'aria, d'essere d'aria diventa marrone, probabilmente a causa dell'ossidazione di impurità di traccia, e potrebbe influenzare negativamente la crescita cellulare o la colorazione. - Filtro sterilizzare la soluzione di magazzino attraverso un filtro a membrana di siringa di 0,2 m in un tubo di reazione sterile fresco da 1,5 mL. Per ridurre al minimo lo sbiancamento del colorante, avvolgere il tubo in un foglio di alluminio.
NOTA: La soluzione di brodo di tintura può essere in grandi volumi per evitare cicli di scongelamento/congelamento, e mantenuta a 4 gradi centigradi per diversi mesi. - Preparare una soluzione di lavoro a 20 m aqueous colorante sciogliendo 2 -L di soluzione di brodo di coloranti in 198 - L di acqua distillata sterile in un tubo di reazione sterile fresco 1,5 mL. Per ridurre al minimo lo sbiancamento del colorante, avvolgere il tubo in un foglio di alluminio.
NOTA: la soluzione di lavoro del tinri deve essere preparata fresco il giorno dell'esperimento. - Durante il montaggio del campione (vedere la sezione 3), la soluzione di lavoro del tintura sarà standardmente diluita 1:10, con conseguente concentrazione finale di tintura di 2 m e dello 0,1% w/v concentrazione finale di DMSO.
NOTA: La scelta di diversi fattori di diluizione modificando semplicemente il rapporto di volume tra la soluzione di lavoro del tintura e il liquido di montaggio, consente di adattare facilmente la concentrazione di tintura finale desiderata.
AVVISO: Per evitare effetti indesiderati dovuti alla tossicità della tintura o alla tossicità DMSO, il fattore di diluizione non deve scendere al di sotto di 1:4 per ottenere concentrazioni finali massime di 5 m di tintura e dello 0,4% w/v DMSO. Concentrazioni più elevate di tintura satureranno rapidamente il sistema e prevengono la quantificazione affidabile del segnale, mentre più dello 0,5% w/v (62,5 mM) DMSO può compromettere lo sviluppo cellulare38.
3. Preparazione del campione per la microscopia
- Montare campioni da colonie fungine (passaggio 1.2) o colture di germinamento solido (passaggio 1.3) con il metodo del blocco di agar invertito.
- Mantenere pronta una lestragliatrice pulita da 24 mm x 60 mm (#1 spessore 0,13-0,16 mm) e aggiungere al centro 18 l di mezzo minimo liquido (VMM o M9) o una soluzione salina fisiologica.
- Aggiungete 2 l della soluzione di lavoro a 20 M di tintura a 18 gradi di liquido e mescolate bene convogliando su e giù più volte, evitando la produzione di bolle d'aria.
NOTA: Quando si lavora con diversi campioni, si consiglia di preparare un mix master di soluzione di tinzione liquida per tutti al fine di garantire la concentrazione di coloranti uguale durante l'esperimento. - Con un bisturi pulito, ritaglia un campione di 15 mm x 15 mm dalla periferia della colonia o dalla coltura solida del germello e posizionalo verticalmente accanto alla goccia media sullo slittamento del coperchio.
- Utilizzando il bisturi per sostenere il bordo superiore del blocco e un dito per tenere il lato posteriore del blocco in posizione, abbassare lentamente il lato portando il micelio o germilings sul liquido. Il campione è ora pronto per il trasferimento sullo stadio del microscopio.
ADERAzione: È essenziale farlo lentamente e con molta attenzione al fine di ridurre al minimo lo stress meccanico sulle cellule ed evitare che le bolle d'aria rimangano intrappolate tra il campione e lo slittamento di copertura.
- Montare le colture di germling liquido dal punto 1.4.
NOTA: La maggior parte delle colture germlanti liquide in micro-pomslide con camera possono essere trasferite direttamente e manipolate ulteriormente sullo stadio del microscopio.- Aggiungere 22 l di soluzione di lavoro di tintura a 200 l di mezzo liquido per ottenere concentrazioni finali standard di 2 m tintura e 0,1% w/v DMSO.
NOTA: Le colture di germling liquido hanno il grande vantaggio che i coloranti fluorescenti (o altre sostanze chimiche, come gli inibitori) possono essere aggiunti in qualsiasi momento desiderato dell'esperimento, anche durante la registrazione. In tal caso, è necessario prestare particolare attenzione a somministrare le gocce liquide molto lentamente per non disturbare le cellule. Le vibrazioni del sistema e il movimento browniano potrebbero già introdurre un certo movimento cellulare.
- Aggiungere 22 l di soluzione di lavoro di tintura a 200 l di mezzo liquido per ottenere concentrazioni finali standard di 2 m tintura e 0,1% w/v DMSO.
4. Microscopia a cellule vive
- Regolare le impostazioni di base per l'acquisizione dell'immagine. Le seguenti impostazioni di acquisizione dell'immagine consentono di catturare le dinamiche di colorazione nelle singole ife e sono applicabili a entrambi i seguenti saggi
- Applicare una potenza laser del 5-10% del 20% della potenza di uscita completa del dispositivo.
- Utilizzare un obiettivo di planigliel 60x 60x 60x 63x o immersione in acqua con un'apertura numerica elevata : 1,2.
- Limitare l'area di acquisizione dell'immagine al contorno delle ife impostando una dimensione dell'immagine di 1024 x 256 pixel e utilizzando un fattore di zoom ottico da 2 a 3.
- Utilizzare la scansione bidirezionale con 400 Hz. Regolare la dimensione del foro stenopeico su 1 unità Airy.
- Impostare il guadagno del rivelatore più sensibile al 100%.
- Per la registrazione dei giri, avviare l'acquisizione dell'immagine con un fotogramma ogni 15 s per consentire una risoluzione temporale ragionevole senza produrre sbiancamento di tintura o stress fotografico.
- Per la registrazione 3D, impostare il limite spaziale superiore e inferiore sul confine delle ottiche di hyphae e spazio a 1 m di distanza per consentire una ragionevole risoluzione spaziale.
NOTA: a causa della rapida crescita delle ife, l'alta risoluzione spaziale nell'asse z è stata spesso sacrificata per l'alta risoluzione temporale nell'asse X/Y o viceversa. Solo i moderni microscopi a scansione laser confocali sono abbastanza veloci da soddisfare entrambe le esigenze.
- Saggi di assorbimento dell'endocitosi
- Consultare la Figura 1 e la Tabella 1 per identificare le migliori impostazioni di eccitazione/emissione per FM 1-43 e/o FM 4-64 disponibili sul sistema di microscopia e regolare di conseguenza.
NOTA: Con la concentrazione raccomandata di 2 M, l'incorporazione di tintura FM nella membrana plasmatica è istantanea nelle normali cellule sane. L'intero processo dalla colorazione iniziale della membrana plasmatica all'aspetto colorante nei vacuoli tubolari viene solitamente completato entro 30-45 min a temperatura ambiente. Aumentando la concentrazione di coloranti FM aumenta il rapporto S/N e quindi produce immagini a contrasto più elevato più velocemente. Tuttavia, accelera anche il processo di etichettatura rendendo più difficile distinguere la successione cronologica della colorazione dell'organello. - Avviare la registrazione delle immagini utilizzando le impostazioni di acquisizione delle immagini di base sopra consigliate e valutare i risultati.
- Ottimizza le impostazioni di acquisizione delle immagini in base alla risoluzione spaziale e temporale necessaria per catturare l'aspetto della membrana plasmatica o della dinamica dell'endocitosi su cui l'esperimento è incentrato.
- Ad esempio, per acquisire dinamiche molto veloci in X/Y, diminuire le dimensioni complessive dell'immagine, visualizzare un solo piano focale e aumentare la velocità di scansione a 1 fps. Per una risoluzione più alta nell'asse z, diminuire la risoluzione in X/Y, ridurre le dimensioni dell'immagine e ridurre la distanza tra le sezioni ottiche a 0,5 m.
- Consultare la Figura 1 e la Tabella 1 per identificare le migliori impostazioni di eccitazione/emissione per FM 1-43 e/o FM 4-64 disponibili sul sistema di microscopia e regolare di conseguenza.
- Dinamica delle pareti cellulari
- Consultare la figura 4 e la tabella 1 per identificare le migliori impostazioni di eccitazione/emissione per il tinto a parete cellulare applicato sul sistema di microscopia e regolare di conseguenza.
NOTA: a causa dei loro ampi spettri di emissione, CFW e SPF non sono adatti per la co-imaging simultanea con altri fluorofori, prevalentemente GFP. Alcune restrizioni si applicano anche per gli approcci di imaging sequenziale con questi coloranti, e quindi devono essere ottimizzati singolarmente. - Avviare la registrazione delle immagini utilizzando le impostazioni di acquisizione delle immagini di base sopra consigliate e valutare i risultati.
NOTA: Con la concentrazione raccomandata di 2 M, l'incorporazione di tinconi nella parete cellulare non è necessariamente istantanea, ma ragionevolmente veloce. L'intero processo di formazione del setto, per esempio, richiede in media circa 5-7 min a temperatura ambiente20. Aumentando la concentrazione di coloranti a parete cellulare aumenta il rapporto S/N e quindi produce immagini a contrasto più elevato più velocemente. Tuttavia, introduce anche rapidamente artefatti a causa della riparazione dei danni alle pareti cellulari indotte. - Ottimizzare le impostazioni di acquisizione delle immagini in base alla risoluzione spaziale e temporale necessaria per catturare l'aspetto della morfogenesi delle pareti cellulari su cui l'esperimento è incentrato, come descritto nella sezione 4.2.3.
- Consultare la figura 4 e la tabella 1 per identificare le migliori impostazioni di eccitazione/emissione per il tinto a parete cellulare applicato sul sistema di microscopia e regolare di conseguenza.
Risultati
Analisi quantitativa delle immagini
Oltre a visualizzare "solo" i processi cellulari, l'imaging live-cell consente di estrarre informazioni quantitative dai dati registrati. In generale, l'analisi quantitativa delle immagini è un argomento complesso la cui corretta discussione è ben al di là dell'ambito di questo articolo, quindi, il lettore è riferito a libri di testo dedicati e articoli39,40,41. Tuttavia, vengono fornite alcune linee guida di base associate ai dati di esempio seguenti. A tutti i campioni devono essere soddisfatti diversi prerequisiti fondamentali, tra cui: (1) molarities definite di coloranti fluorescenti a tutti i campioni per consentire un confronto comparativo relativo accurato; (2) le impostazioni di acquisizione delle immagini devono essere regolate in modo che i rilevatori di luce di emissione non siano mai saturi, altrimenti le intensità massime vengono interrotte; (3) le impostazioni di acquisizione delle immagini devono rimanere fisse nel corso di un insieme sperimentale coerente, altrimenti vengono introdotte modifiche di intensità artificiale; (4) i dati dell'immagine devono essere salvati in un formato di file senza perdita di informazioni insieme alle meta informazioni contenenti tutte le impostazioni dello strumento; e (5) l'analisi delle immagini dovrebbe essere limitata al numero minimo di fasi di post-elaborazione necessarie per estrarre le informazioni quantitative desiderate.
Di solito, gli standard definiti che consentirebbero la quantificazione assoluta dei segnali registrati non sono disponibili nella cellula vivente. Pertanto, nella sua forma più semplice, l'analisi quantitativa delle immagini si basa sul confronto relativo delle intensità dei pixel all'interno della stessa immagine o tra immagini diverse registrate con impostazioni identiche. Il software di controllo del microscopio del produttore include normalmente strumenti di base per la post-elaborazione delle immagini e l'analisi quantitativa, oppure può essere aggiornato con funzioni aggiuntive per la segmentazione dell'immagine, la soglia, l'imaging del rapporto, ecc. Sono disponibili diverse piattaforme di elaborazione delle immagini open source, diverse, diverse adatte a vari tipi di dati di imaging, tra cui ImageJ (https://imagej.net; https://imagej.nih.gov/ij/), ghiaccio (http://icy.bioimageanalysis.org/), CMEIAS Bioimage Informatics (http://cme.msu.edu/cmeias/) e Wimasis (https://www.wimasis.com/en/).
I dati di esempio presentati sono stati elaborati e analizzati utilizzando la piattaforma ImageJ. In breve, regioni specifiche nella cella, come l'apice della punta dell'hyphal o il setto, sono contrassegnate con strumenti di selezione dell'area considerevoli e l'intensità di tutti i pixel contenuti è letta con il software implementato "strumento di misurazione". I dati di intensità dei controlli e dei campioni sperimentali vengono trasferiti in un file di foglio di calcolo, analizzati matematicamente e preparati come grafico. Ulteriori dettagli possono essere trovati nelle pubblicazioni originali citate.
Dati di esempio 1: saggi di assorbimento FM 4-64
I campioni di funghi sono stati coltivati come colonie (passaggio 1.2) e montati con il metodo del blocco di agar invertito (passaggio 3.1). La concentrazione finale di FM 4-64 è stata di 1,67 m. Impostazioni di imaging: HCX PL APO 63x/1.3 NA obiettivo di immersione glicerolo su un microscopio a scansione laser confocale invertito (vedere la tabella dei materiali); FM 4-64 eccitazione a 488 nm ed emissione a 600-700 nm; un fotogramma al minuto per un massimo di 150 min.
Dati di esempio 2: colorazione co-colorazione FM 4-64 delle proteine di fusione fluorescente mirate ai compartimenti endocitici
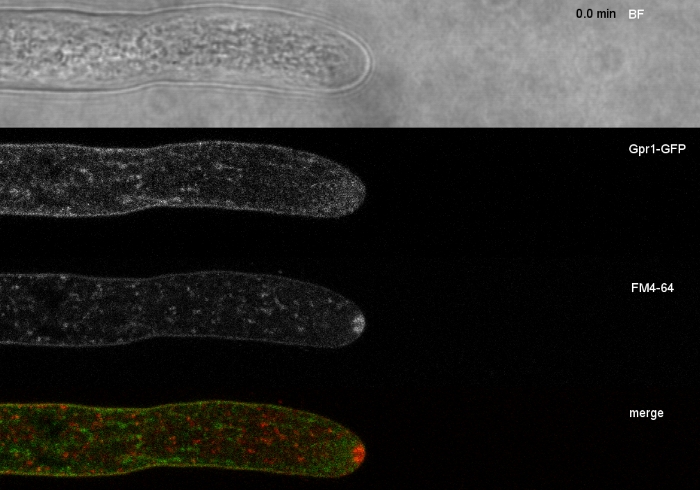
I campioni di funghi sono stati coltivati come colonie (passaggio 1.2) e montati con il metodo del blocco di agar invertito (passaggio 3.1). La concentrazione finale di FM 4-64 è stata di 2 o M. Impostazioni di imaging: CFI Piano Apo VC 60x/1.2 NA XC obiettivo di immersione dell'acqua su un microscopio a scansione laser confocale invertito (vedi Tabella dei materiali); Eccitazione GFP a 488 nm ed emissione a 500-530 nm, eccitazione FM 4-64 a 488 nm ed emissione a 600-700 nm, e campo luminoso con rilevatore di luce trasmesso, il tutto simultaneo; un fotogramma ogni 15 s per un massimo di 15 min. FM4-64 co-colorazione è stato impiegato per correlare la distribuzione subcellulare delle due proteine fluorescenti verdi potenziate (EGFP)-taggato proteine transmembrane Sfp2 e Gpr1 al percorso endocitico in T. atroviride (Figura 6, Film 3, Film 4).
Dati di esempio 3: co-colorazione FM 4-64 per l'identificazione delle differenze morfogenetiche
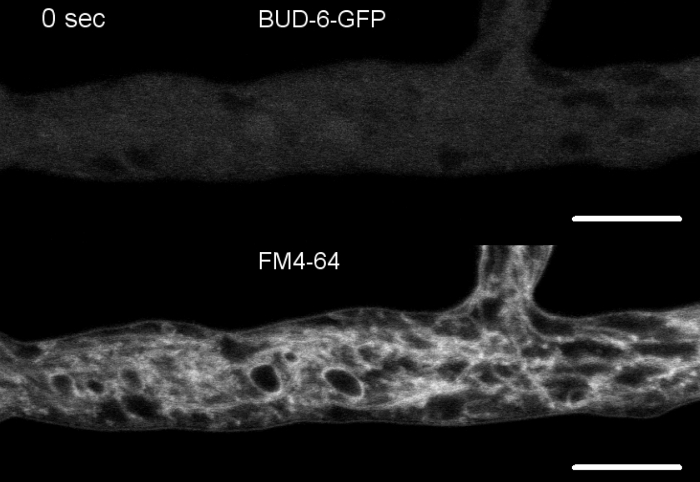
I campioni di funghi sono stati coltivati come colonie (passaggio 1.2) e montati con il metodo del blocco di agar invertito (passaggio 3.1). La concentrazione finale di FM 4-64 era di 2 m. Impostazioni di imaging: Plan Apochromat 63x/1.4 NA obiettivo di immersione dell'olio su un microscopio a scansione laser confocale invertito (vedi La Tabella dei Materiali); Eccitazione GFP a 488 nm ed emissione a 505-550 nm, eccitazione FM 4-62 a 488 nm ed emissione a 574–691 nm, e campo luminoso con rilevatore di luce trasmesso, il tutto simultaneo; un telaio ogni 8,5 s per un massimo di 15 min. FM4-64 co-colorazione ha permesso di mettere in relazione la dinamica di localizzazione subcellulare di proteine polarisomale BUD-6 etichettate fluorescenti per processi endosomiti dipendenti dal traffico, come la formazione di setti e la crescita polarizzata della punta dell'hyphal, e differenze caratterizzate nell'organizzazione subcellulare e nell'architettura iplenica tra tipo selvaggio e ceppi mutanti di N. crassa (Figura 7, Film 5).
Dati di esempio 4: La colorazione della parete cellulare rivela differenze morfogenetiche
I campioni di funghi sono stati coltivati come colonie (passaggio 1.2) e montati con il metodo del blocco di agar invertito (passaggio 3.1). Sono state utilizzate concentrazioni finali di 2 CFW, 20 SPF e 100 CR. Impostazioni di imaging: CFI Plan Apo VC 60x/1.2 NA XC obiettivo di immersione in acqua su un microscopio a scansione laser confocale invertito (vedi tabella dei materiali); CFW e SPF eccitazione a 405 nm ed emissione a 430-470 nm, eccitazione CR a 543 nm ed emissione a 580-620 nm. Le diverse proprietà di interazione di CFW, SPF e CR con polimeri a parete cellulare evidenziano le differenze morfogenetiche tra il mutantesfp2 e il ceppo wild type di T. atroviride9. L'aumento dello stress da parete cellulare inflitto da concentrazioni elevate di tinture si verifica più velocemente e più pronunciato nel mutante rispetto al tipo selvatico. Inoltre, le stesse immagini permettono di quantificare le differenze morfogenetiche per quanto riguarda il diametro della falange e la distanza settale tra entrambi i ceppi (Figura 8).
Dati di esempio 5: monitoraggio in tempo reale della biosintesi delle pareti cellulari
I germi sono stati coltivati come coltura liquida (passaggio 1.4) in micro-vetrini a 8 camere a camera (passaggio 3.2). L'ultima concentrazione di CFW è stata di 0,12 m. Impostazioni di imaging: CFI Plan Apo VC 60x/1.2 NA XC obiettivo di immersione dell'acqua su un microscopio a scansione laser confocale invertito; Escitation CFW a 405 nm ed emissione a 420-470 nm; un telaio ogni 20 s per un massimo di 35 min. La concentrazione molto bassa di CFW previene la saturazione della parete cellulare con molecole coloranti e consente il monitoraggio quantitativo in tempo reale della biosintesi delle pareti cellulari. Ciò rivela che la deposizione di nuovo materiale da parete cellulare non è uniforme, ma risponde molto rapidamente alle sollecitazioni fisiche localizzate derivanti dallo spostamento relativo di una cella dopo l'attacco cellulare prima della fusione germinale in N. crassa (Figura 9, Film 6).
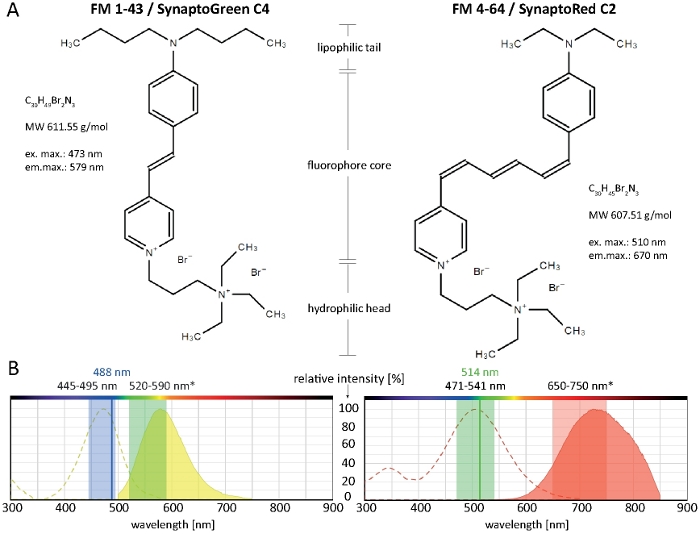
Figura 1: Proprietà biochimiche e biofisiche dei coloranti FM. (A) Strutture chimiche di FM 1-43/SynaptoGreen C4 e FM 4-64/SynaptoRed C2. (B) Gli spettri di assorbimento ed emissione di entrambi i coloranti FM, sovrapposti alle impostazioni di imaging ottimali per i coloranti legati alla membrana nei funghi filamentosi: 445-495 nm di luce blu ecciteranno FM 1-43 con un'efficienza del 100-80%, mentre 488 nm di un laser Argon ecciteranno il colorante con un'efficienza del 91%. A causa dello spostamento blu in seguito alla rilegatura della membrana, la gamma di rilevamento ottimale delle emissioni FM 1-43 è compresa tra 520-590 nm. Analogamente, le impostazioni di imaging ottimali per FM 4-64 nei funghi sono 471-541 nm (efficienza 100-80%), quando si utilizza una sorgente luminosa di eccitazione policromatica o 514 nm (99% di efficienza) quando si utilizza un laser Argon e 650-750 nm per il rilevamento della luce di emissione. Fare clic qui per visualizzare una versione più grande di questa figura.
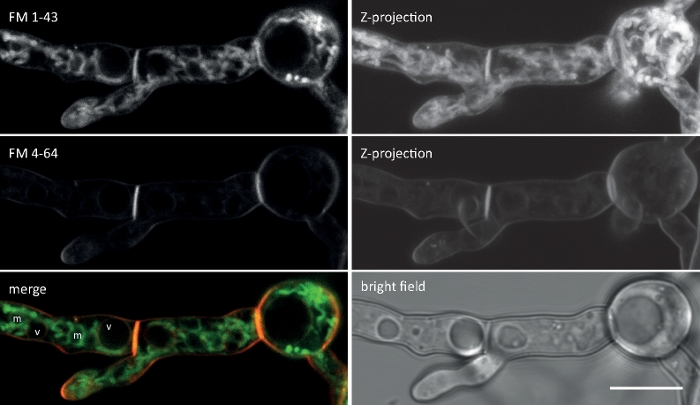
Figura 2: Co-imaging simultaneo di FM 1-43 e FM 4-64. Una miscela equimolare di entrambi i coloranti è stata aggiunta ad una coltura germinale liquida di N. crassa producendo una concentrazione finale di 10 M. A 25 min dopo l'aggiunta di coloranti, FM 1-43 ha macchiato la membrana plasmatica e già accumulato nelle membrane interne, tra cui mitocondri fortemente macchiati (m) ma in gran parte esclusi membrane vacuolare (v), ed è più di otto volte più forte rispetto all'FM 4-64 (intensità di fluorescenza media 176-21, rispettivamente), la cui idrofocia inferiore/idrofilo maggiore rallenta il suo tasso di internalizzazione portando ad un tempo prolungato nella membrana del plasma. Barra di scala : 10 m. Fare clic qui per visualizzare una versione più grande di questa figura.
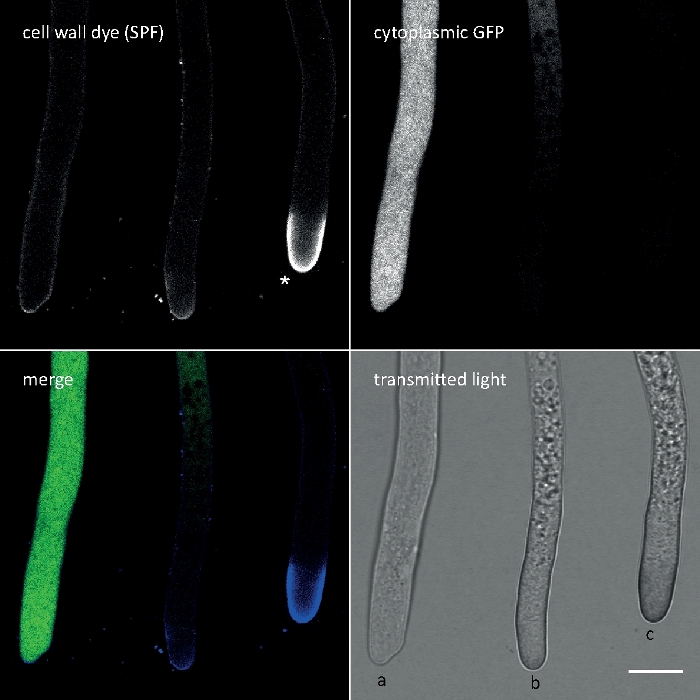
Figura 3: La deposizione indotta dallo stress della parete cellulare dei polimeri delle pareti cellulari nell'apice della punta spesso comporta l'autolisi cellulare. Le ife di T. atroviride che esprimono GFP citoplasmico sono state macchiate con 10 Flavine 7GFE 500 (SPF) e immagini immediatamente al montaggio. Hyphae non accentate (a), hyphae stressate con deposizione glucano/chitina leggermente aumentata all'apice e autolisi progressiva (b), e hyphae fortemente stressate con pronunciato tappo di glucano/chitina apicale (asterisco) e autolisi terminale (c) evidente dalla perdita totale di fluorescenza GFP e dall'ampia vacuolizzazione. Barra della scala: 10 m. Consultate Film 1 per la sequenza di corsi a tempo pieno. Si noti che i tre hyphae erano infatti situati uno accanto all'altro. Fare clic qui per visualizzare una versione più grande di questa figura.
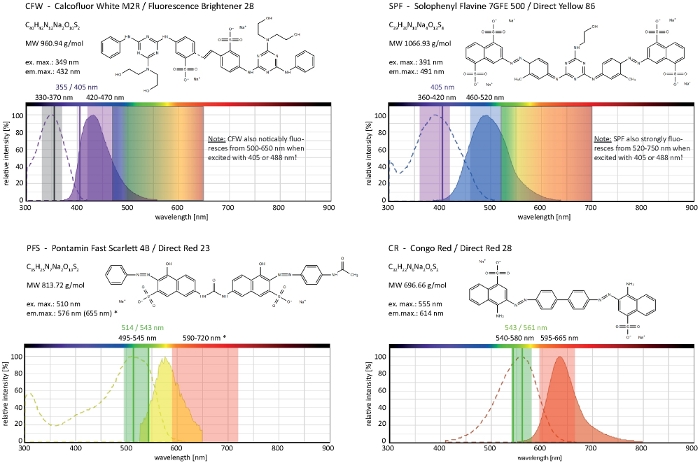
Figura 4: Proprietà biochimiche e biofisiche dei coloranti selettivi delle pareti cellulari. Le caratteristiche chimiche fornite sono quella dei sali di sodio di ogni tinri. Gli spettri di assorbimento ed emissione corrispondono a quelli in ambienti cellulari. Le linee di eccitazione laser monocromatica indicate (scritte a colori), gli intervalli di eccitazione policromatica applicabili per i microscopi a epifluorescenza e gli intervalli di rilevamento della luce di emissione sono quelli raccomandati per l'imaging di funghi filamentosi. Due linee di eccitazione laser sono indicate quando entrambe funzionano altrettanto bene. (*) Lo spettro di emissione del PFS legato a parete cellulare è significativamente più rosso di quanto indicato in precedenza33, tuttavia, con un ottimo rapporto S/N con concentrazioni di coloranti inferiori rispetto a quanto osservato in precedenza. Lo spettro completo di CR non è attualmente disponibile, da qui quello di Nilo Red (CAS N.: 7385-67-3) viene mostrato come la partita più vicina. Informazioni dettagliate sulle proprietà spettrali di CR sono disponibili altrove42. Fare clic qui per visualizzare una versione più grande di questa figura.
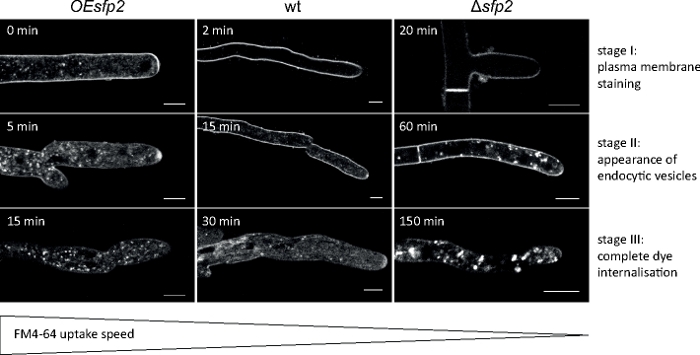
Figura 5: Influenza di Sfp2 sull'assorbimento endocitico di FM4-64. Tre fasi chiave successive di assorbimento del tintura FM sono facilmente distinguibili nel tipo selvaggio (wt). Fase I: colorazione esclusiva della membrana plasmatica, stadio II: prima apparizione del colorante FM in vesciche endocitiche e stadio III: colorazione esclusiva di vesciche e endocitarie. I modelli di colorazione equivalenti sono mostrati al più presto momento del loro aspetto. Rispetto al tipo selvaggio T. atroviride, l'endocitosi è leggermente accelerata nel mutante sfp2 sovra-espresso (OEsfp2), mentre l'assorbimento del colorante è drasticamente ritardato nel mutante di delezione sfp2 (zfp2). Per esempio, l'assorbimento del tinrito nella membrana plasmatica si verifica istantaneamente in OEsfp2 ma prende 2 min nel tipo selvaggio; e l'internalizzazione completa del coloranti FM dalla membrana plasmatica avviene 10 volte più velocemente in OEsfp2 rispetto asfp2. Barre della scala: 5 m. La figura è riprodotta da Atanasova et al.9 in accordo con la Creative Commons License (https://creativecommons.org/licenses/by/4.0/). Fare clic qui per visualizzare una versione più grande di questa figura.
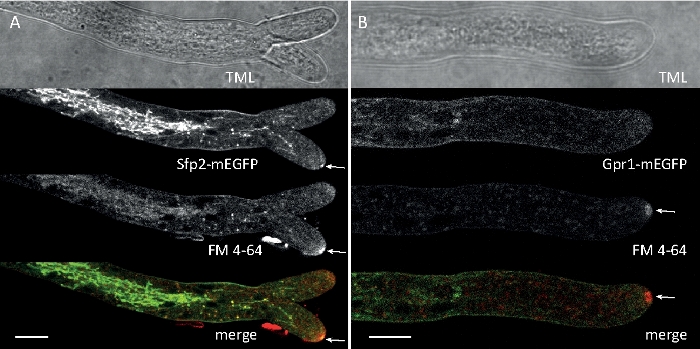
Figura 6: La co-colorazione delle proteine della membrana etichettata EGFP con FM 4-64 facilita la differenziazione delle distinte dinamiche di localizzazione subcellulare in T. atroviride. (A) La proteina di dominio a quattro transmembrane Sfp2 co-localizza con organelli etichettati FM4-64, tra cui la membrana plasmatica e il septa, lo Spitzenk-rper (Spk; freccia) e vacuoli tubolari presunti. (B) La proteina a sette trasmembrane gpCR Gpr1 co-localizza con FM4-64 agli stessi organelli di Sfp2, ad eccezione delle barre di scala Spk. Consultate Film 3 e Film 4 per sequenze di corsi a tempo pieno. La figura è stata modificata da Atanasova etal. 9 in accordo con la licenza Creative Commons. Fare clic qui per visualizzare una versione più grande di questa figura.
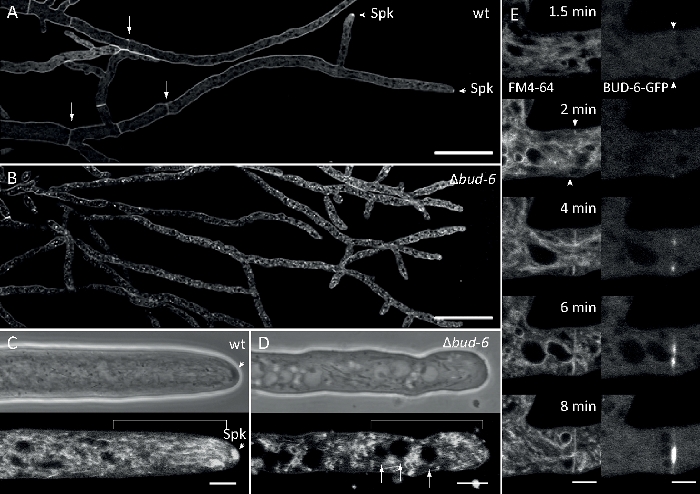
Figura 7: la colorazione FM 4-64 differenzia il mutantebud-6 da quello selvaggio e localizza il BUD-6 all'anello dello settal. (A) FM 4-64 colorazione di ife del tipo selvaggio N. crassa (le frecce indicano setti; punte di freccia indicano la spk). (B) Septa e Spk sono assenti in-bud-6. Barre di scala, 50 m. (C e D) Primo piano dell'apice e subapex hyphal di tipo selvaggio (C) e dibud-6 (D). Spk (freccia) differenzia nel tipo selvaggio, ma nonbud-6. Le parentesi quadre indicano la zona di esclusione nucleare non stabilita in :bud-6. Barre di scala - 5 m.(E)BUD-6-GFP reclutamento al sito di settazione incipiente precedendo l'invaginazione della membrana plasmatica (frecce) e accompagnamento costrizione settale. Barre della scala: 5 m. Consultate Film 5a e Film 5b per sequenze complete dei corsi temporali. La figura è stata riprodotta con modifiche da Lichius et al.16 in accordo con la Licenza Creative Commons. Fare clic qui per visualizzare una versione più grande di questa figura.
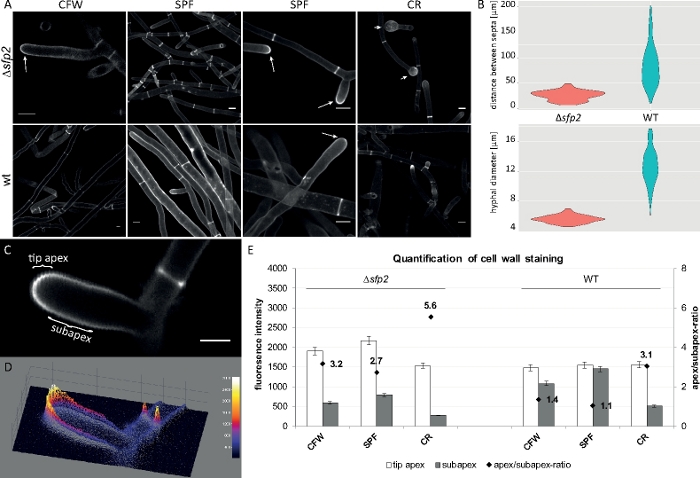
Figura 8: L'eliminazione di sfp2 modifica il modello di deposizione del materiale della parete cellulare e colpisce la morfogenesi sagofale di T. atroviride. (A) La colorazione CFW e SPF rivela un aumento della deposizione della parete cellulare infp2 (frecce) rispetto al tipo selvaggio (wt). La colorazione CR induce un ampio gonfiore della punta solo in ,sfp2 (punte di freccia). Le barre di scala (10m. ( B ) I difetti morfogenetici nella sezionesfp2 includono distanze settali significativamente ridotte (z2s2 x 26,0 m, tipo selvaggio - 85 m; n - 60; ANOVA Pr < 2-16) e diametri imenceali più piccoli(z) sfp2 , 5,6, tipo selvaggio: 12,6 m; n - 100; ANOVA Pr <2-16). (C) Aumento della fluorescenza del tinrito nell'apice della mancia rispetto al subapex. Barra della scala - 5 m.(D)Grafico della superficie 3D con codifica di intensità di (C). (E) Quantificazione delle intensità di fluorescenza relativa nel tiposfp2 e nel tipo selvaggio (n - 55). La figura è stata riprodotta da Atanasova etal. Fare clic qui per visualizzare una versione più grande di questa figura.
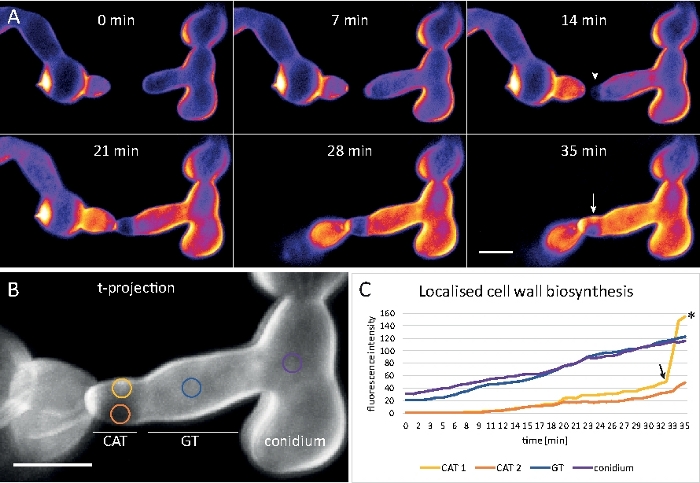
Figura 9: Monitoraggio in tempo reale della biosintesi delle pareti cellulari. (A) Fusione del tubo anastomosi conidiale (CAT) tra germi di N. crassa. Il contatto fisico diventa evidente dalla risposta alla coppia germinante (21-28 min). La fluorescenza CFW codificata a colori in intensità indica le regioni con poca deposizione della parete cellulare (blu scuro) e intensa (giallo). La punta inizialmente incontaminata (punta di freccia), deposita nuovo materiale della parete cellulare al contatto con la punta e nell'area che sperimenta la maggiore sollecitazione fisica (freccia). Barra della scala: 5 m. Consultate Film 6 per la sequenza di corsi a tempo pieno. Figura riprodotta da38 con autorizzazione. (B) Proiezione di (A) che indica quattro regioni circolari in cui sono state misurate le intensità di fluorescenza. Barra della scala: 5 m. (C) Stampa delle regioni indicate che mostrano il rapido aumento della biosintesi della parete cellulare localizzata in risposta allo stress fisico (CAT 1, freccia). Nel tubo germinale (GT) e nel corpo delle spore (conidio), la biosintesi delle pareti cellulari aumenta costantemente. Fare clic qui per visualizzare una versione più grande di questa figura.
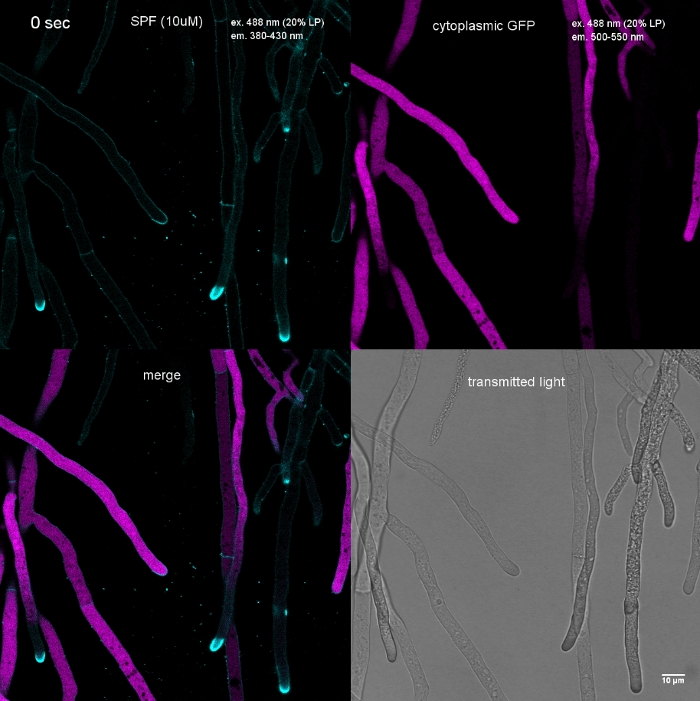
Film 1: Stress da parete cellulare indotta da tinzioni. Sono stati aggiunti a T. atroviride hyphae che esprimevano GFP citoplasmico (magenta). L'ampia colorazione della punta si verifica immediatamente, seguita dalla rapida lisi dei compartimenti della falange entro 2 min; evidente dalla scomparsa della fluorescenza GFP. Clicca qui per scaricare questo film.
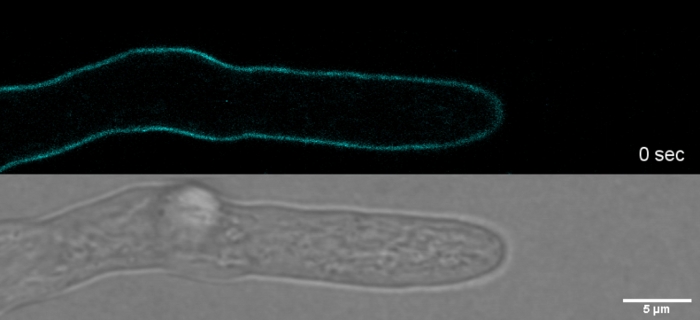
Film 2: Colorazione Vital SPF. 2 SPF (ciano) permettono di monitorare la crescita della punta di T. atroviride hyphae con alta risoluzione spaziale e temporale senza indurre artefatti di stress della parete cellulare sull'apice della punta. Clicca qui per scaricare questo film.
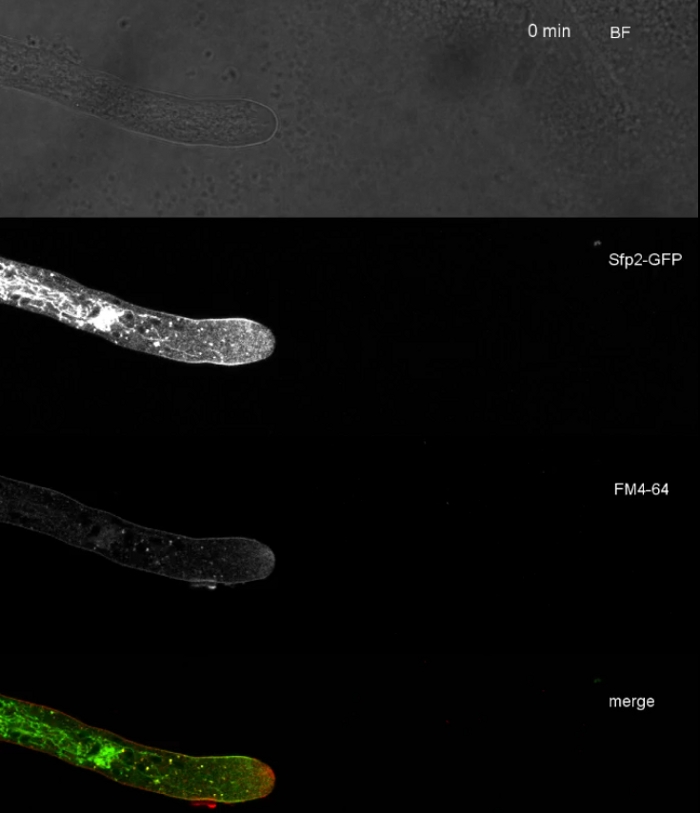
Film 3: FM 4-64 co-colorazione di Sfp2-GFP. La co-colorazione di T. atroviride che esprime Sfp2-mEGFP (verde) con 1,67 M FM 4-64 (rosso) rivela la sovrapposizione e la distinta localizzazione della proteina della membrana con il percorso endocitico. Clicca qui per scaricare questo film.
Film 4: FM 4-64 co-colorazione di Gpr1-GFP. La co-colorazione di T. atroviride che esprime Gpr1-mEGFP (verde) con 1,67 M FM 4-64 (rosso) rivela la sovrapposizione e la distinta localizzazione della proteina della membrana con il percorso endocitico. Clicca qui per scaricare questo film.
Film 5: FM 4-64 co-colorazione di BUD-6-GFP. (5a) La co-colorazione di N. crassa che esprime il BUD-6-GFP (verde) con 2 M FM 4-64 (rosso) consente di tracciare le dinamiche del BUD-6 durante la formazione del setto rispetto all'invaginazione della membrana plasmatica associata. (5b) Immagine ritagliata e di unione di (5a). Clicca qui per scaricare Movie 5a
Clicca qui per scaricare Movie 5b.
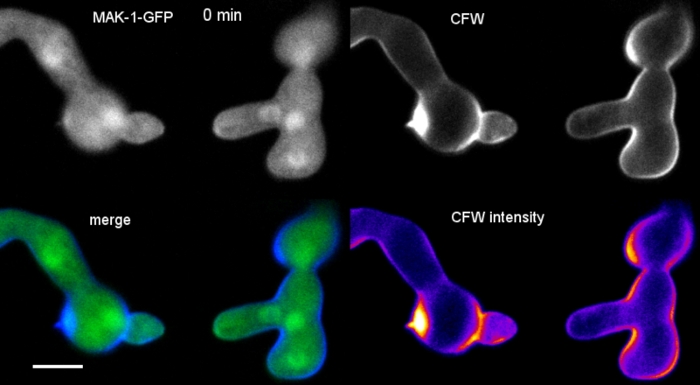
Film a 6: Monitoraggio in tempo reale della biosintesi delle pareti cellulari. N. crassa germlings esprimendo MAK-1-GFP (verde) sono stati co-macchiati con 0,12 CFW (blu) per rivelare la biogenesi della parete cellulare localizzata durante la fusione germinale mediata da CAT. Si noti che c'è un po 'di smarginatura del segnale CFW nei canali GFP, che illustrano che SPF o CR sono scelte migliori come coloranti di co-imaging sequenziali e simultanei per GFP, rispettivamente. Clicca qui per scaricare questo film.
Tabella 1: Proprietà dei coloranti fluorescenti selettivi a membrana e a parete cellulare. Valori di mg/mL corretti per la riduzione della purezza/contenuto di tintura per ottenere equimolarità in tutte le soluzioni; n.i.a. - nessuna informazione disponibile. Fare clic qui per scaricare questa tabella.
Discussione
Questo articolo continua il lavoro all'avanguardia che ha stabilito l'uso di varie coloranti fluorescenti come marcatori di orgelli vitali per funghi filamentosi nei primi anni 2 0002,4,43, e tenta di discutere le proprietà biologiche fotofisiche e cellulari di coloranti FM e coloranti cellulari selezionati in modo più dettagliato rispetto a prima. Soprattutto per quanto riguarda gli effetti cellulari indesiderati, come la saturazione della membrana o danni alla parete cellulare, che si verificano al di sopra di alcune concentrazioni di tintura. Ciò che in precedenza è stato considerato non tossico a livello cellulare è ora considerato tossico a livello molecolare. Anche se questi effetti potrebbero essere molto sottili e non direttamente evidenti da ovvi cambiamenti nell'organello o nel comportamento cellulare, qualsiasi possibile interferenza dell'applicazione dei coloranti diversa dalla visualizzazione deve essere ridotta al minimo per lo studio della funzione molecolare nativa. Fortunatamente, una migliore sensibilità e l'efficienza quantistica dei rilevatori moderni, come i rilevatori fotodiode di valanghe di silicio (Si-ASP)44 o il rilevatore dell'area Airyscan45, facilitano l'uso di quantità di coloranti ancora più basse rispetto a prima. Un altro obiettivo chiave dell'articolo è quello di esemplificare le proprietà di co-imaging di questi coloranti con altri fluorofori, soprattutto quelli della GFP come proteina fluorescente più frequentemente utilizzata in biologia. Questo dovrebbe aiutare la progettazione di esperimenti di imaging che mirano a correlare la dinamica di localizzazione subcellulare delle proteine di fusione fluorescente a quelle della parete cellulare fungina, della membrana plasmatica o del percorso di endo e esocitosi ecc.
L'imaging in condizioni naturali e senza stress è fondamentale per l'acquisizione di dati affidabili. Alcune considerazioni pratiche relative alla preparazione di medie e campioni di coltura mirano a fornire un punto di partenza per trovare le condizioni ottimali che consentono l'osservazione senza artefatti e a lungo tempo di cellule sane e non stressate con il più alto rapporto S/N possibile per ogni dato campione. Non esiste un modo universale per ottenere risultati di imaging affidabili e significativi. È inerente all'approccio che la variazione biologica del campione, la soggettività e le aspettative del microscopista, così come la post-elaborazione dell'immagine hanno un'influenza significativa sull'acquisizione e l'interpretazione dei dati, rispettivamente. Quindi, l'esperienza pratica del microscopista, la sua conoscenza intima della biologia cellulare del fungo in esame, così come la preparazione abile del campione per creare condizioni il più "naturali" e indisturbate possibile in un ambiente di laboratorio, sono di primaria importanza per l'acquisizione e la valutazione di dati di imaging che riflettono sinceramente i fenomeni cellulari studiati. Come regola generale, il verificarsi di effetti collaterali indesiderati dei coloranti fluorescenti, che vanno dall'attivazione sottile e quindi non ovviamente visibile della membrana plasmatica o dei percorsi di risposta allo stress della parete cellulare alla semplice induzione citotossici dell'autolisi cellulare, può essere evitata in modo sicuro solo applicando basse concentrazioni di coloranti .
L'applicazione di coloranti fluorescenti è semplice, ma le loro specificità sono scarsamente caratterizzate. Un punto chiave dell'utilizzo di coloranti fluorescenti è la semplicità seriente dei protocolli sperimentali. La coltivazione e il campionamento del fungo, l'aggiunta del/dei tinri' e il montaggio sullo stadio del microscopio sono (con pratica) semplici. La regolazione delle impostazioni di base dell'imaging, comprese le lunghezze d'onda di eccitazione ed emissione, i tempi di esposizione, le impostazioni dei corsi temporali ecc., seguono semplici regole biofisiche del microscopio e le regole biologiche dei coloranti fluorescenti usati all'interno delle cellule. La Tabella 1 intende sostenere l'identificazione della combinazione di tinture o tinture più adatta per la sperimentazione. Inoltre, i coloranti fluorescenti hanno un prezzo ragionevole, sono facilmente disponibili con un'elevata qualità affidabile e garantiscono quindi un'applicazione altamente riproducibile.
Due importanti restrizioni dell'uso di coloranti fluorescenti selettivi a membrana o a parete cellulare sono la conoscenza (spesso) limitata delle loro precise proprietà di colorazione, che nella maggior parte dei casi non sono specifiche a livello di organello e molecolare, e dei loro effetti collaterali indesiderati dipendenti dalla concentrazione. I coloranti FM sono specifici per i bistrati lipidici che partecipano all'endo- e all'esocitosi. Tuttavia, con precisione quali organelli subcellulari vengono etichettati successivamente in condizioni testate non è immediatamente evidente e richiede il confronto di diverse varianti di colorante FM e la co-etichettatura con ulteriori marcatori specifici dell'organello. La preferenza di FM 1-43 per le membrane mitocondriali, rispetto a FM 4-64, ne è un esempio. I coloranti selettivi delle pareti cellulari mostrano una specificità variabile per i tre principali polimeri della parete cellulare fungina. La CFW è ritenuta una macchia non specifica per i glucani e la chitina z, la SPF è ritenuta la più selettiva per i z-1,4-glucani, e la CR è considerata altamente selettiva per le chitine . Attualmente non sono disponibili informazioni sulla specificità di legame della PFS ai polisaccaride a parete cellulare fungina. A quale rapporto quale polimero della parete fungina è etichettato in modo più efficace ad una data concentrazione di tintura nelle specie fungine in esame non è facilmente risposto, e l'applicazione di misurazioni dettagliate acquisite in vitro o in vivo in altri organismi o altre specie fungine deve essere considerata con molta attenzione. Purtroppo, queste informazioni sono scarse e altamente sparsi nella letteratura35,42,46. I documenti più recenti che seguirebbero gli studi precedenti33 per fornire nuove informazioni sulle precise proprietà di colorazione dei coloranti in primo piano specificamente nei funghi non sono attualmente disponibili.
I controlli di imaging sono essenziali per valutare con precisione i modelli di colorazione e le risposte cellulari. Probabilmente la parte più impegnativa, tuttavia, è conoscere la biologia cellulare del fungo così bene che i cambiamenti registrati nella localizzazione subcellulare di coloranti fluorescenti selettivi a membrana e parete cellulare, alterazioni nell'architettura cellulare o modello di crescita dell'hyphal possono essere esclusivamente e con fittamente correlate agli effetti previsti del trattamento sperimentale. Per questo, è fondamentale avere buoni controlli insieme a qualsiasi nuovo esperimento di imaging a cellule vive. Questi includono il tipo selvatico non trattato come controllo di imaging negativo per escludere l'autofluorescenza di fondo e il rumore del rivelatore dall'immagine acquisita e per avere un comparatore morfologico quando si lavora con i mutanti. Inoltre, un controllo di imaging positivo, ad esempio un ceppo che esprime GFP o RFP nel citoplasma o in un'altra proteina del marcatore fluorescente ben nota, è essenziale per impostare l'intensità della luce di eccitazione al minimo richiesto e avere un controllo della vitalità cellulare. Una volta impostati questi controlli, l'uso di coloranti fluorescenti non è limitato solo alle attività di visualizzazione, ma le loro dinamiche di colorazione dipendenti dalla concentrazione, così come gli effetti collaterali dipendenti dalla concentrazione possono essere sfruttati analiticamente; ad esempio, per monitorare quantitativamente la biosintesi delle pareti cellulari in tempo reale o per l'identificazione di fenotipi specifici dei mutanti nei saggi di suscettibilità47.
Il miglioramento delle applicazioni future dipende da un'analisi funzionale dettagliata delle proprietà di colorazione. Una grande sfida continua è quella di migliorare e automatizzare ulteriormente le analisi quantitative dell'immagine al fine di far avanzare la valutazione funzionale della dinamica subcellulare dei coloranti fluorescenti selettivi della membrana e della parete cellulare nei funghi filamentosi. Per questo, sono necessari per la prima volta studi estensivi e quantitativi di co-localizzazione di questi coloranti con marcatori noti di organelle e polimeri a parete cellulare in combinazione con ceppi mutanti carenti in particolari percorsi di trasporto o che mancano di componenti strutturali specifici. Diversi marcatori di endocitosi per analisi comparative con coloranti FM sono disponibili48,49, e per quanto riguarda le specificità di legame ancora poco caratterizzate di coloranti per pareti cellulari nei funghi, l'applicazione di anticorpi glucici specifici di formato fluorescente50 potrebbe fornire una possibilità per affrontare questo problema.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti e nulla da divulgare.
Riconoscimenti
Grazie al Fondo scientifico tirolese (TWF) per aver fornito sovvenzioni #256524 alla AL, al Vienna Science and Technology Fund (WWTF) per aver fornito sovvenzioni #LS13-086 a S , e al Fondo di pubblicazione dell'Università di Innsbruck per sostenere la pubblicazione ad accesso aperto. Gli autori ringraziano anche il Dipartimento di zoologia dell'Università di Innsbruck per aver fornito il microscopio a scansione laser confocale Leica TCS SP5 II.
Materiali
| Name | Company | Catalog Number | Comments |
| BRAND cell counting chamber | Merck | BR718005 | Thoma format |
| Calcofluor White M2R | Merck/Sigma-Aldrich | F3543 | cell wall dye |
| CFI Plan Apo VC 60x/1.2 NA XC WI | Nikon | MRD07602 | water immersion objective |
| CFI Plan Apo VC 60x/1.2 NA XC WI | Nikon | MRD07602 | water immersion objective |
| Congo Red | Merck/Sigma-Aldrich | C6277 | cell wall dye |
| Dimethyl sulfoxide | VWR | 8,36,73,230 | organic solvent |
| Eclipse TE2000-E with C1 scanning unit | Nikon | custom configuration | inverted laser scanning confocal microscope used to acquire example data 2 and 4 |
| Eclipse TE2000-U with Bio-Rad Radiance 2100 scannig unit | Nikon | custom configuration | inverted laser scanning confocal microscope used to acquire example data 5 |
| FM 1-43 | Merck/Sigma-Aldrich | S6814 | membrane dye |
| FM 4-64 | Merck/Sigma-Aldrich | S6689 | membrane dye |
| Glass beads | Rettberg | 1340691030 | 3 mm glass beads |
| Glass cover slips | Thermo Fisher Scientific | BB02400600A113MNT0 | 24 x 60 # 1 glass cover slips |
| HCX PL APO 63x/1.3 NA Glyc | Leica | 15506353 | glycerol immersion objective |
| LSM 510 Meta | Zeiss | custom configuration | inverted laser scanning confocal microscope used to acquire example data 3 |
| M9 Minimal Medium | Merck/Sigma-Aldrich | M6030 | generic fungal growth medium |
| Micro-slide 8-well | ibidi | 80826 | ibiTreat #1.5 polymer coverslip |
| Miracloth | Merck/Millipore | 475855-1R | polyester filtration material |
| Petri dish | Sarstedt | 8,21,472 | 92 x 16 mm culture dish w/o cams |
| Phytagel | Merck/Sigma-Aldrich | P8169 | transparent gelling agent |
| Plan Apochromat 63x/1.4 NA Oil DIC | Zeiss | 440762-9904-000 | oil immersion objective |
| Pontamine Fast Scarlet 4B | Merck/Sigma-Aldrich | 212490 | cell wall dye |
| Potato Dextrose Agar (PDA) | BD Difco | 213400 | fungal growth medium for T. atroviride |
| Potato Dextrose Broth (PDB) | BD Difco | 254920 | fungal growth medium for T. atroviride |
| Reaction tube | Sarstedt | 72,706 | 1.5 mL SafeSeal tube |
| Scalpel | B.Braun | 5518016 | Cutfix sterile scalpel #23 |
| Screw cap tube | Sarstedt | 6,25,54,502 | 15 mL polypropylene tube |
| Solophenyl Flavine 7GFE 500 | CIBA | 1485385V6 | cell wall dye |
| SynaptoGreen C4 | Biotum | 70020 | membrane dye |
| SynaptoRed C2 | Biotum | 70021 | membrane dye |
| Syringe membrane filter | Thermo Fisher Scientific | 723-9945 | 0.45 µm SFCA syringe filter |
| TCS SP5 II | Leica | custom configuration | inverted laser scanning confocal microscope used to acquire example data 1 |
| Vogel's Minimal Medium (VMM) | FGSC | Fungal Genetics Stock Centre | fungal growth medium for N. crassa |
Riferimenti
- Read, N. D., Fischer, S., Parton, R. M. Imaging Spitzenkörper, pH and calcium dynamics in growing fungal hyphae. Pesticide Science. 54 (2), 179-181 (1998).
- Hickey, P. C., Swift, S. R., Roca, M. G., Read, N. D. Live-cell imaging of filamentous fungi using vital fluorescent dyes and confocal microscopy. Microbial Imaging. , 63-87 (2004).
- Jelínková, A., et al. Probing plant membranes with FM dyes: tracking, dragging or blocking. The Plant Journal. 61 (5), 883-892 (2010).
- Fischer-Parton, S., et al. Confocal microscopy of FM4-64 as a tool for analysing endocytosis and vesicle trafficking in living fungal hyphae. Journal of Microscopy. 198 (3), 246-259 (2000).
- Harris, S. D. Branching of fungal hyphae: regulation, mechanisms and comparison with other branching systems. Mycologia. 100 (6), 823-832 (2008).
- Roca, M. G., Arlt, J., Jeffree, C. E., Read, N. D. Cell biology of conidial anastomosis tubes in Neurospora crassa. Eukaryotic Cell. 4 (5), 911-919 (2005).
- Becker, Y., et al. The fungal cell-wall integrity MAPK cascade is crucial for hyphal network formation and maintenance of restrictive growth of Epichloë festucae in symbiosis with Lolium perenne. Molecular Plant-Microbe Interactions. 28 (1), 69-85 (2015).
- Justa-Schuch, D., Heilig, Y., Richthammer, C., Seiler, S. Septum formation is regulated by the RHO4-specific exchange factors BUD3 and RGF3 and by the landmark protein BUD4 in Neurospora crassa. Molecular Microbiology. 76 (1), 220-235 (2010).
- Atanasova, L., et al. The Gpr1-regulated Sur7 family protein Sfp2 is required for hyphal growth and cell wall stability in the mycoparasite Trichoderma atroviride. Scientific Reports. 8 (1), 12064 (2018).
- Betz, W. J., Mao, F., Bewick, G. S. Activity-dependent fluorescent staining and destaining of living vertebrate motor nerve terminals. Journal of Neuroscience. 12 (2), 363-375 (1992).
- Wu, Y., Yeh, F. L., Mao, F., Chapman, E. R. Biophysical characterization of styryl dye-membrane interactions. Biophysical Journal. 97 (1), 101-109 (2009).
- Betz, W. J., Mao, F., B, S. C. Imaging exocytosis and endocytosis. Current Opinion in Neurobiology. 6, 365-371 (1996).
- Hoopmann, P., Rizzoli, S. O., Betz, W. J. Imaging synaptic vesicle recycling by staining and destaining vesicles with FM dyes. Cold Spring Harbor Protocols. 2012 (1), 77-83 (2012).
- Bolte, S., et al. FM-dyes as experimental probes for dissecting vesicle trafficking in living plant cells. Journal of Microscopy. 214, 159-173 (2004).
- Riquelme, M., et al. Spitzenkorper localization and intracellular traffic of green fluorescent protein-labeled CHS-3 and CHS-6 chitin synthases in living hyphae of Neurospora crassa. Eukayotic Cell. 6 (10), 1853-1864 (2007).
- Lichius, A., Yáñez-Gutiérrez, M. E., Read, N. D., Castro-Longoria, E. Comparative live-cell imaging analyses of SPA-2, BUD-6 and BNI-1 in Neurospora crassa reveal novel features of the filamentous fungal polarisome. PloS one. 7 (1), 30372 (2012).
- Peñalva, M. A. Tracing the endocytic pathway of Aspergillus nidulans with FM4-64. Fungal Genetics and Biology. 42 (12), 963-975 (2005).
- Dijksterhuis, J., Molenaar, D. Vesicle trafficking via the Spitzenkörper during hyphal tip growth in Rhizoctonia solani. Antonie van Leeuwenhoek. 103 (4), 921-931 (2013).
- Hickey, P. C., Read, N. D. Imaging living cells of Aspergillus in vitro. Medical Mycology. 47, 110-119 (2009).
- Delgado-Álvarez, D. L., Bartnicki-García, S., Seiler, S., Mouriño-Pérez, R. R. Septum development in Neurospora crassa: the septal actomyosin tangle. PLoS One. 9 (5), 96744 (2014).
- Hageage, G. J., Harrington, B. J. Use of Calcofluor White in clinical mycology. Laboratory Medicine. 15 (2), 109-112 (1984).
- Monheit, J. E., Cowan, D. F., Moore, D. G. Rapid detection of fungi in tissues using Calcofluor White and fluorescence microscopy. Archives of Pathology and Laboratory. 108 (8), 616-618 (1984).
- Herth, W., Schnepf, E. The fluorochrome Calcofluor White binds oriented to structural polysaccharide fibrils. Protoplasma. 105 (1-2), 129-133 (1980).
- Elorza, M. V., Rico, H., Sentandreu, R. Calcofluor White alters the assembly of chitin fibrils in Saccharomyces cerevisiae and Candida albicans cells. Journal of General Microbiology. 129 (5), 1577-1582 (1983).
- Lagorce, A., et al. Genome-wide analysis of the response to cell wall mutations in the yeast Saccharomyces cerevisiae. Journal of Biological Chemistry. 278 (22), 20345-20357 (2003).
- Sanz, A. B., García, R., Rodríguez-Peña, J. M., Arroyo, J. The CWI Pathway: regulation of the transcriptional adaptive response to cell wall stress in yeast. Journal of Fungi. 4 (1), (2017).
- Slifkin, M., Cumbie, R. Congo Red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Michels, J., Büntzow, M. Assessment of Congo Red as a fluorescence marker for the exoskeleton of small crustaceans and the cuticle of polychaetes. Journal of Microscopy. 238 (2), 95-101 (2010).
- Pancaldi, S., Poli, F., Dall'Olio, G., Vannini, G. L. Morphological anomalies induced by Congo Red in Aspergillus niger. Archives of Microbiology. 137 (3), 185-187 (1984).
- Roncero, C., Durán, A. Effect of Calcofluor White and Congo Red on fungal cell wall morphogenesis: in vivo activation of chitin polymerization. Journal of Bacteriology. 163 (3), 1180-1185 (1985).
- Kopeck, M., Gabriel, M. The influence of Congo Red on the cell wall and (1,3)- β-d-glucan microfibril biogenesis in Saccharomyces cerevisiae. Archives of Microbiology. 158 (2), 115-126 (1992).
- Heilmann, C. J., et al. Surface stress induces a conserved cell wall stress response in the pathogenic fungus Candida albicans. Eukayotic Cell. 12 (2), 254-264 (2013).
- Hoch, H. C., Galvani, C. D., Szarowski, D. H., Turner, J. N. Two new fluorescent dyes applicable for visualization of fungal cell walls. Mycologia. 97 (3), 580-588 (2005).
- Liesche, J., Ziomkiewicz, I., Schulz, A. Super-resolution imaging with Pontamine Fast Scarlet 4BS enables direct visualization of cellulose orientation and cell connection architecture in onion epidermis cells. BMC Plant Biology. 13, 226 (2013).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Knight, N. L., Sutherland, M. W. A rapid differential staining technique for Fusarium pseudograminearum in cereal tissues during crown rot infections. Plant Pathology. 60 (6), 1140-1143 (2011).
- Fajardo-Somera, R. A., et al. Dissecting the function of the different chitin synthases in vegetative growth and sexual development in Neurospora crassa. Fungal Genetics and Biology. 75, 30-45 (2015).
- Lichius, A. . Cell Fusion in Neurospora crassa. , (2010).
- Chen, W., Li, W., Dong, X., Pei, J. A Review of Biological Image Analysis. Current Bioinformatisc. 13 (4), 337-343 (2018).
- Goldman, R. D., Swedlow, J., Spector, D. L. . Live cell imaging: A laboratory manual. , (2010).
- Eliceiri, K. W., et al. Biological imaging software tools. Nature methods. 9 (7), 697-710 (2012).
- Zemanek, G., Jagusiak, A., Chłopaś, K., Piekarska, B., Stopa, B. Congo Red fluorescence upon binding to macromolecules - a possible explanation for the enhanced intensity. Bio-Algorithms and Med-Systems. 13 (2), 1187 (2017).
- Hickey, P. C., Jacobson, D. J., Read, N. D., Louise Glass, N. Live-cell imaging of vegetative hyphal fusion in Neurospora crassa. Fungal Genetics and Biology. 37 (1), 109-119 (2002).
- . Hamamatsu Si APD - high sensitivity photodiodes having an internal gain mechanism: Avalanche photodiode selection guide 2019 Available from: https://www.hamamatsu.com/resources/pdf/ssd/si_apd_kapd0001e.pdf (2019)
- Huff, J. The Airyscan detector from ZEISS: confocal imaging with improved signal-to-noise ratio and super-resolution. Nature Methods. 12, 1205 (2015).
- Thomas, J., Idris, N. A., Collings, D. A. Pontamine Fast Scarlet 4B bifluorescence and measurements of cellulose microfibril angles. Journal of Microscopy. 268 (1), 13-27 (2017).
- Ram, A. F. J., Klis, F. M. Identification of fungal cell wall mutants using susceptibility assays based on Calcofluor White and Congo Red. Nature Protocols. 1 (5), 2253-2256 (2006).
- Toshima, J. Y., et al. Spatial dynamics of receptor-mediated endocytic trafficking in budding yeast revealed by using fluorescent alpha-factor derivatives. Proceedings of the National Academy of Science of the USA. 103 (15), 5793-5798 (2006).
- Kilaru, S., Schuster, M., Latz, M., Guo, M., Steinberg, G. Fluorescent markers of the endocytic pathway in Zymoseptoria tritici. Fungal Genetics and Biology. 79, 150-157 (2015).
- Fu, C., Tanaka, A., Free, S. J. Neurospora crassa 1,3-α-glucan synthase, AGS-1, is required for cell wall biosynthesis during macroconidia development. Microbiology. 160, 1618-1627 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon