Method Article
膜和细胞壁选择性荧光染料在丝状真菌活细胞成像中的应用
摘要
生命荧光染料是现代真菌细胞生物学中活细胞成像分析的重要工具。本文详细介绍了已建立的和鲜为人知的荧光染料在丝状真菌中跟踪血浆膜动力学、内膜/外细胞化和细胞壁形态发生中的应用。
摘要
膜和细胞壁选择性荧光染料在真菌细胞中细胞动力学活细胞成像分析中的应用始于20年前,自那时以来,继续极大地有助于我们理解丝状真菌生活方式。本文为两种膜染料FM 1-43和FM 4-64以及四个细胞壁染色剂的利用提供了实用指南,其中氟化剂白M2R、索洛芬片7GFE 500、庞他明快速猩红48和刚果红。重点是其低剂量应用,以确定无成色、其共成像特性及其定量评估。所述方法适用于所有可以所述方式制备的丝状真菌样本。基本的染色方法可以作为适应可能需要不同种植条件的物种的起点。首先,生物物理和生物化学特性被审查,因为他们的理解是必不可少的使用这些染料作为真正重要的荧光染色剂。其次,提出了分步方案,详细介绍了荧光活细胞成像的各种真菌样本类型的制备。最后,示例实验说明了不同的方法:(1) 识别基因突变体内分泌物的分泌物的时空组织的缺陷,(2) 相对地描述 GFP 标记靶蛋白的共享和独特的共同定位在内分泌途径中,(3)识别基因突变体中的形态遗传细胞壁缺陷,(4)实时监测细胞壁生物发生。
引言
二十年前,膜选择性荧光荧光飞毛染料FM 4-641的应用彻底改变了透明形态生成和底层分子细胞生物学在丝状真菌中可视化的方式。后来,将结扣染料Calcofluor白作为真菌细胞壁动力学的重要荧光标记物的益处得以实现2。自那时以来,染料及其变种已成为真菌中细胞动力学活细胞成像分析的固有部分,并继续为丝状真菌生活方式提供前所未有的见解。本文详细介绍了已建立的和鲜为人知的荧光染料在丝状真菌中跟踪血浆膜动力学、内膜和外泄和细胞壁形态发生的应用。内分泌追踪测定允许解决与内分泌的一般研究有关的各种细胞生物学问题3。为此,在FM染料添加时,染色隔间的定位、速度和连续记录通过时差显微镜和定量比较被测真菌菌株4。细胞壁染料划定细胞的外边界,并允许跟踪形态遗传事件,包括极化子宫尖端生长2,子宫分支5,子宫融合6,7和隔膜形成8。此外,它们还有助于局部细胞壁沉积的定量和细胞壁生物发生过程中缺陷的识别。由于对任何荧光标记物的生化和生物物理特性的深入了解是其成功在体内应用的基本先决条件,因此本文首先总结了本文中介绍的六种染料的这些特性。
膜选择性染料
FM(飞毛)二甲苯染料是小的两栖分子,不能通过,但可逆地与生物膜10脂质双层的外层有关。它们在水溶液中几乎是非荧光的,但在等离子膜集成后变得强烈荧光,产生出色的信噪比11。这些特性使它们非常适合可视化血浆膜和细胞内细胞内动力学,包括跟踪内泌和外泌体分泌12。绿色荧光FM 1-43和红色荧光FM 4-64是两个最广泛使用的荧光膜标记。SynaptoGreen C4 和 SynaptoRed C2 是来自替代供应商的通用分子,可互换使用,而不是分别使用 FM 1-43 和 FM 4-64。
Styryl 染料包括三个关键结构区域:(1) 促进染料插入脂质双层的亲脂性尾部;(2) 确定染料光谱特性的荧光度芯,由两个芳香环组成,由一到三个双键连接;(3) 带正电荷的亲水头,可防止染料通过膜完全插入和渗透(图1A)。
嗜脂性尾巴越长,染料的疏水性越高,因此与膜结合亲和力越强,但其水溶性和膜脱污率越低。因此,不同的FM染料变种产生不同的染色动力学和图案。C4 尾 FM 1-43 的更高的疏水性在等离子膜和内部细胞器中提供比较短的 C2 尾 FM 4-64 更快、更强烈、更稳定的荧光信号(图 2)。
重要的是,两种FM染料11的恒定和高关联/解离率,平均保留时间为1~6s,每个染料分子13可降低膜功能局部中断的机会,例如,通过改变膜流动性或强制膜蛋白的永久相互作用。这可能是这些分子可用作重要染料的关键原因。然而,超过50μM的FM染料浓度对真菌和植物细胞2、14有毒,而BY-2烟草前体的证据表明,超过20μMFM染料会导致血浆膜饱和14。因此,建议不要超过这个限制,特别是考虑到只有2~5μM15,16就实现了出色的成像。
值得注意的是,FM染料的光谱特性因特定的膜微环境而有很大差异(第14页)。一般来说,纯溶剂溶液中FM染料的激发和发射光谱(如产品信息中通常提供)与细胞环境中的显著差异,在大多数情况下,在选择活细胞成像设置时不会直接咨询。例如,FM 1-43 和 FM 4-64 的激励/发射最大值,与甲醇溶液相比,与真菌膜结合时,分别变为蓝色偏移 37/46 nm 和 43/64 nm(表1)。
使用FM 4-64和FM 1-43跟踪血浆膜、内膜/外细胞变和细胞器动力学(包括斯皮森克珀和线粒体)的开创性基本原理,已经全面记录了以前2、4、17、18、19等多种丝状真菌物种。图1B中描述了适用于各种丝状真菌物种的两种FM染料的推荐成像设置。然而,现有设备或特定的细胞和实验条件(如培养培养基、pH 或温度)的技术限制可能需要一些调整。幸运的是,FM 染料在宽光谱范围内工作,并且通过 514 nm 的令人振奋的 FM 1-43 或 488 nm 的 FM 4-64 实现非常好的成像效果。因此,必须针对每种样品类型和预期应用单独确定最佳成像设置。
大量斯托克的FM 4-64超过135nm的偏移,允许与荧光团同时发射绿光的卓越同步成像;这经常被利用来评估绿色荧光蛋白(GFP)标记融合蛋白相对于血浆膜和内分泌途径9、20的细胞内定位动力学。
细胞壁选择性染料
钙氟白M2R(CFW),也作为荧光增白剂28销售,可能是最著名的荧光染料,用于染色细菌,真菌,藻类,高等植物和昆虫的细胞壁。最初用作光学美白剂在造纸、纺织和洗涤剂行业,其对真菌感染的临床诊断的好处于21日、22日提前实现。由于CFW不可逆地插入新生的chitin链中,它在细胞壁生物发生过程中干扰正常的乙酸微纤维素组装,从而产生细胞壁应力23。这反过来又触发细胞壁损伤修复机制,导致局部增加的细胞壁沉积,由于葡胶和奇青辛合成酶激活24,25。这种现象可能发生与任何染料,通过稳定地结合细胞壁聚合物,是浓度依赖,是最明显的在催眠头,代表最丰富的生长,因此最敏感的部分的菌丝(图3)。最近提供了一份对细胞壁损伤作出反应的分子机制的综合摘要。
过量的染料与光毒性相结合,可导致子宫腔细胞快速分裂(电影1)。尽管如此,对野生型中"重要"的染料浓度的敏感性增加,可以利用它来识别基因功能丧失突变体细胞壁生物合成的缺陷9。对于CFW和刚果红(CR),另一种纺织品着色剂也被称为直接红28,并用作β-和β-奇丁特异性细胞壁染色真菌和昆虫27,28,阈值浓度,强烈诱导奇坦合成酶已确定与> 60 μM CFW 和> 70 μM CR,而任一染料的浓度<15 μM 均未改变或抑制真菌生长29、30、31。Hickey等人将CFW的这一阈值浓度置于25μM2。因此,建议使用染料浓度 = 5 μM 来排除与应力相关的伪影,并确保将这些分子用作真正的"重要荧光染料"2,32。这同样适用于索洛芬尼弗拉文7GFE 500 (SPF) 和庞塔明快速猩红 4B (PFS), 分别作为直接黄色 86 和直接红 23 的同义词, 另外两个有用的细胞壁染料,其真菌的应用已首次报告超过十年前33。但是,尽管它们的光谱性能是惊人的34,35,这两种染料的使用自那时以来一直非常有限36,37。如前面为 1.5 μM CFW2所示,2 μM SPF 足以在具有极高时间分辨率的本机条件下解决细胞壁动力学(影片 2)。使用 2 μM CR 或 PFS 可以获得相同的结果。
这四种染料CFW、SPF、PFS和CR共同构成一组细胞壁选择性荧光标记,几乎覆盖了现代荧光显微镜上使用的完整可见发射光谱(400-700 nm)(图4)。与细胞壁聚合物结合后,荧光强度显著增加是所有四种聚合物所固有的,并产生出色的S/N比。这反过来又允许保持染料浓度和激发光强度非常低,并允许执行细胞壁染色作为"低剂量"活细胞成像技术2。由于这些细胞壁染料是等离子膜不渗透,它们同时作为活/死污渍发挥作用。值得注意的是,由于其极宽的发射光光谱,CFW 和 SPF 与其他荧光荧光光的共成像特性的一些限制需要仔细考虑。
研究方案
1. 真菌样品的制备
- 真菌预培养
- 在适当的固体琼脂介质上接种所需的菌株,如用于三叶虫的马铃薯脱胶琼脂(PDA)或用于神经孢子酸的Vogel最小介质(VMM)。 使用变换菌株时,添加适当的选择标记。
- 在生物体的最佳温度下孵育预培养物。例如,在25°C处的T.atroviride在30°C时和12小时/12小时光/暗循环下,直到一个旋转的菌丝已经形成,但尚未到达板的边缘。在标准尺寸的培养皿(9.2 厘米*)上,平均 4-6 天采用野生型T. atroviride,而N. 克拉萨野生型在平均 3-4 天后达到此阶段。
- 真菌菌落的培养
- 使用无菌手术刀,从预培养的菌群边缘切割一个3毫米x3毫米的琼脂块,携带非分离菌丝。
- 将琼脂块置于新鲜固体介质板的中心,为实验培养物接种。
- 根据拟研究的发育阶段孵育实验培养。例如,野生型T. atroviride在黑暗中 25°C 时需要 20-22 小时才能在 PDA 上形成直径约 2 厘米的菌落,而野生型N. 克拉萨在 VMM 的黑暗下孵育 30°C 后达到约 4 厘米的菌落直径。
注:在黑暗中孵育可防止颜料的形成,从而引入自荧光。为了消除实验培养物中的中度背景荧光,用1.5%的透明凝固剂(见材料表)和任何复杂介质与定义的最小介质替换琼脂。
- 培养固体发芽文化
- 使用 5 mL 无菌生理盐溶液(0.9% w/v NaCl)从预培养板中采集孔孢子,并在 15 mL 螺钉盖管中收集产生的孢子悬浮液。
- 通过强力涡旋将孢子悬浮液混合好,然后将其过滤在1 cm x 5 cm的无菌过滤织物条上(见材料表),轻轻塞进1 mL移液器尖端(事先组装和高压灭)中,放入一个新鲜的无菌管中。
- 使用细胞计数室确定孢子密度,并结合生理盐溶液制备1 x 107细胞/mL孢子悬浮液。
注:孢子悬浮液可在4°C下保持长达两周。 - 准备标准尺寸的培养皿(9.2 厘米+),带 20 mL 的固体介质,并在顶部添加 15-20 个无菌玻璃珠(3 mm Ω)。
- 将孢子悬浮液200 μL移液器悬浮到中板,通过轻轻的摇动均匀地将细胞均匀地分布在整个板上。将玻璃珠收集到70%乙醇的烧杯中,以便重复使用。
- 根据拟研究的发育阶段孵育实验培养。例如,T. atroviride野生类型在黑暗中 25°C 时需要 5-6 小时才能在 PDA 上形成结角发芽,而N. 克拉萨野生型在 VMM 的黑暗下在 30°C 下孵育 3-4 小时后,在 3-4 小时后发展结体发芽。
注:为了消除实验培养基中的任何介质背景荧光,用透明凝固剂的1.5%w/v替换琼脂,用定义的最小介质替换任何复杂介质。
- 液体发芽培养的培养
- 将 190 μL 的液体培养基填充到 8 井室微滑动的每个井中。
- 加入10 μL的1 x 107细胞/mL孢子溶液(在步骤1.4.1~1.4.3中制备),然后轻轻上下移液几次混合。生成的单元总数为每口 1 x 105。
- 根据拟研究的发育阶段孵育实验培养。例如,野生型T. atroviride在黑暗中 25°C 时需要 5-6 小时才能在马铃薯脱糖汤 (PDB) 中形成结角胚芽,而野生型N. crasa在液体 VMM 的黑暗中孵育 3-4 小时后,在 30°C 下形成结体发芽。
2. 染料加工解决方案的制备
- 为了保证每种染料的完全溶解性,通过将适量(参见表1中的精确重量)添加到1mL的100%DMSO,并通过涡旋很好地混合,制备2 mM库存溶液。
注意:确保从密封的瓶子中取下 DMSO;它应该是一个透明的液体。与空气接触时,DMSO 变为棕色(可能是由于微量杂质的氧化),并可能对细胞生长或染料染色产生负面影响。 - 过滤通过0.2μm注射器膜过滤器将库存溶液消毒成新鲜无菌的1.5 mL反应管。为了尽量减少染料漂白,请用铝箔包裹管子。
注:染料库存溶液可加报价成更小的体积,以避免解冻/冻结周期,并在4°C下保存数月。 - 在新鲜无菌 1.5 mL 反应管中溶解 198 μL 无菌蒸馏水中的 2 μL 染料溶液,制备 20 μM 水染料工作溶液。为了尽量减少染料漂白,请用铝箔包裹管子。
注:染料工作溶液应在实验当天新鲜制备。 - 在样品安装过程中(见第 3 节),染料工作溶液将标准稀释 1:10,最终染料浓度为 2 μM,最终 DMSO 浓度为 0.1%。
注:只需改变染料加工溶液和安装液之间的体积比,即可选择不同的稀释系数,从而轻松调整所需的最终染料浓度。
注意:为防止染料或DMSO毒性产生不必要的影响,稀释因子不应低于1:4,导致最终最大浓度为5μM染料,0.4%为w/v DMSO。较高的染料浓度会迅速使系统饱和,并阻止可靠的信号定量,而超过0.5%的w/v(±62.5 mM)DMSO会损害细胞发育38。
3. 显微镜的样品制备
- 通过倒置的琼脂块方法,从真菌菌落(步骤1.2)或固体发芽培养物(步骤1.3)中安装样品。
- 保持清洁 24 mm x 60 mm 玻璃盖滑(#1 = 0.13–0.16 mm 厚度)准备好,并将 18 μL 的液体最小介质(VMM 或 M9)或生理盐溶液添加到中心。
- 将 20 μM 染料工作溶液的 2 μL 添加到 18 μL 的液体中,通过上下多次移液进行混合,同时避免产生气泡。
注:当处理多个样品时,建议为所有人制备液体染料溶液的主混合物,以确保在整个实验中染料浓度相等。 - 使用干净的手术刀,从菌落或固体发芽培养物的外围切出 15 mm x 15 mm 的样品,并将其垂直放置在中滴到盖滑处旁边。
- 使用手术刀支撑块的上边缘,用手指将块的后侧保持到位,缓慢地将携带菌丝或胚芽的一侧降至液体上。样品现已准备好转移到显微镜阶段。
注意:必须缓慢和非常小心地执行此操作,以尽量减少电池上的机械应力,并避免气泡夹在样品和盖滑之间。
- 从步骤 1.4 安装液体发芽培养物。
注:最方便的是,室微井幻灯片中的液体发芽培养物可以直接在显微镜平台上直接传输和进一步操作。- 将22μL的染料加工溶液加入200μL的液体介质中,产生2μM染料的标准最终浓度和0.1%的带DMSO。
注:液体发芽培养物具有很大的优势,荧光染料(或其他化学物质,如抑制剂)可以在实验的任何需要的时间点添加,也可以在记录过程中。在这种情况下,需要特别注意管理液体滴落非常缓慢,以免干扰细胞。系统振动和布朗运动可能已经引入一些细胞运动。
- 将22μL的染料加工溶液加入200μL的液体介质中,产生2μM染料的标准最终浓度和0.1%的带DMSO。
4. 活细胞显微镜
- 调整基本图像采集设置。以下图像采集设置允许捕获单个 hyphae 中的染色动态,适用于以下两种检测
- 施加 5~10% 的激光功率,占设备全部输出功率的 20%。
- 使用高数值孔径 = 1.2 的计划 Apo 60x-63x 甘油或浸入水物。
- 通过将图像大小设置为 1024 x 256 像素并使用光学变焦系数 2⁄3,将图像采集区域限制为 hyphae 的轮廓。
- 使用 400 Hz 的双向扫描。将针孔大小调整为 1 Airy 单位。
- 将最灵敏的探测器的增益设置为 100%。
- 对于时间圈记录,每 15 s 以一帧开始图像采集,以便获得合理的时间分辨率,而不会产生染料漂白或照片应力。
- 对于 3D 录制,将上部和下部空间限制设置为隔断面和空间光学部分之间的边界 1 μm,以便获得合理的空间分辨率。
注: 由于 hyphae 的快速增长,Z 轴中的高空间分辨率经常被牺牲,以在 X/Y 轴或相反的边上牺牲高时间分辨率。只有非常现代的共聚焦激光扫描显微镜的速度足以满足这两种需求。
- 内分泌检测
- 请参阅图 1和表 1,以确定显微镜系统上可用的 FM 1-43 和/或 FM 4-64 的最佳激励/发射设置,并相应地进行调整。
注:在推荐的2μM浓度下,将FM染料加入血浆膜是正常健康细胞的即时活性。从最初的等离子膜染色到管状真空中的染料外观的整个过程通常在室温下30-45分钟内完成。提高 FM 染料浓度可增加 S/N 比,从而更快地生成更高的对比度图像。然而,它也加快了标签过程,使得区分细胞器染色的时间顺序继承更加困难。 - 使用上述建议的基本图像采集设置开始图像录制并评估结果。
- 优化图像采集设置,以捕获实验所关注的血浆膜或内分泌动力学方面所需的空间和时间分辨率。
- 例如,为了在 X/Y 中捕获非常快的动态,减小整体图像大小,只图像一个焦平面,并将扫描速率提高到 1 fps。对于 Z 轴中的高分辨率,降低 X/Y 的分辨率,减小图像大小,并将光学部分之间的距离减小到 0.5 μm。
- 请参阅图 1和表 1,以确定显微镜系统上可用的 FM 1-43 和/或 FM 4-64 的最佳激励/发射设置,并相应地进行调整。
- 细胞壁动力学
- 参考图 4和表 1,以确定显微镜系统上可用的应用细胞壁染料的最佳激励/排放设置,并相应地进行调整。
注:由于广广发射光谱,CFW 和 SPF 不适合与其他荧光荧光道(主要是 GFP)同时进行联合成像。有些限制甚至适用于使用这些染料的顺序成像方法,因此必须单独优化。 - 使用上述建议的基本图像采集设置开始图像录制并评估结果。
注:在推荐的2μM浓度下,将染料加入细胞壁不一定是即时的,但相当快。例如,在室温20下,隔膜形成的整个过程平均需要5-7分钟。增加细胞壁染料浓度可增加S/N比,从而更快地产生更高的对比度图像。然而,由于诱导细胞壁损伤修复,它也迅速引入人工制品。 - 优化图像采集设置,以捕获实验所关注的细胞壁形态形成方面所需的空间和时间分辨率,如第 4.2.3 节所述。
- 参考图 4和表 1,以确定显微镜系统上可用的应用细胞壁染料的最佳激励/排放设置,并相应地进行调整。
结果
定量图像分析
除了"公正"可视化细胞过程外,活细胞成像还允许从记录的数据中提取定量信息。一般来说,定量图像分析是一个复杂的主题,其适当的讨论远远超出了本文的范围,因此,读者被引用到专门的教科书和文章39,40,41。但是,提供了与以下示例数据相关的一些基本准则。必须满足几个关键的先决条件才能进行图像量化,包括:(1) 必须对所有样品应用定义的荧光染料摩尔,以便进行准确的相对比较;(2) 必须对所有样品应用已定义的荧光染料的摩尔;(2) 图像采集设置必须调整,使发射光探测器永不饱和,否则最大强度被切断;(3)图像采集设置在相干实验集过程中必须固定,否则引入人工强度变化;(4) 图像数据必须与包含所有仪器设置的元信息一起以无信息文件格式保存;(5) 图像分析应限制在提取所需定量信息所需的最少处理步骤。
通常,在活细胞中,没有允许对记录信号进行绝对量化的既定标准。因此,在最简单的形式中,定量图像分析依赖于对同一图像内像素强度或以相同设置记录的不同图像之间的像素强度的相对比较。制造商的显微镜控制软件通常包括用于图像后处理和定量分析的基本工具,或者可以通过图像分割、阈值、比率成像等附加功能进行升级。提供几种不同类型图像处理平台的开源图像处理平台,包括 ImageJ(https://imagej.net;https://imagej.nih.gov/ij/)、冰(http://icy.bioimageanalysis.org/)、CMEIAS 生物图像信息学(http://cme.msu.edu/cmeias/)和维马西斯(https://www.wimasis.com/en/)。
使用 ImageJ 平台处理和分析所展示的示例数据。简单地说,单元格中的特定区域(如子宫尖顶点或隔膜)用相当大的区域选择工具标记,并且所有包含像素的强度都通过软件实现的"测量工具"进行读取。来自对照组和实验样本的强度数据被传输到电子表格文件中,以数学方式进行分析并作为图形进行准备。更多细节可在引用的原始出版物中找到。
示例数据 1:FM 4-64 接受检测
真菌样本作为菌落(步骤1.2)培育,并通过倒置的琼脂块法(步骤3.1)安装。FM 4-64 的最终浓度为 1.67 μM. 成像设置:HCX PL APO 63x/1.3 NA 甘油浸入物物在倒置共聚焦激光扫描显微镜上(参见材料表);FM 4-64 激励在 488 nm 时,在 600–700 nm 时排放;每分钟一帧,最多150分钟.FM 4-64接受检测,在基因缺失和基因过度表达的内分泌组织的时空组织中的缺陷,以及T.atroviride9的真菌特异性Sur7族蛋白2(Sfp2)的基因过度表达突变体(图5)。
示例数据 2:FM 4-64 荧光融合蛋白共同染色,针对内分泌腔
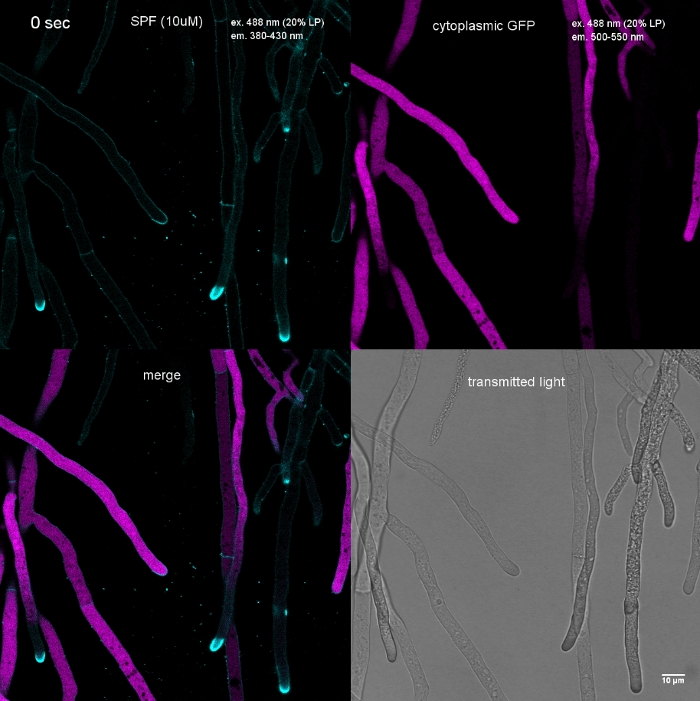
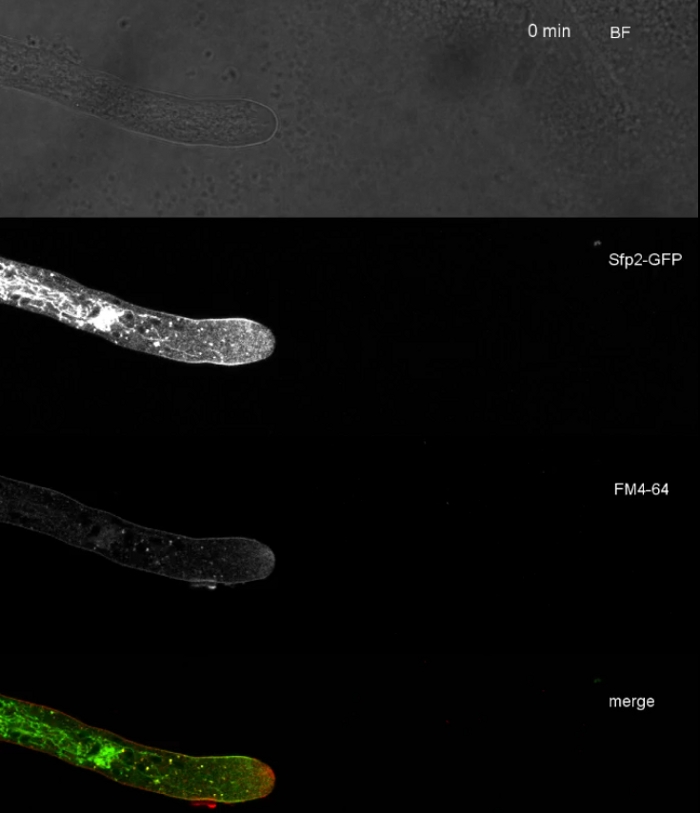
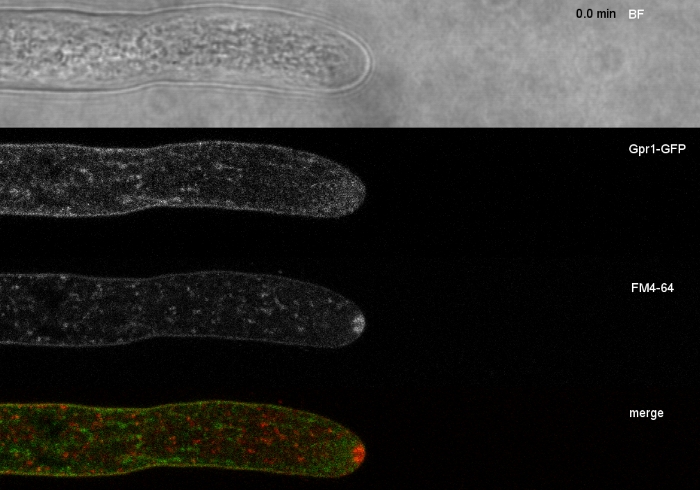
真菌样本作为菌落(步骤1.2)培育,并通过倒置的琼脂块法(步骤3.1)安装。FM 4-64 的最终浓度为 2 μM. 成像设置:CFI 计划 Apo VC 60x/1.2 NA XC 水浸浸入物镜在倒置共焦激光扫描显微镜上(参见材料表);GFP 激励在 488 nm 时,在 500–530 nm 时发射,FM 4-64 激发在 488 nm 时,在 600–700 nm 时发射,以及带透射光探测器的明亮场,所有同时;使用一帧每 15 秒长达 15 分钟FM4-64共染色,将两种增强的绿色荧光蛋白 (EGFP) 标记的跨膜蛋白 Sfp2 和 Gpr1 的亚细胞分布与T. atroviride的端细胞通路(图 6,电影 3,电影 4)。
示例数据 3:FM 4-64 共染色,用于识别形态遗传差异
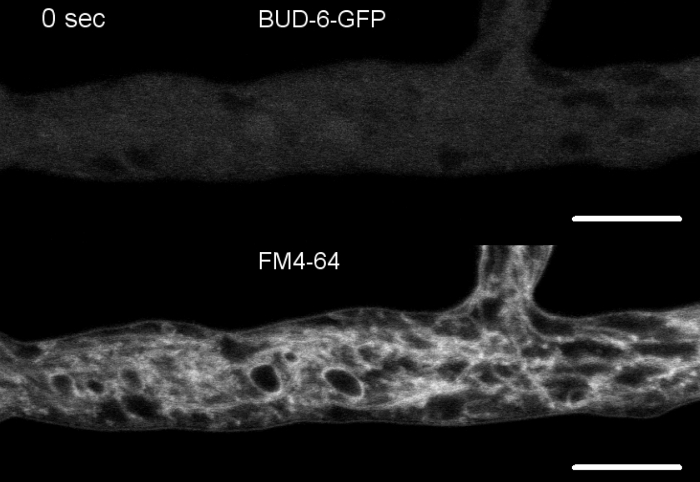
真菌样本作为菌落(步骤1.2)培育,并通过倒置的琼脂块法(步骤3.1)安装。FM 4-64 的最终浓度为 2 μM.成像设置:在倒置共焦激光扫描显微镜上规划 Apochromat 63x/1.4 NA 油浸没物(参见材料表);GFP 激励在 488 nm 时,在 505–550 nm 时发射,FM 4-62 激发在 488 nm 时,在 574–691 nm 时发射,以及带透射光探测器的明亮场,所有同时;每8.5秒一帧,FM4-64共染色允许将荧光标记BUD-6偏振体复合蛋白的亚细胞定位动力学与内体贩运相关过程联系起来,如隔膜和偏振性脑尖生长的形成,以及N.crasa的亚细胞组织和子宫结构之间的特征差异(图7,电影5)。
示例数据 4:细胞壁染色揭示形态遗传学差异
真菌样本作为菌落(步骤1.2)培育,并通过倒置的琼脂块法(步骤3.1)安装。使用了2μM CFW、20μM SPF和100μM CR的最终浓度。成像设置:CFI计划Apo VC 60x/1.2 NA XC浸水物镜在倒置共聚焦激光扫描显微镜上(见材料表);CFW 和 SPF 激励在 405 nm 时,在 430–470 nm 时排放,CR 激发在 543 nm 时,在 580–620 nm 时排放。CFW、SPF和CR与细胞壁聚合物的不同相互作用特性突出了βsfp2突变体与野生型菌株T.atroviride9之间的形态遗传差异。与野生型相比,染料浓度升高引起的细胞壁应力在突变体中发生得更快、更明显。此外,相同的图像允许量化两种菌株之间有关子宫径和隔膜距离的形态遗传学差异(图8)。
示例数据5:细胞壁生物合成的实时监测
在8井室微滑(步骤3.2)中,胚芽被培养为液体培养(步骤1.4)。最终CFW浓度为0.12 μM.成像设置:CFI计划Apo VC 60x/1.2 NA XC水浸浸入物镜在倒置共聚焦激光扫描显微镜上;CFW 激励在 405 nm 时,在 420–470 nm 时排放;每 20 秒一帧,最多 35 分钟。极低的CFW浓度可防止细胞壁与染料分子饱和,并允许对细胞壁生物合成进行定量实时监测。这表明,新的细胞壁材料的沉积并不均匀,但对在N.crassa中发芽融合之前一个细胞在细胞附着上相对位移引起的局部物理应力反应非常迅速(图9,电影6)。
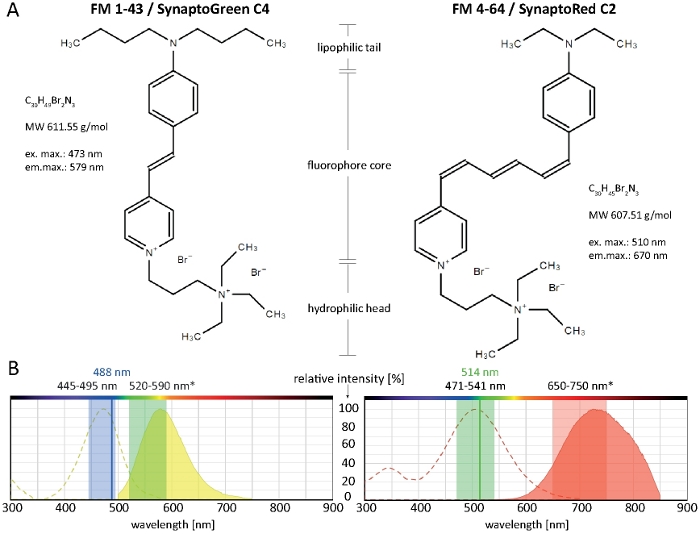
图1:FM染料的生物化学和生物物理特性。(A) FM 1-43/SynaptoGreen C4 和 FM 4-64/辛帕托红 C2 的化学结构。(B) 两种FM染料的吸收和发射光谱,覆盖在丝状真菌中膜结合染料的最佳成像设置:445-495nm蓝光将激发FM 1-43,效率为100~80%,而488nm的Argon激光将激发染料,效率为91%。由于膜结合时的蓝移(*),FM 1-43 发射的最佳检测范围在 520–590 nm 之间。同样,在真菌中使用多色激发光源时,用于 FM 4-64 的最佳成像设置为 471*541 nm(100–80% 效率),使用 Argon 激光时为 514 nm(效率 99%),用于发射光检测时为 650-750 nm。请点击此处查看此图的较大版本。
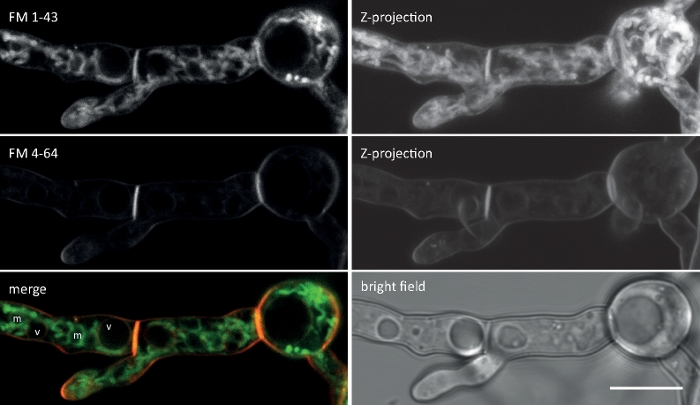
图2:FM 1-43和FM 4-64的同步联合成像。两种染料的模棱两色混合物被添加到N.克拉萨的液体发芽培养物中,最终浓度为10μM。在添加染料后 25 分钟, FM 1-43 已经染色了等离子膜,并已积聚在内部膜中,包括强染色线粒体 (m),但主要不包括真空膜 (v),并且比 FM 4-64(平均荧光强度分别为 176 到 21)强 8 倍以上,其较低的疏水率/较高的亲水性减慢其内化率,导致在等离子膜上长时间居住。比例尺 = 10 μm。请点击此处查看此图的较大版本。
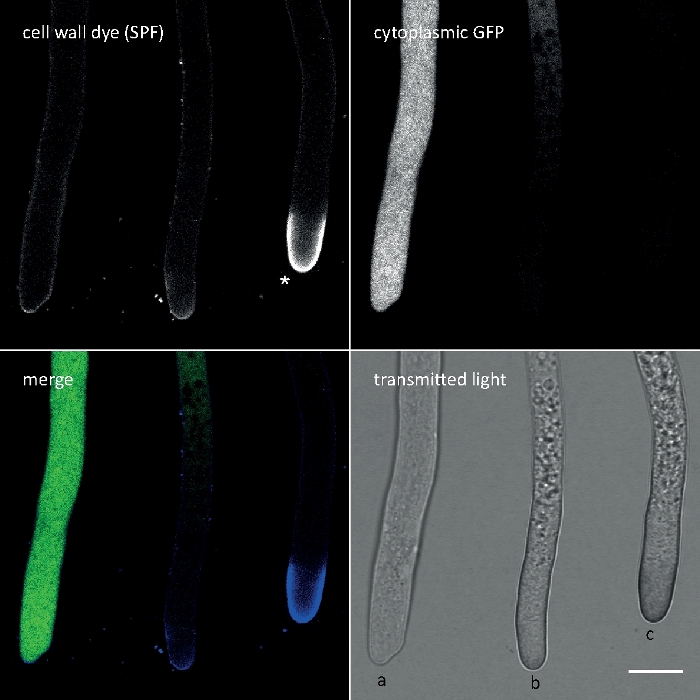
图3:细胞壁应力诱导的细胞壁聚合物在尖端顶点沉积通常需要细胞自干。表达细胞质GFP的T.atroviride的Hyphae被染色了10μM索洛芬片7GFE 500(SPF),并在安装后立即成像。非应力性hyphae (a),强调催眠,在顶点有微增的胶/丙酸沉积,并推进自溶性(b),重压的hyphae与明显的腺胶胶/乙酸帽(星号)和终端自动解(c)明显通过GFP荧光和广泛的真空化的总损失。刻度条 = 10 μm。有关全日制课程序列,请参阅影片 1。请注意,这三个子宫确实位于彼此旁边。请点击此处查看此图的较大版本。
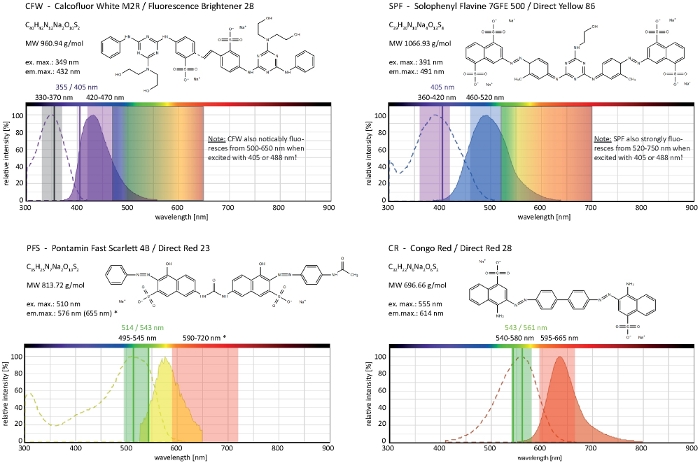
图4:细胞壁选择性染料的生化及生物物理特性。给出的化学特征是每种染料的钠盐。吸收和发射光谱与细胞环境中的光谱相对应。指示的单色激光激发线(以颜色书写)、适用于荧光显微镜的多色激发范围和发射光检测范围推荐用于丝状真菌成像。当两个激光激励线工作得相当好时,两条激光激励线被指示。(*)然而,细胞壁边界PFS的排放谱比先前提到的33明显多红移,因此,与以前相比,染料浓度较低的S/N比非常好。CR 的完整频谱目前不可用,因此尼罗河红(CAS 号:7385-67-3)显示为最接近的匹配。有关CR光谱特性的详细信息,可在其他地方找到42。请点击此处查看此图的较大版本。
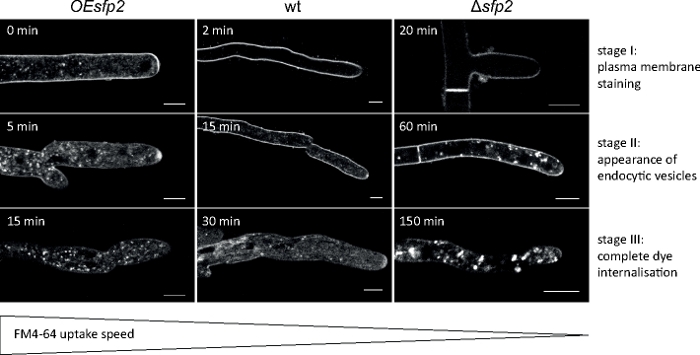
图5:Sfp2对FM4-64内分泌接受的影响。在野生类型 (wt) 中很容易识别 FM 染料的三个连续关键阶段。第一阶段:独家血浆膜染色,第二阶段:在内分泌囊泡中首次出现FM染料,第三阶段:内皮囊泡和内膜的专用染色。等效染色图案在其出现的最初时间点显示。与T. atroviride野生类型相比,在sfp2过度表达突变体 (OEsfp2)中,内分泌稍微加速,而在sfp2缺失突变体 (+sfp2) 中,染料的摄入明显延迟。例如,在OEsfp2中,染料对血浆膜的接收会立即发生,但在野生型中需要2分钟;与μsfp2相比,在OEsfp2中,从等离子膜中完全内化的FM染料发生速度要快10倍。刻度条 = 5 μm。图转载自Atanasova等人9与知识共享许可证(https://creativecommons.org/licenses/by/4.0/)。请点击此处查看此图的较大版本。
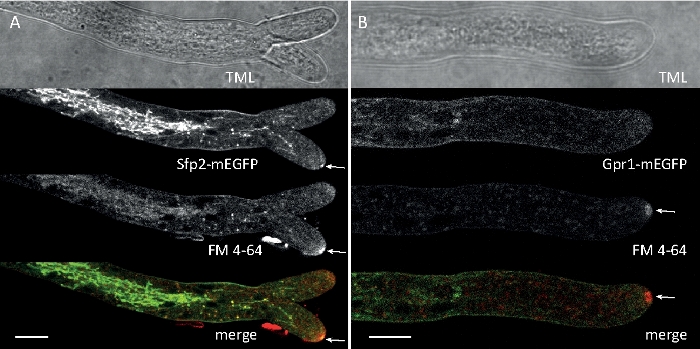
图6:用FM4-64共同染色EGFP标记膜蛋白,有助于在T.atroviride中分化不同的亚细胞定位动力学。(A) 四跨膜域蛋白 Sfp2 与 FM4-64 标记的细胞器(包括血浆膜和隔膜、斯皮森克珀(Spk;箭头)和大概管状真空管状细胞器共同本地化。(B) GPCR样的七膜蛋白Gpr1与FM4-64与Sfp2相同的细胞器共同本地化,但Spk.刻度棒除外,10μm。有关全日制课程序列,请参阅影片 3和影片 4。该数字已由 Atanasova 等人9号修改,以符合知识共享许可。请点击此处查看此图的较大版本。
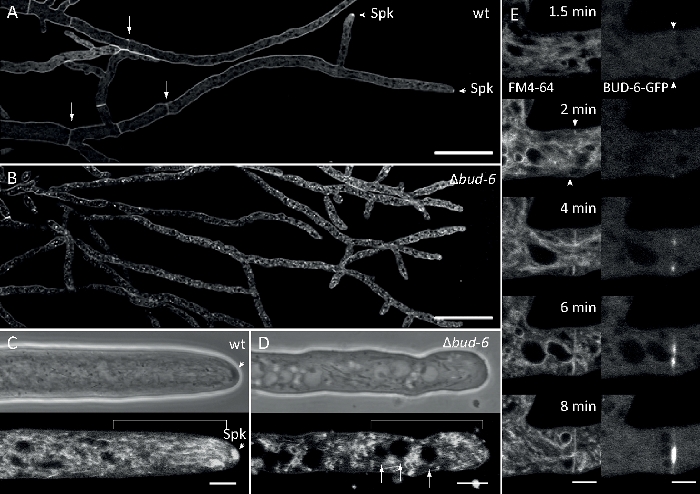
图7:FM 4-64染色区分[芽-6突变体与野生类型,并在隔环处本地化BUD-6。(A) FM 4-64 染色的 hyphae 的N. 克拉萨野生类型 (箭头表示 sepa; 箭头表示 Spk)。(B) 塞帕和斯普在 [芽-6] 中缺席。刻度条,50 μm. (C和D) 野生类型 (C) 和 +芽-6 (D) 的透明顶点和子片的特写。Spk(箭头)在野生类型中区分,但不是 [芽-6] 。支架表示未在 +芽 6中建立的核禁区。刻度条 = 5 μm (E) BUD-6-GFP 招募到血浆膜阴道(箭头)和附带的隔膜收缩前的初期消压位点。刻度条 = 5 μm。有关完整的时间课程序列,请参阅电影 5a和电影 5b。图已转载与Lichius等人16的修改,同意知识共享许可证。请点击此处查看此图的较大版本。
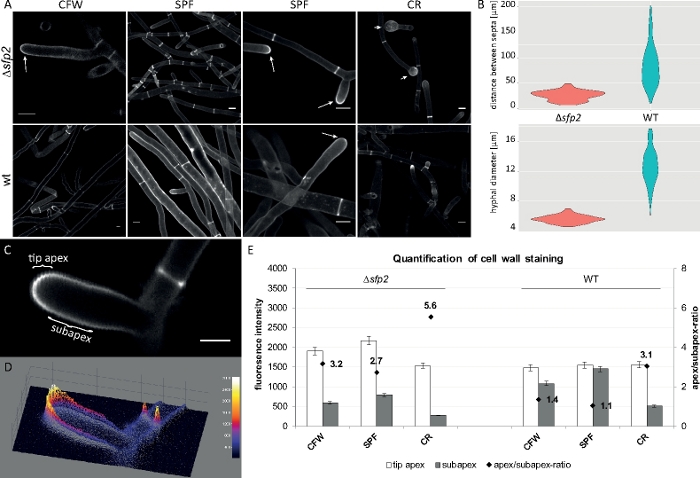
图8:sfp2的删除改变了细胞壁材料的沉积模式,影响T.atroviride的子宫形态发生。(A) CFW 和 SPF 染色显示与野生类型 (wt) 相比,αsfp2(箭头)中的细胞壁沉积增加。CR 染色仅在 +sfp2(箭头)中引起广泛的尖端肿胀。比例尺 = 10 μm. (B) αsfp2中的形态遗传缺陷包括显著减少的隔膜距离 (μsfp2 = 26.0 μm, 野生类型 = 85 μm; n = 60;ANOVA Pr < 2⁄16) 和较小的子宫内径 (*sfp2 = 5.6 μm, 野生类型 = 12.6 μm; n = 100;ANOVA Pr < 2+16)。(C) 与子apex相比,尖端尖中的染料荧光增加。比例尺 = 5 μm (D) 强度编码的 3D 表面图 (C)。(E) αsfp2和野生类型 (n = 55) 中相对荧光强度的量化。图已转载从阿塔纳索娃等人9同意知识共享许可证。请点击此处查看此图的较大版本。
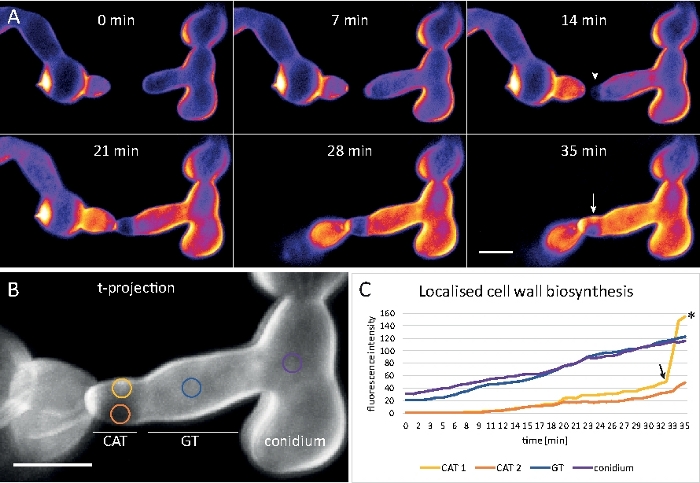
图9:细胞壁生物合成的实时监测。(A) 锥体肿瘤管 (CAT) 融合N. 克拉萨的胚芽之间。通过发芽扭矩响应(21-28 分钟),身体接触变得明显。强度颜色编码的CFW荧光表示区域小(深蓝色)和强烈(黄色)细胞壁沉积。最初未染色的定位尖端(箭头),在尖端接触时和经历最大物理应力的区域(箭头)中沉积新的细胞壁材料。刻度条 = 5 μm。有关全日制课程序列,请参阅影片 6。图从38复制,并经许可。(B) (A) 的投影表示测量荧光强度的四个圆形区域。刻度条 = 5 μm。(C) 指示区域的图,显示局部细胞壁生物合成在物理应力响应时迅速增加(CAT 1,箭头)。在胚芽管(GT)和孢子体(氧化铝)中,细胞壁生物合成稳步增加。请点击此处查看此图的较大版本。
电影1:染料引起的细胞壁应力。10 μM SPF(青色)被添加到T.atroviride hyphae中,表达细胞质GFP(洋红色)。广泛的尖端染色立即发生,随后在2分钟内迅速分出子宫内腔;GFP荧光的消失是显而易见的。请点击此处下载此影片。
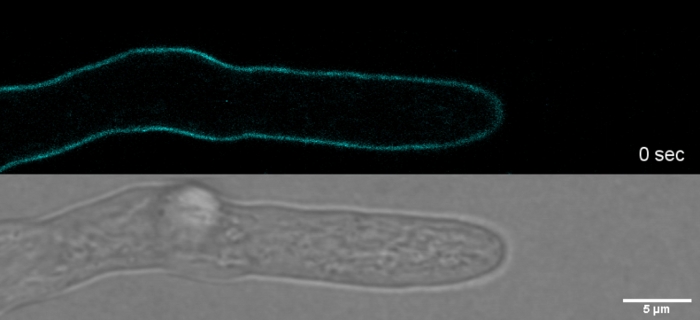
电影2:重要的SPF染色。2 μM SPF(青色)允许跟踪T.atroviride hyphae的尖端生长,具有高空间和时间分辨率,而不会在尖端顶点诱导细胞壁应力人工制品。请点击此处下载此影片。
电影 3: FM 4-64 Sfp2-GFP 共同染色。用1.67 μM FM 4-64(红色)共同染色T.atroviride表达Sfp2-mEGFP(绿色),揭示了膜蛋白与内分泌途径的重叠和独特的定位。请点击此处下载此影片。
电影 4: FM 4-64 Gpr1-GFP 共同染色。用1.67 μM FM 4-64(红色)共同染色T.atroviride表达Gpr1-mEGFP(绿色),揭示了膜蛋白与内分泌途径的重叠和独特的定位。请点击此处下载此影片。
电影 5: FM 4-64 BUD-6-GFP 共同染色。(5a) 与 2 μM FM 4-64 (红色) 一起表达 BUD-6-GFP(绿色)的N. crasa共同染色,允许跟踪在隔膜形成期间相对于相关血浆膜的粘膜动力学的 BUD-6 动力学。(5b) 裁剪和合并图像 (5a)。请点击此处下载电影5a
请点击此处下载电影5b。
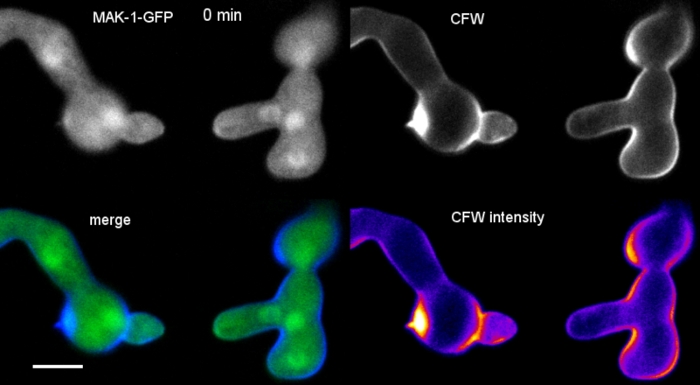
电影6:细胞壁生物合成的实时监测。表达MAK-1-GFP(绿色)的N.克拉萨胚芽与0.12 μM CFW(蓝色)共同染色,以揭示在CAT介导的发芽融合过程中的局部细胞壁生物发生。请注意,CFW 信号会部分渗入 GFP 通道,这表明 SPF 或 CR 是 GFP 的连续和同步共成像染料的更好选择。请点击此处下载此影片。
表1:膜和细胞壁选择性荧光染料的特性。• • mg/mL 值校正,以降低纯度/染料含量,导致所有溶液的均等性;n.i.a. = 没有可用的信息。请点击此处下载此表。
讨论
本文继续开创性的工作,确定使用各种荧光染料作为重要的细胞器标记在21世纪初的丝状真菌2,4,43,并试图讨论FM染料和选定的细胞壁染料的光物理和细胞生物学特性比以前更详细。特别是对于超过某些染料浓度的不需要的细胞效应,如膜饱和或细胞壁损伤。以前在细胞水平上被认为是无毒的,现在在分子水平上被认为是有毒的。尽管这些影响可能非常微妙,并且不能直接通过细胞器或细胞行为的明显变化来明显,但除了可视化之外,染料应用的任何可能的干扰都必须最小化,以便研究原生分子功能。幸运的是,现代探测器(如硅雪崩光电二极管探测器(Si-ApD)44或Airyscan区域探测器45)的灵敏度和量子效率提高,便于使用比以前更低的染料量。本文的另一个关键目标是说明这些染料与其他荧光荧光荧光道的共同成像特性,最重要的是,GFP作为生物学中最常用的荧光蛋白。这应有助于成像实验的设计,旨在将荧光融合蛋白的亚细胞定位动力学与真菌细胞壁、血浆膜或内膜和外泌通路等的亚细胞定位动力学相关联。
在自然和无压力条件下成像是获取可靠数据的关键。关于培养基培养基和样品制备的一些实际考虑旨在提供一个起点,以找到最佳条件,允许对健康、无压力的细胞进行无创事实的长期观察,任何给定样品的S/N比都是可能的。实现可靠和有意义的成像结果没有通用的方法。样本的生物变异、微观生物的主观性和期望值以及图像后处理,对数据的采集和解释分别有着重要的影响。因此,显微镜的实践经验,她/他对被调查真菌细胞生物学的深入了解,以及熟练的样品制备,在实验室环境中创造"自然"和不受干扰的条件,对于获取和评估真实反映所研究的细胞现象的成像数据至关重要。根据经验,荧光染料的不良副作用,从血浆膜或细胞壁的微妙且不明显可见的活化,重新建模应力反应途径,到细胞自解的直接细胞毒性诱导,只能通过应用低染料浓度±2 μM来安全地防止。
荧光染料的应用简单,但其特异性特征较差。使用荧光染料的一个关键优势是实验协议的准备简单性。真菌的培养和取样、染料的添加以及安装到显微镜阶段(与实践一起)都非常简单。调整基本成像设置,包括激发和发射波长、暴露时间、时间过程设置等,遵循显微镜的简单生物物理规则和细胞内使用荧光染料的生物规则。表 1旨在支持识别最适合用于实验的染料或染料组合。此外,荧光染料价格合理,随时可用,具有可靠的高质量,因此可确保高度可重复的应用。
使用膜或细胞壁选择性荧光染料的两个主要限制是(通常)对其精确染色特性的了解有限,在大多数情况下,这些特性在细胞器和分子水平上是非特异性的,以及其浓度依赖性不必要的副作用。FM染料是参与内分泌和外泌的脂质双层特异性。然而,在测试条件下,哪些亚细胞细胞器被连续标记,目前尚不清楚,需要比较不同的FM染料变异,并与其他细胞器特异性标记共同标记。与FM 4-64相比,FM 1-43 对线粒体膜的偏好就是一个例子。细胞壁选择性染料对真菌细胞壁的三种主要聚合物表现出不同的特异性。CFW被认为是β-葡式和奇青的一种非特异性染色,SPF被认为是对β-1,4-葡人最挑剔的,而CR被认为是对β-和β-奇他丁的高度选择性。关于PFS与真菌细胞壁多糖结合特异性的信息目前不可用。对于在所调查的真菌物种中,在给定染料浓度下最有效地标记哪些真菌细胞壁聚合物的比例不容易回答,必须非常仔细地考虑在体外或体内获得的详细测量方法。不幸的是,这些信息是稀疏和高度分散在文献35,42,46。最新的记录将遵循以前的研究33,提供新的见解,以特有的真菌特色染料的精确染色属性,目前还没有。
成像控制对于准确评估染色模式和细胞反应至关重要。然而,最具挑战性的部分可能是非常了解真菌的细胞生物学,因此,膜和细胞壁选择性荧光染料的亚细胞定位、细胞结构或子宫生长模式的改变,可以完全而自信地与实验治疗的预期效果相关。为此,在任何新的活细胞成像实验的同时,保持良好的控制至关重要。其中包括未经处理的野生类型作为负成像控制,以排除背景自荧光和探测器噪声从采集的图像,并在处理突变体时具有形态比较器。此外,阳性成像控制,例如细胞质或其他知名荧光标记蛋白中表达GFP或RFP的菌株,对于将激发光强度设定为所需的最小强度,并控制细胞活力至关重要。一旦设置这些控制,荧光染料的使用不仅限于可视化任务,而是其浓度依赖性染色动力学,以及浓度依赖性的副作用可以分析利用;例如,用于实时定量监测细胞壁生物合成或识别易感性测定47中的突变特异性表型。
改进的未来应用取决于对染色特性的详细功能分析。一项持续的主要挑战是进一步改进和自动化定量图像分析,以便推进丝状真菌中膜和细胞壁选择性荧光染料的亚细胞动力学功能评估。为此,首先需要对这些染料进行广泛的定量联合定位研究,这些染料与已知的细胞器和细胞壁聚合物标记相结合,与缺乏特定运输途径的突变菌株相结合,或缺乏特定的结构成分。几种用于与FM染料进行比较分析的内分泌标记物有48,49种,对于真菌中细胞壁染料的特性仍然较差的结合特性,应用荧光标记的葡甘特异性抗体50可能提供一种可能性来解决这个问题。
披露声明
提交人声明,他们没有相互竞争的经济利益,也没有任何披露。
致谢
感谢蒂罗尔科学基金(TWF)向AL提供赠款#256524,感谢维也纳科学和技术基金(WWTF)向SZ提供#LS13-086赠款,并感谢因斯布鲁克大学出版基金支持开放出版。作者还感谢因斯布鲁克大学动物学系提供莱卡TCS SP5 II共聚焦激光扫描显微镜。
材料
| Name | Company | Catalog Number | Comments |
| BRAND cell counting chamber | Merck | BR718005 | Thoma format |
| Calcofluor White M2R | Merck/Sigma-Aldrich | F3543 | cell wall dye |
| CFI Plan Apo VC 60x/1.2 NA XC WI | Nikon | MRD07602 | water immersion objective |
| CFI Plan Apo VC 60x/1.2 NA XC WI | Nikon | MRD07602 | water immersion objective |
| Congo Red | Merck/Sigma-Aldrich | C6277 | cell wall dye |
| Dimethyl sulfoxide | VWR | 8,36,73,230 | organic solvent |
| Eclipse TE2000-E with C1 scanning unit | Nikon | custom configuration | inverted laser scanning confocal microscope used to acquire example data 2 and 4 |
| Eclipse TE2000-U with Bio-Rad Radiance 2100 scannig unit | Nikon | custom configuration | inverted laser scanning confocal microscope used to acquire example data 5 |
| FM 1-43 | Merck/Sigma-Aldrich | S6814 | membrane dye |
| FM 4-64 | Merck/Sigma-Aldrich | S6689 | membrane dye |
| Glass beads | Rettberg | 1340691030 | 3 mm glass beads |
| Glass cover slips | Thermo Fisher Scientific | BB02400600A113MNT0 | 24 x 60 # 1 glass cover slips |
| HCX PL APO 63x/1.3 NA Glyc | Leica | 15506353 | glycerol immersion objective |
| LSM 510 Meta | Zeiss | custom configuration | inverted laser scanning confocal microscope used to acquire example data 3 |
| M9 Minimal Medium | Merck/Sigma-Aldrich | M6030 | generic fungal growth medium |
| Micro-slide 8-well | ibidi | 80826 | ibiTreat #1.5 polymer coverslip |
| Miracloth | Merck/Millipore | 475855-1R | polyester filtration material |
| Petri dish | Sarstedt | 8,21,472 | 92 x 16 mm culture dish w/o cams |
| Phytagel | Merck/Sigma-Aldrich | P8169 | transparent gelling agent |
| Plan Apochromat 63x/1.4 NA Oil DIC | Zeiss | 440762-9904-000 | oil immersion objective |
| Pontamine Fast Scarlet 4B | Merck/Sigma-Aldrich | 212490 | cell wall dye |
| Potato Dextrose Agar (PDA) | BD Difco | 213400 | fungal growth medium for T. atroviride |
| Potato Dextrose Broth (PDB) | BD Difco | 254920 | fungal growth medium for T. atroviride |
| Reaction tube | Sarstedt | 72,706 | 1.5 mL SafeSeal tube |
| Scalpel | B.Braun | 5518016 | Cutfix sterile scalpel #23 |
| Screw cap tube | Sarstedt | 6,25,54,502 | 15 mL polypropylene tube |
| Solophenyl Flavine 7GFE 500 | CIBA | 1485385V6 | cell wall dye |
| SynaptoGreen C4 | Biotum | 70020 | membrane dye |
| SynaptoRed C2 | Biotum | 70021 | membrane dye |
| Syringe membrane filter | Thermo Fisher Scientific | 723-9945 | 0.45 µm SFCA syringe filter |
| TCS SP5 II | Leica | custom configuration | inverted laser scanning confocal microscope used to acquire example data 1 |
| Vogel's Minimal Medium (VMM) | FGSC | Fungal Genetics Stock Centre | fungal growth medium for N. crassa |
参考文献
- Read, N. D., Fischer, S., Parton, R. M. Imaging Spitzenkörper, pH and calcium dynamics in growing fungal hyphae. Pesticide Science. 54 (2), 179-181 (1998).
- Hickey, P. C., Swift, S. R., Roca, M. G., Read, N. D. Live-cell imaging of filamentous fungi using vital fluorescent dyes and confocal microscopy. Microbial Imaging. , 63-87 (2004).
- Jelínková, A., et al. Probing plant membranes with FM dyes: tracking, dragging or blocking. The Plant Journal. 61 (5), 883-892 (2010).
- Fischer-Parton, S., et al. Confocal microscopy of FM4-64 as a tool for analysing endocytosis and vesicle trafficking in living fungal hyphae. Journal of Microscopy. 198 (3), 246-259 (2000).
- Harris, S. D. Branching of fungal hyphae: regulation, mechanisms and comparison with other branching systems. Mycologia. 100 (6), 823-832 (2008).
- Roca, M. G., Arlt, J., Jeffree, C. E., Read, N. D. Cell biology of conidial anastomosis tubes in Neurospora crassa. Eukaryotic Cell. 4 (5), 911-919 (2005).
- Becker, Y., et al. The fungal cell-wall integrity MAPK cascade is crucial for hyphal network formation and maintenance of restrictive growth of Epichloë festucae in symbiosis with Lolium perenne. Molecular Plant-Microbe Interactions. 28 (1), 69-85 (2015).
- Justa-Schuch, D., Heilig, Y., Richthammer, C., Seiler, S. Septum formation is regulated by the RHO4-specific exchange factors BUD3 and RGF3 and by the landmark protein BUD4 in Neurospora crassa. Molecular Microbiology. 76 (1), 220-235 (2010).
- Atanasova, L., et al. The Gpr1-regulated Sur7 family protein Sfp2 is required for hyphal growth and cell wall stability in the mycoparasite Trichoderma atroviride. Scientific Reports. 8 (1), 12064 (2018).
- Betz, W. J., Mao, F., Bewick, G. S. Activity-dependent fluorescent staining and destaining of living vertebrate motor nerve terminals. Journal of Neuroscience. 12 (2), 363-375 (1992).
- Wu, Y., Yeh, F. L., Mao, F., Chapman, E. R. Biophysical characterization of styryl dye-membrane interactions. Biophysical Journal. 97 (1), 101-109 (2009).
- Betz, W. J., Mao, F., B, S. C. Imaging exocytosis and endocytosis. Current Opinion in Neurobiology. 6, 365-371 (1996).
- Hoopmann, P., Rizzoli, S. O., Betz, W. J. Imaging synaptic vesicle recycling by staining and destaining vesicles with FM dyes. Cold Spring Harbor Protocols. 2012 (1), 77-83 (2012).
- Bolte, S., et al. FM-dyes as experimental probes for dissecting vesicle trafficking in living plant cells. Journal of Microscopy. 214, 159-173 (2004).
- Riquelme, M., et al. Spitzenkorper localization and intracellular traffic of green fluorescent protein-labeled CHS-3 and CHS-6 chitin synthases in living hyphae of Neurospora crassa. Eukayotic Cell. 6 (10), 1853-1864 (2007).
- Lichius, A., Yáñez-Gutiérrez, M. E., Read, N. D., Castro-Longoria, E. Comparative live-cell imaging analyses of SPA-2, BUD-6 and BNI-1 in Neurospora crassa reveal novel features of the filamentous fungal polarisome. PloS one. 7 (1), 30372 (2012).
- Peñalva, M. A. Tracing the endocytic pathway of Aspergillus nidulans with FM4-64. Fungal Genetics and Biology. 42 (12), 963-975 (2005).
- Dijksterhuis, J., Molenaar, D. Vesicle trafficking via the Spitzenkörper during hyphal tip growth in Rhizoctonia solani. Antonie van Leeuwenhoek. 103 (4), 921-931 (2013).
- Hickey, P. C., Read, N. D. Imaging living cells of Aspergillus in vitro. Medical Mycology. 47, 110-119 (2009).
- Delgado-Álvarez, D. L., Bartnicki-García, S., Seiler, S., Mouriño-Pérez, R. R. Septum development in Neurospora crassa: the septal actomyosin tangle. PLoS One. 9 (5), 96744 (2014).
- Hageage, G. J., Harrington, B. J. Use of Calcofluor White in clinical mycology. Laboratory Medicine. 15 (2), 109-112 (1984).
- Monheit, J. E., Cowan, D. F., Moore, D. G. Rapid detection of fungi in tissues using Calcofluor White and fluorescence microscopy. Archives of Pathology and Laboratory. 108 (8), 616-618 (1984).
- Herth, W., Schnepf, E. The fluorochrome Calcofluor White binds oriented to structural polysaccharide fibrils. Protoplasma. 105 (1-2), 129-133 (1980).
- Elorza, M. V., Rico, H., Sentandreu, R. Calcofluor White alters the assembly of chitin fibrils in Saccharomyces cerevisiae and Candida albicans cells. Journal of General Microbiology. 129 (5), 1577-1582 (1983).
- Lagorce, A., et al. Genome-wide analysis of the response to cell wall mutations in the yeast Saccharomyces cerevisiae. Journal of Biological Chemistry. 278 (22), 20345-20357 (2003).
- Sanz, A. B., García, R., Rodríguez-Peña, J. M., Arroyo, J. The CWI Pathway: regulation of the transcriptional adaptive response to cell wall stress in yeast. Journal of Fungi. 4 (1), (2017).
- Slifkin, M., Cumbie, R. Congo Red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Michels, J., Büntzow, M. Assessment of Congo Red as a fluorescence marker for the exoskeleton of small crustaceans and the cuticle of polychaetes. Journal of Microscopy. 238 (2), 95-101 (2010).
- Pancaldi, S., Poli, F., Dall'Olio, G., Vannini, G. L. Morphological anomalies induced by Congo Red in Aspergillus niger. Archives of Microbiology. 137 (3), 185-187 (1984).
- Roncero, C., Durán, A. Effect of Calcofluor White and Congo Red on fungal cell wall morphogenesis: in vivo activation of chitin polymerization. Journal of Bacteriology. 163 (3), 1180-1185 (1985).
- Kopeck, M., Gabriel, M. The influence of Congo Red on the cell wall and (1,3)- β-d-glucan microfibril biogenesis in Saccharomyces cerevisiae. Archives of Microbiology. 158 (2), 115-126 (1992).
- Heilmann, C. J., et al. Surface stress induces a conserved cell wall stress response in the pathogenic fungus Candida albicans. Eukayotic Cell. 12 (2), 254-264 (2013).
- Hoch, H. C., Galvani, C. D., Szarowski, D. H., Turner, J. N. Two new fluorescent dyes applicable for visualization of fungal cell walls. Mycologia. 97 (3), 580-588 (2005).
- Liesche, J., Ziomkiewicz, I., Schulz, A. Super-resolution imaging with Pontamine Fast Scarlet 4BS enables direct visualization of cellulose orientation and cell connection architecture in onion epidermis cells. BMC Plant Biology. 13, 226 (2013).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Knight, N. L., Sutherland, M. W. A rapid differential staining technique for Fusarium pseudograminearum in cereal tissues during crown rot infections. Plant Pathology. 60 (6), 1140-1143 (2011).
- Fajardo-Somera, R. A., et al. Dissecting the function of the different chitin synthases in vegetative growth and sexual development in Neurospora crassa. Fungal Genetics and Biology. 75, 30-45 (2015).
- Lichius, A. . Cell Fusion in Neurospora crassa. , (2010).
- Chen, W., Li, W., Dong, X., Pei, J. A Review of Biological Image Analysis. Current Bioinformatisc. 13 (4), 337-343 (2018).
- Goldman, R. D., Swedlow, J., Spector, D. L. . Live cell imaging: A laboratory manual. , (2010).
- Eliceiri, K. W., et al. Biological imaging software tools. Nature methods. 9 (7), 697-710 (2012).
- Zemanek, G., Jagusiak, A., Chłopaś, K., Piekarska, B., Stopa, B. Congo Red fluorescence upon binding to macromolecules - a possible explanation for the enhanced intensity. Bio-Algorithms and Med-Systems. 13 (2), 1187 (2017).
- Hickey, P. C., Jacobson, D. J., Read, N. D., Louise Glass, N. Live-cell imaging of vegetative hyphal fusion in Neurospora crassa. Fungal Genetics and Biology. 37 (1), 109-119 (2002).
- . Hamamatsu Si APD - high sensitivity photodiodes having an internal gain mechanism: Avalanche photodiode selection guide 2019 Available from: https://www.hamamatsu.com/resources/pdf/ssd/si_apd_kapd0001e.pdf (2019)
- Huff, J. The Airyscan detector from ZEISS: confocal imaging with improved signal-to-noise ratio and super-resolution. Nature Methods. 12, 1205 (2015).
- Thomas, J., Idris, N. A., Collings, D. A. Pontamine Fast Scarlet 4B bifluorescence and measurements of cellulose microfibril angles. Journal of Microscopy. 268 (1), 13-27 (2017).
- Ram, A. F. J., Klis, F. M. Identification of fungal cell wall mutants using susceptibility assays based on Calcofluor White and Congo Red. Nature Protocols. 1 (5), 2253-2256 (2006).
- Toshima, J. Y., et al. Spatial dynamics of receptor-mediated endocytic trafficking in budding yeast revealed by using fluorescent alpha-factor derivatives. Proceedings of the National Academy of Science of the USA. 103 (15), 5793-5798 (2006).
- Kilaru, S., Schuster, M., Latz, M., Guo, M., Steinberg, G. Fluorescent markers of the endocytic pathway in Zymoseptoria tritici. Fungal Genetics and Biology. 79, 150-157 (2015).
- Fu, C., Tanaka, A., Free, S. J. Neurospora crassa 1,3-α-glucan synthase, AGS-1, is required for cell wall biosynthesis during macroconidia development. Microbiology. 160, 1618-1627 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。