Method Article
Aplicación de colorantes fluorescentes selectivos de membrana y pared celular para imágenes de células vivas de hongos filamentosos
En este artículo
Resumen
Los colorantes fluorescentes vitales son herramientas esenciales para el análisis de imágenes de células vivas en la biología moderna de células fúngicas. Este artículo detalla la aplicación de colorantes fluorescentes establecidos y menos conocidos para el seguimiento de la dinámica de la membrana plasmática, la endo-/exócicosis y la morfogénesis de la pared celular en hongos filamentosos.
Resumen
La aplicación de colorantes fluorescentes selectivos de membrana y pared celular para análisis de imágenes de células vivas de la dinámica de los orgásulos en células fúngicas comenzó hace dos décadas y desde entonces continúa contribuyendo en gran medida a nuestra comprensión de los hongos filamentosos modo de vida. Este artículo proporciona una guía práctica para la utilización de los dos tintes de membrana FM 1-43 y FM 4-64 y las cuatro manchas de pared celular Calcofluor Blanco M2R, Solophenyl Flavine 7GFE 500, Pontamine Fast Scarlet 48 y Congo Red. El enfoque se centra en su aplicación de dosis bajas para determinar la tinción libre de artefactos, sus propiedades de co-imagen y su evaluación cuantitativa. Los métodos presentados son aplicables a todas las muestras de hongos filamentosos que se pueden preparar de las maneras descritas. Los enfoques fundamentales de tinción pueden servir como puntos de partida para las adaptaciones a las especies que podrían requerir diferentes condiciones de cultivo. En primer lugar, las propiedades biofísicas y bioquímicas se revisan ya que su comprensión es esencial para el uso de estos colorantes como manchas fluorescentes verdaderamente vitales. En segundo lugar, se presentan protocolos paso a paso que detallan la preparación de varios tipos de muestras de hongos para imágenes fluorescentes de células vivas. Por último, los experimentos de ejemplo ilustran diferentes enfoques para: (1) identificar defectos en la organización espacio-temporal de la enditosis en mutantes genéticos, (2) caracterizar comparativamente la colocalización compartida y distinta de las proteínas diana etiquetadas con GFP en la vía endocítica, (3) identificar defectos de la pared celular morfogenética en un mutante genético, y (4) monitorear la biogénesis de la pared celular en tiempo real.
Introducción
Hace veinte años, la forma en que la morfogénesis hiplórica y la biología celular molecular subyacente podían visualizarse en hongos filamentosos fue revolucionada por la aplicación de la membrana fluorescente selectiva Fei Mao tinte FM 4-641. Más tarde, el beneficio del tinte de unión a la quitina Calcofluor White como marcador fluorescente vital de la dinámica de la pared celular de los hongos se realizó2. Desde entonces, tanto los colorantes como sus variantes se han convertido en una parte inherente de los análisis de imágenes de células vivas de la dinámica de los organosílas en los hongos, y continúan proporcionando información sin precedentes sobre el estilo de vida de los hongos filamentosos. Este artículo detalla la aplicación de colorantes fluorescentes establecidos y menos conocidos para el seguimiento de la dinámica de la membrana plasmática, la endo- y la excitesis y la morfogénesis de la pared celular en hongos filamentosos. Los ensayos de seguimiento de la endotosis permiten abordar varias cuestiones biológicas celulares relacionadas con el estudio general de la endocitasis3. Para ello, la localización, velocidad y sucesión de compartimentos manchados tras la adición de tinte FM se registra mediante microscopía de lapso de tiempo y se compara cuantitativamente entre las cepas de hongos probadas4. Los colorantes de la pared celular delinean el límite exterior de la célula y permiten el seguimiento de eventos morfogenéticos, incluyendo el crecimiento polarizado de la punta hiphal2, ramificación hipal5, fusión hiphal6,7 y formación del tabique8. Además, facilitan la cuantificación de la deposición de la pared celular localizada y la identificación de defectos durante la biogénesis de la pared celular9. Debido a que el conocimiento detallado de las propiedades bioquímicas y biofísicas de cualquier marcador fluorescente es un requisito previo fundamental para su exitosa aplicación in vivo, estas características se resumen primero para los seis colorantes que aparecen en este artículo.
Colorantes selectivos de membrana
Los teñiques de istriil FM (Fei Mao) son moléculas anfifílicas pequeñas que no pueden pasar pero se asocian de forma reversible con el prospecto externo de la bicapa lipídica de las membranas biológicas10. Son prácticamente no fluorescentes en solución acuosa, pero se vuelven intensamente fluorescentes tras laintegración de la membrana plasmática, generando excelentes relaciones señal-ruido (S/N)11 . Estas propiedades las hacen ideales para visualizar la dinámica de la membrana plasmática y del organelo intracelular, incluido el seguimiento de la endo- y la exócitosis12. El FM 1-43 verde-fluorescente y el FM 4-64 rojo-fluorescente son los dos marcadores de membrana fluorescente más utilizados para estos fines. SynaptoGreen C4 y SynaptoRed C2 son moléculas genéricas de proveedores alternativos que se pueden utilizar indistintamente en lugar de FM 1-43 y FM 4-64, respectivamente.
Los tintes de estilo comprenden tres regiones estructurales clave: (1) la cola lipofílica que facilita la inserción del tinte en la bicapa lipídica, (2) el núcleo del fluoróforo que determina las propiedades espectrales del tinte y está constituido por dos anillos aromáticos conectados por uno a tres enlaces dobles, y (3) la cabeza hidrófila cargada positivamente que impide la inserción completa y la permeación del tinte a través de la membrana (Figura 1A).
Cuanto más larga es la cola lipofílica, mayor es la hidrofobicidad del tinte y por lo tanto la afinidad de unión a la membrana, pero la menor es su solubilidad del agua y la tasa de destinción de la membrana. Por lo tanto, diferentes variantes de tinte FM producen diferentes dinámicas de tinción y patrones. La mayor hidrofobicidad de la FM 1-43 de cola C4 proporciona una señal de fluorescencia más fuerte y estable en las membranas plasmáticas y los orgánulos internos más rápido que el FM 4-64 de cola C 2 más corto, cuando se aplica a concentraciones equimolares(Figura 2).
Es importante destacar que las tasas de asociación/disociación constantes y altas de ambos tintes FM11 con tiempos de retención promedio de 1–6 s por molécula de tinte individual13 reducen las posibilidades de interrupción localizada de la función de la membrana, por ejemplo, mediante la modificación de la fluidez de la membrana o la interacción permanente forzada de proteínas de membrana. Esta es probablemente la razón clave por la que estas moléculas se pueden utilizar como disaños vitales. Sin embargo, las concentraciones de tinte FM por encima de 50 m son tóxicas para los hongos y las células vegetales2,14, y la evidencia de los protoplastias de tabaco BY-2 indica que más de 20 m de tinte FM conducen a la saturación de la membrana plasmática14. Por lo tanto, es aconsejable no exceder este límite, sobre todo teniendo en cuenta que se ha logrado una excelente toma de imágenes con tan solo 2-5 m15,16.
En particular, las propiedades espectrales de los dedos FM varían mucho dependiendo del microambiente de membrana en particular (revisado14). Generalmente, los espectros de excitación y emisión de colorantes FM en soluciones de disolvente puro (como se suele proporcionar en la información del producto) difieren significativamente de la que se puede consultar en entornos celulares y, en la mayoría de los casos, no se pueden consultar directamente para seleccionar ajustes de imágenes de células vivas. Los máximos de excitación/emisión de FM 1-43 y FM 4-64, por ejemplo, se convierten en cambios azules en 37/46 nm y 43/64 nm, respectivamente, cuando se unen a membranas fúngicas en comparación con sus soluciones en metanol (Tabla 1).
Los fundamentos innovadores para el uso de FM 4-64 y FM 1-43 para el seguimiento de la membrana plasmática, la endo-/exócitosis y la dinámica de los organigramas, incluyendo el Spitzenk-rper y las mitocondrias, ya han sido documentados exhaustivamente para una amplia gama de especies de hongos filamentosos anteriormente2,4,17,18,19. Los ajustes de imagen recomendados para ambos colorantes FM que funcionan en varias especies de hongos filamentosos se describen en la Figura 1B. Sin embargo, las limitaciones técnicas del equipo disponible o condiciones celulares y experimentales particulares, como el medio de cultivo, el pH o la temperatura, pueden requerir algunas adaptaciones. Afortunadamente, los tejos FM operan en un amplio rango espectral, y muy buenos resultados de imagen se logran mediante emocionantes FM 1-43 con 514 nm o FM 4-64 con 488 nm. Por lo tanto, la configuración de imagen óptima debe determinarse individualmente para cada tipo de muestra y aplicación prevista.
El considerable desplazamiento de Stoke de más de 135 nm de FM 4-64 permite una excelente co-imagen simultánea con fluoróforos que emiten luz verde; esto se explota con frecuencia para evaluar la dinámica de localización intracelular de proteínas de fusión etiquetadas con proteínas fluorescentes verdes (GFP) en relación con la membrana plasmática y la vía endolítica9,20.
Colorantes selectivos de pared celular
Calcofluor White M2R (CFW), también comercializado como Fluorescent Brightener 28, es probablemente el tinte fluorescente más conocido utilizado para manchar las paredes celulares de bacterias, hongos, algas, plantas superiores e insectos. Inicialmente utilizado como agente blanqueamiento óptico en la industria del papel, textil y detergente, sus beneficios para el diagnóstico clínico de infecciones fúngicas se realizaron a tiempodel 21,22. Debido a que CFW intercala irreversiblemente en la naciente cadena de quitina, perturba el conjunto microfibril de quitina normal durante la biogénesis de la pared celular generando así tensión en la pared celular23. Esto a su vez desencadena un mecanismo de reparación de daños en la pared celular que conduce a la deposición de la pared celular localmente mayor como resultado de la activación de glucano y quitinas sintasa24,25. Este fenómeno puede ocurrir con cualquier tinte que opera por unión estable a los polímeros de pared celular, depende de la concentración y es más notable en las puntas hiphal que representan las partes más prolíficas de crecimiento y por lo tanto más sensibles del micelio(Figura 3). Recientemente se ha proporcionado un resumen completo de la maquinaria molecular que responde a los daños en la pared celular26.
El tinte por sobredosis en combinación con fototoxicidad puede conducir a una lisis celular rápida de los compartimentos hiphales (Película 1). No obstante, se puede aprovechar una mayor sensibilidad a las concentraciones de tinte que son "vitales" en el tipo salvaje para identificar defectos en la biosíntesis de la pared celular de mutantes de pérdida de función de genes9. Para CFW y Congo Red (CR), otro colorante textil también conocido como Rojo Directo 28 y empleado como mancha de pared celular específica de la quitina y de la quitina para hongos e insectos27,28, se han determinado concentraciones umbral que inducen fuertemente a las sintetas de quitina > 60 M CFW y > 70 m CR, respectivamente, mientras que las concentraciones <15 m de tinte no alteraron o inhibieron el crecimiento de hongos29,30,31. Hickey et al. colocaron esta concentración umbral para CFW en 25 m2. Por lo tanto, es aconsejable utilizar concentraciones de tinte a 5 m para excluir los artefactos relacionados con el estrés y asegurar el uso de estas moléculas como verdaderos "colorantes fluorescentes vitales"2,32. Esto también se aplica a Solophenyl Flavine 7GFE 500 (SPF) y Pontamine Fast Scarlet 4B (PFS), sinónimo de Direct Yellow 86 y Direct Red 23, respectivamente, otros dos tintes de pared celular útiles cuya aplicación de hongos se ha reportado por primera vez hace más de una década33. Pero a pesar de sus notables propiedades espectrales34,35, el uso de ambos tendedes ha sido desde entonces muy limitado36,37. Como se ha mostrado anteriormente para 1,5 M CFW2, 2 M SPF son suficientes para resolver la dinámica de la pared celular en condiciones nativas con una resolución temporal muy alta (Película 2). Los mismos resultados se pueden obtener con 2 M CR o PFS.
Juntos, estos cuatro colorantes, CFW, SPF, PFS y CR, comprenden un conjunto de marcadores fluorescentes selectivos de pared celular que cubren casi el espectro de luz de emisión visible completo (400–700 nm) utilizado en microscopios fluorescentes modernos(Figura 4). El aumento significativo en la intensidad de la fluorescencia al unirse a los polímeros de pared celular es inherente a los cuatro y genera excelentes relaciones S/N. Esto a su vez permite mantener las concentraciones de tinte y la intensidad de la luz de excitación muy baja y permite realizar la tinción de la pared celular como "dosis baja" técnica de imagen de células vivas2. Debido a que estos colorantes de pared celular son de membrana plasmática impermeable, funcionan simultáneamente como manchas vivas/muertas. En particular, debido a sus espectros de luz de emisión extremadamente amplios, algunas limitaciones con respecto a las propiedades de co-imagen de CFW y SPF con otros fluoróforos deben ser cuidadosamente consideradas.
Protocolo
1. Preparación de muestras de hongos
- Precultivos de hongos
- Inocular la cepa deseada en un medio de agar sólido apropiado, como el agar dextrosa de patata (PDA) para Trichoderma atroviride o Vogel's Minimal Medium (VMM) para Neurospora crassa. Añada un marcador de selección adecuado al trabajar con deformaciones unitarias transformadoras.
- Incubar el precultivo a la temperatura óptima del organismo. Por ejemplo, T. atroviride a 25oC y N. crassa a 30oC, y ciclos de luz/oscuridad de 12 h/12 h hasta que se haya desarrollado un micelio esporulado pero aún no haya alcanzado el borde de la placa. En un plato de Tamaño estándar de Petri (9,2 cm), esto toma el tipo salvaje T. atroviride en 4-6 días de promedio, mientras que el tipo salvaje N. crassa llega a esta etapa después de 3-4 días en promedio.
- Cultivo de colonias de hongos
- Usando un bisturí estéril, corte un pequeño bloque de agar de 3 mm x 3 mm que transporta micelio no esporulado desde el borde de la colonia del precultivo.
- Coloque el bloque de agar en el centro de una placa mediana sólida fresca para inocular el cultivo experimental.
- Incubar el cultivo experimental de acuerdo con la etapa de desarrollo destinada a ser investigada. Por ejemplo, el t. atrovitrito de tipo salvaje requiere 20–22 horas a 25 oC en la oscuridad para desarrollar colonias de aproximadamente 2 cm de diámetro en PDA, mientras que el tipo salvaje N. crassa alcanza diámetros de colonia de unos 4 cm después de 14-16 h de incubación a 30 oC en la oscuridad en VMM.
NOTA: La incubación en la oscuridad evita la formación de pigmentos que podrían introducir autofluorescencia. Para eliminar la fluorescencia de fondo medio del cultivo experimental, sustituya el agar por el 1,5% p/v de un agente solidificador transparente (consulte la Tabla de materiales)y cualquier medio complejo por un medio mínimo definido.
- Cultivo de cultivos sólidos de germling
- Utilice 5 ml de solución de sal fisiológica estéril (0,9% w/v NaCl) para cosechar esporas conidiales de la placa precultivatoria y recoger la suspensión de esporas resultante en un tubo de tapa de tornillo de 15 ml.
- Mezcle bien la suspensión de las esporas mediante un vórtice vigoroso y, posteriormente, filtre sobre una tira de 1 cm x 5 cm de tejido de filtro estéril (ver la Tabla de Materiales)ligeramente rellenada en una punta de pipeta de 1 ml (tanto montada como autoclaveda de antemano) en un tubo estéril fresco.
- Determinar la densidad de las esporas con una cámara de conteo celular y preparar una suspensión de 1 x 107 células/ml de esporas con solución fisiológica de sal.
NOTA: La suspensión de las esporas se puede mantener a 4 oC durante un máximo de dos semanas. - Preparar una placa de Petri de tamaño estándar (9,2 cm) con 20 ml de medio sólido y añadir 15-20 perlas de vidrio estériles (3 mm) en la parte superior.
- Pipetear 200 l de la suspensión de esporas en la placa media y distribuir uniformemente las células a través de toda la placa mediante un suave temblor. Recoger las cuentas de vidrio en un vaso de precipitados con 70% de etanol para su reutilización.
- Incubar el cultivo experimental de acuerdo con la etapa de desarrollo destinada a ser investigada. Por ejemplo, el tipo salvaje T. atroviride requiere 5-6 h a 25 oC en la oscuridad para desarrollar germlings conidiales en PDA, mientras que el tipo salvaje N. crassa desarrolla germlings conidiales después de 3-4 h de incubación a 30 oC en la oscuridad en VMM.
NOTA: Para eliminar cualquier fluorescencia de fondo medio del cultivo experimental, sustituya el agar por el 1,5% p/v de un agente solidificador transparente y cualquier medio complejo por un medio mínimo definido.
- Cultivo de cultivos de germling líquido
- Llene 190 ml de medio de cultivo líquido en cada pocal de un microdeslizamiento de 8 pozos con cámara.
- Añadir 10 l de una solución de esporas de 1 x 107 células/ml (preparada en los pasos 1.4.1–1.4.3) y mezclar pipeteando suavemente hacia arriba y hacia abajo unas cuantas veces. El número total resultante de celdas es 1 x 105 por pozo.
- Incubar el cultivo experimental de acuerdo con la etapa de desarrollo destinada a ser investigada. Por ejemplo, el tipo salvaje T. atroviride requiere 5-6 h a 25 oC en la oscuridad para desarrollar gérmenes conidiales en caldo de dextrosa de patata (PDB), mientras que el tipo salvaje N. crassa desarrolla germlings conidiales después de 3-4 h de incubación a 30 oC en la oscuridad en VMM líquido.
2. Preparación de soluciones de trabajo de tinte
- Para garantizar la solubilidad total de cada tinte, prepare soluciones de stock de 2 mM en dimetilsulfóxido (DMSO) añadiendo la cantidad adecuada (ver pesos exactos en la Tabla 1)a 1 mL de DMSO 100% y mezcle bien mediante vórtice.
ADVERTENCIA: Asegúrese de tomar el DMSO de una botella sellada con tabiques; debe ser un líquido transparente y claro. Al entrar en contacto con el aire, DMSO se vuelve marrón, probablemente debido a la oxidación de las impurezas de trazas, y podría afectar negativamente el crecimiento celular o la tinción de tinte. - El filtro esteriliza la solución en stock a través de un filtro de membrana de jeringa de 0,2 m en un tubo de reacción nuevo y estéril de 1,5 ml. Para minimizar el blanqueo de tinte, envuelva el tubo en papel de aluminio.
NOTA: La solución de colorante se puede alícuota en volúmenes más pequeños para evitar ciclos de descongelación/congelación, y mantenerse a 4 oC durante varios meses. - Preparar una solución de trabajo de tinte acuoso de 20 m disolviendo 2 ml de solución de material de tinte en 198 ml de agua destilada estéril en un tubo de reacción estéril fresco de 1,5 ml. Para minimizar el blanqueo de tinte, envuelva el tubo en papel de aluminio.
NOTA: La solución de trabajo con tinte debe prepararse recién el día del experimento. - Durante el montaje de la muestra (ver sección 3), la solución de trabajo con tinte se diluirá de forma estándar 1:10, lo que resultará en una concentración final de tinte de 2 m y un 0,1% p/v de concentración final de DMSO.
NOTA: La elección de diferentes factores de dilución simplemente cambiando la relación de volumen entre la solución de trabajo de tinte y el líquido de montaje, permite adaptar fácilmente la concentración de tinte final deseada.
ADVERTENCIA: Para evitar efectos no deseados debido sano tinte o toxicidad DMSO, el factor de dilución no debe caer por debajo de 1:4 para producir concentraciones finales máximas de 5 mm de tinte y 0,4% p/v DMSO. Las concentraciones más altas de tinte saturarán rápidamente el sistema y evitarán la cuantificación fiable de la señal, mientras que más del 0,5% p/v (62,5 mM) DMSO puede perjudicar el desarrollo celular38.
3. Preparación de muestras para microscopía
- Monte muestras de colonias de hongos (paso 1.2) o cultivos sólidos de germling (paso 1.3) por el método de bloque de agar invertido.
- Mantenga listo un deslizamiento limpio de la cubierta de vidrio de 24 mm x 60 mm (#1 de 0,13 a 0,16 mm de espesor) y agregue 18 ml de medio mínimo líquido (VMM o M9) o solución fisiológica de sal en el centro.
- Añadir 2 ml de la solución de trabajo de colorante de 20 m a los 18 ml de líquido y mezclar bien pipeteando varias veces, evitando al mismo tiempo la producción de burbujas de aire.
NOTA: Cuando se trabaja con varias muestras, es aconsejable preparar una mezcla maestra de solución de tinte líquido para todos con el fin de garantizar la misma concentración de tinte durante todo el experimento. - Con un bisturí limpio, corte una muestra de 15 mm x 15 mm de la periferia de la colonia o cultivo sólido de germling y colóquelo verticalmente al lado de la gota media en el resbalón de la cubierta.
- Usando el bisturí para apoyar el borde superior del bloque y un dedo para mantener el lado posterior del bloque en su lugar, baje lentamente el lado que lleva el micelio o germlings sobre el líquido. La muestra ya está lista para ser trasladda a la etapa del microscopio.
ADVERTENCIA: Es esencial hacer esto lentamente y con mucho cuidado para minimizar el estrés mecánico en las células y evitar que las burbujas de aire queden atrapadas entre la muestra y el resbalón de la cubierta.
- Monte los cultivos de germling líquido del paso 1.4.
NOTA: Lo más conveniente es que los cultivos de germling líquido en diapositivas de micropozos con cámara se pueden transferir directamente y manipular en el escenario del microscopio.- Añadir 22 ml de solución de trabajo de tinte a 200 ml de medio líquido para dar lugar a concentraciones finales estándar de 2 mm de tinte y 0,1% p/v DMSO.
NOTA: Los cultivos de germolas líquidas tienen la gran ventaja de que los colorantes fluorescentes (u otros productos químicos, como los inhibidores) se pueden agregar en cualquier punto de tiempo deseado del experimento, también durante la grabación. En ese caso, se debe tener especial cuidado para administrar las gotas líquidas muy lentamente con el fin de no molestar a las células. Las vibraciones del sistema y el movimiento Browniano ya podrían introducir algún movimiento celular.
- Añadir 22 ml de solución de trabajo de tinte a 200 ml de medio líquido para dar lugar a concentraciones finales estándar de 2 mm de tinte y 0,1% p/v DMSO.
4. Microscopía de células vivas
- Ajuste los ajustes básicos de adquisición de imágenes. Los siguientes ajustes de adquisición de imágenes permiten capturar la dinámica de tinción en hifas individuales y son aplicables a los dos ensayos siguientes
- Aplique una potencia láser del 5-10% del 20% de la potencia de salida completa del dispositivo.
- Utilice un objetivo de inmersión en agua o glicerol Plan Apo 60x–63x con una apertura numérica alta s.1.2.
- Restringir el área de adquisición de imágenes al contorno de las hifas estableciendo un tamaño de imagen de 1024 x 256 píxeles y utilizando un factor de zoom óptico de 2 a 3.
- Utilice el escaneo bidireccional con 400 Hz. Ajuste el tamaño del orificio a 1 unidad ventilada.
- Establezca la ganancia del detector más sensible al 100%.
- Para la grabación de vueltas de tiempo, inicie la adquisición de imágenes con un fotograma cada 15 s para permitir una resolución temporal razonable sin producir blanqueo de colorante ni estrés fotográfico.
- Para la grabación 3D, establezca el límite espacial superior e inferior en el límite de las secciones ópticas de hifas y espacio a 1 m de distancia para permitir una resolución espacial razonable.
NOTA: Debido al rápido crecimiento de las hifas, la alta resolución espacial en el eje Z a menudo se ha sacrificado por una alta resolución temporal en el eje X/Y o al revés. Sólo los microscopios de escaneo láser confocales muy modernos son lo suficientemente rápidos como para satisfacer ambas demandas.
- Ensayos de aceptación de la endotosis
- Consulte la Figura 1 y la Tabla 1 para identificar los mejores ajustes de excitación/emisión para FM 1-43 y/o FM 4-64 disponibles en el sistema de microscopía y ajuste en consecuencia.
NOTA: Con la concentración recomendada de 2 M, la incorporación de tinte FM en la membrana plasmática es instantánea en las células sanas normales. Todo el proceso desde la tinción inicial de la membrana plasmática hasta la apariencia del tinte en vacuolas tubulares generalmente se completa dentro de 30-45 min a temperatura ambiente. El aumento de la concentración de tinte FM aumenta la relación S/N y, por lo tanto, produce imágenes de mayor contraste más rápido. Sin embargo, también acelera el proceso de etiquetado, lo que dificulta la diferenciación cronológica de la tinción de la orgánula. - Inicie la grabación de imágenes utilizando los ajustes básicos de adquisición de imágenes recomendados anteriormente y evalúe los resultados.
- Optimice la configuración de adquisición de imágenes a la resolución espacial y temporal necesaria para capturar el aspecto de la dinámica de membrana plasmática o endotosis en la que se centra el experimento.
- Por ejemplo, para capturar dinámicas muy rápidas en X/Y, disminuya el tamaño general de la imagen, idee solo un plano focal y aumente la velocidad de escaneo a 1 fps. Para una resolución más alta en el eje Z, disminuya la resolución en X/Y, disminuya el tamaño de la imagen y disminuya la distancia entre las secciones ópticas a 0,5 m.
- Consulte la Figura 1 y la Tabla 1 para identificar los mejores ajustes de excitación/emisión para FM 1-43 y/o FM 4-64 disponibles en el sistema de microscopía y ajuste en consecuencia.
- Dinámica de pared celular
- Consulte la Figura 4 y la Tabla 1 para identificar los mejores ajustes de excitación/emisión para el tinte de pared celular aplicado disponible en el sistema de microscopía y ajuste en consecuencia.
NOTA: Debido a sus amplios espectros de emisión, CFW y SPF no son adecuados para la co-imagen simultánea con otros fluoróforos, predominantemente GFP. Algunas restricciones incluso se aplican a los enfoques de imágenes secuenciales con estos distetipos, y por lo tanto tienen que ser optimizados individualmente. - Inicie la grabación de imágenes utilizando los ajustes básicos de adquisición de imágenes recomendados anteriormente y evalúe los resultados.
NOTA: Con la concentración recomendada de 2 M, la incorporación de tinte en la pared celular no es necesariamente instantánea, sino razonablemente rápida. Todo el proceso de formación del tabique, por ejemplo, toma en promedio alrededor de 5-7 min a temperatura ambiente20. Aumentar la concentración de tinte de pared celular aumenta la relación S/N y, por lo tanto, produce imágenes de mayor contraste más rápido. Sin embargo, también introduce rápidamente artefactos debido a la reparación inducida del daño de la pared celular. - Optimice la configuración de adquisición de imágenes a la resolución espacial y temporal necesaria para capturar el aspecto de la morfogénesis de la pared celular en la que se centra el experimento, como se describe en la sección 4.2.3.
- Consulte la Figura 4 y la Tabla 1 para identificar los mejores ajustes de excitación/emisión para el tinte de pared celular aplicado disponible en el sistema de microscopía y ajuste en consecuencia.
Resultados
Análisis cuantitativo de imágenes
Además de visualizar "simplemente" los procesos celulares, las imágenes de células vivas permiten extraer información cuantitativa de los datos grabados. Generalmente, el análisis cuantitativo de imágenes es un tema complejo cuya discusión adecuada está mucho más allá del alcance de este artículo, por lo tanto, el lector se refiere a libros de texto dedicados y artículos39,40,41. Sin embargo, se proporcionan algunas directrices básicas asociadas a los siguientes datos de ejemplo. Deben cumplirse varios requisitos previos cruciales para permitir la cuantificación de la imagen, entre ellos: 1) deben aplicarse molaridades definidas de los colorantes fluorescentes a todas las muestras para permitir una comparación relativa precisa; 2) los ajustes de adquisición de imágenes deben ajustarse de manera que los detectores de luz de emisión nunca estén saturados, de lo contrario se cortarán las intensidades máximas; 3) los ajustes de adquisición de imágenes deben permanecer fijos durante el transcurso de un conjunto experimental coherente, de lo contrario se introducen cambios de intensidad artificial; (4) los datos de imagen deben guardarse en un formato de archivo sin pérdida de información junto con la información meta que contiene todos los ajustes del instrumento; y (5) el análisis de imágenes debe limitarse al número mínimo de pasos posteriores al procesamiento necesarios para extraer la información cuantitativa deseada.
Por lo general, los estándares definidos que permitirían la cuantificación absoluta de las señales grabadas no están disponibles en la célula viva. Así, en su forma más simple, el análisis cuantitativo de imágenes se basa en la comparación relativa de intensidades de píxeles dentro de la misma imagen o entre diferentes imágenes grabadas con ajustes idénticos. El software de control de microscopios del fabricante normalmente incluye herramientas básicas para el postprocesamiento de imágenes y el análisis cuantitativo, o se puede actualizar con funciones adicionales para segmentación de imágenes, umbrales, imágenes de relación, etc. Varias plataformas de procesamiento de imágenes de código abierto, diferentes adecuadas para varios tipos de datos de imágenes, están disponibles, incluyendo ImageJ (https://imagej.net; https://imagej.nih.gov/ij/), icy (http://icy.bioimageanalysis.org/), CMEIAS Bioimage Informatics (http://cme.msu.edu/cmeias/) y Wimasis (https://www.wimasis.com/en/).
Los datos de ejemplo presentados se procesaron y analizaron utilizando la plataforma ImageJ. Brevemente, regiones específicas de la celda, como el ápice de la punta ondal o el septo, están marcadas con herramientas de selección de área considerables, y la intensidad de todos los píxeles contenidos se lee con el software implementado "herramienta de medición". Los datos de intensidad de los controles y las muestras experimentales se transfieren a un archivo de hoja de cálculo, analizado matemáticamente y preparado como gráfico. Se pueden encontrar más detalles en las publicaciones originales citadas.
Ejemplo de datos 1: Ensayos de admisión de FM 4-64
Las muestras de hongos se cultivaron como colonias (paso 1.2) y se montaron mediante el método de bloque de agar invertido (paso 3.1). La concentración final de FM 4-64 fue de 1,67 m. Ajustes de imagen: HCX PL APO 63x/1.3 NA objetivo de inmersión de glicerol en un microscopio de escaneo láser confocal invertido (ver la Tabla de Materiales); FM 4-64 excitación a 488 nm y emisión a 600–700 nm; un fotograma cada minuto para hasta 150 min. FM 4-64 ensayos de admisión identificados defectos en la organización espacio-temporal de la endotosis en la eliminación de genes y mutantes de sobreexpresión de genes de la proteína sur7-familia específica de hongos (Sfp2) de T. atroviride9 (Figura 5).
Ejemplo de datos 2: FM 4-64 co-manchado de proteínas de fusión fluorescentes dirigidas a compartimentos endolíticos
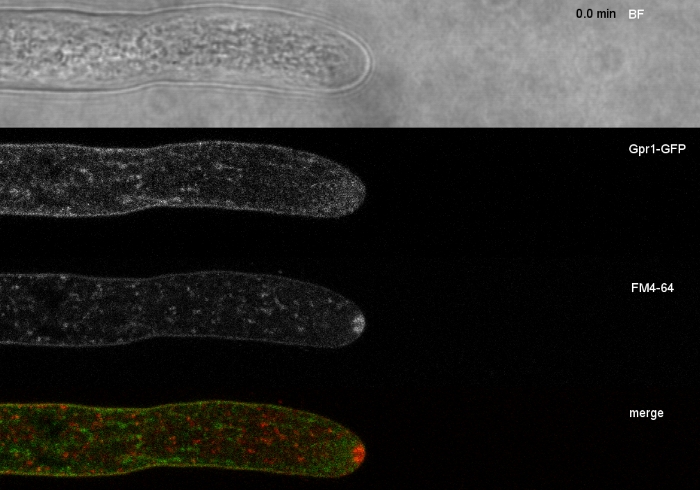
Las muestras de hongos se cultivaron como colonias (paso 1.2) y se montaron mediante el método de bloque de agar invertido (paso 3.1). La concentración final de FM 4-64 fue de 2 M. Ajustes de imagen: CFI Plan Apo VC 60x/1.2 NA XC objetivo de inmersión en agua en un microscopio de exploración láser confocal invertido (ver la Tabla de Materiales); Excitación GFP a 488 nm y emisión a 500–530 nm, excitación FM 4-64 a 488 nm y emisión a 600–700 nm, y campo brillante con detector de luz transmitida, todo simultáneamente; se empleó un fotograma cada 15 s por hasta 15 minutos. Se empleó la co-tinción FM4-64 para relacionar la distribución subcelular de las dos proteínas transmembranas etiquetadas con proteínas transmembranas mejoradas con etiqueta de proteína fluorescente verde (EGFP) Sfp2 y Gpr1 con la vía endocytica en T. atroviride (Figura 6, Película 3, Película 4).
Ejemplo de datos 3: CO-tinción FM 4-64 para la identificación de diferencias morfogenéticas
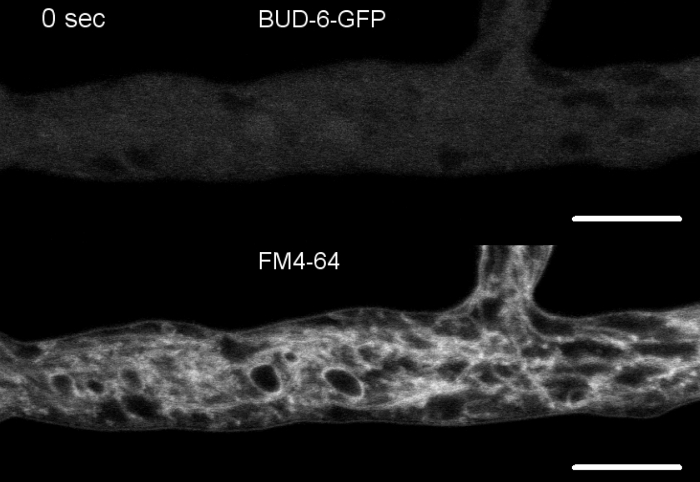
Las muestras de hongos se cultivaron como colonias (paso 1.2) y se montaron mediante el método de bloque de agar invertido (paso 3.1). La concentración final de FM 4-64 fue de 2 M. Ajustes de imagen: Plan Apochromat 63x/1.4 NA objetivo de inmersión en aceite en un microscopio de escaneo láser confocal invertido (ver la Tabla de Materiales); Excitación GFP a 488 nm y emisión a 505–550 nm, excitación FM 4-62 a 488 nm y emisión a 574–691 nm, y campo brillante con detector de luz transmitida, todo simultáneamente; un fotograma cada 8,5 s por hasta 15 minutos de co-manchación FM4-64 permitió relacionar la dinámica de localización subcelular de la proteína compleja polarica BUD-6 etiquetada fluorescentemente a procesos dependientes del tráfico endosoma, tales como la formación de septa y crecimiento de la punta hipal polarizada, y caracterizó las diferencias en la organización subcelular y la arquitectura de bombo hal entre el tipo salvaje y las cepas mutantes de N. crassa (Figura 5.
Ejemplo de datos 4: La tinción de la pared celular revela diferencias morfogenéticas
Las muestras de hongos se cultivaron como colonias (paso 1.2) y se montaron mediante el método de bloque de agar invertido (paso 3.1). Se utilizaron concentraciones finales de 2 M CFW, 20 M SPF y 100 M CR. Ajustes de imagen: CFI Plan Apo VC 60x/1.2 NA XC objetivo de inmersión en agua en un microscopio de escaneo láser confocal invertido (ver la Tabla de Materiales); Excitación CFW y SPF a 405 nm y emisión a 430–470 nm, excitación CR a 543 nm y emisión a 580–620 nm. Las diferentes propiedades de interacción de CFW, SPF y CR con polímeros de pared celular resaltan las diferencias morfogenéticas entre el mutantesfp2 y la cepa de tipo salvaje de T. atroviride9. El aumento del estrés de la pared celular infligida por concentraciones elevadas de tinte ocurre más rápido y más pronunciado en el mutante en comparación con el tipo salvaje. Además, las mismas imágenes permiten cuantificar las diferencias morfogenéticas con respecto al diámetro hiphal y la distancia septal entre ambas cepas(Figura 8).
Ejemplo de datos 5: Monitoreo en tiempo real de la biosíntesis de la pared celular
Los germlings se cultivaron como cultivo líquido (paso 1.4) en microtopos con cámara de 8 pozos (paso 3.2). La concentración final de CFW fue de 0,12 m. Ajustes de imagen: Plan CFI Apo VC 60x/1.2 NA XC objetivo de inmersión en agua en un microscopio de exploración láser confocal invertido; Excitación CFW a 405 nm y emisión a 420–470 nm; un fotograma cada 20 s durante un máximo de 35 minutos. La muy baja concentración de CFW evita la saturación de la pared celular con moléculas de tinte y permite el monitoreo cuantitativo en tiempo real de la biosíntesis de la pared celular. Esto revela que la deposición de nuevo material de pared celular no es uniforme, pero responde muy rápidamente a las tensiones físicas localizadas resultantes del desplazamiento relativo de una célula al apego de células celulares antes de la fusión germinal en N. crassa (Figura 9, Película 6).
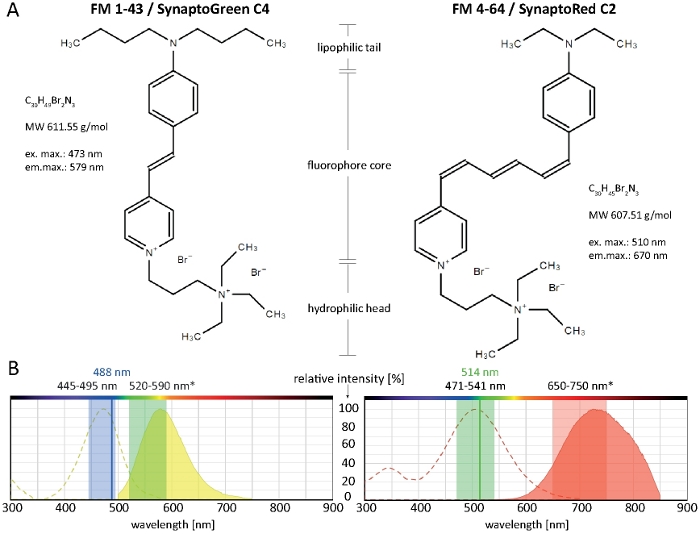
Figura 1: Propiedades bioquímicas y biofísicas de los dedos FM. (A) Estructuras químicas de FM 1-43/SynaptoGreen C4 y FM 4-64/SynaptoRed C2. (B) Los espectros de absorción y emisión de ambos tintes FM, superpuestos con los ajustes de imagen óptimos para tintes ligados a membrana en hongos filamentosos: 445–495 nm de luz azul excitarán FM 1-43 con 100-80% de eficiencia, mientras que 488 nm de un láser Argón excitarán el tinte con 91% de eficiencia. Debido al cambio azul en la unión de membrana (*), el rango de detección óptimo de la emisión FM 1-43 está entre 520-590 nm. Del mismo modo, los ajustes de imagen óptimos para FM 4-64 en hongos son 471–541 nm (100–80% de eficiencia) cuando se utiliza una fuente de luz de excitación policromática o 514 nm (99% de eficiencia) cuando se utiliza un láser Argón, y 650–750 nm para la detección de luz de emisión. Haga clic aquí para ver una versión más grande de esta figura.
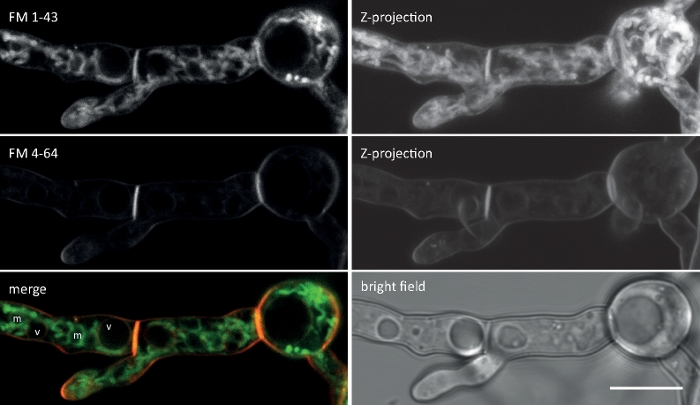
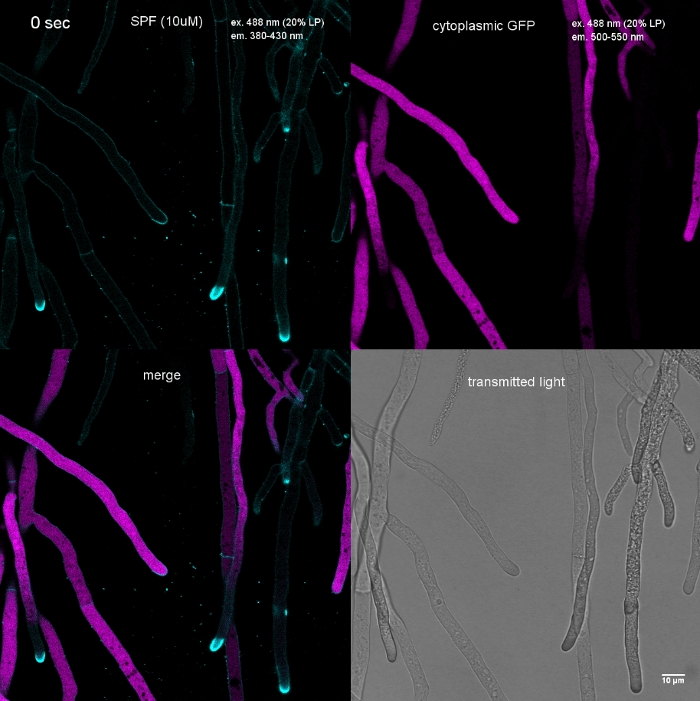
Figura 2: Co-imagen simultánea de FM 1-43 y FM 4-64. Se añadió una mezcla equimolar de ambos colorantes a un cultivo líquido de germling de N. crassa produciendo una concentración final de 10 m. A 25 minutos después de la adición del tinte, FM 1-43 ha manchado la membrana plasmática y ya acumulado en las membranas internas, incluyendo mitocondrias fuertemente manchadas (m) pero en gran medida excluyendo las membranas vacuolar (v), y es más de ocho veces más fuerte en comparación con FM 4-64 (intensidades medias de fluorescencia 176 a 21, respectivamente), cuya hidrofbicidad/hidrofilicidad más alta menor ralentiza su tasa de internalización, lo que conduce a un tiempo de vivienda prolongado en la membrana plasmática. Barra de escala a 10 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.
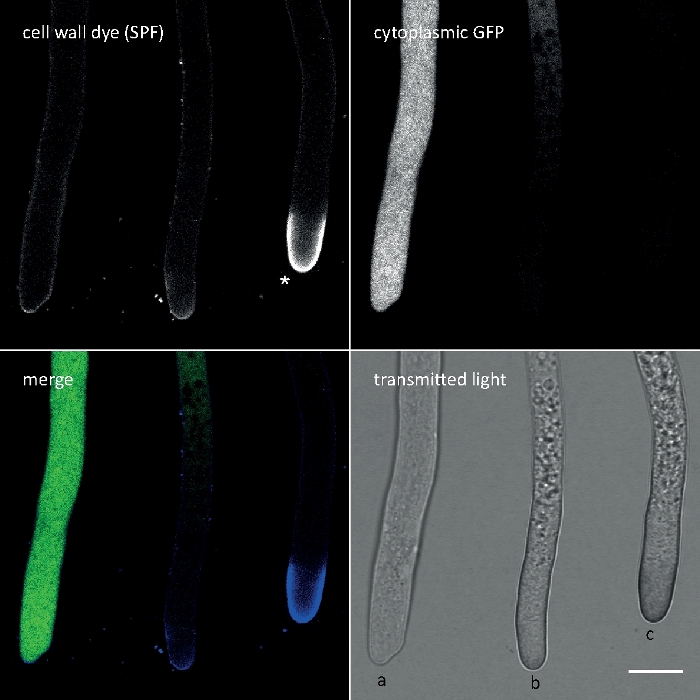
Figura 3: La deposición inducida por el estrés de la pared celular de los polímeros de la pared celular en el ápice de la punta a menudo implica la autolisis celular. Las hifas de T. atroviride que expresan gFP citoplásmico se teñieron con 10 m de solofenilo flavina 7GFE 500 (SPF) e imágenes inmediatamente después del montaje. Hifas no estresadas (a), hifas estresadas con deposición ligeramente mayor de glucano/quitina en el ápice y autolisis progresante (b), y hifas muy estresadas con pronunciada tapa apical de glucano/quitina (asterisco) y autolisis terminal (c) evidente por la pérdida total de fluorescencia GFP y vacuolacia extensiva. Barra de escala a 10 m. Consulte la Película 1 para ver la secuencia del curso de tiempo completo. Tenga en cuenta que las tres hifas estaban situadas una al lado de la otra. Haga clic aquí para ver una versión más grande de esta figura.
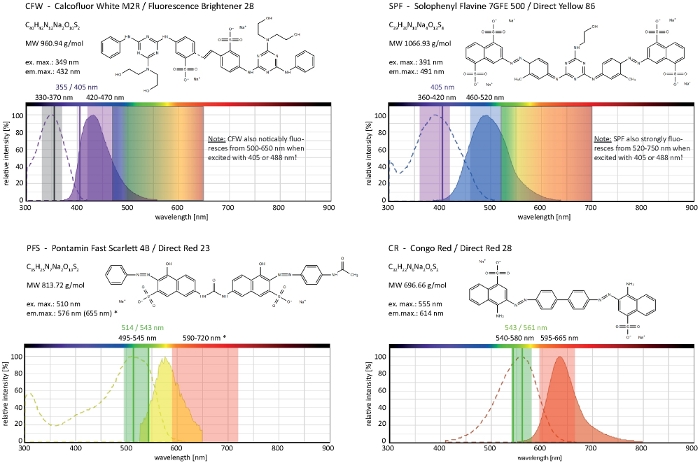
Figura 4: Propiedades bioquímicas y biofísicas de los colorantes selectivos de la pared celular. Las características químicas dadas son las de las sales sódicas de cada tinte. Los espectros de absorción y emisión corresponden a los de entornos celulares. Las líneas de excitación láser monocromáticas indicadas (escritas en color), los rangos de excitación policromática aplicables a los microscopios de epifluorescencia y los rangos de detección de luz de emisión son los recomendados para la toma de imágenes en hongos filamentosos. Dos líneas de excitación láser se indican cuando ambos funcionan igual de bien. (*) El espectro de emisión de sLP ligado a la pared celular es significativamente más descambiado en rojo que el indicado anteriormente33, sin embargo, resultando en muy buenas s/N-ratios con concentraciones de tinte más bajas que las utilizadas anteriormente. El espectro completo de CR no está disponible actualmente, por lo tanto el de rojo del Nilo (CAS No: 7385-67-3) se muestra como la coincidencia más cercana. La información detallada sobre las propiedades espectrales de CR se puede encontrar en otros lugares42. Haga clic aquí para ver una versión más grande de esta figura.
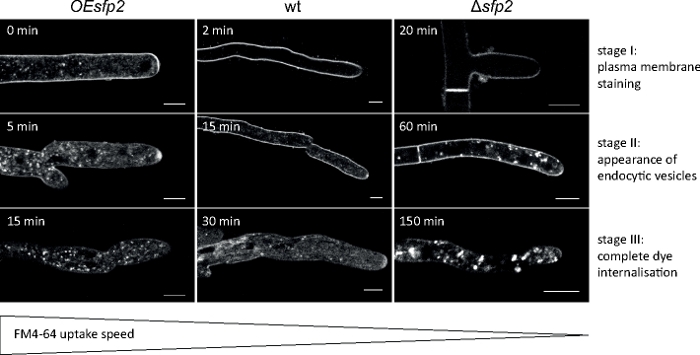
Figura 5: Influencia de Sfp2 en la toma endocytica de FM4-64. Tres etapas clave sucesivas de la sugestión de tinte FM son fácilmente discernibles en el tipo salvaje (wt). Etapa I: tinción exclusiva de la membrana plasmática, etapa II: primera aparición del tinte FM en vesículas endocyticas, y etapa III: tinción exclusiva de vesículas y endomembranas endocyticas. Los patrones de tinción equivalentes se muestran en el punto más temprano de su apariencia. En comparación con el tipo salvaje T. atroviride, la endoctitosis se acelera ligeramente en el mutante que expresa demasiado sfp2 (OEsfp2), mientras que la aceptación del tinte se retrasa drásticamente en el mutante de eliminación sfp2 (sfp2). Por ejemplo, la acumulación de tinte en la membrana plasmática se produce instantáneamente en OEsfp2 pero toma 2 minutos en el tipo salvaje; y la internalización completa del tinte FM de la membrana plasmática se produce 10 veces más rápido en OEsfp2 en comparación consfp2. Barras de escala de 5 m. La figura se reproduce de Atanasova et al.9 de acuerdo con la licencia Creative Commons (https://creativecommons.org/licenses/by/4.0/). Haga clic aquí para ver una versión más grande de esta figura.
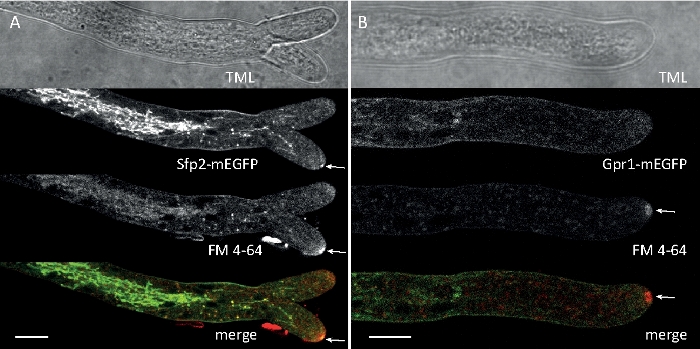
Figura 6: La co-tinción de proteínas de membrana etiquetadas por EGFP con FM 4-64 facilita la diferenciación de la dinámica de localización subcelular distinta en T. atroviride. (A) La proteína de dominio de cuatro transmembranas Sfp2 colocaliza con orgánulos etiquetados FM4-64, incluyendo la membrana plasmática y el septa, el Spitzenk-rper (Spk; flecha) y vacuolas tubulares presumibles. (B) La proteína de siete transmembranas Gpr1 similar a GPCR co-localiza con FM4-64 a los mismos orgánulos que Sfp2, excepto las barras De escala Spk., 10 m. Consulte Película 3 y Película 4 para ver secuencias de cursos de tiempo completo. La cifra ha sido modificada de Atanasova et al.9 de acuerdo con la Licencia Creative Commons. Haga clic aquí para ver una versión más grande de esta figura.
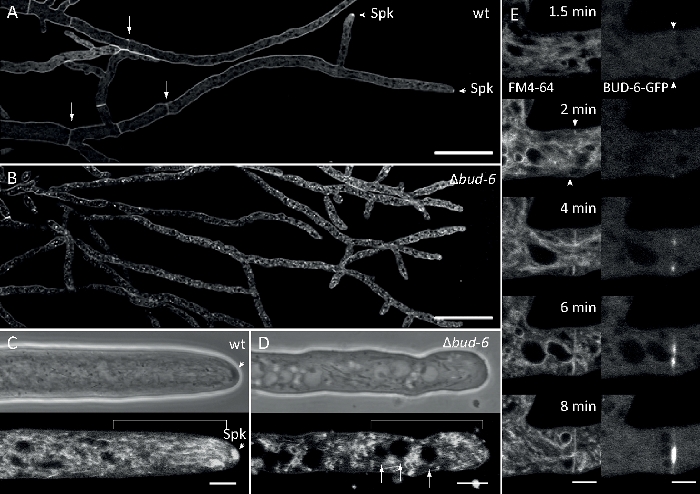
Figura 7: La tinción FM 4-64 diferencia el mutante de loscogollos-6 del tipo salvaje, y localiza el BUD-6 en el anillo septal. (A) FM 4-64 tinción de hifas del tipo n. crassa salvaje (las flechas indican septa; puntas de flecha indican el Spk). (B) Septa y Spk están ausentes en elbrote-6. Barras de escala, 50 m.(C y D) Primer plano del ápice hiplócico y subapex de tipo salvaje (C) y"bud-6(D). Spk (cabeza de flecha) se diferencia en el tipo salvaje, pero noen el bud-6. Los corchetes indican la zona de exclusión nuclear no establecida en elbrote-6. Barras de escala a 5 m. (E) reclutamiento de BUD-6-GFP en el sitio de septación incipiente antes de la invaginación de la membrana plasmática (cabezas de flecha) y la constricción del tabique que lo acompaña. Barras de escala de 5 m. Consulte Película 5a y Película 5b para ver las secuencias completas del curso de tiempo. La figura ha sido reproducida con modificaciones de Lichius et al.16 de acuerdo con la Licencia Creative Commons. Haga clic aquí para ver una versión más grande de esta figura.
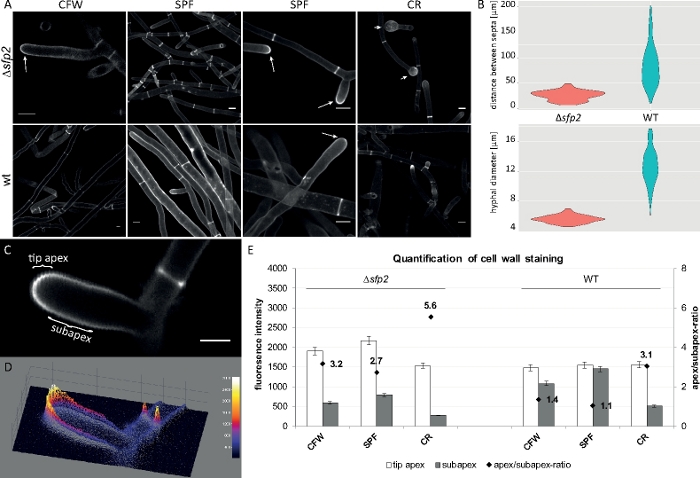
Figura 8: La eliminación de sfp2 cambia el patrón de deposición del material de la pared celular y afecta a la morfogénesis hipal de T. atroviride. (A) La tinción de CFW y SPF revela un aumento de la deposición de la pared celular ensfp2 (flechas) en comparación con el tipo de comodín (wt). La tinción CR induce una hinchazón extensa de la punta sólo ensfp2 (puntas de flecha). Las barras de escala de 10 m.(B) Los defectos morfogenéticos enel sfp2 incluyen distancias septales significativamente reducidas (sfp2 a 26,0 m, tipo silvestre a 85 m; n a 60; ANOVA Pr < 2-16) y diámetros hipócndos más pequeños(sfp2 a 5,6 m, tipo salvaje a 12,6 m; n a 100; ANOVA Pr < 2-16). (C) Aumento de la fluorescencia del tinte en el ápice de la punta en comparación con el subapex. Barra de escala a 5 m. (D) Trazado de superficie 3D codificado por intensidad de (C). (E) Cuantificación de intensidades de fluorescencia relativas ensfp2 y tipo silvestre (n a 55). La figura ha sido reproducida de Atanasova et al.9 de acuerdo con la licencia Creative Commons. Haga clic aquí para ver una versión más grande de esta figura.
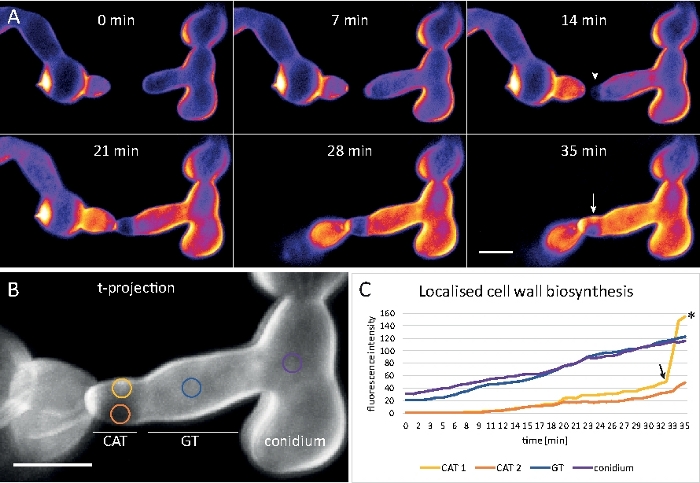
Figura 9: Monitoreo en tiempo real de la biosíntesis de la pared celular. (A) Fusión del tubo de anastomosis conidial (CAT) entre germlings de N. crassa. El contacto físico se hace evidente por la respuesta de par germinado (21-28 min). La fluorescencia CFW codificada por colores de intensidad indica regiones con poca (azul oscuro) e intensa (amarillo) deposición de la pared celular. La punta de localización inicialmente sin manchar (punta de flecha), deposita nuevo material de pared celular al entrar en contacto con la punta y en el área experimentando la mayor tensión física (flecha). Barra de escala a 5 m. Consulte la película 6 para ver la secuencia del curso de tiempo completo. Figura reproducida a partir de38 con permiso. (B) Proyección de (A) que indica cuatro regiones circulares en las que se midieron intensidades de fluorescencia. Barra de escala a 5 m. (C) Gráfica de las regiones indicadas que muestra el rápido aumento de la biosíntesis de la pared celular localizada en respuesta al estrés físico (CAT 1, flecha). En el tubo germinal (GT) y el cuerpo de las esporas (conidio), la biosíntesis de la pared celular aumenta constantemente. Haga clic aquí para ver una versión más grande de esta figura.
Película 1: Estrés de pared celular inducido por el tinte. Se añadieron 10 M de SPF (cian) a las hifas de T. atroviride que expresan GFP citoplasma (magenta). La tinción extensiva de la punta ocurre inmediatamente, seguida de la lisis rápida de los compartimentos hipgoles en 2 minutos; evidente por la desaparición de la fluorescencia gFP. Por favor, haga clic aquí para descargar esta película.
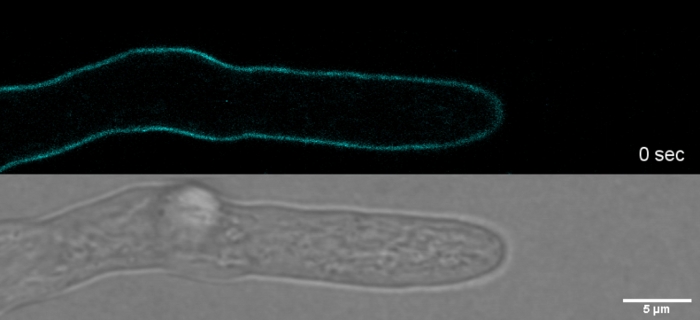
Película 2: Tinción vital SPF. 2 M SPF (cian) permiten rastrear el crecimiento de la punta de las hifas de T. atroviride con alta resolución espacial y temporal sin inducir artefactos de tensión de la pared celular en el ápice de la punta. Por favor, haga clic aquí para descargar esta película.
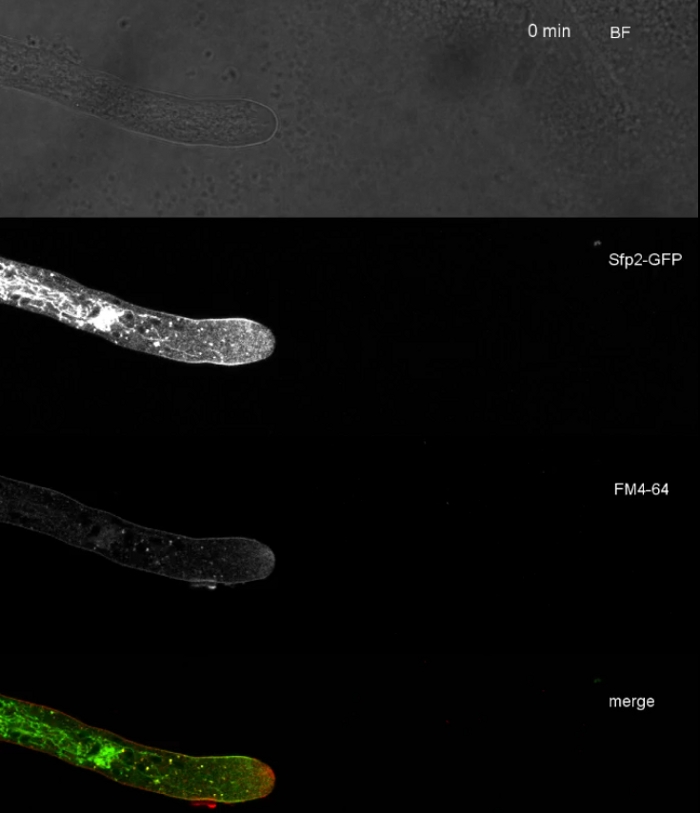
Película 3: FM 4-64 co-manchado de Sfp2-GFP. La co-tinción de T. atroviride que expresa Sfp2-mEGFP (verde) con 1,67 M FM 4-64 (rojo) revela la localización superpuesta y distinta de la proteína de membrana con la vía endocytica. Por favor, haga clic aquí para descargar esta película.
Película 4: FM 4-64 co-manchado de Gpr1-GFP. La co-tinción de T. atroviride que expresa Gpr1-mEGFP (verde) con 1,67 M FM 4-64 (rojo) revela la localización superpuesta y distinta de la proteína de membrana con la vía endocytica. Por favor, haga clic aquí para descargar esta película.
Película 5: FM 4-64 co-manchado de BUD-6-GFP. (5a) La co-tinción de N. crassa expresando BUD-6-GFP (verde) con 2 M FM 4-64 (rojo) permite el seguimiento de la dinámica de BUD-6 durante la formación del tabique en relación con la invaginación de la membrana plasmática asociada. (5b) Imagen recortada y fusionada de (5a). Por favor, haga clic aquí para descargar Película 5a
Por favor, haga clic aquí para descargar Película 5b.
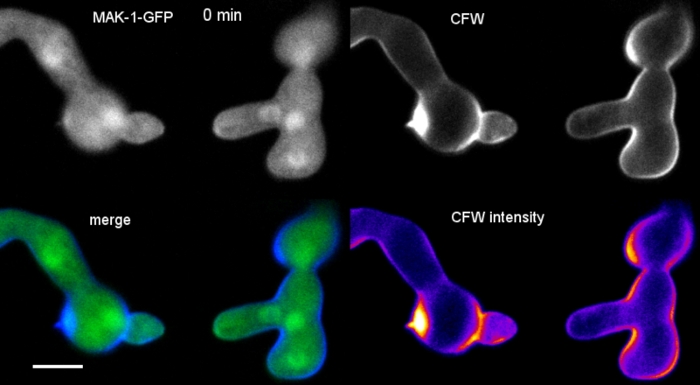
Película 6: Monitoreo en tiempo real de la biosíntesis de la pared celular. N. burssa germlings que expresan MAK-1-GFP (verde) fueron co-teñidas con 0.12 M CFW (azul) para revelar biogénesis localizado de la pared celular durante la fusión germinal mediada por CAT. Tenga en cuenta que hay cierto sangrado a través de la señal CFW en los canales GFP, lo que ilustra que SPF o CR son mejores opciones como colorantes co-imágenes secuenciales y simultáneas para GFP, respectivamente. Por favor, haga clic aquí para descargar esta película.
Tabla 1: Propiedades de los colorantes fluorescentes selectivos de membrana y pared celular. * Valores de mg/ml corregidos para que el contenido reducido de pureza/tinte resulte equimolaridad en todas las soluciones; n.i.a. - No hay información disponible. Haga clic aquí para descargar esta tabla.
Discusión
Este artículo continúa el trabajo innovador que estableció el uso de varios colorantes fluorescentes como marcadores de orgánulo vitales para hongos filamentosos a principios de la década de 20002,4,43, e intenta discutir las propiedades biológicas fotofísicas y celulares de los colorantes FM y los colorantes de pared celular seleccionados con mayor detalle que antes. Especialmente con respecto a los efectos celulares no deseados, como la saturación de la membrana o el daño de la pared celular, que ocurren por encima de ciertas concentraciones de tinte. Lo que anteriormente se ha considerado no tóxico a nivel celular ahora se considera tóxico a nivel molecular. A pesar de que estos efectos pueden ser muy sutiles y no directamente evidentes por cambios obvios en el comportamiento del orgánuel o celular, cualquier posible interferencia de la aplicación de tinte que no sea la visualización tiene que ser minimizada para la investigación de la función molecular nativa. Afortunadamente, la mejora de la sensibilidad y la eficiencia cuántica de los detectores modernos, como los detectores de fotodiodo de avalancha de silicio (Si-ADC)44 o el detector de área Airyscan45,facilitan el uso de cantidades de tinte aún más bajas que antes. Otro objetivo clave del artículo es ejemplificar las propiedades de co-imagen de estos colorantes con otros fluoróforos, lo más importante, los de GFP como la proteína fluorescente más utilizada en la biología. Esto debería ayudar al diseño de experimentos de imagen que tienen como objetivo correlacionar la dinámica de localización subcelular de las proteínas de fusión fluorescentes con las de la pared celular fúngica, la membrana plasmática o la vía de endocitosis, etc.
La creación de imágenes en condiciones naturales y libres de estrés es clave para la adquisición de datos fiables. Algunas consideraciones prácticas con respecto al medio de cultivo y la preparación de muestras tienen como objetivo proporcionar un punto de partida para encontrar las condiciones óptimas que permitan la observación sin artefactos y durante mucho tiempo de células sanas y sin tensión con la mayor proporción S/N posible para cualquier muestra dada. No existe una forma universal de lograr resultados de imágenes fiables y significativos. Es inherente al enfoque de que la variación biológica de la muestra, la subjetividad y las expectativas del microscopista, así como el postprocesamiento de imágenes, tengan una influencia significativa en la adquisición e interpretación de datos, respectivamente. Por lo tanto, la experiencia práctica del microscopista, su conocimiento íntimo sobre la biología celular del hongo objeto de investigación, así como la preparación hábil de muestras para crear condiciones tan "naturales" e inalteradas como sea posible en un entorno de laboratorio, son primordiales para adquirir y evaluar datos de imagen que reflejen con veracidad los fenómenos celulares estudiados. Como regla general, la aparición de efectos secundarios no deseados de los tintes fluorescentes, que van desde la activación sutil y no obviamente visible de la membrana plasmática o de la pared celular remodelando las vías de respuesta al estrés hasta la inducción citotóxica directa de la autolisis celular, sólo se puede prevenir de forma segura mediante la aplicación de bajas concentraciones de tinte de 2 m.
La aplicación de colorantes fluorescentes es simple, sin embargo, sus especificidades están mal caracterizadas. Una fuerza clave del uso de colorantes fluorescentes es la simplicidad preparatoria de los protocolos experimentales. El cultivo y el muestreo del hongo, la adición del tinte y el montaje en la etapa del microscopio son (con práctica) sencillos. El ajuste de los ajustes básicos de imagen, incluidas las longitudes de onda de excitación y emisión, los tiempos de exposición, los ajustes del curso de tiempo, etc., siguen las reglas biofísicas simples del microscopio y las reglas biológicas de los colorantes fluorescentes utilizados dentro de las células. La Tabla 1 tiene la intención de apoyar la identificación de la combinación de tinte o tinte más adecuada para la experimentación. Además, los colorantes fluorescentes tienen un precio razonable, están fácilmente disponibles con una alta calidad confiable y, por lo tanto, garantizan una aplicación altamente reproducible.
Dos restricciones importantes del uso de colorantes fluorescentes selectivos de membrana o pared celular son el (a menudo) conocimiento limitado de sus propiedades de tinción precisas, que en la mayoría de los casos no son específicos en el organigrama y el nivel molecular, y sus efectos secundarios no deseados dependientes de la concentración. Los colorantes FM son específicos para las bicapas lipídicas que participan en la endo- y la exócitosis. Sin embargo, precisamente qué orgánulos subcelulares se etiquetan sucesivamente en las condiciones probadas no es inmediatamente evidente y requiere la comparación de diferentes variantes de tinte FM, y el co-etiquetado con marcadores específicos de orgásmeridos adicionales. La preferencia de FM 1-43 para las membranas mitocondriales, en comparación con FM 4-64, es un ejemplo. Los colorantes selectivos de la pared celular muestran una especificidad variable para los tres polímeros principales de la pared celular de los hongos. Se cree que el CFW es una mancha inespecífica para los glucanos y la quitina, el SPF es más selectivo para los glucanos de -1,4, y CR se cree que es altamente selectivo para las citinas y las.citinas. Actualmente no se dispone de información sobre la especificidad de unión de SLP a polisacáridos de pared de células fúngicas. En qué proporción se etiqueta más eficazmente el polímero de pared celular de los hongos a una concentración de tinte determinada en las especies de hongos objeto de investigación, y la aplicación de mediciones detalladas adquiridas in vitro o in vivo en otros organismos u otras especies de hongos debe considerarse con mucho cuidado. Desafortunadamente, esta información es escasa y muy dispersa en la literatura35,42,46. Actualmente no se dispone de registros más recientes que seguirían en estudios anteriores33 para proporcionar nuevas perspectivas sobre las propiedades de tinción precisas de los colorantes destacados específicamente en los hongos.
Los controles de imágenes son esenciales para evaluar los patrones de tinción y las respuestas celulares con precisión. Probablemente la parte más difícil, sin embargo, es conocer la biología celular del hongo tan bien que los cambios registrados en la localización subcelular de la membrana y la pared celular selectiva de colorantes fluorescentes, alteraciones en la arquitectura celular o patrón de crecimiento hiphal pueden estar relacionados exclusivamente y con confianza con los efectos previstos del tratamiento experimental. Para ello, es crucial tener buenos controles junto con cualquier nuevo experimento de imágenes de células vivas. Estos incluyen el tipo salvaje no tratado como control de imágenes negativo para excluir la autofluorescencia de fondo y el ruido del detector de la imagen adquirida, y para tener un comparador morfológico cuando se trabaja con mutantes. Además, un control de imagen positivo, por ejemplo una cepa que expresa GFP o RFP en el citoplasma u otra proteína marcadora fluorescente bien conocida, es esencial para establecer la intensidad de la luz de excitación al mínimo requerido y tener un control de vitalidad celular. Una vez establecidos estos controles, el uso de colorantes fluorescentes no se limita únicamente a las tareas de visualización, sino que su dinámica de tinción dependiente de la concentración, así como los efectos secundarios dependientes de la concentración pueden ser explotados analíticamente; por ejemplo, para el monitoreo cuantitativo de la biosíntesis de la pared celular en tiempo real o para la identificación de fenotipos mutantes específicos en ensayos de susceptibilidad47.
Las aplicaciones futuras mejoradas dependen de un análisis funcional detallado de las propiedades de tinción de tinte. Un desafío importante en curso es mejorar y automatizar aún más los análisis cuantitativos de imágenes con el fin de avanzar en la evaluación funcional de la dinámica subcelular de los colorantes fluorescentes selectivos de membrana y pared celular en hongos filamentosos. Para ello, primero se requieren estudios extensos y cuantitativos de colocalización de estos colorantes con marcadores de polímeros de pared celular y orgánulo conocidos en combinación con cepas mutantes deficientes en vías de transporte particulares o que carecen de componentes estructurales específicos. Varios marcadores de endocitosis para análisis comparativos con colorantes FM están disponibles48,49, y con respecto a las especificidades de unión todavía mal caracterizadas de los colorantes de pared celular en hongos, la aplicación de anticuerpos específicos de glucano etiquetados fluorescentemente50 podría proporcionar una posibilidad para abordar este problema.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia y nada que revelar.
Agradecimientos
Agradecemos al Fondo De Ciencia Tirolés (TWF) por conceder #256524 a AL, al Fondo de Ciencia y Tecnología de Viena (WWTF) por proporcionar subvenciones #LS13-086 a SZ, y al Fondo de Publicaciones de la Universidad de Innsbruck para apoyar la publicación de acceso abierto. Los autores también agradecen al Departamento de Zoología de la Universidad de Innsbruck por proporcionar el microscopio de escaneo láser confocal Leica TCS SP5 II.
Materiales
| Name | Company | Catalog Number | Comments |
| BRAND cell counting chamber | Merck | BR718005 | Thoma format |
| Calcofluor White M2R | Merck/Sigma-Aldrich | F3543 | cell wall dye |
| CFI Plan Apo VC 60x/1.2 NA XC WI | Nikon | MRD07602 | water immersion objective |
| CFI Plan Apo VC 60x/1.2 NA XC WI | Nikon | MRD07602 | water immersion objective |
| Congo Red | Merck/Sigma-Aldrich | C6277 | cell wall dye |
| Dimethyl sulfoxide | VWR | 8,36,73,230 | organic solvent |
| Eclipse TE2000-E with C1 scanning unit | Nikon | custom configuration | inverted laser scanning confocal microscope used to acquire example data 2 and 4 |
| Eclipse TE2000-U with Bio-Rad Radiance 2100 scannig unit | Nikon | custom configuration | inverted laser scanning confocal microscope used to acquire example data 5 |
| FM 1-43 | Merck/Sigma-Aldrich | S6814 | membrane dye |
| FM 4-64 | Merck/Sigma-Aldrich | S6689 | membrane dye |
| Glass beads | Rettberg | 1340691030 | 3 mm glass beads |
| Glass cover slips | Thermo Fisher Scientific | BB02400600A113MNT0 | 24 x 60 # 1 glass cover slips |
| HCX PL APO 63x/1.3 NA Glyc | Leica | 15506353 | glycerol immersion objective |
| LSM 510 Meta | Zeiss | custom configuration | inverted laser scanning confocal microscope used to acquire example data 3 |
| M9 Minimal Medium | Merck/Sigma-Aldrich | M6030 | generic fungal growth medium |
| Micro-slide 8-well | ibidi | 80826 | ibiTreat #1.5 polymer coverslip |
| Miracloth | Merck/Millipore | 475855-1R | polyester filtration material |
| Petri dish | Sarstedt | 8,21,472 | 92 x 16 mm culture dish w/o cams |
| Phytagel | Merck/Sigma-Aldrich | P8169 | transparent gelling agent |
| Plan Apochromat 63x/1.4 NA Oil DIC | Zeiss | 440762-9904-000 | oil immersion objective |
| Pontamine Fast Scarlet 4B | Merck/Sigma-Aldrich | 212490 | cell wall dye |
| Potato Dextrose Agar (PDA) | BD Difco | 213400 | fungal growth medium for T. atroviride |
| Potato Dextrose Broth (PDB) | BD Difco | 254920 | fungal growth medium for T. atroviride |
| Reaction tube | Sarstedt | 72,706 | 1.5 mL SafeSeal tube |
| Scalpel | B.Braun | 5518016 | Cutfix sterile scalpel #23 |
| Screw cap tube | Sarstedt | 6,25,54,502 | 15 mL polypropylene tube |
| Solophenyl Flavine 7GFE 500 | CIBA | 1485385V6 | cell wall dye |
| SynaptoGreen C4 | Biotum | 70020 | membrane dye |
| SynaptoRed C2 | Biotum | 70021 | membrane dye |
| Syringe membrane filter | Thermo Fisher Scientific | 723-9945 | 0.45 µm SFCA syringe filter |
| TCS SP5 II | Leica | custom configuration | inverted laser scanning confocal microscope used to acquire example data 1 |
| Vogel's Minimal Medium (VMM) | FGSC | Fungal Genetics Stock Centre | fungal growth medium for N. crassa |
Referencias
- Read, N. D., Fischer, S., Parton, R. M. Imaging Spitzenkörper, pH and calcium dynamics in growing fungal hyphae. Pesticide Science. 54 (2), 179-181 (1998).
- Hickey, P. C., Swift, S. R., Roca, M. G., Read, N. D. Live-cell imaging of filamentous fungi using vital fluorescent dyes and confocal microscopy. Microbial Imaging. , 63-87 (2004).
- Jelínková, A., et al. Probing plant membranes with FM dyes: tracking, dragging or blocking. The Plant Journal. 61 (5), 883-892 (2010).
- Fischer-Parton, S., et al. Confocal microscopy of FM4-64 as a tool for analysing endocytosis and vesicle trafficking in living fungal hyphae. Journal of Microscopy. 198 (3), 246-259 (2000).
- Harris, S. D. Branching of fungal hyphae: regulation, mechanisms and comparison with other branching systems. Mycologia. 100 (6), 823-832 (2008).
- Roca, M. G., Arlt, J., Jeffree, C. E., Read, N. D. Cell biology of conidial anastomosis tubes in Neurospora crassa. Eukaryotic Cell. 4 (5), 911-919 (2005).
- Becker, Y., et al. The fungal cell-wall integrity MAPK cascade is crucial for hyphal network formation and maintenance of restrictive growth of Epichloë festucae in symbiosis with Lolium perenne. Molecular Plant-Microbe Interactions. 28 (1), 69-85 (2015).
- Justa-Schuch, D., Heilig, Y., Richthammer, C., Seiler, S. Septum formation is regulated by the RHO4-specific exchange factors BUD3 and RGF3 and by the landmark protein BUD4 in Neurospora crassa. Molecular Microbiology. 76 (1), 220-235 (2010).
- Atanasova, L., et al. The Gpr1-regulated Sur7 family protein Sfp2 is required for hyphal growth and cell wall stability in the mycoparasite Trichoderma atroviride. Scientific Reports. 8 (1), 12064 (2018).
- Betz, W. J., Mao, F., Bewick, G. S. Activity-dependent fluorescent staining and destaining of living vertebrate motor nerve terminals. Journal of Neuroscience. 12 (2), 363-375 (1992).
- Wu, Y., Yeh, F. L., Mao, F., Chapman, E. R. Biophysical characterization of styryl dye-membrane interactions. Biophysical Journal. 97 (1), 101-109 (2009).
- Betz, W. J., Mao, F., B, S. C. Imaging exocytosis and endocytosis. Current Opinion in Neurobiology. 6, 365-371 (1996).
- Hoopmann, P., Rizzoli, S. O., Betz, W. J. Imaging synaptic vesicle recycling by staining and destaining vesicles with FM dyes. Cold Spring Harbor Protocols. 2012 (1), 77-83 (2012).
- Bolte, S., et al. FM-dyes as experimental probes for dissecting vesicle trafficking in living plant cells. Journal of Microscopy. 214, 159-173 (2004).
- Riquelme, M., et al. Spitzenkorper localization and intracellular traffic of green fluorescent protein-labeled CHS-3 and CHS-6 chitin synthases in living hyphae of Neurospora crassa. Eukayotic Cell. 6 (10), 1853-1864 (2007).
- Lichius, A., Yáñez-Gutiérrez, M. E., Read, N. D., Castro-Longoria, E. Comparative live-cell imaging analyses of SPA-2, BUD-6 and BNI-1 in Neurospora crassa reveal novel features of the filamentous fungal polarisome. PloS one. 7 (1), 30372 (2012).
- Peñalva, M. A. Tracing the endocytic pathway of Aspergillus nidulans with FM4-64. Fungal Genetics and Biology. 42 (12), 963-975 (2005).
- Dijksterhuis, J., Molenaar, D. Vesicle trafficking via the Spitzenkörper during hyphal tip growth in Rhizoctonia solani. Antonie van Leeuwenhoek. 103 (4), 921-931 (2013).
- Hickey, P. C., Read, N. D. Imaging living cells of Aspergillus in vitro. Medical Mycology. 47, 110-119 (2009).
- Delgado-Álvarez, D. L., Bartnicki-García, S., Seiler, S., Mouriño-Pérez, R. R. Septum development in Neurospora crassa: the septal actomyosin tangle. PLoS One. 9 (5), 96744 (2014).
- Hageage, G. J., Harrington, B. J. Use of Calcofluor White in clinical mycology. Laboratory Medicine. 15 (2), 109-112 (1984).
- Monheit, J. E., Cowan, D. F., Moore, D. G. Rapid detection of fungi in tissues using Calcofluor White and fluorescence microscopy. Archives of Pathology and Laboratory. 108 (8), 616-618 (1984).
- Herth, W., Schnepf, E. The fluorochrome Calcofluor White binds oriented to structural polysaccharide fibrils. Protoplasma. 105 (1-2), 129-133 (1980).
- Elorza, M. V., Rico, H., Sentandreu, R. Calcofluor White alters the assembly of chitin fibrils in Saccharomyces cerevisiae and Candida albicans cells. Journal of General Microbiology. 129 (5), 1577-1582 (1983).
- Lagorce, A., et al. Genome-wide analysis of the response to cell wall mutations in the yeast Saccharomyces cerevisiae. Journal of Biological Chemistry. 278 (22), 20345-20357 (2003).
- Sanz, A. B., García, R., Rodríguez-Peña, J. M., Arroyo, J. The CWI Pathway: regulation of the transcriptional adaptive response to cell wall stress in yeast. Journal of Fungi. 4 (1), (2017).
- Slifkin, M., Cumbie, R. Congo Red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Michels, J., Büntzow, M. Assessment of Congo Red as a fluorescence marker for the exoskeleton of small crustaceans and the cuticle of polychaetes. Journal of Microscopy. 238 (2), 95-101 (2010).
- Pancaldi, S., Poli, F., Dall'Olio, G., Vannini, G. L. Morphological anomalies induced by Congo Red in Aspergillus niger. Archives of Microbiology. 137 (3), 185-187 (1984).
- Roncero, C., Durán, A. Effect of Calcofluor White and Congo Red on fungal cell wall morphogenesis: in vivo activation of chitin polymerization. Journal of Bacteriology. 163 (3), 1180-1185 (1985).
- Kopeck, M., Gabriel, M. The influence of Congo Red on the cell wall and (1,3)- β-d-glucan microfibril biogenesis in Saccharomyces cerevisiae. Archives of Microbiology. 158 (2), 115-126 (1992).
- Heilmann, C. J., et al. Surface stress induces a conserved cell wall stress response in the pathogenic fungus Candida albicans. Eukayotic Cell. 12 (2), 254-264 (2013).
- Hoch, H. C., Galvani, C. D., Szarowski, D. H., Turner, J. N. Two new fluorescent dyes applicable for visualization of fungal cell walls. Mycologia. 97 (3), 580-588 (2005).
- Liesche, J., Ziomkiewicz, I., Schulz, A. Super-resolution imaging with Pontamine Fast Scarlet 4BS enables direct visualization of cellulose orientation and cell connection architecture in onion epidermis cells. BMC Plant Biology. 13, 226 (2013).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Knight, N. L., Sutherland, M. W. A rapid differential staining technique for Fusarium pseudograminearum in cereal tissues during crown rot infections. Plant Pathology. 60 (6), 1140-1143 (2011).
- Fajardo-Somera, R. A., et al. Dissecting the function of the different chitin synthases in vegetative growth and sexual development in Neurospora crassa. Fungal Genetics and Biology. 75, 30-45 (2015).
- Lichius, A. . Cell Fusion in Neurospora crassa. , (2010).
- Chen, W., Li, W., Dong, X., Pei, J. A Review of Biological Image Analysis. Current Bioinformatisc. 13 (4), 337-343 (2018).
- Goldman, R. D., Swedlow, J., Spector, D. L. . Live cell imaging: A laboratory manual. , (2010).
- Eliceiri, K. W., et al. Biological imaging software tools. Nature methods. 9 (7), 697-710 (2012).
- Zemanek, G., Jagusiak, A., Chłopaś, K., Piekarska, B., Stopa, B. Congo Red fluorescence upon binding to macromolecules - a possible explanation for the enhanced intensity. Bio-Algorithms and Med-Systems. 13 (2), 1187 (2017).
- Hickey, P. C., Jacobson, D. J., Read, N. D., Louise Glass, N. Live-cell imaging of vegetative hyphal fusion in Neurospora crassa. Fungal Genetics and Biology. 37 (1), 109-119 (2002).
- . Hamamatsu Si APD - high sensitivity photodiodes having an internal gain mechanism: Avalanche photodiode selection guide 2019 Available from: https://www.hamamatsu.com/resources/pdf/ssd/si_apd_kapd0001e.pdf (2019)
- Huff, J. The Airyscan detector from ZEISS: confocal imaging with improved signal-to-noise ratio and super-resolution. Nature Methods. 12, 1205 (2015).
- Thomas, J., Idris, N. A., Collings, D. A. Pontamine Fast Scarlet 4B bifluorescence and measurements of cellulose microfibril angles. Journal of Microscopy. 268 (1), 13-27 (2017).
- Ram, A. F. J., Klis, F. M. Identification of fungal cell wall mutants using susceptibility assays based on Calcofluor White and Congo Red. Nature Protocols. 1 (5), 2253-2256 (2006).
- Toshima, J. Y., et al. Spatial dynamics of receptor-mediated endocytic trafficking in budding yeast revealed by using fluorescent alpha-factor derivatives. Proceedings of the National Academy of Science of the USA. 103 (15), 5793-5798 (2006).
- Kilaru, S., Schuster, M., Latz, M., Guo, M., Steinberg, G. Fluorescent markers of the endocytic pathway in Zymoseptoria tritici. Fungal Genetics and Biology. 79, 150-157 (2015).
- Fu, C., Tanaka, A., Free, S. J. Neurospora crassa 1,3-α-glucan synthase, AGS-1, is required for cell wall biosynthesis during macroconidia development. Microbiology. 160, 1618-1627 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados