A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
القياس الكمي لوظيفة البطينين والتشكل عن طريق التصوير بالرنين المغناطيسي للقلب في الفئران ذات النطاقات الشرياني الرئوي
* These authors contributed equally
In This Article
Summary
لفهم الفيزيولوجيا المرضية للتكيف مع البطين الأيمن (RV) مع التحميل غير الطبيعي ، تعتبر النماذج التجريبية حاسمة. ومع ذلك ، فإن تقييم أبعاد عربة سكن متنقلة ووظيفتها أمر معقد وصعب. يوفر هذا البروتوكول طريقة لإجراء التصوير بالرنين المغناطيسي للقلب (CMR) كإجراء معياري غير جراحي في الفئران المعرضة لحمل ضغط RV.
Abstract
تعد وظيفة البطين الأيمن (RV) والفشل من المحددات الرئيسية للنتائج في أمراض القلب المكتسبة والخلقية ، بما في ذلك ارتفاع ضغط الدم الرئوي. يعد تقييم وظيفة RV والتشكل معقدا ، ويرجع ذلك جزئيا إلى الشكل المعقد ل RV. حاليا ، يعد التصوير بالرنين المغناطيسي للقلب (CMR) المعيار الذهبي للتقييم غير الجراحي لوظيفة RV ومورفولوجيا. يصف البروتوكول الحالي تصوير CMR في نموذج فأر لحمل ضغط RV الناجم عن ربط الشريان الرئوي (PAB). يتم إجراء PAB عن طريق وضع خياطة 6-0 حول الشريان الرئوي فوق إبرة 23 جرام. يتم تحديد التدرج PAB باستخدام تخطيط صدى القلب في 2 و 6 أسابيع. في 6 أسابيع ، يتم تقييم مورفولوجيا البطين الأيمن والأيسر ووظيفته عن طريق قياس كل من أحجام وكتلة البطين الانقباضي النهائي والانبساطي النهائي بمقدار عشر إلى إحدى عشرة شريحة سينمائية بسمك 1 مم باستخدام ماسح ضوئي للتصوير بالرنين المغناطيسي 9.4 T مزود بتدرج 1,500 طن متري / متر. تظهر النتائج التمثيلية أن PAB يؤدي إلى زيادة كبيرة في حمل ضغط RV ، مع تأثيرات كبيرة على مورفولوجيا البطينين ووظيفة RV. كما يظهر أنه في 6 أسابيع من حمل ضغط عربة سكن متنقلة ، يتم الحفاظ على النتاج القلبي. يتم تقديم بروتوكول قابل للتكرار هنا لقياس التشكل والوظيفة ثنائية البطينين في نموذج فأر لحمل ضغط RV وقد يكون بمثابة طريقة للتجارب التي تستكشف محددات إعادة تشكيل RV والخلل الوظيفي.
Introduction
المرضى الذين يعانون من أمراض القلب والأوعية الدموية المكتسبة والخلقية ، بما في ذلك ارتفاع ضغط الدم الرئوي (PH) ، معرضون لخطر الإصابة بخلل وظيفي في البطين الأيمن (RV) وفشل1. يتميز تكيف RV نتيجة لزيادة حمل الضغط بتضخم متحد المركز في المراحل المبكرة والتوسع التدريجي في المرحلة النهائية من المرض. علاوة على ذلك ، يرتبط باضطرابات في التمثيل الغذائي والمصفوفة خارج الخلية ، وعمليات الالتهاب ، وفي النهاية ، فشل RV2،3،4،5،6. تم تطوير نماذج حيوانية لاستكشاف العمليات الأساسية للتقدم نحو فشل عربة سكن متنقلة. ومع ذلك ، فإن تحسين النماذج والتقييم المناسب لوظيفة وأبعاد عربة سكن متنقلة كان يمثل تحديا. للتقييم غير الجراحي لوظيفة وأبعاد RV ، فإن التصوير بالرنين المغناطيسي للقلب (CMR) هو المعيار الذهبي. تنشئ هذه التقنية صورا للقلب النابض باستخدام مجال مغناطيسي قوي وموجات الترددات الراديوية. CMR متاح للبشر وللحيوانات مثل القوارض المختبرية. نظرا لأن هذا الأخير يتطلب دقة مكانية أعلى بسبب صغر حجم القلب ، يجب أن يكون المجال المغناطيسي المطلوب لتوفير صور مناسبة أعلى مقارنة بالبشر.
تتوفر نماذج متعددة تحاكي الحمل الزائد لضغط RV ، بما في ذلك نماذج PH7،8،9،10،11،12،13،14،15،16،17 ونماذج من حمل ضغط RV القريب2،3،10،18 ،19،20،21،22،23. يعتمد اختيار نموذج PH أو نموذج لحمل ضغط RV القريب على سؤال البحث: تأثير التدخل على الأوعية الدموية الرئوية وبالتالي ربما تعديل RV بعد الحمل (أي نماذج PH) ، أو التأثير المباشر على RV (أي نماذج ضغط RV القريبة). تتوفر عدة طرق للتحريض التجريبي للأس الهيدروجيني ، بما في ذلك استخدام أحادي الكروتالين (MCT) 12،13،14،16،22،24،25،26 ، MCT جنبا إلى جنب مع تحويلة الشريان الأورطي9 ، نقص الأكسجة المزمن7،27،28،29، ومزيج من مضاد مستقبلات عامل النمو البطاني الوعائي ، Sugen 5416 ، مع نقص الأكسجة المزمن8،10،30،31. تمثل هذه النماذج نماذج رئوية تدريجية لحمل ضغط RV القريب ولا تستهدف الأوعية الدموية الرئوية ولكنها تحفز حمولة لاحقة ثابتة عن طريق انقباض الشريان الرئوي ، مع زيادة مصاحبة في RV بعد الحمل2،3. يمكن إجراء ذلك عن طريق ربط خياطة (ربط الشريان الرئوي ، PAB) أو مشبك وعائي حول الشريان الرئوي. تم إجراء PAB في العديد من الأنواع الحيوانية ، وتمت دراسة أبعاد القلب ووظيفته بطرق مختلفة ، مثل علم الأنسجة ، وتخطيط صدى القلب عبر الصدر (بما في ذلك تتبع البقع) ، وقسطرة القلب2،32،33،34،35،36،37،38،39،40. يعد PAB في القوارض الصغيرة ، مثل الفئران ، أمرا صعبا. وذلك لأن الاختلافات الطفيفة بين ضيق انقباض الشريان قد أظهرت نتائج ملحوظة على درجة حمل ضغط عربة سكن متنقلة والحالة الوظيفية اللاحقة والبقاء على قيد الحياة. عندما يكون الانقباض ضيقا جدا ، سيموت أثناء العملية أو بعدها بفترة وجيزة ، في حين أن النمط الظاهري المطلوب لن يتحقق عندما لا يكون الانقباض ضيقا بدرجة كافية. ومع ذلك ، فإن استخدام الفئران له مزايا مقارنة بالحيوانات الأخرى ، بسبب إمكانيات التعديل الجيني الممتازة (أي النماذج المعدلة وراثيا أو بالضربة القاضية) والتكاثر السريع. هذا ذو قيمة مضافة في دراسة الأمراض وفي استكشاف مساهمة العوامل الجزيئية والوراثية (epi-).
تتحول تصميمات الدراسات على نحو التحقيق في التغيرات الزمنية أثناء المرض2،3،8،13،21. بالنسبة لمثل هذه الدراسات ، تعتبر الطرائق غير الغازية ضرورية ، لأنه يمكن إجراء تقييمات تسلسلية. يمكن أن تكون بدائل CMR في تقييم إعادة تشكيل القلب (1) توصيف الأنسجة باستخدام علم الأنسجة المرضية ، مع التضحية بحيوانات متعددة في نقاط زمنية مختلفة ، (2) التقييم الوظيفي الغازي عن طريق تحليل حجم الضغط ، أو (3) تخطيط صدى القلب ، والذي يسمح للباحث بتحديد تضخم القلب أو التوسع بشكل غير جراحي داخل نفس بشكل متسلسل. يتمتع CMR بميزتين رئيسيتين في تقييم عربة سكن متنقلة: (1) CMR هي طريقة غير جراحية ، تتيح القياسات التسلسلية في واحد ، مما يساهم بموجب ذلك في تقليل أعداد اللازمة للدراسات ، و (2) لا يعتمد CMR على شكل هندسي معين ويتصور ثلاثي الأبعاد. ثبت أن أحجام RV المشتقة من CMR وقياسات الوظائف دقيقة وتعتبر المعيار الذهبي غير الغازي في الكيانات القلبية المختلفة في البشر42،43،44،45 ، ولكن لم تتم ترجمتها بعد إلى بروتوكول CMR للفئران ذات الحمل الزائد لضغط RV.
تم وصف العديد من نماذج PAB في الأدبيات ، ولكن مع عدم تجانس كبير في طرق تقييم تأثيرات ديناميكية الدم ووظيفة RV والتكيف. يحدد هذا البروتوكول إجراء PAB في الفئران مع التحقق من صحة النموذج عن طريق قياس تدرج PAB عن طريق تخطيط صدى القلب وتقييم أبعاد القلب ووظيفته باستخدام CMR. بينما تم نشر بروتوكول CMR في المعرضة ل PAB للفئران ، لم يتم وصف هذا المزيج للفئران حتى الآن. بينما تستخدم الفئران بشكل شائع لنماذج الأسالهيدروجيني 8،12،13،14،15،16،22،24،25،26،27،28،29،30،31،46، غالبا ما تستخدم الفئران في الدراسات المعدلة وراثيا أو بالضربة القاضية ، وبالتالي تساهم في فهمنا لآليات فشل عربة سكن متنقلة محملة بالضغط. يمكن أن يشكل هذا البروتوكول الأساس للدراسات المستقبلية لكشف مسارات الإشارات التي ينطوي عليها الانتقال نحو فشل عربة سكن متنقلة.
Access restricted. Please log in or start a trial to view this content.
Protocol
يتم إجراء جميع التجارب ورعاية وفقا للقانون الهولندي التجريبي للحيوانات وتتوافق مع دليل رعاية واستخدام المختبر الذي نشرته المعاهد الوطنية الأمريكية للصحة. وافقت لجنة التجارب على بجامعة جرونينجن بهولندا على البروتوكول التجريبي الحالي (رقم التصريح: 2014-041/3005).
1. الإسكان والتأقلم
- استخدم 20-30 جم من الفئران البرية من النوع C57 الأسود 6 (C57BL / 6) (خط التكاثر المؤسسي الموصوفسابقا 47) ، من الذكور والإناث ، وجميعهم يزيد عمرهم عن 8 أسابيع. ضع الفئران في مجموعات بحد أقصى خمسة لكل قفص. من أجل التعود على التعامل مع الإنسان ، دع الفئران تتأقلم لمدة 7 أيام على الأقل. لا تقم بإجراء أي إجراءات خلال هذه الفترة.
2. جراحة ربط الشريان الرئوي
- اعداد
- ضع الماوس في حجرة الحث مملوءة بنسبة 5٪ إيزوفلوران / 100٪ أكسجين. تحقق من عدم وجود ردود أفعال عن طريق إعطاء حافز للألم (أي قرصة إصبع القدم).
- احلق الجزء النصفي الأيسر للفأرة باستخدام ماكينة حلاقة كهربائية.
- اسحب اللسان برفق وامسكه بتوتر خفيف.
- تضيء الحلق الداخلي عن طريق وضع مصدر ضوء على الحلق الخارجي على مستوى المزمار.
- قم بتنبيب الفأر عن طريق القصبة الهوائية باستخدام قنية مرنة 20 جم.
- ضع على جانبه الأيمن على حصيرة حرارية (اضبط درجة الحرارة على 37 درجة مئوية).
- قم بتوصيل القنية بجهاز التنفس الصناعي المصغر وابدأ التهوية بنسبة 1.5٪ -2.5٪ من الأيزوفلوران / الأكسجين (180 نفسا / دقيقة ، المد والجزر 250 ميكرولتر).
- حقن 0.1 ملغم/كغ بوبرينورفين تحت الجلد لتسكين الألم بعد الجراحة.
- منع جفاف العين باستخدام مرهم العين.
- جراحة ربط الشريان الرئوي عن طريق بضع الصدر الجانبي الأيسر
- ضع الماوس على جانبه الأيمن عن طريق وضع الساق الأمامية اليمنى في وضع محايد ، وتمتد الساق الخلفية اليمنى ، وثني الساق الأمامية اليسرى للخلف.
- تطهير الجلد على الصدر باستخدام كلوريد هيكسيدين ، مسحة 2x.
- استخدم أدوات معقمة للجراحة. افتح الجلد بمقص صغير (مقبض دائري ، شفرات 12 مم) من الإبط الأيسر بالتوازي مع الضلع الثاني والثالث.
- التعرف على m. صدرية سطحية (عضلة مائلة ، سطحية) و m. صدرية عميقة (عضلة مائلة ، عضلة أساسية).
- باستخدام حلقات الخياطة ، اسحب m. صدرية سطحية باتجاه الجانب البطني و m. صدرية عميقة باتجاه الجانب الظهري للفأر.
- افتح المساحة الوربية الثانية وانشر الأضلاع باستخدام مشابك ورق مكيفة ، مما يسمح لأذن القلب الأيسر والرئة اليسرى والشريان الرئوي بالظهور.
- افصل الشريان الرئوي عن الشريان الأورطي. ضع حلقة خياطة حول الشريان الرئوي بإبرة حادة 25 جم تحتوي على خياطة 6-0 وضع رباط فقدان 2-1-1 حول الشريان الرئوي.
- ضع إبرة 23 جم موازية للشريان الرئوي داخل الخيط 6-0 وقم أولا بإصلاح عقدة الخياطة القريبة ثم العقدة البعيدة للخياطة 2-1-1. قم بإزالة الإبرة 23 جرام. تأكد من أن العقدة كافية.
- أغلق الصدر بخيوط أو ثلاث خيوط منفصلة باستخدام خياطة أحادية البولي بروبيلين 5-0. الافراج عن m. صدرية superficalis و m. صدرية عميقة.
- خياطة الجلد بخياطة حمض البولي جليكوليك النقي 5-0. استخدام تقنية خياطة مستمرة لتقليل تكوين الندبات في الأنسجة. سيؤثر النسيج الندبي على جودة صورة تخطيط صدى القلب.
- قم بإيقاف تشغيل الأيزوفلوران مع الاستمرار في التهوية بالأكسجين أثناء التعافي من التخدير حتى يستعيد الفأر التنفس العفوي الخاص به كما يمكن ملاحظته من حركة البطن.
- افصل الأنبوب الرغامي عن جهاز التنفس الصناعي. تحقق من التنفس التلقائي ، وقم بإخراج الأنبوب فقط عندما يكون العمل التنفسي التلقائي مرئيا. عندما لا يظهر التنفس التلقائي ، قم بتوصيل الأنبوب بجهاز التنفس الصناعي مرة أخرى وارجع إلى الخطوة 2.2.12.
- راقب الفأر حتى يستعيد وعيه.
- جراحة الوهم
- قم بتنفيذ الإجراء أعلاه باستثناء النطاقات (الخطوات 2.2.2-2.2.6).
- فترة ما بعد الجراحة
- ضع الماوس بشكل فردي في حاضنة (37 درجة مئوية) لمدة 24 ساعة.
- راقب الفأر يوميا خلال أول 3 أيام بعد الجراحة. في حالة ظهور أي علامات على عدم الراحة، يتم حقن 0.1 ملغم/كغ من البوبرينورفين تحت الجلد 2x يوميا لعلاج التسكين بعد الجراحة.
3. تخطيط صدى القلب
- اعداد
- إجراء تحليل التدرج PAB عن طريق تخطيط صدى القلب بعد 14 يوما من جراحة PAB.
- ابدأ تشغيل جهاز تخطيط صدى القلب. اختر حزمة القلب ومحول طاقة 14.0 ميجاهرتز.
- تخدير
- ضع الفأر في حجرة الحث مملوءة بمزيج من 5٪ إيزوفلوران و 100٪ أكسجين.
- حلق صدر الماوس.
- ضع الماوس على ظهره على حصيرة الحرارة (درجة الحرارة 37 درجة مئوية) وضع الخطم في قناع التهوية.
- تهوية بمزيج من 1.5٪ -2.5٪ إيزوفلوران و 100٪ أكسجين (0.15 لتر / دقيقة) وهواء الغرفة (0.3 لتر / دقيقة).
- تحقق من عمق التخدير عن طريق إجراء قرصة إصبع القدم وضبط التخدير وفقا لذلك.
- منع جفاف العين باستخدام مرهم العين.
- تحديد تدرج PAB عن طريق تخطيط صدى القلب
- ضع ملصقات تخطيط كهربية القلب للأطفال على كل ساق أمامية وواحدة على كلتا الساقين الخلفيتين. استخدم الملصقات لحمل.
- ضع جل الموجات فوق الصوتية على الجزء المحلوق من صدر الفأر.
- للحصول على صور الشريان الرئوي ، يمكن استخدام طريقتين: المحور الطويل القصي (PLAX) أو عرض المحور القصير القصي (PSAX). احصل على كليهما واستخدم العرض الذي يعطي أفضل قياسات الجودة وأعلى السرعات للتحليل.
- الحصول على طرق عرض PLAX و PSAX.
- اضغط على زر دوبلر الملون لتصور تدفق الدم.
- ضع مسبار الموجات فوق الصوتية بزاوية 30 درجة على الخط القصي للحصول على PLAX (للحصول على وصف مفصل ، انظر Cheng ، et al.48) ، تصور الشريان الأورطي الصاعد.
- امسح المسبار باتجاه اليسار إلى الحد الأدنى حتى يختفي الشريان الأورطي الصاعد خلف الشريان الرئوي. يتم تحديد PLAX المناسب عند تصور الشريان الرئوي ، مع تدفق الدم عموديا.
- ضع المؤشر بما يتماشى مع الشريان الرئوي. اضغط على زر دوبلر الموجة المستمرة (CW) لاشتقاق قياسات تكاملية للسرعة والوقت خلال ثلاث دورات قلبية. اضغط على حفظ.
- قم بتدوير المسبار بزاوية 90 درجة في اتجاه عقارب الساعة من PLAX للحصول على PSAX ، ثم قم بإمالة المسبار قليلا نحو اتجاه الجمجمة / البطني لاشتقاق PSAX على مستوى الأبهر. يتم تحديد عرض PSAX المناسب إذا كان مسار تدفق RV يقع بين الشريان الأورطي والمسبار. يستمر هذا في الشريان الرئوي ، مع تدفق الدم عموديا. للحصول على وصف مفصل ، انظر Cheng et al.48
- ضع المؤشر بما يتماشى مع الشريان الرئوي. اضغط على زر دوبلر الموجة المستمرة (CW) لاشتقاق قياسات تكاملية للسرعة والوقت خلال ثلاث دورات قلبية. اضغط على حفظ.
- قم بقياس السرعات الثلاث القصوى لأفضل عرض (PSAX أو PLAX) واحسب المتوسط. استخدم مبدأ برنولي المبسط لاشتقاق تدرج PAB بالمليمترات الزئبق (mmHg).
4. التصوير بالرنين المغناطيسي للقلب
- اعداد
- إجراء تحليل CMR بعد 6 أسابيع (أي 42 يوما) بعد جراحة PAB.
ملاحظة: بالإضافة إلى ذلك ، يمكن اختيار النقاط الزمنية السابقة بعد جراحة PAB عند تضمين نقاط زمنية متعددة ، اعتمادا على سؤال البحث. يمكن النظر في النقاط الزمنية اللاحقة. ومع ذلك ، قد يحدث فشل RV والموت بشكل متزايد. - استخدم مغناطيسا قويا بما فيه الكفاية (عادة ، يتم استخدام >7 T لمسح CMR للقوارض). بالنسبة للبروتوكول الحالي ، يتم استخدام نظام رأسي 9.4 T ، مع مجموعة تدرج 1,500 طن متري / م وحجم تجويف 89 مم.
- قم بتثبيت برنامج المعالجة اللاحقة CMR لتحليل الأحجام والكتل في الصور المشتقة. يعتبر البرنامج مناسبا إذا كان يسمح بالتجزئة اليدوية لتحديد أحجام الانبساطي النهائي (ED) والانقباضي النهائي (ES) (EDV و ESV ، على التوالي) والكتلة البطينية (تم قياسها على حد سواء ED و ES).
- إجراء تحليل CMR بعد 6 أسابيع (أي 42 يوما) بعد جراحة PAB.
- التخدير والتثبيت
- ضع الفأر في حجرة الحث مملوءة بمزيج من 5٪ إيزوفلوران و 100٪ أكسجين. تحقق من تأثير التخدير عن طريق إعطاء حافز للألم عن طريق قرصة إصبع القدم.
- ضع مرهم العين على عيون الفأر للحفاظ على رطوبتها أثناء المسح.
- ضع الماوس في فراش الماسح الضوئي مع إمداد هواء مدمج ، ومزيج دافئ (37 درجة مئوية) من 1.5٪ -2.5٪ إيزوفلوران ، و 100٪ أكسجين (0.15 لتر / دقيقة) ، وهواء الغرفة (0.3 لتر / دقيقة) ، ووسادة ضغط تتيح مراقبة معدل ضربات القلب (تهدف إلى 400-500 نبضة في الدقيقة) ومعدل التنفس (استهدف ~ 35 نفسا في الدقيقة) أثناء المسح. تنظيم التخدير بناء على هاتين المعلمتين. تأكد من أن السرير مصنوع من البلاستيك ، بدون أي مادة مغناطيسية.
- ضع فراش مع الماوس في الماسح الضوئي.
- إجراء التصوير بالرنين المغناطيسي للقلب
- قم بإجراء تعديلات ما قبل الاستحواذ عن طريق ضبط ملف قفص العصافير بالترددات الراديوية (RF) على تردد رنين 1 هيدروجين (1 ساعة).
- ثم اضبط المجال المغناطيسي متجانسا قدر الإمكان باستخدام إجراء التقطيع التلقائي.
ملاحظة: يتم إجراء اللمعة المحوسبة بواسطة ما يسمى بطريقة الضبط ، والتي تستخدم المنطقة الموجودة تحت 1 H FID كمعلمة جودة. في إجراء الضبط هذا ، يتم فحص مجموعة من الحشوات المعرفة من قبل المستخدم (Z و Z2 و X و Y و XZ و YZ) في دورة تكرارية. يتم ضبط كل رقائق على التوالي بشكل فردي لتعظيم المساحة تحت FID. هذا هو في الأساس إجراء خطي يعمل بشكل جيد بسرعة. - قم بتحسين نبضة التردد اللاسلكي عن طريق تعظيم ملف تعريف الصورة أحادي البعد مع ضبط طاقة نبضة التردد اللاسلكي.
- قم بتعيين الموضع الدقيق للقلب في الماسح الضوئي عن طريق إجراء عمليات مسح استكشافية باستخدام تسلسل ثلاثي الطيار. استخدم تسلسل صدى متدرج سريع للحصول على الصور الكشفية من خلال الصدر: شريحة عرضية وإكليلية وسهمية. (الشكل 1 أ ، ب ، ج)
- اضبط المحاور على المحاور الفعلية للعرض المحوري والغرفتين والأربع غرف (الشكل 1D ، E).
- بعد ذلك ، ضع الشرائح السينمائية بشكل عمودي على محور وهمي بين مسار تدفق RV والجزء القمي الأقصى من عربة سكن متنقلة.
- اشتقاق عشر إلى أحد عشر شريحة سينمائية بسمك 1 مم بدون فجوة شريحة لتغطية التصوير العلوي إلى القاعدة بالكامل لعربة سكن متنقلة (الشكل 1F) عن طريق طريقة اللقطة ذات الزاوية المنخفضة (FLASH) ذات البوابات الذاتية IntraGate ، والتي تلغي الحاجة إلى مخطط كهربية القلب (ECG) وبوابات الجهاز التنفسي. وترد معلمات الاقتناء في الجدول 1. احفظ الصور بتنسيق DICOM.
- إجراء التحليلات على الصور المكتسبة
- انقر نقرا مزدوجا فوق البرنامج لفتح البرنامج.
- افتح الصور في برنامج المعالجة اللاحقة CMR باستخدام زر الاستيراد .
- حدد المرحلة الانقباضية النهائية (المعرفة على أنها المرحلة ذات أصغر تجويف RV بصريا) والمرحلة الانبساطي النهائي (المعرفة على أنها المرحلة ذات أكبر تجويف RV بصريا).
- وفقا لإرشادات جمعية الرنين المغناطيسي للقلب والأوعيةالدموية 49 ، ارسم ملامح النخابي يدويا في الانبساط النهائي والانقباض النهائي من القمة إلى القاعدة ، عن طريق تحديد عدة نقاط على حدود النخابي لكل صورة. في المرحلة الأخيرة ، انقر نقرا مزدوجا لإكمال محيط النخابي.
- افعل الشيء نفسه مع ملامح الشغاف. (الشكل 2). يتم الآن حساب كتلة البطين الأيسر والبطين الأيمن و ESV و ED وكتلة ES تلقائيا بواسطة البرنامج.
ملاحظة: يتم تعريف الكتلة على أنها حجم عضلة القلب مضروبا في كثافة عضلة القلب (أي 1.05). - اعتمادا على سؤال البحث والسكان قيد الدراسة ، قم بفهرسة هذه المتغيرات لحجم الموضوع عن طريق طول الساق أو وزن الجسم ، وفقا للصيغ المنشورةسابقا 50.
- احسب مؤشر الانحراف (EI) في كل من الانبساط النهائي والانقباض النهائي ، عن طريق قسمة قطر تجويف الجهد المنخفض الموازي للحاجز داخل البطين (IVS) على قطر تجويف LV العمودي على IVS ، المشتق من المحور القصير على المستوى الحليمي الأوسط.
- يحسب البرنامج حجم السكتة الدماغية (SV) بالمل ك
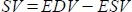 ، وكسر القذف (EF ، ٪) ك
، وكسر القذف (EF ، ٪) ك 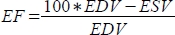 .
. - احسب النتاج القلبي (CO) بالمل / الدقيقة على النحو
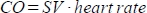 التالي. يتم قياس معدل ضربات القلب يدويا بواسطة وسادة الضغط المدمجة في فراش كما هو موضح أعلاه ، لأن الماسح الضوئي غير قادر على تسجيل معدل ضربات القلب المتكرر المرتفع بشكل كاف.
التالي. يتم قياس معدل ضربات القلب يدويا بواسطة وسادة الضغط المدمجة في فراش كما هو موضح أعلاه ، لأن الماسح الضوئي غير قادر على تسجيل معدل ضربات القلب المتكرر المرتفع بشكل كاف. - اعتمادا على سؤال البحث والسكان قيد الدراسة ، قم بفهرسة ثاني أكسيد الكربون و SV لحجم الموضوع عن طريق طول الساق أو وزن الجسم ، وفقا للصيغ المنشورةسابقا 50.
5. التحليلات الإحصائية
- افتح البرنامج المستخدم لتصور البيانات والتحليلات الإحصائية.
- قم بفرز البيانات لكل مجموعة (PAB و sham) مع كل مجموعة في عمود منفصل.
- استخدم اختبار Mann-Whitney لمقارنة PAB مقابل shom لكل متغير.
Access restricted. Please log in or start a trial to view this content.
النتائج
يبلغ معدل الوفيات من العملية الجراحية PAB حوالي 10٪. تظهر النتائج المقدمة خصائص الفئران في مجموعات الوهم (ن = 5) و PAB (ن = 8). كما هو موضح في الشكل 3 ، زادت قيم التدرج PAB بشكل كبير مقارنة بالحيوانات الزائفة في 2 و 6 أسابيع بعد PAB. تسببت هذه الزيادة في التحميل في توسع RV ...
Access restricted. Please log in or start a trial to view this content.
Discussion
يوفر هذا البروتوكول طريقة قابلة للتكرار ل PAB في الفئران والتقييم اللاحق لإعادة تشكيل القلب والتكيف الوظيفي باستخدام CMR.
يختلف PAB عن النماذج الأخرى لزيادة حمل ضغط RV لأنه ينطوي على زيادة مطلقة وثابتة في الحمل اللاحق دون وجود مشغلات أخرى. يعتمد حمل ضغط RV في نم?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
تعاقد المركز الطبي الجامعي جرونينجن مع Actelion و Lilly للأنشطة الاستشارية ل R.M.F. بيرغر خارج محتوى هذه المخطوطة. يعلن المؤلفون الآخرون أنه ليس لديهم مصالح متنافسة.
Acknowledgements
نود أن نشكر P. Da Costa-Martins على دعمها للتجارب على في هذه الدراسة.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 14.0 MHz i13L-echocardiography transducer | GE Healthcare, Waukesha, WI, USA | ||
| 20G cannula | |||
| 23G needle | |||
| 9.4T magnetic resonance scanner with 1,500 mT/m gradient set | Bruker BioSpin, Ellingen, Germany | ||
| Anesthesia induction chamber | |||
| Blunt 25G needle | |||
| Buprenorphine | |||
| Chloride-hexidine | |||
| CMR post-processing software | Medis Medical Imaging Systems, Leiden, The Netherlands | Qmass version 7.6 | |
| Data visualisation and statistical software | GraphPad Prism Inc, La Jolla, CA, USA | software version 7.02 | |
| Echocardiography machine | GE Healthcare, Waukesha, WI, USA | Vivid Dimension 7 | |
| Eye ointment | |||
| Heat mat | |||
| Incubator (37°C) | |||
| Isoflurane | |||
| Isoflurane evaporator | |||
| Miniventilator for rodents | Hugo Sachs | model 687 | |
| monofilament polypropylene 5-0 sutures | |||
| monofilament polypropylene 6-0 sutures | |||
| Needle and syringe for subcutaneous injections | |||
| Pediatric electrocardiogram-stickers | |||
| pure polyglycolic acid 5-0 sutures | |||
| Sterile surgical instruments | |||
| Ventilation mask |
References
- Norozi, K., et al. Incidence and Risk Distribution of Heart Failure in Adolescents and Adults With Congenital Heart Disease After Cardiac Surgery. The American Journal of Cardiology. 97 (8), 1238-1243 (2006).
- Borgdorff, M. A. J., et al. Clinical symptoms of right ventricular failure in experimental chronic pressure load are associated with progressive diastolic dysfunction. Journal of Molecular and Cellular Cardiology. 79, 244-253 (2015).
- Koop, A. M. C., et al. Right ventricular pressure overload alters cardiac lipid composition. International Journal of Cardiology. , (2019).
- Faber, M. J., et al. Right and left ventricular function after chronic pulmonary artery banding in rats assessed with biventricular pressure-volume loops. American Journal of Physiology and Heart Circirculation Physiology. 291 (4), 1580-1586 (2006).
- Bogaard, H. J., et al. Chronic pulmonary artery pressure elevation is insufficient to explain right heart failure. Circulation. 120 (20), 1951-1960 (2009).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulmonary Circulation. 7 (3), 572-587 (2017).
- Rumsey, W. L., et al. Adaptation to hypoxia alters energy metabolism in rat heart. American Journal of Physiology Heart and Circulatory Physiology. 276 (1), 71-80 (1999).
- Drozd, K., et al. Effects of an endothelin receptor antagonist, Macitentan, on right ventricular substrate utilization and function in a Sugen 5416/hypoxia rat model of severe pulmonary arterial hypertension. Journal of Nuclear Cardiology. 24 (6), 1979-1989 (2017).
- Van Der Feen, D. E., et al. Shunt surgery, right heart catheterization, and vascular morphometry in a rat model for flow-induced pulmonary arterial hypertension. Journal of Visualized Experiments. (120), e55065(2017).
- Gomez-Arroyo, J., et al. Metabolic gene remodeling and mitochondrial dysfunction in failing right ventricular hypertrophy secondary to pulmonary arterial hypertension. Circulation: Heart Failure. 6 (1), 136-144 (2013).
- Bruns, D. R., Dale Brown, R., Stenmark, K. R., Buttrick, P. M., Walker, L. A. Mitochondrial integrity in a neonatal bovine model of right ventricular dysfunction. American Journal of Physiology - Lung Cellular and Molecular Physiology. 308 (2), 158-167 (2015).
- Zhang, W. H., et al. Up-regulation of hexokinase1 in the right ventricle of monocrotaline induced pulmonary hypertension. Respiratory Research. 15 (1), 119(2014).
- Paulin, R., et al. A miR-208-Mef2 axis drives the decompensation of right ventricular function in pulmonary hypertension. Circulation Research. 116 (1), 56-69 (2015).
- Sutendra, G., et al. A metabolic remodeling in right ventricular hypertrophy is associated with decreased angiogenesis and a transition from a compensated to a decompensated state in pulmonary hypertension. Journal of Molecular Medicine. 91 (11), 1315-1327 (2013).
- Balestra, G. M., et al. Increased in vivo mitochondrial oxygenation with right ventricular failure induced by pulmonary arterial hypertension: Mitochondrial inhibition as driver of cardiac failure. Respiratory Research. 16, 6(2015).
- Piao, L., et al. The inhibition of pyruvate dehydrogenase kinase improves impaired cardiac function and electrical remodeling in two models of right ventricular hypertrophy: Resuscitating the hibernating right ventricle. Journal of Molecular Medicine. 88 (1), 47-60 (2010).
- Piao, L., et al. FOXO1-mediated upregulation of pyruvate dehydrogenase kinase-4 (PDK4) decreases glucose oxidation and impairs right ventricular function in pulmonary hypertension: therapeutic benefits of dichloroacetate. Journal of Molecular Medicine. 91, 333-346 (2013).
- Sheikh, A. M., et al. Right ventricular hypertrophy with early dysfunction: A proteomics study in a neonatal model. Journal of Thoracic and Cardiovascular Surgery. 137 (5), 1146-1153 (2009).
- Olivetti, G., et al. Cellular basis of wall remodeling in long-term pressure overload-induced right ventricular hypertrophy in rats. Circulation Research. 63 (3), 648-657 (1988).
- Lauva, I. K., et al. Control of myocardial tissue components and cardiocyte organelles in pressure-overload hypertrophy of the cat right ventricle. The American Journal of Anatomy. 177 (1), 71-80 (1986).
- Fang, Y. H., et al. Therapeutic inhibition of fatty acid oxidation in right ventricular hypertrophy: Exploiting Randle's cycle. Journal of Molecular Medicine. 90 (1), 31-43 (2012).
- Piao, L., et al. Cardiac glutaminolysis: A maladaptive cancer metabolism pathway in the right ventricle in pulmonary hypertension. Journal of Molecular Medicine. 91 (10), 1185-1197 (2013).
- Sack, M. N., Disch, D. L., Rockman, H. A., Kelly, D. P. A role for Sp and nuclear receptor transcription factors in a cardiac hypertrophic growth program. Proceedings of the National Academy of Sciences of the United States of America. 94 (12), 6438-6443 (1997).
- Broderick, T. L., King, T. M. Upregulation of GLUT-4 in right ventricle of rats with monocrotaline- induced pulmonary hypertension. Medical Science Monitor. 14 (12), 261-264 (2008).
- Enache, I., et al. Skeletal muscle mitochondrial dysfunction precedes right ventricular impairment in experimental pulmonary hypertension. Molecular and Cellular Biochemistry. 373 (1-2), 161-170 (2013).
- Sun, X. Q., et al. Reversal of right ventricular remodeling by dichloroacetate is related to inhibition of mitochondria-dependent apoptosis. Hypertension Research. 39 (5), 302-311 (2016).
- Adrogue, J. V., Sharma, S., Ngumbela, K., Essop, M. F., Taegtmeyer, H. Acclimatization to chronic hypobaric hypoxia is associated with a differential transcriptional profile between the right and left ventricle. Molecular and Cellular Biochemistry. 278 (1-2), 71-78 (2005).
- Sharma, S., et al. Dynamic changes of gene expression in hypoxia-induced right ventricular hypertrophy. American Journal of Physiology - Heart and Circulatory Physiology. 286 (3), 1185-1192 (2004).
- Nouette-Gaulain, K., et al. Time course of differential mitochondrial energy metabolism adaptation to chronic hypoxia in right and left ventricles. Cardiovascular Research. 66 (1), 132-140 (2005).
- Graham, B. B., et al. Severe pulmonary hypertension is associated with altered right ventricle metabolic substrate uptake. American Journal of Physiology - Lung Cellular and Molecular Physiology. 309 (5), 435-440 (2015).
- Liu, A., et al. Estrogen maintains mitochondrial content and function in the right ventricle of rats with pulmonary hypertension. Physiological Reports. 5 (6), 1-12 (2017).
- Kobr, J., et al. Right Ventricular Pressure Overload and Pathophysiology of Growing Porcine Biomodel. Pediatric Cardiology. 37 (8), 1498-1506 (2016).
- Yerebakan, C., et al. Acute and chronic response of the right ventricle to surgically induced pressure and volume overload - an analysis of pressure-volume relations. Interactive CardioVascular and Thoracic Surgery. 10 (4), 519-525 (2010).
- Gufler, H., et al. Right Ventricular Function After Pulmonary Artery Banding: Adaptive Processes Assessed by CMR and Conductance Catheter Measurements in Sheep. Journal of Cardiovascular Translational Research. 12 (5), 459-466 (2019).
- Baicu, C. F., et al. Time course of right ventricular pressure-overload induced myocardial fibrosis: relationship to changes in fibroblast postsynthetic procollagen processing. American Journal of Physiology-Heart and Circulatory Physiology. 303 (9), 1128-1134 (2012).
- Manohar, M., et al. Regional myocardial blood flow and coronary vascular reserve in unanesthetized young calves exposed to a simulated altitude of 3500 m for 8-10 weeks. Circulation Research. 50 (5), 714-726 (1982).
- Fávaro, G. A. G., et al. Reversible pulmonary trunk banding: VII. Stress echocardiographic assessment of rapid ventricular hypertrophy in young goats. Journal of Thoracic and Cardiovascular Surgery. 145 (5), 1345-1351 (2013).
- Nielsen, E. A., et al. Regional septal hinge-point injury contributes to adverse biventricular interactions in pulmonary hypertension. Physiological Reports. 5 (14), 1-13 (2017).
- Borgdorff, M. A., et al. Sildenafil enhances systolic adaptation, but does not prevent diastolic dysfunction, in the pressure-loaded right ventricle. European Journal of Heart Failure. 14 (9), 1067-1074 (2012).
- Gold, H., Prindle, K., Levey, G., Epstein, S. Effects of experimental heart failure on the capacity of glucagon to augment myocardial contractility and activate adenyl cyclase. The Journal of Clinical Investigation. 49 (5), 999-1006 (1970).
- Brittain, E. L., et al. Right ventricular plasticity and functional imaging. Pulmonary Circulation. 2 (3), 309-326 (2012).
- Jiang, L., et al. Three-dimensional Echocardiography In Vivo Validation for Right Ventricular Volume and Function. Circulation. 89, 2342-2350 (1994).
- Markiewicz, W., Sechtem, U., Higgins, C. B. Evaluation of the right ventricle by magnetic resonance imaging. American Heart Journal. 113 (1), 8-15 (1987).
- Pattynama, P. M. T., et al. Reproducibility of MRI-derived measurements of right ventricular volumes and myocardial mass. Magnetic Resonance Imaging. 13 (1), 53-63 (1995).
- Wiesmann, F., et al. Comparison of fast spiral, echo planar, and fast low-angle shot MRI for cardiac volumetry at .5T. Journal of Magnetic Resonance Imaging. 8 (5), 1033-1039 (1998).
- Van der Feen, D. E., et al. Multicenter Preclinical Validation of BET Inhibition for the Treatment of Pulmonary Arterial Hypertension. American Journal of Respiratory and Critical Care Medicine. 200 (7), 910-920 (2019).
- da Costa Martins, P. A., et al. MicroRNA-199b targets the nuclear kinase Dyrk1a in an auto-amplification loop promoting calcineurin/NFAT signalling. Nature Cell Biology. 12 (12), 1220-1227 (2010).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. Journal of Visualized Experiments. (84), e51041(2014).
- Schulz-Menger, J., et al. Standardized image interpretation and post processing in cardiovascular magnetic resonance: Society for Cardiovascular Magnetic Resonance (SCMR) Board of Trustees Task Force on Standardized Post Processing. Journal of Cardiovascular Magnetic Resonance. 15 (1), 1-19 (2013).
- Hagdorn, Q. A. J., et al. A novel method optimizing the normalization of cardiac parameters in small animal models: The importance of dimensional indexing. American Journal of Physiology - Heart and Circulatory Physiology. 316 (6), 1552-1557 (2019).
- Scherrer-Crosbie, M., et al. Determination of Right Ventricular Structure and Function in Normoxic and Hypoxic Mice. Circulation. 98 (10), 1015-1021 (2012).
- Wiesmann, F., et al. Analysis of right ventricular function in healthy mice and a murine model of heart failure by in vivo MRI. American Journal of Physiology-Heart and Circulatory Physiology. 283 (3), 1065-1071 (2002).
- Lu, X., et al. Accuracy and Reproducibility of Real-Time Three-Dimensional Echocardiography for Assessment of Right Ventricular Volumes and Ejection Fraction in Children. Journal of the American Society of Echocardiography. 21 (1), 84-89 (2008).
- Soriano, B. D., et al. Matrix-array 3-dimensional echocardiographic assessment of volumes, mass, and ejection fraction in young pediatric patients with a functional single ventricle: A comparison study with cardiac magnetic resonance. Circulation. 117 (14), 1842-1848 (2008).
- Damy, T., et al. Prevalence of, associations with, and prognostic value of tricuspid annular plane systolic excursion (TAPSE) among out-patients referred for the evaluation of heart failure. Journal of Cardiac Failure. 18 (3), 216-225 (2012).
- Kowalik, E., Kowalski, M., Rózański, J., Kuśmierczyk, M., Hoffman, P. The impact of pulmonary regurgitation on right ventricular regional myocardial function: An echocardiographic study in adults after total repair of tetralogy of fallot. Journal of the American Society of Echocardiography. 24 (11), 1199-1204 (2011).
- Koestenberger, M., et al. Systolic right ventricular function in pediatric and adolescent patients with tetralogy of Fallot: Echocardiography versus magnetic resonance imaging. Journal of the American Society of Echocardiography. 24 (1), 45-52 (2011).
- Bovens, S. M., et al. Evaluation of infarcted murine heart function: Comparison of prospectively triggered with self-gated MRI. NMR in Biomedicine. 24 (3), 307-315 (2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved