JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Quantification of Biventricular Function and Morphology by Cardiac Magnetic Resonance Imaging(폐동맥 밴딩이 있는 마우스의 심장 자기 공명 영상에 의한 양심실 기능 및 형태 정량화)
* 이 저자들은 동등하게 기여했습니다
요약
비정상 부하에 대한 우심실(RV) 적응의 병태생리학을 이해하려면 실험 모델이 중요합니다. 그러나 RV 치수 및 기능에 대한 평가는 복잡하고 까다롭습니다. 이 프로토콜은 RV 압력 부하를 받는 마우스에서 비침습적 벤치마크 절차로 심장 자기 공명 영상(CMR)을 수행하는 방법을 제공합니다.
초록
우심실(RV) 기능 및 기능 부전은 폐고혈압을 포함한 후천성 심장 질환 및 선천성 심장 질환의 결과를 결정하는 주요 요인입니다. RV 기능 및 형태에 대한 평가는 복잡한데, 그 이유 중 하나는 RV의 복잡한 모양 때문입니다.현재 심장 자기 공명(CMR) 영상은 RV 기능 및 형태에 대한 비침습적 평가를 위한 황금 표준입니다. 현재 프로토콜은 폐동맥 밴딩(PAB)에 의해 유도된 RV 압력 부하의 마우스 모델에서 CMR 이미징을 설명합니다. PAB는 23G 바늘로 폐동맥 주위에 6-0 봉합사를 배치하여 수행됩니다. PAB 구배는 2주 및 6주에 심초음파를 사용하여 측정합니다. 6주가 되면 1,500mT/m 기울기의 9.4T 자기공명영상스캐너를 사용하여 수축말기 및 확장말단 부피와 질량을 1mm 두께의 10-11개 시네 슬라이스로 측정하여 우심실 및 좌심실 형태와 기능을 평가합니다. 대표적인 결과에 따르면 PAB는 RV 압력 부하의 현저한 증가를 유도하여 양심실 형태 및 RV 기능에 상당한 영향을 미칩니다. 또한 RV 압력 부하의 6주에서 심박출량이 유지되는 것으로 나타났습니다. 여기에 제시된 것은 RV 압력 부하의 마우스 모델에서 양심실 형태 및 기능의 정량화를 위한 재현 가능한 프로토콜이며 RV 리모델링 및 기능 장애의 결정 요인을 탐색하는 실험 방법으로 사용될 수 있습니다.
서문
폐고혈압(PH)을 포함한 후천성 심혈관 질환을 앓고 있는 환자는 우심실(RV) 기능 장애 및 기능 부전의 위험이 있다1. 압력 부하 증가로 인한 RV 적응은 초기 단계에서는 동심원 비대, 말기 질환에서는 점진적 팽창이 특징입니다. 또한, 신진대사 및 세포외 기질의 장애, 염증 과정, 그리고 궁극적으로는 RV 부전 2,3,4,5,6과 관련이 있습니다. RV 고장으로 진행되는 기본 과정을 탐구하기 위해 동물 모델이 개발되었습니다. 그러나 모델을 최적화하고 RV 기능 및 치수를 적절하게 평가하는 것은 어려운 과제였습니다. RV 기능 및 치수의 비침습적 평가의 경우 심장 자기 공명(CMR) 영상이 황금 표준입니다. 이 기술은 강한 자기장과 무선 주파수를 사용하여 박동하는 심장의 이미지를 생성합니다. CMR은 인간과 실험실 설치류와 같은 동물에게 사용할 수 있습니다. 후자는 심장의 크기가 작기 때문에 더 높은 공간 해상도가 필요하기 때문에 적절한 이미지를 제공하는 데 필요한 자기장은 인간에 비해 더 높아야 합니다.
PH 7,8,9,10,11,12,13,14,15,16,17 모델 및 근위 RV 압력 하중 2,3,10,18 모델을 포함하여 RV 압력 과부하를 모방한 여러 모델을 사용할 수 있습니다. 19,20,21,22,23. PH 모델 또는 근위 RV 압력 부하 모델의 선택은 연구 질문에 따라 달라집니다: 폐 혈관 구조에 대한 중재의 영향 및 그에 따른 RV 후하중 조절(즉, PH 모델) 또는 RV에 대한 직접적인 영향(즉, 근위 RV 압력 부하 모델). PH의 실험적 유도를 위한 여러 가지 방법을 사용할 수 있으며, 여기에는 모노크로탈린(MCT)12,13,14,16,22,24,25,26, 대동맥 션트와 결합된 MCT 9, 만성 저 산소증 7,27,28,29 , 및 혈관 내피 성장 인자 수용체 길항제인 Sugen 5416과 만성 저산소증 8,10,30,31의 조합. 이러한 모델은 근위 RV 압력 부하의 점진적 폐 모델을 나타내며 폐 혈관 구조를 대상으로 하지 않지만 RV 후부하의 증가와 함께 폐동맥의 수축에 의해 일정한 후부하를 유도합니다 2,3. 이는 봉합 밴딩(폐동맥 밴딩, PAB) 또는 폐동맥 주위의 혈관 클립으로 수행할 수 있습니다. PAB는 여러 동물 종에서 수행되었으며, 조직학, 경흉부 심장 초음파(반점 추적 포함), 심장 카테터 삽입과 같은 다양한 방법으로 심장 치수와 기능이 연구되었습니다 2,32,33,34,35,36,37,38,39,40. 생쥐와 같은 작은 설치류의 PAB는 까다롭습니다. 이는 동맥 수축의 조임 사이의 미묘한 차이가 RV 압력 부하의 정도와 그에 따른 기능 상태 및 생존에 뚜렷한 결과를 가져왔기 때문입니다. 수축이 매우 꽉 조이면 동물은 수술 중 또는 수술 직후에 죽는 반면, 수축이 충분히 꽉 조이지 않으면 원하는 표현형이 달성되지 않습니다. 그러나 마우스의 사용은 우수한 유전자 변형 가능성(즉, 형질전환 또는 녹아웃 모델)과 빠른 번식으로 인해 다른 동물에 비해 이점이 있습니다. 이것은 질병 연구와 분자 및 (epi-) 유전 요인의 기여를 탐구하는 데 부가가치가 있습니다.
동물 연구 설계는 질병 2,3,8,13,21 동안 시간적 변화를 조사하는 방향으로 이동하고 있습니다. 이러한 연구의 경우 연속 평가를 수행할 수 있기 때문에 비침습적 방식이 필요합니다. 심장 리모델링 평가에서 CMR의 대안은 (1) 서로 다른 시점에서 여러 동물을 희생시키는 조직병리학을 사용한 조직 특성화, (2) 압력-부피 분석을 통한 침습적 기능 평가 또는 (3) 연구자가 동일한 동물 내에서 비침습적으로 심장 비대 또는 확장을 연속적으로 식별할 수 있도록 하는 심장 초음파학. CMR은 RV 평가에 있어 두 가지 주요 장점이 있습니다: (1) CMR은 비침습적 방식으로, 한 동물에서 연속 측정을 가능하게 하여 연구에 필요한 동물 수를 줄이는 데 기여하고, (2) CMR은 특정 기하학적 모양에 의존하지 않고 3차원으로 시각화합니다. CMR에서 파생된 RV 부피 및 기능 측정은 정확한 것으로 나타났으며 인간의 다양한 심장 개체에서 비침습적 황금 표준으로 간주되지만42,43,44,45 RV 압력 과부하가 있는 마우스에 대한 CMR 프로토콜로 아직 번역되지 않았습니다.
PAB의 많은 모델이 문헌에 설명되어 있지만 혈역학적 효과와 RV 기능 및 적응을 평가하는 방법에서 높은 이질성을 가지고 있습니다. 이 프로토콜은 심장초음파로 PAB 구배를 측정하고 CMR로 심장 치수 및 기능을 평가하여 모델을 검증하여 마우스의 PAB 절차를 간략하게 설명합니다. PAB를 투여받은 동물에 대한 CMR 프로토콜이 랫드에 대해 발표되었지만, 이 조합은 지금까지 마우스에 대해 설명되지 않았습니다. 쥐는 PH 모델 8,12,13,14,15,16,22,24,25,26,27,28,29,30,31,46에 가장 일반적으로 사용됩니다., 마우스는 형질전환 또는 녹아웃 연구에 가장 자주 사용되므로 압력 부하 RV 고장의 메커니즘에 대한 이해에 기여합니다. 이 프로토콜은 RV 고장으로의 전환과 관련된 신호 경로를 밝히기 위한 향후 연구의 기초를 형성할 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
모든 실험 및 동물 관리는 네덜란드 동물 실험법에 따라 수행되며 미국 국립 보건원에서 발행한 실험실 동물 관리 및 사용 가이드를 준수합니다. 네덜란드 흐로닝언 대학(University of Groningen)의 동물실험위원회(Animal Experiments Committee)는 현재의 실험 프로토콜(허가번호: 2014-041/3005)을 승인했습니다.
1. 주거 및 순응
- 생후 8주 이상인 수컷 및 암컷 20-30g의 야생형 C57 블랙 6(C57BL/6) 마우스(이전에 설명한 기관 육종 계통47)를 사용합니다. 쥐를 우리당 최대 5마리까지 그룹으로 수용합니다. 인간의 취급에 익숙해지려면 쥐가 최소 7일 동안 적응하도록 하십시오. 이 기간 동안에는 어떠한 절차도 수행하지 마십시오.
2. 폐동맥 밴딩 수술
- 준비
- 5% 이소플루란/100% 산소로 채워진 유도 챔버에 마우스를 넣습니다. 통증 자극(즉, 발가락 꼬집기)을 제공하여 반사 신경이 부족한지 확인합니다.
- 전기 면도기를 사용하여 마우스의 왼쪽 반흉을 면도합니다.
- 혀를 부드럽게 당겨 가벼운 긴장으로 유지합니다.
- 성문 수준에서 외부 목구멍에 광원을 배치하여 내부 목구멍을 비춥니다.
- 20G의 유연한 캐뉼라로 마우스의 기관내 삽관을 합니다.
- 동물을 열 매트(온도 37°C로 설정) 위에 오른쪽에 눕힙니다.
- 캐뉼라를 인공호흡기에 연결하고 1.5%–2.5% 이소플루란/산소(180회/분, 일회 호흡 250μL)로 인공호흡을 시작합니다.
- 수술 후 진통제를 위해 0.1mg/kg 부프레노르핀을 피하주사합니다.
- 눈 연고를 사용하여 눈의 탈수를 예방하십시오.
- 좌측 개흉술에 의한 폐동맥 밴딩 수술
- 오른쪽 앞다리를 중립 위치에 놓고 오른쪽 뒷다리를 펴고 왼쪽 앞다리를 뒤로 구부려 마우스를 오른쪽에 놓습니다.
- 흉부 피부를 염화물 - 헥시딘, 면봉 2x로 소독하십시오.
- 수술을 위해 멸균 기구를 사용하십시오. 왼쪽 겨드랑이에서 두 번째, 세 번째 갈비뼈와 평행하게 작은 가위(둥근 손잡이, 12mm 칼날)로 피부를 엽니다.
- m. pectoralis superficialis(비스듬한, 표재성 근육)와 m. pectoralis profundus(비스듬한, 밑 근육)를 확인합니다.
- 봉합 고리를 사용하여 m. pectoralis superficialis를 복부 쪽으로, m. pectoralis profundus를 마우스의 등쪽 쪽으로 당깁니다.
- 두 번째 늑간 공간을 열고 개조된 종이 클립을 사용하여 갈비뼈를 벌리면 왼쪽 심장, 귀, 왼쪽 폐 및 폐동맥이 보이도록 합니다.
- 대동맥에서 폐동맥을 분리합니다. 6-0 봉합사가 포함된 뭉툭한 25G 바늘로 폐동맥 주위에 봉합사 루프를 놓고 폐동맥 주위에 손실된 2-1-1 합자를 놓습니다.
- 6-0 봉합사 내에서 동맥 폐와 평행하게 23G 바늘을 놓고 먼저 가장 근위부 봉합사 매듭을 고정한 다음 2-1-1 봉합사의 원위 매듭을 고정합니다. 23g 바늘을 제거합니다. 매듭이 적절한지 확인하십시오.
- 모노필라멘트 폴리프로필렌 5-0 봉합사로 2개 또는 3개의 개별 봉합사로 흉부를 닫습니다. M. pectoralis superficalis 및 m. pectoralis profundus를 방출합니다.
- 순수 폴리글리콜산 5-0 봉합사로 피부를 봉합합니다. 조직의 흉터 형성을 최소화하기 위해 연속 봉합 기술을 사용하십시오. 흉터 조직은 심초음파의 이미지 품질에 영향을 미칩니다.
- 마우스가 복부의 움직임에서 관찰할 수 있듯이 자발적 호흡을 회복할 때까지 마취에서 회복하는 동안 산소로 계속 인공호흡을 하면서 이소플루란을 끕니다.
- 인공호흡기에서 기관내관을 분리합니다. 자발적 호흡을 확인하고 자발적 호흡 활동이 보일 때만 발관하십시오. 자발적 호흡이 보이지 않으면 튜브를 인공호흡기에 다시 연결하고 2.2.12단계로 돌아갑니다.
- 쥐가 의식을 되찾을 때까지 관찰하십시오.
- 가짜 수술
- 밴딩을 제외하고 위의 절차를 수행합니다(단계 2.2.2–2.2.6).
- 수술 후 기간
- 마우스를 인큐베이터(37°C)에 24시간 동안 개별적으로 보관합니다.
- 수술 후 처음 3일 동안 매일 마우스를 관찰하십시오. 불편함의 징후가 있는 경우 수술 후 진통제를 위해 0.1mg/kg 부프레노르핀을 하루 2회 피하 주사합니다.
3. 심초음파검사
- 준비
- PAB 수술 14일 후에 심장초음파를 통해 PAB 기울기 분석을 수행합니다.
- 심초음파검사 장치를 시작합니다. 심장 패키지와 14.0MHz 트랜스듀서를 선택하십시오.
- 마취
- 5% 이소플루란과 100% 산소의 혼합물로 채워진 유도 챔버에 마우스를 넣습니다.
- 마우스의 흉부를 면도하십시오.
- 마우스를 열 매트(온도 37°C)에 등을 대고 놓고 주둥이를 환기 마스크에 넣습니다.
- 1.5%–2.5% 이소플루란과 100% 산소(0.15L/분) 및 실내 공기(0.3L/분)의 혼합물로 환기합니다.
- 발가락 꼬집기를 수행하여 마취 깊이를 확인하고 그에 따라 마취를 조정합니다.
- 안연고를 사용하여 눈의 탈수를 예방하십시오.
- 심초음파에 의한 PAB 구배 측정
- 소아 심전도 스티커를 각 앞다리에, 양쪽 뒷다리에 하나씩 붙입니다. 스티커를 사용하여 동물을 잡으십시오.
- 마우스의 흉부의 면도한 부분에 초음파 젤을 바릅니다.
- 폐동맥의 이미지를 얻기 위해 두 가지 보기, 즉 흉골 주위 장축(PLAX) 또는 흉골 주위 짧은 축(PSAX) 보기를 사용할 수 있습니다. 둘 다 얻고 분석을 위한 최상의 품질 측정과 가장 빠른 속도를 제공하는 보기를 사용합니다.
- PLAX 및 PSAX 뷰를 가져옵니다.
- 컬러 도플러 버튼을 눌러 혈류를 시각화합니다.
- 초음파 프로브를 흉골 주위 라인에 대해 30° 각도로 배치하여 상행 대동맥을 시각화하는 PLAX(자세한 설명은 Cheng, et al.48 참조)를 얻습니다.
- 프로브를 왼쪽으로 최소한으로 쓸어 상행 대동맥이 폐동맥 뒤로 사라지도록 합니다. 혈액이 수직으로 흐르는 폐동맥을 시각화할 때 적절한 PLAX를 식별합니다.
- 커서를 폐동맥과 일직선이 되도록 놓습니다. 연속파 (CW) 도플러 버튼을 눌러 세 번의 심장 주기 동안 속도 시간 적분 측정값을 도출합니다. 저장을 누릅니다.
- 프로브를 PLAX에서 시계 방향으로 90° 회전하여 PSAX를 얻은 다음 프로브를 두개골/복부 방향으로 약간 기울여 대동맥 수준에서 PSAX를 유도합니다. RV 유출로가 대동맥과 프로브 사이에 위치한 경우 적절한 PSAX 보기가 식별됩니다. 이것은 폐동맥에서 계속되며 혈액이 수직으로 흐릅니다. 자세한 설명은 Cheng et al.48을 참조하십시오.
- 커서를 폐동맥과 일직선이 되도록 놓습니다. 연속파 (CW) 도플러 버튼을 눌러 세 번의 심장 주기 동안 속도 시간 적분 측정값을 도출합니다. 저장을 누릅니다.
- 최적 시야(PSAX 또는 PLAX)의 세 가지 최대 속도를 측정하고 평균을 계산합니다. 단순화된 베르누이의 원리를 사용하여 PAB 구배를 밀리미터 수은(mmHg) 단위로 도출합니다.
4. 심장 자기 공명 영상
- 준비
- PAB 수술 후 6주(즉, 42일) 후에 CMR 분석을 수행합니다.
참고: 또한, 연구 질문에 따라 여러 시점이 포함되어야 하는 경우 PAB 수술 후 더 이른 시점을 선택할 수 있습니다. 나중의 시점을 고려할 수 있습니다. 그러나 RV 고장 및 사망 사고는 점점 더 많이 발생할 수 있습니다. - 충분히 강력한 자석을 사용하십시오(일반적으로 설치류 CMR 스캔에는 >7 T가 사용됨). 현재 프로토콜의 경우 1,500mT/m 기울기 세트 및 89mm 보어 크기의 9.4T 수직 시스템이 사용됩니다.
- 파생된 이미지에서 부피와 질량을 분석하기 위한 CMR 후처리 소프트웨어를 설치합니다. 이 소프트웨어는 수동 세분화를 통해 확장기말(ED) 및 수축기말(ES) 부피(각각 EDV 및 ESV)와 심실 질량(ED 및 ES 모두 측정)을 결정할 수 있는 경우 적절한 것으로 간주됩니다.
- PAB 수술 후 6주(즉, 42일) 후에 CMR 분석을 수행합니다.
- 마취 및 고정
- 5% 이소플루란과 100% 산소의 혼합물로 채워진 유도 챔버에 마우스를 넣습니다. 발가락을 꼬집어 통증 자극을 주어 마취의 효과를 확인합니다.
- 스캔하는 동안 눈을 촉촉하게 유지하기 위해 마우스의 눈에 안연고를 바르십시오.
- 통합 공기 공급 장치, 1.5%–2.5% 이소플루란, 100% 산소(0.15L/분) 및 실내 공기(0.3L/분)의 가열된(37°C) 혼합물, 스캔하는 동안 심박수(400–500bpm 목표) 및 호흡수(분당 ~35회 호흡 목표)를 관찰할 수 있는 압력 패드가 있는 스캐너의 동물 침대에 마우스를 놓습니다. 이 두 가지 매개변수를 기반으로 마취를 조절합니다. 침대가 자성 물질이 없는 플라스틱으로 만들어졌는지 확인하십시오.
- 마우스가 있는 동물 침대를 스캐너에 놓습니다.
- 심장 자기 공명 영상 수행
- 1 수소(1H) 공진 주파수에서 무선 주파수(RF) 새장 코일을 조정하여 사전 획득 조정을 수행합니다.
- 그런 다음 자동 shimming 절차를 사용하여 자기장을 가능한 한 균일하게 설정합니다.
참고: 컴퓨터화된 shimming은 1H FID 아래의 영역을 품질 매개변수로 사용하는 소위 Tuning 방법에 의해 수행됩니다. 이 튜닝 절차에서는 사용자 정의 심 그룹(Z, Z2, X, Y, XZ 및 YZ)을 반복 주기로 검사합니다. 연속적으로 각 심은 FID 아래의 영역을 최대화하기 위해 개별적으로 조정됩니다. 이것은 본질적으로 빠르게 잘 작동하는 선형 절차입니다. - RF 펄스 파워를 조정하여 1차원 이미지 프로파일을 최대화하여 RF 펄스를 최적화합니다.
- 트라이파일럿 시퀀스를 사용하여 스카우트 스캔을 수행하여 스캐너에서 심장의 정확한 위치를 할당합니다. 빠른 그래디언트 에코 시퀀스를 사용하여 흉부를 통해 scout 이미지(transversal, coronal 및 sagittal slice)를 획득합니다. (그림 1A,B,C)
- 축을 축방향, 2챔버 및 4챔버의 실제 축으로 조정합니다 view(그림 1D,E).
- 그런 다음, RV 유출로와 RV의 가장 정점 부분 사이의 가상 축에 수직으로 cine slices를 배치합니다.
- 심전도(ECG) 및 호흡기 게이팅의 필요성을 없애주는 FLASH(Self-gated IntraGate-fast low-angle shot) 방법을 사용하여 RV의 상단부터 기본 이미징까지 전체를 덮을 수 있는 슬라이스 갭 없이 11mm 두께의 cine slice를 유도합니다(그림 1F). 획득 매개변수는 표 1에 표시되어 있습니다. 이미지를 DICOM 형식으로 저장합니다.
- 획득한 이미지에 대한 분석 수행
- 소프트웨어를 두 번 클릭하여 프로그램을 엽니다.
- 가져오기 버튼을 사용하여 CMR 후처리 소프트웨어에서 이미지를 엽니다.
- 수축기 말기(시각적으로 가장 작은 RV 공동이 있는 단계로 정의됨)와 확장기 말기(시각적으로 가장 큰 RV 공동이 있는 단계로 정의됨)를 식별합니다.
- Society for Cardiovascular Magnetic Resonance49의 지침에 따르면, 각 이미지의 심외막 경계에 여러 지점을 표시하여 이완기 말기와 수축기 말단에서 정점에서 기저부까지 심외막 윤곽을 수동으로 그립니다. 마지막 지점에서 두 번 클릭하여 심외막 윤곽을 완성합니다.
- 심내막 윤곽에 대해서도 동일한 작업을 수행합니다. (그림 2). 이제 좌심실 및 우심실 EDV, ESV, ED 질량 및 ES 질량이 소프트웨어에 의해 자동으로 계산됩니다.
참고: 질량은 심근 부피 곱하기 심근 밀도(즉, 1.05)로 정의됩니다. - 연구 질문과 연구 대상 모집단에 따라, 이전에 발표된 공식50에 따라 경골 길이 또는 체중을 사용하여 피험자 크기에 대한 이러한 변수를 색인화한다.
- 심실 내 중격(IVS)과 평행한 LV 공동의 직경을 IVS에 수직인 LV 공동의 직경으로 나누어 이심 지수(EI)를 계산합니다.
- 이 소프트웨어는 스트로크 부피(SV)를 mL
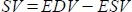 단위로, 박출률(EF, %)
단위로, 박출률(EF, %) 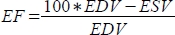 을 로 계산합니다.
을 로 계산합니다. - 심박출량(CO)을 ml/min
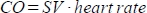 단위로 계산합니다. 심박수는 위에서 설명한 바와 같이 동물 침대에 내장된 압력 패드에 의해 수동으로 측정되는데, 이는 스캐너가 높은 빈번한 심박수를 적절하게 등록할 수 없기 때문입니다.
단위로 계산합니다. 심박수는 위에서 설명한 바와 같이 동물 침대에 내장된 압력 패드에 의해 수동으로 측정되는데, 이는 스캐너가 높은 빈번한 심박수를 적절하게 등록할 수 없기 때문입니다. - 연구 질문 및 연구 대상 모집단에 따라, 이전에 발표된 공식50에 따라 경골 길이 또는 체중을 사용하여 피험자 크기에 대한 CO 및 SV를 색인화한다.
5. 통계 분석
- 데이터 시각화 및 통계 분석에 사용되는 소프트웨어를 엽니다.
- 그룹별(PAB 및 가짜)로 데이터를 별도의 열에 있는 모든 그룹으로 정렬합니다.
- Mann-Whitney 검정을 사용하여 모든 변수에 대해 PAB와 가짜를 비교합니다.
Access restricted. Please log in or start a trial to view this content.
결과
PAB 수술의 사망률은 약 10%입니다. 제시된 결과는 가짜(n=5) 및 PAB(n=8) 그룹에서 마우스의 특성을 보여줍니다. 그림 3에서 볼 수 있듯이, PAB 구배 값은 PAB 후 2주 및 6주에 가짜 동물에 비해 크게 증가했습니다. 이러한 하중 증가로 인해 RV, EDV 및 RV ESV가 증가한 것으로 표현되는 RV 팽창이 발생했습니다(그림 4A, B). RV EF가...
Access restricted. Please log in or start a trial to view this content.
토론
이 프로토콜은 마우스의 PAB에 대한 재현 가능한 방법과 CMR을 사용한 심장 리모델링 및 기능 적응의 후속 평가를 제공합니다.
PAB는 다른 트리거가 없는 후부하의 절대 및 정적 증가를 포함하기 때문에 RV 압력 부하 증가의 다른 모델과 다릅니다. 저산소증, 모노크로탈린, 션트 또는 이러한 유도제의 조합 모델에서 RV 압력 하중은 폐 혈관 구조의 리모델?...
Access restricted. Please log in or start a trial to view this content.
공개
흐로닝언 대학 의료 센터(University Medical Center Groningen)는 이 원고의 내용 외에 R.M.F. 버거(R.M.F. Berger)의 컨설팅 활동을 위해 Actelion 및 Lilly와 계약을 맺었습니다. 다른 저자들은 자신들이 경쟁하는 이해관계가 없다고 선언한다.
감사의 말
이 연구의 동물 실험에 도움을 주신 P. Da Costa-Martins에게 감사드립니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 14.0 MHz i13L-echocardiography transducer | GE Healthcare, Waukesha, WI, USA | ||
| 20G cannula | |||
| 23G needle | |||
| 9.4T magnetic resonance scanner with 1,500 mT/m gradient set | Bruker BioSpin, Ellingen, Germany | ||
| Anesthesia induction chamber | |||
| Blunt 25G needle | |||
| Buprenorphine | |||
| Chloride-hexidine | |||
| CMR post-processing software | Medis Medical Imaging Systems, Leiden, The Netherlands | Qmass version 7.6 | |
| Data visualisation and statistical software | GraphPad Prism Inc, La Jolla, CA, USA | software version 7.02 | |
| Echocardiography machine | GE Healthcare, Waukesha, WI, USA | Vivid Dimension 7 | |
| Eye ointment | |||
| Heat mat | |||
| Incubator (37°C) | |||
| Isoflurane | |||
| Isoflurane evaporator | |||
| Miniventilator for rodents | Hugo Sachs | model 687 | |
| monofilament polypropylene 5-0 sutures | |||
| monofilament polypropylene 6-0 sutures | |||
| Needle and syringe for subcutaneous injections | |||
| Pediatric electrocardiogram-stickers | |||
| pure polyglycolic acid 5-0 sutures | |||
| Sterile surgical instruments | |||
| Ventilation mask |
참고문헌
- Norozi, K., et al. Incidence and Risk Distribution of Heart Failure in Adolescents and Adults With Congenital Heart Disease After Cardiac Surgery. The American Journal of Cardiology. 97 (8), 1238-1243 (2006).
- Borgdorff, M. A. J., et al. Clinical symptoms of right ventricular failure in experimental chronic pressure load are associated with progressive diastolic dysfunction. Journal of Molecular and Cellular Cardiology. 79, 244-253 (2015).
- Koop, A. M. C., et al. Right ventricular pressure overload alters cardiac lipid composition. International Journal of Cardiology. , (2019).
- Faber, M. J., et al. Right and left ventricular function after chronic pulmonary artery banding in rats assessed with biventricular pressure-volume loops. American Journal of Physiology and Heart Circirculation Physiology. 291 (4), 1580-1586 (2006).
- Bogaard, H. J., et al. Chronic pulmonary artery pressure elevation is insufficient to explain right heart failure. Circulation. 120 (20), 1951-1960 (2009).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulmonary Circulation. 7 (3), 572-587 (2017).
- Rumsey, W. L., et al. Adaptation to hypoxia alters energy metabolism in rat heart. American Journal of Physiology Heart and Circulatory Physiology. 276 (1), 71-80 (1999).
- Drozd, K., et al. Effects of an endothelin receptor antagonist, Macitentan, on right ventricular substrate utilization and function in a Sugen 5416/hypoxia rat model of severe pulmonary arterial hypertension. Journal of Nuclear Cardiology. 24 (6), 1979-1989 (2017).
- Van Der Feen, D. E., et al. Shunt surgery, right heart catheterization, and vascular morphometry in a rat model for flow-induced pulmonary arterial hypertension. Journal of Visualized Experiments. (120), e55065(2017).
- Gomez-Arroyo, J., et al. Metabolic gene remodeling and mitochondrial dysfunction in failing right ventricular hypertrophy secondary to pulmonary arterial hypertension. Circulation: Heart Failure. 6 (1), 136-144 (2013).
- Bruns, D. R., Dale Brown, R., Stenmark, K. R., Buttrick, P. M., Walker, L. A. Mitochondrial integrity in a neonatal bovine model of right ventricular dysfunction. American Journal of Physiology - Lung Cellular and Molecular Physiology. 308 (2), 158-167 (2015).
- Zhang, W. H., et al. Up-regulation of hexokinase1 in the right ventricle of monocrotaline induced pulmonary hypertension. Respiratory Research. 15 (1), 119(2014).
- Paulin, R., et al. A miR-208-Mef2 axis drives the decompensation of right ventricular function in pulmonary hypertension. Circulation Research. 116 (1), 56-69 (2015).
- Sutendra, G., et al. A metabolic remodeling in right ventricular hypertrophy is associated with decreased angiogenesis and a transition from a compensated to a decompensated state in pulmonary hypertension. Journal of Molecular Medicine. 91 (11), 1315-1327 (2013).
- Balestra, G. M., et al. Increased in vivo mitochondrial oxygenation with right ventricular failure induced by pulmonary arterial hypertension: Mitochondrial inhibition as driver of cardiac failure. Respiratory Research. 16, 6(2015).
- Piao, L., et al. The inhibition of pyruvate dehydrogenase kinase improves impaired cardiac function and electrical remodeling in two models of right ventricular hypertrophy: Resuscitating the hibernating right ventricle. Journal of Molecular Medicine. 88 (1), 47-60 (2010).
- Piao, L., et al. FOXO1-mediated upregulation of pyruvate dehydrogenase kinase-4 (PDK4) decreases glucose oxidation and impairs right ventricular function in pulmonary hypertension: therapeutic benefits of dichloroacetate. Journal of Molecular Medicine. 91, 333-346 (2013).
- Sheikh, A. M., et al. Right ventricular hypertrophy with early dysfunction: A proteomics study in a neonatal model. Journal of Thoracic and Cardiovascular Surgery. 137 (5), 1146-1153 (2009).
- Olivetti, G., et al. Cellular basis of wall remodeling in long-term pressure overload-induced right ventricular hypertrophy in rats. Circulation Research. 63 (3), 648-657 (1988).
- Lauva, I. K., et al. Control of myocardial tissue components and cardiocyte organelles in pressure-overload hypertrophy of the cat right ventricle. The American Journal of Anatomy. 177 (1), 71-80 (1986).
- Fang, Y. H., et al. Therapeutic inhibition of fatty acid oxidation in right ventricular hypertrophy: Exploiting Randle's cycle. Journal of Molecular Medicine. 90 (1), 31-43 (2012).
- Piao, L., et al. Cardiac glutaminolysis: A maladaptive cancer metabolism pathway in the right ventricle in pulmonary hypertension. Journal of Molecular Medicine. 91 (10), 1185-1197 (2013).
- Sack, M. N., Disch, D. L., Rockman, H. A., Kelly, D. P. A role for Sp and nuclear receptor transcription factors in a cardiac hypertrophic growth program. Proceedings of the National Academy of Sciences of the United States of America. 94 (12), 6438-6443 (1997).
- Broderick, T. L., King, T. M. Upregulation of GLUT-4 in right ventricle of rats with monocrotaline- induced pulmonary hypertension. Medical Science Monitor. 14 (12), 261-264 (2008).
- Enache, I., et al. Skeletal muscle mitochondrial dysfunction precedes right ventricular impairment in experimental pulmonary hypertension. Molecular and Cellular Biochemistry. 373 (1-2), 161-170 (2013).
- Sun, X. Q., et al. Reversal of right ventricular remodeling by dichloroacetate is related to inhibition of mitochondria-dependent apoptosis. Hypertension Research. 39 (5), 302-311 (2016).
- Adrogue, J. V., Sharma, S., Ngumbela, K., Essop, M. F., Taegtmeyer, H. Acclimatization to chronic hypobaric hypoxia is associated with a differential transcriptional profile between the right and left ventricle. Molecular and Cellular Biochemistry. 278 (1-2), 71-78 (2005).
- Sharma, S., et al. Dynamic changes of gene expression in hypoxia-induced right ventricular hypertrophy. American Journal of Physiology - Heart and Circulatory Physiology. 286 (3), 1185-1192 (2004).
- Nouette-Gaulain, K., et al. Time course of differential mitochondrial energy metabolism adaptation to chronic hypoxia in right and left ventricles. Cardiovascular Research. 66 (1), 132-140 (2005).
- Graham, B. B., et al. Severe pulmonary hypertension is associated with altered right ventricle metabolic substrate uptake. American Journal of Physiology - Lung Cellular and Molecular Physiology. 309 (5), 435-440 (2015).
- Liu, A., et al. Estrogen maintains mitochondrial content and function in the right ventricle of rats with pulmonary hypertension. Physiological Reports. 5 (6), 1-12 (2017).
- Kobr, J., et al. Right Ventricular Pressure Overload and Pathophysiology of Growing Porcine Biomodel. Pediatric Cardiology. 37 (8), 1498-1506 (2016).
- Yerebakan, C., et al. Acute and chronic response of the right ventricle to surgically induced pressure and volume overload - an analysis of pressure-volume relations. Interactive CardioVascular and Thoracic Surgery. 10 (4), 519-525 (2010).
- Gufler, H., et al. Right Ventricular Function After Pulmonary Artery Banding: Adaptive Processes Assessed by CMR and Conductance Catheter Measurements in Sheep. Journal of Cardiovascular Translational Research. 12 (5), 459-466 (2019).
- Baicu, C. F., et al. Time course of right ventricular pressure-overload induced myocardial fibrosis: relationship to changes in fibroblast postsynthetic procollagen processing. American Journal of Physiology-Heart and Circulatory Physiology. 303 (9), 1128-1134 (2012).
- Manohar, M., et al. Regional myocardial blood flow and coronary vascular reserve in unanesthetized young calves exposed to a simulated altitude of 3500 m for 8-10 weeks. Circulation Research. 50 (5), 714-726 (1982).
- Fávaro, G. A. G., et al. Reversible pulmonary trunk banding: VII. Stress echocardiographic assessment of rapid ventricular hypertrophy in young goats. Journal of Thoracic and Cardiovascular Surgery. 145 (5), 1345-1351 (2013).
- Nielsen, E. A., et al. Regional septal hinge-point injury contributes to adverse biventricular interactions in pulmonary hypertension. Physiological Reports. 5 (14), 1-13 (2017).
- Borgdorff, M. A., et al. Sildenafil enhances systolic adaptation, but does not prevent diastolic dysfunction, in the pressure-loaded right ventricle. European Journal of Heart Failure. 14 (9), 1067-1074 (2012).
- Gold, H., Prindle, K., Levey, G., Epstein, S. Effects of experimental heart failure on the capacity of glucagon to augment myocardial contractility and activate adenyl cyclase. The Journal of Clinical Investigation. 49 (5), 999-1006 (1970).
- Brittain, E. L., et al. Right ventricular plasticity and functional imaging. Pulmonary Circulation. 2 (3), 309-326 (2012).
- Jiang, L., et al. Three-dimensional Echocardiography In Vivo Validation for Right Ventricular Volume and Function. Circulation. 89, 2342-2350 (1994).
- Markiewicz, W., Sechtem, U., Higgins, C. B. Evaluation of the right ventricle by magnetic resonance imaging. American Heart Journal. 113 (1), 8-15 (1987).
- Pattynama, P. M. T., et al. Reproducibility of MRI-derived measurements of right ventricular volumes and myocardial mass. Magnetic Resonance Imaging. 13 (1), 53-63 (1995).
- Wiesmann, F., et al. Comparison of fast spiral, echo planar, and fast low-angle shot MRI for cardiac volumetry at .5T. Journal of Magnetic Resonance Imaging. 8 (5), 1033-1039 (1998).
- Van der Feen, D. E., et al. Multicenter Preclinical Validation of BET Inhibition for the Treatment of Pulmonary Arterial Hypertension. American Journal of Respiratory and Critical Care Medicine. 200 (7), 910-920 (2019).
- da Costa Martins, P. A., et al. MicroRNA-199b targets the nuclear kinase Dyrk1a in an auto-amplification loop promoting calcineurin/NFAT signalling. Nature Cell Biology. 12 (12), 1220-1227 (2010).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. Journal of Visualized Experiments. (84), e51041(2014).
- Schulz-Menger, J., et al. Standardized image interpretation and post processing in cardiovascular magnetic resonance: Society for Cardiovascular Magnetic Resonance (SCMR) Board of Trustees Task Force on Standardized Post Processing. Journal of Cardiovascular Magnetic Resonance. 15 (1), 1-19 (2013).
- Hagdorn, Q. A. J., et al. A novel method optimizing the normalization of cardiac parameters in small animal models: The importance of dimensional indexing. American Journal of Physiology - Heart and Circulatory Physiology. 316 (6), 1552-1557 (2019).
- Scherrer-Crosbie, M., et al. Determination of Right Ventricular Structure and Function in Normoxic and Hypoxic Mice. Circulation. 98 (10), 1015-1021 (2012).
- Wiesmann, F., et al. Analysis of right ventricular function in healthy mice and a murine model of heart failure by in vivo MRI. American Journal of Physiology-Heart and Circulatory Physiology. 283 (3), 1065-1071 (2002).
- Lu, X., et al. Accuracy and Reproducibility of Real-Time Three-Dimensional Echocardiography for Assessment of Right Ventricular Volumes and Ejection Fraction in Children. Journal of the American Society of Echocardiography. 21 (1), 84-89 (2008).
- Soriano, B. D., et al. Matrix-array 3-dimensional echocardiographic assessment of volumes, mass, and ejection fraction in young pediatric patients with a functional single ventricle: A comparison study with cardiac magnetic resonance. Circulation. 117 (14), 1842-1848 (2008).
- Damy, T., et al. Prevalence of, associations with, and prognostic value of tricuspid annular plane systolic excursion (TAPSE) among out-patients referred for the evaluation of heart failure. Journal of Cardiac Failure. 18 (3), 216-225 (2012).
- Kowalik, E., Kowalski, M., Rózański, J., Kuśmierczyk, M., Hoffman, P. The impact of pulmonary regurgitation on right ventricular regional myocardial function: An echocardiographic study in adults after total repair of tetralogy of fallot. Journal of the American Society of Echocardiography. 24 (11), 1199-1204 (2011).
- Koestenberger, M., et al. Systolic right ventricular function in pediatric and adolescent patients with tetralogy of Fallot: Echocardiography versus magnetic resonance imaging. Journal of the American Society of Echocardiography. 24 (1), 45-52 (2011).
- Bovens, S. M., et al. Evaluation of infarcted murine heart function: Comparison of prospectively triggered with self-gated MRI. NMR in Biomedicine. 24 (3), 307-315 (2011).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유