Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Quantification de la fonction biventriculaire et de la morphologie par imagerie par résonance magnétique cardiaque chez la souris présentant un cerclage de l’artère pulmonaire
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Pour comprendre la physiopathologie de l’adaptation du ventricule droit (VD) à une charge anormale, des modèles expérimentaux sont cruciaux. Cependant, l’évaluation des dimensions et de la fonction d’un VR est complexe et difficile. Ce protocole fournit une méthode pour effectuer l’imagerie par résonance magnétique cardiaque (CMR) en tant que procédure de référence non invasive chez les souris soumises à une charge de pression RV.
Résumé
La fonction ventriculaire droite (VD) et l’insuffisance sont des déterminants majeurs de l’issue des cardiopathies acquises et congénitales, y compris l’hypertension pulmonaire. L’évaluation de la fonction et de la morphologie du rotavirus est complexe, en partie en raison de la forme complexe du rotavirus. Actuellement, l’imagerie par résonance magnétique cardiaque (CMR) est la référence pour l’évaluation non invasive de la fonction et de la morphologie du rotavirus. Le protocole actuel décrit l’imagerie CMR dans un modèle murin de la charge de pression RV induite par le cerclage de l’artère pulmonaire (PAB). La PAB est réalisée en plaçant une suture 6-0 autour de l’artère pulmonaire sur une aiguille de 23 G. Le gradient de la PAB est déterminé par échocardiographie à 2 et 6 semaines. À 6 semaines, la morphologie et la fonction ventriculaires droite et gauche sont évaluées en mesurant les volumes et la masse en fin de systolique et en fin de diastolique par dix à onze coupes de cinéma de 1 mm d’épaisseur à l’aide d’un scanner d’imagerie par résonance magnétique de 9,4 T équipé d’un gradient de 1 500 mT/m. Des résultats représentatifs montrent que la PAB induit une augmentation significative de la charge de pression du VD, avec des effets significatifs sur la morphologie biventriculaire et la fonction du VD. Il est également montré qu’à 6 semaines de charge de pression RV, le débit cardiaque est maintenu. Il est présenté ici un protocole reproductible pour la quantification de la morphologie et de la fonction biventriculaires dans un modèle murin de charge de pression du VD et peut servir de méthode pour des expériences explorant les déterminants du remodelage et du dysfonctionnement du VD.
Introduction
Les patients atteints de maladies cardiovasculaires acquises et congénitales, y compris l’hypertension pulmonaire (HTP), sont à risque de dysfonctionnement et d’insuffisance ventriculaire droite (VD)1. L’adaptation du rotavirus à la suite d’une charge de pression accrue est caractérisée par une hypertrophie concentrique aux stades précoces et une dilatation progressive au stade terminal de la maladie. De plus, il est associé à des troubles du métabolisme et de la matrice extracellulaire, à des processus d’inflammation et, finalement, à une défaillance du VD 2,3,4,5,6. Des modèles animaux ont été développés pour explorer les processus sous-jacents de la progression vers l’échec du VD. Cependant, l’optimisation des modèles et l’évaluation adéquate de la fonction et des dimensions du VR ont été difficiles. Pour l’évaluation non invasive de la fonction et des dimensions du VD, l’imagerie par résonance magnétique cardiaque (CMR) est la norme d’or. Cette technique crée des images du cœur battant en utilisant un champ magnétique puissant et des ondes radiofréquences. La CMR est disponible pour les humains et pour les animaux tels que les rongeurs de laboratoire. Comme ces derniers nécessitent une résolution spatiale plus élevée en raison de la taille plus petite du cœur, le champ magnétique nécessaire pour fournir des images adéquates doit être plus élevé que celui des humains.
Plusieurs modèles imitant la surcharge de pression RV sont disponibles, y compris les modèles de PH 7,8,9,10,11,12,13,14,15,16,17 et les modèles de charge de pression RV proximale 2,3,10,18, 19,20,21,22,23. Le choix d’un modèle de PH ou d’un modèle de charge de pression proximale du VD dépend de la question de recherche : l’effet d’une intervention sur le système vasculaire pulmonaire et donc éventuellement la modulation de la postcharge du VD (c’est-à-dire les modèles de PH), ou l’effet direct sur le VD (c’est-à-dire les modèles de charge de pression du VD proximal). Plusieurs méthodes expérimentales d’induction de l’HTP sont disponibles, notamment l’utilisation de monocrotaline (TCM)12,13,14,16,22,24,25,26, la TCM combinée à une dérivation aorto-cavale 9, l’hypoxie chronique 7,27,28,29 , et l’association d’un antagoniste du récepteur du facteur de croissance de l’endothélium vasculaire, Sugen 5416, avec une hypoxie chronique 8,10,30,31. De tels modèles représentent des modèles pulmonaires progressifs de charge de pression RV proximale et ne ciblent pas le système vasculaire pulmonaire mais induisent une postcharge constante par constriction de l’artère pulmonaire, avec une augmentation concomitante de la postcharge VD 2,3. Cela peut être réalisé par un anneau de suture (anneau de l’artère pulmonaire, PAB) ou un clip vasculaire autour de l’artère pulmonaire. La PAB a été réalisée chez plusieurs espèces animales, et les dimensions et la fonction cardiaques ont été étudiées de diverses manières, telles que l’histologie, l’échocardiographie transthoracique (y compris le suivi du chatoiement) et le cathétérisme cardiaque 2,32,33,34,35,36,37,38,39,40 . La PAB chez les petits rongeurs, comme les souris, est un défi. En effet, des différences subtiles entre l’étanchéité de la constriction artérielle ont des résultats marqués sur le degré de charge de pression du VD et sur l’état fonctionnel et la survie ultérieurs. Lorsque la constriction est très serrée, l’animal meurt pendant ou peu de temps après l’opération, tandis que le phénotype souhaité ne sera pas atteint lorsque la constriction n’est pas assez serrée. Cependant, l’utilisation de souris présente des avantages par rapport à d’autres animaux, en raison des excellentes possibilités de modification génétique (c’est-à-dire des modèles transgéniques ou knock-out) et de la reproduction rapide. Il s’agit d’une valeur ajoutée dans l’étude des maladies et dans l’exploration de la contribution des facteurs moléculaires et (épi-)génétiques.
Les modèles d’étude sur les animaux s’orientent vers l’étude des changements temporels au cours de la maladie 2,3,8,13,21. Pour de telles études, des modalités non invasives sont nécessaires, car des évaluations en série peuvent être effectuées. Des alternatives à la CMR dans l’évaluation du remodelage cardiaque pourraient être (1) la caractérisation tissulaire à l’aide de l’histopathologie, avec plusieurs animaux sacrifiés à différents moments temporels, (2) l’évaluation fonctionnelle invasive par analyse pression-volume, ou (3) l’échocardiographie, qui permet au chercheur d’identifier l’hypertrophie ou la dilatation cardiaque de manière non invasive au sein du même animal en série. La CMR présente deux avantages majeurs dans l’évaluation du RV : (1) la CMR est une modalité non invasive, permettant des mesures en série chez un animal, contribuant ainsi à réduire le nombre d’animaux nécessaires aux études, et (2) la CMR ne repose pas sur une forme géométrique particulière et visualise en trois dimensions. Les volumes et les mesures de fonction du RV dérivés de la CMR se sont révélés précis et sont considérés comme la norme d’or non invasive dans différentes entités cardiaques chez l’homme 42,43,44,45, mais n’avaient pas encore été traduits en un protocole CMR pour les souris présentant une surcharge de pression du RV.
De nombreux modèles de PAB sont décrits dans la littérature, mais avec une grande hétérogénéité dans les méthodes d’évaluation des effets hémodynamiques et de la fonction et de l’adaptation du VD. Ce protocole décrit la procédure de la PAB chez la souris avec validation du modèle en mesurant le gradient de la PAB par échocardiographie et en évaluant les dimensions et la fonction cardiaques avec CMR. Alors qu’un protocole de CMR chez les animaux soumis au PAB a été publié pour les rats, cette combinaison n’a pas été décrite pour les souris jusqu’à présent. Alors que les rats sont le plus souvent utilisés pour les modèles PH 8,12,13,14,15,16,22,24,25,26,27,28,29,30,31,46 , les souris sont le plus souvent utilisées pour des études transgéniques ou knock-out et contribuent ainsi à notre compréhension des mécanismes de défaillance des VD sous pression. Ce protocole pourrait constituer la base d’études futures visant à démêler les voies de signalisation impliquées dans la transition vers l’échec du VD.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les expériences et tous les soins aux animaux sont menés conformément à la loi néerlandaise sur l’expérimentation animale et au Guide pour le soin et l’utilisation des animaux de laboratoire publié par les National Institutes of Health des États-Unis. Le Comité d’expérimentation animale de l’Université de Groningue, aux Pays-Bas, a approuvé le protocole expérimental actuel (numéro de permis : 2014-041/3005).
1. Logement et acclimatation
- Utiliser 20 à 30 g de souris sauvages de type C57 black 6 (C57BL/6) (lignée d’élevage institutionnelle décrite précédemment47), mâles et femelles, toutes âgées de plus de 8 semaines. Hébergez les souris en groupes avec un maximum de cinq par cage. Afin de s’habituer à la manipulation humaine, laissez les souris s’acclimater pendant au moins 7 jours. N’effectuez aucune procédure pendant cette période.
2. Chirurgie de cerclage de l’artère pulmonaire
- Préparation
- Placez la souris dans la chambre d’induction remplie de 5 % d’isoflurane et de 100 % d’oxygène. Vérifiez l’absence de réflexes en donnant un stimulus de douleur (c’est-à-dire un pincement de l’orteil).
- Rasez l’hémithorax gauche de la souris à l’aide d’un rasoir électrique.
- Tirez doucement sur la langue et maintenez-la avec une légère tension.
- Illuminez l’intérieur de la gorge en plaçant une source de lumière sur la gorge extérieure au niveau de la glotte.
- Intubez la souris par voie endotrachéale à l’aide d’une canule flexible de 20 G.
- Placez l’animal sur son côté droit sur un tapis chauffant (température réglée à 37 °C).
- Connectez la canule au mini-ventilateur et démarrez la ventilation avec 1,5 % à 2,5 % d’isoflurane/oxygène (180 respirations/min, marée 250 μL).
- Injecter 0,1 mg/kg de buprénorphine par voie sous-cutanée pour l’analgésie postopératoire.
- Prévenez la déshydratation de l’œil à l’aide d’une pommade pour les yeux.
- Chirurgie de l’anneau de l’artère pulmonaire par thoracotomie latérale gauche
- Placez la souris sur son côté droit en plaçant la patte avant droite en position neutre, la patte arrière droite tendue et la patte avant gauche pliée en arrière.
- Désinfecter la peau du thorax avec du chlorure-hexidine, écouvillon 2x.
- Utilisez des instruments stériles pour la chirurgie. Ouvrez la peau avec de petits ciseaux (manche rond, lames de 12 mm) à partir de l’aisselle gauche parallèlement à la deuxième et à la troisième côte.
- Identifiez le muscle pectoral superficiel (muscle oblique, superficiel) et le muscle pectoral profond (muscle oblique, sous-jacent).
- À l’aide de boucles de suture, tirez le muscle pectoral superficiel vers la face ventrale et le muscle pectoral profond vers la face dorsale de la souris.
- Ouvrez le deuxième espace intercostal et écartez les côtes à l’aide de trombones adaptés, permettant à l’oreille du cœur gauche, au poumon gauche et à l’artère pulmonaire de devenir visibles.
- Séparez l’artère pulmonaire de l’aorte. Placez une boucle de suture autour de l’artère pulmonaire à l’aide d’une aiguille émoussée de 25 G contenant une suture 6-0 et placez une ligature 2-1-1 perdue autour de l’artère pulmonaire.
- Placez une aiguille de 23 G parallèlement à l’artère pulmonaire à l’intérieur de la suture 6-0 et fixez d’abord le nœud de suture le plus proximal, puis le nœud distal de la suture 2-1-1. Retirez l’aiguille de 23 G. Assurez-vous que le nœud est adéquat.
- Fermez le thorax avec deux ou trois sutures séparées avec une suture monofilament en polypropylène 5-0. Relâchez le m. pectoralis superficalis et le m. pectoralis profundus.
- Suturez la peau avec une suture à l’acide polyglycolique pur 5-0. Utilisez une technique de suture continue pour minimiser la formation de cicatrices dans le tissu ; Le tissu cicatriciel influencera la qualité de l’image de l’échocardiographie.
- Éteignez l’isoflurane tout en continuant la ventilation avec de l’oxygène pendant la récupération de l’anesthésie jusqu’à ce que la souris retrouve sa propre respiration spontanée, comme on peut l’observer à partir du mouvement de l’abdomen.
- Désolidarisez le tube endotrachéal du ventilateur. Vérifiez la respiration spontanée, n’extuber que lorsque l’action respiratoire spontanée est visible. Lorsqu’il n’y a pas de respiration spontanée, rebranchez le tube sur le ventilateur et revenez à l’étape 2.2.12.
- Observez la souris jusqu’à ce qu’elle reprenne conscience.
- Chirurgie simulée
- Effectuez la procédure ci-dessus à l’exception de l’utilisation des bandes (étapes 2.2.2 à 2.2.6).
- Période postopératoire
- Hébergez la souris individuellement dans un incubateur (37 °C) pendant 24 h.
- Observez la souris quotidiennement pendant les 3 premiers jours postopératoires. En cas de signes d’inconfort, injecter 0,1 mg/kg de buprénorphine par voie sous-cutanée 2 fois par jour pour l’analgésie postopératoire.
3. Échocardiographie
- Préparation
- Effectuer une analyse du gradient de la PAB au moyen d’une échocardiographie 14 jours après la chirurgie de la PAB.
- Démarrez l’appareil d’échocardiographie. Choisissez le pack cardiaque et un transducteur de 14,0 MHz.
- Anesthésie
- Placez la souris dans la chambre d’induction remplie d’un mélange de 5 % d’isoflurane et de 100 % d’oxygène.
- Rasez le thorax de la souris.
- Placez la souris sur le dos sur le tapis chauffant (température 37 °C) et placez le museau dans le masque de ventilation.
- Aérez avec un mélange de 1,5 % à 2,5 % d’isoflurane et de 100 % d’oxygène (0,15 L/min) et d’air ambiant (0,3 L/min).
- Vérifiez la profondeur de l’anesthésie en effectuant un pincement des orteils et ajustez l’anesthésie en conséquence.
- Prévenez la déshydratation de l’œil en utilisant une pommade pour les yeux.
- Détermination du gradient PAB par échocardiographie
- Placez des autocollants d’électrocardiogramme pédiatrique sur chaque patte avant et un sur les deux pattes arrière. Utilisez les autocollants pour tenir l’animal.
- Appliquez du gel à ultrasons sur la partie rasée du thorax de la souris.
- Pour obtenir les images de l’artère pulmonaire, deux vues peuvent être utilisées : la vue grand axe parasternal (PLAX) ou la vue grand axe parasternal (PSAX). Obtenez les deux et utilisez la vue qui donne les mesures de la meilleure qualité et les vitesses les plus élevées pour l’analyse.
- Obtenez les vues PLAX et PSAX.
- Appuyez sur le bouton Doppler couleur pour visualiser le flux sanguin.
- Placez la sonde à ultrasons à un angle de 30° par rapport à la ligne parasternale pour obtenir PLAX (pour une description détaillée, voir Cheng et al.48), en visualisant l’aorte ascendante.
- Balayez la sonde au minimum vers la gauche pour que l’aorte ascendante disparaisse derrière l’artère pulmonaire. Le PLAX approprié est identifié lorsque l’artère pulmonaire est visualisée, le sang circulant verticalement.
- Placez le curseur dans l’alignement de l’artère pulmonaire. Appuyez sur le bouton Doppler à ondes continues (CW) pour obtenir des mesures intégrales de vitesse et de temps au cours de trois cycles cardiaques. Appuyez sur Enregistrer.
- Tournez la sonde de 90° dans le sens des aiguilles d’une montre par rapport au PLAX pour obtenir le PSAX, puis inclinez légèrement la sonde vers la direction crânienne/ventrale pour obtenir le PSAX au niveau de l’aorte. La vue PSAX appropriée est identifiée si la voie d’évacuation du RV est située entre l’aorte et la sonde. Cela se poursuit dans l’artère pulmonaire, le sang circulant verticalement. Pour une description détaillée, voir Cheng et al.48
- Placez le curseur dans l’alignement de l’artère pulmonaire. Appuyez sur le bouton Doppler à ondes continues (CW) pour obtenir des mesures intégrales de vitesse et de temps au cours de trois cycles cardiaques. Appuyez sur Enregistrer.
- Mesurez les trois vitesses maximales de la meilleure vue (PSAX ou PLAX) et calculez la moyenne. Utilisez le principe de Bernoulli simplifié pour calculer le gradient PAB en millimètres de mercure (mmHg).
4. Imagerie par résonance magnétique cardiaque
- Préparation
- Effectuez une analyse CMR 6 semaines (c’est-à-dire 42 jours) après la chirurgie PAB.
REMARQUE : De plus, des points temporels plus précoces après la chirurgie PAB peuvent être choisis lorsque plusieurs points temporels doivent être inclus, en fonction de la question de recherche. Des points temporels ultérieurs pourraient être envisagés ; cependant, l’échec et la mort du VR peuvent se produire de plus en plus. - Utilisez un aimant suffisamment puissant (en règle générale, >7 T est utilisé pour la numérisation CMR des rongeurs). Pour le protocole actuel, un système vertical de 9,4 T, avec un gradient de 1 500 mT/m et une taille d’alésage de 89 mm, est utilisé.
- Installez un logiciel de post-traitement CMR pour analyser les volumes et les masses dans les images dérivées. Le logiciel est jugé approprié s’il permet une segmentation manuelle pour déterminer les volumes diastolique final (DE) et systolique (ESV) (EDV et ESV, respectivement) et la masse ventriculaire (mesurée à la fois ED et ES).
- Effectuez une analyse CMR 6 semaines (c’est-à-dire 42 jours) après la chirurgie PAB.
- Anesthésie et fixation
- Placez la souris dans la chambre d’induction remplie d’un mélange de 5 % d’isoflurane et de 100 % d’oxygène. Vérifiez l’effet de l’anesthésie en donnant un stimulus de douleur par un pincement de l’orteil.
- Mettez une pommade pour les yeux sur les yeux de la souris pour les garder humides pendant le balayage.
- Placez la souris dans le lit du scanner avec une alimentation en air intégrée, un mélange réchauffé (37 °C) de 1,5 % à 2,5 % d’isoflurane, de 100 % d’oxygène (0,15 L/min) et d’air ambiant (0,3 L/min), et un tampon de pression qui permet d’observer la fréquence cardiaque (objectif 400 à 500 bpm) et la fréquence respiratoire (objectif ~35 respirations par minute) pendant le balayage. Régulez l’anesthésie en fonction de ces deux paramètres. Assurez-vous que le lit est en plastique, sans aucun matériau magnétique.
- Placez le lit d’animal avec la souris dans le scanner.
- Réalisation d’une imagerie par résonance magnétique cardiaque
- Effectuez des ajustements de pré-acquisition en réglant la bobine de la cage à oiseaux radiofréquence (RF) sur 1 fréquence de résonance d’hydrogène (1 H).
- Réglez ensuite le champ magnétique de manière aussi homogène que possible à l’aide de la procédure de calage automatique.
REMARQUE : Le calage informatisé est effectué par la méthode dite de réglage, qui utilise la zone sous le FID 1 H comme paramètre de qualité. Dans cette procédure de réglage, un groupe de cales défini par l’utilisateur (Z, Z2, X, Y, XZ et YZ) est examiné dans un cycle itératif. Chaque cale successivement est ajustée individuellement pour maximiser la surface sous le FID. Il s’agit essentiellement d’une procédure linéaire qui fonctionne bien rapidement. - Optimisez l’impulsion RF en maximisant le profil d’image unidimensionnel avec ajustement de la puissance de l’impulsion RF.
- Attribuez la position exacte du cœur dans le scanner en effectuant des balayages de reconnaissance à l’aide d’une séquence tripilote. Utilisez une séquence d’écho à gradient rapide pour acquérir les images de reconnaissance à travers le thorax : une coupe transversale, coronale et sagittale. (Figure 1A, B et C)
- Ajustez les axes aux axes réels de la vue axiale, à deux chambres et à quatre chambres (Figure 1D,E).
- Par la suite, positionnez les tranches de cinéma perpendiculairement à un axe imaginaire entre la voie d’éjection du RV et la partie apicale la plus extrême du RV.
- Dérivez dix à onze coupes cinéma de 1 mm d’épaisseur sans espace de coupe pour couvrir toute l’imagerie de haut en bas de la partie supérieure à la base du RV (Figure 1F) au moyen de la méthode de prise de vue à faible angle rapide (FLASH) Self-gated IntraGate, qui évite la nécessité d’un électrocardiogramme (ECG) et d’un déclenchement respiratoire. Les paramètres d’acquisition sont présentés dans le Tableau 1. Enregistrez les images au format DICOM.
- Réalisation d’analyses sur les images acquises
- Double-cliquez sur le logiciel pour ouvrir le programme.
- Ouvrez des images dans le logiciel de post-traitement CMR à l’aide du bouton d’importation .
- Identifiez la phase terminale systolique (définie comme la phase avec la cavité VD visuellement la plus petite) et la phase diastolique finale (définie comme la phase avec la cavité VD visuellement la plus grande).
- Selon les directives de la Société de résonance magnétique cardiovasculaire49, tracez manuellement les contours épicardiques en fin de diastole et en fin de systole de l’apex à la base, en marquant plusieurs points sur le bord épicardique de chaque image. Au dernier point, double-cliquez pour compléter le contour épicardique.
- Faites de même pour les contours endocardiques. (Figure 2). La masse ventriculaire gauche et ventriculaire droite, l’ESV, la masse DE et la masse ES sont désormais calculées automatiquement par le logiciel.
REMARQUE : La masse est définie comme le volume myocardique multiplié par la densité myocardique (c’est-à-dire 1,05). - En fonction de la question de recherche et de la population étudiée, indexez ces variables pour la taille du sujet au moyen de la longueur du tibia ou du poids corporel, selon les formules publiées précédemment50.
- Calculez l’indice d’excentricité (EI) à la fois en fin de diastole et en fin de systole, en divisant le diamètre de la cavité VG parallèle au septum intraventriculaire (IVS) par le diamètre de la cavité VG perpendiculaire à l’IVS, dérivé de l’axe court au niveau mi-papillaire.
- Le logiciel calcule le volume systolique (SV) en mL comme
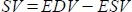 , et la fraction d’éjection (EF, %) comme
, et la fraction d’éjection (EF, %) comme 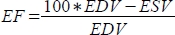 .
. - Calculer le débit cardiaque (CO) en ml/min comme .
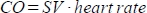 La fréquence cardiaque est mesurée manuellement par le tampon de pression intégré dans le lit de l’animal comme décrit ci-dessus, car le scanner n’est pas en mesure d’enregistrer correctement la fréquence cardiaque élevée et fréquente.
La fréquence cardiaque est mesurée manuellement par le tampon de pression intégré dans le lit de l’animal comme décrit ci-dessus, car le scanner n’est pas en mesure d’enregistrer correctement la fréquence cardiaque élevée et fréquente. - En fonction de la question de recherche et de la population étudiée, indexez le CO et le SV pour la taille du sujet au moyen de la longueur du tibia ou du poids corporel, selon les formules publiées précédemment50.
5. Analyses statistiques
- Ouvrez le logiciel utilisé pour la visualisation des données et les analyses statistiques.
- Triez les données par groupe (PAB et simulacre) avec chaque groupe dans une colonne distincte.
- Utilisez le test de Mann-Whitney pour comparer le PAB à celui du simulacre pour chaque variable.
Access restricted. Please log in or start a trial to view this content.
Résultats
Le taux de mortalité de l’intervention chirurgicale PAB est d’environ 10 %. Les résultats présentés montrent des caractéristiques des souris dans les groupes placebo (n = 5) et PAB (n = 8). Comme le montre la figure 3, les valeurs du gradient de PAB ont considérablement augmenté par rapport aux animaux fictifs à 2 et 6 semaines après le PAB. Cette augmentation de la charge a provoqué une dilatation du VD exprimée en augmentation du VD, de l?...
Access restricted. Please log in or start a trial to view this content.
Discussion
Ce protocole fournit une méthode reproductible pour la PAB chez la souris et l’évaluation ultérieure du remodelage cardiaque et de l’adaptation fonctionnelle à l’aide de la CMR.
Le PAB diffère des autres modèles de charge de pression RV accrue car il implique une augmentation absolue et statique de la postcharge sans la présence d’autres déclencheurs. La charge de pression du VD dans les modèles d’hypoxie, de monocrotaline, de shunt ou d’u...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Le Centre médical universitaire de Groningue a passé un contrat avec Actelion et Lilly pour les activités de conseil de R.M.F. Berger en dehors du contenu de ce manuscrit. Les autres auteurs déclarent qu’ils n’ont pas d’intérêts concurrents.
Remerciements
Nous tenons à remercier P. Da Costa-Martins pour son soutien dans les expériences sur les animaux dans cette étude.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 14.0 MHz i13L-echocardiography transducer | GE Healthcare, Waukesha, WI, USA | ||
| 20G cannula | |||
| 23G needle | |||
| 9.4T magnetic resonance scanner with 1,500 mT/m gradient set | Bruker BioSpin, Ellingen, Germany | ||
| Anesthesia induction chamber | |||
| Blunt 25G needle | |||
| Buprenorphine | |||
| Chloride-hexidine | |||
| CMR post-processing software | Medis Medical Imaging Systems, Leiden, The Netherlands | Qmass version 7.6 | |
| Data visualisation and statistical software | GraphPad Prism Inc, La Jolla, CA, USA | software version 7.02 | |
| Echocardiography machine | GE Healthcare, Waukesha, WI, USA | Vivid Dimension 7 | |
| Eye ointment | |||
| Heat mat | |||
| Incubator (37°C) | |||
| Isoflurane | |||
| Isoflurane evaporator | |||
| Miniventilator for rodents | Hugo Sachs | model 687 | |
| monofilament polypropylene 5-0 sutures | |||
| monofilament polypropylene 6-0 sutures | |||
| Needle and syringe for subcutaneous injections | |||
| Pediatric electrocardiogram-stickers | |||
| pure polyglycolic acid 5-0 sutures | |||
| Sterile surgical instruments | |||
| Ventilation mask |
Références
- Norozi, K., et al. Incidence and Risk Distribution of Heart Failure in Adolescents and Adults With Congenital Heart Disease After Cardiac Surgery. The American Journal of Cardiology. 97 (8), 1238-1243 (2006).
- Borgdorff, M. A. J., et al. Clinical symptoms of right ventricular failure in experimental chronic pressure load are associated with progressive diastolic dysfunction. Journal of Molecular and Cellular Cardiology. 79, 244-253 (2015).
- Koop, A. M. C., et al. Right ventricular pressure overload alters cardiac lipid composition. International Journal of Cardiology. , (2019).
- Faber, M. J., et al. Right and left ventricular function after chronic pulmonary artery banding in rats assessed with biventricular pressure-volume loops. American Journal of Physiology and Heart Circirculation Physiology. 291 (4), 1580-1586 (2006).
- Bogaard, H. J., et al. Chronic pulmonary artery pressure elevation is insufficient to explain right heart failure. Circulation. 120 (20), 1951-1960 (2009).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulmonary Circulation. 7 (3), 572-587 (2017).
- Rumsey, W. L., et al. Adaptation to hypoxia alters energy metabolism in rat heart. American Journal of Physiology Heart and Circulatory Physiology. 276 (1), 71-80 (1999).
- Drozd, K., et al. Effects of an endothelin receptor antagonist, Macitentan, on right ventricular substrate utilization and function in a Sugen 5416/hypoxia rat model of severe pulmonary arterial hypertension. Journal of Nuclear Cardiology. 24 (6), 1979-1989 (2017).
- Van Der Feen, D. E., et al. Shunt surgery, right heart catheterization, and vascular morphometry in a rat model for flow-induced pulmonary arterial hypertension. Journal of Visualized Experiments. (120), e55065(2017).
- Gomez-Arroyo, J., et al. Metabolic gene remodeling and mitochondrial dysfunction in failing right ventricular hypertrophy secondary to pulmonary arterial hypertension. Circulation: Heart Failure. 6 (1), 136-144 (2013).
- Bruns, D. R., Dale Brown, R., Stenmark, K. R., Buttrick, P. M., Walker, L. A. Mitochondrial integrity in a neonatal bovine model of right ventricular dysfunction. American Journal of Physiology - Lung Cellular and Molecular Physiology. 308 (2), 158-167 (2015).
- Zhang, W. H., et al. Up-regulation of hexokinase1 in the right ventricle of monocrotaline induced pulmonary hypertension. Respiratory Research. 15 (1), 119(2014).
- Paulin, R., et al. A miR-208-Mef2 axis drives the decompensation of right ventricular function in pulmonary hypertension. Circulation Research. 116 (1), 56-69 (2015).
- Sutendra, G., et al. A metabolic remodeling in right ventricular hypertrophy is associated with decreased angiogenesis and a transition from a compensated to a decompensated state in pulmonary hypertension. Journal of Molecular Medicine. 91 (11), 1315-1327 (2013).
- Balestra, G. M., et al. Increased in vivo mitochondrial oxygenation with right ventricular failure induced by pulmonary arterial hypertension: Mitochondrial inhibition as driver of cardiac failure. Respiratory Research. 16, 6(2015).
- Piao, L., et al. The inhibition of pyruvate dehydrogenase kinase improves impaired cardiac function and electrical remodeling in two models of right ventricular hypertrophy: Resuscitating the hibernating right ventricle. Journal of Molecular Medicine. 88 (1), 47-60 (2010).
- Piao, L., et al. FOXO1-mediated upregulation of pyruvate dehydrogenase kinase-4 (PDK4) decreases glucose oxidation and impairs right ventricular function in pulmonary hypertension: therapeutic benefits of dichloroacetate. Journal of Molecular Medicine. 91, 333-346 (2013).
- Sheikh, A. M., et al. Right ventricular hypertrophy with early dysfunction: A proteomics study in a neonatal model. Journal of Thoracic and Cardiovascular Surgery. 137 (5), 1146-1153 (2009).
- Olivetti, G., et al. Cellular basis of wall remodeling in long-term pressure overload-induced right ventricular hypertrophy in rats. Circulation Research. 63 (3), 648-657 (1988).
- Lauva, I. K., et al. Control of myocardial tissue components and cardiocyte organelles in pressure-overload hypertrophy of the cat right ventricle. The American Journal of Anatomy. 177 (1), 71-80 (1986).
- Fang, Y. H., et al. Therapeutic inhibition of fatty acid oxidation in right ventricular hypertrophy: Exploiting Randle's cycle. Journal of Molecular Medicine. 90 (1), 31-43 (2012).
- Piao, L., et al. Cardiac glutaminolysis: A maladaptive cancer metabolism pathway in the right ventricle in pulmonary hypertension. Journal of Molecular Medicine. 91 (10), 1185-1197 (2013).
- Sack, M. N., Disch, D. L., Rockman, H. A., Kelly, D. P. A role for Sp and nuclear receptor transcription factors in a cardiac hypertrophic growth program. Proceedings of the National Academy of Sciences of the United States of America. 94 (12), 6438-6443 (1997).
- Broderick, T. L., King, T. M. Upregulation of GLUT-4 in right ventricle of rats with monocrotaline- induced pulmonary hypertension. Medical Science Monitor. 14 (12), 261-264 (2008).
- Enache, I., et al. Skeletal muscle mitochondrial dysfunction precedes right ventricular impairment in experimental pulmonary hypertension. Molecular and Cellular Biochemistry. 373 (1-2), 161-170 (2013).
- Sun, X. Q., et al. Reversal of right ventricular remodeling by dichloroacetate is related to inhibition of mitochondria-dependent apoptosis. Hypertension Research. 39 (5), 302-311 (2016).
- Adrogue, J. V., Sharma, S., Ngumbela, K., Essop, M. F., Taegtmeyer, H. Acclimatization to chronic hypobaric hypoxia is associated with a differential transcriptional profile between the right and left ventricle. Molecular and Cellular Biochemistry. 278 (1-2), 71-78 (2005).
- Sharma, S., et al. Dynamic changes of gene expression in hypoxia-induced right ventricular hypertrophy. American Journal of Physiology - Heart and Circulatory Physiology. 286 (3), 1185-1192 (2004).
- Nouette-Gaulain, K., et al. Time course of differential mitochondrial energy metabolism adaptation to chronic hypoxia in right and left ventricles. Cardiovascular Research. 66 (1), 132-140 (2005).
- Graham, B. B., et al. Severe pulmonary hypertension is associated with altered right ventricle metabolic substrate uptake. American Journal of Physiology - Lung Cellular and Molecular Physiology. 309 (5), 435-440 (2015).
- Liu, A., et al. Estrogen maintains mitochondrial content and function in the right ventricle of rats with pulmonary hypertension. Physiological Reports. 5 (6), 1-12 (2017).
- Kobr, J., et al. Right Ventricular Pressure Overload and Pathophysiology of Growing Porcine Biomodel. Pediatric Cardiology. 37 (8), 1498-1506 (2016).
- Yerebakan, C., et al. Acute and chronic response of the right ventricle to surgically induced pressure and volume overload - an analysis of pressure-volume relations. Interactive CardioVascular and Thoracic Surgery. 10 (4), 519-525 (2010).
- Gufler, H., et al. Right Ventricular Function After Pulmonary Artery Banding: Adaptive Processes Assessed by CMR and Conductance Catheter Measurements in Sheep. Journal of Cardiovascular Translational Research. 12 (5), 459-466 (2019).
- Baicu, C. F., et al. Time course of right ventricular pressure-overload induced myocardial fibrosis: relationship to changes in fibroblast postsynthetic procollagen processing. American Journal of Physiology-Heart and Circulatory Physiology. 303 (9), 1128-1134 (2012).
- Manohar, M., et al. Regional myocardial blood flow and coronary vascular reserve in unanesthetized young calves exposed to a simulated altitude of 3500 m for 8-10 weeks. Circulation Research. 50 (5), 714-726 (1982).
- Fávaro, G. A. G., et al. Reversible pulmonary trunk banding: VII. Stress echocardiographic assessment of rapid ventricular hypertrophy in young goats. Journal of Thoracic and Cardiovascular Surgery. 145 (5), 1345-1351 (2013).
- Nielsen, E. A., et al. Regional septal hinge-point injury contributes to adverse biventricular interactions in pulmonary hypertension. Physiological Reports. 5 (14), 1-13 (2017).
- Borgdorff, M. A., et al. Sildenafil enhances systolic adaptation, but does not prevent diastolic dysfunction, in the pressure-loaded right ventricle. European Journal of Heart Failure. 14 (9), 1067-1074 (2012).
- Gold, H., Prindle, K., Levey, G., Epstein, S. Effects of experimental heart failure on the capacity of glucagon to augment myocardial contractility and activate adenyl cyclase. The Journal of Clinical Investigation. 49 (5), 999-1006 (1970).
- Brittain, E. L., et al. Right ventricular plasticity and functional imaging. Pulmonary Circulation. 2 (3), 309-326 (2012).
- Jiang, L., et al. Three-dimensional Echocardiography In Vivo Validation for Right Ventricular Volume and Function. Circulation. 89, 2342-2350 (1994).
- Markiewicz, W., Sechtem, U., Higgins, C. B. Evaluation of the right ventricle by magnetic resonance imaging. American Heart Journal. 113 (1), 8-15 (1987).
- Pattynama, P. M. T., et al. Reproducibility of MRI-derived measurements of right ventricular volumes and myocardial mass. Magnetic Resonance Imaging. 13 (1), 53-63 (1995).
- Wiesmann, F., et al. Comparison of fast spiral, echo planar, and fast low-angle shot MRI for cardiac volumetry at .5T. Journal of Magnetic Resonance Imaging. 8 (5), 1033-1039 (1998).
- Van der Feen, D. E., et al. Multicenter Preclinical Validation of BET Inhibition for the Treatment of Pulmonary Arterial Hypertension. American Journal of Respiratory and Critical Care Medicine. 200 (7), 910-920 (2019).
- da Costa Martins, P. A., et al. MicroRNA-199b targets the nuclear kinase Dyrk1a in an auto-amplification loop promoting calcineurin/NFAT signalling. Nature Cell Biology. 12 (12), 1220-1227 (2010).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. Journal of Visualized Experiments. (84), e51041(2014).
- Schulz-Menger, J., et al. Standardized image interpretation and post processing in cardiovascular magnetic resonance: Society for Cardiovascular Magnetic Resonance (SCMR) Board of Trustees Task Force on Standardized Post Processing. Journal of Cardiovascular Magnetic Resonance. 15 (1), 1-19 (2013).
- Hagdorn, Q. A. J., et al. A novel method optimizing the normalization of cardiac parameters in small animal models: The importance of dimensional indexing. American Journal of Physiology - Heart and Circulatory Physiology. 316 (6), 1552-1557 (2019).
- Scherrer-Crosbie, M., et al. Determination of Right Ventricular Structure and Function in Normoxic and Hypoxic Mice. Circulation. 98 (10), 1015-1021 (2012).
- Wiesmann, F., et al. Analysis of right ventricular function in healthy mice and a murine model of heart failure by in vivo MRI. American Journal of Physiology-Heart and Circulatory Physiology. 283 (3), 1065-1071 (2002).
- Lu, X., et al. Accuracy and Reproducibility of Real-Time Three-Dimensional Echocardiography for Assessment of Right Ventricular Volumes and Ejection Fraction in Children. Journal of the American Society of Echocardiography. 21 (1), 84-89 (2008).
- Soriano, B. D., et al. Matrix-array 3-dimensional echocardiographic assessment of volumes, mass, and ejection fraction in young pediatric patients with a functional single ventricle: A comparison study with cardiac magnetic resonance. Circulation. 117 (14), 1842-1848 (2008).
- Damy, T., et al. Prevalence of, associations with, and prognostic value of tricuspid annular plane systolic excursion (TAPSE) among out-patients referred for the evaluation of heart failure. Journal of Cardiac Failure. 18 (3), 216-225 (2012).
- Kowalik, E., Kowalski, M., Rózański, J., Kuśmierczyk, M., Hoffman, P. The impact of pulmonary regurgitation on right ventricular regional myocardial function: An echocardiographic study in adults after total repair of tetralogy of fallot. Journal of the American Society of Echocardiography. 24 (11), 1199-1204 (2011).
- Koestenberger, M., et al. Systolic right ventricular function in pediatric and adolescent patients with tetralogy of Fallot: Echocardiography versus magnetic resonance imaging. Journal of the American Society of Echocardiography. 24 (1), 45-52 (2011).
- Bovens, S. M., et al. Evaluation of infarcted murine heart function: Comparison of prospectively triggered with self-gated MRI. NMR in Biomedicine. 24 (3), 307-315 (2011).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon