È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Quantificazione della funzione e della morfologia biventricolare mediante risonanza magnetica cardiaca nei topi con bande arteriose polmonari
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Per comprendere la fisiopatologia dell'adattamento del ventricolo destro (RV) a carichi anomali, i modelli sperimentali sono fondamentali. Tuttavia, la valutazione delle dimensioni e della funzione dei camper è complessa e impegnativa. Questo protocollo fornisce un metodo per eseguire la risonanza magnetica cardiaca (CMR) come procedura di riferimento non invasiva nei topi sottoposti a carico di pressione del ventricolo destro.
Abstract
La funzione e l'insufficienza ventricolare destra (RV) sono i principali determinanti dell'esito nelle cardiopatie acquisite e congenite, inclusa l'ipertensione polmonare. La valutazione della funzione e della morfologia del ventricolo destro è complessa, in parte a causa della forma complessa del ventricolo destro. Attualmente, la risonanza magnetica cardiaca (CMR) è lo standard di riferimento per la valutazione non invasiva della funzione e della morfologia del ventricolo destro. L'attuale protocollo descrive l'imaging CMR in un modello murino del carico di pressione del ventricolo destro indotto dal banding dell'arteria polmonare (PAB). Il PAB viene eseguito posizionando una sutura 6-0 attorno all'arteria polmonare su un ago da 23 G. Il gradiente PAB viene determinato utilizzando l'ecocardiografia a 2 e 6 settimane. A 6 settimane, la morfologia e la funzione del ventricolo destro e sinistro vengono valutate misurando i volumi e la massa sia telesistolica che telediastolica da dieci a undici fette cine di 1 mm di spessore utilizzando uno scanner a risonanza magnetica da 9,4 T dotato di un gradiente di 1.500 mT/m. Risultati rappresentativi mostrano che il PAB induce un aumento significativo del carico pressorio del ventricolo destro, con effetti significativi sulla morfologia biventricolare e sulla funzione del ventricolo destro. È stato anche dimostrato che a 6 settimane di carico pressorio destro, la gittata cardiaca viene mantenuta. Qui viene presentato un protocollo riproducibile per la quantificazione della morfologia e della funzione biventricolare in un modello murino di carico di pressione del ventricolo destro e può servire come metodo per esperimenti che esplorano i determinanti del rimodellamento e della disfunzione del ventricolo destro.
Introduzione
I pazienti con malattie cardiovascolari acquisite e congenite, inclusa l'ipertensione polmonare (PH), sono a rischio di disfunzione e insufficienza ventricolare destra (RV)1. L'adattamento del ventricolo destro a seguito di un aumento del carico pressorio è caratterizzato da ipertrofia concentrica negli stadi iniziali e da dilatazione progressiva nello stadio terminale della malattia. Inoltre, è associato a disturbi del metabolismo e della matrice extracellulare, processi infiammatori e, infine, insufficienza ventricolare ventricolare destra 2,3,4,5,6. Sono stati sviluppati modelli animali per esplorare i processi sottostanti alla progressione verso il fallimento del ventricolo destro. Tuttavia, l'ottimizzazione dei modelli e un'adeguata valutazione della funzione e delle dimensioni dei ventricoli sono state impegnative. Per la valutazione non invasiva della funzione e delle dimensioni del ventricolo destro, la risonanza magnetica cardiaca (CMR) è lo standard di riferimento. Questa tecnica crea immagini del cuore che batte utilizzando un forte campo magnetico e onde a radiofrequenza. La CMR è disponibile per l'uomo e per animali come i roditori da laboratorio. Poiché questi ultimi richiedono una risoluzione spaziale più elevata a causa delle dimensioni ridotte del cuore, il campo magnetico richiesto per fornire immagini adeguate deve essere più elevato rispetto agli esseri umani.
Sono disponibili più modelli che imitano il sovraccarico di pressione RV, inclusi i modelli di PH 7,8,9,10,11,12,13,14,15,16,17 e i modelli di carico di pressione RV prossimale 2,3,10,18, 19,20,21,22,23. La scelta di un modello di PH o di un modello di carico di pressione prossimale del ventricolo destro dipende dalla domanda di ricerca: l'effetto di un intervento sulla vascolarizzazione polmonare e quindi possibilmente la modulazione del postcarico del ventricolo destro (ad esempio, i modelli di PH), o l'effetto diretto sul ventricolo destro (ad esempio, i modelli di carico di pressione prossimale del ventricolo destro). Sono disponibili diversi metodi per l'induzione sperimentale dell'ipertensione polmonare, tra cui l'uso di monocrotalina (MCT)12,13,14,16,22,24,25,26, MCT combinato con uno shunt aortocavale 9, ipossia cronica 7,27,28,29, e la combinazione di un antagonista del recettore del fattore di crescita endoteliale vascolare, Sugen 5416, con ipossia cronica 8,10,30,31. Tali modelli rappresentano modelli polmonari progressivi di carico pressorio destro prossimale e non sono mirati al sistema vascolare polmonare, ma inducono un postcarico costante per costrizione dell'arteria polmonare, con un conseguente aumento del postcarico ventricolare destrodi 2,3. Questo può essere eseguito da un bendaggio di sutura (bendaggio dell'arteria polmonare, PAB) o da una clip vascolare attorno all'arteria polmonare. Il PAB è stato eseguito in diverse specie animali e le dimensioni e la funzione cardiaca sono state studiate in vari modi, come l'istologia, l'ecocardiografia transtoracica (incluso il tracciamento dello speckle) e il cateterismo cardiaco 2,32,33,34,35,36,37,38,39,40 . Il PAB nei piccoli roditori, come i topi, è impegnativo. Questo perché sottili differenze tra la tenuta della costrizione arteriosa hanno ottenuto risultati marcati sul grado di carico di pressione del ventricolo destro e sul successivo stato funzionale e sopravvivenza. Quando la costrizione è molto stretta, l'animale morirà durante o poco dopo l'operazione, mentre il fenotipo desiderato non sarà raggiunto quando la costrizione non è abbastanza stretta. Tuttavia, l'uso dei topi presenta vantaggi rispetto ad altri animali, a causa delle eccellenti possibilità di modificazione genetica (ad esempio, modelli transgenici o knockout) e della rapida riproduzione. Questo è un valore aggiunto nello studio delle malattie e nell'esplorazione del contributo di fattori molecolari ed (epi-)genetici.
I disegni degli studi sugli animali si stanno spostando verso l'indagine dei cambiamenti temporali durante la malattia 2,3,8,13,21. Per tali studi sono necessarie modalità non invasive, perché possono essere eseguite valutazioni seriali. Alternative alla CMR nella valutazione del rimodellamento cardiaco potrebbero essere (1) la caratterizzazione dei tessuti mediante istopatologia, con più animali sacrificati in diversi punti temporali, (2) la valutazione funzionale invasiva mediante analisi pressione-volume o (3) l'ecocardiografia, che consente al ricercatore di identificare l'ipertrofia cardiaca o la dilatazione in modo non invasivo all'interno dello stesso animale in serie. La CMR presenta due principali vantaggi nella valutazione del RV: (1) la CMR è una modalità non invasiva, che consente misurazioni seriali in un animale, contribuendo così a ridurre il numero di animali necessari per gli studi, e (2) la CMR non si basa su una particolare forma geometrica e visualizza tridimensionalmente. Le misurazioni dei volumi e della funzione del ventricolo destro derivate dalla CMR si sono dimostrate accurate e sono considerate lo standard d'oro non invasivo in diverse entità cardiache nell'uomo 42,43,44,45, ma non erano ancora state tradotte in un protocollo CMR per i topi con sovraccarico di pressione del ventricolo destro.
In letteratura sono descritti molti modelli di PAB, ma con un'elevata eterogeneità nei metodi di valutazione degli effetti emodinamici e della funzione e dell'adattamento del ventricolo destro. Questo protocollo delinea la procedura del PAB nei topi con la validazione del modello misurando il gradiente di PAB mediante ecocardiografia e valutando le dimensioni e la funzione cardiaca con CMR. Mentre un protocollo di CMR negli animali sottoposti a PAB è stato pubblicato per i ratti, questa combinazione non è stata descritta per i topi fino ad ora. Mentre i ratti sono più comunemente usati per i modelli PH 8,12,13,14,15,16,22,24,25,26,27,28,29,30,31,46 , i topi sono più spesso utilizzati per studi transgenici o knock-out e quindi contribuiscono alla nostra comprensione dei meccanismi nel fallimento del ventricolo destro sotto pressione. Questo protocollo potrebbe costituire la base per studi futuri per svelare le vie di segnalazione coinvolte nella transizione verso il fallimento del ventricolo destro.
Protocollo
Tutti gli esperimenti e la cura degli animali sono condotti secondo la legge olandese sulla sperimentazione animale e sono conformi alla Guida per la cura e l'uso degli animali da laboratorio pubblicata dal National Institutes of Health degli Stati Uniti. Il Comitato per gli esperimenti sugli animali dell'Università di Groningen, nei Paesi Bassi, ha approvato l'attuale protocollo sperimentale (numero di autorizzazione: 2014-041/3005).
1. Alloggio e acclimatazione
- Utilizzare 20-30 g di topi selvatici C57 neri 6 (C57BL/6) (linea di riproduzione istituzionale descritta in precedenza47), maschi e femmine, tutti di età superiore a 8 settimane. Alloggia i topi in gruppi con un massimo di cinque per gabbia. Per abituarsi alla manipolazione umana, lasciare che i topi si acclimatino per almeno 7 giorni. Non eseguire alcuna procedura durante questo periodo.
2. Chirurgia del bendaggio dell'arteria polmonare
- Preparazione
- Posizionare il mouse nella camera di induzione riempita con isoflurano al 5% e ossigeno al 100%. Verifica la mancanza di riflessi dando uno stimolo doloroso (ad esempio, pizzicare le dita dei piedi).
- Radere l'emitorace sinistro del mouse utilizzando un rasoio elettrico.
- Estrarre delicatamente la linguetta e tenerla con una leggera tensione.
- Illuminare la gola interna posizionando una fonte di luce sulla gola esterna a livello della glottide.
- Intubare il topo per via endotracheale con una cannula flessibile da 20 G.
- Posizionare l'animale sul lato destro su un tappetino termico (impostare la temperatura a 37 °C).
- Collegare la cannula al miniventilatore e avviare la ventilazione con isoflurano/ossigeno all'1,5%-2,5% (180 respiri/min, corrente 250 μL).
- Iniettare 0,1 mg/kg di buprenorfina per via sottocutanea per l'analgesia postoperatoria.
- Prevenire la disidratazione dell'occhio usando un unguento per gli occhi.
- Chirurgia del bendaggio dell'arteria polmonare mediante toracotomia laterale sinistra
- Posiziona il mouse sul lato destro posizionando la zampa anteriore destra in una posizione neutra, la zampa posteriore destra estesa e la zampa anteriore sinistra piegata all'indietro.
- Disinfettare la pelle del torace con cloruro-esaxidina, tamponare 2 volte.
- Utilizzare strumenti sterili per la chirurgia. Aprire la pelle con piccole forbici (manico rotondo, lame da 12 mm) dall'ascella sinistra parallelamente alla seconda e terza costola.
- Identificare il m. pectoralis superficialis (muscolo obliquo superficiale) e il m. pectoralis profundus (muscolo obliquo sottostante).
- Utilizzando gli anelli di sutura, tirare il m. pectoralis superficialis verso il lato ventrale e il m. pectoralis profundus verso il lato dorsale del topo.
- Aprire il secondo spazio intercostale e allargare le costole utilizzando graffette adattate, consentendo al cuore, all'orecchio sinistro, al polmone sinistro e all'arteria polmonare di diventare visibili.
- Separare l'arteria polmonare dall'aorta. Posizionare un anello di sutura attorno all'arteria polmonare con un ago smussato da 25 G che contiene una sutura 6-0 e posizionare una legatura 2-1-1 persa attorno all'arteria polmonare.
- Posizionare un ago da 23 G parallelo all'arteria polmonare all'interno della sutura 6-0 e fissare prima il nodo di sutura più prossimale e poi il nodo distale della sutura 2-1-1. Rimuovere l'ago da 23 G. Assicurati che il nodo sia adeguato.
- Chiudere il torace con due o tre suture separate con una sutura monofilamento in polipropilene 5-0. Rilasciare il m. pectoralis superficalis e il m. pectoralis profundus.
- Sutura la pelle con una sutura 5-0 di acido poliglicolico puro. Utilizzare una tecnica di sutura continua per ridurre al minimo la formazione di cicatrici nel tessuto; Il tessuto cicatriziale influenzerà la qualità dell'immagine dell'ecocardiografia.
- Spegnere l'isoflurano continuando la ventilazione con l'ossigeno durante il recupero dall'anestesia fino a quando il topo non riacquista la propria respirazione spontanea, come si può osservare dal movimento dell'addome.
- Disaccoppiare il tubo endotracheale dal ventilatore. Verificare la respirazione spontanea, estubare solo quando è visibile l'azione respiratoria spontanea. Quando la respirazione spontanea non è visibile, collegare nuovamente il tubo al ventilatore e tornare al passaggio 2.2.12.
- Osserva il topo finché non riprende conoscenza.
- Chirurgia fittizia
- Eseguire la procedura sopra descritta ad eccezione della fascettatura (passaggi 2.2.2–2.2.6).
- Periodo post-operatorio
- Alloggiare il topo singolarmente in un'incubatrice (37 °C) per 24 ore.
- Osservare il mouse quotidianamente durante i primi 3 giorni postoperatori. In caso di segni di disagio, iniettare 0,1 mg/kg di buprenorfina per via sottocutanea 2 volte al giorno per l'analgesia postoperatoria.
3. Ecocardiografia
- Preparazione
- Eseguire l'analisi del gradiente PAB mediante ecocardiografia 14 giorni dopo l'intervento chirurgico di PAB.
- Avviare il dispositivo per ecocardiografia. Scegli il pacchetto cardiaco e un trasduttore da 14,0 MHz.
- Anestesia
- Posizionare il topo nella camera di induzione riempita con una miscela di isoflurano al 5% e ossigeno al 100%.
- Radere il torace del topo.
- Posizionare il mouse sulla schiena sul tappetino termico (temperatura 37 °C) e posizionare il muso nella maschera di ventilazione.
- Ventilare con una miscela di isoflurano all'1,5%-2,5% e ossigeno al 100% (0,15 L/min) e aria ambiente (0,3 L/min).
- Controllare la profondità dell'anestesia eseguendo un pizzicamento delle dita dei piedi e regolare l'anestesia di conseguenza.
- Prevenire la disidratazione dell'occhio usando un unguento per gli occhi.
- Determinazione del gradiente di PAB mediante ecocardiografia
- Posizionare gli adesivi per elettrocardiogramma pediatrico su ciascuna zampa anteriore e una su entrambe le zampe posteriori. Usa gli adesivi per tenere l'animale.
- Applicare il gel per ultrasuoni sulla parte rasata del torace del topo.
- Per ottenere le immagini dell'arteria polmonare, è possibile utilizzare due visualizzazioni: la vista dell'asse lungo parasternale (PLAX) o la vista dell'asse corto parasternale (PSAX). Ottenete entrambi e utilizzate la vista che fornisce le misure della migliore qualità e le velocità più elevate per l'analisi.
- Ottenere le viste PLAX e PSAX.
- Premere il pulsante color-Doppler per visualizzare il flusso sanguigno.
- Posizionare la sonda ecografica con un angolo di 30° rispetto alla linea parasternale per ottenere PLAX (per una descrizione dettagliata vedere Cheng, et al.48), visualizzando l'aorta ascendente.
- Spostare la sonda verso sinistra in modo che l'aorta ascendente scompaia dietro l'arteria polmonare. La PLAX appropriata viene identificata quando viene visualizzata l'arteria polmonare, con il sangue che scorre verticalmente.
- Posizionare il cursore in linea con l'arteria polmonare. Premere il pulsante Doppler a onda continua (CW) per ricavare le misurazioni integrali della velocità, del tempo durante tre cicli cardiaci. Premi Salva.
- Ruotare la sonda di 90° in senso orario rispetto al PLAX per ottenere il PSAX, quindi inclinare leggermente la sonda verso la direzione craniale/ventrale per derivare il PSAX a livello aortico. La vista PSAX appropriata viene identificata se il tratto di efflusso del ventricolo destro si trova tra l'aorta e la sonda. Questo continua nell'arteria polmonare, con il sangue che scorre verticalmente. Per una descrizione dettagliata vedi Cheng et al.48
- Posizionare il cursore in linea con l'arteria polmonare. Premere il pulsante Doppler a onda continua (CW) per ricavare le misurazioni integrali della velocità, del tempo durante tre cicli cardiaci. Premi Salva.
- Misurare le tre velocità massime della vista migliore (PSAX o PLAX) e calcolare la media. Usa il principio di Bernoulli semplificato per derivare il gradiente PAB in millimetri di mercurio (mmHg).
4. Risonanza magnetica cardiaca
- Preparazione
- Eseguire l'analisi CMR 6 settimane (cioè 42 giorni) dopo l'intervento PAB.
NOTA: Inoltre, i punti temporali precedenti dopo l'intervento chirurgico PAB possono essere scelti quando devono essere inclusi più punti temporali, a seconda della domanda di ricerca. Potrebbero essere presi in considerazione punti temporali successivi; tuttavia, il guasto e la morte del camper possono verificarsi sempre più spesso. - Utilizzare un magnete sufficientemente potente (in genere, >7 T viene utilizzato per la scansione CMR dei roditori). Per il protocollo attuale, viene utilizzato un sistema verticale da 9,4 T, con gradiente impostato di 1.500 mT/m e diametro interno di 89 mm.
- Installa il software di post-elaborazione CMR per l'analisi di volumi e masse nelle immagini derivate. Il software è ritenuto appropriato se consente la segmentazione manuale per determinare i volumi telediastolici (ED) e telesistolici (ES) (EDV ed ESV, rispettivamente) e la massa ventricolare (misurata sia ED che ES).
- Eseguire l'analisi CMR 6 settimane (cioè 42 giorni) dopo l'intervento PAB.
- Anestesia e fissazione
- Posizionare il topo nella camera di induzione riempita con una miscela di isoflurano al 5% e ossigeno al 100%. Verificare l'effetto dell'anestesia dando uno stimolo doloroso con un pizzico di dito del piede.
- Metti un unguento sugli occhi del topo per mantenerli umidi durante la scansione.
- Posizionare il mouse nella cuccia dello scanner con alimentazione d'aria integrata, una miscela riscaldata (37 °C) di isoflurano all'1,5%-2,5%, ossigeno al 100% (0,15 L/min) e aria ambiente (0,3 L/min) e un cuscinetto a pressione che consente l'osservazione della frequenza cardiaca (obiettivo 400-500 bpm) e della frequenza respiratoria (obiettivo ~35 respiri al minuto) durante la scansione. Regolare l'anestesia in base a questi due parametri. Assicurati che il letto sia in plastica, senza alcun materiale magnetico.
- Posiziona la cuccia con il mouse nello scanner.
- Esecuzione di risonanza magnetica cardiaca
- Effettuare le regolazioni di preacquisizione regolando la bobina della gabbia per uccelli a radiofrequenza (RF) sulla frequenza di risonanza di 1 idrogeno (1 H).
- Quindi impostare il campo magnetico il più omogeneo possibile utilizzando la procedura di spessoramento automatico.
NOTA: Lo spessoramento computerizzato viene effettuato con il cosiddetto metodo Tuning, che utilizza l'area sotto il FID 1 H come parametro di qualità. In questa procedura di ottimizzazione viene esaminato un gruppo di spessori definito dall'utente (Z, Z2, X, Y, XZ e YZ) in un ciclo iterativo. Ogni spessore in successione viene regolato individualmente per massimizzare l'area sotto il FID. Si tratta essenzialmente di una procedura lineare che funziona bene e rapidamente. - Ottimizza l'impulso RF massimizzando il profilo dell'immagine unidimensionale con la regolazione della potenza dell'impulso RF.
- Assegna la posizione esatta del cuore nello scanner effettuando scansioni scout utilizzando una sequenza tripilota. Usa una sequenza di eco a gradiente veloce per acquisire le immagini dell'esploratore attraverso il torace: una fetta trasversale, coronale e sagittale. (Figura 1A,B,C)
- Regolare gli assi in base agli assi effettivi della vista assiale, a due e quattro camere (Figura 1D, E).
- Successivamente, posizionare le fette cine perpendicolarmente a un asse immaginario tra il tratto di deflusso RV e la parte apicale massima del RV.
- Ricavare da dieci a undici fette cine di 1 mm di spessore senza uno spazio tra le fette per coprire l'intera imaging dall'alto alla base del ventricolo destro (Figura 1F) mediante il metodo FLASH (Self-gated IntraGate-fast low-angle shot), che elimina la necessità di un elettrocardiogramma (ECG) e di un gating respiratorio. I parametri di acquisizione sono visualizzati nella Tabella 1. Salvare le immagini in formato DICOM.
- Esecuzione di analisi sulle immagini acquisite
- Fare doppio clic sul software per aprire il programma.
- Aprire le immagini nel software di post-elaborazione CMR utilizzando il pulsante di importazione .
- Identificare la fase telesistolica (definita come la fase con la cavità ventricolare ventricolare sinistra visivamente) e la fase telediastolica (definita come la fase con la cavità ventricolare ventricolare destra visivamente più grande).
- Secondo le linee guida della Society for Cardiovascular Magnetic Resonance49, disegnare manualmente i contorni epicardici in telediastole e terminalimetria dall'apice alla base, segnando diversi punti sul bordo epicardico di ciascuna immagine. All'ultimo punto, fare doppio clic per completare il contorno epicardico.
- Fai lo stesso per i contorni endocardici. (Figura 2). L'EDV del ventricolo sinistro e del ventricolo destro, l'ESV, la massa DE e la massa ES vengono ora calcolati automaticamente dal software.
NOTA: La massa è definita come volume miocardico moltiplicato per densità miocardica (cioè 1,05). - A seconda della domanda di ricerca e della popolazione oggetto di studio, indicizzare queste variabili per le dimensioni del soggetto per mezzo della lunghezza della tibia o del peso corporeo, secondo le formule precedentemente pubblicate50.
- Calcolare l'indice di eccentricità (EI) sia in telediastole che in telesistole, dividendo il diametro della cavità ventricolare sinistra parallela al setto intraventricolare (IVS) per il diametro della cavità ventricolare sinistra perpendicolare all'IVS, derivato dall'asse corto a livello mediopapillare.
- Il software calcola la gittata sistolica (SV) in mL come
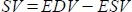 , e la frazione di eiezione (EF, %) come
, e la frazione di eiezione (EF, %) come 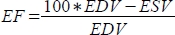 .
. - Calcolare la gittata cardiaca (CO) in ml/min come
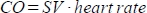 . La frequenza cardiaca viene misurata manualmente dal cuscinetto a pressione incorporato nella cuccia dell'animale come descritto sopra, perché lo scanner non è in grado di registrare adeguatamente l'elevata frequenza cardiaca frequente.
. La frequenza cardiaca viene misurata manualmente dal cuscinetto a pressione incorporato nella cuccia dell'animale come descritto sopra, perché lo scanner non è in grado di registrare adeguatamente l'elevata frequenza cardiaca frequente. - A seconda della domanda di ricerca e della popolazione oggetto di studio, indicizzare il CO e l'SV per le dimensioni del soggetto per mezzo della lunghezza della tibia o del peso corporeo, secondo le formule precedentemente pubblicate50.
5. Analisi statistiche
- Apri il software utilizzato per la visualizzazione dei dati e le analisi statistiche.
- Ordina i dati per gruppo (PAB e sham) con ogni gruppo in una colonna separata.
- Usa il test di Mann-Whitney per confrontare PAB con sham per ogni variabile.
Risultati
Il tasso di mortalità della procedura chirurgica PAB è di circa il 10%. I risultati presentati mostrano le caratteristiche dei topi nei gruppi sham (n = 5) e PAB (n = 8). Come mostrato nella Figura 3, i valori del gradiente di PAB sono aumentati significativamente rispetto agli animali fittizi a 2 e 6 settimane dopo il PAB. Questo aumento del carico ha causato la dilatazione del ventricolo destro espressa come aumento del ventricolo destro, dell'EDV e dell...
Discussione
Questo protocollo fornisce un metodo riproducibile per il PAB nei topi e la successiva valutazione del rimodellamento cardiaco e dell'adattamento funzionale utilizzando la CMR.
Il PAB si differenzia dagli altri modelli di carico di pressione RV aumentato perché comporta un aumento assoluto e statico del postcarico senza la presenza di altri trigger. Il carico di pressione del ventricolo destro nei modelli di ipossia, monocrotalina, shunt o una combinazione di...
Divulgazioni
Il Centro Medico Universitario di Groningen ha stipulato un contratto con Actelion e Lilly per le attività di consulenza di R.M.F. Berger al di fuori del contenuto di questo manoscritto. Gli altri autori dichiarano di non avere interessi concorrenti.
Riconoscimenti
Vorremmo ringraziare P. Da Costa-Martins per il suo supporto con gli esperimenti sugli animali in questo studio.
Materiali
| Name | Company | Catalog Number | Comments |
| 14.0 MHz i13L-echocardiography transducer | GE Healthcare, Waukesha, WI, USA | ||
| 20G cannula | |||
| 23G needle | |||
| 9.4T magnetic resonance scanner with 1,500 mT/m gradient set | Bruker BioSpin, Ellingen, Germany | ||
| Anesthesia induction chamber | |||
| Blunt 25G needle | |||
| Buprenorphine | |||
| Chloride-hexidine | |||
| CMR post-processing software | Medis Medical Imaging Systems, Leiden, The Netherlands | Qmass version 7.6 | |
| Data visualisation and statistical software | GraphPad Prism Inc, La Jolla, CA, USA | software version 7.02 | |
| Echocardiography machine | GE Healthcare, Waukesha, WI, USA | Vivid Dimension 7 | |
| Eye ointment | |||
| Heat mat | |||
| Incubator (37°C) | |||
| Isoflurane | |||
| Isoflurane evaporator | |||
| Miniventilator for rodents | Hugo Sachs | model 687 | |
| monofilament polypropylene 5-0 sutures | |||
| monofilament polypropylene 6-0 sutures | |||
| Needle and syringe for subcutaneous injections | |||
| Pediatric electrocardiogram-stickers | |||
| pure polyglycolic acid 5-0 sutures | |||
| Sterile surgical instruments | |||
| Ventilation mask |
Riferimenti
- Norozi, K., et al. Incidence and Risk Distribution of Heart Failure in Adolescents and Adults With Congenital Heart Disease After Cardiac Surgery. The American Journal of Cardiology. 97 (8), 1238-1243 (2006).
- Borgdorff, M. A. J., et al. Clinical symptoms of right ventricular failure in experimental chronic pressure load are associated with progressive diastolic dysfunction. Journal of Molecular and Cellular Cardiology. 79, 244-253 (2015).
- Koop, A. M. C., et al. Right ventricular pressure overload alters cardiac lipid composition. International Journal of Cardiology. , (2019).
- Faber, M. J., et al. Right and left ventricular function after chronic pulmonary artery banding in rats assessed with biventricular pressure-volume loops. American Journal of Physiology and Heart Circirculation Physiology. 291 (4), 1580-1586 (2006).
- Bogaard, H. J., et al. Chronic pulmonary artery pressure elevation is insufficient to explain right heart failure. Circulation. 120 (20), 1951-1960 (2009).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulmonary Circulation. 7 (3), 572-587 (2017).
- Rumsey, W. L., et al. Adaptation to hypoxia alters energy metabolism in rat heart. American Journal of Physiology Heart and Circulatory Physiology. 276 (1), 71-80 (1999).
- Drozd, K., et al. Effects of an endothelin receptor antagonist, Macitentan, on right ventricular substrate utilization and function in a Sugen 5416/hypoxia rat model of severe pulmonary arterial hypertension. Journal of Nuclear Cardiology. 24 (6), 1979-1989 (2017).
- Van Der Feen, D. E., et al. Shunt surgery, right heart catheterization, and vascular morphometry in a rat model for flow-induced pulmonary arterial hypertension. Journal of Visualized Experiments. (120), e55065 (2017).
- Gomez-Arroyo, J., et al. Metabolic gene remodeling and mitochondrial dysfunction in failing right ventricular hypertrophy secondary to pulmonary arterial hypertension. Circulation: Heart Failure. 6 (1), 136-144 (2013).
- Bruns, D. R., Dale Brown, R., Stenmark, K. R., Buttrick, P. M., Walker, L. A. Mitochondrial integrity in a neonatal bovine model of right ventricular dysfunction. American Journal of Physiology - Lung Cellular and Molecular Physiology. 308 (2), 158-167 (2015).
- Zhang, W. H., et al. Up-regulation of hexokinase1 in the right ventricle of monocrotaline induced pulmonary hypertension. Respiratory Research. 15 (1), 119 (2014).
- Paulin, R., et al. A miR-208-Mef2 axis drives the decompensation of right ventricular function in pulmonary hypertension. Circulation Research. 116 (1), 56-69 (2015).
- Sutendra, G., et al. A metabolic remodeling in right ventricular hypertrophy is associated with decreased angiogenesis and a transition from a compensated to a decompensated state in pulmonary hypertension. Journal of Molecular Medicine. 91 (11), 1315-1327 (2013).
- Balestra, G. M., et al. Increased in vivo mitochondrial oxygenation with right ventricular failure induced by pulmonary arterial hypertension: Mitochondrial inhibition as driver of cardiac failure. Respiratory Research. 16, 6 (2015).
- Piao, L., et al. The inhibition of pyruvate dehydrogenase kinase improves impaired cardiac function and electrical remodeling in two models of right ventricular hypertrophy: Resuscitating the hibernating right ventricle. Journal of Molecular Medicine. 88 (1), 47-60 (2010).
- Piao, L., et al. FOXO1-mediated upregulation of pyruvate dehydrogenase kinase-4 (PDK4) decreases glucose oxidation and impairs right ventricular function in pulmonary hypertension: therapeutic benefits of dichloroacetate. Journal of Molecular Medicine. 91, 333-346 (2013).
- Sheikh, A. M., et al. Right ventricular hypertrophy with early dysfunction: A proteomics study in a neonatal model. Journal of Thoracic and Cardiovascular Surgery. 137 (5), 1146-1153 (2009).
- Olivetti, G., et al. Cellular basis of wall remodeling in long-term pressure overload-induced right ventricular hypertrophy in rats. Circulation Research. 63 (3), 648-657 (1988).
- Lauva, I. K., et al. Control of myocardial tissue components and cardiocyte organelles in pressure-overload hypertrophy of the cat right ventricle. The American Journal of Anatomy. 177 (1), 71-80 (1986).
- Fang, Y. H., et al. Therapeutic inhibition of fatty acid oxidation in right ventricular hypertrophy: Exploiting Randle's cycle. Journal of Molecular Medicine. 90 (1), 31-43 (2012).
- Piao, L., et al. Cardiac glutaminolysis: A maladaptive cancer metabolism pathway in the right ventricle in pulmonary hypertension. Journal of Molecular Medicine. 91 (10), 1185-1197 (2013).
- Sack, M. N., Disch, D. L., Rockman, H. A., Kelly, D. P. A role for Sp and nuclear receptor transcription factors in a cardiac hypertrophic growth program. Proceedings of the National Academy of Sciences of the United States of America. 94 (12), 6438-6443 (1997).
- Broderick, T. L., King, T. M. Upregulation of GLUT-4 in right ventricle of rats with monocrotaline- induced pulmonary hypertension. Medical Science Monitor. 14 (12), 261-264 (2008).
- Enache, I., et al. Skeletal muscle mitochondrial dysfunction precedes right ventricular impairment in experimental pulmonary hypertension. Molecular and Cellular Biochemistry. 373 (1-2), 161-170 (2013).
- Sun, X. Q., et al. Reversal of right ventricular remodeling by dichloroacetate is related to inhibition of mitochondria-dependent apoptosis. Hypertension Research. 39 (5), 302-311 (2016).
- Adrogue, J. V., Sharma, S., Ngumbela, K., Essop, M. F., Taegtmeyer, H. Acclimatization to chronic hypobaric hypoxia is associated with a differential transcriptional profile between the right and left ventricle. Molecular and Cellular Biochemistry. 278 (1-2), 71-78 (2005).
- Sharma, S., et al. Dynamic changes of gene expression in hypoxia-induced right ventricular hypertrophy. American Journal of Physiology - Heart and Circulatory Physiology. 286 (3), 1185-1192 (2004).
- Nouette-Gaulain, K., et al. Time course of differential mitochondrial energy metabolism adaptation to chronic hypoxia in right and left ventricles. Cardiovascular Research. 66 (1), 132-140 (2005).
- Graham, B. B., et al. Severe pulmonary hypertension is associated with altered right ventricle metabolic substrate uptake. American Journal of Physiology - Lung Cellular and Molecular Physiology. 309 (5), 435-440 (2015).
- Liu, A., et al. Estrogen maintains mitochondrial content and function in the right ventricle of rats with pulmonary hypertension. Physiological Reports. 5 (6), 1-12 (2017).
- Kobr, J., et al. Right Ventricular Pressure Overload and Pathophysiology of Growing Porcine Biomodel. Pediatric Cardiology. 37 (8), 1498-1506 (2016).
- Yerebakan, C., et al. Acute and chronic response of the right ventricle to surgically induced pressure and volume overload - an analysis of pressure-volume relations. Interactive CardioVascular and Thoracic Surgery. 10 (4), 519-525 (2010).
- Gufler, H., et al. Right Ventricular Function After Pulmonary Artery Banding: Adaptive Processes Assessed by CMR and Conductance Catheter Measurements in Sheep. Journal of Cardiovascular Translational Research. 12 (5), 459-466 (2019).
- Baicu, C. F., et al. Time course of right ventricular pressure-overload induced myocardial fibrosis: relationship to changes in fibroblast postsynthetic procollagen processing. American Journal of Physiology-Heart and Circulatory Physiology. 303 (9), 1128-1134 (2012).
- Manohar, M., et al. Regional myocardial blood flow and coronary vascular reserve in unanesthetized young calves exposed to a simulated altitude of 3500 m for 8-10 weeks. Circulation Research. 50 (5), 714-726 (1982).
- Fávaro, G. A. G., et al. Reversible pulmonary trunk banding: VII. Stress echocardiographic assessment of rapid ventricular hypertrophy in young goats. Journal of Thoracic and Cardiovascular Surgery. 145 (5), 1345-1351 (2013).
- Nielsen, E. A., et al. Regional septal hinge-point injury contributes to adverse biventricular interactions in pulmonary hypertension. Physiological Reports. 5 (14), 1-13 (2017).
- Borgdorff, M. A., et al. Sildenafil enhances systolic adaptation, but does not prevent diastolic dysfunction, in the pressure-loaded right ventricle. European Journal of Heart Failure. 14 (9), 1067-1074 (2012).
- Gold, H., Prindle, K., Levey, G., Epstein, S. Effects of experimental heart failure on the capacity of glucagon to augment myocardial contractility and activate adenyl cyclase. The Journal of Clinical Investigation. 49 (5), 999-1006 (1970).
- Brittain, E. L., et al. Right ventricular plasticity and functional imaging. Pulmonary Circulation. 2 (3), 309-326 (2012).
- Jiang, L., et al. Three-dimensional Echocardiography In Vivo Validation for Right Ventricular Volume and Function. Circulation. 89, 2342-2350 (1994).
- Markiewicz, W., Sechtem, U., Higgins, C. B. Evaluation of the right ventricle by magnetic resonance imaging. American Heart Journal. 113 (1), 8-15 (1987).
- Pattynama, P. M. T., et al. Reproducibility of MRI-derived measurements of right ventricular volumes and myocardial mass. Magnetic Resonance Imaging. 13 (1), 53-63 (1995).
- Wiesmann, F., et al. Comparison of fast spiral, echo planar, and fast low-angle shot MRI for cardiac volumetry at .5T. Journal of Magnetic Resonance Imaging. 8 (5), 1033-1039 (1998).
- Van der Feen, D. E., et al. Multicenter Preclinical Validation of BET Inhibition for the Treatment of Pulmonary Arterial Hypertension. American Journal of Respiratory and Critical Care Medicine. 200 (7), 910-920 (2019).
- da Costa Martins, P. A., et al. MicroRNA-199b targets the nuclear kinase Dyrk1a in an auto-amplification loop promoting calcineurin/NFAT signalling. Nature Cell Biology. 12 (12), 1220-1227 (2010).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. Journal of Visualized Experiments. (84), e51041 (2014).
- Schulz-Menger, J., et al. Standardized image interpretation and post processing in cardiovascular magnetic resonance: Society for Cardiovascular Magnetic Resonance (SCMR) Board of Trustees Task Force on Standardized Post Processing. Journal of Cardiovascular Magnetic Resonance. 15 (1), 1-19 (2013).
- Hagdorn, Q. A. J., et al. A novel method optimizing the normalization of cardiac parameters in small animal models: The importance of dimensional indexing. American Journal of Physiology - Heart and Circulatory Physiology. 316 (6), 1552-1557 (2019).
- Scherrer-Crosbie, M., et al. Determination of Right Ventricular Structure and Function in Normoxic and Hypoxic Mice. Circulation. 98 (10), 1015-1021 (2012).
- Wiesmann, F., et al. Analysis of right ventricular function in healthy mice and a murine model of heart failure by in vivo MRI. American Journal of Physiology-Heart and Circulatory Physiology. 283 (3), 1065-1071 (2002).
- Lu, X., et al. Accuracy and Reproducibility of Real-Time Three-Dimensional Echocardiography for Assessment of Right Ventricular Volumes and Ejection Fraction in Children. Journal of the American Society of Echocardiography. 21 (1), 84-89 (2008).
- Soriano, B. D., et al. Matrix-array 3-dimensional echocardiographic assessment of volumes, mass, and ejection fraction in young pediatric patients with a functional single ventricle: A comparison study with cardiac magnetic resonance. Circulation. 117 (14), 1842-1848 (2008).
- Damy, T., et al. Prevalence of, associations with, and prognostic value of tricuspid annular plane systolic excursion (TAPSE) among out-patients referred for the evaluation of heart failure. Journal of Cardiac Failure. 18 (3), 216-225 (2012).
- Kowalik, E., Kowalski, M., Rózański, J., Kuśmierczyk, M., Hoffman, P. The impact of pulmonary regurgitation on right ventricular regional myocardial function: An echocardiographic study in adults after total repair of tetralogy of fallot. Journal of the American Society of Echocardiography. 24 (11), 1199-1204 (2011).
- Koestenberger, M., et al. Systolic right ventricular function in pediatric and adolescent patients with tetralogy of Fallot: Echocardiography versus magnetic resonance imaging. Journal of the American Society of Echocardiography. 24 (1), 45-52 (2011).
- Bovens, S. M., et al. Evaluation of infarcted murine heart function: Comparison of prospectively triggered with self-gated MRI. NMR in Biomedicine. 24 (3), 307-315 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon