需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
通过心脏磁共振成像定量肺动脉束带小鼠的双心室功能和形态
* 这些作者具有相同的贡献
摘要
为了了解右心室 (RV) 对异常负荷的适应的病理生理学,实验模型至关重要。然而,RV 尺寸和功能的评估是复杂且具有挑战性的。该协议提供了一种在承受 RV 压力负荷的小鼠中执行心脏磁共振成像 (CMR) 作为无创基准程序的方法。
摘要
右心室 (RV) 功能和衰竭是获得性和先天性心脏病(包括肺动脉高压)结局的主要决定因素。RV 功能和形态的评估很复杂,部分原因是 RV 的形状复杂。目前,心脏磁共振 (CMR) 成像是 RV 功能和形态无创评估的黄金标准。目前的方案描述了肺动脉束带 (PAB) 诱导的 RV 压力负荷小鼠模型中的 CMR 成像。PAB 是通过在 6 G 针头上围绕肺动脉放置 0-23 缝合线来进行的。在 2 周和 6 周时使用超声心动图确定 PAB 梯度。6 周时,通过使用配备 1,500 mT/m 梯度的 9.4 T 磁共振成像扫描仪测量 10 至 11 个 1 mm 厚的电影切片的收缩末期和舒张末期体积和质量来评估右心室和功能。代表性结果表明,PAB 诱导 RV 压力负荷显着增加,对双心室形态和 RV 功能有显着影响。研究还表明,在 RV 压力负荷 6 周时,心输出量得以维持。这里介绍的是一种可重复的方案,用于量化 RV 压力负荷小鼠模型中的双心室形态和功能,可作为探索 RV 重塑和功能障碍决定因素的实验方法。
引言
患有获得性和先天性心血管疾病(包括肺动脉高压 (PH))的患者有右心室 (RV) 功能障碍和衰竭的风险1。由于压力负荷增加而导致的 RV 适应特征为早期向心肥大,终末期疾病进行性扩张。此外,它与新陈代谢和细胞外基质紊乱、炎症过程以及最终的 RV 衰竭有关 2,3,4,5,6。已经开发了动物模型来探索 RV 衰竭进展的潜在过程。然而,模型的优化以及对 RV 功能和尺寸的充分评估一直具有挑战性。对于 RV 功能和尺寸的无创评估,心脏磁共振 (CMR) 成像是金标准。这种技术通过使用强磁场和射频波来创建跳动心脏的图像。CMR 可用于人类以及实验室啮齿动物等动物。由于心脏的尺寸较小,后者需要更高的空间分辨率,因此与人类相比,提供足够图像所需的磁场必须更高。
有多种模拟 RV 压力过载的模型可供选择,包括 PH7、8、9、10、11、12、13、14、15、16、17 模型和近端 RV 压力负荷模型2、3、10、18, 19,20,21,22,23。PH 模型或近端 RV 压力负荷模型的选择取决于研究问题:干预对肺血管系统的影响,因此可能是 RV 后负荷调节(即 PH 模型),或对 RV 的直接影响(即近端 RV 压力负荷模型)。有几种实验性诱导 PH 的方法可用,包括使用野百合碱 (MCT)12、13、14、16、22、24、25、26、MCT 联合主动脉腔静脉分流9、慢性缺氧7、27、28、29,以及血管内皮生长因子受体拮抗剂 Sugen 5416 与慢性缺氧 8,10,30,31 的组合。此类模型代表近端 RV 压力负荷的进行性肺部模型,不针对肺血管系统,而是通过肺动脉收缩诱导恒定的后负荷,伴随着 RV 后负荷的增加 2,3。这可以通过缝合带(肺动脉束带,PAB)或围绕肺动脉的血管夹来完成。PAB 已在多种动物物种中进行,并且以各种方式研究了心脏尺寸和功能,例如组织学、经胸超声心动图(包括斑点追踪)和心导管插入术 2,32,33,34,35,36,37,38,39,40 .小型啮齿动物(如小鼠)的 PAB 具有挑战性。这是因为动脉收缩紧密度之间的细微差异对 RV 压力负荷的程度以及随后的功能状态和生存率产生了显着结果。当收缩非常紧密时,动物会在手术期间或手术后不久死亡,而当收缩不够紧时,将无法达到所需的表型。然而,与其他动物相比,使用小鼠具有优势,因为具有出色的基因修饰可能性(即转基因或敲除模型)和快速繁殖。这对于疾病研究和探索分子和 (epi-) 遗传因素的贡献具有附加价值。
动物研究设计正在转向研究疾病期间的时间变化 2,3,8,13,21。对于此类检查,无创方式是必要的,因为可以进行连续评估。在评估心脏重塑时,CMR 的替代方案可以是 (1) 使用组织病理学进行组织表征,在不同时间点处死多只动物,(2) 通过压力-体积分析进行侵入性功能评估,或 (3) 超声心动图,它允许研究人员连续无创地识别同一动物内的心脏肥大或扩张。CMR 在评估 RV 方面有两个主要优势:(1) CMR 是一种无创方式,可以在一只动物中进行连续测量,从而有助于减少研究所需的动物数量,以及 (2) CMR 不依赖于特定的几何形状,而是三维可视化。CMR 衍生的 RV 体积和功能测量已被证明是准确的,并且被认为是人类不同心脏实体的无创金标准 42,43,44,45,但尚未转化为 RV 压力超负荷小鼠的 CMR 方案。
文献中描述了许多 PAB 模型,但在评估血流动力学效应和 RV 功能和适应的方法上具有高度异质性。该方案概述了小鼠 PAB 的程序,并通过超声心动图测量 PAB 梯度并使用 CMR 评估心脏尺寸和功能来验证模型。虽然已经发表了大鼠对 PAB 的动物进行 CMR 的方案,但直到现在还没有对小鼠描述这种组合。而大鼠最常用于 PH 模型8、12、13、14、15、16、22、24、25、26、27、28、29、30、31、46,小鼠最常用于转基因或敲除研究,从而有助于我们了解负荷性 RV 失败的机制。该协议可以构成未来研究的基础,以揭示参与向 RV 失败过渡的信号通路。
研究方案
所有实验和动物护理均根据荷兰动物实验法进行,并符合美国国立卫生研究院出版的实验动物护理和使用指南。荷兰格罗宁根大学动物实验委员会批准了当前的实验方案(许可证号:2014-041/3005)。
1. 住房和适应环境
- 使用 20-30 g 野生型 C57 黑色 6 (C57BL/6) 小鼠(之前描述的机构育种系47),雄性和雌性,均超过 8 周龄。将小鼠分组饲养,每个笼子最多五只。为了习惯人类的处理,让老鼠适应至少 7 天。在此期间,请勿执行任何程序。
2. 肺动脉束带手术
- 制备
- 将鼠标置于充满 5% 异氟醚/100% 氧气的诱导室中。通过给予疼痛刺激(即捏住脚趾)来检查是否缺乏反射。
- 使用电动剃须刀剃除鼠标的左半胸。
- 轻轻拉出舌头,轻轻拉紧握住。
- 通过在声门水平的外喉上放置光源来照亮内喉。
- 用 20 G 柔性套管在气管内插管小鼠。
- 将动物右侧放在加热垫上(温度设置为 37 °C)。
- 将套管连接到微型呼吸机,并以 1.5%–2.5% 的异氟醚/氧气(180 次呼吸/分钟,潮气 250 μL)开始通气。
- 皮下注射 0.1 mg/kg 丁丙诺啡用于术后镇痛。
- 使用眼膏防止眼睛脱水。
- 左侧开胸术的肺动脉束带手术
- 将右前腿置于中立位置,伸展右后腿,左前腿向后弯曲,将鼠标放在右侧。
- 用氯己定消毒胸部皮肤,拭子 2 次。
- 使用无菌器械进行手术。用小剪刀(圆柄,12 毫米刀片)从平行于第二和第三肋骨的左腋窝打开皮肤。
- 识别 M. pectoralis superficialis (斜肌,浅表肌) 和 M. pectoralis prodeepus (斜肌,底层肌肉)。
- 使用缝合环,将 M. pectoralis 浅表肌拉向小鼠的腹侧,将 M. pectoralis prodeepus 拉向小鼠的背侧。
- 打开第二个肋间隙,使用合适的回形针展开肋骨,让左心耳、左肺和肺动脉可见。
- 将肺动脉与主动脉分开。用包含 25-0 缝合线的 25 G 钝针在肺动脉周围放置一个缝合环,并在肺动脉周围放置一个丢失的 2-1-1 结扎线。
- 在 6-0 缝合线内放置一根平行于肺动脉的 23 G 针,首先固定 2-1-1 缝合线的最近端缝合结,然后固定远端缝合结。拔下 23 G 针头。确保结足够。
- 用单丝聚丙烯 5-0 缝合线用两条或三条单独的缝合线闭合胸部。释放 M. pectoralis superficalis 和 M. pectoralis prodeepus。
- 用纯聚乙醇酸 5-0 缝合线缝合皮肤。使用连续缝合技术以尽量减少组织中瘢痕的形成;瘢痕组织会影响超声心动图的图像质量。
- 在麻醉恢复期间,关闭异氟醚,同时继续用氧气通气,直到小鼠恢复自身的自主呼吸,从腹部运动中可以观察到。
- 将气管插管与呼吸机解耦。检查有无自主呼吸,只有在可见自主呼吸活动时才拔管。当看不到自主呼吸时,再次将管子连接到呼吸机,然后返回步骤 2.2.12。
- 观察鼠标,直到它恢复意识。
- 假手术
- 执行上述过程,但条带除外(步骤 2.2.2–2.2.6)。
- 术后
- 将小鼠单独置于培养箱 (37 °C) 中 24 小时。
- 在术后前 3 天每天观察小鼠。如果出现任何不适迹象,每天 2 次皮下注射 0.1 mg/kg 丁丙诺啡用于术后镇痛。
3. 超声心动图
- 制备
- PAB 手术后 14 天通过超声心动图进行 PAB 梯度分析。
- 启动超声心动图设备。选择心脏套件和 14.0 MHz 换能器。
- 麻醉
- 将鼠标放入装有 5% 异氟醚和 100% 氧气混合物的诱导室中。
- 剃掉鼠标的胸部。
- 将鼠标仰卧在加热垫上(温度 37 °C),然后将鼻子放入通气面罩中。
- 用 1.5%–2.5% 异氟醚和 100% 氧气 (0.15 L/min) 和室内空气 (0.3 L/min) 的混合物通风。
- 通过执行脚趾捏检查麻醉深度并相应地调整麻醉。
- 使用眼药膏防止眼睛脱水。
- 超声心动图测定 PAB 梯度
- 在每条前腿上贴上儿科心电图贴纸,在两条后腿上贴上一张。使用贴纸固定动物。
- 将超声凝胶涂抹在小鼠胸部的剃光部分。
- 为了获得肺动脉的图像,可以使用两种视图:胸骨旁长轴 (PLAX) 或胸骨旁短轴 (PSAX) 视图。同时获取两者,并使用可提供最佳质量测量值和最高分析速度的视图。
- 获取 PLAX 和 PSAX 视图。
- 按下 彩色多普勒按钮 以可视化血流。
- 将超声探头与胸骨旁线成 30° 角放置以获得 PLAX(详细说明参见 Cheng 等人 48),可视化升主动脉。
- 将探头向左轻轻扫动,使升主动脉消失在肺动脉后面。当看到肺动脉,血液垂直流动时,即可确定合适的 PLAX。
- 将光标与肺动脉对齐。按下 连续波 (CW) 多普勒按钮 ,得出三个心动周期期间的速度时间积分测量值。按 Save 键。
- 将探头从 PLAX 顺时针旋转 90° 以获得 PSAX,然后将探头略微向颅/腹方向倾斜以获得主动脉水平的 PSAX。如果 RV 流出道位于主动脉和探头之间,则确定适当的 PSAX 视图。这在肺动脉中持续,血液垂直流动。有关详细说明,请参见 Cheng et al.48
- 将光标与肺动脉对齐。按下 连续波 (CW) 多普勒按钮 ,得出三个心动周期期间的速度时间积分测量值。按 Save 键。
- 测量最佳视图的三个最大速度(PSAX 或 PLAX)并计算平均值。使用简化的伯努利原理得出以毫米汞柱 (mmHg) 为单位的 PAB 梯度。
4. 心脏磁共振成像
- 制备
- 在 PAB 手术后 6 周(即 42 天)进行 CMR 分析。
注意:此外,当要包括多个时间点时,可以选择 PAB 手术后的早期时间点,具体取决于研究问题。可以考虑更晚的时间点;然而,RV 衰竭和死亡的发生率可能越来越高。 - 使用足够强大的磁铁(通常,>7 T 用于啮齿动物 CMR 扫描)。对于当前的协议,使用了一个 9.4 T 垂直系统,梯度设置为 1,500 mT/m,孔径为 89 mm。
- 安装 CMR 后处理软件以分析衍生图像中的体积和质量。如果该软件允许手动分割以确定舒张末期 (ED) 和收缩末期 (ES) 体积(分别为 EDV 和 ESV)和心室质量(测量 ED 和 ES),则认为该软件是合适的。
- 在 PAB 手术后 6 周(即 42 天)进行 CMR 分析。
- 麻醉和固定
- 将鼠标放入装有 5% 异氟醚和 100% 氧气混合物的诱导室中。通过捏住脚趾来刺激疼痛,以验证麻醉效果。
- 将眼药膏涂在鼠标的眼睛上,以便在扫描过程中保持眼睛湿润。
- 将鼠标放在扫描仪的动物床上,该动物床带有集成气源、1.5%–2.5% 异氟醚、100% 氧气 (0.15 L/min) 和室内空气 (0.3 L/min) 的加热 (37 °C) 混合物,以及一个压力垫,可以在扫描过程中观察心率(目标是 400-500 次/分钟)和呼吸频率(目标是每分钟 ~35 次呼吸)。根据这两个参数调节麻醉。确保床由塑料制成,没有任何磁性材料。
- 将带有鼠标的动物床放入扫描仪中。
- 进行心脏磁共振成像
- 通过在 1 氢 (1 H) 谐振频率上调谐射频 (RF) 鸟笼线圈来进行采集前调整。
- 然后使用自动匀场程序将磁场设置得尽可能均匀。
注意:计算机化匀场是通过所谓的 Tuning 方法完成的,该方法使用 1 H FID 下的区域作为质量参数。在此 Tuning 过程中,将以迭代周期检查用户定义的填充程序组(Z、Z2、X、Y、XZ 和 YZ)。每个连续的垫片都单独调整,以最大化 FID 下的面积。这本质上是一个线性过程,可以快速运行。 - 通过调整 RF 脉冲功率来最大化一维图像配置文件,从而优化 RF 脉冲。
- 通过使用 tripilot 序列进行侦察扫描,分配心脏在扫描仪中的确切位置。使用快速梯度回波序列通过胸部获取侦察图像:横向、冠状和矢状切片。(图 1A、B、C)
- 将轴调整到轴向、两腔和四腔视图的实际轴(图 1D,E)。
- 随后,将电影切片垂直于 RV 流出道和 RV 最顶端部分之间的假想轴定位。
- 通过自门控 IntraGate 快速低角度拍摄 (FLASH) 方法,得出 10 到 11 个 1 毫米厚的电影切片,没有切片间隙,以覆盖 RV 的整个从上到下的成像(图 1F),该方法消除了对心电图 (ECG) 和呼吸门控的需求。采集参数如 表 1 所示。以 DICOM 格式保存图像。
- 对采集的图像执行分析
- 双击软件打开程序。
- 使用 导入 按钮在 CMR 后处理软件中打开图像。
- 确定收缩末期(定义为视觉上 RV 腔最小的阶段)和舒张末期(定义为视觉上 RV 腔最大的阶段)。
- 根据心血管磁共振学会49 的指南,通过在每张图像的心外膜边界标记几个点,从心尖到底部手动绘制舒张末期和收缩末期的心外膜轮廓。在最后一个点,双击以完成心外膜轮廓。
- 对心内膜轮廓执行相同作。(图 2)。左心室和右心室 EDV、ESV、ED 质量和 ES 质量现在由软件自动计算。
注:质量定义为心肌体积乘以心肌密度(即 1.05)。 - 根据研究问题和研究人群,根据先前发布的公式50,通过胫骨长度或体重为受试者大小索引这些变量。
- 通过将平行于室内隔膜 (IVS) 的 LV 腔的直径除以垂直于 IVS 的 LV 腔的直径,计算舒张末期和收缩末期的偏心率指数 (EI),该直径来自中部水平的短轴。
- 软件将以 mL 为单位的每搏输出量 (SV) 计算为 ,将射血分数 (EF, %) 计算
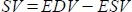 为
为 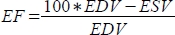 。
。 - 以 ml/min 为单位计算心输出量 (CO),公式为
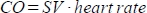 。如上所述,心率是通过嵌入动物床中的压力垫手动测量的,因为扫描仪无法充分记录高频率心率。
。如上所述,心率是通过嵌入动物床中的压力垫手动测量的,因为扫描仪无法充分记录高频率心率。 - 根据研究问题和所研究的人群,根据先前发布的公式50,通过胫骨长度或体重为受试者大小的 CO 和 SV 编制索引。
5. 统计分析
- 打开用于数据可视化和统计分析的软件。
- 对每个组(PAB 和假)的数据进行排序,每个组位于单独的列中。
- 使用 Mann-Whitney 检验比较每个变量的 PAB 与 sham。
结果
PAB 外科手术的死亡率约为 10%。呈现的结果显示了假 (n = 5) 和 PAB (n = 8) 组中小鼠的特征。如图 3 所示,与 PAB 后 2 周和 6 周的假动物相比,PAB 梯度值显着增加。负荷的增加导致 RV 扩张,表现为 RV、EDV 和 RV ESV 增加(图 4A、B)。随着 RV EF 的降低,会出现 RV 功能障碍(图 4C)。RV SV 不受?...
讨论
该方案为小鼠中的 PAB 提供了一种可重复的方法,并随后使用 CMR 评估心脏重塑和功能适应。
PAB 与其他增加 RV 压力负荷的模型不同,因为它涉及后负荷的绝对和静态增加,而不存在其他触发器。缺氧、野百合碱、分流或这些诱导剂的组合模型中的 RV 压力负荷基于肺血管系统的重塑。这种重塑是由内皮损伤、炎症、细胞因子迁移和血管收缩驱动的。这...
披露声明
格罗宁根大学医学中心已与 Actelion 和 Lilly 签订合同,为本手稿内容之外的 R.M.F. Berger 提供咨询活动。其他作者声明他们没有利益冲突。
致谢
我们要感谢 P. Da Costa-Martins 对本研究中动物实验的支持。
材料
| Name | Company | Catalog Number | Comments |
| 14.0 MHz i13L-echocardiography transducer | GE Healthcare, Waukesha, WI, USA | ||
| 20G cannula | |||
| 23G needle | |||
| 9.4T magnetic resonance scanner with 1,500 mT/m gradient set | Bruker BioSpin, Ellingen, Germany | ||
| Anesthesia induction chamber | |||
| Blunt 25G needle | |||
| Buprenorphine | |||
| Chloride-hexidine | |||
| CMR post-processing software | Medis Medical Imaging Systems, Leiden, The Netherlands | Qmass version 7.6 | |
| Data visualisation and statistical software | GraphPad Prism Inc, La Jolla, CA, USA | software version 7.02 | |
| Echocardiography machine | GE Healthcare, Waukesha, WI, USA | Vivid Dimension 7 | |
| Eye ointment | |||
| Heat mat | |||
| Incubator (37°C) | |||
| Isoflurane | |||
| Isoflurane evaporator | |||
| Miniventilator for rodents | Hugo Sachs | model 687 | |
| monofilament polypropylene 5-0 sutures | |||
| monofilament polypropylene 6-0 sutures | |||
| Needle and syringe for subcutaneous injections | |||
| Pediatric electrocardiogram-stickers | |||
| pure polyglycolic acid 5-0 sutures | |||
| Sterile surgical instruments | |||
| Ventilation mask |
参考文献
- Norozi, K., et al. Incidence and Risk Distribution of Heart Failure in Adolescents and Adults With Congenital Heart Disease After Cardiac Surgery. The American Journal of Cardiology. 97 (8), 1238-1243 (2006).
- Borgdorff, M. A. J., et al. Clinical symptoms of right ventricular failure in experimental chronic pressure load are associated with progressive diastolic dysfunction. Journal of Molecular and Cellular Cardiology. 79, 244-253 (2015).
- Koop, A. M. C., et al. Right ventricular pressure overload alters cardiac lipid composition. International Journal of Cardiology. , (2019).
- Faber, M. J., et al. Right and left ventricular function after chronic pulmonary artery banding in rats assessed with biventricular pressure-volume loops. American Journal of Physiology and Heart Circirculation Physiology. 291 (4), 1580-1586 (2006).
- Bogaard, H. J., et al. Chronic pulmonary artery pressure elevation is insufficient to explain right heart failure. Circulation. 120 (20), 1951-1960 (2009).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulmonary Circulation. 7 (3), 572-587 (2017).
- Rumsey, W. L., et al. Adaptation to hypoxia alters energy metabolism in rat heart. American Journal of Physiology Heart and Circulatory Physiology. 276 (1), 71-80 (1999).
- Drozd, K., et al. Effects of an endothelin receptor antagonist, Macitentan, on right ventricular substrate utilization and function in a Sugen 5416/hypoxia rat model of severe pulmonary arterial hypertension. Journal of Nuclear Cardiology. 24 (6), 1979-1989 (2017).
- Van Der Feen, D. E., et al. Shunt surgery, right heart catheterization, and vascular morphometry in a rat model for flow-induced pulmonary arterial hypertension. Journal of Visualized Experiments. (120), e55065 (2017).
- Gomez-Arroyo, J., et al. Metabolic gene remodeling and mitochondrial dysfunction in failing right ventricular hypertrophy secondary to pulmonary arterial hypertension. Circulation: Heart Failure. 6 (1), 136-144 (2013).
- Bruns, D. R., Dale Brown, R., Stenmark, K. R., Buttrick, P. M., Walker, L. A. Mitochondrial integrity in a neonatal bovine model of right ventricular dysfunction. American Journal of Physiology - Lung Cellular and Molecular Physiology. 308 (2), 158-167 (2015).
- Zhang, W. H., et al. Up-regulation of hexokinase1 in the right ventricle of monocrotaline induced pulmonary hypertension. Respiratory Research. 15 (1), 119 (2014).
- Paulin, R., et al. A miR-208-Mef2 axis drives the decompensation of right ventricular function in pulmonary hypertension. Circulation Research. 116 (1), 56-69 (2015).
- Sutendra, G., et al. A metabolic remodeling in right ventricular hypertrophy is associated with decreased angiogenesis and a transition from a compensated to a decompensated state in pulmonary hypertension. Journal of Molecular Medicine. 91 (11), 1315-1327 (2013).
- Balestra, G. M., et al. Increased in vivo mitochondrial oxygenation with right ventricular failure induced by pulmonary arterial hypertension: Mitochondrial inhibition as driver of cardiac failure. Respiratory Research. 16, 6 (2015).
- Piao, L., et al. The inhibition of pyruvate dehydrogenase kinase improves impaired cardiac function and electrical remodeling in two models of right ventricular hypertrophy: Resuscitating the hibernating right ventricle. Journal of Molecular Medicine. 88 (1), 47-60 (2010).
- Piao, L., et al. FOXO1-mediated upregulation of pyruvate dehydrogenase kinase-4 (PDK4) decreases glucose oxidation and impairs right ventricular function in pulmonary hypertension: therapeutic benefits of dichloroacetate. Journal of Molecular Medicine. 91, 333-346 (2013).
- Sheikh, A. M., et al. Right ventricular hypertrophy with early dysfunction: A proteomics study in a neonatal model. Journal of Thoracic and Cardiovascular Surgery. 137 (5), 1146-1153 (2009).
- Olivetti, G., et al. Cellular basis of wall remodeling in long-term pressure overload-induced right ventricular hypertrophy in rats. Circulation Research. 63 (3), 648-657 (1988).
- Lauva, I. K., et al. Control of myocardial tissue components and cardiocyte organelles in pressure-overload hypertrophy of the cat right ventricle. The American Journal of Anatomy. 177 (1), 71-80 (1986).
- Fang, Y. H., et al. Therapeutic inhibition of fatty acid oxidation in right ventricular hypertrophy: Exploiting Randle's cycle. Journal of Molecular Medicine. 90 (1), 31-43 (2012).
- Piao, L., et al. Cardiac glutaminolysis: A maladaptive cancer metabolism pathway in the right ventricle in pulmonary hypertension. Journal of Molecular Medicine. 91 (10), 1185-1197 (2013).
- Sack, M. N., Disch, D. L., Rockman, H. A., Kelly, D. P. A role for Sp and nuclear receptor transcription factors in a cardiac hypertrophic growth program. Proceedings of the National Academy of Sciences of the United States of America. 94 (12), 6438-6443 (1997).
- Broderick, T. L., King, T. M. Upregulation of GLUT-4 in right ventricle of rats with monocrotaline- induced pulmonary hypertension. Medical Science Monitor. 14 (12), 261-264 (2008).
- Enache, I., et al. Skeletal muscle mitochondrial dysfunction precedes right ventricular impairment in experimental pulmonary hypertension. Molecular and Cellular Biochemistry. 373 (1-2), 161-170 (2013).
- Sun, X. Q., et al. Reversal of right ventricular remodeling by dichloroacetate is related to inhibition of mitochondria-dependent apoptosis. Hypertension Research. 39 (5), 302-311 (2016).
- Adrogue, J. V., Sharma, S., Ngumbela, K., Essop, M. F., Taegtmeyer, H. Acclimatization to chronic hypobaric hypoxia is associated with a differential transcriptional profile between the right and left ventricle. Molecular and Cellular Biochemistry. 278 (1-2), 71-78 (2005).
- Sharma, S., et al. Dynamic changes of gene expression in hypoxia-induced right ventricular hypertrophy. American Journal of Physiology - Heart and Circulatory Physiology. 286 (3), 1185-1192 (2004).
- Nouette-Gaulain, K., et al. Time course of differential mitochondrial energy metabolism adaptation to chronic hypoxia in right and left ventricles. Cardiovascular Research. 66 (1), 132-140 (2005).
- Graham, B. B., et al. Severe pulmonary hypertension is associated with altered right ventricle metabolic substrate uptake. American Journal of Physiology - Lung Cellular and Molecular Physiology. 309 (5), 435-440 (2015).
- Liu, A., et al. Estrogen maintains mitochondrial content and function in the right ventricle of rats with pulmonary hypertension. Physiological Reports. 5 (6), 1-12 (2017).
- Kobr, J., et al. Right Ventricular Pressure Overload and Pathophysiology of Growing Porcine Biomodel. Pediatric Cardiology. 37 (8), 1498-1506 (2016).
- Yerebakan, C., et al. Acute and chronic response of the right ventricle to surgically induced pressure and volume overload - an analysis of pressure-volume relations. Interactive CardioVascular and Thoracic Surgery. 10 (4), 519-525 (2010).
- Gufler, H., et al. Right Ventricular Function After Pulmonary Artery Banding: Adaptive Processes Assessed by CMR and Conductance Catheter Measurements in Sheep. Journal of Cardiovascular Translational Research. 12 (5), 459-466 (2019).
- Baicu, C. F., et al. Time course of right ventricular pressure-overload induced myocardial fibrosis: relationship to changes in fibroblast postsynthetic procollagen processing. American Journal of Physiology-Heart and Circulatory Physiology. 303 (9), 1128-1134 (2012).
- Manohar, M., et al. Regional myocardial blood flow and coronary vascular reserve in unanesthetized young calves exposed to a simulated altitude of 3500 m for 8-10 weeks. Circulation Research. 50 (5), 714-726 (1982).
- Fávaro, G. A. G., et al. Reversible pulmonary trunk banding: VII. Stress echocardiographic assessment of rapid ventricular hypertrophy in young goats. Journal of Thoracic and Cardiovascular Surgery. 145 (5), 1345-1351 (2013).
- Nielsen, E. A., et al. Regional septal hinge-point injury contributes to adverse biventricular interactions in pulmonary hypertension. Physiological Reports. 5 (14), 1-13 (2017).
- Borgdorff, M. A., et al. Sildenafil enhances systolic adaptation, but does not prevent diastolic dysfunction, in the pressure-loaded right ventricle. European Journal of Heart Failure. 14 (9), 1067-1074 (2012).
- Gold, H., Prindle, K., Levey, G., Epstein, S. Effects of experimental heart failure on the capacity of glucagon to augment myocardial contractility and activate adenyl cyclase. The Journal of Clinical Investigation. 49 (5), 999-1006 (1970).
- Brittain, E. L., et al. Right ventricular plasticity and functional imaging. Pulmonary Circulation. 2 (3), 309-326 (2012).
- Jiang, L., et al. Three-dimensional Echocardiography In Vivo Validation for Right Ventricular Volume and Function. Circulation. 89, 2342-2350 (1994).
- Markiewicz, W., Sechtem, U., Higgins, C. B. Evaluation of the right ventricle by magnetic resonance imaging. American Heart Journal. 113 (1), 8-15 (1987).
- Pattynama, P. M. T., et al. Reproducibility of MRI-derived measurements of right ventricular volumes and myocardial mass. Magnetic Resonance Imaging. 13 (1), 53-63 (1995).
- Wiesmann, F., et al. Comparison of fast spiral, echo planar, and fast low-angle shot MRI for cardiac volumetry at .5T. Journal of Magnetic Resonance Imaging. 8 (5), 1033-1039 (1998).
- Van der Feen, D. E., et al. Multicenter Preclinical Validation of BET Inhibition for the Treatment of Pulmonary Arterial Hypertension. American Journal of Respiratory and Critical Care Medicine. 200 (7), 910-920 (2019).
- da Costa Martins, P. A., et al. MicroRNA-199b targets the nuclear kinase Dyrk1a in an auto-amplification loop promoting calcineurin/NFAT signalling. Nature Cell Biology. 12 (12), 1220-1227 (2010).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. Journal of Visualized Experiments. (84), e51041 (2014).
- Schulz-Menger, J., et al. Standardized image interpretation and post processing in cardiovascular magnetic resonance: Society for Cardiovascular Magnetic Resonance (SCMR) Board of Trustees Task Force on Standardized Post Processing. Journal of Cardiovascular Magnetic Resonance. 15 (1), 1-19 (2013).
- Hagdorn, Q. A. J., et al. A novel method optimizing the normalization of cardiac parameters in small animal models: The importance of dimensional indexing. American Journal of Physiology - Heart and Circulatory Physiology. 316 (6), 1552-1557 (2019).
- Scherrer-Crosbie, M., et al. Determination of Right Ventricular Structure and Function in Normoxic and Hypoxic Mice. Circulation. 98 (10), 1015-1021 (2012).
- Wiesmann, F., et al. Analysis of right ventricular function in healthy mice and a murine model of heart failure by in vivo MRI. American Journal of Physiology-Heart and Circulatory Physiology. 283 (3), 1065-1071 (2002).
- Lu, X., et al. Accuracy and Reproducibility of Real-Time Three-Dimensional Echocardiography for Assessment of Right Ventricular Volumes and Ejection Fraction in Children. Journal of the American Society of Echocardiography. 21 (1), 84-89 (2008).
- Soriano, B. D., et al. Matrix-array 3-dimensional echocardiographic assessment of volumes, mass, and ejection fraction in young pediatric patients with a functional single ventricle: A comparison study with cardiac magnetic resonance. Circulation. 117 (14), 1842-1848 (2008).
- Damy, T., et al. Prevalence of, associations with, and prognostic value of tricuspid annular plane systolic excursion (TAPSE) among out-patients referred for the evaluation of heart failure. Journal of Cardiac Failure. 18 (3), 216-225 (2012).
- Kowalik, E., Kowalski, M., Rózański, J., Kuśmierczyk, M., Hoffman, P. The impact of pulmonary regurgitation on right ventricular regional myocardial function: An echocardiographic study in adults after total repair of tetralogy of fallot. Journal of the American Society of Echocardiography. 24 (11), 1199-1204 (2011).
- Koestenberger, M., et al. Systolic right ventricular function in pediatric and adolescent patients with tetralogy of Fallot: Echocardiography versus magnetic resonance imaging. Journal of the American Society of Echocardiography. 24 (1), 45-52 (2011).
- Bovens, S. M., et al. Evaluation of infarcted murine heart function: Comparison of prospectively triggered with self-gated MRI. NMR in Biomedicine. 24 (3), 307-315 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。