É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Quantificação da Função e Morfologia Biventricular por Ressonância Magnética Cardíaca em Camundongos com Bandagem da Artéria Pulmonar
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Para entender a fisiopatologia da adaptação do ventrículo direito (VD) à carga anormal, modelos experimentais são cruciais. No entanto, a avaliação das dimensões e função do VD é complexa e desafiadora. Este protocolo fornece um método para realizar ressonância magnética cardíaca (RMC) como um procedimento de referência não invasivo em camundongos submetidos à carga de pressão do VD.
Resumo
A função e a insuficiência do ventrículo direito (VD) são os principais determinantes do desfecho em cardiopatias adquiridas e congênitas, incluindo hipertensão pulmonar. A avaliação da função e morfologia do VD é complexa, em parte devido à forma complexa do VD. Atualmente, a ressonância magnética cardíaca (RMC) é o padrão-ouro para avaliação não invasiva da função e morfologia do VD. O protocolo atual descreve a imagem de RMC em um modelo de camundongo de carga de pressão do VD induzida por bandagem da artéria pulmonar (PAB). A PAB é realizada colocando-se uma sutura 6-0 ao redor da artéria pulmonar sobre uma agulha 23 G. O gradiente de PAB é determinado por ecocardiografia em 2 e 6 semanas. Com 6 semanas, a morfologia e a função dos ventrículos direito e esquerdo são avaliadas medindo os volumes e a massa sistólica e diastólica final em dez a onze cortes de cine de 1 mm de espessura usando um scanner de ressonância magnética de 9,4 T equipado com um gradiente de 1.500 mT / m. Os resultados representativos mostram que a PAB induz um aumento significativo na carga pressórica do VD, com efeitos significativos na morfologia biventricular e na função do VD. Também é demonstrado que, em 6 semanas de carga pressórica do VD, o débito cardíaco é mantido. Apresenta-se aqui um protocolo reprodutível para a quantificação da morfologia e função biventricular em um modelo de camundongo de carga de pressão do VD e pode servir como método para experimentos que exploram determinantes do remodelamento e disfunção do VD.
Introdução
Pacientes com doenças cardiovasculares adquiridas e congênitas, incluindo hipertensão pulmonar (HP), apresentam risco de disfunção e insuficiência ventricular direita (VD)1. A adaptação do VD como resultado do aumento da carga pressórica é caracterizada por hipertrofia concêntrica nos estágios iniciais e dilatação progressiva na doença em estágio terminal. Além disso, está associada a distúrbios no metabolismo e na matriz extracelular, processos inflamatórios e, eventualmente, falha do VD 2,3,4,5,6. Modelos animais foram desenvolvidos para explorar os processos subjacentes da progressão para a falha do VD. No entanto, a otimização dos modelos e a avaliação adequada da função e dimensões do VD têm sido desafiadoras. Para avaliação não invasiva da função e dimensões do VD, a ressonância magnética cardíaca (RMC) é o padrão-ouro. Essa técnica cria imagens do coração batendo usando um forte campo magnético e ondas de radiofrequência. A RMC está disponível para humanos e para animais, como roedores de laboratório. Como estes últimos requerem maior resolução espacial devido ao menor tamanho do coração, o campo magnético necessário para fornecer imagens adequadas deve ser maior, em comparação com os humanos.
Vários modelos que imitam a sobrecarga de pressão do VD estão disponíveis, incluindo modelos de PH 7,8,9,10,11,12,13,14,15,16,17 e modelos de carga de pressão proximal do VD 2,3,10,18, 19,20,21,22,23. A escolha de um modelo de HP ou de um modelo de carga de pressão proximal do VD depende da questão de pesquisa: o efeito de uma intervenção na vasculatura pulmonar e, portanto, possivelmente a modulação da pós-carga do VD (ou seja, modelos de HP) ou o efeito direto no VD (ou seja, modelos de carga de pressão proximal do VD). Vários métodos para indução experimental de HP estão disponíveis, incluindo o uso de monocrotalina (MCT)12,13,14,16,22,24,25,26, MCT combinado com um shunt aortocava 9, hipóxia crônica 7,27,28,29, e a combinação de um antagonista do receptor do fator de crescimento endotelial vascular, Sugen 5416, com hipóxia crônica 8,10,30,31. Tais modelos representam modelos pulmonares progressivos de carga pressórica proximal do VD e não são direcionados à vasculatura pulmonar, mas induzem uma pós-carga constante por constrição da artéria pulmonar, com um aumento concomitante da pós-carga do VD 2,3. Isso pode ser realizado por uma banda de sutura (banda da artéria pulmonar, PAB) ou um clipe vascular ao redor da artéria pulmonar. A PAB tem sido realizada em várias espécies animais, e as dimensões e funções cardíacas têm sido estudadas de várias maneiras, como histologia, ecocardiografia transtorácica (incluindo speckle tracking) e cateterismo cardíaco 2,32,33,34,35,36,37,38,39,40 . PAB em pequenos roedores, como camundongos, é um desafio. Isso ocorre porque diferenças sutis entre a rigidez da constrição da artéria têm resultados marcantes no grau de carga pressórica do VD e no subsequente estado funcional e sobrevida. Quando a constrição é muito apertada, o animal morre durante ou logo após a operação, enquanto o fenótipo desejado não será alcançado quando a constrição não for suficientemente apertada. No entanto, o uso de camundongos apresenta vantagens em relação a outros animais, devido às excelentes possibilidades de modificação genética (ou seja, modelos transgênicos ou nocaute) e rápida reprodução. Isso é de valor agregado no estudo de doenças e na exploração da contribuição de fatores moleculares e (epi) genéticos.
Os desenhos de estudos em animais estão mudando para a investigação de mudanças temporais durante a doença 2,3,8,13,21. Para tais estudos, modalidades não invasivas são necessárias, pois avaliações seriadas podem ser realizadas. Alternativas à RMC na avaliação do remodelamento cardíaco podem ser (1) caracterização tecidual por histopatologia, com múltiplos animais sendo sacrificados em diferentes momentos, (2) avaliação funcional invasiva por análise pressão-volume, ou (3) ecocardiografia, que permite ao pesquisador identificar hipertrofia ou dilatação cardíaca de forma não invasiva dentro do mesmo animal em série. A RMC tem duas vantagens principais na avaliação do VD: (1) a RMC é uma modalidade não invasiva, permitindo medições seriadas em um animal, contribuindo assim para reduzir o número de animais necessários para os estudos, e (2) a RMC não depende de uma forma geométrica específica e visualiza tridimensionalmente. Os volumes de RV derivados de RMC e as medidas de função demonstraram ser precisos e são considerados o padrão-ouro não invasivo em diferentes entidades cardíacas em humanos 42,43,44,45, mas ainda não foram traduzidos para um protocolo de RMC para camundongos com sobrecarga de pressão de VD.
Muitos modelos de PAB são descritos na literatura, mas com alta heterogeneidade nos métodos de avaliação dos efeitos hemodinâmicos e da função e adaptação do VD. Este protocolo descreve o procedimento de PAB em camundongos com validação do modelo medindo o gradiente de PAB por ecocardiografia e avaliando as dimensões e função cardíaca com RMC. Embora um protocolo de RMC em animais submetidos a PAB tenha sido publicado para ratos, essa combinação não foi descrita para camundongos até o momento. Enquanto os ratos são mais comumente usados para modelos de PH 8,12,13,14,15,16,22,24,25,26,27,28,29,30,31,46 , os camundongos são mais frequentemente usados para estudos transgênicos ou knock-out e, assim, contribuem para nossa compreensão dos mecanismos de falha do VD carregado de pressão. Este protocolo pode servir de base para estudos futuros para desvendar as vias de sinalização envolvidas na transição para a falha do VD.
Protocolo
Todos os experimentos e cuidados com os animais são conduzidos de acordo com a Lei Experimental Animal Holandesa e estão em conformidade com o Guia para o Cuidado e Uso de Animais de Laboratório publicado pelos Institutos Nacionais de Saúde dos EUA. O Comitê de Experimentos com Animais da Universidade de Groningen, Holanda, aprovou o protocolo experimental atual (número da licença: 2014-041/3005).
1. Alojamento e aclimatação
- Use 20-30 g de camundongos selvagens tipo C57 preto 6 (C57BL / 6) (linha de reprodução institucional descrita anteriormente47), machos e fêmeas, todos com mais de 8 semanas de idade. Alojar os ratos em grupos com um máximo de cinco por gaiola. Para se acostumar com o manuseio humano, deixe os ratos se aclimatarem por pelo menos 7 dias. Não realize nenhum procedimento durante este período.
2. Cirurgia de bandagem da artéria pulmonar
- Preparação
- Coloque o camundongo na câmara de indução cheia de isoflurano a 5% / oxigênio a 100%. Verifique a falta de reflexos dando um estímulo de dor (ou seja, beliscar o dedo do pé).
- Raspe o hemitórax esquerdo do mouse usando um barbeador elétrico.
- Puxe suavemente a língua para fora e segure com uma leve tensão.
- Ilumine a garganta interna colocando uma fonte de luz na garganta externa no nível da glote.
- Intubar o camundongo por via endotraqueal com uma cânula flexível de 20 G.
- Coloque o animal do lado direito em um tapete térmico (temperatura definida em 37 °C).
- Conecte a cânula ao miniventilador e inicie a ventilação com isoflurano/oxigênio a 1,5% a 2,5% (180 respirações/min, 250 μL corrente).
- Injete 0,1 mg/kg de buprenorfina por via subcutânea para analgesia pós-operatória.
- Evite a desidratação do olho usando pomada para os olhos.
- Cirurgia de bandagem da artéria pulmonar por toracotomia lateral esquerda
- Coloque o mouse do lado direito, colocando a perna dianteira direita em uma posição neutra, a perna traseira direita estendida e a perna dianteira esquerda dobrada para trás.
- Desinfete a pele do tórax com cloreto-hexidina, esfregue 2x.
- Use instrumentos estéreis para cirurgia. Abra a pele com uma tesoura pequena (cabo redondo, lâminas de 12 mm) da axila esquerda paralela à segunda e terceira costela.
- Identifique o m. pectoralis superficialis (músculo oblíquo e superficial) e o m. pectoralis profundus (músculo oblíquo subjacente).
- Usando alças de sutura, puxe o m. pectoralis superficialis em direção ao lado ventral e o m. pectoralis profundus em direção ao lado dorsal do camundongo.
- Abra o segundo espaço intercostal e espalhe as costelas usando clipes de papel adaptados, permitindo que a orelha esquerda do coração, o pulmão esquerdo e a artéria pulmonar se tornem visíveis.
- Separe a artéria pulmonar da aorta. Coloque uma alça de sutura ao redor da artéria pulmonar com uma agulha romba de 25 G que contenha uma sutura 6-0 e coloque uma ligadura 2-1-1 solta ao redor da artéria pulmonal.
- Coloque uma agulha 23 G paralela à artéria pulmonal dentro da sutura 6-0 e primeiro fixe o nó de sutura mais proximal e depois o nó distal da sutura 2-1-1. Remova a agulha de 23 G. Certifique-se de que o nó é adequado.
- Feche o tórax com duas ou três suturas separadas com uma sutura monofilamentar de polipropileno 5-0. Solte o m. pectoralis superficalis e o m. pectoralis profundus.
- Suturar a pele com uma sutura de ácido poliglicólico puro 5-0. Use uma técnica de sutura contínua para minimizar a formação de cicatrizes no tecido; O tecido cicatricial influenciará a qualidade da imagem do ecocardiograma.
- Desligue o isoflurano enquanto continua a ventilação com oxigênio durante a recuperação da anestesia até que o camundongo recupere sua própria respiração espontânea, como pode ser observado pelo movimento do abdômen.
- Desacople o tubo endotraqueal do ventilador. Verifique se há respiração espontânea, extube apenas quando a ação respiratória espontânea for visível. Quando a respiração espontânea não for observada, conecte o tubo ao ventilador novamente e retorne à etapa 2.2.12.
- Observe o rato até que ele recupere a consciência.
- Cirurgia simulada
- Execute o procedimento acima, com exceção da cintagem (etapas 2.2.2–2.2.6).
- Período pós-cirúrgico
- Alojar o rato individualmente numa incubadora (37 °C) durante 24 h.
- Observe o camundongo diariamente durante os primeiros 3 dias de pós-operatório. Em caso de sinais de desconforto, injetar 0,1 mg/kg de buprenorfina por via subcutânea 2x ao dia para analgesia pós-operatória.
3. Ecocardiografia
- Preparação
- Realizar análise do gradiente de PAB por meio de ecocardiografia 14 dias após a cirurgia de PAB.
- Inicie o dispositivo de ecocardiografia. Escolha o pacote cardíaco e um transdutor de 14,0 MHz.
- Anestesia
- Coloque o camundongo na câmara de indução cheia de uma mistura de 5% de isoflurano e 100% de oxigênio.
- Raspe o tórax do mouse.
- Coloque o rato de costas no tapete térmico (temperatura 37 °C) e coloque o focinho na máscara de ventilação.
- Ventile com uma mistura de 1,5% a 2,5% de isoflurano e 100% de oxigênio (0,15 L / min) e ar ambiente (0,3 L / min).
- Verifique a profundidade da anestesia realizando uma pinça do dedo do pé e ajuste a anestesia de acordo.
- Evite a desidratação do olho usando pomada para os olhos.
- Determinação do gradiente PAB por ecocardiografia
- Coloque adesivos de eletrocardiograma pediátrico em cada perna dianteira e um em ambas as patas traseiras. Use os adesivos para segurar o animal.
- Aplique gel de ultrassom na parte raspada do tórax do camundongo.
- Para obter as imagens da artéria pulmonar, duas incidências podem ser utilizadas: a incidência do eixo longo paraesternal (PLAX) ou a incidência do eixo curto paraesternal (PSAX). Obtenha ambos e use a visualização que fornece as medições de melhor qualidade e as velocidades mais altas para análise.
- Obtenha visualizações PLAX e PSAX.
- Pressione o botão Doppler colorido para visualizar o fluxo sanguíneo.
- Coloque a sonda de ultrassom em um ângulo de 30° em relação à linha paraesternal para obter PLAX (para descrição detalhada, consulte Cheng, et al.48), visualizando a aorta ascendente.
- Varra a sonda minimamente para a esquerda para que a aorta ascendente desapareça atrás da artéria pulmonar. A PLAX apropriada é identificada quando a artéria pulmonar é visualizada, com o sangue fluindo verticalmente.
- Coloque o cursor alinhado com a artéria pulmonar. Pressione o botão Doppler de onda contínua (CW) para derivar as medições integrais de tempo de velocidade durante três ciclos cardíacos. Pressione Salvar.
- Gire a sonda 90° no sentido horário do PLAX para obter o PSAX e, em seguida, incline a sonda ligeiramente para a direção cranial/ventral para derivar o PSAX no nível aórtico. A incidência apropriada do PSAX é identificada se a via de saída do VD estiver situada entre a aorta e a sonda. Isso continua na artéria pulmonar, com o sangue fluindo verticalmente. Para uma descrição detalhada, ver Cheng et al.48
- Coloque o cursor alinhado com a artéria pulmonar. Pressione o botão Doppler de onda contínua (CW) para derivar as medições integrais de tempo de velocidade durante três ciclos cardíacos. Pressione Salvar.
- Meça as três velocidades máximas da melhor visão (PSAX ou PLAX) e calcule a média. Use o princípio simplificado de Bernoulli para derivar o gradiente PAB em milímetros de mercúrio (mmHg).
4. Ressonância magnética cardíaca
- Preparação
- Realize a análise de RMC 6 semanas (ou seja, 42 dias) após a cirurgia de PAB.
NOTA: Além disso, pontos de tempo anteriores após a cirurgia de PAB podem ser escolhidos quando vários pontos de tempo devem ser incluídos, dependendo da questão da pesquisa. Pontos de tempo posteriores podem ser considerados; no entanto, a falha do VD e a morte podem ocorrer cada vez mais. - Use um ímã suficientemente potente (normalmente, >7 T é usado para varredura CMR de roedores). Para o protocolo atual, é utilizado um sistema vertical de 9,4 T, com inclinação de 1.500 mT/m e diâmetro interno de 89 mm.
- Instale o software de pós-processamento CMR para analisar volumes e massas nas imagens derivadas. O software é considerado apropriado se permitir a segmentação manual para determinar os volumes diastólico final (DE) e sistólico final (ES) (EDV e ESV, respectivamente) e a massa ventricular (medidos tanto ED quanto ES).
- Realize a análise de RMC 6 semanas (ou seja, 42 dias) após a cirurgia de PAB.
- Anestesia e fixação
- Coloque o camundongo na câmara de indução cheia de uma mistura de 5% de isoflurano e 100% de oxigênio. Verifique o efeito da anestesia dando um estímulo de dor por um beliscão do dedo do pé.
- Coloque pomada nos olhos do rato para mantê-los úmidos durante a digitalização.
- Coloque o mouse na cama do animal do scanner com suprimento de ar integrado, uma mistura aquecida (37 ° C) de 1.5% a 2.5% de isoflurano, 100% de oxigênio (0.15 L / min) e ar ambiente (0.3 L / min) e uma almofada de pressão que permite a observação da frequência cardíaca (apontar para 400-500 bpm) e frequência respiratória (apontar para ~ 35 respirações por minuto) durante a varredura. Regule a anestesia com base nesses dois parâmetros. Certifique-se de que a cama seja feita de plástico, sem nenhum material magnético.
- Coloque a cama do animal com o mouse no scanner.
- Realização de ressonância magnética cardíaca
- Faça ajustes de pré-aquisição ajustando a bobina de radiofrequência (RF) em 1 frequência de ressonância de hidrogênio (1 H).
- Em seguida, defina o campo magnético o mais homogêneo possível usando o procedimento de calço automático.
NOTA: O calço computadorizado é feito pelo chamado método de Tuning, que utiliza a área sob o FID 1 H como parâmetro de qualidade. Neste procedimento de ajuste, um grupo de calços definido pelo usuário (Z, Z2, X, Y, XZ e YZ) é examinado em um ciclo iterativo. Cada calço sucessivamente é ajustado individualmente para maximizar a área sob o FID. Este é essencialmente um procedimento linear que funciona bem rapidamente. - Otimize o pulso de RF maximizando o perfil de imagem unidimensional com ajuste da potência do pulso de RF.
- Atribua a posição exata do coração no scanner fazendo varreduras de reconhecimento usando uma sequência tripiloto. Use uma sequência de eco gradiente rápido para adquirir as imagens scout através do tórax: um corte transversal, coronal e sagital. (Figura 1A, B, C)
- Ajuste os eixos para os eixos reais da vista axial, de duas câmaras e de quatro câmaras (Figura 1D,E).
- Em seguida, posicione os cortes de cine perpendicularmente a um eixo imaginário entre a via de saída do VD e a parte apical máxima do VD.
- Derive de dez a onze fatias de cine de 1 mm de espessura sem uma lacuna de corte para cobrir toda a imagem de cima para baixo do VD (Figura 1F) por meio do método Self-gated IntraGate-fast low-angle shot (FLASH), que evita a necessidade de um eletrocardiograma (ECG) e gating respiratório. Os parâmetros de aquisição são exibidos na Tabela 1. Salve as imagens no formato DICOM.
- Realização de análises em imagens adquiridas
- Clique duas vezes no software para abrir o programa.
- Abra imagens no software de pós-processamento CMR usando o botão de importação .
- Identifique a fase sistólica final (definida como a fase com a cavidade VD visualmente menor) e a fase diastólica final (definida como a fase com a cavidade VD visualmente maior).
- De acordo com as diretrizes da Society for Cardiovascular Magnetic Resonance49, desenhe os contornos epicárdicos manualmente no final da diástole e no final da sístole do ápice à base, marcando vários pontos na borda epicárdica de cada imagem. No último ponto, clique duas vezes para completar o contorno epicárdico.
- Faça o mesmo para os contornos endocárdicos. (Figura 2). O VDF do ventrículo esquerdo e direito, o ESV, a massa do DE e a massa do ES agora são calculados automaticamente pelo software.
NOTA: A massa é definida como o volume miocárdico vezes a densidade miocárdica (ou seja, 1,05). - Dependendo da questão de pesquisa e da população em estudo, indexar essas variáveis para o tamanho do sujeito por meio do comprimento da tíbia ou do peso corporal, de acordo com fórmulas publicadas anteriormente50.
- Calcule o índice de excentricidade (IE) tanto na diástole final quanto na sístole final, dividindo o diâmetro da cavidade do VE paralela ao septo intraventricular (SIV) pelo diâmetro da cavidade do VE perpendicular ao SIV, derivado do eixo curto no nível médio-papilar.
- O software calcula o volume sistólico (VS) em mL como
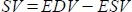 , e a fração de ejeção (FE, %) como
, e a fração de ejeção (FE, %) como 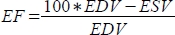 .
. - Calcule o débito cardíaco (DC) em ml/min como
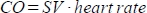 . A frequência cardíaca é medida manualmente pela almofada de pressão embutida na cama do animal, conforme descrito acima, porque o scanner não é capaz de registrar adequadamente a frequência cardíaca alta e frequente.
. A frequência cardíaca é medida manualmente pela almofada de pressão embutida na cama do animal, conforme descrito acima, porque o scanner não é capaz de registrar adequadamente a frequência cardíaca alta e frequente. - Dependendo da questão de pesquisa e da população em estudo, indexar o DC e o VS para o tamanho do sujeito por meio do comprimento da tíbia ou do peso corporal, de acordo com fórmulas publicadas anteriormente50.
5. Análises estatísticas
- Abra o software usado para visualização de dados e análises estatísticas.
- Classifique os dados por grupo (PAB e simulado) com cada grupo em uma coluna separada.
- Use o teste de Mann-Whitney para comparar PAB versus sham para cada variável.
Resultados
A taxa de mortalidade do procedimento cirúrgico PAB é de cerca de 10%. Os resultados apresentados mostram características de camundongos nos grupos sham (n = 5) e PAB (n = 8). Conforme mostrado na Figura 3, os valores de gradiente de PAB aumentaram significativamente em comparação com animais simulados em 2 e 6 semanas após PAB. Esse aumento da carga causou dilatação do VD expressa como aumento do VD, EDV e VD ESV (Figura 4A
Discussão
Este protocolo fornece um método reprodutível para PAB em camundongos e a subsequente avaliação da remodelação cardíaca e adaptação funcional usando RMC.
O PAB difere de outros modelos de aumento da carga pressórica do VD porque envolve aumento absoluto e estático da pós-carga sem a presença de outros gatilhos. A carga pressórica do VD em modelos de hipóxia, monocrotalina, shunt ou uma combinação desses indutores é baseada no remodelamento da...
Divulgações
O University Medical Center Groningen contratou a Actelion e a Lilly para atividades de consultoria de R.M.F. Berger fora do conteúdo deste manuscrito. Os outros autores declaram que não têm interesses conflitantes.
Agradecimentos
Gostaríamos de agradecer a P. Da Costa-Martins por seu apoio com os experimentos com animais neste estudo.
Materiais
| Name | Company | Catalog Number | Comments |
| 14.0 MHz i13L-echocardiography transducer | GE Healthcare, Waukesha, WI, USA | ||
| 20G cannula | |||
| 23G needle | |||
| 9.4T magnetic resonance scanner with 1,500 mT/m gradient set | Bruker BioSpin, Ellingen, Germany | ||
| Anesthesia induction chamber | |||
| Blunt 25G needle | |||
| Buprenorphine | |||
| Chloride-hexidine | |||
| CMR post-processing software | Medis Medical Imaging Systems, Leiden, The Netherlands | Qmass version 7.6 | |
| Data visualisation and statistical software | GraphPad Prism Inc, La Jolla, CA, USA | software version 7.02 | |
| Echocardiography machine | GE Healthcare, Waukesha, WI, USA | Vivid Dimension 7 | |
| Eye ointment | |||
| Heat mat | |||
| Incubator (37°C) | |||
| Isoflurane | |||
| Isoflurane evaporator | |||
| Miniventilator for rodents | Hugo Sachs | model 687 | |
| monofilament polypropylene 5-0 sutures | |||
| monofilament polypropylene 6-0 sutures | |||
| Needle and syringe for subcutaneous injections | |||
| Pediatric electrocardiogram-stickers | |||
| pure polyglycolic acid 5-0 sutures | |||
| Sterile surgical instruments | |||
| Ventilation mask |
Referências
- Norozi, K., et al. Incidence and Risk Distribution of Heart Failure in Adolescents and Adults With Congenital Heart Disease After Cardiac Surgery. The American Journal of Cardiology. 97 (8), 1238-1243 (2006).
- Borgdorff, M. A. J., et al. Clinical symptoms of right ventricular failure in experimental chronic pressure load are associated with progressive diastolic dysfunction. Journal of Molecular and Cellular Cardiology. 79, 244-253 (2015).
- Koop, A. M. C., et al. Right ventricular pressure overload alters cardiac lipid composition. International Journal of Cardiology. , (2019).
- Faber, M. J., et al. Right and left ventricular function after chronic pulmonary artery banding in rats assessed with biventricular pressure-volume loops. American Journal of Physiology and Heart Circirculation Physiology. 291 (4), 1580-1586 (2006).
- Bogaard, H. J., et al. Chronic pulmonary artery pressure elevation is insufficient to explain right heart failure. Circulation. 120 (20), 1951-1960 (2009).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulmonary Circulation. 7 (3), 572-587 (2017).
- Rumsey, W. L., et al. Adaptation to hypoxia alters energy metabolism in rat heart. American Journal of Physiology Heart and Circulatory Physiology. 276 (1), 71-80 (1999).
- Drozd, K., et al. Effects of an endothelin receptor antagonist, Macitentan, on right ventricular substrate utilization and function in a Sugen 5416/hypoxia rat model of severe pulmonary arterial hypertension. Journal of Nuclear Cardiology. 24 (6), 1979-1989 (2017).
- Van Der Feen, D. E., et al. Shunt surgery, right heart catheterization, and vascular morphometry in a rat model for flow-induced pulmonary arterial hypertension. Journal of Visualized Experiments. (120), e55065 (2017).
- Gomez-Arroyo, J., et al. Metabolic gene remodeling and mitochondrial dysfunction in failing right ventricular hypertrophy secondary to pulmonary arterial hypertension. Circulation: Heart Failure. 6 (1), 136-144 (2013).
- Bruns, D. R., Dale Brown, R., Stenmark, K. R., Buttrick, P. M., Walker, L. A. Mitochondrial integrity in a neonatal bovine model of right ventricular dysfunction. American Journal of Physiology - Lung Cellular and Molecular Physiology. 308 (2), 158-167 (2015).
- Zhang, W. H., et al. Up-regulation of hexokinase1 in the right ventricle of monocrotaline induced pulmonary hypertension. Respiratory Research. 15 (1), 119 (2014).
- Paulin, R., et al. A miR-208-Mef2 axis drives the decompensation of right ventricular function in pulmonary hypertension. Circulation Research. 116 (1), 56-69 (2015).
- Sutendra, G., et al. A metabolic remodeling in right ventricular hypertrophy is associated with decreased angiogenesis and a transition from a compensated to a decompensated state in pulmonary hypertension. Journal of Molecular Medicine. 91 (11), 1315-1327 (2013).
- Balestra, G. M., et al. Increased in vivo mitochondrial oxygenation with right ventricular failure induced by pulmonary arterial hypertension: Mitochondrial inhibition as driver of cardiac failure. Respiratory Research. 16, 6 (2015).
- Piao, L., et al. The inhibition of pyruvate dehydrogenase kinase improves impaired cardiac function and electrical remodeling in two models of right ventricular hypertrophy: Resuscitating the hibernating right ventricle. Journal of Molecular Medicine. 88 (1), 47-60 (2010).
- Piao, L., et al. FOXO1-mediated upregulation of pyruvate dehydrogenase kinase-4 (PDK4) decreases glucose oxidation and impairs right ventricular function in pulmonary hypertension: therapeutic benefits of dichloroacetate. Journal of Molecular Medicine. 91, 333-346 (2013).
- Sheikh, A. M., et al. Right ventricular hypertrophy with early dysfunction: A proteomics study in a neonatal model. Journal of Thoracic and Cardiovascular Surgery. 137 (5), 1146-1153 (2009).
- Olivetti, G., et al. Cellular basis of wall remodeling in long-term pressure overload-induced right ventricular hypertrophy in rats. Circulation Research. 63 (3), 648-657 (1988).
- Lauva, I. K., et al. Control of myocardial tissue components and cardiocyte organelles in pressure-overload hypertrophy of the cat right ventricle. The American Journal of Anatomy. 177 (1), 71-80 (1986).
- Fang, Y. H., et al. Therapeutic inhibition of fatty acid oxidation in right ventricular hypertrophy: Exploiting Randle's cycle. Journal of Molecular Medicine. 90 (1), 31-43 (2012).
- Piao, L., et al. Cardiac glutaminolysis: A maladaptive cancer metabolism pathway in the right ventricle in pulmonary hypertension. Journal of Molecular Medicine. 91 (10), 1185-1197 (2013).
- Sack, M. N., Disch, D. L., Rockman, H. A., Kelly, D. P. A role for Sp and nuclear receptor transcription factors in a cardiac hypertrophic growth program. Proceedings of the National Academy of Sciences of the United States of America. 94 (12), 6438-6443 (1997).
- Broderick, T. L., King, T. M. Upregulation of GLUT-4 in right ventricle of rats with monocrotaline- induced pulmonary hypertension. Medical Science Monitor. 14 (12), 261-264 (2008).
- Enache, I., et al. Skeletal muscle mitochondrial dysfunction precedes right ventricular impairment in experimental pulmonary hypertension. Molecular and Cellular Biochemistry. 373 (1-2), 161-170 (2013).
- Sun, X. Q., et al. Reversal of right ventricular remodeling by dichloroacetate is related to inhibition of mitochondria-dependent apoptosis. Hypertension Research. 39 (5), 302-311 (2016).
- Adrogue, J. V., Sharma, S., Ngumbela, K., Essop, M. F., Taegtmeyer, H. Acclimatization to chronic hypobaric hypoxia is associated with a differential transcriptional profile between the right and left ventricle. Molecular and Cellular Biochemistry. 278 (1-2), 71-78 (2005).
- Sharma, S., et al. Dynamic changes of gene expression in hypoxia-induced right ventricular hypertrophy. American Journal of Physiology - Heart and Circulatory Physiology. 286 (3), 1185-1192 (2004).
- Nouette-Gaulain, K., et al. Time course of differential mitochondrial energy metabolism adaptation to chronic hypoxia in right and left ventricles. Cardiovascular Research. 66 (1), 132-140 (2005).
- Graham, B. B., et al. Severe pulmonary hypertension is associated with altered right ventricle metabolic substrate uptake. American Journal of Physiology - Lung Cellular and Molecular Physiology. 309 (5), 435-440 (2015).
- Liu, A., et al. Estrogen maintains mitochondrial content and function in the right ventricle of rats with pulmonary hypertension. Physiological Reports. 5 (6), 1-12 (2017).
- Kobr, J., et al. Right Ventricular Pressure Overload and Pathophysiology of Growing Porcine Biomodel. Pediatric Cardiology. 37 (8), 1498-1506 (2016).
- Yerebakan, C., et al. Acute and chronic response of the right ventricle to surgically induced pressure and volume overload - an analysis of pressure-volume relations. Interactive CardioVascular and Thoracic Surgery. 10 (4), 519-525 (2010).
- Gufler, H., et al. Right Ventricular Function After Pulmonary Artery Banding: Adaptive Processes Assessed by CMR and Conductance Catheter Measurements in Sheep. Journal of Cardiovascular Translational Research. 12 (5), 459-466 (2019).
- Baicu, C. F., et al. Time course of right ventricular pressure-overload induced myocardial fibrosis: relationship to changes in fibroblast postsynthetic procollagen processing. American Journal of Physiology-Heart and Circulatory Physiology. 303 (9), 1128-1134 (2012).
- Manohar, M., et al. Regional myocardial blood flow and coronary vascular reserve in unanesthetized young calves exposed to a simulated altitude of 3500 m for 8-10 weeks. Circulation Research. 50 (5), 714-726 (1982).
- Fávaro, G. A. G., et al. Reversible pulmonary trunk banding: VII. Stress echocardiographic assessment of rapid ventricular hypertrophy in young goats. Journal of Thoracic and Cardiovascular Surgery. 145 (5), 1345-1351 (2013).
- Nielsen, E. A., et al. Regional septal hinge-point injury contributes to adverse biventricular interactions in pulmonary hypertension. Physiological Reports. 5 (14), 1-13 (2017).
- Borgdorff, M. A., et al. Sildenafil enhances systolic adaptation, but does not prevent diastolic dysfunction, in the pressure-loaded right ventricle. European Journal of Heart Failure. 14 (9), 1067-1074 (2012).
- Gold, H., Prindle, K., Levey, G., Epstein, S. Effects of experimental heart failure on the capacity of glucagon to augment myocardial contractility and activate adenyl cyclase. The Journal of Clinical Investigation. 49 (5), 999-1006 (1970).
- Brittain, E. L., et al. Right ventricular plasticity and functional imaging. Pulmonary Circulation. 2 (3), 309-326 (2012).
- Jiang, L., et al. Three-dimensional Echocardiography In Vivo Validation for Right Ventricular Volume and Function. Circulation. 89, 2342-2350 (1994).
- Markiewicz, W., Sechtem, U., Higgins, C. B. Evaluation of the right ventricle by magnetic resonance imaging. American Heart Journal. 113 (1), 8-15 (1987).
- Pattynama, P. M. T., et al. Reproducibility of MRI-derived measurements of right ventricular volumes and myocardial mass. Magnetic Resonance Imaging. 13 (1), 53-63 (1995).
- Wiesmann, F., et al. Comparison of fast spiral, echo planar, and fast low-angle shot MRI for cardiac volumetry at .5T. Journal of Magnetic Resonance Imaging. 8 (5), 1033-1039 (1998).
- Van der Feen, D. E., et al. Multicenter Preclinical Validation of BET Inhibition for the Treatment of Pulmonary Arterial Hypertension. American Journal of Respiratory and Critical Care Medicine. 200 (7), 910-920 (2019).
- da Costa Martins, P. A., et al. MicroRNA-199b targets the nuclear kinase Dyrk1a in an auto-amplification loop promoting calcineurin/NFAT signalling. Nature Cell Biology. 12 (12), 1220-1227 (2010).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. Journal of Visualized Experiments. (84), e51041 (2014).
- Schulz-Menger, J., et al. Standardized image interpretation and post processing in cardiovascular magnetic resonance: Society for Cardiovascular Magnetic Resonance (SCMR) Board of Trustees Task Force on Standardized Post Processing. Journal of Cardiovascular Magnetic Resonance. 15 (1), 1-19 (2013).
- Hagdorn, Q. A. J., et al. A novel method optimizing the normalization of cardiac parameters in small animal models: The importance of dimensional indexing. American Journal of Physiology - Heart and Circulatory Physiology. 316 (6), 1552-1557 (2019).
- Scherrer-Crosbie, M., et al. Determination of Right Ventricular Structure and Function in Normoxic and Hypoxic Mice. Circulation. 98 (10), 1015-1021 (2012).
- Wiesmann, F., et al. Analysis of right ventricular function in healthy mice and a murine model of heart failure by in vivo MRI. American Journal of Physiology-Heart and Circulatory Physiology. 283 (3), 1065-1071 (2002).
- Lu, X., et al. Accuracy and Reproducibility of Real-Time Three-Dimensional Echocardiography for Assessment of Right Ventricular Volumes and Ejection Fraction in Children. Journal of the American Society of Echocardiography. 21 (1), 84-89 (2008).
- Soriano, B. D., et al. Matrix-array 3-dimensional echocardiographic assessment of volumes, mass, and ejection fraction in young pediatric patients with a functional single ventricle: A comparison study with cardiac magnetic resonance. Circulation. 117 (14), 1842-1848 (2008).
- Damy, T., et al. Prevalence of, associations with, and prognostic value of tricuspid annular plane systolic excursion (TAPSE) among out-patients referred for the evaluation of heart failure. Journal of Cardiac Failure. 18 (3), 216-225 (2012).
- Kowalik, E., Kowalski, M., Rózański, J., Kuśmierczyk, M., Hoffman, P. The impact of pulmonary regurgitation on right ventricular regional myocardial function: An echocardiographic study in adults after total repair of tetralogy of fallot. Journal of the American Society of Echocardiography. 24 (11), 1199-1204 (2011).
- Koestenberger, M., et al. Systolic right ventricular function in pediatric and adolescent patients with tetralogy of Fallot: Echocardiography versus magnetic resonance imaging. Journal of the American Society of Echocardiography. 24 (1), 45-52 (2011).
- Bovens, S. M., et al. Evaluation of infarcted murine heart function: Comparison of prospectively triggered with self-gated MRI. NMR in Biomedicine. 24 (3), 307-315 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados