Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cuantificación de la función y morfología biventricular mediante resonancia magnética cardíaca en ratones con bandas en la arteria pulmonar
* Estos autores han contribuido por igual
En este artículo
Resumen
Para comprender la fisiopatología de la adaptación del ventrículo derecho (VD) a la carga anormal, los modelos experimentales son cruciales. Sin embargo, la evaluación de las dimensiones y la función del RV es compleja y desafiante. Este protocolo proporciona un método para realizar imágenes de resonancia magnética cardíaca (RMC) como un procedimiento de referencia no invasivo en ratones sometidos a una carga de presión del VD.
Resumen
La función y el fallo del ventrículo derecho (VD) son los principales determinantes del resultado de las cardiopatías adquiridas y congénitas, incluida la hipertensión pulmonar. La evaluación de la función y morfología del VD es compleja, en parte debido a la compleja forma del VD. Actualmente, la resonancia magnética cardíaca (RMC) es el estándar de oro para la evaluación no invasiva de la función y morfología del VD. El protocolo actual describe la obtención de imágenes de RMC en un modelo de ratón de la carga de presión del VD inducida por el bandeado de la arteria pulmonar (PAB). La PAB se realiza colocando una sutura 6-0 alrededor de la arteria pulmonar sobre una aguja de 23 G. El gradiente de PAB se determina mediante ecocardiografía a las 2 y 6 semanas. A las 6 semanas, la morfología y la función de los ventrículos derecho e izquierdo se evalúan midiendo los volúmenes y la masa telesistólica y telediastólica en diez a once cortes de cine de 1 mm de espesor utilizando un escáner de resonancia magnética de 9,4 T equipado con un gradiente de 1.500 mT/m. Los resultados representativos muestran que el PAB induce un aumento significativo en la carga de presión del VD, con efectos significativos sobre la morfología biventricular y la función del VD. También se ha demostrado que a las 6 semanas de carga de presión del VD, el gasto cardíaco se mantiene. Aquí se presenta un protocolo reproducible para la cuantificación de la morfología y función biventricular en un modelo murino de la carga de presión del VD y puede servir como método para experimentos que exploren los determinantes de la remodelación y disfunción del VD.
Introducción
Los pacientes con enfermedades cardiovasculares adquiridas y congénitas, incluida la hipertensión pulmonar (HP), corren el riesgo de disfunción e insuficiencia del ventrículo derecho (VD)1. La adaptación del VD como resultado del aumento de la carga de presión se caracteriza por hipertrofia concéntrica en estadios tempranos y dilatación progresiva en la enfermedad terminal. Además, se asocia a trastornos en el metabolismo y en la matriz extracelular, procesos de inflamación y, eventualmente, fallo del VD 2,3,4,5,6. Se han desarrollado modelos animales para explorar los procesos subyacentes de la progresión hacia el fracaso del VD. Sin embargo, la optimización de los modelos y la evaluación adecuada de la función y las dimensiones del VD han sido un desafío. Para la evaluación no invasiva de la función y las dimensiones del VD, la resonancia magnética cardíaca (RMC) es el estándar de oro. Esta técnica crea imágenes del corazón latiendo mediante el uso de un fuerte campo magnético y ondas de radiofrecuencia. La CMR está disponible para humanos y para animales como roedores de laboratorio. Como estos últimos requieren una mayor resolución espacial debido al menor tamaño del corazón, el campo magnético requerido para proporcionar imágenes adecuadas debe ser mayor, en comparación con los humanos.
Hay disponibles varios modelos que imitan la sobrecarga de presión RV, incluidos los modelos de PH 7,8,9,10,11,12,13,14,15,16,17 y los modelos de carga de presión RV proximal 2,3,10,18, 19,20,21,22,23. La elección de un modelo de HP o un modelo de carga de presión proximal del VD depende de la pregunta de investigación: el efecto de una intervención sobre la vasculatura pulmonar y, por lo tanto, posiblemente la modulación de la poscarga del VD (es decir, modelos de HP), o el efecto directo sobre el VD (es decir, modelos de carga de presión proximal del VD). Existen varios métodos para la inducción experimental de la HP, incluyendo el uso de monocrogalina (MCT)12,13,14,16,22,24,25,26, MCT combinado con una derivación aortocava 9, hipoxia crónica 7,27,28,29 y la combinación de un antagonista del receptor del factor de crecimiento endotelial vascular, Sugen 5416, con hipoxia crónica 8,10,30,31. Dichos modelos representan modelos pulmonares progresivos de la carga de presión proximal del VD y no están dirigidos a la vasculatura pulmonar, sino que inducen una poscarga constante por constricción de la arteria pulmonar, con un aumento acompañante de la poscarga del VD 2,3. Esto se puede realizar mediante una banda de sutura (banda de la arteria pulmonar, PAB) o una pinza vascular alrededor de la arteria pulmonar. La PAB se ha realizado en varias especies animales, y las dimensiones y la función cardíaca se han estudiado de diversas maneras, como la histología, la ecocardiografía transtorácica (incluido el seguimiento de manchas) y el cateterismo cardíaco 2,32,33,34,35,36,37,38,39,40 . El PAB en roedores pequeños, como ratones, es un desafío. Esto se debe a que las diferencias sutiles entre la estrechez de la constricción arterial han marcado los resultados sobre el grado de carga de presión del VD y el posterior estado funcional y supervivencia. Cuando la constricción es muy ajustada, el animal morirá durante o poco después de la operación, mientras que el fenotipo deseado no se logrará cuando la constricción no es lo suficientemente ajustada. Sin embargo, el uso de ratones tiene ventajas en comparación con otros animales, debido a las excelentes posibilidades de modificación genética (es decir, modelos transgénicos o knockout) y la rápida reproducción asistida. Esto es de valor añadido en el estudio de las enfermedades y en la exploración de la contribución de los factores moleculares y (epi)genéticos.
Los diseños de los estudios en animales están cambiando hacia la investigación de los cambios temporales durante la enfermedad 2,3,8,13,21. Para estos estudios, son necesarias modalidades no invasivas, ya que se pueden realizar evaluaciones seriadas. Las alternativas a la RMC en la evaluación del remodelado cardíaco podrían ser: (1) la caracterización tisular mediante histopatología, con el sacrificio de múltiples animales en diferentes puntos temporales, (2) la evaluación funcional invasiva mediante análisis de presión-volumen, o (3) la ecocardiografía, que permite al investigador identificar la hipertrofia o dilatación cardíaca de forma no invasiva dentro del mismo animal en serie. La RMC tiene dos ventajas principales en la evaluación del RV: (1) la RMC es una modalidad no invasiva, que permite mediciones en serie en un animal, contribuyendo así a reducir el número de animales necesarios para los estudios, y (2) la RMC no se basa en una forma geométrica particular y se visualiza tridimensionalmente. Se ha demostrado que los volúmenes y las mediciones de la función del VD derivados de la RMC son precisos y se consideran el estándar de oro no invasivo en diferentes entidades cardíacas en humanos 42,43,44,45, pero aún no se han traducido a un protocolo de RMC para ratones con sobrecarga de presión del VD.
En la literatura se describen muchos modelos de PAPA, pero con una gran heterogeneidad en los métodos de evaluación de los efectos hemodinámicos y la función y adaptación del VD. Este protocolo describe el procedimiento de PAB en ratones con validación del modelo mediante la medición del gradiente de PAB mediante ecocardiografía y la evaluación de las dimensiones y la función cardíaca con CMR. Si bien se ha publicado un protocolo de CMR en animales sometidos a PAB para ratas, esta combinación no se ha descrito para ratones hasta ahora. Mientras que las ratas se utilizan más comúnmente para los modelosde PH 8,12,13,14,15,16,22,24,25,26,27,28,29,30,31,46 , los ratones se utilizan con mayor frecuencia para estudios transgénicos o knock-out y, por lo tanto, contribuyen a nuestra comprensión de los mecanismos en la falla de los VD cargados de presión. Este protocolo podría constituir la base para futuros estudios que permitan desentrañar las vías de señalización implicadas en la transición hacia el fallo del RV.
Protocolo
Todos los experimentos y el cuidado de los animales se llevan a cabo de acuerdo con la Ley Holandesa de Experimentación Animal y se ajustan a la Guía para el Cuidado y Uso de Animales de Laboratorio publicada por los Institutos Nacionales de Salud de los Estados Unidos. El Comité de Experimentos con Animales de la Universidad de Groningen, Países Bajos, aprobó el protocolo experimental actual (número de permiso: 2014-041/3005).
1. Alojamiento y aclimatación
- Utilice 20-30 g de ratones silvestres tipo C57 negro 6 (C57BL/6) (línea de cría institucional descrita anteriormente47), machos y hembras, todos de más de 8 semanas de edad. Aloja a los ratones en grupos con un máximo de cinco por jaula. Para acostumbrarse a la manipulación humana, deje que los ratones se aclimaten durante al menos 7 días. No realice ningún procedimiento durante este período.
2. Cirugía de bandas de la arteria pulmonar
- Preparación
- Coloque el ratón en la cámara de inducción llena de isoflurano al 5%/oxígeno al 100%. Verifique la falta de reflejos dando un estímulo de dolor (es decir, un pellizco en el dedo del pie).
- Afeita el hemitórax izquierdo del ratón con una afeitadora eléctrica.
- Tire suavemente de la lengua y sujétela con una tensión leve.
- Iluminar la garganta interna colocando una fuente de luz en la garganta exterior a nivel de la glotis.
- Intubar el ratón por vía endotraqueal con una cánula flexible de 20 G.
- Coloque el animal sobre su lado derecho sobre una estera térmica (temperatura establecida a 37 °C).
- Conecte la cánula al miniventilador e inicie la ventilación con isoflurano/oxígeno al 1,5%-2,5% (180 respiraciones/min, 250 μl de marea).
- Inyectar 0,1 mg/kg de buprenorfina por vía subcutánea para la analgesia postoperatoria.
- Evite la deshidratación del ojo con ungüento para los ojos.
- Cirugía de bandas de la arteria pulmonar mediante toracotomía lateral izquierda
- Coloque el ratón sobre su lado derecho colocando la pata delantera derecha en una posición neutral, la pata trasera derecha extendida y la pata delantera izquierda doblada hacia atrás.
- Desinfectar la piel del tórax con cloruro-hexidina, hisopar 2 veces.
- Use instrumentos estériles para la cirugía. Abrir la piel con unas tijeras pequeñas (mango redondo, hojas de 12 mm) desde la axila izquierda paralela a la segunda y tercera costilla.
- Identificar el m. pectoralis superficialis (músculo oblicuo, superficial) y el m. pectoralis profundus (músculo oblicuo, subyacente).
- Usando asas de sutura, tire del m. pectoralis superficialis hacia el lado ventral y del m. pectoralis profundus hacia el lado dorsal del ratón.
- Abra el segundo espacio intercostal y separe las costillas con clips adaptados, permitiendo que la oreja izquierda del corazón, el pulmón izquierdo y la arteria pulmonar se hagan visibles.
- Separe la arteria pulmonal de la aorta. Coloque un asa de sutura alrededor de la arteria pulmonar con una aguja roma de 25 G que contenga una sutura 6-0 y coloque una ligadura 2-1-1 suelta alrededor de la arteria pulmonalis.
- Colocar una aguja de 23 G paralela a la arteria pulmonal dentro de la sutura 6-0 y fijar primero el nudo de sutura más proximal y luego el nudo distal de la sutura 2-1-1. Retire la aguja de 23 G. Asegúrate de que el nudo sea el adecuado.
- Cerrar el tórax con dos o tres suturas separadas con una sutura monofilamento de polipropileno 5-0. Libere el m. pectoralis superficalis y el m. pectoralis profundus.
- Sutura la piel con una sutura de ácido poliglicólico puro 5-0. Utilizar una técnica de sutura continua para minimizar la formación de cicatrices en el tejido; El tejido cicatricial influirá en la calidad de la imagen de la ecocardiografía.
- Apague el isoflurano mientras continúa la ventilación con oxígeno durante la recuperación de la anestesia hasta que el ratón recupere su propia respiración espontánea, como se puede observar por el movimiento del abdomen.
- Desacople el tubo endotraqueal del ventilador. Verifique la respiración espontánea, extubar solo cuando la acción respiratoria espontánea sea visible. Cuando no se observe respiración espontánea, vuelva a conectar el tubo al ventilador y vuelva al paso 2.2.12.
- Observa al ratón hasta que recupere la conciencia.
- Cirugía simulada
- Realice el procedimiento anterior con la excepción de las bandas (pasos 2.2.2 a 2.2.6).
- Periodo postquirúrgico
- Aloje al ratón individualmente en una incubadora (37 °C) durante 24 h.
- Observar al ratón diariamente durante los 3 primeros días postoperatorios. En caso de cualquier signo de molestia, inyecte 0,1 mg/kg de buprenorfina por vía subcutánea 2 veces al día para la analgesia postoperatoria.
3. Ecocardiografía
- Preparación
- Realizar el análisis del gradiente de PAB mediante ecocardiografía 14 días después de la cirugía de PAB.
- Ponga en marcha el dispositivo de ecocardiografía. Elija el paquete cardíaco y un transductor de 14,0 MHz.
- Anestesia
- Coloque el ratón en la cámara de inducción llena de una mezcla de 5% de isoflurano y 100% de oxígeno.
- Afeita el tórax del ratón.
- Coloque el ratón boca arriba sobre la estera térmica (temperatura 37 °C) y coloque el hocico en la máscara de ventilación.
- Ventile con una mezcla de isoflurano al 1,5% y 100% de oxígeno (0,15 L/min) y aire ambiente (0,3 L/min).
- Verifique la profundidad de la anestesia realizando un pellizco en el dedo del pie y ajuste la anestesia en consecuencia.
- Prevenir la deshidratación del ojo mediante el uso de ungüento para los ojos.
- Determinación del gradiente de PAB por ecocardiografía
- Coloque calcomanías de electrocardiograma pediátrico en cada pata delantera y una en ambas patas traseras. Usa las pegatinas para sujetar al animal.
- Aplique gel de ultrasonido en la parte afeitada del tórax del ratón.
- Para obtener las imágenes de la arteria pulmonar se pueden utilizar dos vistas: la del eje largo paraesternal (PLAX) o la del eje corto paraesternal (PSAX). Obtenga ambos y utilice la vista que proporcione las mediciones de mejor calidad y las velocidades más altas para el análisis.
- Obtener vistas PLAX y PSAX.
- Presione el botón Doppler color para visualizar el flujo sanguíneo.
- Coloque la sonda de ultrasonido en un ángulo de 30° con respecto a la línea paraesternal para obtener PLAX (para una descripción detallada ver Cheng, et al.48), visualizando la aorta ascendente.
- Recorra la sonda mínimamente hacia la izquierda para que la aorta ascendente desaparezca detrás de la arteria pulmonar. El PLAX apropiado se identifica cuando se visualiza la arteria pulmonar, con sangre fluyendo verticalmente.
- Coloque el cursor en línea con la arteria pulmonar. Presione el botón Doppler de onda continua (CW) para derivar mediciones integrales de velocidad y tiempo durante tres ciclos cardíacos. Presione Guardar.
- Gire la sonda 90° en el sentido de las agujas del reloj desde el PLAX para obtener el PSAX, luego incline la sonda ligeramente hacia la dirección craneal/ventral para derivar el PSAX a nivel aórtico. La vista PSAX apropiada se identifica si el tracto de salida del VD está situado entre la aorta y la sonda. Esto continúa en la arteria pulmonar, con la sangre fluyendo verticalmente. Para una descripción detallada, véase Cheng et al.48
- Coloque el cursor en línea con la arteria pulmonar. Presione el botón Doppler de onda continua (CW) para derivar mediciones integrales de velocidad y tiempo durante tres ciclos cardíacos. Presione Guardar.
- Mida las tres velocidades máximas de la mejor vista (PSAX o PLAX) y calcule la media. Utilice el principio simplificado de Bernoulli para derivar el gradiente PAB en milímetros de mercurio (mmHg).
4. Resonancia magnética cardíaca
- Preparación
- Realizar el análisis de RMC 6 semanas (es decir, 42 días) después de la cirugía de PAB.
NOTA: Además, se pueden elegir puntos de tiempo más tempranos después de la cirugía de PAB cuando se deben incluir varios puntos de tiempo, dependiendo de la pregunta de investigación. Podrían considerarse plazos posteriores; sin embargo, es posible que cada vez se produzcan más fallos y muertes en el RV. - Utilice un imán lo suficientemente potente (normalmente, se utiliza >7 T para el escaneo CMR con roedores). Para el protocolo actual, se utiliza un sistema vertical de 9,4 T, con una pendiente de 1.500 mT/m y un diámetro interior de 89 mm.
- Instale el software de posprocesamiento CMR para analizar volúmenes y masas en las imágenes derivadas. El software se considera apropiado si permite la segmentación manual para determinar los volúmenes diastólicos finales (DE) y telesistólicos (ES) (EDV y ESV, respectivamente) y la masa ventricular (medida tanto ED como ES).
- Realizar el análisis de RMC 6 semanas (es decir, 42 días) después de la cirugía de PAB.
- Anestesia y fijación
- Coloque el ratón en la cámara de inducción llena de una mezcla de 5% de isoflurano y 100% de oxígeno. Verifique el efecto de la anestesia dando un estímulo de dolor con un pellizco en el dedo del pie.
- Aplique ungüento ocular en los ojos del ratón para mantenerlos húmedos durante la exploración.
- Coloque el ratón en la cama del escáner con suministro de aire integrado, una mezcla calentada (37 °C) de isoflurano al 1,5 %, oxígeno al 100 % (0,15 L/min) y aire ambiente (0,3 L/min), y una almohadilla de presión que permita observar la frecuencia cardíaca (objetivo de 400 a 500 lpm) y la frecuencia respiratoria (objetivo de ~35 respiraciones por minuto) durante el escaneo. Regular la anestesia en base a esos dos parámetros. Asegúrese de que la cama esté hecha de plástico, sin ningún material magnético.
- Coloque la cama del animal con el ratón en el escáner.
- Realización de imágenes por resonancia magnética cardíaca
- Realice ajustes previos a la adquisición sintonizando la bobina de la jaula de pájaros de radiofrecuencia (RF) en una frecuencia de resonancia de 1 hidrógeno (1 H).
- A continuación, ajuste el campo magnético lo más homogéneo posible mediante el procedimiento de calzado automático.
NOTA: El calzado computarizado se realiza mediante el llamado método de afinación, que utiliza el área bajo el FID de 1 H como parámetro de calidad. En este procedimiento de ajuste, se examina un grupo de cuñas definido por el usuario (Z, Z2, X, Y, XZ e YZ) en un ciclo iterativo. Cada cuña en sucesión se ajusta individualmente para maximizar el área bajo el FID. Este es esencialmente un procedimiento lineal que funciona bien rápidamente. - Optimice el pulso de RF maximizando el perfil de imagen unidimensional con el ajuste de la potencia del pulso de RF.
- Asigne la posición exacta del corazón en el escáner mediante la realización de exploraciones con una secuencia de tres pilotos. Utilice una secuencia de eco de gradiente rápido para adquirir las imágenes de exploración a través del tórax: un corte transversal, coronal y sagital. (Figura 1A, B, C)
- Ajuste los ejes a los ejes reales de la vista axial, de dos cámaras y de cuatro cámaras (Figura 1D,E).
- A continuación, coloque los cortes de cine perpendiculares a un eje imaginario entre el tracto de salida del RV y la parte apical más extrema del RV.
- Derive de diez a once cortes de cine de 1 mm de grosor sin un espacio de corte para cubrir toda la imagen de arriba a la base del RV (Figura 1F) mediante el método de disparo rápido de ángulo bajo (FLASH) Self-gated IntraGate, que evita la necesidad de un electrocardiograma (ECG) y una compuerta respiratoria. Los parámetros de adquisición se muestran en la Tabla 1. Guarde las imágenes en formato DICOM.
- Realización de análisis de imágenes adquiridas
- Haga doble clic en el software para abrir el programa.
- Abra las imágenes en el software de posprocesamiento CMR mediante el botón de importación .
- Identifique la fase telesistólica (definida como la fase con la cavidad visualmente más pequeña del VD) y la fase diastólica final (definida como la fase con la cavidad del VD visualmente más grande).
- De acuerdo con las directrices de la Sociedad de Resonancia Magnética Cardiovascular49, dibuje los contornos epicárdicos manualmente al final de la diástole y al final de la sístole desde el ápice hasta la base, marcando varios puntos en el borde epicárdico de cada imagen. En el último punto, haga doble clic para completar el contorno epicárdico.
- Haz lo mismo con los contornos endocárdicos. (Figura 2). El VED, el VEF, la masa ED y la masa ES del ventrículo izquierdo y del ventrículo derecho ahora se calculan automáticamente mediante el software.
NOTA: La masa se define como el volumen miocárdico por la densidad miocárdica (es decir, 1,05). - Dependiendo de la pregunta de investigación y de la población objeto de estudio, se indexaron estas variables para el tamaño del sujeto mediante la longitud de la tibia o el peso corporal, de acuerdo con las fórmulas publicadas anteriormente50.
- Calcular el índice de excentricidad (IE) tanto en la diástole final como en la sístole final, dividiendo el diámetro de la cavidad del VI paralelo al tabique intraventricular (SIV) por el diámetro de la cavidad del VI perpendicular al SIV, derivado del eje corto a nivel papilar medio.
- El software calcula el volumen sistólico (SV) en mL como
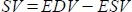 , y la fracción de eyección (EF, %) como
, y la fracción de eyección (EF, %) como 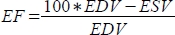 .
. - Calcule el gasto cardíaco (CO) en ml/min como
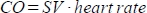 . La frecuencia cardíaca se mide manualmente mediante la almohadilla de presión incrustada en la cama del animal como se ha descrito anteriormente, ya que el escáner no puede registrar adecuadamente la frecuencia cardíaca alta y frecuente.
. La frecuencia cardíaca se mide manualmente mediante la almohadilla de presión incrustada en la cama del animal como se ha descrito anteriormente, ya que el escáner no puede registrar adecuadamente la frecuencia cardíaca alta y frecuente. - Dependiendo de la pregunta de investigación y de la población estudiada, se indexó el CO y el SV para el tamaño del sujeto por medio de la longitud de la tibia o el peso corporal, de acuerdo con las fórmulas previamente publicadas50.
5. Análisis estadístico
- Abra el software utilizado para la visualización de datos y el análisis estadístico.
- Ordene los datos por grupo (PAB y simulado) con cada grupo en una columna separada.
- Utilice la prueba de Mann-Whitney para comparar el PAB con el simulacro para cada variable.
Resultados
La tasa de mortalidad del procedimiento quirúrgico PAB es de alrededor del 10%. Los resultados presentados muestran características de los ratones en los grupos simulado (n = 5) y PAB (n = 8). Como se muestra en la Figura 3, los valores del gradiente de PAB aumentaron significativamente en comparación con los animales simulados a las 2 y 6 semanas después del PAB. Este aumento de la carga provocó la dilatación del VD expresada como un aumento del VD, e...
Discusión
Este protocolo proporciona un método reproducible para la PAB en ratones y la posterior evaluación de la remodelación cardíaca y la adaptación funcional mediante RMC.
El PAB se diferencia de otros modelos de aumento de la carga de presión RV porque implica un aumento absoluto y estático de la poscarga sin la presencia de otros desencadenantes. La carga de presión del VD en los modelos de hipoxia, monocrogalina, derivación o una combinación de estos i...
Divulgaciones
El Centro Médico Universitario de Groningen ha contratado a Actelion y Lilly para las actividades de consultoría de R.M.F. Berger fuera del contenido de este manuscrito. Los demás autores declaran que no tienen intereses contrapuestos.
Agradecimientos
Nos gustaría agradecer a P. Da Costa-Martins por su apoyo con los experimentos con animales en este estudio.
Materiales
| Name | Company | Catalog Number | Comments |
| 14.0 MHz i13L-echocardiography transducer | GE Healthcare, Waukesha, WI, USA | ||
| 20G cannula | |||
| 23G needle | |||
| 9.4T magnetic resonance scanner with 1,500 mT/m gradient set | Bruker BioSpin, Ellingen, Germany | ||
| Anesthesia induction chamber | |||
| Blunt 25G needle | |||
| Buprenorphine | |||
| Chloride-hexidine | |||
| CMR post-processing software | Medis Medical Imaging Systems, Leiden, The Netherlands | Qmass version 7.6 | |
| Data visualisation and statistical software | GraphPad Prism Inc, La Jolla, CA, USA | software version 7.02 | |
| Echocardiography machine | GE Healthcare, Waukesha, WI, USA | Vivid Dimension 7 | |
| Eye ointment | |||
| Heat mat | |||
| Incubator (37°C) | |||
| Isoflurane | |||
| Isoflurane evaporator | |||
| Miniventilator for rodents | Hugo Sachs | model 687 | |
| monofilament polypropylene 5-0 sutures | |||
| monofilament polypropylene 6-0 sutures | |||
| Needle and syringe for subcutaneous injections | |||
| Pediatric electrocardiogram-stickers | |||
| pure polyglycolic acid 5-0 sutures | |||
| Sterile surgical instruments | |||
| Ventilation mask |
Referencias
- Norozi, K., et al. Incidence and Risk Distribution of Heart Failure in Adolescents and Adults With Congenital Heart Disease After Cardiac Surgery. The American Journal of Cardiology. 97 (8), 1238-1243 (2006).
- Borgdorff, M. A. J., et al. Clinical symptoms of right ventricular failure in experimental chronic pressure load are associated with progressive diastolic dysfunction. Journal of Molecular and Cellular Cardiology. 79, 244-253 (2015).
- Koop, A. M. C., et al. Right ventricular pressure overload alters cardiac lipid composition. International Journal of Cardiology. , (2019).
- Faber, M. J., et al. Right and left ventricular function after chronic pulmonary artery banding in rats assessed with biventricular pressure-volume loops. American Journal of Physiology and Heart Circirculation Physiology. 291 (4), 1580-1586 (2006).
- Bogaard, H. J., et al. Chronic pulmonary artery pressure elevation is insufficient to explain right heart failure. Circulation. 120 (20), 1951-1960 (2009).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulmonary Circulation. 7 (3), 572-587 (2017).
- Rumsey, W. L., et al. Adaptation to hypoxia alters energy metabolism in rat heart. American Journal of Physiology Heart and Circulatory Physiology. 276 (1), 71-80 (1999).
- Drozd, K., et al. Effects of an endothelin receptor antagonist, Macitentan, on right ventricular substrate utilization and function in a Sugen 5416/hypoxia rat model of severe pulmonary arterial hypertension. Journal of Nuclear Cardiology. 24 (6), 1979-1989 (2017).
- Van Der Feen, D. E., et al. Shunt surgery, right heart catheterization, and vascular morphometry in a rat model for flow-induced pulmonary arterial hypertension. Journal of Visualized Experiments. (120), e55065 (2017).
- Gomez-Arroyo, J., et al. Metabolic gene remodeling and mitochondrial dysfunction in failing right ventricular hypertrophy secondary to pulmonary arterial hypertension. Circulation: Heart Failure. 6 (1), 136-144 (2013).
- Bruns, D. R., Dale Brown, R., Stenmark, K. R., Buttrick, P. M., Walker, L. A. Mitochondrial integrity in a neonatal bovine model of right ventricular dysfunction. American Journal of Physiology - Lung Cellular and Molecular Physiology. 308 (2), 158-167 (2015).
- Zhang, W. H., et al. Up-regulation of hexokinase1 in the right ventricle of monocrotaline induced pulmonary hypertension. Respiratory Research. 15 (1), 119 (2014).
- Paulin, R., et al. A miR-208-Mef2 axis drives the decompensation of right ventricular function in pulmonary hypertension. Circulation Research. 116 (1), 56-69 (2015).
- Sutendra, G., et al. A metabolic remodeling in right ventricular hypertrophy is associated with decreased angiogenesis and a transition from a compensated to a decompensated state in pulmonary hypertension. Journal of Molecular Medicine. 91 (11), 1315-1327 (2013).
- Balestra, G. M., et al. Increased in vivo mitochondrial oxygenation with right ventricular failure induced by pulmonary arterial hypertension: Mitochondrial inhibition as driver of cardiac failure. Respiratory Research. 16, 6 (2015).
- Piao, L., et al. The inhibition of pyruvate dehydrogenase kinase improves impaired cardiac function and electrical remodeling in two models of right ventricular hypertrophy: Resuscitating the hibernating right ventricle. Journal of Molecular Medicine. 88 (1), 47-60 (2010).
- Piao, L., et al. FOXO1-mediated upregulation of pyruvate dehydrogenase kinase-4 (PDK4) decreases glucose oxidation and impairs right ventricular function in pulmonary hypertension: therapeutic benefits of dichloroacetate. Journal of Molecular Medicine. 91, 333-346 (2013).
- Sheikh, A. M., et al. Right ventricular hypertrophy with early dysfunction: A proteomics study in a neonatal model. Journal of Thoracic and Cardiovascular Surgery. 137 (5), 1146-1153 (2009).
- Olivetti, G., et al. Cellular basis of wall remodeling in long-term pressure overload-induced right ventricular hypertrophy in rats. Circulation Research. 63 (3), 648-657 (1988).
- Lauva, I. K., et al. Control of myocardial tissue components and cardiocyte organelles in pressure-overload hypertrophy of the cat right ventricle. The American Journal of Anatomy. 177 (1), 71-80 (1986).
- Fang, Y. H., et al. Therapeutic inhibition of fatty acid oxidation in right ventricular hypertrophy: Exploiting Randle's cycle. Journal of Molecular Medicine. 90 (1), 31-43 (2012).
- Piao, L., et al. Cardiac glutaminolysis: A maladaptive cancer metabolism pathway in the right ventricle in pulmonary hypertension. Journal of Molecular Medicine. 91 (10), 1185-1197 (2013).
- Sack, M. N., Disch, D. L., Rockman, H. A., Kelly, D. P. A role for Sp and nuclear receptor transcription factors in a cardiac hypertrophic growth program. Proceedings of the National Academy of Sciences of the United States of America. 94 (12), 6438-6443 (1997).
- Broderick, T. L., King, T. M. Upregulation of GLUT-4 in right ventricle of rats with monocrotaline- induced pulmonary hypertension. Medical Science Monitor. 14 (12), 261-264 (2008).
- Enache, I., et al. Skeletal muscle mitochondrial dysfunction precedes right ventricular impairment in experimental pulmonary hypertension. Molecular and Cellular Biochemistry. 373 (1-2), 161-170 (2013).
- Sun, X. Q., et al. Reversal of right ventricular remodeling by dichloroacetate is related to inhibition of mitochondria-dependent apoptosis. Hypertension Research. 39 (5), 302-311 (2016).
- Adrogue, J. V., Sharma, S., Ngumbela, K., Essop, M. F., Taegtmeyer, H. Acclimatization to chronic hypobaric hypoxia is associated with a differential transcriptional profile between the right and left ventricle. Molecular and Cellular Biochemistry. 278 (1-2), 71-78 (2005).
- Sharma, S., et al. Dynamic changes of gene expression in hypoxia-induced right ventricular hypertrophy. American Journal of Physiology - Heart and Circulatory Physiology. 286 (3), 1185-1192 (2004).
- Nouette-Gaulain, K., et al. Time course of differential mitochondrial energy metabolism adaptation to chronic hypoxia in right and left ventricles. Cardiovascular Research. 66 (1), 132-140 (2005).
- Graham, B. B., et al. Severe pulmonary hypertension is associated with altered right ventricle metabolic substrate uptake. American Journal of Physiology - Lung Cellular and Molecular Physiology. 309 (5), 435-440 (2015).
- Liu, A., et al. Estrogen maintains mitochondrial content and function in the right ventricle of rats with pulmonary hypertension. Physiological Reports. 5 (6), 1-12 (2017).
- Kobr, J., et al. Right Ventricular Pressure Overload and Pathophysiology of Growing Porcine Biomodel. Pediatric Cardiology. 37 (8), 1498-1506 (2016).
- Yerebakan, C., et al. Acute and chronic response of the right ventricle to surgically induced pressure and volume overload - an analysis of pressure-volume relations. Interactive CardioVascular and Thoracic Surgery. 10 (4), 519-525 (2010).
- Gufler, H., et al. Right Ventricular Function After Pulmonary Artery Banding: Adaptive Processes Assessed by CMR and Conductance Catheter Measurements in Sheep. Journal of Cardiovascular Translational Research. 12 (5), 459-466 (2019).
- Baicu, C. F., et al. Time course of right ventricular pressure-overload induced myocardial fibrosis: relationship to changes in fibroblast postsynthetic procollagen processing. American Journal of Physiology-Heart and Circulatory Physiology. 303 (9), 1128-1134 (2012).
- Manohar, M., et al. Regional myocardial blood flow and coronary vascular reserve in unanesthetized young calves exposed to a simulated altitude of 3500 m for 8-10 weeks. Circulation Research. 50 (5), 714-726 (1982).
- Fávaro, G. A. G., et al. Reversible pulmonary trunk banding: VII. Stress echocardiographic assessment of rapid ventricular hypertrophy in young goats. Journal of Thoracic and Cardiovascular Surgery. 145 (5), 1345-1351 (2013).
- Nielsen, E. A., et al. Regional septal hinge-point injury contributes to adverse biventricular interactions in pulmonary hypertension. Physiological Reports. 5 (14), 1-13 (2017).
- Borgdorff, M. A., et al. Sildenafil enhances systolic adaptation, but does not prevent diastolic dysfunction, in the pressure-loaded right ventricle. European Journal of Heart Failure. 14 (9), 1067-1074 (2012).
- Gold, H., Prindle, K., Levey, G., Epstein, S. Effects of experimental heart failure on the capacity of glucagon to augment myocardial contractility and activate adenyl cyclase. The Journal of Clinical Investigation. 49 (5), 999-1006 (1970).
- Brittain, E. L., et al. Right ventricular plasticity and functional imaging. Pulmonary Circulation. 2 (3), 309-326 (2012).
- Jiang, L., et al. Three-dimensional Echocardiography In Vivo Validation for Right Ventricular Volume and Function. Circulation. 89, 2342-2350 (1994).
- Markiewicz, W., Sechtem, U., Higgins, C. B. Evaluation of the right ventricle by magnetic resonance imaging. American Heart Journal. 113 (1), 8-15 (1987).
- Pattynama, P. M. T., et al. Reproducibility of MRI-derived measurements of right ventricular volumes and myocardial mass. Magnetic Resonance Imaging. 13 (1), 53-63 (1995).
- Wiesmann, F., et al. Comparison of fast spiral, echo planar, and fast low-angle shot MRI for cardiac volumetry at .5T. Journal of Magnetic Resonance Imaging. 8 (5), 1033-1039 (1998).
- Van der Feen, D. E., et al. Multicenter Preclinical Validation of BET Inhibition for the Treatment of Pulmonary Arterial Hypertension. American Journal of Respiratory and Critical Care Medicine. 200 (7), 910-920 (2019).
- da Costa Martins, P. A., et al. MicroRNA-199b targets the nuclear kinase Dyrk1a in an auto-amplification loop promoting calcineurin/NFAT signalling. Nature Cell Biology. 12 (12), 1220-1227 (2010).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. Journal of Visualized Experiments. (84), e51041 (2014).
- Schulz-Menger, J., et al. Standardized image interpretation and post processing in cardiovascular magnetic resonance: Society for Cardiovascular Magnetic Resonance (SCMR) Board of Trustees Task Force on Standardized Post Processing. Journal of Cardiovascular Magnetic Resonance. 15 (1), 1-19 (2013).
- Hagdorn, Q. A. J., et al. A novel method optimizing the normalization of cardiac parameters in small animal models: The importance of dimensional indexing. American Journal of Physiology - Heart and Circulatory Physiology. 316 (6), 1552-1557 (2019).
- Scherrer-Crosbie, M., et al. Determination of Right Ventricular Structure and Function in Normoxic and Hypoxic Mice. Circulation. 98 (10), 1015-1021 (2012).
- Wiesmann, F., et al. Analysis of right ventricular function in healthy mice and a murine model of heart failure by in vivo MRI. American Journal of Physiology-Heart and Circulatory Physiology. 283 (3), 1065-1071 (2002).
- Lu, X., et al. Accuracy and Reproducibility of Real-Time Three-Dimensional Echocardiography for Assessment of Right Ventricular Volumes and Ejection Fraction in Children. Journal of the American Society of Echocardiography. 21 (1), 84-89 (2008).
- Soriano, B. D., et al. Matrix-array 3-dimensional echocardiographic assessment of volumes, mass, and ejection fraction in young pediatric patients with a functional single ventricle: A comparison study with cardiac magnetic resonance. Circulation. 117 (14), 1842-1848 (2008).
- Damy, T., et al. Prevalence of, associations with, and prognostic value of tricuspid annular plane systolic excursion (TAPSE) among out-patients referred for the evaluation of heart failure. Journal of Cardiac Failure. 18 (3), 216-225 (2012).
- Kowalik, E., Kowalski, M., Rózański, J., Kuśmierczyk, M., Hoffman, P. The impact of pulmonary regurgitation on right ventricular regional myocardial function: An echocardiographic study in adults after total repair of tetralogy of fallot. Journal of the American Society of Echocardiography. 24 (11), 1199-1204 (2011).
- Koestenberger, M., et al. Systolic right ventricular function in pediatric and adolescent patients with tetralogy of Fallot: Echocardiography versus magnetic resonance imaging. Journal of the American Society of Echocardiography. 24 (1), 45-52 (2011).
- Bovens, S. M., et al. Evaluation of infarcted murine heart function: Comparison of prospectively triggered with self-gated MRI. NMR in Biomedicine. 24 (3), 307-315 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados