Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Pulmoner Arter Bantlı Farelerde Kardiyak Manyetik Rezonans Görüntüleme ile Biventriküler Fonksiyon ve Morfolojinin Ölçülmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Sağ ventrikülün (RV) anormal yüklenmeye adaptasyonunun patofizyolojisini anlamak için deneysel modeller çok önemlidir. Bununla birlikte, RV boyutlarının ve işlevinin değerlendirilmesi karmaşık ve zordur. Bu protokol, RV basınç yüküne maruz kalan farelerde noninvaziv bir kıyaslama prosedürü olarak kardiyak manyetik rezonans görüntüleme (CMR) gerçekleştirmek için bir yöntem sağlar.
Özet
Sağ ventrikül (RV) fonksiyonu ve yetmezliği, pulmoner hipertansiyon da dahil olmak üzere edinsel ve konjenital kalp hastalıklarında prognozun majör belirleyicileridir. RV fonksiyonunun ve morfolojisinin değerlendirilmesi, kısmen RV'nin karmaşık şekli nedeniyle karmaşıktır. Şu anda, kardiyak manyetik rezonans (CMR) görüntüleme, RV fonksiyonu ve morfolojisinin noninvaziv değerlendirmesi için altın standarttır. Mevcut protokol, pulmoner arter bantlaması (PAB) tarafından indüklenen RV basınç yükünün bir fare modelinde CMR görüntülemeyi tanımlar. PAB, 23 G'lik bir iğne üzerine pulmoner arter etrafına 6-0 şeklinde dikiş atılması ile gerçekleştirilir. PAB gradyanı 2. ve 6. haftalarda ekokardiyografi kullanılarak belirlenir. 6. haftada, sağ ve sol ventrikül morfolojisi ve fonksiyonu, 1.500 mT / m gradyan ile donatılmış 9.4 T manyetik rezonans görüntüleme tarayıcısı kullanılarak 1 mm kalınlığında on ila on bir sina dilimi ile hem sistolik hem de diyastol sonu hacimler ve kütle ölçülerek değerlendirilir. Temsili sonuçlar, PAB'nin biventriküler morfoloji ve RV fonksiyonu üzerinde önemli etkileri olan RV basınç yükünde önemli bir artışa neden olduğunu göstermektedir. Ayrıca 6 haftalık RV basınç yükünde kardiyak debinin korunduğu gösterilmiştir. Burada sunulan, RV basınç yükünün bir fare modelinde biventriküler morfolojinin ve fonksiyonun ölçülmesi için tekrarlanabilir bir protokoldür ve RV yeniden şekillenmesi ve disfonksiyonunun belirleyicilerini araştıran deneyler için bir yöntem olarak hizmet edebilir.
Giriş
Pulmoner hipertansiyon (PH) dahil olmak üzere edinsel ve konjenital kardiyovasküler hastalıkları olan hastalar sağ ventrikül (RV) disfonksiyonu ve yetmezliği riski altındadır1. Artmış basınç yükünün bir sonucu olarak RV adaptasyonu, erken evrelerde konsantrik hipertrofi ve son evre hastalıkta ilerleyici dilatasyon ile karakterizedir. Ayrıca, metabolizma ve hücre dışı matriksteki bozukluklar, iltihaplanma süreçleri ve nihayetinde RV yetmezliği 2,3,4,5,6 ile ilişkilidir. RV başarısızlığına doğru ilerlemenin altında yatan süreçleri keşfetmek için hayvan modelleri geliştirilmiştir. Bununla birlikte, modellerin optimizasyonu ve RV fonksiyonunun ve boyutlarının yeterli şekilde değerlendirilmesi zor olmuştur. RV fonksiyonunun ve boyutlarının noninvaziv değerlendirilmesi için kardiyak manyetik rezonans (CMR) görüntüleme altın standarttır. Bu teknik, güçlü bir manyetik alan ve radyofrekans dalgaları kullanarak atan kalbin görüntülerini oluşturur. CMR, insanlar ve laboratuvar kemirgenleri gibi hayvanlar için kullanılabilir. İkincisi, kalbin daha küçük boyutu nedeniyle daha yüksek uzamsal çözünürlük gerektirdiğinden, yeterli görüntüleri sağlamak için gereken manyetik alanın insanlara kıyasla daha yüksek olması gerekir.
PH 7,8,9,10,11,12,13,14,15,16,17 modelleri ve proksimal RV basınç yükü 2,3,10,18 modelleri dahil olmak üzere RV basınç aşırı yüklenmesini taklit eden birden fazla model mevcuttur, 19,20,21,22,23. Bir PH modelinin veya bir proksimal RV basınç yükü modelinin seçimi araştırma sorusuna bağlıdır: bir müdahalenin pulmoner vaskülatür üzerindeki etkisi ve dolayısıyla muhtemelen RV art yük modülasyonu (yani, PH modelleri) veya RV üzerindeki doğrudan etkisi (yani, proksimal RV basınç yükü modelleri). Monokrotalin (MCT) kullanımı dahil olmak üzere PH'ın deneysel indüksiyonu için çeşitli yöntemler mevcuttur.12,13,14,16,22,24,25,26, aortocaval şant 9 ile kombine MCT, kronik hipoksi 7,27,28,29 ve vasküler endotelyal büyüme faktörü reseptör antagonisti Sugen 5416'nın kronik hipoksi 8,10,30,31 ile kombinasyonu. Bu tür modeller, proksimal RV basınç yükünün ilerleyici pulmoner modellerini temsil eder ve pulmoner vaskülatürü hedef almaz, ancak pulmoner arterin daralması yoluyla sabit bir art yük indükler ve buna eşlik eden RV art yükü 2,3 artar. Bu, bir dikiş bantlama (pulmoner arter bantlama, PAB) veya pulmoner arter etrafında vasküler bir klips ile gerçekleştirilebilir. PAB çeşitli hayvan türlerinde gerçekleştirilmiştir ve kardiyak boyutlar ve fonksiyon, histoloji, transtorasik ekokardiyografi (benek takibi dahil) ve kalp kateterizasyonu gibi çeşitli şekillerde incelenmiştir 2,32,33,34,35,36,37,38,39,40 . Fareler gibi küçük kemirgenlerde PAB zordur. Bunun nedeni, arter daralmasının sıkılığı arasındaki ince farklılıkların, RV basınç yükünün derecesi ve müteakip fonksiyonel durum ve sağkalım üzerinde belirgin sonuçlara sahip olmasıdır. Daralma çok sıkı olduğunda, hayvan operasyon sırasında veya kısa bir süre sonra ölecek, daralma yeterince sıkı olmadığında istenen fenotip elde edilmeyecektir. Bununla birlikte, farelerin kullanımı, mükemmel genetik modifikasyon olasılıkları (yani, transgenik veya nakavt modelleri) ve hızlı üreme nedeniyle diğer hayvanlara kıyasla avantajlara sahiptir. Bu, hastalıkların incelenmesinde ve moleküler ve (epi-) genetik faktörlerin katkısının araştırılmasında katma değerlidir.
Hayvan çalışma tasarımları, hastalık 2,3,8,13,21 sırasındaki zamansal değişikliklerin araştırılmasına doğru kaymaktadır. Bu tür çalışmalar için noninvaziv modaliteler gereklidir, çünkü seri değerlendirmeler yapılabilir. Kardiyak yeniden şekillenmenin değerlendirilmesinde CMR'ye alternatifler, (1) farklı zaman noktalarında birden fazla hayvanın safide edildiği histopatoloji kullanılarak doku karakterizasyonu, (2) basınç-hacim analizi ile invaziv fonksiyonel değerlendirme veya (3) araştırmacının aynı hayvan içinde invaziv olmayan bir şekilde kardiyak hipertrofiyi veya dilatasyonu tanımlamasına olanak tanıyan ekokardiyografi olabilir. CMR'nin RV'nin değerlendirilmesinde iki önemli avantajı vardır: (1) CMR, bir hayvanda seri ölçümleri mümkün kılan noninvaziv bir modalitedir, bu nedenle çalışmalar için gereken hayvan sayısının azaltılmasına katkıda bulunur ve (2) CMR belirli bir geometrik şekle dayanmaz ve üç boyutlu olarak görselleştirir. CMR'den türetilen RV hacimlerinin ve fonksiyon ölçümlerinin doğru olduğu gösterilmiştir ve insanlarda farklı kardiyak varlıklarda invaziv olmayan altın standart olarak kabul edilmiştir 42,43,44,45, ancak henüz RV basıncı aşırı yüklenmesi olan fareler için bir CMR protokolüne çevrilmemiştir.
Literatürde birçok PAB modeli tanımlanmıştır, ancak hemodinamik etkileri ve RV fonksiyonunu ve adaptasyonunu değerlendirme yöntemlerinde yüksek heterojenliğe sahiptir. Bu protokol, ekokardiyografi ile PAB gradyanını ölçerek ve CMR ile kardiyak boyutları ve fonksiyonu değerlendirerek modelin doğrulanması ile farelerde PAB prosedürünü ana hatlarıyla belirtir. Sıçanlar için PAB'a maruz kalan hayvanlarda bir CMR protokolü yayınlanmış olsa da, bu kombinasyon şimdiye kadar fareler için tarif edilmemiştir. Sıçanlar en yaygın olarakPH modelleri 8,12,13,14,15,16,22,24,25,26,27,28,29,30,31,46 için kullanılırken , fareler çoğunlukla transgenik veya nakavt çalışmaları için kullanılır ve bu nedenle basınç yüklü RV arızasındaki mekanizmaları anlamamıza katkıda bulunur. Bu protokol, RV arızasına geçişte yer alan sinyal yollarını çözmek için gelecekteki çalışmaların temelini oluşturabilir.
Protokol
Tüm deneyler ve hayvan bakımı, Hollanda Hayvan Deney Yasası'na göre yürütülür ve ABD Ulusal Sağlık Enstitüleri tarafından yayınlanan Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na uygundur. Hollanda Groningen Üniversitesi Hayvan Deneyleri Komitesi, mevcut deney protokolünü onayladı (izin numarası: 2014-041/3005).
1. Konut ve iklimlendirme
- 20-30 g vahşi tip C57 siyah 6 (C57BL/6) fareler (daha öncetanımlanan 47 kurumsal üreme hattı), erkek ve dişi, tümü 8 haftalıktan daha eski kullanın. Fareleri kafes başına en fazla beş olacak şekilde gruplar halinde barındırın. İnsan kullanımına alışmak için farelerin en az 7 gün iklime alışmasına izin verin. Bu süre zarfında herhangi bir işlem yapmayın.
2. Pulmoner arter bantlama ameliyatı
- Hazırlık
- Fareyi %5 izofluran/%100 oksijenle doldurulmuş indüksiyon odasına yerleştirin. Bir ağrı uyaranı vererek (yani ayak parmağını çimdikleyerek) refleks eksikliğini kontrol edin.
- Elektrikli tıraş makinesi kullanarak farenin sol hemitoraksını tıraş edin.
- Dili nazikçe dışarı çekin ve hafif bir gerginlikle tutun.
- Dış boğazın üzerine glottis hizasında bir ışık kaynağı yerleştirerek iç boğazı aydınlatın.
- Fareyi 20 G esnek bir kanül ile endotrakeal olarak entübe edin.
- Hayvanı bir ısı matı üzerine sağ tarafına yerleştirin (sıcaklığı 37 °C'ye ayarlayın).
- Kanülü miniventilatöre bağlayın ve %1,5 – %2,5 izofluran/oksijen (180 nefes/dk, tidal 250 μL) ile ventilasyona başlayın.
- Postoperatif analjezi için deri altına 0.1 mg / kg buprenorfin enjekte edin.
- Göz merhemi kullanarak gözün susuz kalmasını önleyin.
- Sol lateral torakotomi ile pulmoner arter bantlama ameliyatı
- Sağ ön bacağını nötr bir pozisyona getirerek, sağ arka bacağını uzatarak ve sol ön ayağı geriye doğru bükerek fareyi sağ tarafına yerleştirin.
- Göğüs kafesindeki cildi klorür-heksidin ile dezenfekte edin, 2x sürüntü ile dezenfekte edin.
- Ameliyat için steril aletler kullanın. Cildi küçük bir makasla (yuvarlak saplı, 12 mm'lik bıçaklar) sol koltuk altından ikinci ve üçüncü kaburgaya paralel olarak açın.
- M. pectoralis superficialis (eğik, yüzeysel kas) ve m. pectoralis profundus'u (eğik, altta yatan kas) tanımlayın.
- Sütür halkalarını kullanarak, m. pectoralis superficialis'i ventral tarafa doğru ve m. pectoralis profundus'u farenin dorsal tarafına doğru çekin.
- İkinci interkostal boşluğu açın ve uyarlanmış ataşlar kullanarak kaburgaları açın, sol kalp kulağın, sol akciğerin ve pulmoner arterin görünür hale gelmesine izin verin.
- Arteriya pulmonalis'i aorttan ayırın. 6-0 sütür içeren künt 25 G'lik bir iğne ile pulmoner arterin etrafına bir dikiş halkası yerleştirin ve arteria pulmonalis etrafına bir lose 2-1-1 ligatürü yerleştirin.
- 6-0 sütürün içine arteria pulmonalis'e paralel 23 G'lik bir iğne yerleştirin ve önce en proksimal sütür düğümünü ve ardından 2-1-1 sütürün distal düğümünü sabitleyin. 23 G iğneyi çıkarın. Düğümün yeterli olduğundan emin olun.
- Monofilament polipropilen 5-0 sütür ile göğüs kafesi iki veya üç ayrı dikişle kapatın. M. pectoralis superficalis ve m. pectoralis profundus'u serbest bırakın.
- Cildi saf poliglikolik asit 5-0 sütür ile dikin. Dokuda yara izi oluşumunu en aza indirmek için sürekli bir dikiş tekniği kullanın; Yara dokusu ekokardiyografinin görüntü kalitesini etkileyecektir.
- Anesteziden iyileşme sırasında oksijenle ventilasyona devam ederken, fare karın hareketinden görülebileceği gibi kendi spontan solunumunu geri kazanana kadar izofluranı kapatın.
- Endotrakeal tüpü ventilatörden ayırın. Spontan solunumu kontrol edin, sadece spontan solunum hareketi görünür olduğunda ekstübe edin. Spontan solunum görülmediğinde, tüpü tekrar ventilatöre bağlayın ve adım 2.2.12'ye dönün.
- Bilincini geri kazanana kadar fareyi gözlemleyin.
- Sahte cerrahi
- Şeritleme hariç yukarıdaki prosedürü uygulayın (adım 2.2.2–2.2.6).
- Ameliyat sonrası dönem
- Fareyi ayrı ayrı 24 saat boyunca bir inkübatörde (37 ° C) saklayın.
- Ameliyat sonrası ilk 3 gün boyunca fareyi günlük olarak gözlemleyin. Herhangi bir rahatsızlık belirtisi durumunda, postoperatif analjezi için günde 2 kez deri altına 0.1 mg / kg buprenorfin enjekte edin.
3. Ekokardiyografi
- Hazırlık
- PAB ameliyatından 14 gün sonra ekokardiyografi ile PAB gradyan analizi yapın.
- Ekokardiyografi cihazını başlatın. Kardiyak paketi ve 14.0 MHz dönüştürücüyü seçin.
- Anestezi
- Fareyi% 5 izofluran ve% 100 oksijen karışımı ile doldurulmuş indüksiyon odasına yerleştirin.
- Farenin göğüs kafesini tıraş edin.
- Fareyi ısı matının üzerine (sıcaklık 37 °C) sırt üstü yerleştirin ve burnunu havalandırma maskesine yerleştirin.
- %1,5 ila %2,5 izofluran ve %100 oksijen (0,15 L/dk) ve oda havası (0,3 L/dk) karışımı ile havalandırın.
- Ayak parmağınızı kıstırarak anestezinin derinliğini kontrol edin ve anesteziyi buna göre ayarlayın.
- Göz merhemi kullanarak gözün susuz kalmasını önleyin.
- Ekokardiyografi ile PAB gradientinin belirlenmesi
- Pediatrik elektrokardiyogram etiketlerini her bir ön bacağa ve her iki arka bacağa bir tane yerleştirin. Hayvanı tutmak için çıkartmaları kullanın.
- Farenin göğüs kafesinin traşlı kısmına ultrason jeli uygulayın.
- Pulmoner arterin görüntülerini elde etmek için iki görünüm kullanılabilir: parasternal uzun eksen (PLAX) veya parasternal kısa eksen (PSAX) görünümü. Her ikisini de elde edin ve analiz için en kaliteli ölçümleri ve en yüksek hızları veren görünümü kullanın.
- PLAX ve PSAX görünümleri elde edin.
- Kan akışını görselleştirmek için renkli Doppler düğmesine basın.
- PLAX elde etmek için ultrason probunu parasternal çizgiye 30°'lik bir açıyla yerleştirin (ayrıntılı açıklama için bkz. Cheng, et al.48), çıkan aortu görselleştirin.
- Probu minimal olarak sola doğru süpürün, böylece çıkan aort pulmoner arterin arkasında kaybolur. Uygun PLAX, pulmoner arter görüntülendiğinde ve kan dikey olarak akarken tanımlanır.
- İmleci pulmoner arter ile aynı hizaya getirin. Üç kardiyak döngü sırasında hız zaman integrali ölçümleri elde etmek için sürekli dalga (CW) Doppler düğmesine basın. Kaydet'e basın.
- PSAX'ı elde etmek için probu PLAX'tan saat yönünde 90° döndürün, ardından PSAX'ı aort seviyesinde elde etmek için probu hafifçe kraniyal / ventral yöne doğru eğin. RV çıkış yolu aort ile prob arasında yer alıyorsa uygun PSAX görünümü tanımlanır. Bu, pulmoner arterde devam eder ve kan dikey olarak akar. Ayrıntılı bir açıklama için bakınız Cheng ve ark.48
- İmleci pulmoner arter ile aynı hizaya getirin. Üç kardiyak döngü sırasında hız zaman integrali ölçümleri elde etmek için sürekli dalga (CW) Doppler düğmesine basın. Kaydet'e basın.
- En iyi görünümün (PSAX veya PLAX) üç maksimum hızını ölçün ve ortalamayı hesaplayın. PAB gradyanını milimetre cıva (mmHg) cinsinden türetmek için basitleştirilmiş Bernoulli ilkesini kullanın.
4. Kardiyak manyetik rezonans görüntüleme
- Hazırlık
- PAB ameliyatından 6 hafta sonra (yani 42 gün) CMR analizi yapın.
NOT: Ek olarak, araştırma sorusuna bağlı olarak birden fazla zaman noktası dahil edileceğinde, PAB ameliyatından sonra daha erken zaman noktaları seçilebilir. Daha sonraki zaman noktaları düşünülebilir; bununla birlikte, RV arızası ve ölüm giderek daha fazla ortaya çıkabilir. - Yeterince güçlü bir mıknatıs kullanın (tipik olarak, kemirgen CMR taraması için >7 T kullanılır). Mevcut protokol için, 1.500 mT/m gradyan setine ve 89 mm delik boyutuna sahip 9,4 T dikey sistem kullanılmaktadır.
- Türetilmiş görüntülerdeki hacimleri ve kütleleri analiz etmek için CMR son işleme yazılımını yükleyin. Yazılım, diyastol sonu (ED) ve sistolik (ES) sonu (ES) hacimleri (sırasıyla EDV ve ESV) ve ventriküler kütleyi (hem ED hem de ES'yi ölçen) belirlemek için manuel segmentasyona izin veriyorsa uygun kabul edilir.
- PAB ameliyatından 6 hafta sonra (yani 42 gün) CMR analizi yapın.
- Anestezi ve fiksasyon
- Fareyi% 5 izofluran ve% 100 oksijen karışımı ile doldurulmuş indüksiyon odasına yerleştirin. Bir ayak parmağı tutamıyla bir ağrı uyarısı vererek anestezinin etkisini doğrulayın.
- Tarama sırasında nemli kalmaları için farenin gözlerine göz merhemi sürün.
- Fareyi, entegre hava beslemesi, %1,5 ila %2,5 izofluran, %100 oksijen (0,15 L/dk) ve oda havası (0,3 L/dk) karışımı ve tarama sırasında kalp atış hızının (400-500 bpm'yi hedefleyin) ve solunum hızının (dakikada ~35 nefesi hedefleyin) gözlemlemesini sağlayan bir baskı pedi ile tarayıcının hayvan yatağına yerleştirin. Anesteziyi bu iki parametreye göre düzenleyin. Yatağın herhangi bir manyetik malzeme olmadan plastikten yapıldığından emin olun.
- Hayvan yatağını fare ile tarayıcıya yerleştirin.
- Kardiyak manyetik rezonans görüntüleme yapılması
- Radyo frekansı (RF) kuş kafesi bobinini 1 Hidrojen (1 H) rezonans frekansına ayarlayarak ön çekim ayarlamaları yapın.
- Ardından, otomatik şimleme prosedürünü kullanarak manyetik alanı mümkün olduğunca homojen hale getirin.
NOT: Bilgisayarlı şimleme, 1 H FID'nin altındaki alanı kalite parametresi olarak kullanan Ayarlama yöntemi ile yapılır. Bu Ayarlama prosedüründe, kullanıcı tanımlı bir dolgu grubu (Z, Z2, X, Y, XZ ve YZ) yinelemeli bir döngüde incelenir. Art arda her şim, FID altındaki alanı en üst düzeye çıkarmak için ayrı ayrı ayarlanır. Bu esasen hızlı bir şekilde iyi çalışan doğrusal bir prosedürdür. - RF darbe gücünün ayarlanmasıyla tek boyutlu görüntü profilini en üst düzeye çıkararak RF darbesini optimize edin.
- Üç pilotlu bir dizi kullanarak keşif taramaları yaparak tarayıcıdaki kalbin tam konumunu atayın. Göğüs kafesinden izci görüntülerini elde etmek için hızlı bir gradyan yankı dizisi kullanın: enine, koronal ve sagital bir dilim. (Şekil 1A,B,C)
- Eksenleri eksenel, iki odacıklı ve dört odacıklı görünümün gerçek eksenlerine ayarlayın (Şekil 1D,E).
- Daha sonra, sine dilimlerini RV çıkış yolu ile RV'nin en apikal kısmı arasındaki hayali bir eksene dik olarak konumlandırın.
- Elektrokardiyogram (EKG) ve solunum kapısı ihtiyacını ortadan kaldıran Kendinden Kapılı IntraGate hızlı düşük açılı çekim (FLASH) yöntemi ile RV'nin (Şekil 1F) yukarıdan tabana görüntülemesinin tamamını kaplamak için dilim boşluğu olmadan on ila on bir 1 mm kalınlığında sine dilimleri türetin. Edinme parametreleri Tablo 1'de gösterilmektedir. Görüntüleri DICOM formatında kaydedin.
- Elde edilen görüntüler üzerinde analizler yapılması
- Programı açmak için yazılıma çift tıklayın.
- İçe aktar düğmesini kullanarak görüntüleri CMR son işleme yazılımında açın.
- Sistolik sonu fazı (görsel olarak en küçük RV boşluğuna sahip faz olarak tanımlanır) ve diyastol sonu fazı (görsel olarak en büyük RV boşluğuna sahip faz olarak tanımlanır) tanımlayın.
- Kardiyovasküler Manyetik RezonansDerneği 49'un yönergelerine göre, her görüntünün epikardiyal sınırında birkaç noktayı işaretleyerek epikardiyal konturları diyastol sonu ve sistol sonunda apeksten tabana manuel olarak çizin. Son noktada, epikardiyal konturu tamamlamak için çift tıklayın.
- Endokardiyal konturlar için de aynısını yapın. (Şekil 2). Sol ventrikül ve sağ ventrikül EDV, ESV, ED kütlesi ve ES kütlesi artık yazılım tarafından otomatik olarak hesaplanmaktadır.
NOT: Kütle, miyokard hacmi çarpı miyokard yoğunluğu (yani 1.05) olarak tanımlanır. - Araştırma sorusuna ve incelenen popülasyona bağlı olarak, daha önce yayınlanmış formülleregöre 50 tibia uzunluğu veya vücut ağırlığı aracılığıyla denek büyüklüğü için bu değişkenleri indeksleyin.
- İntraventriküler septuma (IVS) paralel LV boşluğunun çapını, orta papiller seviyedeki kısa eksenden türetilen IVS'ye dik LV boşluğunun çapına bölerek hem diyastol sonu hem de sistol sonunda eksantriklik indeksini (EI) hesaplayın.
- Yazılım, strok hacmini (SV) mL cinsinden
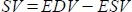 ve ejeksiyon fraksiyonunu (EF, %) olarak
ve ejeksiyon fraksiyonunu (EF, %) olarak 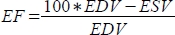 hesaplar.
hesaplar. - Kardiyak çıktıyı (CO) ml/dak cinsinden şu şekilde
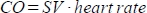 hesaplayın: . Kalp atış hızı, yukarıda açıklandığı gibi hayvan yatağına gömülü basınç pedi tarafından manuel olarak ölçülür, çünkü tarayıcı yüksek sıklıkta kalp atış hızını yeterince kaydedemez.
hesaplayın: . Kalp atış hızı, yukarıda açıklandığı gibi hayvan yatağına gömülü basınç pedi tarafından manuel olarak ölçülür, çünkü tarayıcı yüksek sıklıkta kalp atış hızını yeterince kaydedemez. - Araştırma sorusuna ve incelenen popülasyona bağlı olarak, daha önce yayınlanmış formüllere50 göre, tibia uzunluğu veya vücut ağırlığı aracılığıyla denek büyüklüğü için CO ve SV'yi indeksleyin.
5. İstatistiksel analizler
- Veri görselleştirme ve istatistiksel analizler için kullanılan yazılımı açın.
- Verileri grup başına (PAB ve sahte) her grup ayrı bir sütunda olacak şekilde sıralayın.
- Her değişken için PAB ile sahtekarlığı karşılaştırmak için Mann-Whitney testini kullanın.
Sonuçlar
PAB cerrahi işleminin mortalite oranı %10 civarındadır. Sunulan sonuçlar, sahte (n = 5) ve PAB (n = 8) gruplarındaki farelerin özelliklerini göstermektedir. Şekil 3'te gösterildiği gibi, PAB gradyan değerleri, PAB'den 2 ve 6 hafta sonra sahte hayvanlara kıyasla önemli ölçüde artmıştır. Bu yükleme artışı, artmış RV, EDV ve RV ESV olarak ifade edilen RV dilatasyonuna neden olmuştur (Şekil 4A,B
Tartışmalar
Bu protokol, farelerde PAB için tekrarlanabilir bir yöntem ve daha sonra CMR kullanılarak kardiyak yeniden şekillenme ve fonksiyonel adaptasyonun değerlendirilmesini sağlar.
PAB, artan RV basınç yükünün diğer modellerinden farklıdır, çünkü diğer tetikleyicilerin varlığı olmadan art yükün mutlak ve statik artışını içerir. Hipoksi, monokrotalin, şant veya bu indükleyicilerin bir kombinasyonu modellerinde RV basınç yükü, pulmoner...
Açıklamalar
Groningen Üniversitesi Tıp Merkezi, bu makalenin içeriği dışında R.M.F. Berger'in danışmanlık faaliyetleri için Actelion ve Lilly ile sözleşme yapmıştır. Diğer yazarlar çatışan çıkarları olmadığını beyan ederler.
Teşekkürler
Bu çalışmada yer alan hayvan deneylerine verdiği destek için P. Da Costa-Martins'e teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 14.0 MHz i13L-echocardiography transducer | GE Healthcare, Waukesha, WI, USA | ||
| 20G cannula | |||
| 23G needle | |||
| 9.4T magnetic resonance scanner with 1,500 mT/m gradient set | Bruker BioSpin, Ellingen, Germany | ||
| Anesthesia induction chamber | |||
| Blunt 25G needle | |||
| Buprenorphine | |||
| Chloride-hexidine | |||
| CMR post-processing software | Medis Medical Imaging Systems, Leiden, The Netherlands | Qmass version 7.6 | |
| Data visualisation and statistical software | GraphPad Prism Inc, La Jolla, CA, USA | software version 7.02 | |
| Echocardiography machine | GE Healthcare, Waukesha, WI, USA | Vivid Dimension 7 | |
| Eye ointment | |||
| Heat mat | |||
| Incubator (37°C) | |||
| Isoflurane | |||
| Isoflurane evaporator | |||
| Miniventilator for rodents | Hugo Sachs | model 687 | |
| monofilament polypropylene 5-0 sutures | |||
| monofilament polypropylene 6-0 sutures | |||
| Needle and syringe for subcutaneous injections | |||
| Pediatric electrocardiogram-stickers | |||
| pure polyglycolic acid 5-0 sutures | |||
| Sterile surgical instruments | |||
| Ventilation mask |
Referanslar
- Norozi, K., et al. Incidence and Risk Distribution of Heart Failure in Adolescents and Adults With Congenital Heart Disease After Cardiac Surgery. The American Journal of Cardiology. 97 (8), 1238-1243 (2006).
- Borgdorff, M. A. J., et al. Clinical symptoms of right ventricular failure in experimental chronic pressure load are associated with progressive diastolic dysfunction. Journal of Molecular and Cellular Cardiology. 79, 244-253 (2015).
- Koop, A. M. C., et al. Right ventricular pressure overload alters cardiac lipid composition. International Journal of Cardiology. , (2019).
- Faber, M. J., et al. Right and left ventricular function after chronic pulmonary artery banding in rats assessed with biventricular pressure-volume loops. American Journal of Physiology and Heart Circirculation Physiology. 291 (4), 1580-1586 (2006).
- Bogaard, H. J., et al. Chronic pulmonary artery pressure elevation is insufficient to explain right heart failure. Circulation. 120 (20), 1951-1960 (2009).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulmonary Circulation. 7 (3), 572-587 (2017).
- Rumsey, W. L., et al. Adaptation to hypoxia alters energy metabolism in rat heart. American Journal of Physiology Heart and Circulatory Physiology. 276 (1), 71-80 (1999).
- Drozd, K., et al. Effects of an endothelin receptor antagonist, Macitentan, on right ventricular substrate utilization and function in a Sugen 5416/hypoxia rat model of severe pulmonary arterial hypertension. Journal of Nuclear Cardiology. 24 (6), 1979-1989 (2017).
- Van Der Feen, D. E., et al. Shunt surgery, right heart catheterization, and vascular morphometry in a rat model for flow-induced pulmonary arterial hypertension. Journal of Visualized Experiments. (120), e55065 (2017).
- Gomez-Arroyo, J., et al. Metabolic gene remodeling and mitochondrial dysfunction in failing right ventricular hypertrophy secondary to pulmonary arterial hypertension. Circulation: Heart Failure. 6 (1), 136-144 (2013).
- Bruns, D. R., Dale Brown, R., Stenmark, K. R., Buttrick, P. M., Walker, L. A. Mitochondrial integrity in a neonatal bovine model of right ventricular dysfunction. American Journal of Physiology - Lung Cellular and Molecular Physiology. 308 (2), 158-167 (2015).
- Zhang, W. H., et al. Up-regulation of hexokinase1 in the right ventricle of monocrotaline induced pulmonary hypertension. Respiratory Research. 15 (1), 119 (2014).
- Paulin, R., et al. A miR-208-Mef2 axis drives the decompensation of right ventricular function in pulmonary hypertension. Circulation Research. 116 (1), 56-69 (2015).
- Sutendra, G., et al. A metabolic remodeling in right ventricular hypertrophy is associated with decreased angiogenesis and a transition from a compensated to a decompensated state in pulmonary hypertension. Journal of Molecular Medicine. 91 (11), 1315-1327 (2013).
- Balestra, G. M., et al. Increased in vivo mitochondrial oxygenation with right ventricular failure induced by pulmonary arterial hypertension: Mitochondrial inhibition as driver of cardiac failure. Respiratory Research. 16, 6 (2015).
- Piao, L., et al. The inhibition of pyruvate dehydrogenase kinase improves impaired cardiac function and electrical remodeling in two models of right ventricular hypertrophy: Resuscitating the hibernating right ventricle. Journal of Molecular Medicine. 88 (1), 47-60 (2010).
- Piao, L., et al. FOXO1-mediated upregulation of pyruvate dehydrogenase kinase-4 (PDK4) decreases glucose oxidation and impairs right ventricular function in pulmonary hypertension: therapeutic benefits of dichloroacetate. Journal of Molecular Medicine. 91, 333-346 (2013).
- Sheikh, A. M., et al. Right ventricular hypertrophy with early dysfunction: A proteomics study in a neonatal model. Journal of Thoracic and Cardiovascular Surgery. 137 (5), 1146-1153 (2009).
- Olivetti, G., et al. Cellular basis of wall remodeling in long-term pressure overload-induced right ventricular hypertrophy in rats. Circulation Research. 63 (3), 648-657 (1988).
- Lauva, I. K., et al. Control of myocardial tissue components and cardiocyte organelles in pressure-overload hypertrophy of the cat right ventricle. The American Journal of Anatomy. 177 (1), 71-80 (1986).
- Fang, Y. H., et al. Therapeutic inhibition of fatty acid oxidation in right ventricular hypertrophy: Exploiting Randle's cycle. Journal of Molecular Medicine. 90 (1), 31-43 (2012).
- Piao, L., et al. Cardiac glutaminolysis: A maladaptive cancer metabolism pathway in the right ventricle in pulmonary hypertension. Journal of Molecular Medicine. 91 (10), 1185-1197 (2013).
- Sack, M. N., Disch, D. L., Rockman, H. A., Kelly, D. P. A role for Sp and nuclear receptor transcription factors in a cardiac hypertrophic growth program. Proceedings of the National Academy of Sciences of the United States of America. 94 (12), 6438-6443 (1997).
- Broderick, T. L., King, T. M. Upregulation of GLUT-4 in right ventricle of rats with monocrotaline- induced pulmonary hypertension. Medical Science Monitor. 14 (12), 261-264 (2008).
- Enache, I., et al. Skeletal muscle mitochondrial dysfunction precedes right ventricular impairment in experimental pulmonary hypertension. Molecular and Cellular Biochemistry. 373 (1-2), 161-170 (2013).
- Sun, X. Q., et al. Reversal of right ventricular remodeling by dichloroacetate is related to inhibition of mitochondria-dependent apoptosis. Hypertension Research. 39 (5), 302-311 (2016).
- Adrogue, J. V., Sharma, S., Ngumbela, K., Essop, M. F., Taegtmeyer, H. Acclimatization to chronic hypobaric hypoxia is associated with a differential transcriptional profile between the right and left ventricle. Molecular and Cellular Biochemistry. 278 (1-2), 71-78 (2005).
- Sharma, S., et al. Dynamic changes of gene expression in hypoxia-induced right ventricular hypertrophy. American Journal of Physiology - Heart and Circulatory Physiology. 286 (3), 1185-1192 (2004).
- Nouette-Gaulain, K., et al. Time course of differential mitochondrial energy metabolism adaptation to chronic hypoxia in right and left ventricles. Cardiovascular Research. 66 (1), 132-140 (2005).
- Graham, B. B., et al. Severe pulmonary hypertension is associated with altered right ventricle metabolic substrate uptake. American Journal of Physiology - Lung Cellular and Molecular Physiology. 309 (5), 435-440 (2015).
- Liu, A., et al. Estrogen maintains mitochondrial content and function in the right ventricle of rats with pulmonary hypertension. Physiological Reports. 5 (6), 1-12 (2017).
- Kobr, J., et al. Right Ventricular Pressure Overload and Pathophysiology of Growing Porcine Biomodel. Pediatric Cardiology. 37 (8), 1498-1506 (2016).
- Yerebakan, C., et al. Acute and chronic response of the right ventricle to surgically induced pressure and volume overload - an analysis of pressure-volume relations. Interactive CardioVascular and Thoracic Surgery. 10 (4), 519-525 (2010).
- Gufler, H., et al. Right Ventricular Function After Pulmonary Artery Banding: Adaptive Processes Assessed by CMR and Conductance Catheter Measurements in Sheep. Journal of Cardiovascular Translational Research. 12 (5), 459-466 (2019).
- Baicu, C. F., et al. Time course of right ventricular pressure-overload induced myocardial fibrosis: relationship to changes in fibroblast postsynthetic procollagen processing. American Journal of Physiology-Heart and Circulatory Physiology. 303 (9), 1128-1134 (2012).
- Manohar, M., et al. Regional myocardial blood flow and coronary vascular reserve in unanesthetized young calves exposed to a simulated altitude of 3500 m for 8-10 weeks. Circulation Research. 50 (5), 714-726 (1982).
- Fávaro, G. A. G., et al. Reversible pulmonary trunk banding: VII. Stress echocardiographic assessment of rapid ventricular hypertrophy in young goats. Journal of Thoracic and Cardiovascular Surgery. 145 (5), 1345-1351 (2013).
- Nielsen, E. A., et al. Regional septal hinge-point injury contributes to adverse biventricular interactions in pulmonary hypertension. Physiological Reports. 5 (14), 1-13 (2017).
- Borgdorff, M. A., et al. Sildenafil enhances systolic adaptation, but does not prevent diastolic dysfunction, in the pressure-loaded right ventricle. European Journal of Heart Failure. 14 (9), 1067-1074 (2012).
- Gold, H., Prindle, K., Levey, G., Epstein, S. Effects of experimental heart failure on the capacity of glucagon to augment myocardial contractility and activate adenyl cyclase. The Journal of Clinical Investigation. 49 (5), 999-1006 (1970).
- Brittain, E. L., et al. Right ventricular plasticity and functional imaging. Pulmonary Circulation. 2 (3), 309-326 (2012).
- Jiang, L., et al. Three-dimensional Echocardiography In Vivo Validation for Right Ventricular Volume and Function. Circulation. 89, 2342-2350 (1994).
- Markiewicz, W., Sechtem, U., Higgins, C. B. Evaluation of the right ventricle by magnetic resonance imaging. American Heart Journal. 113 (1), 8-15 (1987).
- Pattynama, P. M. T., et al. Reproducibility of MRI-derived measurements of right ventricular volumes and myocardial mass. Magnetic Resonance Imaging. 13 (1), 53-63 (1995).
- Wiesmann, F., et al. Comparison of fast spiral, echo planar, and fast low-angle shot MRI for cardiac volumetry at .5T. Journal of Magnetic Resonance Imaging. 8 (5), 1033-1039 (1998).
- Van der Feen, D. E., et al. Multicenter Preclinical Validation of BET Inhibition for the Treatment of Pulmonary Arterial Hypertension. American Journal of Respiratory and Critical Care Medicine. 200 (7), 910-920 (2019).
- da Costa Martins, P. A., et al. MicroRNA-199b targets the nuclear kinase Dyrk1a in an auto-amplification loop promoting calcineurin/NFAT signalling. Nature Cell Biology. 12 (12), 1220-1227 (2010).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. Journal of Visualized Experiments. (84), e51041 (2014).
- Schulz-Menger, J., et al. Standardized image interpretation and post processing in cardiovascular magnetic resonance: Society for Cardiovascular Magnetic Resonance (SCMR) Board of Trustees Task Force on Standardized Post Processing. Journal of Cardiovascular Magnetic Resonance. 15 (1), 1-19 (2013).
- Hagdorn, Q. A. J., et al. A novel method optimizing the normalization of cardiac parameters in small animal models: The importance of dimensional indexing. American Journal of Physiology - Heart and Circulatory Physiology. 316 (6), 1552-1557 (2019).
- Scherrer-Crosbie, M., et al. Determination of Right Ventricular Structure and Function in Normoxic and Hypoxic Mice. Circulation. 98 (10), 1015-1021 (2012).
- Wiesmann, F., et al. Analysis of right ventricular function in healthy mice and a murine model of heart failure by in vivo MRI. American Journal of Physiology-Heart and Circulatory Physiology. 283 (3), 1065-1071 (2002).
- Lu, X., et al. Accuracy and Reproducibility of Real-Time Three-Dimensional Echocardiography for Assessment of Right Ventricular Volumes and Ejection Fraction in Children. Journal of the American Society of Echocardiography. 21 (1), 84-89 (2008).
- Soriano, B. D., et al. Matrix-array 3-dimensional echocardiographic assessment of volumes, mass, and ejection fraction in young pediatric patients with a functional single ventricle: A comparison study with cardiac magnetic resonance. Circulation. 117 (14), 1842-1848 (2008).
- Damy, T., et al. Prevalence of, associations with, and prognostic value of tricuspid annular plane systolic excursion (TAPSE) among out-patients referred for the evaluation of heart failure. Journal of Cardiac Failure. 18 (3), 216-225 (2012).
- Kowalik, E., Kowalski, M., Rózański, J., Kuśmierczyk, M., Hoffman, P. The impact of pulmonary regurgitation on right ventricular regional myocardial function: An echocardiographic study in adults after total repair of tetralogy of fallot. Journal of the American Society of Echocardiography. 24 (11), 1199-1204 (2011).
- Koestenberger, M., et al. Systolic right ventricular function in pediatric and adolescent patients with tetralogy of Fallot: Echocardiography versus magnetic resonance imaging. Journal of the American Society of Echocardiography. 24 (1), 45-52 (2011).
- Bovens, S. M., et al. Evaluation of infarcted murine heart function: Comparison of prospectively triggered with self-gated MRI. NMR in Biomedicine. 24 (3), 307-315 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır