このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
肺動脈バンディングを有するマウスにおける心臓磁気共鳴画像法による両心室機能と形態の定量化
* これらの著者は同等に貢献しました
要約
異常負荷に対する右心室(RV)の適応の病態生理学を理解するには、実験モデルが重要です。しかし、RVの寸法と機能の評価は複雑で困難です。このプロトコルは、RV圧力負荷を受けるマウスの非侵襲的ベンチマーク手順として心臓磁気共鳴画像法(CMR)を実行する方法を提供します。
要約
右心室(RV)の機能と失敗は、肺高血圧症を含む後天性および先天性心疾患の転帰の主要な決定要因です。RVの機能と形態の評価は複雑で、その一部はRVの形状が複雑なため、心臓磁気共鳴(CMR)イメージングは、RVの機能と形態を非侵襲的に評価するためのゴールデンスタンダードです。現在のプロトコルでは、肺動脈バンディング (PAB) によって誘発される RV 圧力負荷のマウス モデルでの CMR イメージングについて説明しています。PAB は、23 G 針の上に肺動脈の周囲に 6-0 縫合糸を配置することによって行われます。PAB 勾配は、2 週間と 6 週間で心エコー検査を使用して決定されます。6 週間で、1,500 mT/m の勾配を備えた 9.4 T 磁気共鳴イメージング スキャナーを使用して、収縮末期と拡張末期の両方の体積と質量を厚さ 1 mm の 10 から 11 のシネスライスで測定することにより、左右の心室の形態と機能を評価します。代表的な結果は、PAB が RV 圧力負荷の有意な増加を誘発し、両心室の形態と RV 機能に有意な影響を与えることを示しています。また、RV圧負荷の6週間で、心拍出量が維持されることも示されています。ここで紹介するのは、RV圧力負荷のマウスモデルにおける両心室の形態と機能の定量化のための再現可能なプロトコルであり、RVリモデリングと機能不全の決定要因を調査する実験の方法として役立つ可能性があります。
概要
肺高血圧症(PH)を含む後天性および先天性心血管疾患の患者は、右心室(RV)の機能障害と失敗のリスクがあります1。圧力負荷の増加の結果としてのRV適応は、初期段階では同心円状に肥大し、末期疾患では進行性の拡張を特徴としています。さらに、それは代謝および細胞外マトリックスの障害、炎症のプロセス、そして最終的にはRV失敗2,3,4,5,6に関連しています。RVの失敗への進行の根本的なプロセスを探求するために、動物モデルが開発されました。しかし、モデルの最適化とRVの機能と次元の適切な評価は困難でした。RVの機能と寸法の非侵襲的評価には、心臓磁気共鳴(CMR)イメージングがゴールデンスタンダードです。この技術は、強い磁場と高周波を使用して、鼓動する心臓の画像を作成します。CMRは、ヒトだけでなく、実験用のげっ歯類などの動物にも使用できます。後者は心臓のサイズが小さいため、より高い空間分解能を必要とするため、適切な画像を提供するために必要な磁場は、人間と比較して高くなければなりません。
PH 7,8,9,10,11,12,13,14,15,16,17のモデルや近位RV圧力負荷2,3,10,18のモデルを含む、RV圧力過負荷を模倣した複数のモデルが利用可能です。19、20、21、22、23。PHのモデルまたは近位RV圧力負荷のモデルのいずれかを選択するかどうかは、研究課題によって異なります:肺血管系に対する介入の影響、したがっておそらくRV後負荷変調(つまり、PHモデル)、またはRVへの直接的な影響(つまり、近位RV圧力負荷モデル)。モノクロタリン(MCT)12,13,14,16,22,24,25,26、大動脈シャントと組み合わせたMCT9、慢性低酸素症7,27,28,29など、PHの実験的誘導にはいくつかの方法があります、および血管内皮増殖因子受容体拮抗薬であるSugen 5416と慢性低酸素症8,10,30,31との組み合わせ。このようなモデルは、近位RV圧力負荷の進行性肺モデルを表し、肺血管系を対象としていませんが、肺動脈の収縮によって一定の後負荷を誘発し、それに伴うRV後負荷の増加を伴います2,3。これは、縫合糸バンディング(肺動脈バンディング、PAB)または肺動脈の周りの血管クリップによって実行できます。PABはいくつかの動物種で行われており、心臓の寸法と機能は、組織学、経胸壁心エコー検査(スペックルトラッキングを含む)、心臓カテーテル法など、さまざまな方法で研究されています2,32,33,34,35,36,37,38,39,40 .マウスなどの小さなげっ歯類のPABは困難です。これは、動脈収縮の圧迫感との間の微妙な違いが、RV圧力負荷の程度とその後の機能状態および生存に顕著な結果をもたらしたためです。狭窄が非常にきつい場合、動物は手術中または手術直後に死亡しますが、狭窄が十分にきついと望ましい表現型は達成されません。しかし、マウスの使用は、優れた遺伝子改変の可能性(すなわち、トランスジェニックまたはノックアウトモデル)および迅速な育種のために、他の動物と比較して利点を有する。これは、疾患の研究や、分子的および(エピ)遺伝的要因の寄与を探求する上で付加価値があります。
動物実験のデザインは、疾患2,3,8,13,21の時間的変化の調査にシフトしています。このような研究には、連続評価を実施できるため、非侵襲的なモダリティが必要です。心臓リモデリングの評価におけるCMRの代替法としては、(1)組織病理学を用いた組織特性評価(異なる時点で複数の動物を屠殺する)、(2)圧力体積分析による侵襲的機能評価、または(3)心エコー検査があり、これにより研究者は同じ動物内で非侵襲的に心肥大または拡張を連続的に特定できる。CMRは、RVの評価において、(1)非侵襲的なモダリティであり、1匹の動物で連続測定が可能であり、これにより研究に必要な動物数の削減に貢献する、(2)CMRは特定の幾何学的形状に依存せず、3次元的に視覚化する、という2つの大きな利点があります。CMR由来のRVボリュームおよび機能測定は正確であることが示されており、ヒト42,43,44,45の異なる心臓実体における非侵襲的ゴールデンスタンダードと考えられているが、RV圧力過負荷のマウスに対するCMRプロトコルにはまだ変換されていなかった。
PABの多くのモデルが文献に記載されていますが、血行動態の影響とRVの機能と適応を評価する方法には高い不均一性があります。このプロトコルでは、マウスでの PAB の手順を概説し、心エコー検査で PAB 勾配を測定し、CMR で心臓の寸法と機能を評価することにより、モデルを検証します。PABを投与した動物におけるCMRのプロトコルはラットについて発表されていますが、この組み合わせはこれまでマウスについて記載されていませんでした。ラットはPHモデル8,12,13,14,15,16,22,24,25,26,27,28,29,30,31,46に最も一般的に使用されます、マウスはトランスジェニックまたはノックアウト研究に最も頻繁に使用され、それによって圧力負荷RV故障のメカニズムの理解に貢献します。このプロトコルは、RV不全への移行に関与するシグナル伝達経路を解明するための将来の研究の基礎を形成する可能性があります。
Access restricted. Please log in or start a trial to view this content.
プロトコル
すべての実験および動物の飼育は、オランダの動物実験法に従って行われ、米国国立衛生研究所が発行した実験動物の世話と使用に関するガイドに準拠しています。オランダ・フローニンゲン大学の動物実験委員会は、現行の実験プロトコルを承認しました(許可番号:2014-041/3005)。
1. 住居と順応
- 20〜30 gの野生型C57ブラック6(C57BL / 6)マウス(前述の施設繁殖系統47)の雄と雌、すべて8週齢以上を使用します。マウスはケージごとに最大5匹のグループで収容します。人間の取り扱いに慣れるために、マウスを少なくとも7日間順応させます。この期間中は、いかなる手続きも行わないでください。
2. 肺動脈バンディング手術
- 準備
- マウスを5%イソフルラン/ 100%酸素で満たされた誘導チャンバーに入れます。痛みの刺激(つまり、つま先をつまむ)を与えることにより、反射の欠如を確認します。
- 電動シェーバーを使用してマウスの左半胸部を剃ります。
- 舌をそっと引き抜き、穏やかな緊張感でホールドします。
- 声門の高さで外側の喉に光源を配置して、内側の喉を照らします。
- マウスを気管内に20Gの柔軟なカニューレで挿管します。.
- 動物を右側にしてヒートマット(温度を37°Cに設定)の上に置きます。
- カニューレをミニベンチレーターに接続し、1.5%〜2.5%のイソフルラン/酸素(180回/分、潮汐250μL)で換気を開始します。
- 術後鎮痛のために0.1 mg / kgのブプレノルフィンを皮下注射します。.
- 目の軟膏を使用して目の脱水症を防ぎます。
- 左外側開胸術による肺動脈バンディング手術
- 右前脚をニュートラル位置に置き、右後脚を伸ばし、左前脚を後ろに曲げて、マウスを右側に置きます。
- 胸部の皮膚を塩化物-ヘキシジン、綿棒2xで消毒します。
- 手術には滅菌器具を使用してください。左脇の下から2本目と3本目の肋骨に平行に小さなハサミ(丸い柄、12mmの刃)で皮膚を開きます。
- m. pectoralis superficialis (斜めの表在筋) と m. pectoralis profundus (斜めの、下にある筋肉) を特定します。
- 縫合糸ループを使用して、m. pectoralis superficialisを腹側に引き、m. pectoralis profundusをマウスの背側に引っ張ります。
- 2 番目の肋間腔を開き、適合したペーパー クリップを使用して肋骨を広げ、左心耳、左肺、肺動脈が見えるようにします。
- 肺動脈を大動脈から分離します。6-0縫合糸を含む鈍い25G針で肺動脈の周りに縫合糸ループを配置し、肺動脈の周りに失われた2-1-1結紮糸を配置します。
- 23Gの針を6-0縫合糸内の肺動脈と平行に配置し、最初に最も近位の縫合糸の結び目を固定し、次に2-1-1縫合糸の遠位結び目を固定します。23Gの針を取り外します。結び目が適切であることを確認してください。
- モノフィラメントポリプロピレン5-0縫合糸で2つまたは3つの別々の縫合糸で胸部を閉じます。m. pectoralis superficalis と m. pectoralis profundus を放します。
- 純粋なポリグリコール酸5-0縫合糸で皮膚を縫合します。連続縫合技術を使用して、組織内の瘢痕形成を最小限に抑えます。瘢痕組織は、心エコー検査の画質に影響を与えます。
- 麻酔からの回復中は、マウスが腹部の動きから観察できるように自発的な呼吸を取り戻すまで、酸素で換気を続けながらイソフルランをオフにします。.
- 気管内チューブを人工呼吸器から切り離します。自発呼吸を確認し、自発的な呼吸作用が見られる場合にのみ抜管します。自発呼吸が見られない場合は、チューブを人工呼吸器に再度接続し、手順2.2.12に戻ります。
- マウスが意識を取り戻すまで観察します。
- 偽の手術
- バンディング(手順2.2.2〜2.2.6)を除いて、上記の手順を実行します。
- 術後期間
- マウスをインキュベーター(37°C)に個別に24時間収容します。
- 術後最初の3日間は、マウスを毎日観察します。不快感の兆候がある場合は、術後鎮痛のために0.1 mg / kgのブプレノルフィンを1日2回皮下注射してください。.
3. 心エコー検査
- 準備
- PAB手術の14日後に心エコー検査によるPAB勾配分析を行います。
- 心エコー検査装置を起動します。心臓パッケージと14.0MHzトランスデューサーを選択します。
- 麻酔
- マウスを5%イソフルランと100%酸素の混合物で満たされた誘導チャンバーに入れます。
- マウスの胸部を剃ります。
- マウスを背にしてヒートマット(温度37°C)に置き、鼻を換気マスクに入れます。
- 1.5%〜2.5%イソフルランと100%酸素(0.15 L / min)および室内空気(0.3 L / min)の混合物で換気します。.
- つま先をつまむような痛みの深さを確認し、それに応じて麻酔を調整します。
- 目の軟膏を使用して目の脱水症を防ぎます。
- 心エコー検査によるPAB勾配の決定
- 小児用心電図ステッカーを各前足に、両方の後足に1枚ずつ貼ります。ステッカーを使って動物を抱きしめます。
- マウスの胸部の剃毛部分に超音波ジェルを塗布します。
- 肺動脈の画像を取得するには、胸骨傍長軸(PLAX)または傍胸骨短軸(PSAX)ビューの2つのビューを使用できます。両方を取得し、最高品質の測定値と分析速度を提供するビューを使用します。
- PLAX ビューと PSAX ビューを取得します。
- カラードップラーボタンを押すと、血流が視覚化されます。
- 超音波プローブを胸骨傍線に対して30°の角度で配置してPLAXを取得し(詳細な説明についてはChengら48を参照)、上行大動脈を視覚化します。
- プローブを左に最小限にスイープして、上行大動脈が肺動脈の後ろに消えるようにします。適切なPLAXは、血液が垂直に流れる肺動脈を視覚化すると特定されます。
- カーソルを肺動脈と一直線に置きます。 連続波 (CW) ドップラーボタンを押す と、3つの心周期の速度時間積分測定値が得られます。 [保存]を押します。
- プローブをPLAXから時計回りに90°回転させてPSAXを取得し、次にプローブを頭蓋/腹方向にわずかに傾けて、大動脈レベルでPSAXを導き出します。RV流出路が大動脈とプローブの間にある場合、適切なPSAXビューが特定されます。これは肺動脈で続き、血液は垂直に流れます。詳細な説明については、Cheng et al.48を参照してください。
- カーソルを肺動脈と一直線に置きます。 連続波 (CW) ドップラーボタンを押す と、3つの心周期の速度時間積分測定値が得られます。 [保存]を押します。
- 最適ビュー(PSAXまたはPLAX)の3つの最大速度を測定し、平均を計算します。簡略化されたベルヌーイの原理を使用して、ミリメートル水銀柱 (mmHg) で PAB 勾配を導き出します。
4. 心臓磁気共鳴画像法
- 準備
- PAB手術の6週間後(つまり、42日後)にCMR分析を実行します。
注: さらに、研究課題によっては、複数の時点を含める場合は、PAB 手術後の早い時点を選択する場合があります。後の時点も考えられます。ただし、RVの故障や死亡がますます発生する可能性があります。 - 十分に強力な磁石を使用します(通常、げっ歯類のCMRスキャンには>7 Tが使用されます)。現在のプロトコルでは、1,500 mT/mの勾配が設定され、ボアサイズが89 mmの9.4 T垂直システムが使用されます。
- CMR後処理ソフトウェアをインストールして、派生画像の体積と質量を分析します。このソフトウェアは、拡張末期 (ED) と収縮末期 (ES) の容積 (それぞれ EDV と ESV) と心室質量 (ED と ES の両方で測定) を手動で決定するためのセグメンテーションを許可する場合に適切であると見なされます。
- PAB手術の6週間後(つまり、42日後)にCMR分析を実行します。
- 麻酔と固定
- マウスを5%イソフルランと100%酸素の混合物で満たされた誘導チャンバーに入れます。つま先をつまむことで痛み刺激を与えることで麻酔の効果を確認します。
- マウスの目に軟膏を塗って、スキャン中に目を湿らせます。
- マウスをスキャナーの動物用ベッドに置き、空気供給、1.5%〜2.5%のイソフルラン、100%の酸素(0.15 L / min)、室内の空気(0.3 L / min)の加温(37°C)混合物、およびスキャン中の心拍数(400〜500 bpmを目標)と呼吸数(毎分~35呼吸を目標)を観察できる圧力パッドを備えています。これら2つのパラメータに基づいて麻酔を調整します。ベッドが磁性材料を含まないプラスチック製であることを確認してください。
- マウス付きの動物用ベッドをスキャナーに置きます。
- 心臓磁気共鳴画像法の実施
- 無線周波数(RF)バードケージコイルを1水素(1H)共振周波数に調整して、取得前の調整を行います。
- 次に、自動シミング手順を使用して磁場をできるだけ均一に設定します。
注:コンピューター化されたシミングは、1 H FIDの下の領域を品質パラメータとして使用する、いわゆるチューニング方法によって行われます。このチューニング手順では、ユーザー定義のシムのグループ(Z、Z2、X、Y、XZ、およびYZ)が反復サイクルで検査されます。連続する各シムは、FIDの下の面積を最大化するために個別に調整されます。これは基本的に、迅速にうまく機能する線形の手順です。 - RFパルスパワーを調整して1次元イメージプロファイルを最大化することにより、RFパルスを最適化します。
- スキャナー内の心臓の正確な位置を割り当てるには、トライパイロットシーケンスを使用してスカウトスキャンを行います。高速グラデーションエコーシーケンスを使用して、胸部(横スライス、冠状スライス、矢状スライス)を通じてスカウト画像を取得します。(図1A、B、C)
- 軸、2 チャンバー、および 4 チャンバー ビューの実際の軸に軸を調整します (図 1D、E)。
- 次に、シネスライスをRV流出路とRVの最大頂端部分との間の仮想軸に垂直に配置します。
- セルフゲートIntraGate高速ローアングルショット(FLASH)法により、RV(図1F)の上部からベースまでのイメージング全体をカバーするスライスギャップのない厚さの1mm厚のシネスライスを10〜11個導き出します。これにより、心電図(ECG)と呼吸ゲーティングが不要になります。取得パラメータを 表1に示します。画像をDICOM形式で保存します。
- 取得した画像の解析
- ソフトウェアをダブルクリックしてプログラムを開きます。
- インポートボタンを使用して、CMR後処理ソフトウェアで画像を開きます。
- 収縮末期 (視覚的に最小の RV 空洞を持つ相として定義) と拡張末期 (視覚的に最大の RV 空洞を持つ相として定義) を特定します。
- Society for Cardiovascular Magnetic Resonance49 のガイドラインに従って、各画像の心外膜境界にいくつかの点をマークすることにより、拡張末期と収縮末期の心外膜の輪郭を頂点から基部まで手動で描画します。最後のポイントで、ダブルクリックして心外膜輪郭を完成させます。
- 心内膜の輪郭についても同じことを行います。(図2)。左心室と右室EDV、ESV、ED質量、ES質量がソフトウェアによって自動的に計算されるようになりました。
注:質量は、心筋体積×心筋密度(つまり、1.05)として定義されます。 - 研究課題と研究中の人口に応じて、以前に公開された式50に従って、脛骨の長さまたは体重によって被験者のサイズについてこれらの変数をインデックス化します。
- 脳室内中隔 (IVS) に平行な左室腔の直径を、IVS に垂直な左室腔の直径で割ることにより、拡張末期と収縮期末の両方で離心率 (EI) を計算します。これは、中乳頭レベルの短軸から導き出されます。
- ソフトウェアは、一回拍出量(SV)をmLで
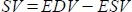 、駆出率(EF、%)を
、駆出率(EF、%)を 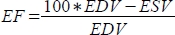 として計算します。
として計算します。 - 心拍出量(CO)をml / minで計算
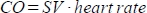 。心拍数は、スキャナが高い高頻度心拍数を適切に登録できないため、上記のように動物床に埋め込まれた圧力パッドによって手動で測定されます。
。心拍数は、スキャナが高い高頻度心拍数を適切に登録できないため、上記のように動物床に埋め込まれた圧力パッドによって手動で測定されます。 - 研究課題と研究中の集団に応じて、以前に公開された式50に従って、脛骨の長さまたは体重によって被験者のサイズのCOとSVをインデックス化します。
5. 統計分析
- データの視覚化と統計分析に使用するソフトウェアを開きます。
- グループごと (PAB と sham) ごとにデータを並べ替え、すべてのグループを別々の列に並べます。
- マンホイットニー検定を使用して、すべての変数についてPABと偽の変数を比較します。
Access restricted. Please log in or start a trial to view this content.
結果
PAB外科手術の死亡率は約10%です。提示された結果は、sham(n = 5)およびPAB(n = 8)グループのマウスの特性を示しています。 図3に示すように、PABの勾配値は、PABの2週間後および6週間後に偽動物と比較して有意に増加しました。この負荷の増加により、RV、EDV、およびRV ESVの増加として表されるRV拡張が発生しました(図4A、
Access restricted. Please log in or start a trial to view this content.
ディスカッション
このプロトコルは、マウスのPABの再現性のある方法と、その後のCMRを使用した心臓のリモデリングと機能適応の評価を提供します。
PABは、他のトリガーの存在なしに後負荷の絶対的および静的な増加を伴うため、RV圧力負荷が増加する他のモデルとは異なります。低酸素症、モノクロタリン、シャント、またはこれらの誘導剤の組み合わせのモ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
フローニンゲン大学医療センターは、この原稿の内容以外のRMFバーガーのコンサルタント活動について、アクテリオンおよびリリーと契約を結んでいます。他の著者は、競合する利益はないと宣言しています。
謝辞
本研究の動物実験にご協力いただいたP. Da Costa-Martins氏に感謝いたします。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 14.0 MHz i13L-echocardiography transducer | GE Healthcare, Waukesha, WI, USA | ||
| 20G cannula | |||
| 23G needle | |||
| 9.4T magnetic resonance scanner with 1,500 mT/m gradient set | Bruker BioSpin, Ellingen, Germany | ||
| Anesthesia induction chamber | |||
| Blunt 25G needle | |||
| Buprenorphine | |||
| Chloride-hexidine | |||
| CMR post-processing software | Medis Medical Imaging Systems, Leiden, The Netherlands | Qmass version 7.6 | |
| Data visualisation and statistical software | GraphPad Prism Inc, La Jolla, CA, USA | software version 7.02 | |
| Echocardiography machine | GE Healthcare, Waukesha, WI, USA | Vivid Dimension 7 | |
| Eye ointment | |||
| Heat mat | |||
| Incubator (37°C) | |||
| Isoflurane | |||
| Isoflurane evaporator | |||
| Miniventilator for rodents | Hugo Sachs | model 687 | |
| monofilament polypropylene 5-0 sutures | |||
| monofilament polypropylene 6-0 sutures | |||
| Needle and syringe for subcutaneous injections | |||
| Pediatric electrocardiogram-stickers | |||
| pure polyglycolic acid 5-0 sutures | |||
| Sterile surgical instruments | |||
| Ventilation mask |
参考文献
- Norozi, K., et al. Incidence and Risk Distribution of Heart Failure in Adolescents and Adults With Congenital Heart Disease After Cardiac Surgery. The American Journal of Cardiology. 97 (8), 1238-1243 (2006).
- Borgdorff, M. A. J., et al. Clinical symptoms of right ventricular failure in experimental chronic pressure load are associated with progressive diastolic dysfunction. Journal of Molecular and Cellular Cardiology. 79, 244-253 (2015).
- Koop, A. M. C., et al. Right ventricular pressure overload alters cardiac lipid composition. International Journal of Cardiology. , (2019).
- Faber, M. J., et al. Right and left ventricular function after chronic pulmonary artery banding in rats assessed with biventricular pressure-volume loops. American Journal of Physiology and Heart Circirculation Physiology. 291 (4), 1580-1586 (2006).
- Bogaard, H. J., et al. Chronic pulmonary artery pressure elevation is insufficient to explain right heart failure. Circulation. 120 (20), 1951-1960 (2009).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulmonary Circulation. 7 (3), 572-587 (2017).
- Rumsey, W. L., et al. Adaptation to hypoxia alters energy metabolism in rat heart. American Journal of Physiology Heart and Circulatory Physiology. 276 (1), 71-80 (1999).
- Drozd, K., et al. Effects of an endothelin receptor antagonist, Macitentan, on right ventricular substrate utilization and function in a Sugen 5416/hypoxia rat model of severe pulmonary arterial hypertension. Journal of Nuclear Cardiology. 24 (6), 1979-1989 (2017).
- Van Der Feen, D. E., et al. Shunt surgery, right heart catheterization, and vascular morphometry in a rat model for flow-induced pulmonary arterial hypertension. Journal of Visualized Experiments. (120), e55065(2017).
- Gomez-Arroyo, J., et al. Metabolic gene remodeling and mitochondrial dysfunction in failing right ventricular hypertrophy secondary to pulmonary arterial hypertension. Circulation: Heart Failure. 6 (1), 136-144 (2013).
- Bruns, D. R., Dale Brown, R., Stenmark, K. R., Buttrick, P. M., Walker, L. A. Mitochondrial integrity in a neonatal bovine model of right ventricular dysfunction. American Journal of Physiology - Lung Cellular and Molecular Physiology. 308 (2), 158-167 (2015).
- Zhang, W. H., et al. Up-regulation of hexokinase1 in the right ventricle of monocrotaline induced pulmonary hypertension. Respiratory Research. 15 (1), 119(2014).
- Paulin, R., et al. A miR-208-Mef2 axis drives the decompensation of right ventricular function in pulmonary hypertension. Circulation Research. 116 (1), 56-69 (2015).
- Sutendra, G., et al. A metabolic remodeling in right ventricular hypertrophy is associated with decreased angiogenesis and a transition from a compensated to a decompensated state in pulmonary hypertension. Journal of Molecular Medicine. 91 (11), 1315-1327 (2013).
- Balestra, G. M., et al. Increased in vivo mitochondrial oxygenation with right ventricular failure induced by pulmonary arterial hypertension: Mitochondrial inhibition as driver of cardiac failure. Respiratory Research. 16, 6(2015).
- Piao, L., et al. The inhibition of pyruvate dehydrogenase kinase improves impaired cardiac function and electrical remodeling in two models of right ventricular hypertrophy: Resuscitating the hibernating right ventricle. Journal of Molecular Medicine. 88 (1), 47-60 (2010).
- Piao, L., et al. FOXO1-mediated upregulation of pyruvate dehydrogenase kinase-4 (PDK4) decreases glucose oxidation and impairs right ventricular function in pulmonary hypertension: therapeutic benefits of dichloroacetate. Journal of Molecular Medicine. 91, 333-346 (2013).
- Sheikh, A. M., et al. Right ventricular hypertrophy with early dysfunction: A proteomics study in a neonatal model. Journal of Thoracic and Cardiovascular Surgery. 137 (5), 1146-1153 (2009).
- Olivetti, G., et al. Cellular basis of wall remodeling in long-term pressure overload-induced right ventricular hypertrophy in rats. Circulation Research. 63 (3), 648-657 (1988).
- Lauva, I. K., et al. Control of myocardial tissue components and cardiocyte organelles in pressure-overload hypertrophy of the cat right ventricle. The American Journal of Anatomy. 177 (1), 71-80 (1986).
- Fang, Y. H., et al. Therapeutic inhibition of fatty acid oxidation in right ventricular hypertrophy: Exploiting Randle's cycle. Journal of Molecular Medicine. 90 (1), 31-43 (2012).
- Piao, L., et al. Cardiac glutaminolysis: A maladaptive cancer metabolism pathway in the right ventricle in pulmonary hypertension. Journal of Molecular Medicine. 91 (10), 1185-1197 (2013).
- Sack, M. N., Disch, D. L., Rockman, H. A., Kelly, D. P. A role for Sp and nuclear receptor transcription factors in a cardiac hypertrophic growth program. Proceedings of the National Academy of Sciences of the United States of America. 94 (12), 6438-6443 (1997).
- Broderick, T. L., King, T. M. Upregulation of GLUT-4 in right ventricle of rats with monocrotaline- induced pulmonary hypertension. Medical Science Monitor. 14 (12), 261-264 (2008).
- Enache, I., et al. Skeletal muscle mitochondrial dysfunction precedes right ventricular impairment in experimental pulmonary hypertension. Molecular and Cellular Biochemistry. 373 (1-2), 161-170 (2013).
- Sun, X. Q., et al. Reversal of right ventricular remodeling by dichloroacetate is related to inhibition of mitochondria-dependent apoptosis. Hypertension Research. 39 (5), 302-311 (2016).
- Adrogue, J. V., Sharma, S., Ngumbela, K., Essop, M. F., Taegtmeyer, H. Acclimatization to chronic hypobaric hypoxia is associated with a differential transcriptional profile between the right and left ventricle. Molecular and Cellular Biochemistry. 278 (1-2), 71-78 (2005).
- Sharma, S., et al. Dynamic changes of gene expression in hypoxia-induced right ventricular hypertrophy. American Journal of Physiology - Heart and Circulatory Physiology. 286 (3), 1185-1192 (2004).
- Nouette-Gaulain, K., et al. Time course of differential mitochondrial energy metabolism adaptation to chronic hypoxia in right and left ventricles. Cardiovascular Research. 66 (1), 132-140 (2005).
- Graham, B. B., et al. Severe pulmonary hypertension is associated with altered right ventricle metabolic substrate uptake. American Journal of Physiology - Lung Cellular and Molecular Physiology. 309 (5), 435-440 (2015).
- Liu, A., et al. Estrogen maintains mitochondrial content and function in the right ventricle of rats with pulmonary hypertension. Physiological Reports. 5 (6), 1-12 (2017).
- Kobr, J., et al. Right Ventricular Pressure Overload and Pathophysiology of Growing Porcine Biomodel. Pediatric Cardiology. 37 (8), 1498-1506 (2016).
- Yerebakan, C., et al. Acute and chronic response of the right ventricle to surgically induced pressure and volume overload - an analysis of pressure-volume relations. Interactive CardioVascular and Thoracic Surgery. 10 (4), 519-525 (2010).
- Gufler, H., et al. Right Ventricular Function After Pulmonary Artery Banding: Adaptive Processes Assessed by CMR and Conductance Catheter Measurements in Sheep. Journal of Cardiovascular Translational Research. 12 (5), 459-466 (2019).
- Baicu, C. F., et al. Time course of right ventricular pressure-overload induced myocardial fibrosis: relationship to changes in fibroblast postsynthetic procollagen processing. American Journal of Physiology-Heart and Circulatory Physiology. 303 (9), 1128-1134 (2012).
- Manohar, M., et al. Regional myocardial blood flow and coronary vascular reserve in unanesthetized young calves exposed to a simulated altitude of 3500 m for 8-10 weeks. Circulation Research. 50 (5), 714-726 (1982).
- Fávaro, G. A. G., et al. Reversible pulmonary trunk banding: VII. Stress echocardiographic assessment of rapid ventricular hypertrophy in young goats. Journal of Thoracic and Cardiovascular Surgery. 145 (5), 1345-1351 (2013).
- Nielsen, E. A., et al. Regional septal hinge-point injury contributes to adverse biventricular interactions in pulmonary hypertension. Physiological Reports. 5 (14), 1-13 (2017).
- Borgdorff, M. A., et al. Sildenafil enhances systolic adaptation, but does not prevent diastolic dysfunction, in the pressure-loaded right ventricle. European Journal of Heart Failure. 14 (9), 1067-1074 (2012).
- Gold, H., Prindle, K., Levey, G., Epstein, S. Effects of experimental heart failure on the capacity of glucagon to augment myocardial contractility and activate adenyl cyclase. The Journal of Clinical Investigation. 49 (5), 999-1006 (1970).
- Brittain, E. L., et al. Right ventricular plasticity and functional imaging. Pulmonary Circulation. 2 (3), 309-326 (2012).
- Jiang, L., et al. Three-dimensional Echocardiography In Vivo Validation for Right Ventricular Volume and Function. Circulation. 89, 2342-2350 (1994).
- Markiewicz, W., Sechtem, U., Higgins, C. B. Evaluation of the right ventricle by magnetic resonance imaging. American Heart Journal. 113 (1), 8-15 (1987).
- Pattynama, P. M. T., et al. Reproducibility of MRI-derived measurements of right ventricular volumes and myocardial mass. Magnetic Resonance Imaging. 13 (1), 53-63 (1995).
- Wiesmann, F., et al. Comparison of fast spiral, echo planar, and fast low-angle shot MRI for cardiac volumetry at .5T. Journal of Magnetic Resonance Imaging. 8 (5), 1033-1039 (1998).
- Van der Feen, D. E., et al. Multicenter Preclinical Validation of BET Inhibition for the Treatment of Pulmonary Arterial Hypertension. American Journal of Respiratory and Critical Care Medicine. 200 (7), 910-920 (2019).
- da Costa Martins, P. A., et al. MicroRNA-199b targets the nuclear kinase Dyrk1a in an auto-amplification loop promoting calcineurin/NFAT signalling. Nature Cell Biology. 12 (12), 1220-1227 (2010).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. Journal of Visualized Experiments. (84), e51041(2014).
- Schulz-Menger, J., et al. Standardized image interpretation and post processing in cardiovascular magnetic resonance: Society for Cardiovascular Magnetic Resonance (SCMR) Board of Trustees Task Force on Standardized Post Processing. Journal of Cardiovascular Magnetic Resonance. 15 (1), 1-19 (2013).
- Hagdorn, Q. A. J., et al. A novel method optimizing the normalization of cardiac parameters in small animal models: The importance of dimensional indexing. American Journal of Physiology - Heart and Circulatory Physiology. 316 (6), 1552-1557 (2019).
- Scherrer-Crosbie, M., et al. Determination of Right Ventricular Structure and Function in Normoxic and Hypoxic Mice. Circulation. 98 (10), 1015-1021 (2012).
- Wiesmann, F., et al. Analysis of right ventricular function in healthy mice and a murine model of heart failure by in vivo MRI. American Journal of Physiology-Heart and Circulatory Physiology. 283 (3), 1065-1071 (2002).
- Lu, X., et al. Accuracy and Reproducibility of Real-Time Three-Dimensional Echocardiography for Assessment of Right Ventricular Volumes and Ejection Fraction in Children. Journal of the American Society of Echocardiography. 21 (1), 84-89 (2008).
- Soriano, B. D., et al. Matrix-array 3-dimensional echocardiographic assessment of volumes, mass, and ejection fraction in young pediatric patients with a functional single ventricle: A comparison study with cardiac magnetic resonance. Circulation. 117 (14), 1842-1848 (2008).
- Damy, T., et al. Prevalence of, associations with, and prognostic value of tricuspid annular plane systolic excursion (TAPSE) among out-patients referred for the evaluation of heart failure. Journal of Cardiac Failure. 18 (3), 216-225 (2012).
- Kowalik, E., Kowalski, M., Rózański, J., Kuśmierczyk, M., Hoffman, P. The impact of pulmonary regurgitation on right ventricular regional myocardial function: An echocardiographic study in adults after total repair of tetralogy of fallot. Journal of the American Society of Echocardiography. 24 (11), 1199-1204 (2011).
- Koestenberger, M., et al. Systolic right ventricular function in pediatric and adolescent patients with tetralogy of Fallot: Echocardiography versus magnetic resonance imaging. Journal of the American Society of Echocardiography. 24 (1), 45-52 (2011).
- Bovens, S. M., et al. Evaluation of infarcted murine heart function: Comparison of prospectively triggered with self-gated MRI. NMR in Biomedicine. 24 (3), 307-315 (2011).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved