Method Article
توصيف البروتينات الخلوية مع الأكسدة الضوئية السريعة في الخلية من البروتينات
In This Article
Summary
هنا ، نحن نميز بنية البروتين ومواقع التفاعل في الخلايا الحية باستخدام تقنية بصمة البروتين التي يطلق عليها الأكسدة الضوئية الضوئية السريعة للبروتينات (IC-FPOP).
Abstract
الأكسدة الضوئية السريعة للبروتينات (FPOP) هي طريقة بصمة البروتين الهيدروكسيل الراديكالية المستخدمة لتوصيف بنية البروتين والتفاعلات. FPOP يستخدم ليزر excimer 248 نانومتر لphotolyze بيروكسيد الهيدروجين إنتاج الجذور الهيدروكسيل. هذه الجذور تعديل المذيبات المؤكّد السلاسل الجانبية المكشوفة من 19 من الأحماض الأمينية 20. في الآونة الأخيرة ، تم استخدام هذه الطريقة في الخلايا الحية (IC-FPOP) لدراسة تفاعلات البروتين في بيئتها الأصلية. دراسة البروتينات في الخلايا حسابات للازدحام بين الجزيئات والتفاعلات البروتين المختلفة التي تعطلت للدراسات المختبرية. تم تصميم نظام تدفق خلية واحدة مخصص للحد من تجميع الخلايا وانسداد خلال IC-FPOP. يركز نظام التدفق هذا الخلايا بعد الليزر excimer بشكل فردي ، وبالتالي ضمان التشعيع المستمر. من خلال مقارنة مدى الأكسدة المنتجة من FPOP لإمكانية وصول المذيبات للبروتين المحسوبة من بنية بلورية ، يمكن لـ IC-FPOP أن تحقق بدقة السلاسل الجانبية للمذيبات التي يمكن الوصول إليها من البروتينات.
Introduction
البصمة البروتينية الجذرية الهيدروكسيل (HRPF) هي طريقة تحقق إمكانية وصول المذيبات من البروتين من خلال التعديلات الكوفالة المنتجة من جذور الهيدروكسيل. عندما يتغير هيكل البروتين أو تفاعلات البروتين ، فإنه سيغير تعرض المذيبات من الأحماض الأمينية ، وبالتالي تغيير مدى تعديل المخلفات. مع HRPF، تفاعلات البروتين1،,2،,3 والتغيرات التشكلية البروتين4،,5،,6 وقد تم استجوابه بنجاح في المختبر. هناك العديد من الطرق التي تولد الجذور الهيدروكسيل للتجارب HRPF، واحدة يجري الأكسدة الضوئية السريعة من البروتينات (FPOP). تم تطوير FPOP من قبل هامبلي وغروس في عام 2005 ويستخدم ليزر excimer 248 نانومتر لإنتاج الجذور الهيدروكسيل من خلال التحليل الضوئي لبيروكسيد الهيدروجين (H2O2)7.
في الآونة الأخيرة ، وسعت اسبينو وآخرون استخدام FPOP للتحقيق في بنية البروتين في الخلايا الحية ، وهي طريقة يطلق عليها في الخلية FPOP (IC-FPOP)8. على النقيض من الدراسات المختبرية، دراسة البروتينات في الخلايا حسابات للازدحام الجزيئي جنبا إلى جنب مع مختلف التفاعلات البروتين التي يمكن أن تؤثر على الهيكل. بالإضافة إلى ذلك ، فإنه يقدم ميزة توفير لقطة من البروتيوم الكامل يحتمل أن توفر معلومات هيكلية من العديد من النظم في وقت واحد لأداء البيولوجيا الهيكلية البروتيوم واسعة. وعلاوة على ذلك، هذه التقنية مثالية للبروتينات التي يصعب دراستها في المختبر، مثل بروتينات الغشاء.
بحثت الدراسات الأولية لـ IC-FPOP بنجاح 105 بروتينات تتراوح في وفرة البروتين وتوطين الخلايا. لتحسين طريقة IC-FPOP ، طور Rinas وآخرون نظام تدفق صغير لتدفق الخلية المفردة9. ويحد تعزيز نظام التدفق الأصلي من تجميع الخلايا ويزيد من المتاحة H2O2 المتاحة للتشعيع. في نظام التدفق الأولي ، أدت الخلايا التي تتجمع في أنابيب السيليكا إلى القباقيب والتشعيع غير المتكافئ. دمج اثنين من تيارات العازلة غمد هيدروديناميكيا يركز الخلايا، مما يسمح لهم بالتدفق بشكل فردي الماضي الليزر. يتيح دمج حقنة منفصلة لـ H2O2 وقت تعرض أكثر تحكمًا وقابلًا للتحسين مما يسمح بتركيزات H2O2 أعلى دون آثار ضارة. أيضا، الحد من الوقت حضانة يحد من انهيار H2O2 بواسطة الكاتالاز الذاتية. من خلال دمج نظام التدفق الجديد هذا ، زاد عدد البروتينات المكتشفة مع تعديل FPOP 13 مرة ، وبالتالي توسيع قدرات هذه الطريقة للتحقيق في العديد من البروتينات في الخلايا الحية. في هذا البروتوكول يتم وصف تجربة IC-FPOP عامة مع التركيز على تجميع نظام تدفق IC-FPOP.
Protocol
1. إعداد نظام تدفق IC-FPOP
- لبدء تجميع نظام التدفق، وقطع السيليكا تنصهر باستخدام حجر الانقسام إلى الحجم. يتطلب نظام تدفق IC-FPOP أربعة 12 سم وواحد 17 سم تنصهر السيليكا مع قطر داخلي (ID) من 450 ميكرون وقطر خارجي (OD) من 670 ميكرومتر، واثنين 24 سم وواحد 40 سم مع معرف 75 ميكرومتر وOD من 360 ميكرون ، وأخيرا اثنين 57 سم مع معرف من 150 ميكرومتر وOD من 360 ميكرون.
ملاحظة: عند قطع أنابيب السيليكا، كشط بلطف بعيدا طلاء البوليميد، والانحناء للحصول على أنظف قطع. تحقق للتأكد من أنه قطع مستقيم (وهذا ضروري لضمان عدم وجود انسداد أو تسرب شكل). - إعداد 15 اتصالات باستخدام نانو ضيق الأكمام (0.0155" معرف X 1/16"OD ل360 ميكرومتر OD السيليكا الأنابيب و 0.027"معرف X 1/16"OD ل670 ميكرومتر OD السيليكا الأنابيب) مع سوبر flangeless الجوز PEEK 1/4-28 شقة أسفل ل1/16 "OD والسوبر flangeless ferrule ث / SST حلقة, Tefzel (ETFE) ، 1/4-28 شقة القاع ، ل1 /16 "OD. بناء الاتصالات وفقا لبروتوكول الشركة المصنعة(الشكل 1).
- ضع 6 مغناطيسات أسطوانية صغيرة في حقنة واحدة 500 ميكرولتر. ملء هذه الحقنة جنبا إلى جنب مع آخر 500 ميكرولتر حقنة واثنين من 5 مل المحاقن مع العازلة وإزالة الهواء. موقف على مضخة حقنة كما هو مبين في الشكل 2A.
ملاحظة: الحقن 5 مل أكبر من 500 ميكرولتر المحاقن، لذلك هناك حاجة إلى فاصل لتشديد جميع المحاقن في وقت واحد في مكان(الشكل 2B). - تشديد مضخة حقنة سدادة بحيث حقنة الخلية لديها ما يقرب من 50 ميكرولتر اليسار عندما الأكشاك المحرك. هذا سوف يترك مجالا للاثار المغناطيسية. (الشكل2C-D).
تنبيه: إذا كانت مضخة الحقنة تضغط على المغناطيس، فإنها سوف مربى الحقنة ويمكن أن يسبب حقنة لكسر. - باستخدام محول Luer، قم بتوصيل صمام يدوي بكل حقنة. تجميع أنابيب السيليكا كما هو مبين في الشكل 3.
ملاحظة: مؤشر ترابط الخط مع الخلايا + H2O2 على طول الطريق من خلال الصليب إلى الجانب الآخر. ثم أدخله في أنابيب السيليكا معرف 450 ميكرون. سوف تتدفق المخازن المؤقتة في حقنة 5 مل بمعدل أسرع من الخلايا وH2O2. مع مخازن غمد على كلا الجانبين، سيتم تركيز الخلايا الهيدروديناميكية في خط واحد للتشعيع. - موقف نظام تدفق بجانب الليزر. باستخدام أخف وزنا، وحرق بعيدا طلاء السيليكا على أنابيب معرف 450 ميكرومتر لجعل نافذة لتشعيع الليزر.
- ضع جهاز تحريك مغناطيسي فوق حقنة الخلية التي تحتوي على المغناطيسات الستة.
- تعيين مضخة حقنة إلى 492.4 ميكرولتر/ دقيقة لمعدل تدفق نهائي قدره 1,083.3 ميكرولتر/دقيقة.
- تركيز الليزر excimer على أنابيب السيليكا باستخدام عدسة محدبة. مرة واحدة تركز، واختبار نافذة التشعيع عن طريق وضع قطعة صغيرة من الورق وراء أنابيب السيليكا وتحويل الليزر على. قياس المنطقة المحترقة من التشعيع. احسب تردد الليزر المطلوب باستخدام نافذة التشعيع ومعدل التدفق للحصول على جزء استبعاد صفري.
ملاحظة: طاقة الليزر الموصى بها لتجربة IC-FPOP ≥ 120 mJ. للحصول على جزء استبعاد من 0 مع نافذة تشعيع من 2.58 ملم ومعدل تدفق 1083.3 ميكرولتر / دقيقة، يجب أن يكون التردد 44. فيما يلي المعادلات المطلوبة لحساب تردد الليزر إذا كانت نافذة التشعيع ومعدل التدفق وجزء الاستبعاد معروفًا.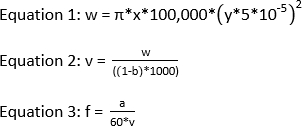
حيث w هو حجم في nL، x هو عرض بقعة الليزر في مم، y هو معرف أنابيب السيليكا في μm، v هو الحجم الإجمالي في μL، ب هو كسر الاستبعاد، a هو معدل التدفق في μL/min، و و هو التردد في هرتز.
2. جعل إخماد وH2O2
- جعل إخماد تحتوي على 100 mM N-tert-Butyl-alpha-phenylnitrone (PBN) و 100 mM N, N'dimethylthiourea (DMTU). Aliquot 11 مل من إخماد لكل عينة في أنبوب مخروطي 50 مل.
- تمييع H2O2 إلى 200 mm. كل عينة يتطلب 500 ميكرولتر من H2O2.
ملاحظة: يمكن إجراء التبريد في اليوم السابق وتخزينها في 4 درجة مئوية بين عشية وضحاها، محمية من الضوء. يجب أن تكون H2O2 طازجة في يوم التجريب.
3. جمع الخلايا
- تنمو الخلايا في قارورة T175 إلى حوالي 70-90٪ التقاء.
- إزالة الوسائط وشطف مع المخزن المؤقت.
ملاحظة: المخازن المؤقتة النموذجية للاستخدام هي درجة ثقافة الخلية دولبيكو في الفوسفات موسى (DPBS) أو حل الملح متوازن هانك (HBSS). - فصل الخلايا باستخدام إما التربسين-EDTA أو مع مكشطة.
- مرة واحدة منفصلة إعادة تعليق في 10 مل من المخزن المؤقت والعد الخلايا.
- قم بتدوير العازلة وإزالة العازلة والتربسين-EDTA، وإعادة تعليق لجعل 2 × 106 خلايا / مل.
- Aliquot 500 ميكرولتر من الخلايا لكل عينة.
ملاحظة: لكل حالة، قم بإجراء ما لا يقل عن 3 عينات ليزر، و 3 لا توجد عناصر تحكم ليزر.
4. أداء IC-FPOP
- ملء اثنين من حقن 5 مل مع العازلة، وحقنة 500 ميكرولتر تحتوي على المغناطيس مع الخلايا، وحقنة 500 ميكرولتر النهائي مع H2O2. تشغيل التحريك المغناطيسي.
- ارتفاع في 220 ميكرولتر من ثنائي ميثيل سولفوكسيد (DMSO) إلى واحد aliquot من إخماد، مزيج بلطف، ومكان وراء نظام التدفق لجمع العينات المشععة. إضافة DMSO سوف تمنع الميثيونين الذاتية اختزال أكسيد الكبريت.
- قم بتشغيل الليزر، وانتظر 7 s، ثم قم بتشغيل نظام التدفق.
- بمجرد الانتهاء من تدفق العينة، قم بإيقاف تشغيل الليزر، واخلط التروية بلطف مع العينة التي تم جمعها. ضع هذا على الجانب أثناء الخطوات 4.5 و 4.6.
- ملء جميع المحاقن الأربعة مع المخزن المؤقت يتم تعليق الخلايا في وتدفق ذلك من خلال نظام التدفق.
- بعد انتهاء النظام من التنظيف، كرر الخطوات 4.1 و 4.2. بدء تدفق دون تشعيع. هذا هو عدم وجود التحكم بالليزر لحساب أكسدة الخلفية في الخلايا.
- أثناء تشغيل العينة التالية، تدور أسفل العينة السابقة في 450-800 × ز لمدة 5 دقيقة، وإزالة المذيبات، وإعادة تعليق في 100 ميكرولتر من العازلة التحلل الخلوي مثل فحص المناعة الإشعاعية (RIPA) عازلة.
- نقل العينة إلى أنبوب الطرد المركزي الدقيق وتجميد الفلاش في النيتروجين السائل.
- عند الانتهاء من تشغيل جميع العينات، قم بتفكيك نظام التدفق للتنظيف. تجاهل أنابيب السيليكا المستخدمة وتنظيف جميع الاتصالات الأخرى عن طريق سونيكاينغ لمدة 1 ساعة في 50٪ من الماء: 50٪ الميثانول. تنظيف المحاقن وفقا لتعليمات الشركة المصنعة.
5. ملخص
- هضم خلية كاملة. تبدأ بإذابة العينات والحرارة في 95 درجة مئوية لمدة 10 دقيقة.
- بعد التسخين، يُبرّد الليزات على الثلج لمدة 15 دقيقة.
- إضافة 25 وحدة من nuclease لهضم الحمض النووي والحمض النووي الريبي واحتضان في غرفة معتدلة لمدة 15 دقيقة.
- عينات الدوران باستخدام جهاز طرد مركزي من أعلى الطاولة عند 16,000 × ز لمدة 10 دقيقة عند 4 درجات مئوية.
- جمع supernatant ونقله إلى أنبوب الطرد المركزي الدقيق نظيفة.
- تحقق من تركيز البروتين باستخدام مجموعة فحص البروتين.
- نقل 20-100 ميكروغرام من العينة إلى أنبوب طرد مركزي صغير نظيف وجلب إلى 100 ميكرولتر.
- تقليل العينات مع 20 mM dithiothreiotol (DTT) في 50 درجة مئوية لمدة 45 دقيقة.
- تبريد العينات في درجة حرارة الغرفة لمدة 15 دقيقة.
- الكيلات مع يودوهاتاميد 20 MM (IAA) في درجة حرارة الغرفة لمدة 20 دقيقة محمية من الضوء.
- أضف الأسيتون المبرد مسبقًا ببروتين نسبة 1:4: الأسيتون. مزيج العينات ومكان في -20 درجة مئوية بين عشية وضحاها.
- في صباح اليوم التالي، تدور العينات في 16،000 ز لمدة 10 دقيقة في 4 °C.
- إزالة supernatant وإضافة 50 ميكرولتر من 90٪ الأسيتون المبردة. مزيج العينات وتدور أسفل في 16،000 × ز لمدة 5 دقيقة في 4 درجة مئوية.
- إزالة الأسيتون والسماح للعينات الجافة عن طريق ترك قبعات من أجهزة الطرد المركزي الدقيقة مفتوحة مع مسح الوبر الحرة التي تغطي الجزء العلوي. بعد أن جفت العينات، وإعادة تعليق بيليه البروتين مع 10 MM تريس درجة الحموضة العازلة 8.
- إعادة تعليق 20 ميكروغرام من التربسين في 40 ميكرولتر من 10 mM تريس درجة الحموضة العازلة 8. إضافة 2 ميكروغرام من التربسين (الكتلة: نسبة الكتلة من 1 التربسين: 50 عينة). عينات احتضان في 37 درجة مئوية بين عشية وضحاها.
- في صباح اليوم التالي تحقق من تركيز الببتيد باستخدام فحص الببتيد. بعد إزالة العينة لعينات الببتيد، إخماد هضم التربسين عن طريق إضافة حمض الفورميك إلى العينات (التركيز النهائي هو 5٪ حمض فورميك).
- بمجرد تحديد تركيز الببتيد النهائي ، نقل 10 ميكروغرام من كل عينة إلى أنبوب طرد مركزي صغير نظيف. وهذا يضمن تحليل نفس الكمية من كل عينة. جفف العينة باستخدام جهاز طرد مركزي فراغي. مرة واحدة المجففة تعليق مع 20 ميكرولتر من درجة قياس الطيف الكتلي 0.1٪ حمض فورميك. نقل العينات إلى قوارير العينات التلقائية.
6. قياس الطيف الكتلي اللوني السائل - الترادف
- لتوطين تعديلات FPOP تحليل تحلل الخلية المهضومة باستخدام تحليل LC-MS/MS.
- استخدام مراحل متنقلة من 0.1٪ حمض الفورميك في الماء (A) و 0.1٪ حمض الفورميك في الأسيتونتريل (B).
- تحميل 0.5 ميكروغرام من العينة على عمود محاصرة 180 ميكرومتر × 20 مم C18 (5 ميكرومتر و 100 Å) وعينة الغسيل مع 99٪ (A) و 1٪ (B) لمدة 15 دقيقة.
- باستخدام عمود تحليلي يبلغ 75 ميكرومتر × 30 سم C18 (5 ميكرومتر و125 Å) ، قم بتشغيل طريقة الفصل التحليلي بمعدل تدفق 0.300 ميكرولتر / دقيقة بدءًا من 3٪ (B) لدقيقة واحدة ثم المنحدر إلى 10٪ (B) من 1-2 دقيقة. المنحدر التالي إلى 45٪ (B) من 2-100 دقيقة ثم 100٪ (B) من 100-110 دقيقة. تنظيف العمود عن طريق عقد في 100٪ (B) من 110-115 دقيقة.
- تعيين أسلوب اكتساب MS إلى دقة 60,000 مع نطاق مسح m/z من 375-1500. تعيين هدف التحكم في الكسب التلقائي (AGC) إلى 5.0 × 105 مع الحد الأقصى لوقت الحقن 50 مللي ثانية.
- أثناء اكتساب MS، حدد الأيونات السلائف مع الدول تهمة 2-6 لعزل عن طريق الحصول على البيانات المعتمدة (DDA) مع نافذة عزل من 1.2 م / ز ووقت دورة من 4 s. حدد الببتيدات مع عتبة كثافة من 5.0 × 104 لتنشيط HCD مع مجموعة الطاقة العادية إلى 32٪. استبعاد الببتيدات بعد 1 MS / MS اقتناء لمدة 60 ثانية. تعيين القرار MS / MS إلى 15,000 مع هدف AGC من 5.0 × 104 ووقت حقن الحد الأقصى من 35 مللي ثانية.
7- معالجة البيانات
- ابحث في ملفات RAW على برنامج تحليل البروتين المتاح مقابل قاعدة بيانات البروتين ذات الصلة وأنزيم الهضم ذي الصلة. هنا، استخدم قاعدة بيانات Swiss-Prot Homo Sapiens والتربسين.
- تعيين كتلة السلائف للبحث بين 350 إلى 5000 دا والتسامح الشامل من 10 جزء في المليون. يمكن أن يكون هناك على الأكثر 1 غاب موقع الانقسام مع طول الببتيد بين 6 إلى 144 بقايا. تسهل هذه القيود البحث في قاعدة البيانات.
- تعيين الأجزاء الأيونات الحد الأقصى للتسامح الشامل إلى 0.02 Da مع carbamidomethyl (+57.021) كتعديل ثابت وجميع تعديلات FPOP من 17 الأحماض الأمينية كتعديل ديناميكي(الشكل 4 هو مثال على سير عمل تحليل البروتين المستخدمة للكشف عن تعديلات FPOP).
ملاحظة: لا يتم تضمين تعديلات FPOP على سيرين وثريونين في البحث بسبب تفاعلها المنخفض مع الجذور الهيدروكسيل. - البحث مع قاعدة بيانات شرك مع معدل اكتشاف كاذبة من 1٪ و 5٪.
- مرة واحدة يتم الانتهاء من الملفات البحث حساب مدى تعديل FPOP. فتح Proteome مكتشف 2.2، تسلسل التصدير، ومواقع التعديل، والانضمام البروتين، وملف الطيف، وفرة السلائف، ومعلومات وقت الاحتفاظ. حساب مدى التعديل من المعادلة 4:

منطقة EIC المعدلة هي منطقة كروماتوغرافية لببتيد معين مع تعديل جذري للهيدروكسيل. منطقة EIC هي المنطقة الكروماتوغرافية الإجمالية لكل من المناطق المعدلة وغير المعدلة من هذا الببتيد المحدد. يتم حساب مدى الأكسدة في العينات مع وبدون تشعيع. العينة حذف التشعيع (السيطرة) حسابات أي أكسدة الخلفية التي يمكن أن تكون موجودة في الخلايا قبل وبعد H2O2 التعرض. يتم طرح عناصر التحكم من عينات التشعيع للمساعدة في عزل تعديلات FPOP محددة.
النتائج
IC-FPOP هو أسلوب بصمة لإستجواب تفاعلات البروتين في الخلايا الحية. في نظام تدفق IC-FPOP ، يقتصر وقت التعرض H2O2 على ما يقرب من 3 s ، مما يبرر تركيزات H2O2 أعلى دون عواقب ضارة على الخلايا. نظام تدفق يتضمن أيضا اثنين من تيارات العازلة غمد، الذي يركز الخلايا المائية إلى مركز الأنابيب إنتاج تدفق واحد من الخلايا لتكون مشععة بشكل موحد(الشكل 5)9. التصوير الفلوري للصور المتشعبة YZ مكدسة(الشكل 5A)تظهر فصلا واضحا من المخزن المؤقت غمد (التي تحتوي على فلوروفور فيت C) من محلول الخلية (التي تحتوي على فلوروفور TMRM). للتأكيد على هذا الفصل ، الشكل 5باء والشكل 5جيم تظهر خرائط الحرارة متوسط ثلاثي الأبعاد إما حل العازلة غمد أو حل الخلية ، مما يدل على الحد الأدنى من خلط الحلين.
استخدام نظام تدفق خلية واحدة يزيد من عدد البروتينات المعدلة أكسدة بنسبة 13 أضعاف(الشكل 6A)9. في هذه الطريقة ، يتم تسمية البروتينات في العديد من المقصورات الخلوية مع بروتينات الغشاء ، والبروتينات السيتوبلازمية ، والبروتينات داخل النواة كونها الأكثر انتشارًا8،9. لضمان تعديل البروتينات داخل الخلايا السليمة ، تم تنفيذ صور فلورية للخلايا المعالجة CellROX بعد العلاج H2O2 والتشعيع(الشكل 6B)8. استقرار الخلايا في جميع أنحاء عملية وضع العلامات يؤكد كذلك فعالية IC-FPOP للتحقيق البروتينات في بيئتها الخلوية الأصلية. باستخدام قياس الطيف الترادفي الشامل، يمكن ترجمة هذه التعديلات إلى أحماض أمينية محددة على البروتين. يمثل الشكل 7 تعديلًا يحدث أثناء IC-FPOP مع مخطط الكروماتوجرام أيوني المستخرج. التحول الذي لوحظ في الكروماتوجرام أيون المستخرج يترجم إلى التغيير في hydrophobicity الناجم عن الميثيونين المؤكسد في الببتيد المعدل.
لاختبار ما إذا كانت تعديلات FPOP التحقيق إمكانية الوصول إلى المذيبات داخل الخلايا، في الخلية المسمى actin تمت مقارنة كل من دراسة البصمة في المختبر والهياكل البلورية المختلفة من actin(الشكل 8)8. يتم تمثيل actin المسمى في الخلية في الشكل 8A يظهر نطاقات مماثلة من الأكسدة من الدراسة المختبرية التي أجراها غوان وآخرون10 (الشكل 8B)، مما أدى إلى أن actin يحتوي على إمكانية وصول مماثلة للمذيبات لكل من الدراسات في الخلية والمختبر. ولتأكيد ذلك، كان IC-FPOP يحقق في إمكانية وصول المذيبات إلى actin ، تمت مقارنة مدى تعديلات FPOP بإمكانية الوصول إلى المذيبات من المخلفات المسماة المحسوبة من اثنين من هياكل الكريستال actin(الشكل 8C). هذا الارتباط يدل على أن IC-FPOP تحقيقات إمكانية الوصول إلى المذيبات من البروتين أحادي ة جيدا.

الشكل 1: كيفية بناء قواعد بشكل صحيح. (أ)مكان ferrules، أنابيب السيليكا، والأكمام معا قبل تشديد. (ب)تشديد جميع المكونات معا. (C)المنتج النهائي سوف تنتج ferule التي تم تشديد أسفل على الأكمام. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: إعداد نظام تدفق IC-FPOP. (أ)صورة لنظام تدفق IC-FPOP مجمعبالكامل وموضوعة بجوار الليزر. (ب)مثال على فاصل مطلوب لزيادة القطر الخارجي للمحاقن 500 ميكرولتر لشد جميع المحاقن بنجاح معا. (C)صور تمثيلية تظهر المساحة المطلوبة للتحريك المغناطيسي. (د)سدادات ضرورية لتعطيل مضخة الحقندون كسر المحاقن. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
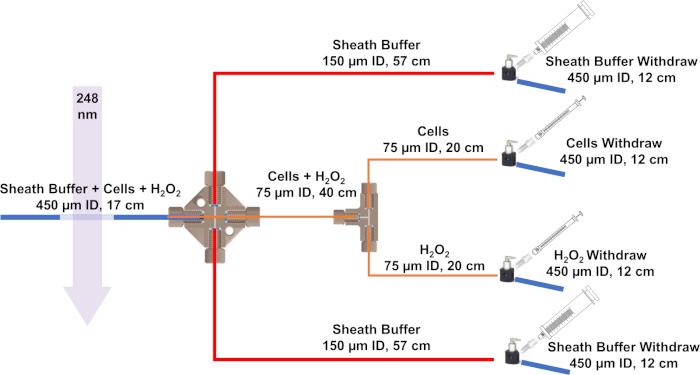
الشكل 3: التخطيطلنظام التدفق المطور لـ IC-FPOP. تمثل الخطوط الزرقاء أنابيب السيليكا مع معرف 450 ميكرومتر و 670 ميكرومتر OD، والخطوط الحمراء لديها معرف 150 ميكرومتر و 360 ميكرومتر OD، والخطوط البرتقالية لديها معرف 75 ميكرومتر و 360 ميكرومتر OD. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: برنامج تحليل البروتين المستخدم للكشف عن تعديلات FPOP. سير عمل نموذجي مع التعديلات المقابلة التي تم البحث عنها في كل عقدة. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
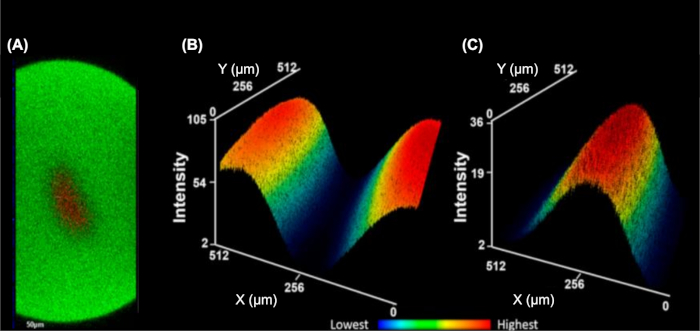
الشكل 5: يركز نظام تدفق الخلية الواحدة الخلايا هيدروديناميكية في تيار واحد. (أ)متعامد YZ المكدس توضيح 3D التركيز من الأنلايتي الخلوية (الأحمر، TMRM الفلورفور) محاطة العازلة غمد (الأخضر، FITC الفلوروفور). ثلاثي الأبعاد متوسط كثافة خريطة الحرارة من العازلة غمد(B)وanalyte الخلوية(C). انخفاض كثافة هي الأزرق وأعلى هي حمراء(B-C). وقد تم تعديل هذا الرقم من ريناس وآخرون.9يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
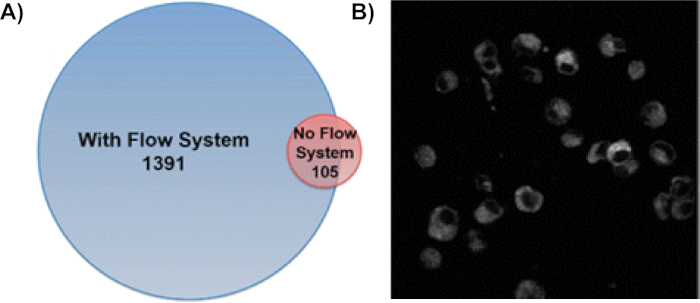
الشكل 6: استخدام نظام تدفق IC-FPOP يزيد بشكل كبير من البروتينات المعدلة FPOP في خلايا المدخول. (أ)مقارنة البروتينات المؤكسدة التي تم تحديدها مع نظام التدفق وبدونه. وحدد نظام التدفق 1391 بروتينامعدلا من نوع FPOP بينما تم تحديد 105 بروتينات فقط بدون نظام تدفق مع تداخل 58 بروتينا معدلا. وقد تم تعديل هذا الرقم من ريناسوآخرون. 9 (ب)تصوير الفلورمنس من CellROX الخلايا المعالجة بعد IC-FPOP تظهر الخلايا لا تزال سليمة بعد وضع العلامات التأكسدية. تم تصوير الخلايا باستخدام المجهر متعدد الفوتون Olympus Fluoview FV1000 MPE في 665 نانومتر. الصورة المعروضة هي شريحة واحدة. وقد تم تعديل هذا الرقم من Espino وآخرون.8يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: أمثلة على أطياف MS/MS المترادفة التي تحدث أثناء IC-FPOP. المنتج أيون (MS / MS) أطياف الببتيد(A)غير المعدلة، و(B)الأكسدة الكشف عن بقايا M8 وجدت على أن الببتيد. ممثل EIC من(C)الببتيد غير المعدلة و(D)الببتيد المعدلة. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: IC-FPOP فعال في التحقيق في إمكانية الوصول إلى المذيبات من البروتينات. (أ)مدى التعديل للببتيدات المعدلة 9 من actin. يتم عرض القيم كمتوسطات بالإضافة إلى الانحراف المعياري وناقصه (n = 3). (ب)تعديل الببتيدات actin أكسدة في المختبر عن طريق التحليل الإشعاعي synchrotron من غوان وآخرون(C)ارتباط بقايا FPOP التعديلات مع SASA في ضيق (مثلثات، خط الاتجاه محطما) ومفتوحة (دوائر، خط الاتجاه الصلب) الدول من actin.10 وقد تم تعديل هذا الرقم من Espino وآخرون.8يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
وقد تم تطوير العديد من التقنيات القائمة على قياس الطيف الكتلي لدراسة بنية البروتين ومجمعات البروتين-ligand بطريقة على نطاق البروتيوم في الخلايا الكاملة أو الخلايا الغنية. وتشمل هذه التقنيات على سبيل المثال لا الحصر استقرار البروتينات من معدل الأكسدة (SPROX)، وتنميط البروتيوم الحراري (TPP)، والربط الكيميائي المتبادل (XL-MS)، وبصمة البروتين الجذري ة الهيدروكسيل (HRPF). كل تقنية لها قيود ومزايا فريدة بالمقارنة مع بعضها البعض ، والتي تم استعراضها على نطاق واسع12. وقد استخدمت كل من هذه الأساليب لبيولوجيا بروتيوم الهيكلية واسعة لتوضيح بنية البروتين وظيفة في نهاية المطاف داخل البيئة الخلوية المعقدة. IC-FPOP هو تقنية HRPF التي تستخدم الجذور الهيدروكسيل لتعديل المذيبات يتعرض السلاسل الجانبية للأكسدة من الأحماض الأمينية، وفحص بنية البروتين والتفاعلات البروتين ليغاند داخل الخلايا قابلة للحياة13. IC-FPOP هو تحسين لـ HRPF الأولي في الخلايا الحية التي استخدمت كيمياء فنتون لتوليد الجذور على مقياس الوقتدقيقة 14. في هذه الدراسة ، تميزت التغيرات الهيكلية في بروتين غشاء متكامل استجابة لخفض درجة الحموضة أو القوة الأيونية للعازل بنجاح بتغطية أكسدة جيدة عبر البروتين. بالمقارنة مع كيمياء فنتون ، فإن IC-FPOP أسرع بكثير ، حيث تعدل البروتينات على المقياس الزمني للثانية الدقيقة ، مما يتيح دراسة تركيبة البروتين الأصلية.
اختبار رئيسي لIC-FPOP هو تأكيد صلاحية الخلايا بعد التعرض لH2O2. باستخدام خط خلط 40 سم ، يتم احتضان الخلايا في H2O2 لمدة 3 s تقريبًا قبل التشعيع. ويمكن تعديل هذا الوقت عن طريق تغيير طول هذا الأنابيب السيليكا. ومن الجدير بالذكر أنه على الرغم من أن استخدام الأزرق trypan لاختبار صلاحية الخلية يظهر الحفاظ على سلامة الخلايا بعد H2O2 حضانة, الخلايا يمكن أن تكون تحت تأثير الإجهاد مسارات الإشارات التي تتفاعل مع H2O2. لحسن الحظ، وقت الحضانة القصير أسرع من تخليق البروتين مما يوفر الثقة لا يتم حث البروتينات الموجودة بواسطة H2O2.
الخطوة الهامة التالية هي تأكيد التجميع السليم لنظام التدفق. مرة واحدة تجميعها، تأكد من عدم وجود تسرب اتّسح بعد مسح النظام مع المخزن المؤقت المطلوب. إذا كانت التسريبات موجودة، تأكد من أن تم قطع أنابيب السيليكا بشكل صحيح وتدفق ضد الفمرة لجعل ختم السليم مرة واحدة تشديد أسفل. جميع أجزاء هي اليد تشديد، لذلك لا توجد أدوات ضرورية. خلال كل تجربة IC-FPOP، تأكد من أن التحريك المغناطيسي في حقنة الخلية لا تزال في الحركة. هذا الانفعالات الصغيرة يحد من عدد الخلايا التي تستقر في الجزء السفلي من الحقنة ولكن ليست قاسية بما يكفي لقص الخلايا. بعد تشغيل واحد، هناك ما يقرب من 50 ميكرولتر من الخلايا المتبقية في الحقنة. تأكد دائمًا من تخفيف هذا الأمر بخطوة الإنصافية للحد من عدد الخلايا التي تنقل إلى التجربة التالية. من المستحسن استخدام حقنة خلية جديدة إذا تم مقارنة علاجات الخلايا المتعددة. من المهم أيضًا تحديد مخزن مؤقت مناسب للخلايا التي يتم اختبارها. بعض المخازن المؤقتة إخماد الهيدروكسيل الجذريمما يؤدي إلى تعديلات أقل على البروتينات. وقد أظهرت شو وآخرون أن بعض المخازن المؤقتة شائعة الاستخدام تقلل من عمر الهيدروكسيل الراديكالي11. DPBS و HBSS هي المخازن المؤقتة المشتركة المستخدمة لتجارب IC-FPOP.
بعد IC-FPOP، وتحسين بروتوكول الهضم على أساس المعلمات اللازمة. نظرًا لأن FPOP تنتج تعديلات التكافؤ التي لا رجعة فيها ، فهناك وقت كاف متاح للهضم الشامل والتنظيف دون فقدان تغطية وضع العلامات. دائما اختبار وتطبيع تركيز البروتين حتى يتم تحميل تركيزات الببتيد موحدة لقياس الطيف الكتلي جنبا إلى جنب. وأخيراً، يجب أن تضع في اعتبارها أنه لا يمكن إجراء الهطول المناعي بالاقتران مع IC-FPOP. إذا كان تعديل FPOP يستهدف منطقة التفاعل سيتم خفض تقارب الجسم المضاد. للمساعدة في زيادة تحديد تعديلات FPOP ، أظهرت خطوات الفصل 2D-chromatographic إلى أكثر من ثلاثة أضعاف عدد الببتيدات المؤكسدة التي تم اكتشافها15.
ويتمثل أحد التحديات التي تواجه أي تجربة من تجارب FPOP في المستوى المعقد لتحليل البيانات بسبب منتجات الأكسدة المحتملة التي يمكن أن تنشأ. هذا صحيح لكل من في الخلية أو في المختبر ولكن يتم زيادة بشكل كبير مع تعقيد المضافة من تحليل تحلل الخلايا. مع مزيد من التحسين من IC-FPOP المزيد من البروتينات مع تغطية التعديل أعلى تنشأ، وبالتالي على وجه السرعة جعل التحليل أكثر صعوبة. إن كمية القص من البيانات التي تم إنشاؤها من تجربة IC-FPOP واحدة يحد من استخدام التحقق اليدوي مما يجعل الباحثين يعتمدون بشكل أكبر على البرامج. ونتيجة لذلك، وضعت ريناس وآخرون استراتيجية كمية لـ HRPF باستخدام بروتيوم ديسكفري (PD)16. يستخدم هذا الأسلوب سير عمل عقدة متعددة البحث على PD جنبا إلى جنب مع منصة كمية في جدول بيانات. ويجري إدخال مزيد من التحسينات على منصة IC-FPOP لزيادة عدد الببتيدات المحددة مع تعديلات FPOP إلى جانب زيادة قابلية الاستنساخ ودقة الكمية.
Disclosures
ليزا جونز هو مخترع على تدفق الجمعية للخلايا براءات الاختراع (رقم المنشور: 20180079998).
Acknowledgements
تم دعم هذا العمل من قبل جائزة NSF الوظيفية (MCB1701692) لLMJ.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-53A | any brand is sufficient |
| 5 mL Gas Tight Syringe, Removable Luer Lock | SGE Analytical Science | 008760 | |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | any brand is sufficient |
| 500 µL SGE Gastight Syringes: Fixed Luer-Lok Models | Fisher Scientific | SG-00723 | |
| Acetone, HPLC Grade | Fisher Scientific | A929-4 | 4 L quantity is not necessary |
| Acetonitrile with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | LS120-500 | |
| ACQUITY UPLC M-Class Symmetry C18 Trap Column, 100 Å, 5 µm, 180 µm x 20 mm, 2G, V/M, 1/pkg | Waters | 186007496 | |
| ACQUITY UPLC M-Class System | Waters | ACQUITY UPLC M-Class System | |
| Aluminum Foil | Fisher Scientific | 01-213-100 | any brand is sufficient |
| Aqua 5 µm C18 125 Å packing material | Phenomenex | 04A-4299 | |
| Centrifuge | Eppendorf | 022625501 | |
| Delicate Task Wipers | Fisher Scientific | 06-666A | |
| Dithiothreiotol (DTT) | AmericanBio | AB00490-00005 | |
| DMSO, Anhydrous | Invitrogen | D12345 | |
| EX350 excimer laser | GAM Laser | EX350 excimer laser | |
| FEP Tubing 1/16" OD x 0.020" ID | IDEX Health & Science | 1548L | |
| Formic Acid, LC/MS Grade | Fisher Scientific | A117-50 | |
| HV3-2 VALVE | Hamilton | 86728 | |
| Hydrogen Peroxide | Fisher Scientific | H325-100 | any 30% hydrogen peroxide is sufficient |
| Iodoacetamide (IAA) | ACROS Organics | 122270050 | |
| Legato 210 syringe pump | KD Scientific | 788212 | Any syringe pump that can hold 4, 5 mL syringes, withdraw and expel liquid, and have a way to stale the motor should work |
| Luer Adapter Female Luer to 1/4-28 Male Polypropylene | IDEX Health & Science | P-618L | |
| Methanol, LC/MS Grade | Fisher Scientific | A454SK-4 | 4 L quantity is not necessary |
| Microcentrifuge | Thermo Scientific | 75002436 | |
| N,N'-Dimethylthiourea (DMTU) | ACROS Organics | 116891000 | |
| NanoTight Sleeve Green 1/16" ID x .0155" ID x 1.6" | IDEX Health & Science | F-242X | |
| NanoTight Sleeve Yellow 1/16" OD x 0.027" ID x 1.6" | IDEX Health & Science | F-246 | |
| N-tert-Butyl-α-phenylnitrone (PBN) | ACROS Organics | 177350250 | |
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | Orbitrap Fusion Lumos Tribrid Mass Spectrometer | other high resolution instruments (e.g. Q exactive Orbitrap or Orbitrap Fusion) can be used |
| PE50-C pyroelectric energy meter | Ophir Optronics | 7Z02936 | |
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Scientific | 23275 | |
| Pierce Rapid Gold BCA Protein Assay Kit | Thermo Scientific | A53225 | |
| Pierce Trypsin Protease, MS Grade | Thermo Scientific | 90058 | |
| Pierce Universal Nuclease for Cell Lysis | Fisher Scientific | 88702 | |
| Polymicro Cleaving Stone, 1" x 1" x 1/32" | Molex | 1068680064 | any capillary tubing cutter is sufficient |
| Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 150 µm, Outer Diameter 360 µm, TSP150350 | Polymicro Technologies | 1068150024 | |
| Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 450 µm, Outer Diameter 670 µm, TSP450670 | Polymicro Technologies | 1068150025 | |
| Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 75 µm, Outer Diameter 360 µm, TSP075375 | Polymicro Technologies | 1068150019 | |
| Potassium Phosphate Monobasic | Fisher Scientific | P382-500 | |
| Proteome Discover 2.2 (bottom-up proteomics software) | Thermo Scientific | OPTON-30799 | |
| Rotary Magnetic Tumble Stirrer | V&P Scientific, Inc. | VP 710D3 | |
| Rotary Magnetic Tumble Stirrer, accessory kit for use with Syringe Pumps | V&P Scientific, Inc. | VP 710D3-4 | |
| Super Flangeless Ferrule w/SST Ring, Tefzel™ (ETFE), 1/4-28 Flat-Bottom, for 1/16" OD | IDEX Health & Science | P-259X | |
| Super Flangeless Nut PEEK 1/4-28 Flat-Bottom, for 1/16" & 1/32" OD | IDEX Health & Science | P-255X | |
| Super Tumble Stir Discs, 3.35 mm diameter, 0.61 mm thick | V&P Scientific, Inc. | VP 722F | |
| Thermo Scientific Pierce RIPA Buffer | Fisher Scientific | PI89900 | |
| Tris Base | Fisher Scientific | BP152-500 | |
| Upchurch Scientific Low-Pressure Crosses: PEEK | Fisher Scientific | 05-700-182 | |
| Upchurch Scientific Low-Pressure Tees: PEEK | Fisher Scientific | 05-700-178 | |
| UV Fused Silica Plano-Convex Spherical Lenses | THORLABS | LA4052 | |
| V&P Scientific IncSupplier Diversity Partner TUMBL STIR DISC PARYLENE 1000 | V&P Scientific, Inc. | VP724F | |
| VHP MicroTight Union for 360µm OD | IDEX Health & Science | UH-436 | |
| Water with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | LS118-500 | |
| Water, LC/MS Grade | Fisher Scientific | W6-4 |
References
- Gau, B., Garai, K., Frieden, C., Gross, M. L. Mass spectrometry-based protein footprinting characterizes the structures of oligomeric apolipoprotein E2, E3, and E4. Biochemistry. 50 (38), 8117-8126 (2011).
- Li, Z., et al. High structural resolution hydroxyl radical protein footprinting reveals an extended Robo1-heparin binding interface. Journal of Biological Chemistry. 290 (17), 10729-10740 (2015).
- Zhang, H., Gau, B. C., Jones, L. M., Vidavsky, I., Gross, M. L. Fast photochemical oxidation of proteins for comparing structures of protein− ligand complexes: the calmodulin− peptide model system. Analytical Chemistry. 83 (1), 311-318 (2010).
- Jones, L. M., et al. Complementary MS methods assist conformational characterization of antibodies with altered S-S bonding networks. Journal of the American Society for Mass Spectrometry. 24 (6), 835-845 (2013).
- Kiselar, J. G., Janmey, P. A., Almo, S. C., Chance, M. R. Structural analysis of gelsolin using synchrotron protein footprinting. Molecular & Cellular Proteomic. 2 (10), 1120-1132 (2003).
- Vahidi, S., Stocks, B. B., Liaghati-Mobarhan, Y., Konermann, L. Mapping pH-induced protein structural changes under equilibrium conditions by pulsed oxidative labeling and mass spectrometry. Analytical Chemistry. 84 (21), 9124-9130 (2012).
- Hambly, D. M., Gross, M. L. Laser flash photolysis of hydrogen peroxide to oxidize protein solvent-accessible residues on the microsecond timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Espino, J. A., Mali, V. S., Jones, L. M. In cell footprinting coupled with mass spectrometry for the structural analysis of proteins in live cells. Analytical Chemistry. 87 (15), 7971-7978 (2015).
- Rinas, A., Mali, V. S., Espino, J. A., Jones, L. M. Development of a Microflow System for In-Cell Footprinting Coupled with Mass Spectrometry. Analytical Chemistry. 88 (20), 10052-10058 (2016).
- Guan, J. Q., Almo, S. C., Reisler, E., Chance, M. R. Structural Reorganization of Proteins Revealed by Radiolysis and Mass Spectrometry: G-Actin Solution Structure Is Divalent Cation Dependent. Biochemistry. 42 (41), 11992-12000 (2003).
- Xu, G., Chance, M. R. Hydroxyl radical-mediated modification of proteins as probes for structural proteomics. Chemical Reviews. 107 (8), 3514-3543 (2007).
- Kaur, U., et al. Proteome-Wide Structural Biology: An Emerging Field for the Structural Analysis of Proteins on the Proteomic Scale. Journal of Proteome Research. 17 (11), 3614-3627 (2018).
- Chea, E. E., Jones, L. M. Analyzing the structure of macromolecules in their native cellular environment using hydroxyl radical footprinting. Analyst. 143 (4), 798-807 (2018).
- Zhu, Y., et al. Elucidating in vivo structural dynamics in integral membrane protein by hydroxyl radical footprinting. Molecular & Cellular Proteomic. 8 (8), 1999-2010 (1999).
- Rinas, A., Jones, L. M. Fast photochemical oxidation of proteins coupled to multidimensional protein identification technology (MudPIT): expanding footprinting strategies to complex systems. Journal of the American Society for Mass Spectrometry. 26 (4), 540-546 (2015).
- Rinas, A., Espino, J. A., Jones, L. M. An efficient quantitation strategy for hydroxyl radical-mediated protein footprinting using Proteome Discoverer. Analytical and Bioanalytical Chemistry. 408 (11), 3021-3031 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved