Method Article
Charakterisierung zellulärer Proteine mit in-zelliger schneller photochemischer Oxidation von Proteinen
In diesem Artikel
Zusammenfassung
Hier charakterisieren wir Proteinstruktur und Interaktionsstellen in lebenden Zellen mit einer Protein-Footprinting-Technik, die als zellschnelle photochemische Oxidation von Proteinen (IC-FPOP) bezeichnet wird.
Zusammenfassung
Die schnelle photochemische Oxidation von Proteinen (FPOP) ist eine Methode zur Charakterisierung der Proteinstruktur und -wechselwirkungen. FPOP verwendet einen 248 nm Excimer-Laser, um Wasserstoffperoxid zu photolysieren, der Hydroxylradikale produziert. Diese Radikale verändern oxidativ lösungsmittelexponierte Seitenketten von 19 der 20 Aminosäuren. Kürzlich wurde diese Methode in lebenden Zellen (IC-FPOP) verwendet, um Protein-Wechselwirkungen in ihrer nativen Umgebung zu untersuchen. Die Untersuchung von Proteinen in Zellen erklärt intermolekulare Überfüllung und verschiedene Protein-Wechselwirkungen, die für In-vitro-Studien gestört werden. Ein benutzerdefiniertes Einzelzell-Flow-System wurde entwickelt, um die Zellaggregation und Verstopfung während des IC-FPOP zu reduzieren. Dieses Strömungssystem fokussiert die Zellen individuell am Excimerlaser vorbei und sorgt so für eine gleichmäßige Bestrahlung. Durch den Vergleich des Ausmaßes der Oxidation, die aus FPOP erzeugt wird, mit der Lösemittelzugänglichkeit des Proteins, die aus einer Kristallstruktur berechnet wird, kann IC-FPOP die lösungsmittelzugänglichen Seitenketten von Proteinen genau untersuchen.
Einleitung
Hydroxyl radical protein footprinting (HRPF) ist eine Methode, die die Lösemittelzugänglichkeit eines Proteins durch kovalente Modifikationen aus Hydroxylradikalen untersucht. Wenn sich die Proteinstruktur oder die Proteinwechselwirkungen ändern, wird die Slösemittelexposition von Aminosäuren verändert und somit das Ausmaß der Veränderung von Rückständen verändert. Mit HRPF wurden Protein-Wechselwirkungen1,2,3 und Protein-Konformationsveränderungen4,5,6 erfolgreich in vitro abgefragt. Es gibt mehrere Methoden, die Hydroxylradikale für HRPF-Experimente erzeugen, eine davon ist die schnelle photochemische Oxidation von Proteinen (FPOP). FPOP wurde 2005 von Hambly und Gross entwickelt und nutzt einen 248 nm Excimer-Laser zur Herstellung von Hydroxylradikalen durch die Photolyse von Wasserstoffperoxid (H2O2)7.
Kürzlich haben Espino et al. die Verwendung von FPOP erweitert, um die Proteinstruktur in lebenden Zellen zu untersuchen, eine Methode, die als in-Cell FPOP (IC-FPOP)8bezeichnet wird. Im Gegensatz zu In-vitro-Studien ist die Untersuchung von Proteinen in Zellen für molekulare Überfüllung zusammen mit verschiedenen Protein-Wechselwirkungen, die potenziell die Struktur beeinflussen könnten. Darüber hinaus bietet es den Vorteil, eine Momentaufnahme des vollständigen Proteoms bereitzustellen, das möglicherweise strukturelle Informationen von zahlreichen Systemen gleichzeitig bereitstellt, um proteomweite Strukturbiologie durchzuführen. Darüber hinaus ist diese Technik ideal für Proteine, die in vitro schwer zu untersuchen sind, wie Membranproteine.
Erste Studien von IC-FPOP untersuchten erfolgreich 105 Proteine, die in Proteinreichtum und zellulärer Lokalisierung reichen. Um die IC-FPOP-Methode zu verbessern, entwickelten Rinas et al. ein Mikroflow-System für den Einzelzellstrom9. Die Erweiterung des ursprünglichen Strömungssystems begrenzt die Zellaggregation und erhöht die für die Bestrahlung verfügbare H2O2. Im anfänglichen Strömungssystem führten Zellen, die in den Kieselsäureschläuchen verklumpen, zu Verstopfungen und ungleichmäßiger Bestrahlung. Die Einbindung von zwei Strömen eines Mantelpuffers fokussiert die Zellen hydrodynamisch, so dass sie einzeln am Laser vorbeifließen können. Die Einbindung einer separaten Spritze für die H2O2 ermöglicht eine kontrolliertere und optimierte Expositionszeit, die höhereH2O2-Konzentrationen ohne Nebenwirkungen ermöglicht. Auch die Begrenzung der Inkubationszeit begrenzt den Abbau vonH2O2 durch endogene Katasalase. Durch die Integration dieses neuen Strömungssystems erhöhte sich die nachgewiesene Anzahl von Proteinen mit einer FPOP-Modifikation um das 13-fache, wodurch die Möglichkeiten dieser Methode erweitert wurden, eine Vielzahl von Proteinen in lebenden Zellen zu untersuchen. In diesem Protokoll wird ein allgemeines IC-FPOP-Experiment beschrieben, das sich auf die Montage des IC-FPOP-Flusssystems konzentriert.
Protokoll
1. IC-FPOP-Flusssystem einrichten
- Um mit der Montage des Strömungssystems zu beginnen, schneiden Sie die geschmolzene Kieselsäure mit einem Spaltstein auf Größe. Das IC-FPOP-Durchflusssystem benötigt vier 12 cm und eine 17 cm geschmolzene Kieselsäure mit einem Innendurchmesser (ID) von 450 m und einem Außendurchmesser (OD) von 670 m, zwei 24 cm und einem 40 cm mit einem ID von 75 m und einem OD von 360 m und schließlich zwei 57 cm mit einem ID von 150 m und einem OD von 360 m.
HINWEIS: Beim Schneiden der Kieselsäureschläuche, kratzen Sie die Polyimid-Beschichtung vorsichtig weg und biegen Sie sie, um den saubersten Schnitt zu erhalten. Stellen Sie sicher, dass es sich um einen geraden Schnitt handelt (dies ist notwendig, um sicherzustellen, dass sich keine Blockaden oder Leckagen bilden). - Einrichten von 15 Anschlüssen mit nanodichten Hülsen (0,0155" ID X 1/16" OD für 360 'm OD Kieselsäureschläuche und 0,027" ID X 1/16" OD für den 670'm OD Kieselsäureschlauch) mit super flangeless nut PEEK 1/4-28 flat-bottom für 1/16" OD und super flangeless ferrule w/SST ring, Tefzel (ETFE), 1/4-28 flach unten, für 1/16" OD. Erstellen von Verbindungen gemäß dem Herstellerprotokoll (Abbildung 1).
- Legen Sie 6 kleine zylindrische Magnete in eine 500-L-Spritze. Füllen Sie diese Spritze zusammen mit einer weiteren 500-L-Spritze und zwei 5 ml Spritzen mit Puffer und entfernen Sie Luft. Position auf Spritzenpumpe, wie in Abbildung 2Adargestellt.
HINWEIS: Die 5 ml Spritzen sind größer als die 500-L-Spritzen, so dass ein Abstandsabstand benötigt wird, um alle Spritzen gleichzeitig an Ort und Stelle zu ziehen (Abbildung 2B). - Ziehen Sie den Spritzenpumpenstopfen so an, dass die Zellspritze bei stehendem Motor etwa 50 l übrig hat. Dies lässt Platz für die magnetischen Rührwerke. (Abbildung 2C-D).
VORSICHT: Wenn die Spritzenpumpe Druck auf die Magnete ausübt, wird sie die Spritze verstopfen und kann dazu führen, dass die Spritze bricht. - Schließen Sie mit einem Luer-Adapter ein manuelles Ventil an jede Spritze an. Montieren Sie die Kieselsäureschläuche, wie in Abbildung 3dargestellt.
HINWEIS: Fädeln Sie die Linie mit den Zellen + H2O2 den ganzen Weg durch das Kreuz auf die andere Seite. Dann legen Sie es in die 450 m ID Kieselsäureschläuche. Die Mantelpuffer in der 5 ml Spritze fließen schneller als die Zellen und H2O2. Mit den Mantelpuffern auf beiden Seiten werden die Zellen hydrodynamisch in eine einzige Linie für die Bestrahlung fokussiert. - Positionsflusssystem neben Laser. Brennen Sie mit einem Feuerzeug die Kieselsäurebeschichtung auf den 450-m-ID-Schläuchen weg, um ein Fenster für die Laserbestrahlung zu schaffen.
- Legen Sie einen Magnetischen Rührer über der Zellspritze, der die sechs Magnete enthält.
- Stellen Sie die Spritzenpumpe auf 492,4 l/min für eine Enddurchflussrate von 1.083,3 l/min. Durchflusspuffer durch das System dreimal, um das System zu spülen und auf Leckagen zu testen.
- Konzentrieren Sie den Excimerlaser mit einer konvexen Linse auf die Kieselsäureschläuche. Einmal fokussiert, testen Sie das Bestrahlungsfenster, indem Sie ein kleines Stück Papier hinter den Kieselsäureschläuchen platzieren und den Laser einschalten. Messen Sie die region, die durch die Bestrahlung verbrannt wurde. Berechnen Sie die benötigte Laserfrequenz, indem Sie das Bestrahlungsfenster und die Durchflussrate verwenden, um einen Ausschlussanteil von Null zu erhalten.
HINWEIS: Die empfohlene Laserenergie für ein IC-FPOP-Experiment beträgt 120 mJ. Um einen Ausschlussanteil von 0 mit einem Bestrahlungsfenster von 2,58 mm und einer Durchflussrate von 1083,3 l/min zu erhalten, muss die Frequenz 44 betragen. Im Folgenden finden Sie die Gleichungen, die erforderlich sind, um die Laserfrequenz zu berechnen, wenn das Bestrahlungsfenster, die Durchflussrate und der Ausschlussanteil bekannt sind.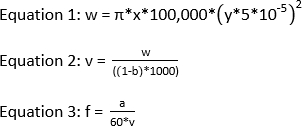
wobei w das Volumen in nL, x die Laserpunktbreite in mm, y die Kieselsäure-Schlauch-ID in m, v das Gesamtvolumen in L, b der Ausschlussanteil, a die Durchflussrate in L/min und f die Frequenz in Hz ist.
2. Machen Sie Quench und H2O2
- Quench mit 100 mM N-tert-Butyl-alpha-Phenylnitron (PBN) und 100 mM N,N'-dimethylthiourea (DMTU) herstellen. Aliquot 11 ml Abschreck für jede Probe in ein 50 ml konisches Rohr.
- H2O2 bis 200 mM verdünnen. Jede Probe benötigt 500 l H2O2.
HINWEIS: Die Abschreckung kann am Vortag hergestellt und bei 4 °C über Nacht vor Licht geschützt gelagert werden. H2O2 sollte am Tag des Experimentierens frisch gemacht werden.
3. Sammeln von Zellen
- Wachsen Sie Zellen in einem T175-Kolben auf etwa 70-90% Konfluenz.
- Entfernen Sie die Medien und spülen Sie sie mit Puffer.
HINWEIS: Typische Puffer sind die zellkulturgrade Dulbecco-Phosphat-gepufferte Kochsalzlösung (DPBS) oder Hanks ausgewogene Salzlösung (HBSS). - Lösen Sie Zellen entweder mit trypsin-EDTA oder mit einem Schaber.
- Einmal losgelöst resuspend in 10 ml Puffer und zählen Sie die Zellen.
- Drehen Sie nach unten, entfernen Sie den Puffer und trypsin-EDTA, und setzen Sie erneut, um 2 x 106 Zellen/ml zu machen.
- Aliquot 500 l der Zellen pro Probe.
HINWEIS: Erstellen Sie für jede Bedingung mindestens 3 Laserproben und 3 keine Lasersteuerungen.
4. Durchführung von IC-FPOP
- Füllen Sie die beiden 5 ml Spritzen mit Puffer, die 500-L-Spritze mit den Magneten mit den Zellen und die letzte 500-L-Spritze mit H2O2. Schalten Sie den Magnetrührer ein.
- Spike in 220 l Dimethylsulfoxid (DMSO) zu einem Aliquot von Quench, sanft mischen, und hinter Strömungssystem platzieren, um bestrahlte Proben zu sammeln. Die Zugabe von DMSO hemmt endogenes Methionin-Sulfoxid-Reduktase.
- Schalten Sie den Laser ein, warten Sie 7 s, und schalten Sie dann das Durchflusssystem ein.
- Sobald die Probe mit dem Fließen fertig ist, schalten Sie den Laser aus und mischen Sie die Abschreckung vorsichtig mit der gesammelten Probe. Legen Sie diese in den Schritten 4.5 und 4.6 zur Seite.
- Füllen Sie alle vier Spritzen mit dem Puffer, in dem die Zellen aufgehängt werden, und fließen Sie ihn durch das Durchflusssystem.
- Nachdem das System die Spülung beendet hat, wiederholen Sie die Schritte 4.1 und 4.2. Starten Sie den Fluss ohne Bestrahlung. Dies ist die keine Lasersteuerung, um die Hintergrundoxidation in den Zellen zu berücksichtigen.
- Während die nächste Probe läuft, drehen Sie die vorherige Probe bei 450-800 x g für 5 min, entfernen Sie das Lösungsmittel, und setzen Sie in 100 l eines Zelllysepuffers wie dem Radioimmunoprecipitation-Assay (RIPA)-Puffer wieder ab.
- Übertragen Sie die Probe in ein Mikrozentrifugenrohr und blitzen Sie in flüssigem Stickstoff einfrieren.
- Wenn alle Proben ausgeführt sind, zerlegen Sie das Durchflusssystem zur Reinigung. Entsorgen Sie die verwendeten Kieselsäureschläuche und reinigen Sie alle anderen Anschlüsse, indem Sie 1 h in 50% Wasser beschallen: 50% Methanol. Reinigen Sie die Spritzen gemäß den Anweisungen des Herstellers.
5. Digest
- Verdauen Sie die ganze Zelle lysieren. Beginnen Sie mit dem Auftauen der Proben und erhitzen Sie bei 95 °C für 10 min.
- Nach dem Erhitzen 15 min auf Eis abkühlen.
- Fügen Sie 25 Einheiten Nuklease hinzu, um DNA und RNA zu verdauen und 15 min im Raum gemäßigt zu inkubieren.
- Spinproben mit einer Tischzentrifuge bei 16.000 x g für 10 min bei 4 °C.
- Sammeln Sie den Überstand und übertragen Sie ihn in ein sauberes Mikrozentrifugenrohr.
- Überprüfen Sie die Proteinkonzentration mit einem Protein-Assay-Kit.
- Übertragen Sie die Probe 20-100 g in ein sauberes Mikrozentrifugenrohr und bringen Sie sie auf 100 l.
- Proben mit 20 mM Dithiothreiotol (DTT) bei 50 °C für 45 min reduzieren.
- Kühlen Sie die Proben bei Raumtemperatur für 15 min.
- Alkylat mit 20 mM Iodoacetamid (IAA) bei Raumtemperatur für 20 min lichtgeschützt.
- Vorgekühltes Aceton mit einem Protein im Verhältnis 1:4 hinzufügen: Aceton. Proben mischen und über Nacht in -20 °C aufstellen.
- Am nächsten Morgen Spinproben bei 16.000 x g für 10 min bei 4 °C.
- Entfernen Sie den Überstand und fügen Sie 50 l 90% vorgekühltem Aceton hinzu. Proben mischen und bei 16.000 x g 5 min bei 4 °C nach unten drehen.
- Entfernen Sie Aceton und lassen Sie die Proben trocknen, indem Sie die Kappen der Mikrozentrifuge mit einem fusselfreien Wischtuch, das die Oberseite bedeckt, offen lassen. Nachdem die Proben getrocknet sind, setzen Sie das Proteinpellet mit 10 mM Tris Puffer pH 8 wieder auf.
- Setzen Sie 20 g Trypsin in 40 l von 10 mM Tris Puffer pH 8 aus. Fügen Sie 2 g Trypsin hinzu (Masse: Massenverhältnis von 1 Trypsin: 50 Probe). Proben bei 37 °C über Nacht inkubieren.
- Am nächsten Morgen überprüfen Sie die Peptidkonzentration mit einem Peptid-Test. Nachdem die Probe für den Peptid-Assay entfernt wurde, löschen Sie die Trypsin-Verdauung durch Zugabe von Ameisensäure zu den Proben (Endkonzentration beträgt 5% Ameisensäure).
- Sobald die endgültige Peptidkonzentration bestimmt ist, übertragen Sie 10 g jeder Probe in ein sauberes Mikrozentrifugenrohr. Dadurch wird sichergestellt, dass die gleiche Menge jeder Probe analysiert wird. Trocknen Sie die Probe mit einer Vakuumzentrifuge. Nach dem Trocknen resuspendieren mit 20 l Massespektrometrie Grad 0,1% Ameisensäure. Übertragen Sie Proben auf Autosampler-Durchstechflaschen.
6. Flüssige Chromatographie-Tandem-Massenspektrometrie
- Um FPOP-Modifikationen zu lokalisieren, analysieren Sie das verdaute Zelllysat mithilfe der LC-MS/MS-Analyse.
- Verwenden Sie mobile Phasen von 0,1% Ameisensäure in Wasser (A) und 0,1% Ameisensäure in Acetonitril (B).
- Eine 180 x 20 mm C18-Fangsäule und eine Waschprobe mit 99 % (A) und 1 % (B) für 15 min auf eine Fangsäule mit 180 x 20 mm C18 (5 m und 100 °
- Führen Sie die analytische Trennmethode mit einer Durchflussrate von 0,300 l/min ab 3% (B) für eine min und dann rampe auf 10% (B) von 1-2 min. Nächste Rampe zu 45% (B) von 2-100 min dann 100% (B) von 100-110 min. Reinigen Sie die Säule, indem Sie bei 100% (B) von 110-115 min halten. Rekonditionieren Sie die Säule, indem Sie von 115-116 min auf 3% (B) herunterfahren und bei 3% (B) von 116-130 min halten.
- Legen Sie die MS-Erfassungsmethode auf eine Auflösung von 60.000 bei einem m/z-Scanbereich von 375-1500 fest. Stellen Sie das Ziel der automatischen Verstärkungssteuerung (AGC) auf 5,0 x 105 mit einer maximalen Einspritzzeit von 50 ms ein.
- Wählen Sie während der MS-Erfassung die Vorläuferionen mit den Ladezuständen 2-6 zur Isolierung über datenabhängige Erfassung (DDA) mit einem Isolationsfenster von 1,2 m/z und einer Zykluszeit von 4 s aus. Wählen Sie die Peptide mit einem Intensitätsschwellenwert von 5,0 x 104 für die HCD-Aktivierung mit einer normalisierten Energie von 32%. Schließen Sie die Peptide nach 1 MS/MS-Erfassung für 60 s aus. Stellen Sie die MS/MS-Auflösung auf 15.000 mit einem AGC-Ziel von 5,0 x 104 und einer maximalen Injektionszeit von 35 ms ein.
7. Datenverarbeitung
- Durchsuchen Sie die RAW-Dateien einer verfügbaren Proteinanalysesoftware anhand einer relevanten Proteindatenbank und des relevanten Verdauungsenzyms. Verwenden Sie hier die Swiss-Prot Homo Sapiens Datenbank und trypsin.
- Stellen Sie die Vorläufermasse für die Suche zwischen 350 und 5.000 Da und einer Massentoleranz von 10 ppm ein. Es kann höchstens 1 verpasste Dekolleté-Stelle mit einer Peptidlänge zwischen 6 bis 144 Rückständen sein. Diese Einschränkungen erleichtern die Datenbanksuche.
- Stellen Sie die maximale Massentoleranz der Fragmentionen auf 0,02 Da mit dem Carbamidomethyl (+57.021) als statische Modifikation und alle FPOP-Modifikationen von 17 Aminosäuren als dynamische Modifikation ein(Abbildung 4 ist ein Beispiel für den Proteinanalyse-Workflow, der zum Nachweis von FPOP-Modifikationen verwendet wird).
HINWEIS: FPOP-Modifikationen an Serin und Threonin sind aufgrund ihrer geringeren Reaktivität mit Hydroxylradikalen nicht in die Suche einbezogen. - Suchen Sie mit einer Lockvogeldatenbank mit einer falschen Erkennungsrate von 1% und 5%.
- Sobald die Datei suche, berechnen Sie die Ausdehnung der FPOP-Änderung. Öffnen Sie Proteome Discoverer 2.2, Exportsequenz, Änderungsorte, Proteinbeitritt, Spektrumdatei, Vorläuferhäufigkeit und Aufbewahrungszeitinformationen. Berechnen Sie den Umfang der Änderung aus Gleichung 4:

Der modifizierte EIC-Bereich ist der chromatographische Bereich eines bestimmten Peptids mit einer Hydroxylradikalmodifikation. Der EIC-Bereich ist der gesamte chromatographische Bereich sowohl modifizierter als auch unveränderter Bereiche dieses spezifischen Peptids. Das Oxidationsausmaß wird in den Proben mit und ohne Bestrahlung berechnet. Die Probe, die die Bestrahlung (Kontrolle) auslässt, ist für jede Hintergrundoxidation verantwortlich, die in den Zellen vor und nach der Exposition nach H2O2 vorhanden sein könnte. Die Steuerelemente werden von den Bestrahlungsproben subtrahiert, um FPOP-spezifische Modifikationen zu isolieren.
Ergebnisse
IC-FPOP ist eine Footprinting-Methode, um Protein-Wechselwirkungen in lebenden Zellen abzuhören. Im IC-FPOP-Flusssystem ist die H2O2-Expositionszeit auf ca. 3 s begrenzt, was höhereH2O2-Konzentrationen ohne nachteilige Folgen für die Zellen rechtfertigt. Das Strömungssystem enthält auch zwei Ströme von Mantelpuffer, die die Zellen hydrodynamisch auf die Mitte des Rohres fokussiert, wodurch ein einziger Zellstrom erzeugt wird, der gleichmäßig bestrahlt werden soll (Abbildung 5)9. Die Fluoreszenzbildgebung orthogonaler YZ-gestapelter Bilder (Abbildung 5A) zeigt eine klare Trennung des Mantelpuffers (enthält ein FITC-Fluorophor) von der Zelllösung (die ein TMRM-Fluorophor enthält). Um diese Trennung hervorzuheben, zeigen Abbildung 5B und Abbildung 5C dreidimensionale durchschnittliche Wärmekarten der Mantelpufferlösung oder der Zelllösung, was eine minimale Durchmischung der beiden Lösungen veranschaulicht.
Die Verwendung des Einzelzell-Durchflusssystems erhöht die Anzahl der oxidativ modifizierten Proteine um das 13-fache (Abbildung 6A)9. Bei dieser Methode werden Proteine in vielen Zellkompartimenten mit Membranproteinen, zytoplasmatischen Proteinen und Proteinen innerhalb des Zellkerns als die am weitesten verbreiteten8,9gekennzeichnet. Um sicherzustellen, dass Proteine innerhalb intakter Zellen modifiziert wurden, wurden nach h2O2-Behandlung und Bestrahlung fluoreszierende Bilder von CellROX-behandelten Zellen durchgeführt (Abbildung 6B)8. Die Stabilität der Zellen während des gesamten Etikettierungsprozesses bestätigt die Wirksamkeit von IC-FPOP zur Untersuchung von Proteinen in ihrer nativen zellulären Umgebung. Durch die Verwendung der Tandem-Massenspektrometrie können diese Modifikationen auf bestimmte Aminosäuren auf einem Protein lokalisiert werden. Abbildung 7 stellt eine Modifikation dar, die während des IC-FPOP zusammen mit dem extrahierten Ionenchromatogramm stattfindet. Die im extrahierten Ionenchromatogramm beobachtete Verschiebung übersetzt sich auf die Veränderung der Hydrophobizität, die durch das oxidierte Methionin im modifizierten Peptid verursacht wird.
Um zu testen, ob die FPOP-Modifikationen die Lösemittel-Zugänglichkeit innerhalb der Zellen sondieren, wurde in-zellbeschriftemten Actin sowohl mit einer In-vitro-Fußabdruckstudie als auch mit verschiedenen Kristallstrukturen von Actin verglichen (Abbildung 8)8. Das in der Zelle beschriftete Aktin ist in Abbildung 8A dargestellt und zeigt vergleichbare Oxidationsausmaße aus der In-vitro-Studie von Guan et al.10 (Abbildung 8B), die Schlussfolgerung, dass Actin eine ähnliche Lösungsmittelzugänglichkeit sowohl für in-zellige als auch für In-vitro-Studien hat. Um weiter zu bestätigen, dass IC-FPOP die Lösemittel-Zugänglichkeit von Actin untersucht, wurde das Ausmaß der FPOP-Modifikationen mit der Lösemittel-Zugänglichkeit der gekennzeichneten Rückstände verglichen, die aus zwei Aktinkristallstrukturen berechnet wurden (Abbildung 8C). Diese Korrelation zeigt, dass IC-FPOP die Lösemittelzugänglichkeit des monomeren Proteins gut untersucht.

Abbildung 1: So konstruieren Sie Ferules ordnungsgemäß. (A) Ferrules, Kieselsäureschläuche und Hülse vor dem Anziehen zusammenlegen. (B) Ziehen Sie alle Komponenten zusammen. (C) Das Endprodukt erzeugt eine Ferule, die an der Hülse angezogen wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Einrichten des IC-FPOP-Flusssystems. (A) Bild eines vollständig montierten IC-FPOP-Durchflusssystems, das neben dem Laser positioniert ist. (B) Beispiel eines Abstandsers, der erforderlich ist, um den Außendurchmesser der 500 L Spritzen zu erhöhen, um alle Spritzen erfolgreich zusammen zu festziehen. (C) Repräsentative Bilder, die den Platzfürdie für die Magnetrührer zeigen. (D) Stopper sind notwendig, um die Spritzenpumpe zu stoppen, ohne die Spritzen zu brechen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
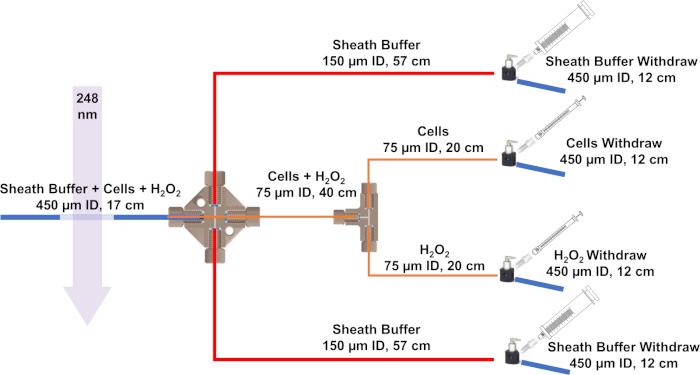
Abbildung 3: Schematic des für IC-FPOP entwickelten Strömungssystems. Blaue Linien stellen Kieselsäureschläuche mit einer ID von 450 m und einer OD-Id von 670 m dar, rote Linien haben eine ID von 150 m und eine OD-Id von 360 m und orangefarbene Linien eine ID von 75 m und eine OD-Datei von 360 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Proteinanalysesoftware zur Erkennung von FPOP-Modifikationen. Ein typischer Workflow mit den entsprechenden Änderungen, die in jedem Knoten durchsucht werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
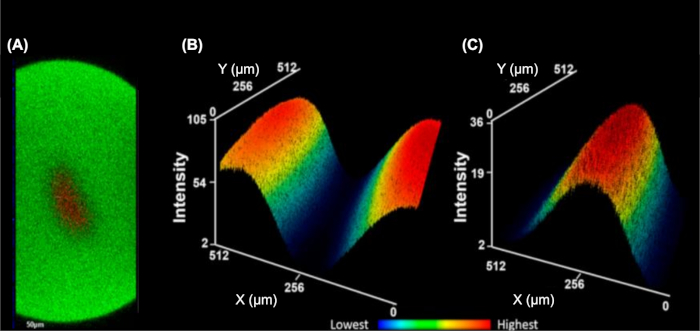
Abbildung 5: Das Einzelzell-Durchflusssystem fokussiert die Zellen hydrodynamisch in einen einzelnen Strom. (A) Orthogonaler YZ-Stack zur Veranschaulichung der 3D-Fokussierung des Zellanalyten (rot, TMRM-Fluorophor) umgeben vom Mantelpuffer (grün, FITC-Fluorophor). Dreidimensionale durchschnittliche Intensität Sumkarte des Mantelpuffers (B) und des Zellanalyten (C). Die unteren Intensitäten sind blau und die höchsten rot (B-C). Diese Abbildung wurde von Rinas et al.9geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
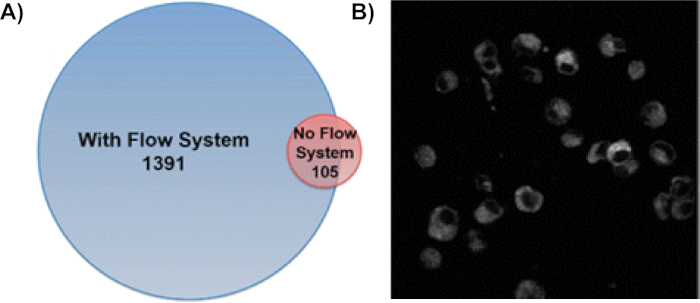
Abbildung 6: Die Nutzung des IC-FPOP-Flusssystems erhöht fPOP-modifizierte Proteine in Aufnahmezellen drastisch. (A) Vergleich von oxidierten Proteinen, die mit und ohne das Strömungssystem identifiziert werden. Das Strömungssystem identifizierte 1391 FPOP-modifizierte Proteine, während nur 105 Proteine ohne Strömungssystem mit einer Überlappung von 58 modifizierten Proteinen identifiziert wurden. Diese Zahl wurde von Rinas et al.9 (B) Fluoreszenzbildgebung von CellROX behandelten Zellen modifiziert, nachdem IC-FPOP zeigt, dass die Zellen nach der oxidativen Etikettierung noch intakt sind. Die Zellen wurden mit einem Olympus Fluoview FV1000 MPE Multiphotonenmikroskop bei 665 nm abgebildet. Das gezeigte Bild ist ein einzelnes Segment. Diese Abbildung wurde von Espino et al.8geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Beispiele für Tandem-MS/MS-Spektren, die während des IC-FPOP stattfinden. Produkt-Ionen-Spektren (MS/MS) eines (A) unveränderten Peptids und einer (B) Oxidation, die auf Rückstand M8 auf diesem Peptid nachgewiesen wurde. Ein repräsentatives EIC des (C) unveränderten Peptids und (D) modifizierten Peptids. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: IC-FPOP ist wirksam bei der Prüfung der Lösungsmittelzugänglichkeit von Proteinen. (A) Ausmaß der Modifikation der 9 oxidativ modifizierten Peptide aus Actin. Die Werte werden als Mittelwerte plus und minus Standardabweichung (n = 3) angezeigt. (B) Modifikation von In-vitro-Aktivpeptiden, die durch Synchrotronradiolyse aus Guan et al.10 (C) Oxidation von Rückständen FPOP-Modifikationen mit SASA in den engen (Dreiecke, gestrichelten Trendlinien) und offenen (Kreisen, feste Trendlinie) Actin-Zuständen oxidiert werden. Diese Abbildung wurde von Espino et al.8geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Mehrere auf Massenspektrometrie basierende Techniken wurden entwickelt, um Proteinstruktur und Protein-Ligand-Komplexe proteomweit in ganzen Zellen oder Zelllysaten zu untersuchen. Diese Techniken umfassen unter anderem die Stabilität von Proteinen aus Oxidationsgeschwindigkeit (SPROX), thermischeproteomprofilierung (TPP), chemische Vernetzung (XL-MS) und Hydroxylradikalprotein-Footprinting (HRPF). Jede Technik hat einzigartige Einschränkungen und Vorteile im Vergleich zueinander, die ausgiebig überprüft wurden12. Jede dieser Methoden wurde für proteom breite Strukturbiologie verwendet, um Proteinstruktur aufzuklären und schließlich innerhalb der komplexen zellulären Umgebung zu funktionieren. IC-FPOP ist eine HRPF-Technik, die Hydroxylradikale nutzt, um lösungsmittelexponierte Seitenketten von Aminosäuren oxidativ zu modifizieren, die Proteinstruktur und Protein-Ligand-Wechselwirkungen innerhalb lebensfähiger Zellen zu untersuchen13. IC-FPOP ist eine Verbesserung der anfänglichen HRPF in lebenden Zellen, die Fenton-Chemie verwendet, um Radikale auf der Minutenzeitskala14zu erzeugen. In dieser Studie wurden strukturelle Veränderungen in einem integralen Membranprotein als Reaktion auf die Senkung des pH- oder Ionenstärke des Puffers erfolgreich mit einer guten Oxidationsabdeckung im gesamten Protein charakterisiert. Im Vergleich zur Fenton-Chemie ist IC-FPOP viel schneller und modifizieren Proteine auf der Mikrosekunden-Zeitskala, so dass die native Proteinkonformation untersucht werden kann.
Ein wichtiger Test für IC-FPOP besteht darin, die Lebensfähigkeit der Zellen nach der Exposition gegenüberH2O2zu bestätigen. Mit einer 40 cm-Mischlinie werden die Zellen in H2O2 etwa 3 s vor der Bestrahlung inkubiert. Diese Zeit kann durch Ändern der Länge dieses Kieselsäureschlauchs eingestellt werden. Es ist bemerkenswert, dass, obwohl die Verwendung von Trypan blau, um die Zelllebensfähigkeit zu testen zeigt, die Integrität der Zellen nach h2O2 Inkubation aufrechterhalten werden, die Zellen möglicherweise unter Stress-Effekt-Signalbahnen sein könnten, die mit H2O2interagieren. Glücklicherweise ist die kurze Inkubationszeit schneller als die Proteinsynthese, die Vertrauen gibt, dass die vorhandenen Proteine nicht durchH2O2induziert werden.
Der nächste wichtige Schritt besteht darin, die ordnungsgemäße Montage des Strömungssystems zu bestätigen. Stellen Sie nach der Montage sicher, dass nach dem Spülen des Systems mit dem gewünschten Puffer keine Leckagen vorhanden sind. Wenn Lecks vorhanden sind, stellen Sie sicher, dass die Kieselsäureschläuche richtig geschnitten wurden und bündig gegen die Ferrule ist, um eine richtige Dichtung zu machen, sobald sie angezogen wurde. Alle Teile sind von Hand angezogen, so dass keine Werkzeuge erforderlich sind. Stellen Sie bei jedem IC-FPOP-Experiment sicher, dass die Magnetischen Rührwerke in der Zellspritze in Bewegung bleiben. Diese kleine Agitation begrenzt die Anzahl der Zellen, die sich am Boden der Spritze absetzen, aber nicht hart genug sind, um die Zellen zu scheren. Nach einem Durchlauf sind in der Spritze noch ca. 50 l Zellen übrig. Achten Sie immer darauf, dies mit einem Spülschritt zu verdünnen, um die Anzahl der Zellen zu begrenzen, die zum nächsten Experiment übertragen werden. Es wird empfohlen, eine Frischzellenspritze zu verwenden, wenn mehrere Zellbehandlungen verglichen werden. Es ist auch wichtig, einen geeigneten Puffer für die getesteten Zellen auszuwählen. Einige Puffer löschen den Hydroxylradikal, was zu weniger Modifikationen an Proteinen führt. Xu et al. haben gezeigt, dass einige häufig verwendete Puffer die Hydroxylradikallebensdauer11verringern. DPBS und HBSS sind gängige Puffer, die für IC-FPOP-Experimente verwendet werden.
Optimieren Sie nach IC-FPOP das Verdauungsprotokoll basierend auf den erforderlichen Parametern. Da FPOP irreversible kovalente Modifikationen produziert, bleibt genügend Zeit für eine gründliche Verdauung und Reinigung, ohne die Etikettierungsabdeckung zu verlieren. Testen und normalisieren Sie die Proteinkonzentration immer, so dass gleichmäßige Peptidkonzentrationen für die Tandem-Massenspektrometrie geladen werden. Schließlich sollten Sie beachten, dass eine Immunpräzipitation nicht in Verbindung mit IC-FPOP durchgeführt werden kann. Wenn eine FPOP-Änderung auf den Interaktionsbereich abzielt, wird die Affinität des Antikörpers verringert. Um die Identifizierung von FPOP-Modifikationen zu erhöhen, haben 2D-chromatographische Trennschritte gezeigt, dass die Anzahl der oxidierten Peptide15mehr als verdreifacht hat.
Eine Herausforderung eines jeden FPOP-Experiments ist der komplizierte Grad der Datenanalyse aufgrund der möglichen Oxidationsprodukte, die entstehen können. Dies gilt sowohl für in-Zell- als auch für in vitro, wird aber mit der zusätzlichen Komplexität der Analyse von Zelllysaten drastisch erhöht. Mit der weiteren Optimierung von IC-FPOP entstehen mehr Proteine mit höheren Modifikationsabdeckungen, wodurch die Analyse beschleunigt wird. Die Schermenge an Daten, die aus einem einzigen IC-FPOP-Experiment generiert werden, schränkt die Verwendung manueller Validierung ein, wodurch sich Forscher stärker auf Software verlassen. Aus diesem Grund entwickelten Rinas et al. eine Quantifizierungsstrategie für HRPF mit Proteome Discoverer (PD)16. Diese Methode verwendet einen Workflow mit mehreren Suchknoten auf PD in Kombination mit einer quantitativen Plattform in einer Kalkulationstabelle. Weitere Verbesserungen auf der IC-FPOP-Plattform sind im Gange, um die Anzahl der identifizierten Peptide mit FPOP-Modifikationen zusammen mit erhöhter Reproduzierbarkeit und Quantifizierungsgenauigkeit zu erhöhen.
Offenlegungen
Lisa Jones ist Eine Erfinderin der Flow Assembly for Cells Patent (Publikationsnummer: 20180079998).
Danksagungen
Diese Arbeit wurde durch den NSF CAREER Award (MCB1701692) für LMJ unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-53A | any brand is sufficient |
| 5 mL Gas Tight Syringe, Removable Luer Lock | SGE Analytical Science | 008760 | |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | any brand is sufficient |
| 500 µL SGE Gastight Syringes: Fixed Luer-Lok Models | Fisher Scientific | SG-00723 | |
| Acetone, HPLC Grade | Fisher Scientific | A929-4 | 4 L quantity is not necessary |
| Acetonitrile with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | LS120-500 | |
| ACQUITY UPLC M-Class Symmetry C18 Trap Column, 100 Å, 5 µm, 180 µm x 20 mm, 2G, V/M, 1/pkg | Waters | 186007496 | |
| ACQUITY UPLC M-Class System | Waters | ACQUITY UPLC M-Class System | |
| Aluminum Foil | Fisher Scientific | 01-213-100 | any brand is sufficient |
| Aqua 5 µm C18 125 Å packing material | Phenomenex | 04A-4299 | |
| Centrifuge | Eppendorf | 022625501 | |
| Delicate Task Wipers | Fisher Scientific | 06-666A | |
| Dithiothreiotol (DTT) | AmericanBio | AB00490-00005 | |
| DMSO, Anhydrous | Invitrogen | D12345 | |
| EX350 excimer laser | GAM Laser | EX350 excimer laser | |
| FEP Tubing 1/16" OD x 0.020" ID | IDEX Health & Science | 1548L | |
| Formic Acid, LC/MS Grade | Fisher Scientific | A117-50 | |
| HV3-2 VALVE | Hamilton | 86728 | |
| Hydrogen Peroxide | Fisher Scientific | H325-100 | any 30% hydrogen peroxide is sufficient |
| Iodoacetamide (IAA) | ACROS Organics | 122270050 | |
| Legato 210 syringe pump | KD Scientific | 788212 | Any syringe pump that can hold 4, 5 mL syringes, withdraw and expel liquid, and have a way to stale the motor should work |
| Luer Adapter Female Luer to 1/4-28 Male Polypropylene | IDEX Health & Science | P-618L | |
| Methanol, LC/MS Grade | Fisher Scientific | A454SK-4 | 4 L quantity is not necessary |
| Microcentrifuge | Thermo Scientific | 75002436 | |
| N,N'-Dimethylthiourea (DMTU) | ACROS Organics | 116891000 | |
| NanoTight Sleeve Green 1/16" ID x .0155" ID x 1.6" | IDEX Health & Science | F-242X | |
| NanoTight Sleeve Yellow 1/16" OD x 0.027" ID x 1.6" | IDEX Health & Science | F-246 | |
| N-tert-Butyl-α-phenylnitrone (PBN) | ACROS Organics | 177350250 | |
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | Orbitrap Fusion Lumos Tribrid Mass Spectrometer | other high resolution instruments (e.g. Q exactive Orbitrap or Orbitrap Fusion) can be used |
| PE50-C pyroelectric energy meter | Ophir Optronics | 7Z02936 | |
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Scientific | 23275 | |
| Pierce Rapid Gold BCA Protein Assay Kit | Thermo Scientific | A53225 | |
| Pierce Trypsin Protease, MS Grade | Thermo Scientific | 90058 | |
| Pierce Universal Nuclease for Cell Lysis | Fisher Scientific | 88702 | |
| Polymicro Cleaving Stone, 1" x 1" x 1/32" | Molex | 1068680064 | any capillary tubing cutter is sufficient |
| Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 150 µm, Outer Diameter 360 µm, TSP150350 | Polymicro Technologies | 1068150024 | |
| Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 450 µm, Outer Diameter 670 µm, TSP450670 | Polymicro Technologies | 1068150025 | |
| Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 75 µm, Outer Diameter 360 µm, TSP075375 | Polymicro Technologies | 1068150019 | |
| Potassium Phosphate Monobasic | Fisher Scientific | P382-500 | |
| Proteome Discover 2.2 (bottom-up proteomics software) | Thermo Scientific | OPTON-30799 | |
| Rotary Magnetic Tumble Stirrer | V&P Scientific, Inc. | VP 710D3 | |
| Rotary Magnetic Tumble Stirrer, accessory kit for use with Syringe Pumps | V&P Scientific, Inc. | VP 710D3-4 | |
| Super Flangeless Ferrule w/SST Ring, Tefzel™ (ETFE), 1/4-28 Flat-Bottom, for 1/16" OD | IDEX Health & Science | P-259X | |
| Super Flangeless Nut PEEK 1/4-28 Flat-Bottom, for 1/16" & 1/32" OD | IDEX Health & Science | P-255X | |
| Super Tumble Stir Discs, 3.35 mm diameter, 0.61 mm thick | V&P Scientific, Inc. | VP 722F | |
| Thermo Scientific Pierce RIPA Buffer | Fisher Scientific | PI89900 | |
| Tris Base | Fisher Scientific | BP152-500 | |
| Upchurch Scientific Low-Pressure Crosses: PEEK | Fisher Scientific | 05-700-182 | |
| Upchurch Scientific Low-Pressure Tees: PEEK | Fisher Scientific | 05-700-178 | |
| UV Fused Silica Plano-Convex Spherical Lenses | THORLABS | LA4052 | |
| V&P Scientific IncSupplier Diversity Partner TUMBL STIR DISC PARYLENE 1000 | V&P Scientific, Inc. | VP724F | |
| VHP MicroTight Union for 360µm OD | IDEX Health & Science | UH-436 | |
| Water with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | LS118-500 | |
| Water, LC/MS Grade | Fisher Scientific | W6-4 |
Referenzen
- Gau, B., Garai, K., Frieden, C., Gross, M. L. Mass spectrometry-based protein footprinting characterizes the structures of oligomeric apolipoprotein E2, E3, and E4. Biochemistry. 50 (38), 8117-8126 (2011).
- Li, Z., et al. High structural resolution hydroxyl radical protein footprinting reveals an extended Robo1-heparin binding interface. Journal of Biological Chemistry. 290 (17), 10729-10740 (2015).
- Zhang, H., Gau, B. C., Jones, L. M., Vidavsky, I., Gross, M. L. Fast photochemical oxidation of proteins for comparing structures of protein− ligand complexes: the calmodulin− peptide model system. Analytical Chemistry. 83 (1), 311-318 (2010).
- Jones, L. M., et al. Complementary MS methods assist conformational characterization of antibodies with altered S-S bonding networks. Journal of the American Society for Mass Spectrometry. 24 (6), 835-845 (2013).
- Kiselar, J. G., Janmey, P. A., Almo, S. C., Chance, M. R. Structural analysis of gelsolin using synchrotron protein footprinting. Molecular & Cellular Proteomic. 2 (10), 1120-1132 (2003).
- Vahidi, S., Stocks, B. B., Liaghati-Mobarhan, Y., Konermann, L. Mapping pH-induced protein structural changes under equilibrium conditions by pulsed oxidative labeling and mass spectrometry. Analytical Chemistry. 84 (21), 9124-9130 (2012).
- Hambly, D. M., Gross, M. L. Laser flash photolysis of hydrogen peroxide to oxidize protein solvent-accessible residues on the microsecond timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Espino, J. A., Mali, V. S., Jones, L. M. In cell footprinting coupled with mass spectrometry for the structural analysis of proteins in live cells. Analytical Chemistry. 87 (15), 7971-7978 (2015).
- Rinas, A., Mali, V. S., Espino, J. A., Jones, L. M. Development of a Microflow System for In-Cell Footprinting Coupled with Mass Spectrometry. Analytical Chemistry. 88 (20), 10052-10058 (2016).
- Guan, J. Q., Almo, S. C., Reisler, E., Chance, M. R. Structural Reorganization of Proteins Revealed by Radiolysis and Mass Spectrometry: G-Actin Solution Structure Is Divalent Cation Dependent. Biochemistry. 42 (41), 11992-12000 (2003).
- Xu, G., Chance, M. R. Hydroxyl radical-mediated modification of proteins as probes for structural proteomics. Chemical Reviews. 107 (8), 3514-3543 (2007).
- Kaur, U., et al. Proteome-Wide Structural Biology: An Emerging Field for the Structural Analysis of Proteins on the Proteomic Scale. Journal of Proteome Research. 17 (11), 3614-3627 (2018).
- Chea, E. E., Jones, L. M. Analyzing the structure of macromolecules in their native cellular environment using hydroxyl radical footprinting. Analyst. 143 (4), 798-807 (2018).
- Zhu, Y., et al. Elucidating in vivo structural dynamics in integral membrane protein by hydroxyl radical footprinting. Molecular & Cellular Proteomic. 8 (8), 1999-2010 (1999).
- Rinas, A., Jones, L. M. Fast photochemical oxidation of proteins coupled to multidimensional protein identification technology (MudPIT): expanding footprinting strategies to complex systems. Journal of the American Society for Mass Spectrometry. 26 (4), 540-546 (2015).
- Rinas, A., Espino, J. A., Jones, L. M. An efficient quantitation strategy for hydroxyl radical-mediated protein footprinting using Proteome Discoverer. Analytical and Bioanalytical Chemistry. 408 (11), 3021-3031 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten