Method Article
Hücre İçi Hızlı Fotokimyasal Oksidasyon ile Hücresel Proteinlerin Karakterizasyonu
Bu Makalede
Özet
Burada, canlı hücrelerdeki protein yapısını ve etkileşim alanlarını, proteinlerin hücre içi hızlı fotokimyasal oksidasyonu (IC-FPOP) olarak adlandırılan bir protein ayak izi tekniği ile karakterize ediyoruz.
Özet
Proteinlerin hızlı fotokimyasal oksidasyonu (FPOP), protein yapısını ve etkileşimlerini karakterize etmek için kullanılan hidroksil radikal protein ayak izi yöntemidir. FPOP hidroksil radikalleri üreten hidrojen peroksit fotolize için 248 nm excimer lazer kullanır. Bu radikaller oksidatif 20 amino asit19 solvent maruz yan zincirleri değiştirmek. Son zamanlarda, bu yöntem canlı hücrelerde (IC-FPOP) kendi doğal ortamda protein etkileşimleri çalışma için kullanılmıştır. Hücrelerdeki proteinlerin incelenmesi, in vitro çalışmalar da bozulan moleküler kalabalık ve çeşitli protein etkileşimlerini oluşturur. Özel bir tek hücre akış sistemi IC-FPOP sırasında hücre toplama ve tıkanma azaltmak için tasarlanmıştır. Bu akış sistemi hücreleri tek tek excimer lazer geçmiş odaklanır, böylece tutarlı ışınlama sağlanması. IC-FPOP, FPOP'tan üretilen oksidasyonun kapsamını kristal yapıdan hesaplanan proteinin çözücü erişilebilirliğiile karşılaştırarak, çözücüye erişilebilen proteinlerin yan zincirlerini doğru bir şekilde inceleyebilir.
Giriş
Hidroksil radikal protein ayak izi (HRPF), hidroksil radikallerinden üretilen kovalent modifikasyonlarla bir proteinin solvent erişilebilirliğini araştıran bir yöntemdir. Protein yapısı veya protein etkileşimleri değiştiğinde, amino asitlerin solvent maruziyetini değiştirerek kalıntıların modifikasyonderecesini değiştirir. HRPF ile protein etkileşimleri1,2,3 ve protein konformasyonel değişiklikler4,5,6 in vitro başarıyla sorgulanmıştır. HRPF deneyleri için hidroksil radikalleri oluşturmak çeşitli yöntemler vardır, bir proteinlerin hızlı fotokimyasal oksidasyonu olmak (FPOP). FPOP Hambly ve Gross tarafından 2005 yılında geliştirilen ve hidrojen peroksit fotoliz yoluyla hidroksil radikalleri üretmek için 248 nm excimer lazer kullanır (H2O2)7.
Son zamanlarda, Espino ve ark canlı hücrelerde protein yapısını araştırmak için FPOP kullanımını genişletilmiş, hücre içi FPOP (IC-FPOP)8olarak adlandırdığı bir yöntem. In vitro çalışmaların aksine, hücrelerdeki proteinlerin incelenmesi, yapıyı etkileyebilecek çeşitli protein etkileşimleri ile birlikte moleküler kalabalıklığı da hesaba katsın. Buna ek olarak, proteome geniş yapısal biyoloji yi gerçekleştirmek için aynı anda çok sayıda sistem hakkında yapısal bilgi sağlama potansiyeline sahip tam proteomun anlık görüntüsünü sağlamanın avantajını sunar. Ayrıca, bu teknik in vitro çalışması zor proteinler için idealdir, membran proteinleri gibi.
IC-FPOP'un ilk çalışmaları, protein bolluğu ve hücresel lokalizasyon açısından 105 proteini başarıyla incelemifltir. IC-FPOP yöntemini geliştirmek için, Rinas ve ark. tek hücre akışı için bir mikroakış sistemi geliştirdi9. Orijinal akış sisteminin geliştirilmesi hücre toplamasınırlandırır ve ışınlama için kullanılabilir H2O2'yi artırır. İlk akış sisteminde, silika tüpünde kümelenmiş hücreler tıkanması ve düzensiz ışınlama ile sonuçlandı. Bir kılıf tampon iki akışları dahil hidrodinamik hücreleri odaklanır, onları tek tek lazer geçmiş akmasına izin. H2O2 için ayrı bir şırınga nın eklenmesi, daha kontrollü ve optimize edilebilir pozlama süresi sağlayarak yan etkileri olmadan daha yüksek H2O2 konsantrasyonları sağlar. Ayrıca, kuluçka süresini sınırlamak H2O2'nin endojen katalaz ile bozulmasını sınırlar. Bu yeni akış sistemini birleştirerek, FPOP modifikasyonu ile algılanan protein sayısı 13 kat artarak bu yöntemin yeteneklerini genişleterek canlı hücrelerdeki çok sayıda proteini araştırdı. Bu protokolde, IC-FPOP akış sisteminin montajına odaklanan genel bir IC-FPOP deneyi tanımlanmıştır.
Protokol
1. IC-FPOP akış sistemi kurmak
- Akış sisteminin montajına başlamak için, erimiş silikayı bir dekolte taşı kullanarak kesin. IC-FPOP akış sistemi, 450 μm ve dış çapı (OD) 670 m, iki 24 cm ve 75 μm kimlikli bir 40 cm ve 360 μm'lik bir OD ile dört adet 12 cm ve bir adet 17 cm erimiş silika (ID) gerektirir. , ve son olarak 150 μm kimliği ve 360 μm bir OD ile iki 57 cm.
NOT: Silika boruyu keserken poliimid kaplamayı hafifçe kazıyın ve en temiz kesimi elde etmek için bükün. Düz bir kesim olduğundan emin olun (bu hiçbir tıkanıklık veya sızıntı formu sağlamak için gereklidir). - Nano-sıkı kollu (0,0155" ID X 1/16" OD 360 μm OD silika boru ve 0,027" ID X 1/16" OD 670 μ için m OD silika tüp) süper flangeless somun PEEK 1/4-28 düz alt için 1/16 "OD ve süper flangeless ferrule w / SST halka, Tefzel (ETFE), 1/4-28 düz alt, 1/16" OD için. Üreticiprotokolüne göre bağlantılar oluşturma(Şekil 1).
- Bir 500 μL şırınga 6 küçük silindirik mıknatıslar yerleştirin. Bu şırıngayı 500 μL şırınga ve iki 5 mL şırınga ile birlikte tamponla doldurun ve havayı çıkarın. Şekil 2A'dagösterildiği gibi şırınga pompası üzerinde pozisyon.
NOT: 5 mL şırıngalar 500 μL şırıngalardan daha büyüktür, bu nedenle tüm şırıngaları aynı anda yerinde sıkmak için bir boşluk gereklidir(Şekil 2B). - Şırınga pompası durdurucuyu sıkın, böylece hücre şırıngası motor durduğunda yaklaşık 50 μL sola sahiptir. Bu manyetik karıştırıcılar için yer bırakacaktır. (Şekil 2C-D).
DİkKAT: Şırınga pompası mıknatıslara baskı yaparsa, şırıngayı bozar ve şırınganın kırılmasına neden olabilir. - Luer adaptörü kullanarak, her şırıngaya bir manuel vana bağlayın. Şekil 3'tegösterildiği gibi silika borularını birleştirin.
NOT: Hattı hücrelerle (+ H2O2 ile diğer tarafa doğru çapraz dan geçirin. Daha sonra 450 μm ID silika boru içine takın. 5 mL şırıngadaki kılıf tamponları hücrelerden ve H2O2'dendaha hızlı akacak. Her iki tarafta kılıf tamponları ile, hücreler hidrodinamik ışınlama için tek bir satır içine odaklanmış olacaktır. - Lazerin yanındaki konum akış sistemi. Bir çakmak kullanarak, lazer ışınlama için bir pencere yapmak için 450 μm ID boru üzerinde silika kaplama yakmak.
- Altı mıknatısiçeren hücre şırıngası üzerinde bir manyetik karıştırıcı yerleştirin.
- 1,083.3 μL/dk. Son akış hızı için şırınga pompasını 492,4 μL/dk'ya ayarlayın.
- Dışbüvek lens kullanarak silika boru üzerine excimer lazer odaklanın. Bir kez odaklanmış, silika boru arkasında küçük bir kağıt parçası yerleştirerek ışınlama penceresi test ve lazer açın. Işınlamadan yanmış bölgeyi ölçün. Sıfır bir dışlama fraksiyonu elde etmek için ışınlama penceresi ve akış hızı kullanarak gerekli lazer frekansını hesaplayın.
NOT: IC-FPOP deneyi için önerilen lazer enerjisi ≥120 mJ'dir. 2,58 mm'lik ışınlama penceresi ve 1083,3 μL/dk akış hızı ile 0'ın dışlanma kısmını elde etmek için frekansın 44 olması gerekir. Işınlama penceresi, akış hızı ve dışlama fraksiyonu biliniyorsa, lazer frekansını hesaplamak için gereken denklemler aşağıda verilmiştir.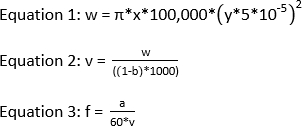
w nL'de hacim, x mm'deki lazer nokta genişliği, y μm'deki silika boru kimliği, v μL'deki toplam hacim, b dışlama fraksiyonu, a μL/dk'daki akış hızı, f ise Hz.'deki frekanstır.
2. Söndürme ve H2O2 olun
- 100 mM N-tert-Butil-alfa-fenilnitron (PBN) ve 100 mM N,N'-dimethylthiourea (DMTU) içeren söndürme yapın. Aliquot her numune için 50 mL konik bir tüp içine 11 mL söndürme.
- Seyreltik H2O2 ila 200 mM. Her numune 500 μL H2O2gerektirir.
NOT: Söndürme bir gün önce yapılabilir ve ışıktan korundu, 4 °C'de bir gecede saklanabilir. H2O2 deney günü taze yapılmalıdır.
3. Hücreleri topla
- Bir T175 şişesindeki hücreleri %70-90 oranında büyütün.
- Ortamı kaldırın ve arabellekle durulanın.
NOT: Kullanılacak tipik tamponlar hücre kültürü sınıfı Dulbecco'nun fosfat tamponlu salini (DPBS) veya Hank'in dengeli tuz çözeltisi (HBSS) dir. - Hücreleri tripsin-EDTA veya kazıyıcı kullanarak ayırın.
- Bir kez arabellek 10 mL içinde resuspend ayrılmış ve hücreleri saymak.
- Aşağı dön, arabelleği ve tripsin-EDTA'yı çıkarın ve 2 x 106 hücre/mL yapmak için yeniden askıya alın.
- Aliquot 500 μL her numune başına hücre.
NOT: Her durum için en az 3 lazer örneği ve 3 lazer kontrolü yok.
4. IC-FPOP Yapmak
- İki 5 mL şırıngayı tamponla, mıknatısları içeren 500 μL şırıngayla ve son 500 μL şırıngayı H2O2 iledoldurun. Manyetik karıştırıcıyı aç.
- Dikmetil sülfoksit 220 μL (DMSO) söndürme bir aliquot, yavaşça karıştırın ve ışınlanmış örnekleri toplamak için akış sisteminin arkasına yerleştirin. DMSO eklenmesi endojen metiyonin sülfoksit redüktaz inhibe edecek.
- Lazeri açın, 7'leri bekleyin ve akış sistemini açın.
- Numune akışı bittikten sonra lazeri kapatın ve toplanan numuneyle söndürmeyi nazikçe karıştırın. 4.5 ve 4.6 adımlarını sırasında bunu kenara yerleştirin.
- Dört şırıngayı da hücrelerin askıya alınan tamponla doldurun ve akış sisteminden geçirin.
- Sistem kızarma işlemi bittikten sonra 4.1 ve 4.2 adımlarını tekrarlayın. Işınlama olmadan akışı başlatın. Bu hücrelerde arka plan oksidasyonu için hesap hiçbir lazer kontrolüdür.
- Bir sonraki numune çalışırken, önceki numuneyi 5 dk için 450-800 x g'de döndürün, çözücüü çıkarın ve radioimmunoçöken analiz (RIPA) tamponu gibi bir hücre lisis tamponunun 100 μL'sinde yeniden askıya alın.
- Numuneyi bir mikrosantrifüj tüpüne aktarın ve sıvı nitrojende flaş dondurma.
- Tüm numuneler çalışma tamamlandığında, temizleme için akış sistemini sökün. Kullanılan silika boruatın ve % 50 su 1 saat sonicating tarafından diğer tüm bağlantıları temizleyin: 50% metanol. Şırıngaları üreticinin talimatlarına göre temizleyin.
5. Özet
- Tüm hücre lisatını sindir. Numuneleri eriterek başlayın ve 95 °C'de 10 dakika ısı.
- Isıtma dan sonra, 15 dakika buz üzerinde lysate soğutun.
- DNA ve RNA'yı sindirmek için 25 ünite nükleaz ekleyin ve 15 dakika boyunca odada kuluçkaya yatın.
- 4 °C'de 10 dk için 16.000 x g'de masa üstü santrifüj kullanarak spin örnekleri.
- Supernatant toplamak ve temiz bir mikrosantrifüj tüp aktarın.
- Protein elekt kiti kullanarak protein konsantrasyonu kontrol edin.
- 20-100 μg numuneyi temiz bir mikrosantrifüj tüpüne aktarın ve 100 μL'ye getirin.
- 20 mM dithiothreiotol (DTT) ile numuneleri 50 °C'de 45 dakika azaltın.
- Numuneleri oda sıcaklığında 15 dk soğutun.
- 20 mM iodoacetamide (IAA) oda sıcaklığında 20 dk ışıktan korunan alkilat.
- 1:4 oran proteinde önceden soğutulmuş aseton ekleyin: aseton. Örnekleri karıştırın ve -20 °C'ye bir gecede yerleştirin.
- Ertesi sabah, 4 °C'de 10 dakika boyunca 16.000 x g'de döndürme örnekleri.
- Supernatant çıkarın ve% 90 önceden soğutulmuş aseton 50 μL ekleyin. Numuneleri karıştırın ve 4 °C'de 5 dk için 16.000 x g'de aşağı doğru döndürün.
- Asetonu çıkarın ve mikrocentrifuge kapakları üst kapsayan bir tiftik ücretsiz silme ile açık bırakarak örnekleri kurumasını bekleyin. Numuneler kuruduktan sonra 10 mM Tris tampon pH 8 ile protein peletini yeniden askıya alın.
- 10 mM Tris tampon pH'ın 40 μL'sinde 20 μg tripsin isini yeniden askıya alın. 2 μg tripsin ekleyin (kütle: 1 tripsin kütle oranı: 50 örnek). Bir gecede 37 °C'de kuluçka örnekleri.
- Ertesi sabah peptit tonu kullanarak peptit konsantrasyonu kontrol edin. Örnek peptit tahliliçin çıkarıldıktan sonra, numunelere formik asit ekleyerek tripsin sindirimini söndürün (son konsantrasyon %5 formik asittir).
- Son peptit konsantrasyonu belirlendikten sonra, her numuneden 10 μg temiz bir mikrosantrifüj tüpüne aktarın. Bu, her numunenin aynı miktarda analiz edilmesini sağlar. Bir vakum santrifüj kullanarak örnek kuru. 20 μL kütle spektrometresi ile kurutulduktan sonra %0.1 formik asit. Örnekleri otomatik numune şişelerine aktarın.
6. Sıvı Kromatografi-Tandem Kütle Spektrometresi
- FPOP modifikasyonları lokalize etmek için Sindirilmiş hücre lysate LC-MS/MS analizi kullanarak analiz.
- Suda %0.1 formik asit (A) ve asetonitrilde (B) %0,1 formik asit mobil fazları kullanın.
- 180 μm x 20 mm C18 (5 μm ve 100 Å) bindirme sütununa 0,5 μg numune yükleyin ve 15 dakika boyunca %99 (A) ve %1 (B) ile yıkama numunesi alın.
- 75 μm x 30 cm C18 (5 μm ve 125 Å) analitik kolon kullanarak analitik ayırma yöntemini %3 'den başlayan (B) 0,300 μL/dk akış hızıyla çalıştırın ve 1-2 dakikadan itibaren %10 rampa (B) çalıştırın. Sonraki rampa% 45 (B) 2-100 dk sonra% 100 (B) 100-110 dk. 110-115 dk% 100 (B) tutarak sütun temizleyin. 115-116 dk% 3 (B) rampa ve tutmak sütun un% 3 (B) 116-130 min.
- MS edinme yöntemini m/z teşriyle 375-1500 arasında 60.000 çözünürlüğe sahip olarak ayarlayın. Otomatik kazanç kontrolü (AGC) hedefini maksimum enjeksiyon süresi 50 ms ile 5,0 x 105 olarak ayarlayın.
- MS kazanımı sırasında, 1,2 m/z izolasyon penceresi ve 4 s'lik çevrim süresi ile veri bağımlı edinimi (DDA) yoluyla izolasyon için şarj durumları 2-64 olan öncül iyonları seçin. 60 s. 1 MS/MS edinimi sonrası peptidleri hariç takın.4
7. Veri İşleme
- Raw dosyalarını kullanılabilir bir protein analiz yazılımında ilgili protein veritabanı ve ilgili sindirim enzimine karşı arayın. Burada, Swiss-Prot Homo Sapiens veritabanını ve trypsin'i kullanın.
- Öncül kütleyi 350 ila 5.000 Da ve 10 ppm'lik bir kütle toleransı arasında arama yapacak şekilde ayarlayın. En fazla 1 6 ila 144 kalıntı arasında bir peptit uzunluğu ile cevapsız dekolte sitesi olabilir. Bu sınırlamalar veritabanı aramakolaylaştırmak.
- Parça iyonlarının maksimum kütle toleransını karbamidotil (+57.021) ile statik modifikasyon olarak 0.02 Da'ya ve 17 amino asitten dinamik modifikasyon olarak tüm FPOP modifikasyonlarına ayarlayın(Şekil 4, FPOP modifikasyonlarını tespit etmek için kullanılan protein analizi iş akışının bir örneğidir).
NOT: Serin ve treonin üzerindeki FPOP modifikasyonları hidroksil radikalleri ile daha düşük reaktivite nedeniyle arama dahil değildir. - %1 ve %5'lik yanlış bir keşif oranına sahip bir yem veritabanıyla arama yapın.
- Dosyalar tamamlandıktan sonra fpop değişikliğinin kapsamını hesaplar. Açık Proteome Discoverer 2.2, ihracat sırası, modifikasyon yerleri, protein katılımı, spektrum dosyası, öncül bolluk ve saklama süresi bilgileri. 4. denklemden modifikasyonun kapsamını hesaplayın:

EIC alan modifiye hidroksil radikal modifikasyonu ile belirli bir peptit kromatografik alandır. EIC alanı, o peptidin hem değiştirilmiş hem de değiştirilmemiş alanlarının toplam kromatografik alanıdır. Oksidasyonun kapsamı, ışınlama lı ve radyasyonsuz numunelerde hesaplanır. Örnek atlayan ışınlama (kontrol) h2O2 maruziyetinden önce ve sonra hücrelerde mevcut olabilecek herhangi bir arka plan oksidasyonu için hesaplar. Kontroller, FPOP'a özgü modifikasyonları izole etmeye yardımcı olmak için ışınlama örneklerinden çıkarılır.
Sonuçlar
IC-FPOP canlı hücrelerdeki protein etkileşimlerini sorgulamak için bir ayak izi yöntemidir. IC-FPOP akış sisteminde, H2O2 maruz kalma süresi kabaca 3 s ile sınırlıdır ve hücreler için zararlı sonuçlar doğurmadan daha yüksek H2O2 konsantrasyonları garanti eder. Akış sistemi aynı zamanda iki kılıf tampon uzerinden içerir, hidrodinamik olarak hücreleri borunun merkezine odaklar ve tek bir hücre aktarımını tek bir akışla üretir (Şekil 5)9. Ortogonal YZ yığılmış görüntülerin floresan görüntülemesi(Şekil 5A)kılıf tamponunun (FITC florofor içeren) hücre çözeltisinden (TMRM florofor içeren) net bir ayrıştırma olduğunu göstermektedir. Bu ayrımı vurgulamak için Şekil 5B ve Şekil 5C, iki çözeltinin en az karıştırılmasını gösteren kılıf tampon çözeltisinin veya hücre çözeltisinin üç boyutlu ortalama ısı haritalarını gösterir.
Tek hücreli akış sisteminin kullanımı oksidatif olarak modifiye edilmiş protein sayısını 13 kat arttırır(Şekil 6A)9. Bu yöntemde, hücresel bölmelerin çoğunda proteinler membran proteinleri, sitoplazmik proteinler ve çekirdek içindeki proteinler ile etiketlenir8,9. Proteinlerin bozulmamış hücreler içinde modifiye edilmesini sağlamak için H2O2 tedavisi ve ışınlama(Şekil 6B)8sonrasında CellROX tedavi edilen hücrelerin floresan görüntüleri yapılmıştır. Etiketleme işlemi boyunca hücrelerin stabilitesi ic-FPOP'un proteinleri kendi hücresel ortamlarında araştırmak için etkinliğini daha da doğrular. Tandem-kütle spektrometresi kullanılarak, bu değişiklikler bir protein üzerinde belirli amino asitler lokalize edilebilir. Şekil 7, ic-FPOP sırasında çıkarılan iyon kromatogramı ile birlikte gerçekleşen bir değişikliği temsil eder. Çıkarılan iyon kromatogramında gözlenen kayma, modifiye peptiddeki oksitlenmiş metiyonin in neden olduğu hidrofobiklik değişimine işaret eder.
FPOP modifikasyonlarının hücrelerin içinde solvent erişilebilirliğini araştırıp araştırmadığını test etmek için hücre içi etiketli aktin hem in vitro ayak izi çalışması hem de aktinin çeşitli kristal yapıları ile karşılaştırıldı (Şekil 8)8. Hücre içi etiketli aktin Şekil 8A'da gösterilmiştir Guan ve ark.10 (Şekil 8B)tarafından yapılan in vitro çalışmadan oksidasyonun karşılaştırılabilir dereceleri gösterilmektedir, sonuçlandırıcı aktin hem hücre içi hem de invitro çalışmalar için benzer çözücü erişilebilirliğine sahiptir. IC-FPOP'un aktinin çözücü erişilebilirliğini araştırdığı doğrulayabilmek için, FPOP modifikasyonlarının kapsamı, iki aktin kristal yapısından hesaplanan etiketli kalıntıların çözücü erişilebilirliği ile karşılaştırıldı(Şekil 8C). Bu korelasyon IC-FPOP'un monomerik proteinin solvent erişilebilirliğini iyi incelediğini göstermektedir.

Şekil 1: Ferules'ın düzgün bir şekilde nasıl inşa edilebildiğini. (A) Sıkmadan önce ferrules, silika boru ve kılıfı birbirine yerleştirin. (B) Tüm bileşenleri bir araya getirin. (C) Nihai ürün, kol üzerinde sıkılaştırılmış bir ferule üretecektir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: IC-FPOP akış sisteminin kurulması. (A) Lazerin yanına yerleştirilmiş tam olarak monte edilmiş bir IC-FPOP akış sisteminin görüntüsü. (B) Tüm şırıngaları başarıyla sıkılaştırmak için 500°L şırınganın dış çapını artırmak için gereken bir uzayıcı örneği. (C) Manyetik karıştırıcılar için gerekli alanı gösteren temsili resimler. (D) Stoperler şırıngaları kırmadan şırınga pompasını oyalamak için gereklidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
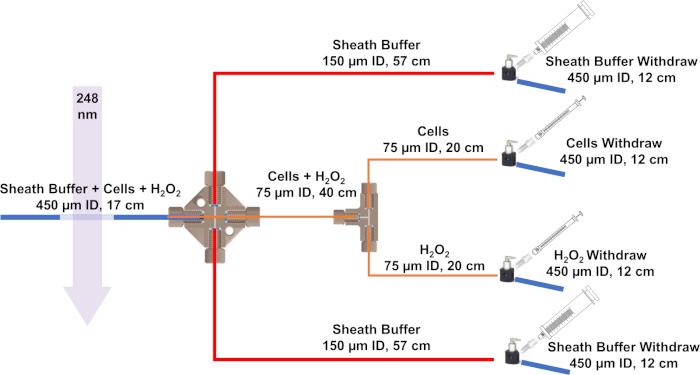
Şekil 3: IC-FPOP için geliştirilen akış sisteminin şeması. Mavi çizgiler 450 μm ID ve 670 m OD ile silika boru temsil, kırmızı çizgiler 150 μm ID ve 360 μm OD ve turuncu çizgiler 75 μm ID ve 360 μm OD var. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: FPOP modifikasyonlarını tespit etmek için kullanılan protein analiz yazılımı. Her düğümde aranan karşılık gelen değişiklikler içeren tipik bir iş akışı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
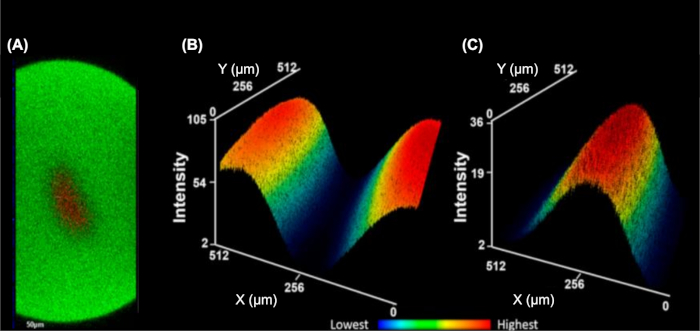
Şekil 5: Tek hücreakış sistemi hidrodinamik olarak hücreleri tek bir akışa odaklar. (A) Hücreli analitin 3D odaklama gösteren ortogonal YZ yığını (kırmızı, TMRM florofor) kılıf tampon (yeşil, FITC florofor) ile çevrili. Kılıf tamponunun üç boyutlu ortalama yoğunluklu ısı haritası (B) ve hücresel analit (C). Alt yoğunlukları mavi ve en yüksek kırmızı(B-C)vardır. Bu rakam Rinas ve ark.9'dandeğiştirilmiştir.
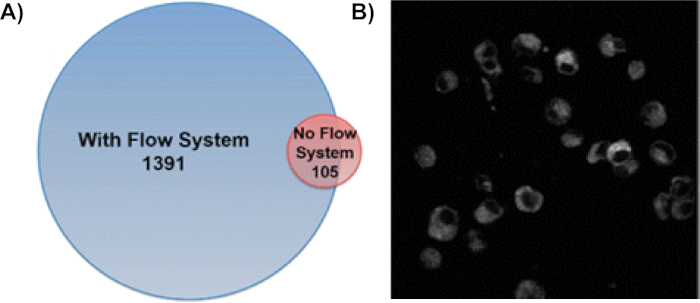
Şekil 6: IC-FPOP Akış Sisteminin kullanımı, alım hücrelerinde FPOP modifiye edilmiş proteinleri önemli ölçüde artırır. (A) Akış sistemi ile ve akış sistemi olmadan tanımlanan oksitlenmiş proteinlerin karşılaştırılması. Akış sistemi 1391 FPOP modifiye proteini tespit ederken, sadece 105 protein 58 modifiye proteinle çakışma olmadan akış sistemi ile tanımlanmıştı. Bu rakam Rinas ve ark.9 (B)IC-FPOP'un oksidatif etiketlemeden sonra hücrelerin hala bozulmamış olduğunu göstermesinden sonra CellROX ile tedavi edilen hücrelerin floresan görüntülemesinden değiştirilmiştir. Hücreler Olympus Fluoview FV1000 MPE multifoton mikroskobu kullanılarak 665 nm'de görüntülendi. Gösterilen resim tek bir dilimdir. Bu rakam Espino ve ark.8'dendeğiştirilmiştir.

Şekil 7: IC-FPOP sırasında gerçekleşen tandem MS/MS spektrumları örnekleri. Ürün-iyon (MS/MS) bir (A) değiştirilmemiş peptid in spektrumu ve(B)oksidasyonu bu peptidüzerinde bulunan M8 kalıntısı üzerinde saptanır. Bir temsilcisi EIC (C) değiştirilmemiş peptid ve (D) modifiye peptid. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 8: IC-FPOP proteinlerin solvent erişilebilirliğini araştırmada etkilidir. (A) Aktinden oksidatif modifiye peptidler için modifikasyon ölçüde. Değerler ortalama artı ve eksi standart sapma (n = 3) olarak gösterilir. (B) Guan ve ark.10 (C)kalıntı FPOP modifikasyonlarının sasa ile sıkı (üçgenler, kesik eğilim çizgisi) ve açık (daireler, katı eğilim çizgisi) aktin durumlarında senkronize radyolizinin in vitro oksitlenmesine neden olan aktin peptidlerinin modifikasyonu. Bu rakam Espino ve ark.8'dendeğiştirilmiştir.
Tartışmalar
Protein yapısını ve protein-ligand komplekslerini tüm hücre veya hücre litatlarında proteom çapında bir şekilde incelemek için çeşitli kütle spektrometresi tabanlı teknikler geliştirilmiştir. Bu teknikler oksidasyon hızı (SPROX), termal proteom profilleme (TPP), kimyasal çapraz bağlama (XL-MS) ve hidroksil radikal protein ayak izi (HRPF) proteinlerinin stabilitesi ile sınırlı değildir. Her tekniğin birbirine göre benzersiz sınırlamaları ve avantajları vardır, hangi kapsamlı12gözden geçirilmiştir. Bu yöntemlerin her biri proteom geniş yapısal biyoloji için protein yapısını açıklamak ve sonuçta karmaşık hücresel ortamda işlev için kullanılmıştır. IC-FPOP oksidatif amino asitlerin solvent maruz yan zincirleri değiştirmek için hidroksil radikalleri kullanan bir HRPF tekniğidir, probing protein yapısı ve protein-ligand etkileşimleri canlı hücreler içinde13. IC-FPOP dakika zaman ölçeği14radikalleri oluşturmak için Fenton kimyası kullanılan canlı hücrelerde ilk HRPF için bir gelişmedir. Bu çalışmada, tamponun pH veya iyonik mukavemetinin düşürülmesine yanıt olarak integral membran proteinindeki yapısal değişiklikler protein genelinde iyi oksidasyon kapsamı ile başarıyla karakterize edilmiştir. Fenton kimyası ile karşılaştırıldığında, IC-FPOP çok daha hızlıdır, mikrosaniye zaman ölçeğinde proteinleri değiştirerek yerli protein konformasyonu üzerinde çalışılmasını sağlar.
IC-FPOP için önemli bir test H2O2maruz kaldıktan sonra hücrelerin canlılığını onaylamaktır. 40 cm'lik bir karıştırma hattı kullanılarak, hücreler ışınlamadan önce yaklaşık 3 s için H2O2'de kuluçkaya yatırılır. Bu süre bu silika boru uzunluğu değiştirerek ayarlanabilir. Hücre canlılığını test etmek için trypan mavisi kullanımının H2O2 kuluçkadan sonra hücrelerin bütünlüğünün sürdürüldüğünü göstermesine rağmen, hücrelerin H2O2ile etkileşime girebilen sinyal yollarını etkileyen stres altında olma potansiyeline sahip olması dikkat çekicidir. Neyse ki, kısa kuluçka süresi protein sentezinden daha hızlıdır ve mevcut proteinlerin H2O2ile indüklenmediğini sağlar.
Bir sonraki önemli adım akış sisteminin uygun montaj onaylamaktır. Monte edildikten sonra, sistemi istenilen arabellekle yıkdıktan sonra sızıntı olmadığından emin olun. Sızıntılar varsa, silika boru düzgün kesilmiş ve bir kez aşağı sıkılır uygun bir mühür yapmak için ferrule karşı floş olduğundan emin olun. Tüm parçalar elle sıkılır, bu nedenle hiçbir alet gerekli değildir. Her IC-FPOP deneyi sırasında, hücre şırıngasındaki manyetik karıştırıcıların hareket halinde kaldığından emin olun. Bu küçük ajitasyon şırınganın altına yerleşen ancak hücreleri yamaya yetecek kadar sert olmayan hücrelerin sayısını sınırlar. Bir koşudan sonra şırıngada yaklaşık 50 μL hücre koluşur. Her zaman bir sonraki deney üzerinde taşıyan hücre sayısını sınırlamak için bir durulama adımı ile bu seyreltmek için emin olun. Birden fazla hücre tedavileri karşılaştırıldığında ise taze bir hücre şırınga kullanılması tavsiye edilir. Test edilen hücreler için uygun bir arabellek seçmek de önemlidir. Bazı tamponlar proteinler üzerinde daha az değişiklik yol açan hidroksil radikal söndürmek. Xu ve ark. bazı yaygın olarak kullanılan tamponlar hidroksil radikal ömür boyu azaltmak göstermiştir11. DPBS ve HBSS, IC-FPOP deneyleri için kullanılan yaygın tamponlardır.
IC-FPOP'u takiben, gerekli parametrelere göre sindirim protokolünü optimize edin. FPOP geri dönüşümsüz kovalent modifikasyonlar ürettiğinden, etiketleme kapsamını kaybetmeden kapsamlı bir sindirim ve temizlik için yeterli zaman vardır. Her zaman test ve tek tip peptit konsantrasyonları tandem kütle spektrometresi için yüklenir böylece protein konsantrasyonu normalleştirmek. Son olarak, bir immünopresidit IC-FPOP ile birlikte yapılamaz dikkatli olun. Bir FPOP modifikasyonu etkileşim bölgesini hedeflerse antikor afiyeti azalır. FPOP modifikasyonlarının tanımlanmasını artırmak için, 2D-kromatografik ayırma adımları, tespit edilen oksitlenmiş peptid sayısının üç katından fazlasına kadar gösterilmiştir15.
Herhangi bir FPOP deneyinin zorluğu, ortaya çıkabilecek olası oksidasyon ürünleri nedeniyle karmaşık veri analizi düzeyidir. Bu hem hücre içi hem de in vitro için geçerlidir, ancak hücre lisatlarının analizinin karmaşıklığı ile büyük ölçüde artmaktadır. IC-FPOP daha fazla optimizasyon ile daha yüksek modifikasyon kapsama alanı ile daha fazla protein ortaya çıkmaktadır, böylece hızlı bir şekilde analiz daha zahmetli hale. Tek bir IC-FPOP deneyinden oluşturulan veri yaması, araştırmacıların yazılıma daha fazla güvenmelerine neden olan manuel doğrulama kullanımını sınırlar. Bu nedenle, Rinas ve ark. Proteome Discoverer (PD)16kullanarak HRPF için bir nicelik stratejisi geliştirdi. Bu yöntem, bir elektronik tablodaki nicel bir platformla birlikte PD'deki çoklu arama düğümü iş akışını kullanır. IC-FPOP platformunda daha fazla iyileştirme, FPOP modifikasyonları ile tanımlanan peptidlerin sayısını artırmak ve artan tekrarlanabilirlik ve nicel doğruluk la birlikte devam etmektedir.
Açıklamalar
Lisa Jones hücre patenti için akış montajında bir mucittir (yayın numarası: 20180079998).
Teşekkürler
Bu çalışma LMJ için NSF CAREER Award (MCB1701692) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-53A | any brand is sufficient |
| 5 mL Gas Tight Syringe, Removable Luer Lock | SGE Analytical Science | 008760 | |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | any brand is sufficient |
| 500 µL SGE Gastight Syringes: Fixed Luer-Lok Models | Fisher Scientific | SG-00723 | |
| Acetone, HPLC Grade | Fisher Scientific | A929-4 | 4 L quantity is not necessary |
| Acetonitrile with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | LS120-500 | |
| ACQUITY UPLC M-Class Symmetry C18 Trap Column, 100 Å, 5 µm, 180 µm x 20 mm, 2G, V/M, 1/pkg | Waters | 186007496 | |
| ACQUITY UPLC M-Class System | Waters | ACQUITY UPLC M-Class System | |
| Aluminum Foil | Fisher Scientific | 01-213-100 | any brand is sufficient |
| Aqua 5 µm C18 125 Å packing material | Phenomenex | 04A-4299 | |
| Centrifuge | Eppendorf | 022625501 | |
| Delicate Task Wipers | Fisher Scientific | 06-666A | |
| Dithiothreiotol (DTT) | AmericanBio | AB00490-00005 | |
| DMSO, Anhydrous | Invitrogen | D12345 | |
| EX350 excimer laser | GAM Laser | EX350 excimer laser | |
| FEP Tubing 1/16" OD x 0.020" ID | IDEX Health & Science | 1548L | |
| Formic Acid, LC/MS Grade | Fisher Scientific | A117-50 | |
| HV3-2 VALVE | Hamilton | 86728 | |
| Hydrogen Peroxide | Fisher Scientific | H325-100 | any 30% hydrogen peroxide is sufficient |
| Iodoacetamide (IAA) | ACROS Organics | 122270050 | |
| Legato 210 syringe pump | KD Scientific | 788212 | Any syringe pump that can hold 4, 5 mL syringes, withdraw and expel liquid, and have a way to stale the motor should work |
| Luer Adapter Female Luer to 1/4-28 Male Polypropylene | IDEX Health & Science | P-618L | |
| Methanol, LC/MS Grade | Fisher Scientific | A454SK-4 | 4 L quantity is not necessary |
| Microcentrifuge | Thermo Scientific | 75002436 | |
| N,N'-Dimethylthiourea (DMTU) | ACROS Organics | 116891000 | |
| NanoTight Sleeve Green 1/16" ID x .0155" ID x 1.6" | IDEX Health & Science | F-242X | |
| NanoTight Sleeve Yellow 1/16" OD x 0.027" ID x 1.6" | IDEX Health & Science | F-246 | |
| N-tert-Butyl-α-phenylnitrone (PBN) | ACROS Organics | 177350250 | |
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | Orbitrap Fusion Lumos Tribrid Mass Spectrometer | other high resolution instruments (e.g. Q exactive Orbitrap or Orbitrap Fusion) can be used |
| PE50-C pyroelectric energy meter | Ophir Optronics | 7Z02936 | |
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Scientific | 23275 | |
| Pierce Rapid Gold BCA Protein Assay Kit | Thermo Scientific | A53225 | |
| Pierce Trypsin Protease, MS Grade | Thermo Scientific | 90058 | |
| Pierce Universal Nuclease for Cell Lysis | Fisher Scientific | 88702 | |
| Polymicro Cleaving Stone, 1" x 1" x 1/32" | Molex | 1068680064 | any capillary tubing cutter is sufficient |
| Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 150 µm, Outer Diameter 360 µm, TSP150350 | Polymicro Technologies | 1068150024 | |
| Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 450 µm, Outer Diameter 670 µm, TSP450670 | Polymicro Technologies | 1068150025 | |
| Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 75 µm, Outer Diameter 360 µm, TSP075375 | Polymicro Technologies | 1068150019 | |
| Potassium Phosphate Monobasic | Fisher Scientific | P382-500 | |
| Proteome Discover 2.2 (bottom-up proteomics software) | Thermo Scientific | OPTON-30799 | |
| Rotary Magnetic Tumble Stirrer | V&P Scientific, Inc. | VP 710D3 | |
| Rotary Magnetic Tumble Stirrer, accessory kit for use with Syringe Pumps | V&P Scientific, Inc. | VP 710D3-4 | |
| Super Flangeless Ferrule w/SST Ring, Tefzel™ (ETFE), 1/4-28 Flat-Bottom, for 1/16" OD | IDEX Health & Science | P-259X | |
| Super Flangeless Nut PEEK 1/4-28 Flat-Bottom, for 1/16" & 1/32" OD | IDEX Health & Science | P-255X | |
| Super Tumble Stir Discs, 3.35 mm diameter, 0.61 mm thick | V&P Scientific, Inc. | VP 722F | |
| Thermo Scientific Pierce RIPA Buffer | Fisher Scientific | PI89900 | |
| Tris Base | Fisher Scientific | BP152-500 | |
| Upchurch Scientific Low-Pressure Crosses: PEEK | Fisher Scientific | 05-700-182 | |
| Upchurch Scientific Low-Pressure Tees: PEEK | Fisher Scientific | 05-700-178 | |
| UV Fused Silica Plano-Convex Spherical Lenses | THORLABS | LA4052 | |
| V&P Scientific IncSupplier Diversity Partner TUMBL STIR DISC PARYLENE 1000 | V&P Scientific, Inc. | VP724F | |
| VHP MicroTight Union for 360µm OD | IDEX Health & Science | UH-436 | |
| Water with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | LS118-500 | |
| Water, LC/MS Grade | Fisher Scientific | W6-4 |
Referanslar
- Gau, B., Garai, K., Frieden, C., Gross, M. L. Mass spectrometry-based protein footprinting characterizes the structures of oligomeric apolipoprotein E2, E3, and E4. Biochemistry. 50 (38), 8117-8126 (2011).
- Li, Z., et al. High structural resolution hydroxyl radical protein footprinting reveals an extended Robo1-heparin binding interface. Journal of Biological Chemistry. 290 (17), 10729-10740 (2015).
- Zhang, H., Gau, B. C., Jones, L. M., Vidavsky, I., Gross, M. L. Fast photochemical oxidation of proteins for comparing structures of protein− ligand complexes: the calmodulin− peptide model system. Analytical Chemistry. 83 (1), 311-318 (2010).
- Jones, L. M., et al. Complementary MS methods assist conformational characterization of antibodies with altered S-S bonding networks. Journal of the American Society for Mass Spectrometry. 24 (6), 835-845 (2013).
- Kiselar, J. G., Janmey, P. A., Almo, S. C., Chance, M. R. Structural analysis of gelsolin using synchrotron protein footprinting. Molecular & Cellular Proteomic. 2 (10), 1120-1132 (2003).
- Vahidi, S., Stocks, B. B., Liaghati-Mobarhan, Y., Konermann, L. Mapping pH-induced protein structural changes under equilibrium conditions by pulsed oxidative labeling and mass spectrometry. Analytical Chemistry. 84 (21), 9124-9130 (2012).
- Hambly, D. M., Gross, M. L. Laser flash photolysis of hydrogen peroxide to oxidize protein solvent-accessible residues on the microsecond timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Espino, J. A., Mali, V. S., Jones, L. M. In cell footprinting coupled with mass spectrometry for the structural analysis of proteins in live cells. Analytical Chemistry. 87 (15), 7971-7978 (2015).
- Rinas, A., Mali, V. S., Espino, J. A., Jones, L. M. Development of a Microflow System for In-Cell Footprinting Coupled with Mass Spectrometry. Analytical Chemistry. 88 (20), 10052-10058 (2016).
- Guan, J. Q., Almo, S. C., Reisler, E., Chance, M. R. Structural Reorganization of Proteins Revealed by Radiolysis and Mass Spectrometry: G-Actin Solution Structure Is Divalent Cation Dependent. Biochemistry. 42 (41), 11992-12000 (2003).
- Xu, G., Chance, M. R. Hydroxyl radical-mediated modification of proteins as probes for structural proteomics. Chemical Reviews. 107 (8), 3514-3543 (2007).
- Kaur, U., et al. Proteome-Wide Structural Biology: An Emerging Field for the Structural Analysis of Proteins on the Proteomic Scale. Journal of Proteome Research. 17 (11), 3614-3627 (2018).
- Chea, E. E., Jones, L. M. Analyzing the structure of macromolecules in their native cellular environment using hydroxyl radical footprinting. Analyst. 143 (4), 798-807 (2018).
- Zhu, Y., et al. Elucidating in vivo structural dynamics in integral membrane protein by hydroxyl radical footprinting. Molecular & Cellular Proteomic. 8 (8), 1999-2010 (1999).
- Rinas, A., Jones, L. M. Fast photochemical oxidation of proteins coupled to multidimensional protein identification technology (MudPIT): expanding footprinting strategies to complex systems. Journal of the American Society for Mass Spectrometry. 26 (4), 540-546 (2015).
- Rinas, A., Espino, J. A., Jones, L. M. An efficient quantitation strategy for hydroxyl radical-mediated protein footprinting using Proteome Discoverer. Analytical and Bioanalytical Chemistry. 408 (11), 3021-3031 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır