Method Article
Caractériser les protéines cellulaires avec l’oxydation photochimique rapide à cellule des protéines
Dans cet article
Résumé
Ici, nous caractérisons la structure des protéines et les sites d’interaction dans les cellules vivantes à l’aide d’une technique d’empreinte protéique appelée oxydation photochimique rapide cellulaire des protéines (IC-FPOP).
Résumé
L’oxydation photochimique rapide des protéines (FPOP) est une méthode d’empreinte protéique radicale hydroxyl utilisée pour caractériser la structure et les interactions des protéines. FPOP utilise un laser excimer de 248 nm pour photolyser le peroxyde d’hydrogène produisant des radicaux hydroxyl. Ces radicaux modifient oxydativement les chaînes latérales exposées au solvant de 19 des 20 acides aminés. Récemment, cette méthode a été utilisée dans les cellules vivantes (IC-FPOP) pour étudier les interactions protéiques dans leur environnement indigène. L’étude des protéines dans les cellules explique l’encombrement intermoléculaire et diverses interactions protéiques qui sont perturbées pour les études in vitro. Un système de flux cellulaire unique personnalisé a été conçu pour réduire l’agrégation cellulaire et le colmatage pendant IC-FPOP. Ce système de flux concentre les cellules au-delà du laser excimer individuellement, assurant ainsi une irradiation cohérente. En comparant l’étendue de l’oxydation produite à partir de FPOP à l’accessibilité du solvant de la protéine calculée à partir d’une structure cristalline, IC-FPOP peut sonder avec précision les chaînes latérales accessibles solvant de protéines.
Introduction
L’empreinte de protéine radicale hydroxyl (HRPF) est une méthode qui sonde l’accessibilité solvante d’une protéine par des modifications covalentes produites à partir de radicaux hydroxylaux. Lorsque la structure protéique ou les interactions protéiques changent, elle modifie l’exposition aux solvants des acides aminés, modifiant ainsi l’étendue de la modification des résidus. Avec HRPF, les interactions protéiques1,2,3 et les changements conformationnels de protéine4,5,6 ont été interrogés avec succès in vitro. Il existe plusieurs méthodes qui génèrent des radicaux hydroxyliques pour les expériences HRPF, l’une étant l’oxydation photochimique rapide des protéines (FPOP). FPOP a été développé par Hambly et Gross en 2005 et utilise un laser excimer de 248 nm pour produire des radicaux hydroxyl grâce à la photolyse du peroxyde d’hydrogène (H2O2)7.
Récemment, Espino et coll. ont étendu l’utilisation de FPOP pour sonder la structure des protéines dans les cellules vivantes, une méthode appelée FPOP à cellule (IC-FPOP)8. Contrairement aux études in vitro, l’étude des protéines dans les cellules explique l’encombrement moléculaire ainsi que diverses interactions protéiques qui pourraient potentiellement influencer la structure. En outre, il présente l’avantage de fournir un instantané du protéome complet potentiellement fournir des informations structurelles de nombreux systèmes à la fois pour effectuer la biologie structurelle de protéome large. En outre, cette technique est idéale pour les protéines qui sont difficiles à étudier in vitro, comme les protéines membranaires.
Les premières études de l’IC-FPOP ont examiné avec succès 105 protéines s’étendant dans l’abondance des protéines et la localisation cellulaire. Pour améliorer la méthode IC-FPOP, Rinas et coll. ont mis au point un système de microflow pour le flux cellulaireunique 9. L’amélioration du système de débit d’origine limite l’agrégation cellulaire et augmente le H2O2 disponible pour l’irradiation. Dans le système d’écoulement initial, les cellules s’agglutinant dans les tubes de silice ont entraîné des obstruements et une irradiation inégale. L’incorporation de deux courants d’un tampon de gaine concentre hydrodynamiquement les cellules, leur permettant de circuler individuellement au-delà du laser. L’incorporation d’une seringue séparée pour le H2O2 permet un temps d’exposition plus contrôlé et optimisé permettant des concentrations plus élevées de H2O2 sans effets indésirables. En outre, limiter le temps d’incubation limite la ventilation de H2O2 par catalase endogène. En incorporant ce nouveau système de débit, le nombre détecté de protéines avec une modification FPOP a augmenté de 13 fois, élargissant ainsi les capacités de cette méthode pour sonder une multitude de protéines dans les cellules vivantes. Dans ce protocole, une expérience générale IC-FPOP est décrite en se concentrant sur l’assemblage du système de débit IC-FPOP.
Protocole
1. Mettre en place un système de débit IC-FPOP
- Pour commencer l’assemblage du système d’écoulement, couper la silice fusionnée à l’aide d’une pierre de clivage à la taille. Le système d’écoulement IC-FPOP nécessite quatre 12 cm et une silice fondue de 17 cm avec un diamètre intérieur (ID) de 450 m et diamètre extérieur (OD) de 670 m, deux 24 cm et un 40 cm avec une pièce d’identité de 75 m et un OD de 360 m , et enfin deux 57 cm avec une pièce d’identité de 150 m et un OD de 360 m.
REMARQUE : Lors de la coupe du tube de silice, grattez doucement le revêtement en polyimide et pliez pour obtenir la coupe la plus propre. Vérifiez s’il s’agit d’une coupe droite (cela est nécessaire pour s’assurer qu’aucun blocage ou fuite ne se forme). - Configurez 15 connexions à l’aide de manches nano-serrées (0,0155" ID X 1/16" OD pour 360 m tubes de silice OD et 0,027" ID X 1/16" OD pour le 670 670 0m de silice OD tubing et 0,027" ID X 1/16" OD pour le 670 10 000 Tube de silice OD) avec écrou super sans flanges PEEK 1/4-28 fond plat pour 1/16" OD et super flangeless ferrule w/SST ring, Tefzel (ETFE), 1/4-28 à fond plat, pour 1/16" OD. Construire des connexions selon le protocole du fabricant(figure 1).
- Placer 6 petits aimants cylindriques dans une seringue de 500 L. Remplissez cette seringue avec une autre seringue de 500 L et deux seringues de 5 ml de tampon et retirez l’air. Position sur la pompe à seringue comme indiqué sur la figure 2A.
REMARQUE : Les seringues de 5 ml sont plus grandes que les seringues de 500 L, de sorte qu’un espaceur est nécessaire pour resserrer toutes les seringues simultanément en place(figure 2B). - Resserrer le bouchon de la pompe à seringue de sorte que la seringue cellulaire a environ 50 ll à gauche lorsque le moteur cale. Cela laissera de la place pour les agitateurs magnétiques. (Figure 2C-D).
AVERTISSEMENT : Si la pompe à seringue exerce une pression sur les aimants, ils brouillent la seringue et peuvent causer la rupture de la seringue. - À l’aide d’un adaptateur Luer, connectez une valve manuelle à chaque seringue. Assembler le tube de silice comme le montre la figure 3.
REMARQUE : Enfilez la ligne avec les cellules et H2O2 tout au long de la croix de l’autre côté. Puis insérez-le dans le tube de silice ID de 450 m. Les tampons de gaine dans la seringue de 5 ml circuleront à un rythme plus rapide que les cellules et H2O2. Avec les tampons de gaine des deux côtés, les cellules seront hydrodynamiquement concentrées en une seule ligne pour l’irradiation. - Système de flux de position à côté du laser. À l’aide d’un briquet, brûlez le revêtement de silice sur les tubes d’identification de 450 m pour faire une fenêtre pour l’irradiation laser.
- Placez un agitateur magnétique au-dessus de la seringue cellulaire contenant les six aimants.
- Réglez la pompe à seringue à 492,4 l/min pour un débit final de 1 083,3 L/min. Débit tampon à travers le système trois fois pour rincer le système et tester les fuites.
- Concentrez le laser excimer sur le tube de silice à l’aide d’une lentille convexe. Une fois concentré, testez la fenêtre d’irradiation en plaçant un petit morceau de papier derrière le tube de silice et allumez le laser. Mesurer la région brûlée par l’irradiation. Calculez la fréquence laser nécessaire en utilisant la fenêtre et le débit d’irradiation pour obtenir une fraction d’exclusion de zéro.
REMARQUE : L’énergie laser recommandée pour une expérience IC-FPOP est de 120 mJ. Pour obtenir une fraction d’exclusion de 0 avec une fenêtre d’irradiation de 2,58 mm et un débit de 1083,3 l/min, la fréquence doit être de 44. Voici les équations qui sont nécessaires pour calculer la fréquence laser si la fenêtre d’irradiation, le débit et la fraction d’exclusion est connu.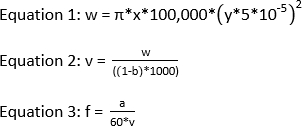
où w est le volume en nL, x est la largeur de tache laser en mm, y est l’ID de tube de silice dans 'm, v est le volume total en 'L, b est la fraction d’exclusion, a est le taux d’écoulement dans 'L/min, et f est la fréquence dans Hz.
2. Faire étancher et H2O2
- Faire de l’étanchéité contenant 100 mM N-tert-Butyl-alpha-phénylnitrone (PBN) et 100 mM N,N'-dimethylthiourea (DMTU). Aliquot 11 ml d’étanchéité pour chaque échantillon dans un tube conique de 50 ml.
- Diluer H2O2 à 200 mM. Chaque échantillon nécessite 500 L de H2O2.
REMARQUE : L’étanchéité peut être faite la veille et stockée à 4 oC pendant la nuit, protégée de la lumière. H2O2 devrait être rendu frais le jour de l’expérimentation.
3. Collecter des cellules
- Cultivez des cellules dans un flacon T175 à environ 70-90% confluence.
- Retirer les supports et rincer à l’amorti.
REMARQUE : Les tampons typiques à utiliser sont la culture cellulaire de catégorie Dulbecco’s phosphate-buffered saline (DPBS) ou la solution de sel équilibrée de Hank (HBSS). - Détachez les cellules à l’aide d’une trypsine-EDTA ou d’un grattoir.
- Une fois la résuspendance détachée dans 10 ml de tampon et compter les cellules.
- Tourner vers le bas, enlever le tampon et la trypsine-EDTA, et la résuspendance pour faire 2 x 106 cellules/mL.
- Aliquot 500 lil des cellules par échantillon.
REMARQUE : Pour chaque condition, faites un minimum de 3 échantillons de laser, et 3 pas de commandes laser.
4. Exécution IC-FPOP
- Remplissez les deux seringues de 5 ml de tampon, la seringue de 500 L contenant les aimants avec les cellules, et la seringue finale de 500 L avec H2O2. Allumez l’agitateur magnétique.
- Spike dans 220 L de sulfoxide de diméthyle (DMSO) à un aliquot d’étanchéité, mélangez doucement, et placez derrière le système d’écoulement pour recueillir des échantillons irradiés. L’ajout de DMSO inhibera la réductase endogène de sulfoxide de méthionine.
- Allumez le laser, attendez 7 s, puis allumez le système d’écoulement.
- Une fois que l’échantillon finit de couler, éteignez le laser et mélangez doucement l’étanchéité avec l’échantillon recueilli. Placez ceci sur le côté pendant les étapes 4.5 et 4.6.
- Remplissez les quatre seringues avec le tampon dans lequel les cellules sont suspendues et écoulez-la à travers le système d’écoulement.
- Une fois que le système a terminé le rinçage, répétez les étapes 4.1 et 4.2. Démarrer le flux sans irradiation. C’est le contrôle de laser aucun pour expliquer l’oxydation de fond dans les cellules.
- Pendant que l’échantillon suivant est en cours d’exécution, faites tomber l’échantillon précédent à 450-800 x g pendant 5 min, retirez le solvant et réutilisez-le dans 100 l d’un tampon de lyse cellulaire comme le tampon d’essai d’essai de radioimmunoprecipitation (RIPA).
- Transférer l’échantillon dans un tube de microcentrifuge et geler le flash dans de l’azote liquide.
- Lorsque tous les échantillons ont fini de fonctionner, démonter le système de débit pour le nettoyage. Jetez les tubes de silice usagés et nettoyez toutes les autres connexions en sonicant 1 h dans 50% d’eau: 50% de méthanol. Nettoyer les seringues selon les instructions du fabricant.
5. Digest
- Digérer toute la cellule lysate. Commencez par décongeler les échantillons et chauffer à 95 oC pendant 10 min.
- Après le chauffage, refroidir le lysate sur la glace pendant 15 min.
- Ajouter 25 unités de nucléase pour digérer l’ADN et l’ARN et incuber à l’espace tempéré pendant 15 min.
- Faire tourner les échantillons à l’aide d’une centrifugeuse de table à 16 000 x g pendant 10 min à 4 oC.
- Recueillir le supernatant et le transférer dans un tube de microcentrifuge propre.
- Vérifiez la concentration de protéines à l’aide d’un kit d’analyse de protéines.
- Transférer 20-100 g d’échantillon dans un tube de microcentrifuge propre et porter à 100 l.
- Réduire les échantillons de 20 mM dithiothreiotol (TNT) à 50 oC pendant 45 min.
- Refroidir les échantillons à température ambiante pendant 15 min.
- Alkylate avec 20 mM iodoacetamide (IAA) à température ambiante pendant 20 min protégé de la lumière.
- Ajouter l’acétone pré-réfrigérée à une protéine de rapport 1:4 : acétone. Mélanger les échantillons et les placer dans -20 oC pendant la nuit.
- Le lendemain matin, faire tourner des échantillons à 16 000 x g pendant 10 min à 4 oC.
- Retirer le supernatant et ajouter 50 L d’acétone pré-réfrigérée à 90 %. Mélanger les échantillons et faire tourner à 16 000 x g pendant 5 minutes à 4 oC.
- Retirer l’acétone et laisser sécher les échantillons en laissant les bouchons de la microcentrifugeuse ouverts avec une lingette sans peluche recouvrant le dessus. Une fois les échantillons séchés, réutilisez la granule de protéines avec 10 mM Tris tampon pH 8.
- Résuspendez 20 g de trypsine dans 40 l de 10 mM Tris tampon pH 8. Ajouter 2 g de trypsine (masse : rapport de masse de 1 trypsine : 50 échantillons). Incuber des échantillons à 37 oC pendant la nuit.
- Le lendemain matin, vérifiez la concentration de peptides à l’aide d’un essai de peptide. Une fois que l’échantillon a été enlevé pour l’essai de peptide, étancher la digestion de trypsine en ajoutant de l’acide formique aux échantillons (la concentration finale est de 5% d’acide formique).
- Une fois la concentration finale de peptide déterminée, transférer 10 g de chaque échantillon dans un tube de microcentrifuge propre. Cela garantit que la même quantité de chaque échantillon est analysée. Séchez l’échantillon à l’aide d’une centrifugeuse sous vide. Une fois la résuspendance séchée avec 20 l de spectrométrie de masse grade 0.1% acide formique. Transférer des échantillons dans des flacons autosampler.
6. Spectrométrie de masse liquidé chromatographie-Tandem
- Pour localiser les modifications FPOP analyser le lysate cellulaire digéré à l’aide de LC-MS / MS analyse.
- Utilisez des phases mobiles de 0,1 % d’acide formique dans l’eau (A) et de 0,1 % d’acide formique en acétyronique (B).
- Chargez 0,5 g d’échantillon sur une colonne de piégeage et un échantillon de lavage de 180 m x 20 mm C18 (5 m et 100 o) avec 99 % (A) et 1 % (B) pendant 15 min.
- À l’aide d’une colonne analytique de 75 m x 30 cm C18 (5 m et 125 euros), exécutez la méthode de séparation analytique avec un débit de 0,300 l/min à partir de 3 % (B) pendant une minute puis rampe à 10 % (B) de 1 à 2 min. Prochaine rampe à 45% (B) de 2-100 min puis 100% (B) de 100-110 min. Nettoyez la colonne en maintenant à 100% (B) de 110-115 min. Reconditionner la colonne en passant de 115 à 116 min (B) et tenir à 3% (B) de 116 à 130 min.
- Définissez la méthode d’acquisition de SP pour avoir une résolution de 60.000 avec une gamme de balayage m/z de 375-1500. Définissez l’objectif de contrôle automatique du gain (AGC) à 5,0 x 105 avec un temps d’injection maximum de 50 ms.
- Lors de l’acquisition de LA SP, sélectionnez les ions précurseurs avec les états de charge 2-6 pour l’isolement par l’acquisition dépendante des données (DDA) avec une fenêtre d’isolement de 1,2 m/z et un temps de cycle de 4 s. Sélectionnez les peptides avec un seuil d’intensité de 5,0 x 104 pour l’activation de HCD avec une énergie normalisée réglée à 32%. Exclure les peptides après 1 MS/MS acquisition pour 60 s. Définir la résolution MS/MS à 15 000 avec un objectif AGC de 5,0 x 104 et un délai d’injection maximal de 35 ms.
7. Traitement des données
- Rechercher les fichiers RAW sur un logiciel d’analyse de protéines disponible contre une base de données protéique pertinente et l’enzyme digeste pertinente. Ici, utilisez la base de données Swiss-Prot Homo Sapiens et trypsin.
- Réglez la masse précurseur à la recherche entre 350 à 5000 Da et une tolérance de masse de 10 ppm. Il peut y avoir au plus 1 site de clivage manqué avec une longueur de peptide entre 6 à 144 résidus. Ces limitations facilitent la recherche de bases de données.
- Définissez les ions fragmentaux tolérance de masse maximale à 0,02 Da avec le carbamidomethyl (57.021) comme une modification statique et toutes les modifications FPOP de 17 acides aminés comme une modification dynamique(figure 4 est un exemple du flux de travail d’analyse de protéine utilisé pour détecter les modifications FPOP).
REMARQUE : Les modifications FPOP sur la sérine et la thréonine ne sont pas incluses dans la recherche en raison de leur réactivité plus faible avec les radicaux hydroxylaux. - Rechercher avec une base de données leurres avec un taux de découverte de faux de 1% et 5%.
- Une fois les fichiers terminés, la recherche calcule l’étendue de la modification FPOP. Découvert 2.2 open Proteome, séquence d’exportation, emplacements de modification, adhésion aux protéines, fichier de spectre, abondance de précurseurs et informations sur le temps de rétention. Calculer l’étendue de la modification de l’équation 4 :

La zone EIC modifiée est la zone chromatographique d’un peptide spécifique avec une modification radicale hydroxyl. La zone EIC est la zone chromagraphique totale des zones modifiées et non modifiées de ce peptide spécifique. L’étendue de l’oxydation est calculée dans les échantillons avec et sans irradiation. L’irradiation d’omission d’échantillon (contrôle) explique toute oxydation de fond qui aurait pu être présente dans les cellules avant et après l’exposition de H2O2. Les contrôles sont soustraits des échantillons d’irradiation pour aider à isoler les modifications spécifiques À la FPOP.
Résultats
IC-FPOP est une méthode d’empreinte pour interroger les interactions protéiques dans les cellules vivantes. Dans le système de débit IC-FPOP, le temps d’exposition H2O2 est limité à environ 3 s, ce qui justifie des concentrations plus élevées de H2O2 sans conséquences néfastes pour les cellules. Le système de débit intègre également deux flux de tampon de gaine, qui concentre hydrodynamiquement les cellules au centre de la tubulure produisant un seul flux de cellules à irradier uniformément (figure 5)9. L’imagerie par fluorescence des images empilées de YZ orthogonal(figure 5A) montre une séparation claire du tampon de gaine (contenant un fluorophore FITC) de la solution cellulaire (contenant un fluorophore de TMRM). Pour souligner cette séparation, les figures 5B et figure 5C montrent des cartes de chaleur moyennes tridimensionnelles de la solution tampon gainée ou de la solution cellulaire, illustrant un mélange minimal des deux solutions.
L’utilisation du système d’écoulement cellulaire unique augmente le nombre de protéines oxydativement modifiées de 13 fois(figure 6A)9. Dans cette méthode, les protéines dans beaucoup de compartiments cellulaires sont étiquetés avec des protéines membranaires, des protéines cytoplasmiques, et des protéines dans le noyau étant le plus répandu8,9. Pour s’assurer que les protéines ont été modifiées dans des cellules intactes, des images fluorescentes des cellules traitées par CellROX ont été réalisées après le traitement H2O2 et l’irradiation (figure 6B)8. La stabilité des cellules tout au long du processus d’étiquetage confirme encore l’efficacité de l’IC-FPOP pour sonder les protéines dans leur environnement cellulaire indigène. En utilisant la spectrométrie de masse tandem, ces modifications peuvent être localisées à des acides aminés spécifiques sur une protéine. La figure 7 représente une modification qui a lieu pendant IC-FPOP avec son chromatogramme d’ion extrait. Le décalage observé dans l’ion ion extrait se traduit par le changement de l’hydrophobicité causé par la méthionine oxydée dans le peptide modifié.
Pour tester si les modifications FPOP sondent l’accessibilité solvable à l’intérieur des cellules, l’actine étiquetée dans la cellule a été comparée à la fois à une étude d’empreinte in vitro et à diverses structures cristallines d’actine(figure 8)8. L’actine étiquetée en cellule est représentée dans la figure 8A montre des étendues comparables d’oxydation de l’étude in vitro de Guan et coll.10 (figure 8B), l’actine finale présente une accessibilité solvable similaire pour des études innétiques et in vitro. Pour confirmer en outre que IC-FPOP sondait l’accessibilité solvante de l’actine, l’étendue des modifications de FPOP a été comparée à l’accessibilité solvant des résidus étiquetés calculés à partir de deux structures cristallines d’actine(figure 8C). Cette corrélation démontre que IC-FPOP sonde bien l’accessibilité solvante de la protéine monomérique.

Figure 1 : Comment bien construire des ferules. (A) Placez les ferrules, les tubes de silice et les manches ensemble avant de serrer. (B) Resserrer tous les composants ensemble. (C) Le produit final produira une ferule qui a été resserrée sur la manche. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 2 : Mise en place d’un système de débit IC-FPOP. (A) Image d’un système de débit IC-FPOP entièrement assemblé positionné à côté du laser. (B) Exemple d’un espaceur nécessaire pour augmenter le diamètre extérieur des seringues de 500 L pour resserrer avec succès toutes les seringues vers le bas ensemble. (C) Images représentatives montrant l’espace requis pour les agitateurs magnétiques. (D) Bouchons sont nécessaires pour caler la pompe à seringue sans casser les seringues. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
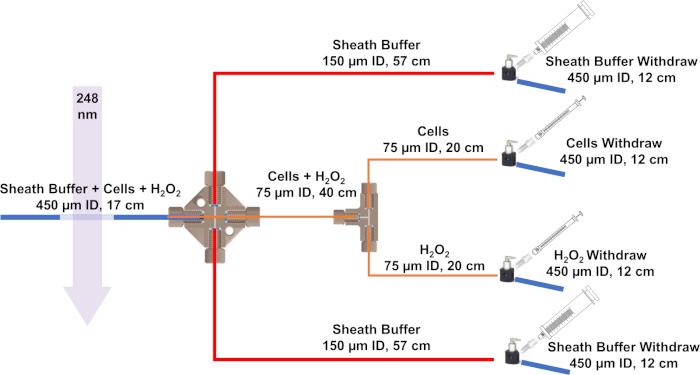
Figure 3 : Schéma du système de débit développé pour IC-FPOP. Les lignes bleues représentent des tubes de silice avec un ID de 450 m et un OD de 670 m, les lignes rouges ont un ID de 150 m et un OD de 360 m, et les lignes oranges ont un ID de 75 m et une DMO de 360 m. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 4 : Logiciel d’analyse des protéines utilisé pour détecter les modifications FPOP. Un flux de travail typique avec les modifications correspondantes recherchées dans chaque nœud. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
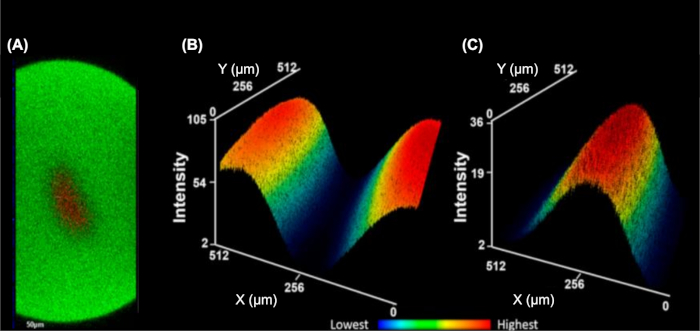
Figure 5 : Le système d’écoulement d’une seule cellule concentre hydrodynamiquement les cellules en un seul flux. (A) Pile de YZ orthogonale illustrant la mise au point 3D de l’analyte cellulaire (rouge, fluorophore de TMRM) entourée par le tampon de gaine (vert, fluorophore FITC). Carte de chaleur d’intensité moyenne tridimensionnelle du tampon de gaine (B) et analyte cellulaire (C). Les intensités inférieures sont bleues et les plus élevées sont rouges (B-C). Ce chiffre a été modifié à partir de Rinas et coll.9S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
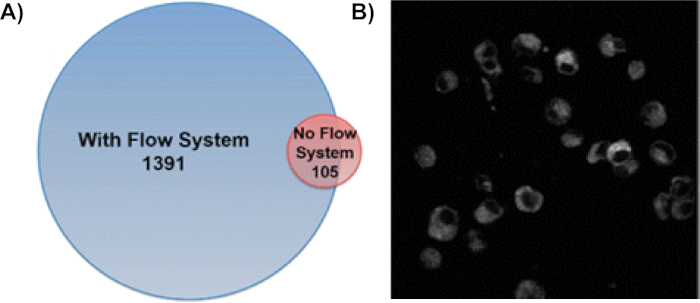
Figure 6 : L’utilisation du système de débit IC-FPOP augmente considérablement les protéines modifiées FPOP dans les cellules d’admission. (A) Comparaison des protéines oxydées identifiées avec et sans le système d’écoulement. Le système d’écoulement a identifié 1391 protéines modifiées FPOP tandis que seulement 105 protéines ont été identifiées sans système d’écoulement avec un chevauchement de 58 protéines modifiées. Ce chiffre a été modifié à partir de Rinas et coll.9 (B) Imagerie fluorescence des cellules traitées CellROX après IC-FPOP montrent que les cellules sont encore intactes après l’étiquetage oxydatif. Des cellules ont été illustrées à l’aide d’un microscope multiphoton Olympus Fluoview FV1000 MPE à 665 nm. L’image montrée est une seule tranche. Ce chiffre a été modifié à partir d’Espino et coll.8S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 7 : Exemples de spectres tandem MS/MS qui ont lieu pendant IC-FPOP. Spectre produit-ion (MS/MS) d’un peptide non modifié (A)et d’une oxydation(B)détectée sur les résidus M8 trouvés sur ce peptide. Un EIC représentatif du peptide non modifiéetdu peptide modifiéD. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 8 : IC-FPOP est efficace pour sonder l’accessibilité des protéines solvables. (A) Étendue de modification pour les 9 peptides oxydativement modifiés de l’actine. Les valeurs sont indiquées comme moyennes plus et moins l’écart standard (n - 3). (B) Modification des peptides d’actine oxydés in vitro par radiolyse synchrotron de Guan et autres10 (C) Corrélation des modifications de résidus FPOP avec SASA dans les états serrés (triangles, tendance pointillé) et ouverts (cercles, ligne de tendance solide) des états d’actine. Ce chiffre a été modifié à partir d’Espino et coll.8S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Plusieurs techniques basées sur la spectrométrie de masse ont été développées pour étudier la structure des protéines et les complexes protéiques-ligand d’une manière protéomome-large dans des cellules entières ou des lysates cellulaires. Ces techniques comprennent la stabilité des protéines provenant du taux d’oxydation (SPROX), du profilage thermique du protéome (PTP), du lien transversal chimique (XL-MS) et de l’empreinte de protéines radicales hydroxyl (HRPF). Chaque technique a des limites et des avantages uniques par rapport à l’autre, qui ont été largement examinés12. Chacune de ces méthodes ont été utilisées pour la biologie structurelle large de protéome pour élucider la structure de protéine et finalement fonctionner dans l’environnement cellulaire complexe. IC-FPOP est une technique HRPF qui utilise des radicaux hydroxyl pour modifier oxydativement les chaînes latérales exposées aux solvants d’acides aminés, la structure des protéines de sondage et les interactions protéines-ligand dans les cellules viables13. IC-FPOP est une amélioration de HRPF initial dans les cellules vivantes qui ont utilisé la chimie Fenton pour générer des radicaux sur l’échelle de temps minutes14. Dans cette étude, les changements structurels dans une protéine de membrane intégrale en réponse à l’abaissement du pH ou de la force ionique du tampon ont été caractérisés avec succès avec une bonne couverture d’oxydation à travers la protéine. Par rapport à la chimie Fenton, IC-FPOP est beaucoup plus rapide, modifiant les protéines sur le micro-échelle de temps, permettant ainsi la conformation des protéines indigènes à étudier.
Un test clé pour IC-FPOP est de confirmer la viabilité des cellules après l’exposition à H2O2. À l’aide d’une ligne de mélange de 40 cm, les cellules sont incubées en H2O2 pendant environ 3 s avant l’irradiation. Cette fois peut être ajustée en modifiant la longueur de ce tube de silice. Il est à noter que bien que l’utilisation du bleu trypan pour tester la viabilité cellulaire montre l’intégrité des cellules sont soutenues après l’incubation H2O2, les cellules pourraient potentiellement être sous des voies de signalisation d’effet de stress qui interagissent avec H2O2. Heureusement, le temps d’incubation court est plus rapide que la synthèse des protéines fournissant la confiance que les protéines présentes ne sont pas induites par H2O2.
La prochaine étape importante consiste à confirmer l’assemblage approprié du système de débit. Une fois assemblé, assurez-vous qu’il n’y a pas de fuites présentes après avoir rincé le système avec le tampon désiré. Si des fuites sont présentes, assurez-vous que le tube de silice a été coupé correctement et est rincé contre la ferrule pour faire un joint approprié une fois resserré vers le bas. Toutes les pièces sont serrées à la main, donc aucun outil n’est nécessaire. Au cours de chaque expérience IC-FPOP, assurez-vous que les agitateurs magnétiques de la seringue cellulaire restent en mouvement. Cette petite agitation limite le nombre de cellules qui se déposent au fond de la seringue, mais n’est pas assez dure pour tondre les cellules. Après une course, il reste environ 50 l de cellules dans la seringue. Assurez-vous toujours de diluer cela avec une étape de rinçage pour limiter le nombre de cellules qui se reportent à la prochaine expérience. Il est recommandé d’utiliser une seringue cellulaire fraîche si plusieurs traitements cellulaires sont comparés. Il est également important de choisir un tampon approprié pour les cellules testées. Certains tampons étanchent le radical hydroxyl conduisant à moins de modifications sur les protéines. Xu et coll. ont montré que certains tampons couramment utilisés diminuent la durée de vie radicale hydroxyl11. DPBS et HBSS sont des tampons communs utilisés pour les expériences IC-FPOP.
Après IC-FPOP, optimisez le protocole de digestion en fonction des paramètres nécessaires. Puisque FPOP produit des modifications covalentes irréversibles, il y a suffisamment de temps disponible pour une digestion et un nettoyage complets sans perdre la couverture d’étiquetage. Testez et normalisez toujours la concentration de protéines afin que des concentrations uniformes de peptide soient chargées pour la spectrométrie de masse en tandem. Enfin, soyez conscient qu’une immunoprécipitation ne peut pas être effectuée en conjonction avec IC-FPOP. Si une modification FPOP cible la région d’interaction, l’affinité de l’anticorps sera abaissée. Pour aider à augmenter l’identification des modifications FPOP, 2D-chromatographic étapes de séparation ont montré à plus que tripler le nombre de peptides oxydésdétectés 15.
Un défi de toute expérience FPOP est le niveau compliqué d’analyse des données en raison des produits d’oxydation possibles qui peuvent survenir. Cela est vrai pour les deux in-cell ou in vitro, mais est considérablement augmenté avec la complexité supplémentaire de l’analyse des lysates cellulaires. Avec une optimisation supplémentaire de l’IC-FPOP plus de protéines avec des couvertures de modification plus élevées sont surgissent, rendant ainsi rapidement l’analyse plus ardue. La quantité de cisaillement générée par une seule expérience IC-FPOP limite l’utilisation de la validation manuelle, ce qui amène les chercheurs à s’appuyer davantage sur les logiciels. Pour cette raison, Rinas et coll. ont développé une stratégie de quantitation pour HRPF en utilisant Proteome Discoverer (PD)16. Cette méthode utilise un flux de travail multi-recherche de nœuds sur combiné avec une plate-forme quantitative dans une feuille de calcul. D’autres améliorations de la plate-forme IC-FPOP sont en cours pour augmenter le nombre de peptides identifiés avec des modifications FPOP ainsi que l’augmentation de la reproductibilité et la précision de quantitation.
Déclarations de divulgation
Lisa Jones est une inventeur sur l’assemblage de flux pour le brevet des cellules (numéro de publication: 20180079998).
Remerciements
Ce travail a été soutenu par le NSF CAREER Award (MCB1701692) pour LMJ.
matériels
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-53A | any brand is sufficient |
| 5 mL Gas Tight Syringe, Removable Luer Lock | SGE Analytical Science | 008760 | |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | any brand is sufficient |
| 500 µL SGE Gastight Syringes: Fixed Luer-Lok Models | Fisher Scientific | SG-00723 | |
| Acetone, HPLC Grade | Fisher Scientific | A929-4 | 4 L quantity is not necessary |
| Acetonitrile with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | LS120-500 | |
| ACQUITY UPLC M-Class Symmetry C18 Trap Column, 100 Å, 5 µm, 180 µm x 20 mm, 2G, V/M, 1/pkg | Waters | 186007496 | |
| ACQUITY UPLC M-Class System | Waters | ACQUITY UPLC M-Class System | |
| Aluminum Foil | Fisher Scientific | 01-213-100 | any brand is sufficient |
| Aqua 5 µm C18 125 Å packing material | Phenomenex | 04A-4299 | |
| Centrifuge | Eppendorf | 022625501 | |
| Delicate Task Wipers | Fisher Scientific | 06-666A | |
| Dithiothreiotol (DTT) | AmericanBio | AB00490-00005 | |
| DMSO, Anhydrous | Invitrogen | D12345 | |
| EX350 excimer laser | GAM Laser | EX350 excimer laser | |
| FEP Tubing 1/16" OD x 0.020" ID | IDEX Health & Science | 1548L | |
| Formic Acid, LC/MS Grade | Fisher Scientific | A117-50 | |
| HV3-2 VALVE | Hamilton | 86728 | |
| Hydrogen Peroxide | Fisher Scientific | H325-100 | any 30% hydrogen peroxide is sufficient |
| Iodoacetamide (IAA) | ACROS Organics | 122270050 | |
| Legato 210 syringe pump | KD Scientific | 788212 | Any syringe pump that can hold 4, 5 mL syringes, withdraw and expel liquid, and have a way to stale the motor should work |
| Luer Adapter Female Luer to 1/4-28 Male Polypropylene | IDEX Health & Science | P-618L | |
| Methanol, LC/MS Grade | Fisher Scientific | A454SK-4 | 4 L quantity is not necessary |
| Microcentrifuge | Thermo Scientific | 75002436 | |
| N,N'-Dimethylthiourea (DMTU) | ACROS Organics | 116891000 | |
| NanoTight Sleeve Green 1/16" ID x .0155" ID x 1.6" | IDEX Health & Science | F-242X | |
| NanoTight Sleeve Yellow 1/16" OD x 0.027" ID x 1.6" | IDEX Health & Science | F-246 | |
| N-tert-Butyl-α-phenylnitrone (PBN) | ACROS Organics | 177350250 | |
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | Orbitrap Fusion Lumos Tribrid Mass Spectrometer | other high resolution instruments (e.g. Q exactive Orbitrap or Orbitrap Fusion) can be used |
| PE50-C pyroelectric energy meter | Ophir Optronics | 7Z02936 | |
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Scientific | 23275 | |
| Pierce Rapid Gold BCA Protein Assay Kit | Thermo Scientific | A53225 | |
| Pierce Trypsin Protease, MS Grade | Thermo Scientific | 90058 | |
| Pierce Universal Nuclease for Cell Lysis | Fisher Scientific | 88702 | |
| Polymicro Cleaving Stone, 1" x 1" x 1/32" | Molex | 1068680064 | any capillary tubing cutter is sufficient |
| Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 150 µm, Outer Diameter 360 µm, TSP150350 | Polymicro Technologies | 1068150024 | |
| Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 450 µm, Outer Diameter 670 µm, TSP450670 | Polymicro Technologies | 1068150025 | |
| Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 75 µm, Outer Diameter 360 µm, TSP075375 | Polymicro Technologies | 1068150019 | |
| Potassium Phosphate Monobasic | Fisher Scientific | P382-500 | |
| Proteome Discover 2.2 (bottom-up proteomics software) | Thermo Scientific | OPTON-30799 | |
| Rotary Magnetic Tumble Stirrer | V&P Scientific, Inc. | VP 710D3 | |
| Rotary Magnetic Tumble Stirrer, accessory kit for use with Syringe Pumps | V&P Scientific, Inc. | VP 710D3-4 | |
| Super Flangeless Ferrule w/SST Ring, Tefzel™ (ETFE), 1/4-28 Flat-Bottom, for 1/16" OD | IDEX Health & Science | P-259X | |
| Super Flangeless Nut PEEK 1/4-28 Flat-Bottom, for 1/16" & 1/32" OD | IDEX Health & Science | P-255X | |
| Super Tumble Stir Discs, 3.35 mm diameter, 0.61 mm thick | V&P Scientific, Inc. | VP 722F | |
| Thermo Scientific Pierce RIPA Buffer | Fisher Scientific | PI89900 | |
| Tris Base | Fisher Scientific | BP152-500 | |
| Upchurch Scientific Low-Pressure Crosses: PEEK | Fisher Scientific | 05-700-182 | |
| Upchurch Scientific Low-Pressure Tees: PEEK | Fisher Scientific | 05-700-178 | |
| UV Fused Silica Plano-Convex Spherical Lenses | THORLABS | LA4052 | |
| V&P Scientific IncSupplier Diversity Partner TUMBL STIR DISC PARYLENE 1000 | V&P Scientific, Inc. | VP724F | |
| VHP MicroTight Union for 360µm OD | IDEX Health & Science | UH-436 | |
| Water with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | LS118-500 | |
| Water, LC/MS Grade | Fisher Scientific | W6-4 |
Références
- Gau, B., Garai, K., Frieden, C., Gross, M. L. Mass spectrometry-based protein footprinting characterizes the structures of oligomeric apolipoprotein E2, E3, and E4. Biochemistry. 50 (38), 8117-8126 (2011).
- Li, Z., et al. High structural resolution hydroxyl radical protein footprinting reveals an extended Robo1-heparin binding interface. Journal of Biological Chemistry. 290 (17), 10729-10740 (2015).
- Zhang, H., Gau, B. C., Jones, L. M., Vidavsky, I., Gross, M. L. Fast photochemical oxidation of proteins for comparing structures of protein− ligand complexes: the calmodulin− peptide model system. Analytical Chemistry. 83 (1), 311-318 (2010).
- Jones, L. M., et al. Complementary MS methods assist conformational characterization of antibodies with altered S-S bonding networks. Journal of the American Society for Mass Spectrometry. 24 (6), 835-845 (2013).
- Kiselar, J. G., Janmey, P. A., Almo, S. C., Chance, M. R. Structural analysis of gelsolin using synchrotron protein footprinting. Molecular & Cellular Proteomic. 2 (10), 1120-1132 (2003).
- Vahidi, S., Stocks, B. B., Liaghati-Mobarhan, Y., Konermann, L. Mapping pH-induced protein structural changes under equilibrium conditions by pulsed oxidative labeling and mass spectrometry. Analytical Chemistry. 84 (21), 9124-9130 (2012).
- Hambly, D. M., Gross, M. L. Laser flash photolysis of hydrogen peroxide to oxidize protein solvent-accessible residues on the microsecond timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Espino, J. A., Mali, V. S., Jones, L. M. In cell footprinting coupled with mass spectrometry for the structural analysis of proteins in live cells. Analytical Chemistry. 87 (15), 7971-7978 (2015).
- Rinas, A., Mali, V. S., Espino, J. A., Jones, L. M. Development of a Microflow System for In-Cell Footprinting Coupled with Mass Spectrometry. Analytical Chemistry. 88 (20), 10052-10058 (2016).
- Guan, J. Q., Almo, S. C., Reisler, E., Chance, M. R. Structural Reorganization of Proteins Revealed by Radiolysis and Mass Spectrometry: G-Actin Solution Structure Is Divalent Cation Dependent. Biochemistry. 42 (41), 11992-12000 (2003).
- Xu, G., Chance, M. R. Hydroxyl radical-mediated modification of proteins as probes for structural proteomics. Chemical Reviews. 107 (8), 3514-3543 (2007).
- Kaur, U., et al. Proteome-Wide Structural Biology: An Emerging Field for the Structural Analysis of Proteins on the Proteomic Scale. Journal of Proteome Research. 17 (11), 3614-3627 (2018).
- Chea, E. E., Jones, L. M. Analyzing the structure of macromolecules in their native cellular environment using hydroxyl radical footprinting. Analyst. 143 (4), 798-807 (2018).
- Zhu, Y., et al. Elucidating in vivo structural dynamics in integral membrane protein by hydroxyl radical footprinting. Molecular & Cellular Proteomic. 8 (8), 1999-2010 (1999).
- Rinas, A., Jones, L. M. Fast photochemical oxidation of proteins coupled to multidimensional protein identification technology (MudPIT): expanding footprinting strategies to complex systems. Journal of the American Society for Mass Spectrometry. 26 (4), 540-546 (2015).
- Rinas, A., Espino, J. A., Jones, L. M. An efficient quantitation strategy for hydroxyl radical-mediated protein footprinting using Proteome Discoverer. Analytical and Bioanalytical Chemistry. 408 (11), 3021-3031 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon