Method Article
Caratterizzare le proteine cellulari con l'ossidazione fotochimica veloce all'incell delle proteine
In questo articolo
Riepilogo
Qui, caratterizzamo la struttura delle proteine e i siti di interazione nelle cellule viventi utilizzando una tecnica di impronta delle proteine definita ossidazione fotochimica veloce in cell delle proteine (IC-FPOP).
Abstract
L'ossidazione fotochimica rapida delle proteine (FPOP) è un metodo di impronta proteica radicale idrossile utilizzato per caratterizzare la struttura e le interazioni delle proteine. FPOP utilizza un laser ad eccimeri a 248 nm per fotolizzare il perossido di idrogeno producendo radicali idrossili. Questi radicali ossidativamente modificano solvente esposto catene laterali di 19 dei 20 aminoacidi. Recentemente, questo metodo è stato utilizzato nelle cellule vive (IC-FPOP) per studiare le interazioni proteiche nel loro ambiente nativo. Lo studio delle proteine nelle cellule spiega l'affollamento intermolecolare e varie interazioni proteiche che vengono interrotte per gli studi in vitro. Un sistema di flusso a cella singola personalizzato è stato progettato per ridurre l'aggregazione delle celle e l'intasamento durante IC-FPOP. Questo sistema di flusso concentra le cellule oltre il laser degli eccimeri individualmente, garantendo così un'irradiazione costante. Confrontando l'estensione dell'ossidazione prodotta da FPOP con l'accessibilità del solvente della proteina calcolata da una struttura cristallina, IC-FPOP può sondare con precisione le catene laterali accessibili al solvente delle proteine.
Introduzione
L'idrossile radical e il tureante (HRPF) sono un metodo che sonda l'accessibilità del solvente di una proteina attraverso modifiche covalenti prodotte da radicali idrossili. Quando la struttura proteica o le interazioni proteiche cambiano, altererà l'esposizione al solvente degli amminoacidi, alterando così l'entità della modificazione dei residui. Con HRPF, le interazioni proteiche1,2,3 e i cambiamenti conformazionali proteici4,5,6 sono stati interrogati con successo in vitro. Ci sono diversi metodi che generano radicali idrossili per esperimenti HRPF, uno dei quali è l'ossidazione fotochimica veloce delle proteine (FPOP). FPOP è stato sviluppato da Hambly e Gross nel 2005 e utilizza un laser ad eccimeri 248 nm per produrre radicali idrossili attraverso la fotolisi del perossido di idrogeno (H2O2)7.
Recentemente, Espino et al. ha esteso l'uso di FPOP per sondare la struttura delle proteine nelle cellule vive, un metodo chiamato FPOP in-cell (IC-FPOP)8. A differenza degli studi in vitro, lo studio delle proteine nelle cellule spiega l'affollamento molecolare insieme a varie interazioni proteiche che potrebbero potenzialmente influenzare la struttura. Inoltre, presenta il vantaggio di fornire un'istantanea dell'intero proteoma potenzialmente fornendo informazioni strutturali di numerosi sistemi contemporaneamente per eseguire la biologia strutturale larga proteoma. Inoltre, questa tecnica è ideale per proteine difficili da studiare in vitro, come le proteine della membrana.
Gli studi iniziali dell'IC-FPOP hanno sondato con successo 105 proteine che vanno in abbondanza di proteine e localizzazione cellulare. Per migliorare il metodo IC-FPOP, Rinas e altri hanno sviluppato un sistema di microflusso per il flusso a cella singola9. Il miglioramento del sistema di flusso originale limita l'aggregazione delle cellule e aumenta l'H2O2 disponibile disponibile per l'irradiazione. Nel sistema di flusso iniziale, le cellule che si acmassano nel tubo di silice hanno provocato ostriche e irradiazione irregolare. L'incorporazione di due flussi di un tampone di guaina concentra idrodinamicamente le cellule, permettendo loro di fluire individualmente oltre il laser. L'incorporazione di una siringa separata per l'H2O2 consente un tempo di esposizione più controllato e ottimizzabile che consente concentrazioni più elevate di H2O2 senza effetti negativi. Inoltre, limitando il tempo di incubazione limita la ripartizione di H2O2 da catalasi endogena. Incorporando questo nuovo sistema di flusso, il numero rilevato di proteine con una modifica FPOP è aumentato di 13 volte, espandendo così le capacità di questo metodo per sondare una moltitudine di proteine nelle cellule viventi. In questo protocollo viene descritto un esperimento generale IC-FPOP incentrato sull'assemblaggio del sistema di flusso IC-FPOP.
Protocollo
1. Configurare il sistema di flusso IC-FPOP
- Per iniziare l'assemblaggio del sistema di flusso, tagliare la silice fusa utilizzando una pietra scissione a misura. Il sistema di flusso IC-FPOP richiede quattro 12 cm e una silice fusa da 17 cm con un diametro interno (ID) di 450 m e diametro esterno (OD) di 670 m, due 24 cm e uno 40 cm con un ID di 75 m e un OD di 360 m , e infine due 57 cm con un ID di 150 m e un OD di 360 m.
NOTA: Quando si taglia il tubo di silice, raschiare delicatamente via il rivestimento in poliimide e piegare per ottenere il taglio più pulito. Controllare che si tratti di un taglio dritto (questo è necessario per garantire nessun blocco o perdite di forma). - Impostare 15 connessioni utilizzando maniche nano-strette (0,0155" ID X 1/16" OD per tubi di silice 360 m OD e 0.027" ID X 1/16" OD per il 670 M OD Tubing silice d'olio) con super flangeless dado PEEK 1/4-28 fondo piatto per 1/16" OD e super flangeless ferrule w/SST anello, Tefzel (ETFE), 1/4-28 fondo piatto, per 1/16" OD. Costruire le connessioni in base al protocollo del produttore (Figura 1).
- Mettere 6 piccoli magneti cilindrici in una siringa da 500. Riempire questa siringa insieme ad altre siringhe da 500 e due siringhe da 5 mL con tampone e rimuovere l'aria. Posizione sulla pompa della siringa come mostrato nella Figura 2A.
NOTA: Le siringhe da 5 mL sono più grandi delle siringhe 500, quindi è necessario un distanziale per stringere tutte le siringhe contemporaneamente in posizione (Figura 2B). - Stringere il tappo della pompa della siringa in modo che la siringa cellulare abbia circa 50 gradi all'arresto quando il motore si blocca. Questo lascerà spazio per gli agitatori magnetici. (Figura 2C-D).
AVVISO: Se la pompa della siringa mette pressione sui magneti, inceppano la siringa e possono causare la rottura della siringa. - Utilizzando un adattatore Luer, collegare una valvola manuale ad ogni siringa. Assemblare il tubo di silice come mostrato nella Figura 3.
NOTA: Infilare la linea con le celle : H2O2 fino all'altro lato. Quindi inserirlo nel tubo di silice ID 450 m. I buffer di di ottania nella siringa da 5 mL scorreranno ad una velocità più veloce rispetto alle celle e H2O2. Con i cuscinetti di falena su entrambi i lati, le cellule saranno idrodinamicamente focalizzate su un'unica linea per l'irradiazione. - Sistema di flusso di posizione accanto al laser. Utilizzando un accendino, bruciare il rivestimento di silice sul tubo ID 450 m per fare una finestra per l'irradiazione laser.
- Posizionare un agitatore magnetico sopra la siringa che contiene i sei magneti.
- Impostare la pompa della siringa a 492,4 l/min per una portata finale di 1.083,3 L/min.
- Concentrare il laser degli ascimeri sul tubo di silice utilizzando una lente convessa. Una volta messa a fuoco, testare la finestra di irradiazione posizionando un piccolo pezzo di carta dietro il tubo di silice e accendere il laser. Misurare la regione bruciata dall'irradiazione. Calcolare la frequenza laser necessaria utilizzando la finestra di irradiazione e la portata per ottenere una frazione di esclusione pari a zero.
NOTA: L'energia laser consigliata per un esperimento IC-FPOP è di 120 mJ. Per ottenere una frazione di esclusione pari a 0 con una finestra di irradiazione di 2,58 mm e una portata di 1083,3 l/min, la frequenza deve essere 44. Di seguito sono riportate le equazioni necessarie per calcolare la frequenza laser se la finestra di irradiazione, la portata e la frazione di esclusione sono note.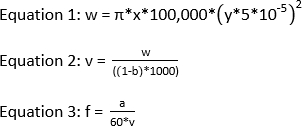
dove w è il volume in nL, x è la larghezza del punto laser in mm, y è l'ID del tubo di silice in zm, v è il volume totale in L, b è la frazione di esclusione, a è la velocità di flusso in Hz/min, e f è la frequenza in Hz.
2. Fare quench e H2O2
- Fare quench contenente 100 mM N-tert-Butyl-alpha-phenylnitrone (PBN) e 100 mM N,N'-dimethylthiourea (DMTU). Aliquota 11 mL di spegnimento per ogni campione in un tubo conico da 50 mL.
- Diluire H2O2 200 mM. Ogni campione richiede 500 L di H2O2.
NOTA: La tinto può essere effettuata il giorno prima e conservata a 4 gradi durante la notte, protetta dalla luce. H2O2 deve essere reso fresco il giorno della sperimentazione.
3. Raccogliere le celle
- Coltivare le cellule in un flacone T175 a circa 70-90% confluenza.
- Rimuovere il supporto e risciacquare con buffer.
NOTA: i buffer tipici da utilizzare sono la soluzione salina con buffer di fosfato di Dulbecco (DPBS) di tipo coltivato in coltura cellulare o la soluzione di sale equilibrato di Hank (HBSS). - Scollegare le cellule utilizzando trypsin-EDTA o con un raschietto.
- Una volta scollegato resuspend in 10 mL di buffer e contare le celle.
- Girare verso il basso, rimuovere il buffer e trypsin-EDTA, e risospendere per fare 2 x 106 celle / mL.
- Aliquota 500 l delle cellule per campione.
NOTA: Per ogni condizione, fare un minimo di 3 campioni laser, e 3 nessun controllo laser.
4. Esecuzione di IC-FPOP
- Riempire le due siringhe da 5 mL con tampone, la siringa 500 con i magneti con le cellule e la siringa finale da 500 ll con H2O2. Accendere l'agitatore magnetico.
- Spike in 220 - L di solforo dimetilo (DMSO) a una macchia di slittino, mescolare delicatamente e posizionare il sistema di flusso per raccogliere campioni irradiati. L'aggiunta di DMSO inibirà la riduttodio endogeno di solforosi.
- Accendere il laser, attendere 7 s, quindi accendere il sistema di flusso.
- Una volta che il campione finisce di fluire, spegnere il laser e mescolare delicatamente lo spegnimento con il campione raccolto. Posizionarlo a lato durante i passaggi 4.5 e 4.6.
- Riempire tutte e quattro le siringhe con il buffer in cui le celle vengono sospese e scorrerle attraverso il sistema di flusso.
- Al termine del lavaggio del sistema, ripetere i passaggi 4.1 e 4.2. Avviare il flusso senza irradiazione. Questo è il controllo del laser per tenere conto dell'ossidazione dello sfondo nelle cellule.
- Mentre l'esempio successivo è in esecuzione, girare verso il basso il campione precedente a 450-800 x g per 5 min, rimuovere il solvente e risospendere in 100 : L di un buffer di lisi cellulare come il buffer di analisi di analisi radioimmunoprecipitazione (RIPA).
- Trasferire il campione in un tubo di microcentrifuga e congelare il flash in azoto liquido.
- Al termine dell'esecuzione di tutti i campioni, smontare il sistema di flusso per la pulizia. Scartare il tubo di silice usato e pulire tutte le altre connessioni sonalgiando per 1 h in 50% di acqua: 50% metanolo. Pulire le siringhe come da istruzioni del produttore.
5. Digest
- Digerire l'intera cellula lisata. Iniziare scongelando i campioni e riscaldando a 95 gradi centigradi per 10 minuti.
- Dopo il riscaldamento, raffreddare il lisato sul ghiaccio per 15 min.
- Aggiungere 25 unità di nucleato per digerire DNA e RNA e incubare in camera temperata per 15 min.
- Campioni di spin utilizzando una centrifuga da tavolo a 16.000 x g per 10 min a 4 gradi centigradi.
- Raccogliere il supernatante e trasferirlo in un tubo di microcentrifuga pulito.
- Controllare la concentrazione proteica utilizzando un kit di saggi proteici.
- Trasferire 20-100 g di campione su un tubo di microcentrifuga pulito e portare a 100 .L.
- Riduci i campioni con dithiothreiotol da 20 mM (DTT) a 50 gradi centigradi per 45 min.
- Raffreddare i campioni a temperatura ambiente per 15 min.
- Alkylate con 20 mM di iodoacetamide (IAA) a temperatura ambiente per 20 min protetto dalla luce.
- Aggiungere l'acetone pre-raffreddato a una proteina con rapporto 1:4: l'acetone. Mescolare i campioni e mettere in -20 gradi durante la notte.
- La mattina dopo, i campioni di spin a 16.000 x g per 10 min a 4 gradi centigradi.
- Togliere il supernatante e aggiungere 50 l of 90% di acetone prefreddo. Mescolare i campioni e girare verso il basso a 16.000 x g per 5 min a 4 gradi centigradi.
- Rimuovere l'acetone e lasciare asciugare i campioni lasciando aperti i tappi della microcentrifuga con una salvietta libera di laminetta che copre la parte superiore. Dopo che i campioni si sono asciugati, risospendere il pellet proteico con 10 mM Tris tampone pH 8.
- Risospendere 20 g di trippsina in 40 -L di 10 mM Tris tampone pH 8. Aggiungere 2 g di trypsin (massa: rapporto di massa di 1 trypsin: 50 campione). Incubare campioni a 37 gradi durante la notte.
- La mattina successiva controllare la concentrazione di peptidi utilizzando un saggio di peptide. Dopo che il campione è stato rimosso per il saggio di peptidi, placare la digestione della metapsina aggiungendo acido formico ai campioni (la concentrazione finale è del 5% di acido formica).
- Una volta determinata la concentrazione finale dei peptidi, trasferire 10 g di ciascun campione in un tubo di microcentrifuga pulito. Ciò garantisce l'analisi della stessa quantità di ogni campione. Asciugare il campione con una centrifuga sottovuoto. Una volta essiccata la resospensione con 20 - L di spettrometria di massa di grado 0.1% acido formico. Trasferire i campioni alle fiale autocampione.
6. Spettrometria di massa Liquid Chromatography-Tandem
- Per localizzare le modifiche FPOP analizzare il lisato di cellule digerite utilizzando l'analisi LC-MS/MS.
- Utilizzare fasi mobili dello 0,1% di acido formico nell'acqua (A) e dello 0,1% dell'acido formico in acetonitrile (B).
- Caricare 0,5 g di campione su una colonna di intrappolamento di 180 m x 20 mm (5 m e 100) e lavare il campione con il 99% (A) e l'1% (B) per 15 min.
- Utilizzando una colonna analitica di 75 m x 30 cm C18 (5 m e 125 ) , eseguire il metodo di separazione analitica con una portata di 0,300 l/min a partire da 3% (B) per un min, quindi rampa al 10% (B) da 1-2 min. Rampa successiva al 45% (B) da 2-100 min quindi 100% (B) da 100-110 min. Pulire la colonna tenendo al 100% (B) da 110-115 min. Ricondizionare la colonna di rampa verso il basso al 3% (B) da 115-116 min e tenere a 3% (B) da 116-130 min.
- Impostare il metodo di acquisizione MS per una risoluzione di 60.000 con un intervallo di scansione m/z di 375-1500. Impostare l'obiettivo di controllo automatico del guadagno (AGC) su 5,0 x 105 con un tempo massimo di iniezione di 50 ms.
- Durante l'acquisizione di MS, selezionare gli ioni precursori con stati di carica 2-6 per l'isolamento tramite l'acquisizione dipendente dai dati (DDA) con una finestra di isolamento di 1,2 m/z e un tempo di ciclo di 4 s. Selezionare i peptidi con una soglia di intensità di 5,0 x 10 4 perl'attivazione di HCD con un'energia normalizzata impostata al 32%. Escludere i peptidi dopo 1 acquisizione MS/MS per 60 s. Impostare la risoluzione MS/MS su 15.000 con un obiettivo AGC di 5,0 x 104 e un tempo massimo di iniezione di 35 ms.
7. Trattamento dei dati
- Cerca i file RAW su un software di analisi delle proteine disponibile in un database di proteine rilevante e sull'enzima digest pertinente. Qui, utilizzare il database Svizzero-Prot Homo Sapiens e trypsin.
- Impostare la massa precursore per la ricerca tra 350 e 5.000 Da e una tolleranza di massa di 10 ppm. Ci può essere al massimo 1 sito di scissione perso con una lunghezza peptide tra 6 a 144 residui. Queste limitazioni facilitano la ricerca nel database.
- Impostare la tolleranza di massa massima degli ioni di frammento su 0,02 Da con il carbamidomethyl (57,021) come modifica statica e tutte le modifiche FPOP da 17 aminoacidi come modifica dinamica(Figura 4 è un esempio del flusso di lavoro di analisi delle proteine utilizzato per rilevare le modifiche FPOP).
NOTA: le modifiche FPOP su serina e tosonina non sono incluse nella ricerca a causa della loro minore reattività con i radicali idrossili. - Ricerca con un database esca con un tasso di scoperta falso di 1% e 5%.
- Una volta che i file sono finiti, calcolare l'entità della modifica FPOP. Open Proteome Discoverer 2.2, sequenza di esportazione, posizioni di modifica, adesione di proteine, file di spettro, abbondanza di precursori e informazioni sul tempo di conservazione. Calcolare l'estensione della modifica dall'equazione 4:

L'area EIC modificata è l'area cromatografica di un peptide specifico con modifica radicale dell'idrossile. L'area EIC è l'area cromatica totale di aree sia modificate che non modificate di quel peptide specifico. L'entità dell'ossidazione è calcolata nei campioni con e senza irradiazione. Il campione che omette l'irradiazione (controllo) tiene conto di qualsiasi ossidazione di fondo che avrebbe potuto essere presente nelle cellule prima e dopo l'esposizione a H2O2. I controlli vengono sottratti dai campioni di irradiazione per aiutare a isolare le modifiche specifiche dell'FPOP.
Risultati
IC-FPOP è un metodo di impronta per interrogare le interazioni proteiche nelle cellule vive. Nel sistema di flusso IC-FPOP, il tempo di esposizione H2O2 è limitato a circa 3 s, garantendo concentrazioni più elevate di H2O2 senza conseguenze dannose per le cellule. Il sistema di flusso incorpora anche due flussi di tampone di fasiai, che idrodinamicamente concentrale al centro del tubo producendo un singolo flusso di cellule da irradiare uniformemente (Figura 5)9. L'imaging a fluorescenza di immagini impilate ortogonali(Figura 5A) mostra una chiara separazione del buffer di ottana (contenente un fluoroforo FITC) dalla soluzione cellulare (contenente un fluoroforo TMRM). Per sottolineare questa separazione, Figura 5B e Figura 5C mostrano mappe di calore medio tridimensionale della soluzione buffer di tipo di ettatura o soluzione cellulare, che illustra la combinazione minima delle due soluzioni.
L'uso del sistema a flusso a cella singola aumenta di 13 volte il numero di proteine modificate ossidativamente (Figura 6A)9. In questo metodo, le proteine in molti dei compartimenti cellulari sono etichettate con proteine della membrana, proteine citoplasmiche e proteine all'interno del nucleo essendo il più prevalente8,9. Per garantire che le proteine siano state modificate all'interno di cellule intatte, sono state eseguite immagini fluorescenti delle cellule trattate CellROX in seguito al trattamento H2O2 e all'irradiazione (Figura 6B)8. La stabilità delle cellule durante tutto il processo di etichettatura conferma ulteriormente l'efficacia di IC-FPOP per sondare le proteine nel loro ambiente cellulare nativo. Utilizzando la spettrometria tandem-massa, queste modifiche possono essere localizzate in aminoacidi specifici su una proteina. Figura 7 rappresenta una modifica che avviene durante IC-FPOP insieme al relativo cromatogramma io stirato. Lo spostamento osservato nel cromatogramma iostrato si traduce nel cambiamento di idrofobicità causato dalla methionina ossidata nel peptide modificato.
Per verificare se l'accessibilità del solvente della sonda di modifica FPOP all'interno delle cellule, actina etichettata in cella è stata confrontata sia con uno studio di impronta in vitro che con varie strutture cristalline di actin (Figura 8)8. L'actin etichettato in cella è rappresentato nella figura 8A mostra estensioni comparabili di ossidazione dallo studio in vitro di Guan et al.10 (Figura 8B), l'atto conclusivo ha un'accessibilità a solvente simile sia per gli studi in cella che per gli studi in vitro. Per confermare ulteriormente l'IC-FPOP stava sondando l'accessibilità del solvente di actin, l'entità delle modifiche FPOP è stata confrontata con l'accessibilità solvente dei residui etichettati calcolati da due strutture di cristallo actin(Figura 8C). Questa correlazione dimostra che IC-FPOP sonda bene l'accessibilità solvente della proteina monomerica.

Figura 1: Come costruire correttamente le regole. (A) Posizionare le ferregole, il tubo di silice e il manicotto insieme prima di stringere. (B) Stringere tutti i componenti insieme. (C) Il prodotto finale produrrà una ferule che è stata serrata sulla manica. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Configurazione del sistema di flusso IC-FPOP. (A) Immagine di un sistema di flusso IC-FPOP completamente assemblato posizionato accanto al laser. (B) Esempio di distanziatore necessario per aumentare il diametro esterno delle siringhe 500 per stringere con successo tutte le siringhe verso il basso insieme. (C) Immagini rappresentative che mostrano lo spazio necessario per gli agitatori magnetici. (D) I tappi sono necessari per bloccare la pompa di siringhe senza rompere le siringhe. Fare clic qui per visualizzare una versione più grande di questa figura.
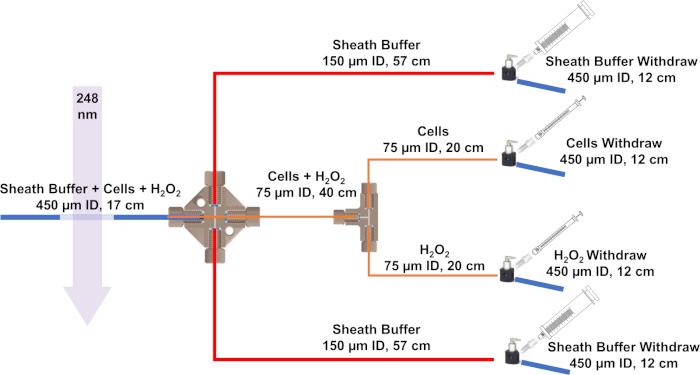
Figura 3: Schema del sistema di flusso sviluppato per IC-FPOP. Le linee blu rappresentano tubi di silice con un ID di 450 m e 670 m OD, le linee rosse hanno un ID di 150 m e 360 OD, e le linee arancioni hanno un ID di 75 m e 360m OD. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Software di analisi delle proteine utilizzato per rilevare le modifiche FPOP. Flusso di lavoro tipico con le modifiche corrispondenti ricercate in ogni nodo. Fare clic qui per visualizzare una versione più grande di questa figura.
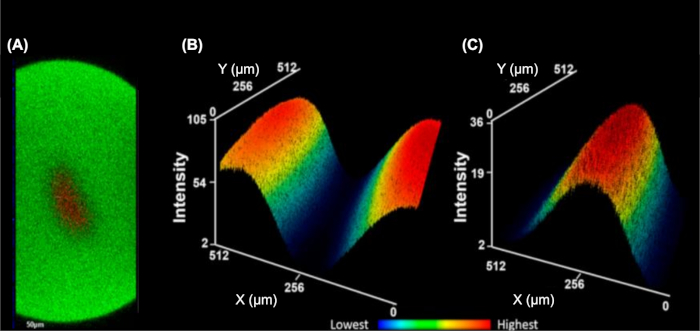
Figura 5: Il sistema di flusso a cella singola concentra le celle in un unico flusso. (A) Stack ortogonale yz che illustra la messa a fuoco 3D dell'analita cellulare (rosso, fluoroforo TMRM) circondato dal buffer di guaina (verde, fluoroforo FITC). Mappa termica di intensità media tridimensionale del buffer di neocula (B) e dell'analita cellulare (C). Le intensità inferiori sono blu e più alte sono rosse (B-C). Questa cifra è stata modificata da Rinas et al.9Clicca qui per vedere una versione più grande di questa figura.
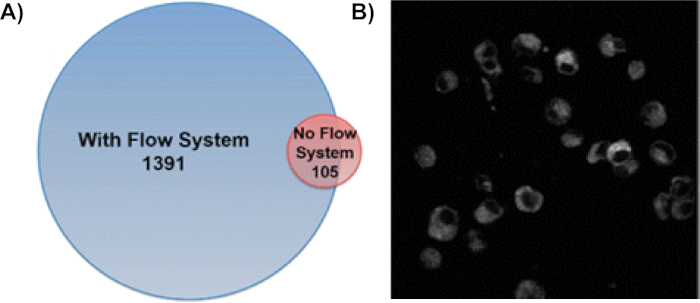
Figura 6: L'utilizzo del sistema di flusso IC-FPOP aumenta drasticamente le proteine modificate FPOP nelle cellule di assunzione. (A) Confronto delle proteine ossidati identificate con e senza il sistema di flusso. Il sistema di flusso ha identificato 1391 proteine modificate Dall'FPOP, mentre solo 105 proteine sono state identificate con nessun sistema di flusso con una sovrapposizione di 58 proteine modificate. Questa cifra è stata modificata da Rinas et al.9 (B) L'imaging di fluorescenza delle cellule trattate da CellROX dopo IC-FPOP mostra che le cellule sono ancora intatte dopo l'etichettatura ossidativa. Le cellule sono state fotografate utilizzando un olympus Fluoview FV1000 multiphoton al microscopio multifotono a 665 nm. Immagine mostrata è una singola sezione. Questa cifra è stata modificata da Espino et al.8Si prega di fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7: Esempi di spettri MS/MS in tandem che si svolgono durante i controlli IC-FPOP. Spettri di ioni di prodotto (MS/MS) di un peptide non modificato (Ae di un'ossidazione (B)rilevata sul residuo M8 trovato su quel peptide. Un EIC rappresentativo del peptide non modificato (C) e del peptide (D) modificato. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8: IC-FPOP è efficace nel sondare l'accessibilità del solvente delle proteine. (A) Estensione della modifica per i 9 peptidi ossidativi da actin. I valori vengono visualizzati come medie più e meno deviazione standard (n - 3). (B) Modifica dei peptidi actinosi ossidati in vitro dalla radiolisi del sincrotrone da Guan et al.10 (C) Correlazione delle modifiche FPOP dei residui con SASA nei triangoli stretti (triangoli, linea di tendenza tratteggiata) e aperti (cerchi, linea di tendenza solida) stati di actina. Questa cifra è stata modificata da Espino et al.8Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Diverse tecniche basate sulla spettrometria di massa sono state sviluppate per studiare la struttura delle proteine e i complessi proteina-ligando in modo diffuso su proteoma in cellule intere o lismi cellulari. Queste tecniche includono, a dire, non si limitano alla stabilità delle proteine derivanti dal tasso di ossidazione (SPROX), alla profilazione termica del proteoma (TPP), al collegamento chimico incrociato (XL-MS) e all'impronta delle proteine radicali degli idrossili (HRPF). Ogni tecnica ha limitazioni e vantaggi unici l'uno rispetto all'altro, che sono stati ampiamente rivisti12. Ognuno di questi metodi è stato utilizzato per la biologia strutturale larga proteoma per chiarire la struttura delle proteine e, in ultima analisi, funzionare all'interno del complesso ambiente cellulare. IC-FPOP è una tecnica HRPF che utilizza i radicali idrossili per modificare ossidativamente catene laterali esposte solventi di aminoacidi, sondando la struttura delle proteine e proteine-ligand oleosse all'interno di cellule vitali13. IC-FPOP è un miglioramento all'HRPF iniziale nelle cellule vive che hanno utilizzato la chimica del Fenton per generare radicali sulla scala cronologica dei minuti14. In questo studio, i cambiamenti strutturali in una proteina membrana integrale in risposta all'abbassamento del pH o della forza ionica del buffer sono stati caratterizzati con successo con una buona copertura di ossidazione in tutta la proteina. Rispetto alla chimica del Fenton, l'IC-FPOP è molto più veloce, modificando le proteine sulla scala temporale di microsecondi, consentendo così di studiare la conformazione delle proteine native.
Un test chiave per IC-FPOP è quello di confermare la vitalità delle cellule dopo l'esposizione a H2O2. Utilizzando una linea di miscelazione di 40 cm, le cellule vengono incubate in H2O2 per circa 3 s prima dell'irradiazione. Questo tempo può essere regolato cambiando la lunghezza di questo tubo di silice. È interessante notare che, sebbene l'uso di trypan blue per testare la vitalità cellulare dimostri che l'integrità delle cellule è sostenuta dopo l'incubazione di H2O2, le cellule potrebbero essere potenzialmente sotto stress effettuando percorsi di segnalazione che interagiscono con H2O2. Fortunatamente, il breve tempo di incubazione è più veloce della sintesi proteica fornendo fiducia le proteine presenti non sono indotte da H2O2.
Il passo successivo importante è quello di confermare il corretto assemblaggio del sistema di flusso. Una volta assemblato, assicurarsi che non siano presenti perdite dopo aver svuotato il sistema con il buffer desiderato. Se sono presenti perdite, assicurarsi che il tubo di silice è stato tagliato correttamente e viene a filo contro il ferrule per fare una corretta guarnizione una volta stretto verso il basso. Tutte le parti sono serrate a mano, quindi non sono necessari utensili. Durante ogni esperimento IC-FPOP, assicurarsi che gli agitatori magnetici nella siringa cellulare rimangano in movimento. Questa piccola agitazione limita il numero di cellule che si depositano nella parte inferiore della siringa, ma non è abbastanza dura per shearlare le cellule. Dopo una corsa, nella siringa rimane circa 50 gradi di cellule. Assicurati sempre di diluire questo con un passo di risciacquo per limitare il numero di cellule che portano all'esperimento successivo. Si consiglia di utilizzare una siringa a cellule fresche se vengono confrontati più trattamenti cellulari. È inoltre importante selezionare un buffer appropriato per le celle sottoposte a test. Alcuni tamponi placano il radicale idrossile portando a meno modifiche sulle proteine. Xu et al. hanno dimostrato che alcuni buffer comunemente utilizzati diminuiscono la vita radicale idrossile11. DPBS e HBSS sono buffer comuni utilizzati per gli esperimenti IC-FPOP.
Dopo IC-FPOP, ottimizzare il protocollo di digestione in base ai parametri necessari. Poiché l'FPOP produce modifiche covalenti irreversibili, c'è molto tempo a disposizione per una digestione e pulizia approfondita senza perdere la copertura di etichettatura. Testate sempre e normalizzare la concentrazione proteica in modo che concentrazioni di peptidi uniformi vengano caricate per la spettrometria di massa in tandem. Infine, tenere presente che un'immunoprecipitazioni non può essere eseguita in combinazione con IC-FPOP. Se una modifica FPOP è destinata all'area di interazione, l'affinità dell'anticorpo verrà abbassata. Per contribuire ad aumentare l'identificazione delle modifiche FPOP, i passaggi di separazione 2D-cromatografica hanno dimostrato di più che triplicare il numero di peptidi ossidati rilevati15.
Una sfida di qualsiasi esperimento FPOP è il complicato livello di analisi dei dati dovuto ai possibili prodotti di ossidazione che possono sorgere. Questo è vero sia per la cella o in vitro, ma è drasticamente aumentato con l'ulteriore complessità di analizzare le lisate cellulari. Con un'ulteriore ottimizzazione di Un numero maggiore di proteine IC-FPOP con coperture di modificazione più elevate, rendendo così rapidamente l'analisi più ardua. La quantità di taglio dei dati generati da un singolo esperimento IC-FPOP limita l'uso della convalida manuale, inducendo i ricercatori a fare più affidamento sul software. Per questo motivo, Rinas e altri hanno sviluppato una strategia di quantificazione per HRPF utilizzando Proteome Discoverer (PD)16. Questo metodo utilizza un flusso di lavoro di nodo multi-ricerca su PD combinato con una piattaforma quantitativa in un foglio di calcolo. Ulteriori miglioramenti sulla piattaforma IC-FPOP sono in corso per aumentare il numero di peptidi identificati con modifiche FPOP insieme a una maggiore riproducibilità e precisione di quantificazione.
Divulgazioni
Lisa Jones è un inventore sull'assemblaggio di flusso per le cellule brevetto (numero di pubblicazione: 201800799998).
Riconoscimenti
Questo lavoro è stato sostenuto dal NSF CAREER Award (MCB1701692) per LMJ.
Materiali
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-53A | any brand is sufficient |
| 5 mL Gas Tight Syringe, Removable Luer Lock | SGE Analytical Science | 008760 | |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | any brand is sufficient |
| 500 µL SGE Gastight Syringes: Fixed Luer-Lok Models | Fisher Scientific | SG-00723 | |
| Acetone, HPLC Grade | Fisher Scientific | A929-4 | 4 L quantity is not necessary |
| Acetonitrile with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | LS120-500 | |
| ACQUITY UPLC M-Class Symmetry C18 Trap Column, 100 Å, 5 µm, 180 µm x 20 mm, 2G, V/M, 1/pkg | Waters | 186007496 | |
| ACQUITY UPLC M-Class System | Waters | ACQUITY UPLC M-Class System | |
| Aluminum Foil | Fisher Scientific | 01-213-100 | any brand is sufficient |
| Aqua 5 µm C18 125 Å packing material | Phenomenex | 04A-4299 | |
| Centrifuge | Eppendorf | 022625501 | |
| Delicate Task Wipers | Fisher Scientific | 06-666A | |
| Dithiothreiotol (DTT) | AmericanBio | AB00490-00005 | |
| DMSO, Anhydrous | Invitrogen | D12345 | |
| EX350 excimer laser | GAM Laser | EX350 excimer laser | |
| FEP Tubing 1/16" OD x 0.020" ID | IDEX Health & Science | 1548L | |
| Formic Acid, LC/MS Grade | Fisher Scientific | A117-50 | |
| HV3-2 VALVE | Hamilton | 86728 | |
| Hydrogen Peroxide | Fisher Scientific | H325-100 | any 30% hydrogen peroxide is sufficient |
| Iodoacetamide (IAA) | ACROS Organics | 122270050 | |
| Legato 210 syringe pump | KD Scientific | 788212 | Any syringe pump that can hold 4, 5 mL syringes, withdraw and expel liquid, and have a way to stale the motor should work |
| Luer Adapter Female Luer to 1/4-28 Male Polypropylene | IDEX Health & Science | P-618L | |
| Methanol, LC/MS Grade | Fisher Scientific | A454SK-4 | 4 L quantity is not necessary |
| Microcentrifuge | Thermo Scientific | 75002436 | |
| N,N'-Dimethylthiourea (DMTU) | ACROS Organics | 116891000 | |
| NanoTight Sleeve Green 1/16" ID x .0155" ID x 1.6" | IDEX Health & Science | F-242X | |
| NanoTight Sleeve Yellow 1/16" OD x 0.027" ID x 1.6" | IDEX Health & Science | F-246 | |
| N-tert-Butyl-α-phenylnitrone (PBN) | ACROS Organics | 177350250 | |
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | Orbitrap Fusion Lumos Tribrid Mass Spectrometer | other high resolution instruments (e.g. Q exactive Orbitrap or Orbitrap Fusion) can be used |
| PE50-C pyroelectric energy meter | Ophir Optronics | 7Z02936 | |
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Scientific | 23275 | |
| Pierce Rapid Gold BCA Protein Assay Kit | Thermo Scientific | A53225 | |
| Pierce Trypsin Protease, MS Grade | Thermo Scientific | 90058 | |
| Pierce Universal Nuclease for Cell Lysis | Fisher Scientific | 88702 | |
| Polymicro Cleaving Stone, 1" x 1" x 1/32" | Molex | 1068680064 | any capillary tubing cutter is sufficient |
| Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 150 µm, Outer Diameter 360 µm, TSP150350 | Polymicro Technologies | 1068150024 | |
| Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 450 µm, Outer Diameter 670 µm, TSP450670 | Polymicro Technologies | 1068150025 | |
| Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 75 µm, Outer Diameter 360 µm, TSP075375 | Polymicro Technologies | 1068150019 | |
| Potassium Phosphate Monobasic | Fisher Scientific | P382-500 | |
| Proteome Discover 2.2 (bottom-up proteomics software) | Thermo Scientific | OPTON-30799 | |
| Rotary Magnetic Tumble Stirrer | V&P Scientific, Inc. | VP 710D3 | |
| Rotary Magnetic Tumble Stirrer, accessory kit for use with Syringe Pumps | V&P Scientific, Inc. | VP 710D3-4 | |
| Super Flangeless Ferrule w/SST Ring, Tefzel™ (ETFE), 1/4-28 Flat-Bottom, for 1/16" OD | IDEX Health & Science | P-259X | |
| Super Flangeless Nut PEEK 1/4-28 Flat-Bottom, for 1/16" & 1/32" OD | IDEX Health & Science | P-255X | |
| Super Tumble Stir Discs, 3.35 mm diameter, 0.61 mm thick | V&P Scientific, Inc. | VP 722F | |
| Thermo Scientific Pierce RIPA Buffer | Fisher Scientific | PI89900 | |
| Tris Base | Fisher Scientific | BP152-500 | |
| Upchurch Scientific Low-Pressure Crosses: PEEK | Fisher Scientific | 05-700-182 | |
| Upchurch Scientific Low-Pressure Tees: PEEK | Fisher Scientific | 05-700-178 | |
| UV Fused Silica Plano-Convex Spherical Lenses | THORLABS | LA4052 | |
| V&P Scientific IncSupplier Diversity Partner TUMBL STIR DISC PARYLENE 1000 | V&P Scientific, Inc. | VP724F | |
| VHP MicroTight Union for 360µm OD | IDEX Health & Science | UH-436 | |
| Water with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | LS118-500 | |
| Water, LC/MS Grade | Fisher Scientific | W6-4 |
Riferimenti
- Gau, B., Garai, K., Frieden, C., Gross, M. L. Mass spectrometry-based protein footprinting characterizes the structures of oligomeric apolipoprotein E2, E3, and E4. Biochemistry. 50 (38), 8117-8126 (2011).
- Li, Z., et al. High structural resolution hydroxyl radical protein footprinting reveals an extended Robo1-heparin binding interface. Journal of Biological Chemistry. 290 (17), 10729-10740 (2015).
- Zhang, H., Gau, B. C., Jones, L. M., Vidavsky, I., Gross, M. L. Fast photochemical oxidation of proteins for comparing structures of protein− ligand complexes: the calmodulin− peptide model system. Analytical Chemistry. 83 (1), 311-318 (2010).
- Jones, L. M., et al. Complementary MS methods assist conformational characterization of antibodies with altered S-S bonding networks. Journal of the American Society for Mass Spectrometry. 24 (6), 835-845 (2013).
- Kiselar, J. G., Janmey, P. A., Almo, S. C., Chance, M. R. Structural analysis of gelsolin using synchrotron protein footprinting. Molecular & Cellular Proteomic. 2 (10), 1120-1132 (2003).
- Vahidi, S., Stocks, B. B., Liaghati-Mobarhan, Y., Konermann, L. Mapping pH-induced protein structural changes under equilibrium conditions by pulsed oxidative labeling and mass spectrometry. Analytical Chemistry. 84 (21), 9124-9130 (2012).
- Hambly, D. M., Gross, M. L. Laser flash photolysis of hydrogen peroxide to oxidize protein solvent-accessible residues on the microsecond timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Espino, J. A., Mali, V. S., Jones, L. M. In cell footprinting coupled with mass spectrometry for the structural analysis of proteins in live cells. Analytical Chemistry. 87 (15), 7971-7978 (2015).
- Rinas, A., Mali, V. S., Espino, J. A., Jones, L. M. Development of a Microflow System for In-Cell Footprinting Coupled with Mass Spectrometry. Analytical Chemistry. 88 (20), 10052-10058 (2016).
- Guan, J. Q., Almo, S. C., Reisler, E., Chance, M. R. Structural Reorganization of Proteins Revealed by Radiolysis and Mass Spectrometry: G-Actin Solution Structure Is Divalent Cation Dependent. Biochemistry. 42 (41), 11992-12000 (2003).
- Xu, G., Chance, M. R. Hydroxyl radical-mediated modification of proteins as probes for structural proteomics. Chemical Reviews. 107 (8), 3514-3543 (2007).
- Kaur, U., et al. Proteome-Wide Structural Biology: An Emerging Field for the Structural Analysis of Proteins on the Proteomic Scale. Journal of Proteome Research. 17 (11), 3614-3627 (2018).
- Chea, E. E., Jones, L. M. Analyzing the structure of macromolecules in their native cellular environment using hydroxyl radical footprinting. Analyst. 143 (4), 798-807 (2018).
- Zhu, Y., et al. Elucidating in vivo structural dynamics in integral membrane protein by hydroxyl radical footprinting. Molecular & Cellular Proteomic. 8 (8), 1999-2010 (1999).
- Rinas, A., Jones, L. M. Fast photochemical oxidation of proteins coupled to multidimensional protein identification technology (MudPIT): expanding footprinting strategies to complex systems. Journal of the American Society for Mass Spectrometry. 26 (4), 540-546 (2015).
- Rinas, A., Espino, J. A., Jones, L. M. An efficient quantitation strategy for hydroxyl radical-mediated protein footprinting using Proteome Discoverer. Analytical and Bioanalytical Chemistry. 408 (11), 3021-3031 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon