A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس الوذمة الدماغية بعد السكتة الدماغية، منطقة إنفاركت وانهيار حاجز الدم والدماغ في مجموعة واحدة من عينات الدماغ القوارض
* These authors contributed equally
In This Article
Summary
يصف هذا البروتوكول تقنية جديدة لقياس أهم ثلاثة معلمات لإصابة الدماغ الإقفاري على نفس المجموعة من عينات دماغ القوارض. استخدام عينة واحدة فقط الدماغ مفيد للغاية من حيث التكاليف الأخلاقية والاقتصادية.
Abstract
واحد من الأسباب الأكثر شيوعا من الاعتلال والوفيات في جميع أنحاء العالم هو السكتة الدماغية. تاريخيا، نموذج حيواني يستخدم لتحفيز السكتة الدماغية ينطوي على انسداد الشريان الدماغي الأوسط (MCAO). يتم قياس منطقة الحفارة وذمة الدماغ وانهيار حاجز الدم في الدماغ (BBB) كمعلمات تعكس مدى إصابة الدماغ بعد MCAO. ومن القيود الهامة على هذه الطريقة أن هذه القياسات يتم الحصول عليها عادة في عينات مختلفة من مخ الفئران، مما يؤدي إلى أعباء أخلاقية ومالية بسبب العدد الكبير من الجرذان التي تحتاج إلى القتل الرحيم لحجم العينة المناسب. هنا نقدم طريقة لتقييم إصابات الدماغ بدقة بعد MCAO عن طريق قياس منطقة الفاركت ، وذمة الدماغ ونفاذية BBB في نفس المجموعة من أدمغة الفئران. هذه التقنية الجديدة يوفر وسيلة أكثر كفاءة لتقييم الفيزيولوجيا المرضية من السكتة الدماغية.
Introduction
أحد الأسباب الأكثر شيوعاً للمراضة والوفيات في جميع أنحاء العالم هو السكتة الدماغية. على الصعيد العالمي، يمثل السكتة الدماغية 68٪ من جميع حالات السكتة الدماغية، في حين أن السكتة الدماغية في الولايات المتحدة تمثل 87٪ من حالات السكتة الدماغية1،2. ويقدر أن العبء الاقتصادي للسكتة الدماغية يصل إلى 34 مليار دولار في الولايات المتحدة2 و 45 مليار يورو في الاتحاد الأوروبي3. النماذج الحيوانية من السكتة الدماغية ضرورية لدراسة الفيزيولوجيا المرضية، وتطوير أساليب جديدة للتقييم، واقتراح خيارات علاجية جديدة4.
السكتة الدماغية يحدث مع انسداد الشريان الدماغي الرئيسي، وعادة ما الشريان الدماغي الأوسط أو أحد فروعه5. وهكذا، قد شملت نماذج من السكتة الدماغية تاريخيا انسداد الشريان الدماغي الأوسط (MCAO)6،7،8،9،10،11،12. بعد MCAO، يتم تقييم الإصابة العصبية الأكثر شيوعًا عن طريق قياس منطقة الفاركت (IZ) باستخدام 2,3,5-ثلاثية الفينيل تيترازوليوم (TTC) طريقة تلطيخ13, وذمة الدماغ (BE) باستخدام تجفيف أو حساب وحدات التخزين نصف الكرة14،15،16، ونفاذية الدم في الدماغ (BBB) بواسطة تقنية القياس الطيفي باستخدام ايفانز الأزرق تلطيخ17،18،19.
تستخدم طريقة MCAO التقليدية مجموعات منفصلة من الأدمغة لكل من قياسات الدماغ الثلاثة. بالنسبة لحجم العينة الكبيرة ، يؤدي هذا إلى عدد كبير من الحيوانات الرحيمة ، مع اعتبارات أخلاقية ومالية إضافية. وهناك طريقة بديلة لتخفيف هذه التكاليف تتضمن قياسات للبارامترات الثلاثة في مجموعة واحدة من أدمغة القوارض بعد MCAO.
وقد بذلت محاولات سابقة لقياس مجموعات من المعلمات في نفس عينة الدماغ. في وقت واحد immunofluorescent أساليب تلوين20 فضلا عن غيرها من التحليلات الجزيئية والبيوكيميائية21 وقد وصفت بعد تلطيخ TTC في نفس عينة الدماغ. لدينا سابقا حسابات أحجام نصف الكرة الدماغ لتقييم وذمة الدماغ وأداء تلطيخ TTC لحساب منطقة في المزارع في نفس مجموعة الدماغ15.
في هذا البروتوكول، نقدم تقنية MCAO المعدلة التي تقيس إصابة الدماغ الإقفارية من خلال تحديد النفاذية IZ و BE و BBB في نفس المجموعة من أدمغة القوارض. يتم قياس IZ بواسطة تلطيخ TTC ، يتم تحديد BE عن طريق حساب حجم نصف الكرة ، ويتم الحصول على نفاذية BBB بواسطة أساليب القياس الطيفي19. في هذا البروتوكول، استخدمنا نموذج MCAO المعدلة، استنادا إلى الإدراج المباشر والثابة من القسطرة أحادية في الشريان السباتي الداخلي (ICA) ومزيد من سد تدفق الدم إلى الشريان الدماغي الأوسط (MCA)22. هذه الطريقة المعدلة تظهر انخفاض معدل الوفيات والاعتلال مقارنة مع الطريقة التقليدية MCAO16،22.
يوفر هذا النهج الجديد نموذجًا أخلاقيًا وسليمًا ماليًا لقياس الإصابات العصبية بعد MCAO. هذا التقييم للبارامترات الرئيسية للإصابة الدماغية الإقفارية سيساعد على التحقيق الشامل في الفيزيولوجيا المرضية.
Protocol
10- وقد أجريت الإجراءات التالية وفقاً لتوصيات إعلان هلسنكي وطوكيو والمبادئ التوجيهية للجماعة الأوروبية بشأن استخدام الحيوانات التجريبية. كما وافقت لجنة رعاية الحيوان في جامعة بن غوريون في النقب على هذه التجارب.
1. إعداد الفئران لإجراء تجريبي
- حدد فئران Sprague-Dawley الذكور البالغين دون علم الأمراض البين، كل وزن يتراوح بين 300 و 350 غرام.
- الحفاظ على جميع الفئران في درجة حرارة الغرفة عند 22 درجة مئوية، مع 12 ساعة من دورات الضوء والظلام قبل التجربة.
- تأكد من توفر الطعام والماء على إعلان libitum.
- تنفيذ كافة الإجراءات بين 6:00 a.m. و 2:00 p.m.
2. إعداد الفئران للجراحة
- تخدير الفئران لمدة 30 دقيقة مع isoflurane (4٪ لالحثياط و 2٪ للصيانة) و 24٪ الأكسجين (1.5 لتر / دقيقة).
- اختبار مستوى التخدير في الفئران عن طريق التأكد من أنها لم يكن لديك رد فعل سحب دواسة.
- أدخل القسطرة 24 قياس في الوريد الذيل.
ملاحظة: لا يتم تنفيذ ارتفاع درجة حرارة الذيل من أجل توسع الأوعية.- ضع الفئران على الطاولة في موضع غيري. استخدم الشريط الطبي للصق أطراف الجرذان الأربعة.
- ضع المسبار لقياس درجة الحرارة في المستقيم الفئران قبل الجراحة.
- خلال هذا الإجراء، والحفاظ على لوحة التدفئة لدعم درجة حرارة الجسم الأساسية 37 درجة مئوية.
- إضافة مرهم في كل من عيون الفئران للحماية.
- حلق المنطقة الجراحية وتطهيرها مع ثلاثة تطبيقات من 10٪ povidone-اليود تليها 70٪ الكحول ايزوبروبيل.
3. الجانب الأيمن من منتصف انسداد الشريان الدماغي
ملاحظة: يتم تنفيذ MCAO بواسطة تقنية معدلة، كما سبق وصفها16و22و23، باستخدام الأدوات التي وصفها McGarry وآخرون24 و Uluç وآخرون25.
- تشريح الجلد والواجهة السطحية في خط الوسط البطني من الرقبة مع ملاقط الجراحية ومقص مع شفرات منحنية.
- تحديد مثلث العضلات, تتكون من ICA, الشريان السباتي الخارجي (ECA) وشريان السباتي المشترك (CCA).
- قم بفصل CCA وICA الأيمنين بعناية عن العصب المبهم مع ميكروفورس لجراحة الأوعية الدموية.
- فضح CCA الصحيح وICA. منع تدفق الدم القادمة من CCA إلى ICA باستخدام إما مقاطع صغيرة أو tourniquets الخاصة لجراحة الأوعية الدموية. إجراء شق (حوالي 1 مم) على ICA باستخدام microscissors لجراحة الأوعية الدموية.
- إدراج قسطرة أحادية الألياف (4-0 النايلون) مباشرة من خلال ICA، حوالي 18.5-19 ملم من نقطة التشعب من CCA الحق في دائرة ويليس حتى الوصول إلى مقاومة خفيفة، لocclude MCA26.
- Ligate حول ICA فوق تشعب CCA.
- لمجموعة التحكم التي تعمل بشكل صوري، قم بإجراء إدخال من خيط النايلون بدلاً من الخطوات 3.5 و 3.616,22.
- إدارة 5 مل من 0.9٪ كلوريد الصوديوم عن طريق الحقن داخل الصفتون.
- إغلاق الجرح عن طريق خياطة واتخاذ الفئران إلى منطقة الانتعاش.
ملاحظة: بعد بضع دقائق من نهاية التخدير، سوف يستيقظ الجرذ ويتحرك بشكل مستقل حول القفص. - في 23 ح بعد MCAO، حقن 2٪ ايفانز الأزرق في المالحة (4 مل / كجم)23،26 في الوريد الذيل لكلا المجموعات التي تعمل عن طريق قنية27.
ملاحظة: يستخدم هذا كمتتبع نفاذية في الدماغ. السماح لتعميم لمدة 60 دقيقة.
4. تحديد المنطقة الزراعية
- قياس IZ في 24 ساعة بعد MCAO كما هو موضح سابقا9،15،18،19،26.
ملاحظة: يتم استبعاد الفئران التي فقدت أكثر من 20٪ من وزنها أو المضبوطات أو النوبات المهرج من التجربة. - القتل الرحيم الفئران عن طريق استبدال خليط الغاز مستوحاة مع 20٪ الأكسجين و 80٪ ثاني أكسيد الكربون حتى يتوقف الجرذ عن التنفس تلقائيا.
- افتح الصدر بشق جانبي 5-6 سم من خلال جدار البطن تحت القفص الصدري باستخدام المقص والملقط الجراحي.
- إجراء شق الحجاب الحاجز على طول طول القفص الصدري مع مقص ملقط الجراحية.
- بعناية تشريد الرئتين، وقطع من خلال القفص الصدري حتى الترقوة على الجانبين الأيمن والأيسر28.
- Perfuse مع 200 مل من المالحة العادية من خلال البطين الأيسر للقلب.
- ثقب أو اثقب الأذين الأيمن من القلب مع مقص.
- قم بإجراء قطع الرأس باستخدام المقصلة وجمع أنسجة الدماغ.
- باستخدام مقص القزحية، وقطع من ماغنوم ماغنوم forsals إلى الحافة البعيدة من سطح الجمجمة الخلفي على كلا الجانبين.
- فصل المصابيح الشمية، والاتصالات العصبية على طول السطح البطني وسطح الظهر الجمجمة من الدماغ.
- إزالة الدماغ من الرأس.
- إنتاج 6 شرائح الدماغ عن طريق خلق 2 مم المقاطع الأفقية سميكة مع الفولاذ المقاوم للصدأ .009 "، uncoated، شفرة حلاقة حافة واحدة.
- احتضان لمدة 30 دقيقة في 37 درجة مئوية في 0.05٪ TTC.
- وضع أنسجة الدماغ على الشرائح المجهر وإجراء المسح الضوئي لهذه الشرائح الدماغ 6 مع قرار من 1600x1600 نقطة في البوصة (انظر الملحق 1 على سبيل المثال).
- إضافة مرشح أزرق مع محرر الصور (على سبيل المثال، أدوبي فوتوشوب CS2) باستخدام وظيفة خلاط القناة(صورة > التعديلات > خلاط قناة)وحفظ الصورة بتنسيق ملف JPEG.
ملاحظة: بعد تطبيق مرشح أزرق، ستظهر الصورة تدرج الرمادي. - فتح الصورة المحفوظة في ImageJ 1.37v29،30.
ملاحظة: يستخدم هذا البرنامج دالة عتبة لعزل وحساب وحدات البكسل التي هي إما سوداء أو بيضاء (راجع الشكل 1). - لكل شريحة من شرائح الدماغ 6 من الصورة، حدد وحفظ كل نصف الكرة الأرضية (الحق في ipsilateral وترك contralateral غير مصاب) كملف صورة منفصلة باستخدام أداة "اختيار المضلع" من القائمة الرئيسية.
- تعيين القطع لتحديد IZ باستخدام وظيفة عتبة السيارات من القائمة الرئيسية لبرنامج ImageJ عن طريق تحديد ImageJ عن طريق تحديد Image > ضبط > Threshold، وقياس عدد وحدات البكسل في كل نصف الكرة الأرضية لمجموعة واحدة من الدماغ.
ملاحظة: قد يتم استخدام وحدات الماكرو لهذه الخطوة في برنامج ImageJ (راجع الملحق 2 للتعليمات البرمجية). قطع هو معلمة حاسمة لتحديد أي بكسل لتحويل إلى الأبيض والتي لتحويل إلى الأسود اعتمادا على الظل الرمادي (انظر الملحق 3 والملحق 4 كأمثلة). ImageJ ثم يقارن بكسل أبيض وأسود لتحديد IZ. استنادًا إلى بروتوكول تلوين وإعدادات الماسح الضوئي ، استخدمنا قيمة قطع ثابتة قدرها 0.220. - إجراء قياس IZ تصحيح لتورم الأنسجة باستخدام نسب من Ipsilateral و Contralateral نصفات الكرة الدماغية (RICH) طريقة13،23 (انظر المثال في الملحق 5).
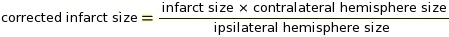
ملاحظة: يتم تقييم حجم infarct كنسبة مئوية من نصف الكرة الأرضية المقابلة.
5. تحديد وذمة الدماغ31
ملاحظة: استخدام ImageJ 1.37v لقياس BE32،33.
- قياس يكون 24 ساعة بعد MCAO. لحساب BE، استخدم البيانات من حجم نصف الكرة الأرضية الأيمن والأيسر (بوحدات).
- إجراء المسح الضوئي بدقة 1600x1600 نقطة في البوصة (انظر الملحق 1 على سبيل المثال).
- حدد نصفي الدماغ وتعيين قطع لتحديد BE مع ImageJ 1.37v، كما هو موضح أعلاه في الأقسام 4.17-4.19.
- التعبير عن منطقة BE كنسبة مئوية من المناطق القياسية لنصف الكرة الأرضية المقابلة غير المتأثرة، محسوبة بطريقة RICH باستخدام المعادلة التالية (انظر المثال في الملحق 5)23،34.

ملاحظة: يتم تقييم مدى BE كنسبة مئوية من نصف الكرة الأرضية المقابل.
6. تحديد تعطيل BBB
- إجراء اضطراب BBB 24 ساعة بعد MCAO.
- تقسيم نصفي الكرة الأرضية اليمين واليسار إلى ست شرائح ووضع كل واحد في أنبوب microcentrifuge.
- التجانس كل شريحة من أنسجة المخ في حمض ثلاثي الكلور أوسيتيك، استنادا إلى حساب 1 غرام من أنسجة المخ في 4 مل من حمض ثلاثي الكلور أوسيتيك 50٪.
- جهاز طرد مركزي في 10،000 س ز لمدة 20 دقيقة.
- تخفيف السائل افرا 1:3 مع 96٪ الإيثانول.
- أداء قياس الطيف الضوئي التلألؤ من خلال الاستفادة من برنامج القياس الطيفي، وتركيب لوحة، وأداء قراءة عينة باستخدام المعلمات التالية: التألق التألق كثافة الفلوريسين الطول الموجي من 620 نانومتر (عرض النطاق الترددي 10 نانومتر) والطول الموجي للانبعاثات من 680 نانومتر (عرض النطاق الترددي 10 نانومتر)23،35 ؛ وزارة الدفاع أعلى؛ عدد اللحم 25؛ دليل 100؛ تهتز 1 ثانية، 1 ملم.
ملاحظة: استخدم طول موجي مثير 620 نانومتر (عرض النطاق الترددي 10 نانومتر) و طول موجة من الانبعاثات 680 نانومتر (عرض النطاق الترددي 10 نانومتر). 23,35
النتائج
قياس منطقة infarct
وأشار اختبار T عينة مستقلة أن 19 الفئران التي خضعت MCAO دائمة أظهرت زيادة كبيرة في حجم المزارع في الدماغ مقارنة مع الفئران 16 التي تعمل بالتشكيل (MCAO = 7.49٪ ± 3.57 مقابل. الشام = 0.31٪ ± 1.9، ر(28.49) = 7.56، p < 0.01 (انظر الشكل 2A)). ويعبر عن البيانات...
Discussion
وكان الهدف الرئيسي لهذا البروتوكول هو إظهار قياسات متسقة لثلاثة بارامترات رئيسية للإصابة باقفزي: IZ، و BE، و BBB النفاذية. وقد أظهرت الدراسات السابقة في هذا المجال إمكانية تنفيذ واحد أو اثنين من هذه المعلمات معا في نفس العينة. وإلى جانب تخفيض التكلفة الذي توفره هذه الطريقة من ثلاثة أجزاء، فإن...
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
نشكر كل من ماريانا كوشيريافا، ماكسيم كريفونوسوف، دارينا ياكومينكو، ويفجينيا جونتشاريك من قسم علم وظائف الأعضاء، كلية علم الأحياء، علم البيئة والطب، أوليز هونشار، جامعة دنيبرو، دنيبرو، أوكرانيا على دعمهم ومساهماتهم المفيدة في مناقشاتنا. البيانات التي تم الحصول عليها هي جزء من أطروحة الدكتوراه التي كتبها رسلان كوتس.
Materials
| Name | Company | Catalog Number | Comments |
| 2 mL Syringe | Braun | 4606027V | |
| 2% chlorhexidine in 70% alcohol solution | Sigma-Aldrich | 500 cc | Provides general antisepsis of the skin in the operatory field |
| 27 G Needle with Syringe | Braun | 305620 | |
| 3-0 Silk sutures | Henry Schein | 1007842 | |
| 4-0 Nylon suture | 4-00 | ||
| Brain & Tissue Matrices | Sigma-Aldrich | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 183603985447 | |
| Centrifuge Sigma 2-16P | Sigma-Aldrich | Sigma 2-16P | |
| Compact Analytical Balances | Sigma-Aldrich | HR-AZ/HR-A | |
| Digital weighing scale | Sigma-Aldrich | Rs 4,000 | |
| Dissecting scissors | Sigma-Aldrich | Z265969 | |
| Eppendorf pipette | Sigma-Aldrich | Z683884 | |
| Eppendorf tube | Sigma-Aldrich | EP0030119460 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | Model: Infinite 200 PRO multimode reader | Optional. |
| Fluorescence detector | Molecular Devices LLC | VWR cat. # 10822 512 SpectraMax Paradigm Multi Mode Microplate Reader Base Instrument | Optional. |
| Gauze sponges | Fisher | 22-362-178 | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Hemostatic microclips | Sigma-Aldrich | ||
| Horizon-XL | Mennen Medical Ltd | ||
| Infusion cuff | ABN | IC-500 | |
| Micro forceps | Sigma-Aldrich | ||
| Micro scissors | Sigma-Aldrich | ||
| Multiset | Teva Medical | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Operating forceps | Sigma-Aldrich | ||
| Operating scissors | Sigma-Aldrich | ||
| Optical scanner | Canon | Cano Scan 4200F | Resolution 3200 x 6400 dpi |
| Petri dishes | Sigma-Aldrich | P5606 | |
| Purina Chow | Purina | 5001 | Rodent laboratory chow given to rats, mice and hamster is a life-cycle nutrition that has been used in biomedical research for over 5 decades. Provided to rats ad libitum in this experiment. |
| Rat cages | Techniplast | 2000P | Conventional housing for rodents. Cages were used for housing rats throughout the experiment |
| Scalpel blades #11 | Sigma-Aldrich | S2771 | |
| Software | |||
| Adobe Photoshop CS2 for Windows | Adobe | ||
| ImageJ 1.37v | NIH | The source code is freely available. The author, Wayne Rasband (wayne@codon.nih.gov), is at the Research Services Branch, National Institute of Mental Health, Bethesda, Maryland, USA | |
| SPSS Statistics 22 | IBM | ||
| Office 365 ProPlus | Microsoft | - | Microsoft Office Excel |
| Windows 10 | Microsoft | ||
| Reagents | |||
| 2,3,5-Triphenyltetrazolium chloride | Sigma-Aldrich | 298-96-4 | |
| 50% trichloroacetic acid | Sigma-Aldrich | 76-03-9 | |
| Ethanol 96 % | Romical | Flammable liquid | |
| Evans blue 2% | Sigma-Aldrich | 314-13-6 | |
| Isoflurane, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 |
References
- Krishnamurthi, R. V., et al. Global and regional burden of first-ever ischaemic and haemorrhagic stroke during 1990-2010: findings from the Global Burden of Disease Study 2010. Lancet Global Health. 1, 259-281 (2013).
- Benjamin, E. J., et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 135, 146 (2017).
- Wilkins, E., et al. . European cardiovascular disease statistics 2017. , (2017).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Lloyd-Jones, D., et al. Heart disease and stroke statistics--2009 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation. 119, 480-486 (2009).
- Shigeno, T., McCulloch, J., Graham, D. I., Mendelow, A. D., Teasdale, G. M. Pure cortical ischemia versus striatal ischemia. Circulatory, metabolic, and neuropathologic consequences. Surgical Neurology. 24, 47-51 (1985).
- Albanese, V., Tommasino, C., Spadaro, A., Tomasello, F. A transbasisphenoidal approach for selective occlusion of the middle cerebral artery in rats. Experientia. 36, 1302-1304 (1980).
- Hudgins, W. R., Garcia, J. H. Transorbital approach to the middle cerebral artery of the squirrel monkey: a technique for experimental cerebral infarction applicable to ultrastructural studies. Stroke. 1, 107-111 (1970).
- Waltz, A. G., Sundt, T. M., Owen, C. A. Effect of middle cerebral artery occlusion on cortical blood flow in animals. Neurology. 16, 1185-1190 (1966).
- Tamura, A., Graham, D. I., McCulloch, J., Teasdale, G. M. Focal cerebral ischaemia in the rat: 1. Description of technique and early neuropathological consequences following middle cerebral artery occlusion. Journal of Cerebral Blood Flow & Metabolism. 1, 53-60 (1981).
- Aspey, B. S., Cohen, S., Patel, Y., Terruli, M., Harrison, M. J. Middle cerebral artery occlusion in the rat: consistent protocol for a model of stroke. Neuropathology and Applied Neurobiology. 24, 487-497 (1998).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20, 84-91 (1989).
- O'Brien, M. D., Jordan, M. M., Waltz, A. G. Ischemic cerebral edema and the blood-brain barrier. Distributions of pertechnetate, albumin, sodium, and antipyrine in brains of cats after occlusion of the middle cerebral artery. Archives of Neurology. 30, 461-465 (1974).
- Chen, C. H., Toung, T. J., Sapirstein, A., Bhardwaj, A. Effect of duration of osmotherapy on blood-brain barrier disruption and regional cerebral edema after experimental stroke. Journal of Cerebral Blood Flow & Metabolism. 26, 951-958 (2006).
- Boyko, M., et al. Establishment of Novel Technical Methods for Evaluating Brain Edema and Lesion Volume in Stroked Rats: a Standardization of Measurement Procedures. Brain Research. , (2019).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Sifat, A. E., Vaidya, B., Abbruscato, T. J. Blood-Brain Barrier Protection as a Therapeutic Strategy for Acute Ischemic Stroke. AAPS Journal. 19, 957-972 (2017).
- Jiang, X., et al. Blood-brain barrier dysfunction and recovery after ischemic stroke. Progress in Neurobiology. 163-164, 144-171 (2018).
- Belayev, L., Busto, R., Zhao, W., Ginsberg, M. D. Quantitative evaluation of blood-brain barrier permeability following middle cerebral artery occlusion in rats. Brain Research. 739, 88-96 (1996).
- Li, L., Yu, Q., Liang, W. Use of 2,3,5-triphenyltetrazolium chloride-stained brain tissues for immunofluorescence analyses after focal cerebral ischemia in rats. Pathology - Research and Practice. 214, 174-179 (2018).
- Kramer, M., et al. TTC staining of damaged brain areas after MCA occlusion in the rat does not constrict quantitative gene and protein analyses. Journal of Neuroscience Methods. 187, 84-89 (2010).
- Kuts, R., et al. A middle cerebral artery occlusion technique for inducing post-stroke depression in rats. Journal of Visualized Experiments. , e58875 (2019).
- Kuts, R., et al. A Novel Method for Assessing Cerebral Edema, Infarcted Zone and Blood-Brain Barrier Breakdown in a Single Post-stroke Rodent Brain. Frontiers in Neuroscience. 13, 1105 (2019).
- McGarry, B. L., Jokivarsi, K. T., Knight, M. J., Grohn, O. H. J., Kauppinen, R. A. A Magnetic Resonance Imaging Protocol for Stroke Onset Time Estimation in Permanent Cerebral Ischemia. Journal of Visualized Experiments. , e55277 (2017).
- Uluc, K., Miranpuri, A., Kujoth, G. C., Akture, E., Baskaya, M. K. Focal cerebral ischemia model by endovascular suture occlusion of the middle cerebral artery in the rat. Journal of Visualized Experiments. , e1978 (2011).
- Boyko, M., et al. The effect of blood glutamate scavengers oxaloacetate and pyruvate on neurological outcome in a rat model of subarachnoid hemorrhage. Neurotherapeutics. 9, 649-657 (2012).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. , e58875 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. , e3564 (2012).
- Poinsatte, K., et al. Quantification of neurovascular protection following repetitive hypoxic preconditioning and transient middle cerebral artery occlusion in mice. Journal of Visualized Experiments. , e52675 (2015).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (2018)
- Boyko, M., et al. Pyruvate's blood glutamate scavenging activity contributes to the spectrum of its neuroprotective mechanisms in a rat model of stroke. European Journal of Neuroscience. 34, 1432-1441 (2011).
- Collins, T. J. ImageJ for microscopy. Biotechniques. 43, 25-30 (2007).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (1997)
- Kaplan, B., et al. Temporal thresholds for neocortical infarction in rats subjected to reversible focal cerebral ischemia. Stroke. 22, 1032-1039 (1991).
- Kumai, Y., et al. Postischemic gene transfer of soluble Flt-1 protects against brain ischemia with marked attenuation of blood-brain barrier permeability. Journal of Cerebral Blood Flow & Metabolism. 27, 1152-1160 (2007).
- Schuleri, K. H., et al. Characterization of peri-infarct zone heterogeneity by contrast-enhanced multidetector computed tomography: a comparison with magnetic resonance imaging. Journal of the American College of Cardiology. 53, 1699-1707 (2009).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative Stress: A Key Modulator in Neurodegenerative Diseases. Molecules. 24, (2019).
- Di Napoli, M. Caplan's Stroke: A Clinical Approach. Journal of the American Medical Association. 302, 2600-2601 (2009).
- Deb, P., Sharma, S., Hassan, K. M. Pathophysiologic mechanisms of acute ischemic stroke: An overview with emphasis on therapeutic significance beyond thrombolysis. Pathophysiology. 17, 197-218 (2010).
- Simard, J. M., Kent, T. A., Chen, M., Tarasov, K. V., Gerzanich, V. Brain oedema in focal ischaemia: molecular pathophysiology and theoretical implications. Lancet Neurology. 6, 258-268 (2007).
- Klatzo, I. Pathophysiological aspects of brain edema. Acta Neuropathology. 72, 236-239 (1987).
- Yang, Y., Rosenberg, G. A. Blood-brain barrier breakdown in acute and chronic cerebrovascular disease. Stroke. 42, 3323-3328 (2011).
- Lin, T. N., He, Y. Y., Wu, G., Khan, M., Hsu, C. Y. Effect of brain edema on infarct volume in a focal cerebral ischemia model in rats. Stroke. 24, 117-121 (1993).
- Liu, C., et al. Increased blood-brain barrier permeability in contralateral hemisphere predicts worse outcome in acute ischemic stroke after reperfusion therapy. Journal of NeuroInterventional Surgery. 10, 937-941 (2018).
- Boyko, M., et al. Establishment of novel technical methods for evaluating brain edema and lesion volume in stroked rats: A standardization of measurement procedures. Brain Research. 1718, 12-21 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved