È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurazione dell'edema cerebrale post-ictus, della zona infarct e della rottura della barriera ematica-encefalica in un singolo set di campioni cerebrali dei roditori
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive una nuova tecnica di misurazione dei tre parametri più importanti della lesione cerebrale ischemica sullo stesso set di campioni cerebrali di roditori. L'uso di un solo campione cerebrale è altamente vantaggioso in termini di costi etici ed economici.
Abstract
Una delle cause più comuni di morbilità e mortalità in tutto il mondo è l'ictus ischemico. Storicamente, un modello animale utilizzato per stimolare l'ictus ischemico coinvolge l'occlusione dell'arteria cerebrale media (MCAO). Zona infarct, edema cerebrale e rottura della barriera ematico-encefalica (BBB) sono misurati come parametri che riflettono l'entità della lesione cerebrale dopo MCAO. Una limitazione significativa a questo metodo è che queste misurazioni sono normalmente ottenute in diversi campioni di cervello di ratto, portando a oneri etici e finanziari dovuti al gran numero di ratti che devono essere eutanasiati per una dimensione del campione appropriata. Qui presentiamo un metodo per valutare con precisione le lesioni cerebrali dopo MCAO misurando la zona infarct, l'edema cerebrale e la permeabilità BBB nello stesso set di cervelli di ratto. Questa nuova tecnica fornisce un modo più efficiente per valutare la fisiopatologia dell'ictus.
Introduzione
Una delle cause più comuni di morbilità e mortalità in tutto il mondo è l'ictus. A livello globale, l'ictus ischemico rappresenta il 68% di tutti i casi di ictus, mentre negli Stati Uniti l'ictus ischemico rappresenta l'87% dei casidi ictus 1,2. Si stima che l'onere economico dell'ictus raggiunga i 34 miliardi di dollari negli StatiUniti 2 e 45 miliardi di euro nell'Unione europea3. I modelli animali di ictus sono necessari per studiarne la fisiopatologia, sviluppare nuovi metodi di valutazione e proporre nuove opzioni terapeutiche4.
L'ictus ischemico si verifica con occlusione di una grande arteria cerebrale, di solito l'arteria cerebrale centrale o uno dei suoi rami5. Così, i modelli di ictus ischemico hanno storicamente coinvolto l'occlusione dell'arteria cerebrale media (MCAO)6,7,8,9,10,11,12. Dopo MCAO, lesione neurologica è più comunemente valutata misurando la zona infar bene (IZ) utilizzando un metodo di colorazione 2,3,5-tripfeniltetrazolo (TTC)13, edema cerebrale (BE) utilizzando essiccazione o calcolo dei volumi emisferici14,15,16e permeabilità alla barriera epatica (BBB) con una tecnica di spettrometria che utilizza la colorazione blu Evans17,18,19.
Il tradizionale metodo MCAO utilizza insiemi separati di cervelli per ciascuna delle tre misurazioni cerebrali. Per un campione di grandi dimensioni, ciò si traduce in un numero significativo di animali eutanasiati, con considerazioni etiche e finanziarie aggiuntive. Un metodo alternativo per alleviare questi costi comporterebbe misurazioni di tutti e tre i parametri in un unico insieme di cervelli di roditori post-MCAO.
Precedenti tentativi sono stati fatti per misurare combinazioni di parametri nello stesso campione cerebrale. Metodi simultanei di colorazione immunofluorescente20 e altre analisi molecolari ebiochimiche 21 sono stati descritti dopo la colorazione TTC nello stesso campione cerebrale. In precedenza abbiamo calcolato i volumi dell'emisfero cerebrale per valutare l'edema cerebrale ed eseguito la colorazione TTC per calcolare la zona infarct nello stesso set cerebrale15.
Nel presente protocollo, presentiamo una tecnica MCAO modificata che misura le lesioni cerebrali ischemiche attraverso la determinazione della permeabilità IZ, BE e BBB nello stesso set di cervelli di roditori. IZ è misurato dalla colorazione TTC, BE è determinato calcolando il volume emisferico e la permeabilità BBB è ottenuta con metodi di spettrometria19. In questo protocollo, abbiamo utilizzato un modello MCAO modificato, basato sull'inserimento diretto e la fissazione del catetere monofilamento nell'arteria carotide interna (ICA) e sull'ulteriore blocco del flusso sanguigno verso l'arteria cerebrale media (MCA)22. Questo metodo modificato mostra una diminuzione del tasso di mortalità e morbilità rispetto al metodo tradizionale MCAO16,22.
Questo nuovo approccio fornisce un modello finanziario ed etico per misurare le lesioni neurologiche dopo l'MCAO. Questa valutazione dei principali parametri della lesione cerebrale ischemica aiuterà a indagare in modo completo la sua fisiopatologia.
Protocollo
Secondo le raccomandazioni della dichiarazione di Helsinki e di Tokyo e degli orientamenti per l'impiego di animali da esperimento della Comunità europea, sono state condotte le seguenti procedure. Gli esperimenti sono stati approvati anche dal Comitato per la cura degli animali dell'Università Ben-Gurion del Negev.
1. Preparazione dei ratti alla procedura sperimentale
- Selezionare ratti maschi adulti Sprague-Dawley senza patologia troppo grave, ognuno del peso compreso tra 300 e 350 g.
- Mantenere tutti i ratti a temperatura ambiente a 22 °C, con 12 ore di cicli di luce e buio prima dell'esperimento.
- Assicurarsi che cibo e acqua siano disponibili ad libitum.
- Eseguire tutte le procedure tra le 6:00 .m e le 14:00.m.
2. Preparare i ratti per l'intervento chirurgico
- Anestetizzare i ratti per 30 min con isoflurane (4% per l'induzione e 2% per la manutenzione) e 24% ossigeno (1,5 L/min).
- Testare il livello di anestesia nei ratti assicurandosi che non abbiano un riflesso di prelievo del pedale.
- Inserire il catetere calibro 24 nella vena di coda.
NOTA: Il riscaldamento della coda per la vasodilatazione non viene eseguito.- Posizionare i ratti sul tavolo in posizione supina. Usa il nastro medico per apporre tutti e quattro gli arti dei topi.
- Posizionare la sonda per la misurazione della temperatura nel retto del ratto prima dell'intervento chirurgico.
- Durante la procedura, mantenere una piastra di riscaldamento per sostenere una temperatura corporea interna di 37 °C.
- Aggiungere un unguento in entrambi gli occhi del topo per la protezione.
- Radere l'area chirurgica e disinfettare con tre applicazioni del 10% di povidone-iodio seguito dal 70% di alcol isopropile.
3. Occlusione dell'arteria cerebrale centrale laterale destra
NOTA: MCAO è eseguito con una tecnica modificata, comeprecedentemente descritto 16,22,23, con l'uso di strumenti descritti da McGarry etal.
- Sezionare la pelle e la fascia superficiale alla linea mediana ventrale del collo con pinzette chirurgiche e forbici con lame curve.
- Identificare il triangolo muscolare, costituito dall'ICA, dall'arteria carotide esterna (ECA) e dall'arteria carotide comune (CCA).
- Separare accuratamente il CCA e l'ICA giusti dal nervo vascolare con microforza per la chirurgia vascolare.
- Esponi il CCA giusto e l'ICA. Bloccare il flusso sanguigno proveniente dal CCA all'ICA utilizzando micro-clip o speciali laccio emostatici per la chirurgia vascolare. Effettuare un'incisione (circa 1 mm) sull'ICA utilizzando microscissori per la chirurgia vascolare.
- Inserire un catetere monofilamento (4-0 nylon) direttamente attraverso l'ICA, a circa 18,5-19 mm dal punto di biforcazione del CCA destro nel cerchio di Willis fino a raggiungere una lieve resistenza, per occludere l'MCA26.
- Ligate intorno all'ICA sopra la biforcazione del CCA.
- Per il gruppo di controllo gestito da sham, eseguire un inserimento di filo di nylon invece dei passaggi 3.5 e 3.616,22.
- Somministrare 5 mL di cloruro di sodio 0,9% per iniezione intraperitoneale.
- Chiudere la ferita per sutura e portare il topo in un'area di recupero.
NOTA: Pochi minuti dopo la fine dell'anestesia, il topo si sveglierà e si muoverà in modo indipendente intorno alla gabbia. - A 23 ore dopo MCAO, iniettare il 2% di Evans blu in soluzione salina (4 mL/kg)23,26 nella vena di coda per entrambi i gruppi azionati tramite una cannula27.
NOTA: Questo è usato come tracciante permeabilità sangue-cervello. Lasciare circolare per 60 minuti.
4. Determinazione della zona infaritta
- Misurare IZ a 24 ore dopo MCAO come descritto inprecedenza 9,15,18,19,26.
NOTA: I ratti che hanno perso più del 20% del loro peso o sviluppato convulsioni o emiplegia sono esclusi dall'esperimento. - Eutanasia del ratto sostituendo la miscela di gas ispirata con il 20% di ossigeno e l'80% di anidride carbonica fino a quando il topo non smette di respirare spontaneamente.
- Aprire il torace con un'incisione laterale di 5-6 cm attraverso la parete addominale sotto la gabbia toracica usando forbici e forcep chirurgiche.
- Eseguire un'incisione diaframmatica lungo l'intera lunghezza della gabbia toracica con forbici e forceli chirurgici.
- Spostare con cura i polmoni, tagliare attraverso la gabbia toracica fino alla clavicola sui lati destro e sinistro28.
- Perfondere con 200 mL di soluzione salina normale attraverso il ventricolo sinistro del cuore.
- Forare o incidere l'atrio destro del cuore con le forbici.
- Eseguire la decapitazione usando una ghigliottina e raccogliere il tessuto cerebrale.
- Usando le forbici dell'iride, tagliate dal forame magnum al bordo distale della superficie posteriore del cranio su entrambi i lati.
- Separare i bulbi olfattivi, le connessioni nervose lungo la superficie ventrale e la superficie dorsale del cranio dal cervello.
- Rimuovi il cervello dalla testa.
- Produci 6 fette cerebrali creando sezioni orizzontali spesse 2 mm con una lama in acciaio inossidabile .009", non patinato e a bordo singolo.
- Incubare per 30 min a 37 °C nello 0,05% di TTC.
- Posizionare il tessuto cerebrale sulle diapositive del microscopio ed eseguire la scansione ottica di queste 6 fette cerebrali con una risoluzione di 1600x1600 dpi (vedi supplemento 1 per esempio).
- Aggiungete un filtro blu con un editor di foto (ad esempio Adobe Photoshop CS2) utilizzando la funzione Mixer canale (Image > Adjustments > Channel Mixer) e salvate l'immagine come formato di file JPEG.
NOTA: dopo aver applicato il filtro blu, l'immagine apparirà in scala di grigi. - Aprire l'immagine salvata in ImageJ 1.37v29,30.
NOTA: questo programma per computer utilizza una funzione di soglia per isolare e calcolare i pixel in bianco o nero (vedere figura 1). - Per ciascuna delle 6 fette cerebrali dell'immagine, selezionare e salvare ogni emisfero (ipsilaterale ferito a destra e contralaterale sinistro illeso) come file di immagine separato utilizzando lo strumento "selezione poligonale" dal menu principale.
- Impostare il cut-off per determinare IZ utilizzando una funzione di soglia automatica dal menu principale del software ImageJ selezionando Immagine > Regola > Sogliae misurare il numero di pixel in ogni emisfero di un singolo insieme cerebrale.
NOTA: le macro possono essere utilizzate per questo passaggio nel software ImageJ (vedere il Supplemento 2 per il codice). Il cut off è un parametro critico per determinare quali pixel convertire in bianco e quali convertire in nero a seconda della tonalità di grigio (vedi Supplemento 3 e Supplemento 4 come esempi). ImageJ confronta quindi i pixel bianchi e neri per determinare IZ. In base al protocollo di colorazione e alle impostazioni dello scanner, abbiamo utilizzato un valore di cut-off costante di 0,220. - Eseguire la misurazione della correzione IZ per il gonfiore dei tessuti utilizzando il metodo RICH (Ratios of Ipsilateral and Contralateral Cerebral Hemispheres)13,23 (vedere esempio nel Supplemento 5).
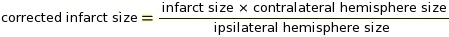
NOTA: La dimensione infarct è valutata come percentuale dell'emisfero contralaterale.
5. Determinazione dell'edema cerebrale31
NOTA: Utilizzare ImageJ 1.37v per la misurazione di BE32,33.
- Misurare BE 24 ore dopo MCAO. Per il calcolo di BE, utilizzare i dati del volume dell'emisfero sinistro e destro (in unità).
- Eseguire la scansione ottica con una risoluzione di 1600x1600 dpi (vedere ad esempio il Supplemento 1).
- Selezionare gli emisferi cerebrali e impostare il cut-off per determinare BE con ImageJ 1.37v, come descritto sopra nelle sezioni 4.17-4.19.
- Esprimere l'area BE come percentuale delle aree standard dell'emisfero contralaterale non influenzato, calcolata con il metodo RICH utilizzando l'equazione seguente (vedere l'esempio nel Supplemento 5)23,34.

NOTA: L'estensione di BE è valutata come percentuale dell'emisfero contralaterale.
6. Determinazione dell'interruzione della BBB
- Misurare l'interruzione della BBB 24 ore dopo MCAO.
- Dividere gli emisferi destro e sinistro in sei fette e metterli in un tubo di microcentrifugo.
- Omogeneizzare ogni fetta del tessuto cerebrale in acido tricloroacetico, sulla base del calcolo di 1 g di tessuto cerebrale in 4 mL di acido tricloroacetico al 50%.
- Centrifuga a 10.000 x g per 20 min.
- Diluire il liquido supernatante 1:3 con il 96% di etanolo.
- Eseguire la spettrofotometria a luminescenza utilizzando il software di spettrofotometria, installando la piastra ed eseguendo una lettura del campione utilizzando i seguenti parametri: lunghezza d'onda di eccitazione dell'intensità di fluorescenza di 620 nm (larghezza di banda 10 nm) e lunghezza d'onda di emissione di 680 nm (larghezza di banda 10 nm)23,35 ; Mod top; Numero Carne 25; Manuale 100; Tremante 1 sec, 1 mm.
NOTA: utilizzare una lunghezza d'onda di eccitazione di 620 nm (larghezza di banda 10 nm) e una lunghezza d'onda di emissione di 680 nm (larghezza di banda 10 nm). 23di35 anni
Risultati
Misurazione della zona infarto
Un test t a campione indipendente ha indicato che 19 ratti sottoposti a MCAO permanente hanno dimostrato un aumento significativo del volume di infarto cerebrale rispetto ai 16 ratti sottoposti a sham (MCAO =7,49% ± 3,57 vs. Sham = 0,31% ± 1,9, t(28,49) = 7,56, p < 0,01 (cfr. figura 2A)). I dati sono espressi come percentuale media dell'emisfero ± SD.
Misurazio...
Discussione
L'obiettivo principale del presente protocollo era quello di dimostrare misurazioni coerenti di tre parametri principali della lesione ischemica: permeabilità IZ, BE e BBB. Studi precedenti in questo campo hanno dimostrato la possibilità di eseguire uno o due di questi parametri insieme nello stesso campione. Oltre alla riduzione dei costi offerta da questo metodo in tre parti, fornisce anche un modello bioetico più desiderabile che limita il numero di animali che devono essere utilizzati e successivamente eutanasiati...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Maryna Kuscheriava, Maksym Kryvonosov, Daryna Yakumenko ed Evgenia Goncharyk del Dipartimento di Fisiologia, Facoltà di Biologia, Ecologia e Medicina, Oles Honchar, Università Dnipro, Dnipro, Ucraina per il loro sostegno e contributi utili alle nostre discussioni. I dati ottenuti fanno parte della tesi di dottorato di Ruslan Kuts.
Materiali
| Name | Company | Catalog Number | Comments |
| 2 mL Syringe | Braun | 4606027V | |
| 2% chlorhexidine in 70% alcohol solution | Sigma-Aldrich | 500 cc | Provides general antisepsis of the skin in the operatory field |
| 27 G Needle with Syringe | Braun | 305620 | |
| 3-0 Silk sutures | Henry Schein | 1007842 | |
| 4-0 Nylon suture | 4-00 | ||
| Brain & Tissue Matrices | Sigma-Aldrich | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 183603985447 | |
| Centrifuge Sigma 2-16P | Sigma-Aldrich | Sigma 2-16P | |
| Compact Analytical Balances | Sigma-Aldrich | HR-AZ/HR-A | |
| Digital weighing scale | Sigma-Aldrich | Rs 4,000 | |
| Dissecting scissors | Sigma-Aldrich | Z265969 | |
| Eppendorf pipette | Sigma-Aldrich | Z683884 | |
| Eppendorf tube | Sigma-Aldrich | EP0030119460 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | Model: Infinite 200 PRO multimode reader | Optional. |
| Fluorescence detector | Molecular Devices LLC | VWR cat. # 10822 512 SpectraMax Paradigm Multi Mode Microplate Reader Base Instrument | Optional. |
| Gauze sponges | Fisher | 22-362-178 | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Hemostatic microclips | Sigma-Aldrich | ||
| Horizon-XL | Mennen Medical Ltd | ||
| Infusion cuff | ABN | IC-500 | |
| Micro forceps | Sigma-Aldrich | ||
| Micro scissors | Sigma-Aldrich | ||
| Multiset | Teva Medical | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Operating forceps | Sigma-Aldrich | ||
| Operating scissors | Sigma-Aldrich | ||
| Optical scanner | Canon | Cano Scan 4200F | Resolution 3200 x 6400 dpi |
| Petri dishes | Sigma-Aldrich | P5606 | |
| Purina Chow | Purina | 5001 | Rodent laboratory chow given to rats, mice and hamster is a life-cycle nutrition that has been used in biomedical research for over 5 decades. Provided to rats ad libitum in this experiment. |
| Rat cages | Techniplast | 2000P | Conventional housing for rodents. Cages were used for housing rats throughout the experiment |
| Scalpel blades #11 | Sigma-Aldrich | S2771 | |
| Software | |||
| Adobe Photoshop CS2 for Windows | Adobe | ||
| ImageJ 1.37v | NIH | The source code is freely available. The author, Wayne Rasband (wayne@codon.nih.gov), is at the Research Services Branch, National Institute of Mental Health, Bethesda, Maryland, USA | |
| SPSS Statistics 22 | IBM | ||
| Office 365 ProPlus | Microsoft | - | Microsoft Office Excel |
| Windows 10 | Microsoft | ||
| Reagents | |||
| 2,3,5-Triphenyltetrazolium chloride | Sigma-Aldrich | 298-96-4 | |
| 50% trichloroacetic acid | Sigma-Aldrich | 76-03-9 | |
| Ethanol 96 % | Romical | Flammable liquid | |
| Evans blue 2% | Sigma-Aldrich | 314-13-6 | |
| Isoflurane, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 |
Riferimenti
- Krishnamurthi, R. V., et al. Global and regional burden of first-ever ischaemic and haemorrhagic stroke during 1990-2010: findings from the Global Burden of Disease Study 2010. Lancet Global Health. 1, 259-281 (2013).
- Benjamin, E. J., et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 135, 146 (2017).
- Wilkins, E., et al. . European cardiovascular disease statistics 2017. , (2017).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Lloyd-Jones, D., et al. Heart disease and stroke statistics--2009 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation. 119, 480-486 (2009).
- Shigeno, T., McCulloch, J., Graham, D. I., Mendelow, A. D., Teasdale, G. M. Pure cortical ischemia versus striatal ischemia. Circulatory, metabolic, and neuropathologic consequences. Surgical Neurology. 24, 47-51 (1985).
- Albanese, V., Tommasino, C., Spadaro, A., Tomasello, F. A transbasisphenoidal approach for selective occlusion of the middle cerebral artery in rats. Experientia. 36, 1302-1304 (1980).
- Hudgins, W. R., Garcia, J. H. Transorbital approach to the middle cerebral artery of the squirrel monkey: a technique for experimental cerebral infarction applicable to ultrastructural studies. Stroke. 1, 107-111 (1970).
- Waltz, A. G., Sundt, T. M., Owen, C. A. Effect of middle cerebral artery occlusion on cortical blood flow in animals. Neurology. 16, 1185-1190 (1966).
- Tamura, A., Graham, D. I., McCulloch, J., Teasdale, G. M. Focal cerebral ischaemia in the rat: 1. Description of technique and early neuropathological consequences following middle cerebral artery occlusion. Journal of Cerebral Blood Flow & Metabolism. 1, 53-60 (1981).
- Aspey, B. S., Cohen, S., Patel, Y., Terruli, M., Harrison, M. J. Middle cerebral artery occlusion in the rat: consistent protocol for a model of stroke. Neuropathology and Applied Neurobiology. 24, 487-497 (1998).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20, 84-91 (1989).
- O'Brien, M. D., Jordan, M. M., Waltz, A. G. Ischemic cerebral edema and the blood-brain barrier. Distributions of pertechnetate, albumin, sodium, and antipyrine in brains of cats after occlusion of the middle cerebral artery. Archives of Neurology. 30, 461-465 (1974).
- Chen, C. H., Toung, T. J., Sapirstein, A., Bhardwaj, A. Effect of duration of osmotherapy on blood-brain barrier disruption and regional cerebral edema after experimental stroke. Journal of Cerebral Blood Flow & Metabolism. 26, 951-958 (2006).
- Boyko, M., et al. Establishment of Novel Technical Methods for Evaluating Brain Edema and Lesion Volume in Stroked Rats: a Standardization of Measurement Procedures. Brain Research. , (2019).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Sifat, A. E., Vaidya, B., Abbruscato, T. J. Blood-Brain Barrier Protection as a Therapeutic Strategy for Acute Ischemic Stroke. AAPS Journal. 19, 957-972 (2017).
- Jiang, X., et al. Blood-brain barrier dysfunction and recovery after ischemic stroke. Progress in Neurobiology. 163-164, 144-171 (2018).
- Belayev, L., Busto, R., Zhao, W., Ginsberg, M. D. Quantitative evaluation of blood-brain barrier permeability following middle cerebral artery occlusion in rats. Brain Research. 739, 88-96 (1996).
- Li, L., Yu, Q., Liang, W. Use of 2,3,5-triphenyltetrazolium chloride-stained brain tissues for immunofluorescence analyses after focal cerebral ischemia in rats. Pathology - Research and Practice. 214, 174-179 (2018).
- Kramer, M., et al. TTC staining of damaged brain areas after MCA occlusion in the rat does not constrict quantitative gene and protein analyses. Journal of Neuroscience Methods. 187, 84-89 (2010).
- Kuts, R., et al. A middle cerebral artery occlusion technique for inducing post-stroke depression in rats. Journal of Visualized Experiments. , e58875 (2019).
- Kuts, R., et al. A Novel Method for Assessing Cerebral Edema, Infarcted Zone and Blood-Brain Barrier Breakdown in a Single Post-stroke Rodent Brain. Frontiers in Neuroscience. 13, 1105 (2019).
- McGarry, B. L., Jokivarsi, K. T., Knight, M. J., Grohn, O. H. J., Kauppinen, R. A. A Magnetic Resonance Imaging Protocol for Stroke Onset Time Estimation in Permanent Cerebral Ischemia. Journal of Visualized Experiments. , e55277 (2017).
- Uluc, K., Miranpuri, A., Kujoth, G. C., Akture, E., Baskaya, M. K. Focal cerebral ischemia model by endovascular suture occlusion of the middle cerebral artery in the rat. Journal of Visualized Experiments. , e1978 (2011).
- Boyko, M., et al. The effect of blood glutamate scavengers oxaloacetate and pyruvate on neurological outcome in a rat model of subarachnoid hemorrhage. Neurotherapeutics. 9, 649-657 (2012).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. , e58875 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. , e3564 (2012).
- Poinsatte, K., et al. Quantification of neurovascular protection following repetitive hypoxic preconditioning and transient middle cerebral artery occlusion in mice. Journal of Visualized Experiments. , e52675 (2015).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (2018)
- Boyko, M., et al. Pyruvate's blood glutamate scavenging activity contributes to the spectrum of its neuroprotective mechanisms in a rat model of stroke. European Journal of Neuroscience. 34, 1432-1441 (2011).
- Collins, T. J. ImageJ for microscopy. Biotechniques. 43, 25-30 (2007).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (1997)
- Kaplan, B., et al. Temporal thresholds for neocortical infarction in rats subjected to reversible focal cerebral ischemia. Stroke. 22, 1032-1039 (1991).
- Kumai, Y., et al. Postischemic gene transfer of soluble Flt-1 protects against brain ischemia with marked attenuation of blood-brain barrier permeability. Journal of Cerebral Blood Flow & Metabolism. 27, 1152-1160 (2007).
- Schuleri, K. H., et al. Characterization of peri-infarct zone heterogeneity by contrast-enhanced multidetector computed tomography: a comparison with magnetic resonance imaging. Journal of the American College of Cardiology. 53, 1699-1707 (2009).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative Stress: A Key Modulator in Neurodegenerative Diseases. Molecules. 24, (2019).
- Di Napoli, M. Caplan's Stroke: A Clinical Approach. Journal of the American Medical Association. 302, 2600-2601 (2009).
- Deb, P., Sharma, S., Hassan, K. M. Pathophysiologic mechanisms of acute ischemic stroke: An overview with emphasis on therapeutic significance beyond thrombolysis. Pathophysiology. 17, 197-218 (2010).
- Simard, J. M., Kent, T. A., Chen, M., Tarasov, K. V., Gerzanich, V. Brain oedema in focal ischaemia: molecular pathophysiology and theoretical implications. Lancet Neurology. 6, 258-268 (2007).
- Klatzo, I. Pathophysiological aspects of brain edema. Acta Neuropathology. 72, 236-239 (1987).
- Yang, Y., Rosenberg, G. A. Blood-brain barrier breakdown in acute and chronic cerebrovascular disease. Stroke. 42, 3323-3328 (2011).
- Lin, T. N., He, Y. Y., Wu, G., Khan, M., Hsu, C. Y. Effect of brain edema on infarct volume in a focal cerebral ischemia model in rats. Stroke. 24, 117-121 (1993).
- Liu, C., et al. Increased blood-brain barrier permeability in contralateral hemisphere predicts worse outcome in acute ischemic stroke after reperfusion therapy. Journal of NeuroInterventional Surgery. 10, 937-941 (2018).
- Boyko, M., et al. Establishment of novel technical methods for evaluating brain edema and lesion volume in stroked rats: A standardization of measurement procedures. Brain Research. 1718, 12-21 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon