Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tek Bir Kemirgen Beyin Örneklerinde İnme Sonrası Serebral Ödem, Enfarktüs Bölgesi ve Kan-Beyin Bariyeri Kırılımının Ölçülmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, aynı kemirgen beyin örnekleri kümesinde iskemik beyin hasarının en önemli üç parametresini ölçmenin yeni bir tekniğini açıklar. Sadece bir beyin örneği kullanmak etik ve ekonomik maliyetler açısından oldukça avantajlıdır.
Özet
Dünya genelinde morbidite ve mortalitenin en sık nedenlerinden biri iskemik inmedir. Tarihsel olarak, iskemik inmeyi uyarmak için kullanılan bir hayvan modeli orta serebral arter tıkanıklığını (MCAO) içerir. Enfarktüs bölgesi, beyin ödemi ve kan-beyin bariyeri (BBB) bozulması MCAO sonrası beyin hasarının boyutunu yansıtan parametreler olarak ölçülür. Bu yöntemin önemli bir sınırlaması, bu ölçümlerin normalde farklı sıçan beyin örneklerinde elde edilmesi ve uygun bir örnek boyutu için ötenazi yapılması gereken çok sayıda sıçan nedeniyle etik ve finansal yüklere yol açtır. Burada, aynı sıçan beyin kümesinde enfarktüs bölgesini, beyin ödemini ve BBB geçirgenliğini ölçerek MCAO'yu takiben beyin hasarının doğru bir şekilde değerlendirilmesi için bir yöntem sunuyoruz. Bu yeni teknik, inmenin patofizyolojisini değerlendirmek için daha verimli bir yol sağlar.
Giriş
Dünya genelinde morbidite ve mortalitenin en sık nedenlerinden biri inmedir. Küresel olarak, iskemik inme tüm inme vakalarının% 68'ini temsil ederken, Amerika Birleşik Devletleri'nde iskemik inme, inme vakalarının% 87'sini oluşturur1,2. İnmenin ekonomik yükünün Amerika Birleşik Devletleri'nde2 ve Avrupa Birliği'nde 45 milyar Euro'ya ulaştığı tahmin edilmektedir3. İnmenin hayvan modelleri patofizyolojisini incelemek, değerlendirme için yeni yöntemler geliştirmek ve yeni terapötik seçenekler önermek için gereklidir4.
İskemik inme, genellikle orta serebral arter veya dallarından biri olan majör bir serebral arterin tıkanması ile ortaya çıkar5. Bu nedenle, iskemik inme modelleri tarihsel olarak orta serebral arter tıkanıklığını (MCAO)6, 7,8,9,10,11,12'yikapsamıştır. MCAO'yu takip ederek, nörolojik yaralanma en sık 2,3,5-triphenyltetrazolium klorür (TTC) boyama yöntemi13, beyin ödemi (BE) kullanılarak enfarktüs bölgesi (IZ) ölçülerek değerlendirilir. ) Evans mavi boyama17 , 18,19kullanarak bir spektrometre tekniği ile kurutma veya hesaplama hemisferik hacimleri 14 , 15,16vekan beyin bariyeri (BBB) geçirgenliği kullanarak.
Geleneksel MCAO yöntemi, üç beyin ölçümünün her biri için ayrı beyin kümeleri kullanır. Büyük bir örneklem boyutu için, bu, ek etik ve finansal hususlarla birlikte önemli sayıda ötenaziye tabi hayvanla sonuçlanır. Bu maliyetleri hafifletmek için alternatif bir yöntem, MCAO sonrası kemirgen beyinlerinin tek bir kümesindeki üç parametrenin de ölçümünü içerecektir.
Aynı beyin örneğindeki parametrelerin kombinasyonlarını ölçmek için önceki girişimler yapılmıştır. Aynı beyin örneğinde TTC lekelemeden sonra eşzamanlı immünoresan boyama yöntemleri20 ve diğer moleküler ve biyokimyasal analizler21 tanımlanmıştır. Daha önce beyin ödemini değerlendirmek için beyin yarımküre hacimlerini hesapladık ve aynı beyin setinde enfarktüs bölgesini hesaplamak için TTC boyama yaptık15.
Mevcut protokolde, aynı kemirgen beyin kümesinde IZ, BE ve BBB geçirgenliğini belirleyerek iskemik beyin hasarını ölçen değiştirilmiş bir MCAO tekniği sunuyoruz. IZ TTC boyama ile ölçülür, BE yarım küre hacmi hesaplanarak belirlenir ve BBB geçirgenliği spektrometre yöntemleri ile elde edilir19. Bu protokolde, monofilament kateterin iç karotid artere (ICA) doğrudan yerleştirilmesine ve sabitlenmesine ve orta serebral artere (MCA) kan akışının daha fazla engellenmesine dayanan modifiye bir MCAO modeli kullandık22. Bu değiştirilmiş yöntem, geleneksel MCAO yöntemi16,22'yekıyasla ölüm ve morbidite oranının azaldığını göstermektedir.
Bu yeni yaklaşım, MCAO'dan sonra nörolojik hasarı ölçmek için finansal açıdan sağlam ve etik bir model sunmaktadır. İskemik beyin hasarının ana parametrelerinin bu değerlendirmesi, patofizyolojisinin kapsamlı bir şekilde araştırılmasına yardımcı olacaktır.
Protokol
Aşağıdaki prosedürler Helsinki ve Tokyo Bildirgesi'nin önerilerine ve Avrupa Topluluğu Deney Hayvanlarının Kullanımına İlişkin Yönergelere göre gerçek yapılmıştır. Deneyler, Negev Ben-Gurion Üniversitesi Hayvan Bakım Komitesi tarafından da onaylandı.
1. Sıçanların deneysel prosedüre hazırlanması
- Her biri 300 ila 350 g ağırlığında, açık patolojisi olmayan yetişkin erkek Sprague-Dawley sıçanlarını seçin.
- Deneyden önce 12 saatlik açık ve karanlık döngülerle tüm sıçanları oda sıcaklığında 22 °C'de koruyun.
- Yiyecek ve suyun mevcut reklam libitum olduğundan emin olun.
- Tüm işlemleri 06:00.m ile 14:00 .m arasında gerçekleştirin.
2. Sıçanların ameliyata hazırlanması
- Sıçanları izofluran (indüksiyon için% 4 ve bakım için% 2) ve% 24 oksijen (1.5 L / dk) ile 30 dakika uyuşturun.
- Pedal çekme refleksine sahip olmadıklarından emin olarak sıçanlardaki anestezi seviyesini test edin.
- 24 kalibrelik kateteri kuyruk damarına yerleştirin.
NOT: Vazodilasyon için kuyruk ısıtma işlemi yapılmaz.- Sıçanları masaya bir supine pozisyonunda yerleştirin. Farelerin dört uzuvlarını yapıştırmak için tıbbi bant kullan.
- Sıcaklık ölçümü için probu ameliyattan önce sıçan rektumuna yerleştirin.
- İşlem sırasında, 37 °C çekirdek vücut sıcaklığını desteklemek için bir ısıtma plakası muhafaza edin.
- Koruma için sıçanın her iki gözüne de merhem ekleyin.
- Cerrahi bölgeyi tıraş edin ve % 10 povidon-iyot ve ardından% 70 izopropil alkol ile üç uygulama ile dezenfekte edin.
3. Sağ taraf orta serebral arter tıkanma
NOT: MCAO, daha önce16,22,23olarak tanımlandığı gibi, McGarry ve ark.24ve Uluç ve ark.25 tarafından açıklanan enstrümanların kullanımı ile değiştirilmiş bir tekniklegerçekleştirilir.
- Boynun ventral orta hattındaki deriyi ve yüzeysel fasyayı cerrahi cımbız ve kavisli bıçaklarla makasla parçalara ayrıştırın.
- ICA, harici karotis arter (ECA) ve ortak şahdamardan (CCA) oluşan kas üçgenini tanımlayın.
- Damar cerrahisi için doğru CCA ve ICA'yı mikroforceps ile vagus sinirinden dikkatlice ayırın.
- Doğru CCA ve ICA'yı açığa çıkar. CCA'dan ICA'ya gelen kan akışını mikro klipsler veya damar cerrahisi için özel turnikeler kullanarak engelleyin. Vasküler cerrahi için mikros makas kullanarak ICA üzerinde bir kesi (yaklaşık 1 mm) yapın.
- McA 26'yı tıkamak için, sağ CCA'nın çatallanma noktasından Willis çemberine hafif bir dirence ulaşana kadar yaklaşık 18,5-19 mm uzaklıkta, doğrudan ICA'dan bir monofilament kateter(4-0naylon) yerleştirin.
- CCA'nın çatallanmasının üzerinde ICA'nın etrafında ligat.
- Sham tarafından çalıştırılan denetim grubu için, adım 3.5 ve 3.616,22yerine naylon iplik ekleme gerçekleştirin.
- intraperitoneal enjeksiyon ile% 0.9 sodyum klorürün 5 mL'sini uygulayın.
- Yarayı dikişle kapatın ve sıçanı bir iyileşme alanına götürün.
NOT: Anestezinin bitiminden birkaç dakika sonra, sıçan uyanacak ve kafesin etrafında bağımsız olarak hareket edecektir. - MCAO'dan sonra 23 saat sonra, salin (4 mL / kg)23,26% 2 Evans mavisini bir kanonül27aracılığıyla her iki ameliyat grubu için kuyruk damarına enjekte edin.
NOT: Bu, kan-beyin geçirgenlik izleyicisi olarak kullanılır. 60 dakika boyunca dolaşmasına izin verin.
4. Enfarktüs bölgesinin belirlenmesi
- IZ'yi MCAO'dan sonra 24 saat olarakölçün,daha önce açıklandığı gibi9,15,18,19,26.
NOT: Kilolarının % 20'sinden fazlasını kaybeden veya nöbet veya hemipleji gelişen sıçanlar deneyden çıkarılır. - Fare kendiliğinden nefes almaya son verene kadar ilham alan gaz karışımını% 20 oksijen ve% 80 karbondioksit ile değiştirerek sıçanı ötenazi edin.
- Makas ve cerrahi dikiz kullanarak göğüs kafesinin altındaki karın duvarından 5-6 cm yanal kesi ile göğsü açın.
- Makas ve cerrahi önps ile göğüs kafesinin tüm uzunluğu boyunca diyaframlı bir kesi gerçekleştirin.
- Akciğerleri dikkatlice yerinden çıkarmak, göğüs kafesini sağ ve sol taraftaki köprücük kemiğine kadar kesin28.
- Kalbin sol ventrikülünden 200 mL normal salin ile perfuse.
- Kalbin sağ kulakçıkını makasla delin veya kuluçkaya yatırın.
- Giyotin kullanarak kafa kesme işlemi gerçekleştirin ve beyin dokusunu toplayın.
- İris makası kullanarak, foramen magnum'dan her iki taraftaki arka kafatası yüzeyinin distal kenarına kesin.
- Koku ampullerini, ventral yüzey boyunca sinir bağlantılarını ve kafatasının dorsal yüzeyini beyinden ayırın.
- Beyni kafasından çıkar.
- .009" paslanmaz çelik, kaplamasız, tek kenarlı jilet ile 2 mm kalınlığında yatay bölümler oluşturarak 6 beyin dilimi üretin.
- %0,05 TTC'de 37 °C'de 30 dakika kuluçkaya yatır.
- Beyin dokusunu mikroskop slaytlarına yerleştirin ve bu 6 beyin diliminin 1600x1600 dpi çözünürlüğe sahip optik taramasını gerçekleştirin (örneğin, ek 1'e bakın).
- Kanal Karıştırıcı işlevini(Görüntü > Ayarlamalar >Kanal Karıştırıcısı) kullanarak fotoğraf düzenleyicisi (örneğin, Adobe Photoshop CS2) içeren mavi bir filtre ekleyin ve görüntüyü JPEG dosya biçimi olarak kaydedin.
NOT: Mavi filtre uygulandıktan sonra görüntü gri tonlamalı görünecektir. - Kaydedilen görüntüyü ImageJ 1.37v29,30'da açın.
NOT: Bu bilgisayar programı, siyah veya beyaz pikselleri yalıtmak ve hesaplamak için bir eşik işlevi kullanır (bkz. Şekil 1). - Görüntünün 6 beyin diliminin her biri için, ana menüden "çokgen seçim" aracını kullanarak her yarımküreyi (sağ yaralı ipsilateral ve sol yaralanmamış kontralatör) ayrı bir görüntü dosyası olarak seçin ve kaydedin.
- Görüntü > Ayarla > Eşik'i seçerek ImageJ yazılımının ana menüsünden otomatik eşik işlevini kullanarak IZ'yi belirlemek için kesmeyi ayarlayın ve tek bir beyin kümesinin her yarımküreslerindeki piksel sayısını ölçün.
NOT: ImageJ yazılımında bu adım için makrolar kullanılabilir (bkz. kod için Ek 2). Kesme, hangi piksellerin beyaza dönüştürüleceklerini ve grinin gölgesine bağlı olarak hangilerinin siyaha dönüştürüleceklerini belirlemek için kritik bir parametredir (örnek olarak Ek 3 ve Ek 4'e bakın). ImageJ daha sonra IZ'yi belirlemek için beyaz ve siyah pikselleri karşılaştırır. Boyama protokolü ve tarayıcı ayarlarına dayanarak, 0.220 sabit bir kesme değeri kullandık. - Ipsilateral ve Kontrallateral Serebral Yarımküre Oranları (RICH) yöntemi13,23 kullanarak doku şişmesi için IZ düzeltme ölçümünü gerçekleştirin (Ek 5'tekiörneğe bakın).
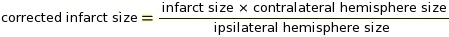
NOT: Enfarktüs boyutu kontrallateral yarımkürenin bir yüzdesi olarak değerlendirilir.
5. Beyin ödeminin belirlenmesi31
NOT: BE 32 , 33 ölçümü için ImageJ1.37vkullanın.
- MCAO'dan sonra 24 saat ölçün. BE'nin hesaplanması için, sol ve sağ yarımküre hacmindeki verileri (birimler halinde) kullanın.
- 1600x1600 dpi çözünürlükte optik tarama gerçekleştirin (örneğin, Ek 1'e bakın).
- Beyin yarımkürelerini seçin ve yukarıda 4.17-4.19 bölümlerinde açıklandığı gibi ImageJ 1.37v ile BE'yi belirlemek için kesmeyi ayarlayın.
- BE alanını, aşağıdaki denklem kullanılarak RICH yöntemiyle hesaplanan etkilenmemiş kontrallateral yarımkürenin standart alanlarının yüzdesi olarak ifade edin (Ek 5'tekiörneğe bakınız)23,34.

NOT: BE kapsamı kontrallateral yarımkürenin bir yüzdesi olarak değerlendirilir.
6. BBB kesintisinin belirlenmesi
- MCAO'dan sonra BBB kesintisini 24 saat ölçün.
- Sağ ve sol yarımküreleri altı dilime bölün ve her birini bir mikrosantrifüj tüpüne koyun.
- Beyin dokusunun her dilimini trikloroasetik asitte homojenize edin, %50 trikloroasetik asidin 4 mL'sinde 1 g beyin dokusunun hesaplanmasına dayanarak.
- 20 dakika boyunca 10.000 x g'da santrifüj.
- %96 etanol ile süpernatant sıvı 1:3 seyreltin.
- Spektrofotometri yazılımını kullanarak, plakayı yükleyerek ve aşağıdaki parametreleri kullanarak örnek bir okuma gerçekleştirerek lüminesans spektrofotometrisi gerçekleştirin: Floresan yoğunluğu 620 nm (bant genişliği 10 nm) ve emisyon dalga boyu 680 nm (bant genişliği 10 nm)23,35 ; Mod üst; Sayı Et 25; Manuel 100; Sallanıyor 1 sn, 1 mm.
NOT: 620 nm'lik (bant genişliği 10 nm) bir heyecan dalga boyu ve 680 nm emisyon dalga boyu (bant genişliği 10 nm) kullanın. 23,35
Sonuçlar
Enfarktüs bölgesi ölçümü
Bağımsız örneklemli bir t-testi, kalıcı MCAO uygulanan 19 sıçanın, 16 sahte fareye kıyasla beyin enfarktüs hacminde önemli bir artış gösterdiğini göstermiştir (MCAO=% 7.49 ± 3.57 vs. Sham = %0,31 ± 1,9, t(28,49) = 7,56, p < 0,01 (bkz. Şekil 2A)). Veriler, SD'± kontrallateral yarımkürenin ortalama bir yüzdesi olarak ifade edilir.
Beyin öde...
Tartışmalar
Mevcut protokolün temel amacı, iskemik yaralanmanın üç ana parametresinin tutarlı ölçümlerini göstermekti: IZ, BE ve BBB geçirgenliği. Bu alanda daha önce yapılan çalışmalar, bu parametrelerden bir veya ikisinin aynı örnekte birlikte gerçekleştirilme olasılığını ortaya koymuştur. Bu üç parçalı yöntemin sunduğu maliyet azaltmanın yanı sıra, ameliyat edilmesi ve daha sonra ötenazi yapılması gereken hayvan sayısını sınırlayan daha arzu edilen bir biyoetik model de sağlar. Tüm hi...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Maryna Kuscheriava, Maksym Kryvonosov, Daryna Yakumenko ve Fizyoloji Bölümü, Biyoloji, Ekoloji ve Tıp Fakültesi Evgenia Goncharyk, Oles Honchar, Dnipro Üniversitesi, Dnipro, Ukrayna'ya görüşmelerimize destekleri ve yararlı katkıları için teşekkür ederiz. Elde edilen veriler Ruslan Kuts'un doktora tezinin bir parçasıdır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2 mL Syringe | Braun | 4606027V | |
| 2% chlorhexidine in 70% alcohol solution | Sigma-Aldrich | 500 cc | Provides general antisepsis of the skin in the operatory field |
| 27 G Needle with Syringe | Braun | 305620 | |
| 3-0 Silk sutures | Henry Schein | 1007842 | |
| 4-0 Nylon suture | 4-00 | ||
| Brain & Tissue Matrices | Sigma-Aldrich | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 183603985447 | |
| Centrifuge Sigma 2-16P | Sigma-Aldrich | Sigma 2-16P | |
| Compact Analytical Balances | Sigma-Aldrich | HR-AZ/HR-A | |
| Digital weighing scale | Sigma-Aldrich | Rs 4,000 | |
| Dissecting scissors | Sigma-Aldrich | Z265969 | |
| Eppendorf pipette | Sigma-Aldrich | Z683884 | |
| Eppendorf tube | Sigma-Aldrich | EP0030119460 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | Model: Infinite 200 PRO multimode reader | Optional. |
| Fluorescence detector | Molecular Devices LLC | VWR cat. # 10822 512 SpectraMax Paradigm Multi Mode Microplate Reader Base Instrument | Optional. |
| Gauze sponges | Fisher | 22-362-178 | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Hemostatic microclips | Sigma-Aldrich | ||
| Horizon-XL | Mennen Medical Ltd | ||
| Infusion cuff | ABN | IC-500 | |
| Micro forceps | Sigma-Aldrich | ||
| Micro scissors | Sigma-Aldrich | ||
| Multiset | Teva Medical | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Operating forceps | Sigma-Aldrich | ||
| Operating scissors | Sigma-Aldrich | ||
| Optical scanner | Canon | Cano Scan 4200F | Resolution 3200 x 6400 dpi |
| Petri dishes | Sigma-Aldrich | P5606 | |
| Purina Chow | Purina | 5001 | Rodent laboratory chow given to rats, mice and hamster is a life-cycle nutrition that has been used in biomedical research for over 5 decades. Provided to rats ad libitum in this experiment. |
| Rat cages | Techniplast | 2000P | Conventional housing for rodents. Cages were used for housing rats throughout the experiment |
| Scalpel blades #11 | Sigma-Aldrich | S2771 | |
| Software | |||
| Adobe Photoshop CS2 for Windows | Adobe | ||
| ImageJ 1.37v | NIH | The source code is freely available. The author, Wayne Rasband (wayne@codon.nih.gov), is at the Research Services Branch, National Institute of Mental Health, Bethesda, Maryland, USA | |
| SPSS Statistics 22 | IBM | ||
| Office 365 ProPlus | Microsoft | - | Microsoft Office Excel |
| Windows 10 | Microsoft | ||
| Reagents | |||
| 2,3,5-Triphenyltetrazolium chloride | Sigma-Aldrich | 298-96-4 | |
| 50% trichloroacetic acid | Sigma-Aldrich | 76-03-9 | |
| Ethanol 96 % | Romical | Flammable liquid | |
| Evans blue 2% | Sigma-Aldrich | 314-13-6 | |
| Isoflurane, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 |
Referanslar
- Krishnamurthi, R. V., et al. Global and regional burden of first-ever ischaemic and haemorrhagic stroke during 1990-2010: findings from the Global Burden of Disease Study 2010. Lancet Global Health. 1, 259-281 (2013).
- Benjamin, E. J., et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 135, 146 (2017).
- Wilkins, E., et al. . European cardiovascular disease statistics 2017. , (2017).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Lloyd-Jones, D., et al. Heart disease and stroke statistics--2009 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation. 119, 480-486 (2009).
- Shigeno, T., McCulloch, J., Graham, D. I., Mendelow, A. D., Teasdale, G. M. Pure cortical ischemia versus striatal ischemia. Circulatory, metabolic, and neuropathologic consequences. Surgical Neurology. 24, 47-51 (1985).
- Albanese, V., Tommasino, C., Spadaro, A., Tomasello, F. A transbasisphenoidal approach for selective occlusion of the middle cerebral artery in rats. Experientia. 36, 1302-1304 (1980).
- Hudgins, W. R., Garcia, J. H. Transorbital approach to the middle cerebral artery of the squirrel monkey: a technique for experimental cerebral infarction applicable to ultrastructural studies. Stroke. 1, 107-111 (1970).
- Waltz, A. G., Sundt, T. M., Owen, C. A. Effect of middle cerebral artery occlusion on cortical blood flow in animals. Neurology. 16, 1185-1190 (1966).
- Tamura, A., Graham, D. I., McCulloch, J., Teasdale, G. M. Focal cerebral ischaemia in the rat: 1. Description of technique and early neuropathological consequences following middle cerebral artery occlusion. Journal of Cerebral Blood Flow & Metabolism. 1, 53-60 (1981).
- Aspey, B. S., Cohen, S., Patel, Y., Terruli, M., Harrison, M. J. Middle cerebral artery occlusion in the rat: consistent protocol for a model of stroke. Neuropathology and Applied Neurobiology. 24, 487-497 (1998).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20, 84-91 (1989).
- O'Brien, M. D., Jordan, M. M., Waltz, A. G. Ischemic cerebral edema and the blood-brain barrier. Distributions of pertechnetate, albumin, sodium, and antipyrine in brains of cats after occlusion of the middle cerebral artery. Archives of Neurology. 30, 461-465 (1974).
- Chen, C. H., Toung, T. J., Sapirstein, A., Bhardwaj, A. Effect of duration of osmotherapy on blood-brain barrier disruption and regional cerebral edema after experimental stroke. Journal of Cerebral Blood Flow & Metabolism. 26, 951-958 (2006).
- Boyko, M., et al. Establishment of Novel Technical Methods for Evaluating Brain Edema and Lesion Volume in Stroked Rats: a Standardization of Measurement Procedures. Brain Research. , (2019).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Sifat, A. E., Vaidya, B., Abbruscato, T. J. Blood-Brain Barrier Protection as a Therapeutic Strategy for Acute Ischemic Stroke. AAPS Journal. 19, 957-972 (2017).
- Jiang, X., et al. Blood-brain barrier dysfunction and recovery after ischemic stroke. Progress in Neurobiology. 163-164, 144-171 (2018).
- Belayev, L., Busto, R., Zhao, W., Ginsberg, M. D. Quantitative evaluation of blood-brain barrier permeability following middle cerebral artery occlusion in rats. Brain Research. 739, 88-96 (1996).
- Li, L., Yu, Q., Liang, W. Use of 2,3,5-triphenyltetrazolium chloride-stained brain tissues for immunofluorescence analyses after focal cerebral ischemia in rats. Pathology - Research and Practice. 214, 174-179 (2018).
- Kramer, M., et al. TTC staining of damaged brain areas after MCA occlusion in the rat does not constrict quantitative gene and protein analyses. Journal of Neuroscience Methods. 187, 84-89 (2010).
- Kuts, R., et al. A middle cerebral artery occlusion technique for inducing post-stroke depression in rats. Journal of Visualized Experiments. , e58875 (2019).
- Kuts, R., et al. A Novel Method for Assessing Cerebral Edema, Infarcted Zone and Blood-Brain Barrier Breakdown in a Single Post-stroke Rodent Brain. Frontiers in Neuroscience. 13, 1105 (2019).
- McGarry, B. L., Jokivarsi, K. T., Knight, M. J., Grohn, O. H. J., Kauppinen, R. A. A Magnetic Resonance Imaging Protocol for Stroke Onset Time Estimation in Permanent Cerebral Ischemia. Journal of Visualized Experiments. , e55277 (2017).
- Uluc, K., Miranpuri, A., Kujoth, G. C., Akture, E., Baskaya, M. K. Focal cerebral ischemia model by endovascular suture occlusion of the middle cerebral artery in the rat. Journal of Visualized Experiments. , e1978 (2011).
- Boyko, M., et al. The effect of blood glutamate scavengers oxaloacetate and pyruvate on neurological outcome in a rat model of subarachnoid hemorrhage. Neurotherapeutics. 9, 649-657 (2012).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. , e58875 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. , e3564 (2012).
- Poinsatte, K., et al. Quantification of neurovascular protection following repetitive hypoxic preconditioning and transient middle cerebral artery occlusion in mice. Journal of Visualized Experiments. , e52675 (2015).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (2018)
- Boyko, M., et al. Pyruvate's blood glutamate scavenging activity contributes to the spectrum of its neuroprotective mechanisms in a rat model of stroke. European Journal of Neuroscience. 34, 1432-1441 (2011).
- Collins, T. J. ImageJ for microscopy. Biotechniques. 43, 25-30 (2007).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (1997)
- Kaplan, B., et al. Temporal thresholds for neocortical infarction in rats subjected to reversible focal cerebral ischemia. Stroke. 22, 1032-1039 (1991).
- Kumai, Y., et al. Postischemic gene transfer of soluble Flt-1 protects against brain ischemia with marked attenuation of blood-brain barrier permeability. Journal of Cerebral Blood Flow & Metabolism. 27, 1152-1160 (2007).
- Schuleri, K. H., et al. Characterization of peri-infarct zone heterogeneity by contrast-enhanced multidetector computed tomography: a comparison with magnetic resonance imaging. Journal of the American College of Cardiology. 53, 1699-1707 (2009).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative Stress: A Key Modulator in Neurodegenerative Diseases. Molecules. 24, (2019).
- Di Napoli, M. Caplan's Stroke: A Clinical Approach. Journal of the American Medical Association. 302, 2600-2601 (2009).
- Deb, P., Sharma, S., Hassan, K. M. Pathophysiologic mechanisms of acute ischemic stroke: An overview with emphasis on therapeutic significance beyond thrombolysis. Pathophysiology. 17, 197-218 (2010).
- Simard, J. M., Kent, T. A., Chen, M., Tarasov, K. V., Gerzanich, V. Brain oedema in focal ischaemia: molecular pathophysiology and theoretical implications. Lancet Neurology. 6, 258-268 (2007).
- Klatzo, I. Pathophysiological aspects of brain edema. Acta Neuropathology. 72, 236-239 (1987).
- Yang, Y., Rosenberg, G. A. Blood-brain barrier breakdown in acute and chronic cerebrovascular disease. Stroke. 42, 3323-3328 (2011).
- Lin, T. N., He, Y. Y., Wu, G., Khan, M., Hsu, C. Y. Effect of brain edema on infarct volume in a focal cerebral ischemia model in rats. Stroke. 24, 117-121 (1993).
- Liu, C., et al. Increased blood-brain barrier permeability in contralateral hemisphere predicts worse outcome in acute ischemic stroke after reperfusion therapy. Journal of NeuroInterventional Surgery. 10, 937-941 (2018).
- Boyko, M., et al. Establishment of novel technical methods for evaluating brain edema and lesion volume in stroked rats: A standardization of measurement procedures. Brain Research. 1718, 12-21 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır