Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Messung des Abbaus von Hirnödem nach dem Schlaganfall, Infarktzone und Blut-Hirn-Barrierenabbau in einem einzigen Satz von Nagetier-Gehirnproben
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine neuartige Technik zur Messung der drei wichtigsten Parameter ischämischer Hirnverletzungen an demselben Satz von Nagetier-Gehirnproben. Die Verwendung von nur einer Hirnprobe ist in Bezug auf ethische und wirtschaftliche Kosten sehr vorteilhaft.
Zusammenfassung
Eine der häufigsten Ursachen für Morbidität und Mortalität weltweit ist ischämischer Schlaganfall. Historisch gesehen beinhaltet ein Tiermodell, das zur Stimulierung des ischämischen Schlaganfalls verwendet wird, die mittlere Hirnarterienverschluss (MCAO). Infarktzone, Hirnödem und Blut-Hirn-Schranke (BBB) Abbau werden als Parameter gemessen, die das Ausmaß der Hirnverletzung nach MCAO widerspiegeln. Eine wesentliche Einschränkung dieser Methode besteht darin, dass diese Messungen normalerweise in verschiedenen Hirnproben von Ratten durchgeführt werden, was aufgrund der großen Anzahl von Ratten, die für eine angemessene Stichprobengröße eingeschläfert werden müssen, zu ethischen und finanziellen Belastungen führt. Hier stellen wir eine Methode zur genauen Beurteilung von Hirnverletzungen nach MCAO vor, indem wir Infarktzonen, Hirnödeme und BBB-Permeabilität in den gleichen Rattengehirnen messen. Diese neuartige Technik bietet eine effizientere Möglichkeit, die Pathophysiologie des Schlaganfalls zu bewerten.
Einleitung
Eine der häufigsten Ursachen für Morbidität und Sterblichkeit weltweit ist Schlaganfall. Weltweit macht ischämischer Schlaganfall 68% aller Schlaganfallfälle aus, während in den Vereinigten Staaten ischämischer Schlaganfall 87% der Schlaganfallfälle1,2ausmacht. Es wird geschätzt, dass die wirtschaftliche Belastung durch Schlaganfall in den Vereinigten Staaten34 Milliarden Dollar 2 und 45 Milliarden Euro in der Europäischen Union3erreicht. Tiermodelle des Schlaganfalls sind notwendig, um seine Pathophysiologie zu studieren, neue Methoden für die Bewertung zu entwickeln und neue therapeutische Optionen vorzuschlagen4.
Ischämischer Schlaganfall tritt mit Okklusion einer großen Zerebralparese auf, in der Regel die mittlere Hirnarterie oder einer seiner Zweige5. So haben Modelle des ischämischen Schlaganfalls historisch gesehen mittlere Zerebrale Arterienverschluss (MCAO)6,7,8,9,10,11,12. Nach MCAO wird eine neurologische Verletzung am häufigsten durch Messung der Infarktzone (IZ) mit einer 2,3,5-Triphenyltetrazoliumchlorid (TTC) Färbemethode13, Hirnödem (BE) mit Trocknung oder Berechnung hemisphärischer Volumina14,15,16, und Blut-Hirn-Schranke (BBB) Permeabilität durch eine Spektrometrie-Technik mit Evans blaue Färbung17,18,19.
Die traditionelle MCAO-Methode verwendet separate Sätze von Gehirnen für jede der drei Gehirnmessungen. Bei einem großen Stichprobenumfang führt dies zu einer erheblichen Anzahl eingeschläferter Tiere mit zusätzlichen ethischen und finanziellen Erwägungen. Eine alternative Methode zur Verringerung dieser Kosten würde Messungen aller drei Parameter in einem einzigen Satz von Post-MCAO Nagetiergehirnen beinhalten.
Frühere Versuche wurden unternommen, um Kombinationen von Parametern in derselben Gehirnprobe zu messen. Die gleichzeitigen immunfluoreszierenden Färbemethoden20 sowie andere molekulare und biochemische Analysen21 wurden nach TTC-Färbung in derselben Hirnprobe beschrieben. Wir haben zuvor Gehirnhälften berechnet, um Hirnödeme zu bewerten, und TTC-Färbung durchgeführt, um die Infarktzone im selben Gehirnsatz15zu berechnen.
Im vorliegenden Protokoll stellen wir eine modifizierte MCAO-Technik vor, die ischämische Hirnverletzungen misst, indem sie die Durchlässigkeit von IZ, BE und BBB in denselben Nagetierhirnen ermittelt. IZ wird durch TTC-Färbung gemessen, BE wird durch Berechnung des hemisphärischen Volumens bestimmt und BBB-Permeabilität wird durch Spektrometriemethoden19ermittelt. In diesem Protokoll verwendeten wir ein modifiziertes MCAO-Modell, das auf der direkten Insertion und Fixierung des Monofilamentkatheters in die innere Halsschlagader (ICA) und der weiteren Blockierung des Blutflusses zur mittleren Hirnarterie (MCA)22basiert. Diese modifizierte Methode zeigt eine verringerte Sterblichkeits- und Morbiditätsrate im Vergleich zur traditionellen MCAO-Methode16,22.
Dieser neue Ansatz bietet ein finanziell solides und ethisches Modell zur Messung neurologischer Verletzungen nach MCAO. Diese Bewertung der wichtigsten Parameter der ischämischen Hirnverletzung wird dazu beitragen, seine Pathophysiologie umfassend zu untersuchen.
Protokoll
Die folgenden Verfahren wurden gemäß den Empfehlungen der Erklärung von Helsinki und Tokio und der Leitlinien für die Verwendung von Versuchstieren der Europäischen Gemeinschaft durchgeführt. Die Experimente wurden auch vom Animal Care Committee an der Ben-Gurion Universität des Negev genehmigt.
1. Vorbereitung von Ratten auf das Experimentelle Verfahren
- Wählen Sie erwachsene männliche Sprague-Dawley Ratten ohne unbedenkte Pathologie, die jeweils zwischen 300 und 350 g wiegen.
- Halten Sie alle Ratten bei Raumtemperatur bei 22 °C, mit 12 Stunden licht- und dunkler Zyklen vor dem Experiment.
- Stellen Sie sicher, dass Nahrungsmittel und Wasser ad libitum verfügbar sind.
- Führen Sie alle Prozeduren zwischen 6:00 .m und 14:00 uhr .m durch.
2. Vorbereitung von Ratten auf die Operation
- Anästhesisieren Sie die Ratten 30 min mit Isofluran (4% für Induktion und 2% für die Wartung) und 24% Sauerstoff (1,5 l/min).
- Testen Sie das Niveau der Anästhesie bei den Ratten, indem Sie sicherstellen, dass sie keinen Pedalentzugsreflex haben.
- Setzen Sie den 24-Spur-Katheter in die Schwanzvene ein.
HINWEIS: Die Schwänewämt für vasodilatation wird nicht durchgeführt.- Legen Sie die Ratten auf den Tisch in einer supine Position. Verwenden Sie medizinisches Klebeband, um alle vier Gliedmaßen der Ratten anzubringen.
- Legen Sie die Sonde zur Temperaturmessung vor der Operation in das Rattenrektum.
- Während des Verfahrens eine Heizplatte pflegen, um eine Körpertemperatur von 37 °C zu unterstützen.
- Fügen Sie Salbe in beiden Augen der Ratte zum Schutz.
- Rasieren Sie den operationsischen Bereich und desinfizieren Sie mit drei Anwendungen von 10% Povidon-Jod gefolgt von 70% Isopropylalkohol.
3. Rechte Seite mittlere Zerebrale Arterie Okklusion
HINWEIS: MCAO wird durch eine modifizierte Technik durchgeführt, wie zuvor beschrieben16,22,23, mit der Verwendung von Instrumenten beschrieben von McGarry et al.24 und Ulua et al.25.
- Sezieren Sie die Haut und oberflächliche Faszien an der ventralen Mittellinie des Halses mit chirurgischer Pinzette und Schere mit gebogenen Klingen.
- Identifizieren Sie das Muskeldreieck, bestehend aus der ICA, der äußeren Halsschlagader (ECA) und der gemeinsamen Halsschlagader (CCA).
- Trennen Sie vorsichtig die richtige CCA und ICA vom Vagusnerv mit Mikrozangen für die Gefäßchirurgie.
- Stellen Sie die richtige CCA und die ICA zur Seite. Blockieren Sie den Blutfluss, der von der CCA zur ICA kommt, entweder mit Mikroclips oder speziellen Tourniquets für die Gefäßchirurgie. Machen Sie einen Schnitt (ca. 1 mm) auf der ICA mit Mikroschere für die Gefäßchirurgie.
- Legen Sie einen Monofilamentkatheter (4-0 Nylon) direkt durch die ICA, ca. 18,5-19 mm vom Bifurkationspunkt des rechten CCA in den Kreis von Willis, bis sie einen leichten Widerstand erreichen, um den MCA26zu verschließen.
- Ligate um die ICA über der Bifurkation von CCA.
- Führen Sie für die scheinbetriebene Steuerungsgruppe ein Einsetzen von Nylongewinde anstelle der Schritte 3.5 und 3.616,22.
- 5 ml 0,9% Natriumchlorid durch intraperitoneale Injektion verabreichen.
- Schließen Sie die Wunde durch Naht und bringen Sie die Ratte in einen Erholungsbereich.
HINWEIS: Wenige Minuten nach dem Ende der Anästhesie wacht die Ratte auf und bewegt sich selbstständig um den Käfig. - Bei 23 h nach MCAO 2% Evans blau in Salin (4 ml/kg)23,26 in die Schwanzvene für beide operierten Gruppen über eine Kanüle27injizieren.
HINWEIS: Dies wird als Blut -Hirn-Permeability-Tracer verwendet. 60 Minuten zirkulieren lassen.
4. Bestimmung der Infarktzone
- Messen Sie IZ bei 24 h nach MCAO, wie zuvor beschrieben9,15,18,19,26.
HINWEIS: Ratten, die mehr als 20% ihres Gewichts verloren haben oder Anfälle oder Hemiplegie entwickelt haben, sind vom Experiment ausgeschlossen. - Euthanisieren Sie die Ratte, indem Sie das inspirierte Gasgemisch durch 20% Sauerstoff und 80% Kohlendioxid ersetzen, bis die Ratte aufhört, spontan zu atmen.
- Öffnen Sie die Brust mit einem 5-6 cm seitlichen Schnitt durch die Bauchwand unter dem Rippenkäfig mit Schere und chirurgischen Zangen.
- Führen Sie einen Zwerchfellschnitt entlang der gesamten Länge des Rippenkäfigs mit Schere und chirurgischen Zangen durch.
- Sorgfältige Verdrängung der Lunge, durch schneiden Sie durch den Rippenkäfig bis zum Schlüsselbein auf der rechten und linken Seite28.
- Durchdieseln Sie mit 200 ml normaler Saline durch die linke Herzkammer.
- Punktieren oder Incise das rechte Vorhof des Herzens mit der Schere.
- Enthauptung mit einer Guillotine durchführen und Hirngewebe sammeln.
- Mit Irisschere, von der Foramen magnum bis zum distalen Rand der hinteren Schädeloberfläche auf beiden Seiten geschnitten.
- Trennen Sie die Riechbirnen, nervöse Verbindungen entlang der ventralen Oberfläche und dorsale Oberfläche des Schädels vom Gehirn.
- Entfernen Sie das Gehirn aus dem Kopf.
- Produzieren Sie 6 Gehirnscheiben, indem Sie 2 mm dicke horizontale Abschnitte mit einem .009" Edelstahl, unbeschichtet, einrandige Rasierklinge.
- 30 min bei 37 °C in 0,05% TTC inkubieren.
- Legen Sie das Hirngewebe auf die Mikroskopdias und führen Sie ein optisches Scannen dieser 6 Gehirnscheiben mit einer Auflösung von 1600x1600 dpi durch (siehe z. B. Beilage 1).
- Fügen Sie einen blauen Filter mit einem Fotoeditor (z. B. Adobe Photoshop CS2) mit der Kanalmixer-Funktion (Bild > Anpassungen > Kanalmixer)hinzu und speichern Sie das Bild als JPEG-Dateiformat.
HINWEIS: Nach dem Anwenden des blauen Filters wird das Bild grauskaliert angezeigt. - Öffnen Sie das gespeicherte Bild in ImageJ 1.37v29,30.
HINWEIS: Dieses Computerprogramm verwendet eine Schwellenwertfunktion, um die Pixel zu isolieren und zu berechnen, die entweder schwarz oder weiß sind (siehe Abbildung 1). - Wählen Sie für jede der 6 Gehirnscheiben des Bildes jede Hemisphäre (rechtsverletzte ipsilaterale und unverletzte Kontralaterale) als separate Bilddatei mit dem Werkzeug "Polygonauswahl" aus dem Hauptmenü aus und speichern Sie sie.
- Legen Sie den Cut-off für die Bestimmung von IZ fest, indem Sie eine automatische Schwellenwertfunktion aus dem Hauptmenü der ImageJ-Software verwenden, indem Sie Bild > Anpassen > Schwellenwertauswählen und die Anzahl der Pixel in jeder Hemisphäre eines einzelnen Gehirnsatzes messen.
HINWEIS: Makros können für diesen Schritt in der ImageJ-Software verwendet werden (siehe Ergänzung 2 für den Code). Der Cut-off ist ein kritischer Parameter, um zu bestimmen, welche Pixel in Weiß konvertiert werden sollen und welche je nach Grautoninton in Schwarz konvertiert werden sollen (siehe Ergänzung 3 und Ergänzung 4 als Beispiele). ImageJ vergleicht dann weiße und schwarze Pixel, um IZ zu bestimmen. Basierend auf den Färbeprotokollen und Scannereinstellungen haben wir einen konstanten Cut-off-Wert von 0,220 verwendet. - Führen Sie die Messung der IZ-Korrektur für Gewebeschwellungen mit den Verhältnissen der Ipsilateralen und Contralateralen Zerebralpwarten (RICH) Methode13,23 (siehe Beispiel in Supplement 5).
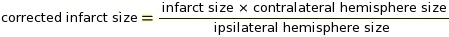
HINWEIS: Die Infarktgröße wird als Prozentsatz der kontralateralen Hemisphäre bewertet.
5. Bestimmung von Hirnödem31
HINWEIS: Verwenden Sie ImageJ 1.37v für die Messung von BE32,33.
- Messen Sie BE 24 h nach MCAO. Verwenden Sie für die Berechnung von BE die Daten aus dem volumen der linken und rechten Halbkugel (in Einheiten).
- Führen Sie optisches Scannen mit einer Auflösung von 1600x1600 dpi durch (siehe z. B. Beilage 1).
- Wählen Sie Gehirnhälften aus und setzen Sie den Cut-off zur Bestimmung von BE mit ImageJ 1.37v, wie oben in den Abschnitten 4.17-4.19 beschrieben.
- Geben Sie den BE-Bereich als Prozentsatz der Standardbereiche der nicht betroffenen kontralateralen Hemisphäre aus, berechnet nach der RICH-Methode unter Verwendung der folgenden Gleichung (siehe Beispiel in Beilage 5)23,34.

HINWEIS: Die Ausdehnung von BE wird als Prozentsatz der kontralateralen Hemisphäre bewertet.
6. Bestimmung der BBB-Störung
- Messen Sie BBB-Störung 24 h nach MCAO.
- Teilen Sie die rechte und linke Hemisphäre in sechs Scheiben und legen Sie jede in ein Mikrozentrifugenrohr.
- Homogenisieren Sie jede Scheibe des Hirngewebes in Trichloressigsäure, basierend auf der Berechnung von 1 g Hirngewebe in 4 ml 50% Trichloressigsäure.
- Zentrifuge bei 10.000 x g für 20 min.
- Verdünnt überstandflüssigkeit 1:3 mit 96% Ethanol.
- Durchführen von Lumineszenzspektrophotometrie durch den Einsatz von Spektrophotometrie-Software, die Installation der Platte und die Durchführung eines Probenmesswerts unter Verwendung der folgenden Parameter: Fluoreszenzintensitäts-Anregungswellenlänge von 620 nm (Bandbreite 10 nm) und eine Emissionswellenlänge von 680 nm (Bandbreite 10 nm)23,35 ; Mod-Top; Nummer Fleisch 25; Handbuch 100; Schütteln 1 Sek., 1 mm.
HINWEIS: Verwenden Sie eine Anregungswellenlänge von 620 nm (Bandbreite 10 nm) und eine Emissionswellenlänge von 680 nm (Bandbreite 10 nm). 23,35
Ergebnisse
Infarktzonenmessung
Ein t-Test mit unabhängiger Stichprobe ergab, dass 19 Ratten, die dauerhaften MCAO unterzogen wurden, eine signifikante Zunahme des Hirninfarktvolumens im Vergleich zu den 16 scheinbetriebenen Ratten zeigten (MCAO=7,49% ± 3,57 vs. Schein = 0,31% ± 1,9, t(28,49) = 7,56, p < 0,01 (siehe Abbildung 2A)). Die Daten werden als mittlerer Prozentsatz der kontralateralen Hemisphäre ± SD ausgedrückt.
Diskussion
Das Hauptziel des vorliegenden Protokolls bestand darin, konsistente Messungen von drei Hauptparametern ischämischer Verletzungen zu demonstrieren: IZ, BE und BBB-Permeabilität. Frühere Studien in diesem Bereich haben die Möglichkeit gezeigt, einen oder zwei dieser Parameter zusammen in derselben Stichprobe durchzuführen. Neben der Kostensenkung, die diese dreiteilige Methode bietet, bietet sie auch ein wünschenswerteres bioethisches Modell, das die Anzahl der Tiere begrenzt, die operiert und anschließend eingesch...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken Maryna Kuscheriava, Maksym Kryvonosov, Daryna Yakumenko und Evgenia Goncharyk von der Abteilung für Physiologie, Fakultät für Biologie, Ökologie und Medizin, Oles Honchar, Dnipro Universität, Dnipro, Ukraine für ihre Unterstützung und hilfreiche Beiträge zu unseren Diskussionen. Die gewonnenen Daten sind Teil der Dissertation von Ruslan Kuts.
Materialien
| Name | Company | Catalog Number | Comments |
| 2 mL Syringe | Braun | 4606027V | |
| 2% chlorhexidine in 70% alcohol solution | Sigma-Aldrich | 500 cc | Provides general antisepsis of the skin in the operatory field |
| 27 G Needle with Syringe | Braun | 305620 | |
| 3-0 Silk sutures | Henry Schein | 1007842 | |
| 4-0 Nylon suture | 4-00 | ||
| Brain & Tissue Matrices | Sigma-Aldrich | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 183603985447 | |
| Centrifuge Sigma 2-16P | Sigma-Aldrich | Sigma 2-16P | |
| Compact Analytical Balances | Sigma-Aldrich | HR-AZ/HR-A | |
| Digital weighing scale | Sigma-Aldrich | Rs 4,000 | |
| Dissecting scissors | Sigma-Aldrich | Z265969 | |
| Eppendorf pipette | Sigma-Aldrich | Z683884 | |
| Eppendorf tube | Sigma-Aldrich | EP0030119460 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | Model: Infinite 200 PRO multimode reader | Optional. |
| Fluorescence detector | Molecular Devices LLC | VWR cat. # 10822 512 SpectraMax Paradigm Multi Mode Microplate Reader Base Instrument | Optional. |
| Gauze sponges | Fisher | 22-362-178 | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Hemostatic microclips | Sigma-Aldrich | ||
| Horizon-XL | Mennen Medical Ltd | ||
| Infusion cuff | ABN | IC-500 | |
| Micro forceps | Sigma-Aldrich | ||
| Micro scissors | Sigma-Aldrich | ||
| Multiset | Teva Medical | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Operating forceps | Sigma-Aldrich | ||
| Operating scissors | Sigma-Aldrich | ||
| Optical scanner | Canon | Cano Scan 4200F | Resolution 3200 x 6400 dpi |
| Petri dishes | Sigma-Aldrich | P5606 | |
| Purina Chow | Purina | 5001 | Rodent laboratory chow given to rats, mice and hamster is a life-cycle nutrition that has been used in biomedical research for over 5 decades. Provided to rats ad libitum in this experiment. |
| Rat cages | Techniplast | 2000P | Conventional housing for rodents. Cages were used for housing rats throughout the experiment |
| Scalpel blades #11 | Sigma-Aldrich | S2771 | |
| Software | |||
| Adobe Photoshop CS2 for Windows | Adobe | ||
| ImageJ 1.37v | NIH | The source code is freely available. The author, Wayne Rasband (wayne@codon.nih.gov), is at the Research Services Branch, National Institute of Mental Health, Bethesda, Maryland, USA | |
| SPSS Statistics 22 | IBM | ||
| Office 365 ProPlus | Microsoft | - | Microsoft Office Excel |
| Windows 10 | Microsoft | ||
| Reagents | |||
| 2,3,5-Triphenyltetrazolium chloride | Sigma-Aldrich | 298-96-4 | |
| 50% trichloroacetic acid | Sigma-Aldrich | 76-03-9 | |
| Ethanol 96 % | Romical | Flammable liquid | |
| Evans blue 2% | Sigma-Aldrich | 314-13-6 | |
| Isoflurane, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 |
Referenzen
- Krishnamurthi, R. V., et al. Global and regional burden of first-ever ischaemic and haemorrhagic stroke during 1990-2010: findings from the Global Burden of Disease Study 2010. Lancet Global Health. 1, 259-281 (2013).
- Benjamin, E. J., et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 135, 146 (2017).
- Wilkins, E., et al. . European cardiovascular disease statistics 2017. , (2017).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Lloyd-Jones, D., et al. Heart disease and stroke statistics--2009 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation. 119, 480-486 (2009).
- Shigeno, T., McCulloch, J., Graham, D. I., Mendelow, A. D., Teasdale, G. M. Pure cortical ischemia versus striatal ischemia. Circulatory, metabolic, and neuropathologic consequences. Surgical Neurology. 24, 47-51 (1985).
- Albanese, V., Tommasino, C., Spadaro, A., Tomasello, F. A transbasisphenoidal approach for selective occlusion of the middle cerebral artery in rats. Experientia. 36, 1302-1304 (1980).
- Hudgins, W. R., Garcia, J. H. Transorbital approach to the middle cerebral artery of the squirrel monkey: a technique for experimental cerebral infarction applicable to ultrastructural studies. Stroke. 1, 107-111 (1970).
- Waltz, A. G., Sundt, T. M., Owen, C. A. Effect of middle cerebral artery occlusion on cortical blood flow in animals. Neurology. 16, 1185-1190 (1966).
- Tamura, A., Graham, D. I., McCulloch, J., Teasdale, G. M. Focal cerebral ischaemia in the rat: 1. Description of technique and early neuropathological consequences following middle cerebral artery occlusion. Journal of Cerebral Blood Flow & Metabolism. 1, 53-60 (1981).
- Aspey, B. S., Cohen, S., Patel, Y., Terruli, M., Harrison, M. J. Middle cerebral artery occlusion in the rat: consistent protocol for a model of stroke. Neuropathology and Applied Neurobiology. 24, 487-497 (1998).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20, 84-91 (1989).
- O'Brien, M. D., Jordan, M. M., Waltz, A. G. Ischemic cerebral edema and the blood-brain barrier. Distributions of pertechnetate, albumin, sodium, and antipyrine in brains of cats after occlusion of the middle cerebral artery. Archives of Neurology. 30, 461-465 (1974).
- Chen, C. H., Toung, T. J., Sapirstein, A., Bhardwaj, A. Effect of duration of osmotherapy on blood-brain barrier disruption and regional cerebral edema after experimental stroke. Journal of Cerebral Blood Flow & Metabolism. 26, 951-958 (2006).
- Boyko, M., et al. Establishment of Novel Technical Methods for Evaluating Brain Edema and Lesion Volume in Stroked Rats: a Standardization of Measurement Procedures. Brain Research. , (2019).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Sifat, A. E., Vaidya, B., Abbruscato, T. J. Blood-Brain Barrier Protection as a Therapeutic Strategy for Acute Ischemic Stroke. AAPS Journal. 19, 957-972 (2017).
- Jiang, X., et al. Blood-brain barrier dysfunction and recovery after ischemic stroke. Progress in Neurobiology. 163-164, 144-171 (2018).
- Belayev, L., Busto, R., Zhao, W., Ginsberg, M. D. Quantitative evaluation of blood-brain barrier permeability following middle cerebral artery occlusion in rats. Brain Research. 739, 88-96 (1996).
- Li, L., Yu, Q., Liang, W. Use of 2,3,5-triphenyltetrazolium chloride-stained brain tissues for immunofluorescence analyses after focal cerebral ischemia in rats. Pathology - Research and Practice. 214, 174-179 (2018).
- Kramer, M., et al. TTC staining of damaged brain areas after MCA occlusion in the rat does not constrict quantitative gene and protein analyses. Journal of Neuroscience Methods. 187, 84-89 (2010).
- Kuts, R., et al. A middle cerebral artery occlusion technique for inducing post-stroke depression in rats. Journal of Visualized Experiments. , e58875 (2019).
- Kuts, R., et al. A Novel Method for Assessing Cerebral Edema, Infarcted Zone and Blood-Brain Barrier Breakdown in a Single Post-stroke Rodent Brain. Frontiers in Neuroscience. 13, 1105 (2019).
- McGarry, B. L., Jokivarsi, K. T., Knight, M. J., Grohn, O. H. J., Kauppinen, R. A. A Magnetic Resonance Imaging Protocol for Stroke Onset Time Estimation in Permanent Cerebral Ischemia. Journal of Visualized Experiments. , e55277 (2017).
- Uluc, K., Miranpuri, A., Kujoth, G. C., Akture, E., Baskaya, M. K. Focal cerebral ischemia model by endovascular suture occlusion of the middle cerebral artery in the rat. Journal of Visualized Experiments. , e1978 (2011).
- Boyko, M., et al. The effect of blood glutamate scavengers oxaloacetate and pyruvate on neurological outcome in a rat model of subarachnoid hemorrhage. Neurotherapeutics. 9, 649-657 (2012).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. , e58875 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. , e3564 (2012).
- Poinsatte, K., et al. Quantification of neurovascular protection following repetitive hypoxic preconditioning and transient middle cerebral artery occlusion in mice. Journal of Visualized Experiments. , e52675 (2015).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (2018)
- Boyko, M., et al. Pyruvate's blood glutamate scavenging activity contributes to the spectrum of its neuroprotective mechanisms in a rat model of stroke. European Journal of Neuroscience. 34, 1432-1441 (2011).
- Collins, T. J. ImageJ for microscopy. Biotechniques. 43, 25-30 (2007).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (1997)
- Kaplan, B., et al. Temporal thresholds for neocortical infarction in rats subjected to reversible focal cerebral ischemia. Stroke. 22, 1032-1039 (1991).
- Kumai, Y., et al. Postischemic gene transfer of soluble Flt-1 protects against brain ischemia with marked attenuation of blood-brain barrier permeability. Journal of Cerebral Blood Flow & Metabolism. 27, 1152-1160 (2007).
- Schuleri, K. H., et al. Characterization of peri-infarct zone heterogeneity by contrast-enhanced multidetector computed tomography: a comparison with magnetic resonance imaging. Journal of the American College of Cardiology. 53, 1699-1707 (2009).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative Stress: A Key Modulator in Neurodegenerative Diseases. Molecules. 24, (2019).
- Di Napoli, M. Caplan's Stroke: A Clinical Approach. Journal of the American Medical Association. 302, 2600-2601 (2009).
- Deb, P., Sharma, S., Hassan, K. M. Pathophysiologic mechanisms of acute ischemic stroke: An overview with emphasis on therapeutic significance beyond thrombolysis. Pathophysiology. 17, 197-218 (2010).
- Simard, J. M., Kent, T. A., Chen, M., Tarasov, K. V., Gerzanich, V. Brain oedema in focal ischaemia: molecular pathophysiology and theoretical implications. Lancet Neurology. 6, 258-268 (2007).
- Klatzo, I. Pathophysiological aspects of brain edema. Acta Neuropathology. 72, 236-239 (1987).
- Yang, Y., Rosenberg, G. A. Blood-brain barrier breakdown in acute and chronic cerebrovascular disease. Stroke. 42, 3323-3328 (2011).
- Lin, T. N., He, Y. Y., Wu, G., Khan, M., Hsu, C. Y. Effect of brain edema on infarct volume in a focal cerebral ischemia model in rats. Stroke. 24, 117-121 (1993).
- Liu, C., et al. Increased blood-brain barrier permeability in contralateral hemisphere predicts worse outcome in acute ischemic stroke after reperfusion therapy. Journal of NeuroInterventional Surgery. 10, 937-941 (2018).
- Boyko, M., et al. Establishment of novel technical methods for evaluating brain edema and lesion volume in stroked rats: A standardization of measurement procedures. Brain Research. 1718, 12-21 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten