Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Medición del edema cerebral post-accidente cerebrovascular, zona infarta y descomposición de la barrera hematoencefálica en un solo conjunto de muestras cerebrales de roedores
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe una novedosa técnica de medir los tres parámetros más importantes de la lesión cerebral isquémica en el mismo conjunto de muestras cerebrales de roedores. El uso de una sola muestra cerebral es altamente ventajoso en términos de costos éticos y económicos.
Resumen
Una de las causas más comunes de morbilidad y mortalidad en todo el mundo es el accidente cerebrovascular isquémico. Históricamente, un modelo animal utilizado para estimular el accidente cerebrovascular isquémico implica oclusión arterial cerebral media (MCAO). La zona infarta, el edema cerebral y la descomposición de la barrera hematoencefálica (BBB) se miden como parámetros que reflejan el alcance de la lesión cerebral después del MCAO. Una limitación significativa a este método es que estas mediciones se obtienen normalmente en diferentes muestras de cerebro de rata, lo que conduce a cargas éticas y financieras debido al gran número de ratas que necesitan ser eutanasiadas para un tamaño de muestra adecuado. Aquí presentamos un método para evaluar con precisión las lesiones cerebrales después de MCAO midiendo la zona infarta, el edema cerebral y la permeabilidad bbb en el mismo conjunto de cerebros de ratas. Esta novedosa técnica proporciona una manera más eficiente de evaluar la fisiopatología del accidente cerebrovascular.
Introducción
Una de las causas más comunes de morbilidad y mortalidad en todo el mundo es el accidente cerebrovascular. A nivel mundial, el accidente cerebrovascular isquémico representa el 68% de todos los casos de accidente cerebrovascular, mientras que en los Estados Unidos el accidente cerebrovascular isquémico representa el 87% de los casos de accidente cerebrovascular1,2. Se estima que la carga económica del ictus alcanza los 34.000 millones de dólares en los Estados Unidos2.000 millones de dólares y los 45.000 millones de euros en la Unión Europea3. Los modelos animales de ictus son necesarios para estudiar su fisiopatología, desarrollar nuevos métodos de evaluación y proponer nuevas opciones terapéuticas4.
El accidente cerebrovascular isquémico ocurre con oclusión de una arteria cerebral importante, generalmente la arteria cerebral media o una de sus ramas5. Así, los modelos de accidente cerebrovascular isquémico han implicado históricamente oclusión arterial cerebral media (MCAO)6,7,8,9,10,11,12. Después de MCAO, las lesiones neurológicas se evalúan con mayor frecuencia midiendo la zona infarta (IZ) utilizando un método de tinción de cloruro de 2,3,5 tripfeniltrazolium (TTC)13,edema cerebral (BE) usando14, 15,16,y la permeabilidad de la barrera hemisférica de la barrera hemisférica de la sangre (BBB) mediante una técnica de espectrometría utilizando las manchas azules evans17,18,19.
El método tradicional MCAO utiliza conjuntos separados de cerebros para cada una de las tres mediciones cerebrales. Para un gran tamaño de muestra, esto resulta en un número significativo de animales eutanasiados, con consideraciones éticas y financieras añadidas. Un método alternativo para aliviar estos costos implicaría mediciones de los tres parámetros en un solo conjunto de cerebros de roedores post-MCAO.
Se han realizado intentos anteriores para medir combinaciones de parámetros en la misma muestra cerebral. Se han descrito métodos de tinción inmunofluorescentes simultáneas20, así como otros análisis moleculares y bioquímicos21 después de la tinción de TTC en la misma muestra cerebral. Hemos calculado previamente los volúmenes del hemisferio cerebral para evaluar el edema cerebral y hemos realizado manchas de TTC para calcular la zona infarta en el mismo cerebro establecido15.
En el protocolo actual, presentamos una técnica de MCAO modificada que mide la lesión cerebral isquémica a través de la determinación de la permeabilidad iz, BE y BBB en el mismo conjunto de cerebros de roedores. Iz se mide mediante tinción TTC, BE se determina calculando el volumen hemisférico, y la permeabilidad BBB se obtiene mediante métodos de espectrometría19. En este protocolo, utilizamos un modelo MCAO modificado, basado en la inserción directa y fijación del catéter monofilamento en la arteria carótida interna (ICA) y el bloqueo adicional del flujo sanguíneo a la arteria cerebral media (MCA)22. Este método modificado muestra una disminución de la tasa de mortalidad y morbilidad en comparación con el método tradicional MCAO16,22.
Este nuevo enfoque proporciona un modelo financieramente sólido y ético para medir lesiones neurológicas después de MCAO. Esta evaluación de los principales parámetros de la lesión cerebral isquémica ayudará a investigar exhaustivamente su fisiopatología.
Protocolo
Los siguientes procedimientos se llevaron a cabo de acuerdo con las recomendaciones de la Declaración de Helsinki y Tokio y las Directrices para el uso de animales experimentales de la Comunidad Europea. Los experimentos también fueron aprobados por el Comité de Cuidado animal de la Universidad Ben-Gurion del Negev.
1. Preparación de ratas para el procedimiento experimental
- Seleccione ratas macho sprague-dawley adultas sin patología excesiva, cada una con un peso de entre 300 y 350 g.
- Mantenga todas las ratas a temperatura ambiente a 22 °C, con 12 horas de ciclos claros y oscuros antes del experimento.
- Asegúrese de que los alimentos y el agua estén disponibles ad libitum.
- Realice todos los procedimientos entre las 6:00 a.m. y las 2:00 p.m.
2. Preparación de ratas para cirugía
- Anestesiar las ratas durante 30 min con isoflurano (4% para inducción y 2% para mantenimiento) y 24% oxígeno (1,5 L/min).
- Pruebe el nivel de anestesia en las ratas asegurándose de que no tengan un reflejo de abstinencia del pedal.
- Inserte el catéter del calibre 24 en la vena de la cola.
NOTA: El calentamiento de la cola para vasodilatación no se realiza.- Coloque las ratas sobre la mesa en posición supina. Utilice cinta médica para colocar las cuatro extremidades de las ratas.
- Coloque la sonda para medir la temperatura en el recto de la rata antes de la cirugía.
- Durante el procedimiento, mantenga una placa de calentamiento para soportar una temperatura corporal del núcleo de 37 °C.
- Agregue ungüento en ambos ojos de la rata para protegerse.
- Afeitar el área quirúrgica y desinfectar con tres aplicaciones de 10% povidone-yodo seguido de 70% alcohol isopropílico.
3. Oclusión de la arteria cerebral media derecha
NOTA: MCAO se realiza mediante una técnica modificada, como se describió anteriormente16,22,23, con el uso de instrumentos descritos por McGarry et al.24 y Uluç et al.25.
- Disecciona la piel y la fascia superficial en la línea media ventral del cuello con pinzas quirúrgicas y tijeras con cuchillas curvas.
- Identificar el triángulo muscular, formado por el ICA, la arteria carótida externa (ECA) y la arteria carótida común (CCA).
- Separe cuidadosamente el CCA y el ICA correctos del nervio vago con microaplicaps para la cirugía vascular.
- Exponga el CCA y el ICA correctos. Bloquee el flujo sanguíneo que proviene de la CCA al ICA utilizando micro-clips o torniquetes especiales para cirugía vascular. Haga una incisión (aproximadamente 1 mm) en el ICA usando microscisores para cirugía vascular.
- Inserte un catéter monofilamento (nylon 4-0) directamente a través del ICA, aproximadamente 18,5-19 mm desde el punto de bifurcación de la CCA derecha en el círculo de Willis hasta alcanzar una resistencia leve, para ocultar el MCA26.
- Ligar alrededor del ICA por encima de la bifurcación de CCA.
- Para el grupo de control operado por sham, realice una inserción de hilo de nylon en lugar de los pasos 3.5 y 3.616,22.
- Administrar 5 ml de cloruro de sodio al 0,9% mediante inyección intraperitoneal.
- Cierre la herida por sutura y lleve a la rata a un área de recuperación.
NOTA: Unos minutos después del final de la anestesia, la rata se despertará y se moverá independientemente alrededor de la jaula. - A las 23 h después de MCAO, inyectar 2% Evans azul en solución salina (4 mL/kg)23,26 en la vena trasera para ambos grupos operados a través de una cánula27.
NOTA: Esto se utiliza como un trazador de permeabilidad cerebro-sangre. Dejar circular durante 60 minutos.
4. Determinación de la zona infarta
- Medir IZ a las 24 h después de MCAO como se describió anteriormente9,15,18,19,26.
NOTA: Las ratas que perdieron más del 20% de su peso o desarrollaron convulsiones o hemiplejia están excluidas del experimento. - Eutanasia a la rata reemplazando la mezcla de gas inspirada por un 20% de oxígeno y un 80% de dióxido de carbono hasta que la rata deje de respirar espontáneamente.
- Abra el pecho con una incisión lateral de 5-6 cm a través de la pared abdominal debajo de la caja torácica con tijeras y fórceps quirúrgicos.
- Realice una incisión diafragmática a lo largo de toda la longitud de la caja torácica con tijeras y fórceps quirúrgicos.
- Desplazar cuidadosamente los pulmones, cortar a través de la caja torácica hasta la clavícula en los lados derecho e izquierdo28.
- Perfuso con 200 ml de solución salina normal a través del ventrículo izquierdo del corazón.
- Pinchazo o incienso el atrio derecho del corazón con tijeras.
- Realiza la decapitación usando una guillotina y recoge tejido cerebral.
- Usando tijeras de iris, corta desde el antenombre hasta el borde distal de la superficie posterior del cráneo en ambos lados.
- Separa las bombillas olfativas, las conexiones nerviosas a lo largo de la superficie ventral y la superficie dorsal del cráneo del cerebro.
- Extraiga el cerebro de la cabeza.
- Produzca 6 rebanadas cerebrales creando secciones horizontales de 2 mm de espesor con una hoja de afeitar de .009", sin recubrimiento y de un solo borde.
- Incubar durante 30 min a 37 °C en 0.05% TTC.
- Coloque el tejido cerebral en las diapositivas del microscopio y realice la exploración óptica de estas 6 rebanadas cerebrales con una resolución de 1600x1600 dpi (ver Suplemento 1 por ejemplo).
- Añada un filtro azul con un editor de fotos (por ejemplo, Adobe Photoshop CS2) utilizando la función Mezclador de canales(Imagen > Ajustes > Mezclador de canales)y guarde la imagen como formato de archivo JPEG.
NOTA: Después de aplicar el filtro azul, la imagen aparecerá en escala de grises. - Abra la imagen guardada en ImageJ 1.37v29,30.
NOTA: Este programa informático utiliza una función de umbral para aislar y calcular los píxeles que son en blanco o negro (consulte la figura 1). - Para cada uno de los 6 sectores cerebrales de la imagen, seleccione y guarde cada hemisferio (ipsilateral lesionado derecho e contralateral izquierdo sin lesiones) como un archivo de imagen independiente utilizando la herramienta "selección de polígonos" del menú principal.
- Establezca el límite para determinar IZ mediante una función de umbral automático en el menú principal del software ImageJ seleccionando Imagen > Ajustar > Umbraly mida el número de píxeles en cada hemisferio de un solo conjunto cerebral.
NOTA: Las macros se pueden utilizar para este paso en el software ImageJ (consulte suplemento 2 para el código). El corte es un parámetro crítico para determinar qué píxeles convertir al blanco y qué convertir al negro dependiendo del tono de gris (consulte Suplemento 3 y Suplemento 4 como ejemplos). A continuación, ImageJ compara píxeles blancos y negros para determinar IZ. Basándonos en el protocolo de tinción y la configuración del escáner, usamos un valor de corte constante de 0,220. - Realizar la medición de la corrección de IZ para la hinchazón del tejido utilizando las relaciones de los hemisferios cerebrales ipsilaterales y contralaterales (RICH) método13,23 (ver ejemplo en suplemento 5).
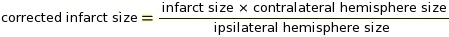
NOTA: El tamaño infarto se evalúa como un porcentaje del hemisferio contralateral.
5. Determinación del edema cerebral31
NOTA: Utilice ImageJ 1.37v para la medición de BE32,33.
- Mida BE 24 h después de MCAO. Para el cálculo de BE, utilice los datos del volumen del hemisferio izquierdo y derecho (en unidades).
- Realice el escaneo óptico con una resolución de 1600x1600 ppp (consulte suplemento 1, por ejemplo).
- Seleccione los hemisferios cerebrales y establezca el corte para determinar BE con ImageJ 1.37v, como se describió anteriormente en las secciones 4.17-4.19.
- Exprese el área BE como porcentaje de las áreas estándar del hemisferio contralateral no afectado, calculada por el método RICH utilizando la siguiente ecuación (véase el ejemplo en Suplemento 5)23,34.

NOTA: La extensión de BE se evalúa como un porcentaje del hemisferio contralateral.
6. Determinación de la interrupción del BBB
- Mida la interrupción de BBB 24 h después de MCAO.
- Divida los hemisferios derecho e izquierdo en seis rebanadas y coloque cada uno en un tubo de microcentrífuga.
- Homogeneizar cada rebanada del tejido cerebral en ácido tricloroacético, basado en el cálculo de 1 g de tejido cerebral en 4 ml de ácido tricloroacético al 50%.
- Centrífuga a 10.000 x g durante 20 min.
- Diluir líquido sobrenadante 1:3 con 96% etanol.
- Realice espectrofotometría de luminiscencia utilizando software de espectrofotometría, instalando la placa y realizando una lectura de muestra utilizando los siguientes parámetros: Longitud de onda de excitación de intensidad de fluorescencia de 620 nm (ancho de banda 10 nm) y una longitud de onda de emisión de 680 nm (ancho de banda 10 nm)23,35 ; Mod superior; Número Carne 25; Manual 100; Agitar 1 s, 1 mm.
NOTA: Utilice una longitud de onda de excitación de 620 nm (ancho de banda 10 nm) y una longitud de onda de emisión de 680 nm (ancho de banda 10 nm). 23,35
Resultados
Medición de zona infarto
Una prueba t de muestra independiente indicó que 19 ratas que se sometieron a MCAO permanente demostraron un aumento significativo en el volumen de infartos cerebrales en comparación con las 16 ratas operadas por sham (MCAO=7.49% ± 3.57 contra. Sham = 0,31% ± 1,9, t(28,49) = 7,56, p < 0,01 (véase la Figura 2A)). Los datos se expresan como un porcentaje medio del hemisferio contralateral ± SD.
<...Discusión
El objetivo principal del presente protocolo era demostrar mediciones consistentes de tres parámetros principales de lesión isquémica: IZ, BE y BBB permeabilidad. Estudios previos en este campo han demostrado la posibilidad de realizar uno o dos de estos parámetros juntos en la misma muestra. Además de la reducción de costes que ofrece este método de tres partes, también proporciona un modelo bioético más deseable que limita el número de animales que deben ser operados y posteriormente eutanasiados. Al igual q...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Maryna Kuscheriava, Maksym Kryvonosov, Daryna Yakumenko y Evgenia Goncharyk del Departamento de Fisiología, Facultad de Biología, Ecología y Medicina, Oles Honchar, Universidad Dnipro, Dnipro, Ucrania por su apoyo y contribuciones útiles a nuestros debates. Los datos obtenidos forman parte de la tesis doctoral de Ruslan Kuts.
Materiales
| Name | Company | Catalog Number | Comments |
| 2 mL Syringe | Braun | 4606027V | |
| 2% chlorhexidine in 70% alcohol solution | Sigma-Aldrich | 500 cc | Provides general antisepsis of the skin in the operatory field |
| 27 G Needle with Syringe | Braun | 305620 | |
| 3-0 Silk sutures | Henry Schein | 1007842 | |
| 4-0 Nylon suture | 4-00 | ||
| Brain & Tissue Matrices | Sigma-Aldrich | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 183603985447 | |
| Centrifuge Sigma 2-16P | Sigma-Aldrich | Sigma 2-16P | |
| Compact Analytical Balances | Sigma-Aldrich | HR-AZ/HR-A | |
| Digital weighing scale | Sigma-Aldrich | Rs 4,000 | |
| Dissecting scissors | Sigma-Aldrich | Z265969 | |
| Eppendorf pipette | Sigma-Aldrich | Z683884 | |
| Eppendorf tube | Sigma-Aldrich | EP0030119460 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | Model: Infinite 200 PRO multimode reader | Optional. |
| Fluorescence detector | Molecular Devices LLC | VWR cat. # 10822 512 SpectraMax Paradigm Multi Mode Microplate Reader Base Instrument | Optional. |
| Gauze sponges | Fisher | 22-362-178 | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Hemostatic microclips | Sigma-Aldrich | ||
| Horizon-XL | Mennen Medical Ltd | ||
| Infusion cuff | ABN | IC-500 | |
| Micro forceps | Sigma-Aldrich | ||
| Micro scissors | Sigma-Aldrich | ||
| Multiset | Teva Medical | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Operating forceps | Sigma-Aldrich | ||
| Operating scissors | Sigma-Aldrich | ||
| Optical scanner | Canon | Cano Scan 4200F | Resolution 3200 x 6400 dpi |
| Petri dishes | Sigma-Aldrich | P5606 | |
| Purina Chow | Purina | 5001 | Rodent laboratory chow given to rats, mice and hamster is a life-cycle nutrition that has been used in biomedical research for over 5 decades. Provided to rats ad libitum in this experiment. |
| Rat cages | Techniplast | 2000P | Conventional housing for rodents. Cages were used for housing rats throughout the experiment |
| Scalpel blades #11 | Sigma-Aldrich | S2771 | |
| Software | |||
| Adobe Photoshop CS2 for Windows | Adobe | ||
| ImageJ 1.37v | NIH | The source code is freely available. The author, Wayne Rasband (wayne@codon.nih.gov), is at the Research Services Branch, National Institute of Mental Health, Bethesda, Maryland, USA | |
| SPSS Statistics 22 | IBM | ||
| Office 365 ProPlus | Microsoft | - | Microsoft Office Excel |
| Windows 10 | Microsoft | ||
| Reagents | |||
| 2,3,5-Triphenyltetrazolium chloride | Sigma-Aldrich | 298-96-4 | |
| 50% trichloroacetic acid | Sigma-Aldrich | 76-03-9 | |
| Ethanol 96 % | Romical | Flammable liquid | |
| Evans blue 2% | Sigma-Aldrich | 314-13-6 | |
| Isoflurane, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 |
Referencias
- Krishnamurthi, R. V., et al. Global and regional burden of first-ever ischaemic and haemorrhagic stroke during 1990-2010: findings from the Global Burden of Disease Study 2010. Lancet Global Health. 1, 259-281 (2013).
- Benjamin, E. J., et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 135, 146 (2017).
- Wilkins, E., et al. . European cardiovascular disease statistics 2017. , (2017).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Lloyd-Jones, D., et al. Heart disease and stroke statistics--2009 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation. 119, 480-486 (2009).
- Shigeno, T., McCulloch, J., Graham, D. I., Mendelow, A. D., Teasdale, G. M. Pure cortical ischemia versus striatal ischemia. Circulatory, metabolic, and neuropathologic consequences. Surgical Neurology. 24, 47-51 (1985).
- Albanese, V., Tommasino, C., Spadaro, A., Tomasello, F. A transbasisphenoidal approach for selective occlusion of the middle cerebral artery in rats. Experientia. 36, 1302-1304 (1980).
- Hudgins, W. R., Garcia, J. H. Transorbital approach to the middle cerebral artery of the squirrel monkey: a technique for experimental cerebral infarction applicable to ultrastructural studies. Stroke. 1, 107-111 (1970).
- Waltz, A. G., Sundt, T. M., Owen, C. A. Effect of middle cerebral artery occlusion on cortical blood flow in animals. Neurology. 16, 1185-1190 (1966).
- Tamura, A., Graham, D. I., McCulloch, J., Teasdale, G. M. Focal cerebral ischaemia in the rat: 1. Description of technique and early neuropathological consequences following middle cerebral artery occlusion. Journal of Cerebral Blood Flow & Metabolism. 1, 53-60 (1981).
- Aspey, B. S., Cohen, S., Patel, Y., Terruli, M., Harrison, M. J. Middle cerebral artery occlusion in the rat: consistent protocol for a model of stroke. Neuropathology and Applied Neurobiology. 24, 487-497 (1998).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20, 84-91 (1989).
- O'Brien, M. D., Jordan, M. M., Waltz, A. G. Ischemic cerebral edema and the blood-brain barrier. Distributions of pertechnetate, albumin, sodium, and antipyrine in brains of cats after occlusion of the middle cerebral artery. Archives of Neurology. 30, 461-465 (1974).
- Chen, C. H., Toung, T. J., Sapirstein, A., Bhardwaj, A. Effect of duration of osmotherapy on blood-brain barrier disruption and regional cerebral edema after experimental stroke. Journal of Cerebral Blood Flow & Metabolism. 26, 951-958 (2006).
- Boyko, M., et al. Establishment of Novel Technical Methods for Evaluating Brain Edema and Lesion Volume in Stroked Rats: a Standardization of Measurement Procedures. Brain Research. , (2019).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Sifat, A. E., Vaidya, B., Abbruscato, T. J. Blood-Brain Barrier Protection as a Therapeutic Strategy for Acute Ischemic Stroke. AAPS Journal. 19, 957-972 (2017).
- Jiang, X., et al. Blood-brain barrier dysfunction and recovery after ischemic stroke. Progress in Neurobiology. 163-164, 144-171 (2018).
- Belayev, L., Busto, R., Zhao, W., Ginsberg, M. D. Quantitative evaluation of blood-brain barrier permeability following middle cerebral artery occlusion in rats. Brain Research. 739, 88-96 (1996).
- Li, L., Yu, Q., Liang, W. Use of 2,3,5-triphenyltetrazolium chloride-stained brain tissues for immunofluorescence analyses after focal cerebral ischemia in rats. Pathology - Research and Practice. 214, 174-179 (2018).
- Kramer, M., et al. TTC staining of damaged brain areas after MCA occlusion in the rat does not constrict quantitative gene and protein analyses. Journal of Neuroscience Methods. 187, 84-89 (2010).
- Kuts, R., et al. A middle cerebral artery occlusion technique for inducing post-stroke depression in rats. Journal of Visualized Experiments. , e58875 (2019).
- Kuts, R., et al. A Novel Method for Assessing Cerebral Edema, Infarcted Zone and Blood-Brain Barrier Breakdown in a Single Post-stroke Rodent Brain. Frontiers in Neuroscience. 13, 1105 (2019).
- McGarry, B. L., Jokivarsi, K. T., Knight, M. J., Grohn, O. H. J., Kauppinen, R. A. A Magnetic Resonance Imaging Protocol for Stroke Onset Time Estimation in Permanent Cerebral Ischemia. Journal of Visualized Experiments. , e55277 (2017).
- Uluc, K., Miranpuri, A., Kujoth, G. C., Akture, E., Baskaya, M. K. Focal cerebral ischemia model by endovascular suture occlusion of the middle cerebral artery in the rat. Journal of Visualized Experiments. , e1978 (2011).
- Boyko, M., et al. The effect of blood glutamate scavengers oxaloacetate and pyruvate on neurological outcome in a rat model of subarachnoid hemorrhage. Neurotherapeutics. 9, 649-657 (2012).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. , e58875 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. , e3564 (2012).
- Poinsatte, K., et al. Quantification of neurovascular protection following repetitive hypoxic preconditioning and transient middle cerebral artery occlusion in mice. Journal of Visualized Experiments. , e52675 (2015).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (2018)
- Boyko, M., et al. Pyruvate's blood glutamate scavenging activity contributes to the spectrum of its neuroprotective mechanisms in a rat model of stroke. European Journal of Neuroscience. 34, 1432-1441 (2011).
- Collins, T. J. ImageJ for microscopy. Biotechniques. 43, 25-30 (2007).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (1997)
- Kaplan, B., et al. Temporal thresholds for neocortical infarction in rats subjected to reversible focal cerebral ischemia. Stroke. 22, 1032-1039 (1991).
- Kumai, Y., et al. Postischemic gene transfer of soluble Flt-1 protects against brain ischemia with marked attenuation of blood-brain barrier permeability. Journal of Cerebral Blood Flow & Metabolism. 27, 1152-1160 (2007).
- Schuleri, K. H., et al. Characterization of peri-infarct zone heterogeneity by contrast-enhanced multidetector computed tomography: a comparison with magnetic resonance imaging. Journal of the American College of Cardiology. 53, 1699-1707 (2009).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative Stress: A Key Modulator in Neurodegenerative Diseases. Molecules. 24, (2019).
- Di Napoli, M. Caplan's Stroke: A Clinical Approach. Journal of the American Medical Association. 302, 2600-2601 (2009).
- Deb, P., Sharma, S., Hassan, K. M. Pathophysiologic mechanisms of acute ischemic stroke: An overview with emphasis on therapeutic significance beyond thrombolysis. Pathophysiology. 17, 197-218 (2010).
- Simard, J. M., Kent, T. A., Chen, M., Tarasov, K. V., Gerzanich, V. Brain oedema in focal ischaemia: molecular pathophysiology and theoretical implications. Lancet Neurology. 6, 258-268 (2007).
- Klatzo, I. Pathophysiological aspects of brain edema. Acta Neuropathology. 72, 236-239 (1987).
- Yang, Y., Rosenberg, G. A. Blood-brain barrier breakdown in acute and chronic cerebrovascular disease. Stroke. 42, 3323-3328 (2011).
- Lin, T. N., He, Y. Y., Wu, G., Khan, M., Hsu, C. Y. Effect of brain edema on infarct volume in a focal cerebral ischemia model in rats. Stroke. 24, 117-121 (1993).
- Liu, C., et al. Increased blood-brain barrier permeability in contralateral hemisphere predicts worse outcome in acute ischemic stroke after reperfusion therapy. Journal of NeuroInterventional Surgery. 10, 937-941 (2018).
- Boyko, M., et al. Establishment of novel technical methods for evaluating brain edema and lesion volume in stroked rats: A standardization of measurement procedures. Brain Research. 1718, 12-21 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados