JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
설치류 뇌 샘플의 단일 세트에서 뇌졸중 후 뇌 부종, 경색 영역 및 혈액 뇌 장벽 고장 측정
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 설치류 뇌 샘플의 동일한 세트에서 허혈성 뇌 손상의 세 가지 가장 중요한 매개 변수를 측정하는 새로운 기술을 설명합니다. 하나의 뇌 샘플만 사용하는 것은 윤리적 및 경제적 비용 면에서 매우 유리합니다.
초록
전 세계적으로 사망률과 사망률의 가장 흔한 원인 중 하나는 허혈성 뇌졸중입니다. 역사적으로, 허혈성 뇌졸중을 자극하는 데 사용되는 동물 모델은 중간 뇌동맥 폐색(MCAO)을 포함한다. 경색 영역, 뇌 부종 및 혈액 뇌 장벽 (BBB) 고장은 MCAO 후 뇌 손상의 정도를 반영하는 매개 변수로 측정됩니다. 이 방법에 대한 중요한 제한은 이러한 측정이 일반적으로 다른 쥐 뇌 샘플에서 얻어져 적절한 샘플 크기에 대해 안락사해야 하는 많은 수의 쥐로 인해 윤리적 및 재정적 부담을 초래한다는 것입니다. 여기서 우리는 쥐 두뇌의 동일한 세트에서 경색 영역, 뇌 부종 및 BBB 투과성을 측정하여 MCAO 다음 뇌 손상을 정확하게 평가하는 방법을 제시합니다. 이 새로운 기술은 뇌졸중의 병리생리학을 평가하는 보다 효율적인 방법을 제공합니다.
서문
전 세계적으로 사망률과 사망률의 가장 흔한 원인 중 하나는 뇌졸중입니다. 전 세계적으로 허혈성 뇌졸중은 모든 뇌졸중 사례의 68%를 나타내며, 미국에서는 허혈성 뇌졸중이뇌졸중사례1,2의87%를 차지합니다. 미국의 뇌졸중 경제적 부담은 미국2억 4천만 달러, 유럽연합3에서450억 유로에 달하는 것으로 추산된다. 뇌졸중의 동물 모델은 병리 생리학을 연구하고, 평가를 위한 새로운 방법을 개발하고, 새로운 치료 옵션을 제안하기 위해 필요하다4.
허혈성 뇌졸중은 주요 뇌동맥의 폐색, 보통 중간 뇌동맥 또는 그 가지5중 하나를 다듬어 발생한다. 따라서, 허혈성 뇌졸중의 모델은 역사적으로 중뇌 동맥 폐색(MCAO)6, 7,8,9,10,11,12를포함하였다. MCAO에 이어, 신경상해는 2,3,5-triphenyltetrazolium 염화 (TTC) 염색 방법을 사용하여 광원 영역 (IZ)을 측정하여 가장 일반적으로 평가된다13,뇌 부종 (BE) 건조 또는 계산 반구체 볼륨을 사용하여14,15,16,및 혈액 뇌 장벽 (BBB) 천피법 기술을 사용하여19,19
전통적인 MCAO 방법은 세 가지 뇌 측정각각에 대해 별도의 뇌 세트를 사용합니다. 큰 샘플 크기의 경우, 이것은 윤리적 및 재정적 고려 사항과 함께 상당한 수의 안락사 동물을 초래합니다. 이러한 비용을 완화하는 다른 방법은 MCAO 이후 설치류 두뇌의 단일 세트에서 세 가지 매개 변수의 측정을 포함한다.
동일한 뇌 샘플에서 매개 변수의 조합을 측정하기 위해 이전 시도가 이루어졌습니다. 동시 면역형성 염색방법(20)뿐만 아니라 다른 분자 및 생화학적분석(21)은 TTC가 동일한 뇌 샘플에서 염색한 후 설명되었다. 우리는 이전에 뇌 부종을 평가하기 위해 뇌 반구 볼륨을 계산하고 같은 뇌 세트15에서광원 영역을 계산하기 위해 TTC 염색을 수행했다.
본 프로토콜에서는 동일한 설치류 뇌 세트에서 IZ, BE 및 BBB 투과성을 결정하여 허혈성 뇌 손상을 측정하는 수정된 MCAO 기술을 제시합니다. IZ는 TTC 염색에 의해 측정되고, BE는 반구체 부피를 계산하여 결정되고, BBB 투과성은분광법(19)에의해 얻어진다. 본 프로토콜에서, 우리는 내부 경동맥(ICA)에 모노필라멘트 카테터의 직접 삽입 및 고정을 기반으로 수정된 MCAO 모델을 사용하고, 중형 뇌동맥(MCA) (MCA)22로의혈류를 더욱 차단하였다. 이러한 수정방법은 기존의 MCAO방법(16,22)에비해 사망률과 이환율의 감소율을 나타낸다.
이 새로운 접근 법은 MCAO 후에 신경 상해를 측정하기 위한 재정적으로 건전하고 윤리적인 모형을 제공합니다. 허혈성 뇌 손상의 주요 매개 변수의이 평가는 포괄적으로 병리 생리학을 조사하는 데 도움이 될 것입니다.
프로토콜
헬싱키와 도쿄 선언의 권고와 유럽 공동체의 실험동물 사용 지침에 따라 다음과 같은 절차가 진행되었습니다. 실험은 또한 네게브의 벤 구리온 대학에 동물 관리 위원회에 의해 승인되었습니다.
1. 실험 절차를 위해 쥐를 준비
- 300에서 350 g 사이 각 무게는 과잉 병리학 없이 성인 남성 Sprague-Dawley 쥐를 선택합니다.
- 모든 쥐를 22°C의 실온에서 유지하며 실험 전에 12시간의 빛과 어두운 주기를 유지합니다.
- 음식과 물을 사용할 수 있는지 확인 합니다.
- 6:00 a.m 및 2:00 p.m 사이의 모든 절차를 수행합니다.
2. 수술을 위한 쥐 준비
- 이소플루란(in흡입은 4%, 유지보수2%)과 24%의 산소(1.5L/분)로 30분 동안 쥐를 마취시합니다.
- 그들은 페달 철수 반사가없는 보장하여 쥐의 마취 수준을 테스트합니다.
- 24 게이지 카테터를 꼬리 정맥에 삽입합니다.
참고: 혈관 확장을 위한 꼬리 온난화는 수행되지 않습니다.- 쥐를 테이블에 올려놓는 자세를 취합니다. 의료 용 테이프를 사용하여 쥐의 사지 네 마리를 모두 부착하십시오.
- 수술 전에 온도 측정을 위한 프로브를 쥐 직장에 놓습니다.
- 시술 중에, 37°C 코어 체온을 지지하기 위해 가열판을 유지한다.
- 보호를 위해 쥐의 눈에 연고를 넣습니다.
- 수술 부위를 면도하고 10% 포비도요오드의 3가지 응용 프로그램으로 소독한 다음 70%의 이소프로필 알코올을 사용한다.
3. 오른쪽 중위 뇌동맥 폐색
참고: MCAO는 이전에 설명된 바와 같이 수정된 기술에 의해 수행되며,16,22,23,맥게리 외 24 및 Uluç 외25에의해 기술된 계측기의 사용과 함께.
- 수술 핀셋과 곡선 블레이드가 있는 가위를 목의 복부 중간선에 피부와 피상적 인 근막으로 해부하십시오.
- ICA, 외부 경동맥(ECA) 및 일반적인 경동맥(CCA)으로 구성된 근육 삼각형을 식별합니다.
- 혈관 수술을 위한 마이크로포스프로 오른쪽 CCA와 ICA를 미주 신경과 조심스럽게 분리합니다.
- 올바른 CCA와 ICA를 노출합니다. 혈관 수술을 위한 마이크로 클립 또는 특수 지혈대를 사용하여 CCA에서 ICA에 오는 혈류를 차단합니다. 혈관 수술을 위한 현미경을 사용하여 ICA에 절개를 (약 1 mm)합니다.
- ICA를 통해 직접 모노필라멘트 카테터(4-0 나일론)를 삽입하고, 오른쪽 CCA의 분기점에서 약 18.5-19mm를 윌리스 원안으로 삽입하여 온화한 저항에 도달할 때까지MCA(26)를폐백한다.
- CCA의 분기 위의 ICA 주위에 리게이트.
- 샴 조작 제어 그룹의 경우 3.5 단계 및 3.616,22대신 나일론 스레드삽입을 수행하십시오.
- 관면 주입에 의해 염화 나트륨 0.9 %의 5 mL을 투여하십시오.
- 봉합사로 상처를 닫고 쥐를 회복 영역으로 가져 가라.
참고 : 마취가 끝난 후 몇 분 후에 쥐가 깨어나 케이지 주위를 독립적으로 움직입니다. - MCAO 후 23h에서, 식염수 (4 mL / kg)23,26 캐뉼라(27)를통해 두 수술 그룹에 대한 꼬리 정맥에 2 % 에반스 블루를 주입한다.
참고: 이것은 혈액 뇌 투과성 추적자로 사용됩니다. 60분 동안 순환합니다.
4. 경색 지대 의 결정
- MCAO 후 24h에서 측정된 IZ는 이전에 설명 된 바와 같이9,15,18,19,26.
참고: 체중의 20% 이상을 잃었거나 발작또는 헤미플기아를 개발한 쥐는 실험에서 제외됩니다. - 쥐가 자발적으로 호흡을 중단할 때까지 영감 받은 가스 혼합물을 20%의 산소와 80%의 이산화탄소로 대체하여 쥐를 안락사시하십시오.
- 가위와 외과 용 집게를 사용하여 갈비뼈 아래복벽을 통해 5-6cm 측면 절개로 가슴을 엽니다.
- 가위와 외과 용 집게로 늑골 케이지의 전체 길이를 따라 횡격막 절개를 수행하십시오.
- 조심스럽게 폐를 대체하고, 갈비뼈를 통과하여 오른쪽과왼쪽면(28)의쇄골까지 잘라낸다.
- 심장의 왼쪽 심실을 통해 일반 식염수 200mL로 퍼퓨즈.
- 가위로 심장의 오른쪽 아트리움을 구멍을 뚫거나 절개하십시오.
- 기요틴을 사용하여 참수 작업을 수행하고 뇌 조직을 수집합니다.
- 홍채 가위를 사용하여, 양쪽에 후방 두개골 표면의 단면 가장자리에 포라멘 매그넘에서 잘라.
- 후각 전구, 복부 표면을 따라 신경 연결 및 두개골의 등대 표면을 뇌에서 분리합니다.
- 머리에서 뇌를 제거합니다.
- .009" 스테인리스 스틸, 코팅되지 않은 단일 엣지 면도날로 2mm 두께의 수평 단면을 만들어 6개의 뇌 슬라이스를 생성합니다.
- 0.05% TTC에서 37°C에서 30분 동안 배양합니다.
- 현미경 슬라이드에 뇌 조직을 배치하고 1600x1600 dpi의 해상도와 이 6 뇌 슬라이스의 광학 스캐닝을 수행 (예를 들어 보충 1 참조).
- 채널 믹서기능(이미지 > 조정 > 채널 믹서)을사용하여 사진 편집기(예: 어도비 포토샵 CS2)가 있는 파란색 필터를 추가하고 이미지를 JPEG 파일 형식으로 저장합니다.
참고: 파란색 필터를 적용하면 이미지가 회색 으로 표시됩니다. - ImageJ 1.37v29,30에서저장된 이미지를 엽니다.
참고: 이 컴퓨터 프로그램은 임계값 함수를 사용하여 검은색 또는 흰색 픽셀을 격리하고 계산합니다(그림 1참조). - 이미지의 6개의 뇌 슬라이스 각각에 대해 각 반구(오른쪽 부상 된 ipsilateral 및 손상되지 않은 위반)를 메인 메뉴에서 "다각형 선택"도구를 사용하여 별도의 이미지 파일로 선택하고 저장합니다.
- Image > Adjust > 임계값을선택하여 ImageJ 소프트웨어의 메인 메뉴에서 자동 임계값 함수를 사용하여 IZ를 결정하기 위한 컷오프를 설정하고 단일 뇌 세트의 각 반구의 픽셀 수를 측정합니다.
참고: Macros는 ImageJ 소프트웨어의 이 단계에 사용할 수 있습니다(코드에 대한 보충 2 참조). 컷오프는 흰색으로 변환할 픽셀과 회색 음영에 따라 검은색으로 변환할 픽셀을 결정하는 중요한 매개 변수입니다(예: 보충 3 및 보충 4 참조). ImageJ는 흰색과 검은색 픽셀을 비교하여 IZ를 결정합니다. 스테닝 프로토콜 및 스캐너 설정을 기반으로 0.220의 일정한 컷오프 값을 사용했습니다. - Ipsilateral 및 콘트라탈 대뇌 반구 (RICH) 방법의 비율을 사용하여 조직 부종에 대한 IZ 보정의 측정을 수행 (보충 5의예 참조).
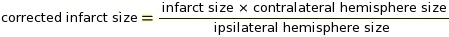
참고: 경색 크기는 반구의 백분율로 평가됩니다.
5. 뇌 부종의 결정31
참고: BE32,33의측정을 위해 ImageJ 1.37v를 사용합니다.
- MCAO 후 24h를 측정합니다. BE 계산의 경우 왼쪽 및 오른쪽 반구 볼륨(단위)의 데이터를 사용합니다.
- 1600x1600 dpi의 해상도로 광학 스캐닝을 수행합니다(예: 보충 1 참조).
- 뇌 반구를 선택하고 4.17-4.19 섹션에서 위에서 설명한 대로 ImageJ 1.37v로 BE를 결정하기 위한 컷오프를 설정합니다.
- 다음 방정식을 사용하여 RICH 방법에 의해 계산된 영향을 받지 않는 반구의 표준 영역의 백분율로 BE영역을 표현한다(예참조 5)23,34.

참고: BE의 범위는 반구의 백분율로 평가됩니다.
6. BBB 중단 결정
- MCAO 후 24시간 BBB 중단을 측정합니다.
- 좌우 반구를 6개의 조각으로 나누고 각각을 마이크로센심분리기 튜브에 넣습니다.
- 트리클로로아세산에서 뇌 조직의 각 조각을 균질화하여 50% 트리클로로아세산의 4mL에서 뇌 조직 1 g의 계산에 기초하여 균질화한다.
- 원심분리기 10,000 x g에서 20분 동안.
- 96% 에탄올로 상피 액체 1:3을 희석합니다.
- 분광광광광원측정을 활용하여 발광 분광성 측정을 수행하고, 플레이트를 설치하고, 다음 매개 변수를 사용하여 샘플 판독을 수행합니다: 620 nm(대역폭 10 nm)의 형광 강도 흥분 파장 및 680 nm(대역폭 10 nm)23,35; 모드 상단; 숫자 살 25; 수동 100; 1 초, 1 mm를 흔들어.
참고: 620nm(대역폭 10nm)의 내분 파장과 680nm(대역폭 10nm)의 방출 파장을 사용합니다. 23,35
결과
비원지 측정
독립적인 견본 t-시험은 16개의 sham-작동 한 쥐에 비해 뇌 경색 볼륨의 상당한 증가를 입증 했다 19 쥐 표시 (MCAO=7.49% ± 3.57 대 샴 = 0.31% ± 1.9, t(28.49) = 7.56, p lt&01 (그림). 데이터는 SD에 ± 반대 반구의 평균 백분율로 표현됩니다.
뇌 부종 측정
독립적인 샘플 t-test는 ...
토론
현재 프로토콜의 주요 목표는 허혈성 상해의 세 가지 주요 매개 변수인 IZ, BE 및 BBB 투과성에 대한 일관된 측정을 입증하는 것이었습니다. 이 분야의 이전 연구는 동일한 샘플에서 이러한 매개 변수 중 하나 또는 두 개의 매개 변수를 함께 수행 할 가능성을 입증했습니다. 이 3부법이 제공하는 비용 절감 외에도, 또한 수술해야 하는 동물의 수를 제한하고 이후에 안락사해야 하는 보다 바람직한 생?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
우리는 메리나 쿠체리아바, 막심 크리보노소프, 다리나 야쿠멘코, 에브게니아 곤차릭 생리학과, 생물학 학부, 생태학 및 의학, 올레스 혼차르, 드니프로 대학, 드니프로, 우크라이나 에 대한 지원과 우리의 토론에 도움이 기여에 감사드립니다. 수집된 데이터는 루슬란 쿠츠 박사 학위 학위 의 일부입니다.
자료
| Name | Company | Catalog Number | Comments |
| 2 mL Syringe | Braun | 4606027V | |
| 2% chlorhexidine in 70% alcohol solution | Sigma-Aldrich | 500 cc | Provides general antisepsis of the skin in the operatory field |
| 27 G Needle with Syringe | Braun | 305620 | |
| 3-0 Silk sutures | Henry Schein | 1007842 | |
| 4-0 Nylon suture | 4-00 | ||
| Brain & Tissue Matrices | Sigma-Aldrich | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 183603985447 | |
| Centrifuge Sigma 2-16P | Sigma-Aldrich | Sigma 2-16P | |
| Compact Analytical Balances | Sigma-Aldrich | HR-AZ/HR-A | |
| Digital weighing scale | Sigma-Aldrich | Rs 4,000 | |
| Dissecting scissors | Sigma-Aldrich | Z265969 | |
| Eppendorf pipette | Sigma-Aldrich | Z683884 | |
| Eppendorf tube | Sigma-Aldrich | EP0030119460 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | Model: Infinite 200 PRO multimode reader | Optional. |
| Fluorescence detector | Molecular Devices LLC | VWR cat. # 10822 512 SpectraMax Paradigm Multi Mode Microplate Reader Base Instrument | Optional. |
| Gauze sponges | Fisher | 22-362-178 | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Hemostatic microclips | Sigma-Aldrich | ||
| Horizon-XL | Mennen Medical Ltd | ||
| Infusion cuff | ABN | IC-500 | |
| Micro forceps | Sigma-Aldrich | ||
| Micro scissors | Sigma-Aldrich | ||
| Multiset | Teva Medical | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Operating forceps | Sigma-Aldrich | ||
| Operating scissors | Sigma-Aldrich | ||
| Optical scanner | Canon | Cano Scan 4200F | Resolution 3200 x 6400 dpi |
| Petri dishes | Sigma-Aldrich | P5606 | |
| Purina Chow | Purina | 5001 | Rodent laboratory chow given to rats, mice and hamster is a life-cycle nutrition that has been used in biomedical research for over 5 decades. Provided to rats ad libitum in this experiment. |
| Rat cages | Techniplast | 2000P | Conventional housing for rodents. Cages were used for housing rats throughout the experiment |
| Scalpel blades #11 | Sigma-Aldrich | S2771 | |
| Software | |||
| Adobe Photoshop CS2 for Windows | Adobe | ||
| ImageJ 1.37v | NIH | The source code is freely available. The author, Wayne Rasband (wayne@codon.nih.gov), is at the Research Services Branch, National Institute of Mental Health, Bethesda, Maryland, USA | |
| SPSS Statistics 22 | IBM | ||
| Office 365 ProPlus | Microsoft | - | Microsoft Office Excel |
| Windows 10 | Microsoft | ||
| Reagents | |||
| 2,3,5-Triphenyltetrazolium chloride | Sigma-Aldrich | 298-96-4 | |
| 50% trichloroacetic acid | Sigma-Aldrich | 76-03-9 | |
| Ethanol 96 % | Romical | Flammable liquid | |
| Evans blue 2% | Sigma-Aldrich | 314-13-6 | |
| Isoflurane, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 |
참고문헌
- Krishnamurthi, R. V., et al. Global and regional burden of first-ever ischaemic and haemorrhagic stroke during 1990-2010: findings from the Global Burden of Disease Study 2010. Lancet Global Health. 1, 259-281 (2013).
- Benjamin, E. J., et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 135, 146 (2017).
- Wilkins, E., et al. . European cardiovascular disease statistics 2017. , (2017).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Lloyd-Jones, D., et al. Heart disease and stroke statistics--2009 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation. 119, 480-486 (2009).
- Shigeno, T., McCulloch, J., Graham, D. I., Mendelow, A. D., Teasdale, G. M. Pure cortical ischemia versus striatal ischemia. Circulatory, metabolic, and neuropathologic consequences. Surgical Neurology. 24, 47-51 (1985).
- Albanese, V., Tommasino, C., Spadaro, A., Tomasello, F. A transbasisphenoidal approach for selective occlusion of the middle cerebral artery in rats. Experientia. 36, 1302-1304 (1980).
- Hudgins, W. R., Garcia, J. H. Transorbital approach to the middle cerebral artery of the squirrel monkey: a technique for experimental cerebral infarction applicable to ultrastructural studies. Stroke. 1, 107-111 (1970).
- Waltz, A. G., Sundt, T. M., Owen, C. A. Effect of middle cerebral artery occlusion on cortical blood flow in animals. Neurology. 16, 1185-1190 (1966).
- Tamura, A., Graham, D. I., McCulloch, J., Teasdale, G. M. Focal cerebral ischaemia in the rat: 1. Description of technique and early neuropathological consequences following middle cerebral artery occlusion. Journal of Cerebral Blood Flow & Metabolism. 1, 53-60 (1981).
- Aspey, B. S., Cohen, S., Patel, Y., Terruli, M., Harrison, M. J. Middle cerebral artery occlusion in the rat: consistent protocol for a model of stroke. Neuropathology and Applied Neurobiology. 24, 487-497 (1998).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20, 84-91 (1989).
- O'Brien, M. D., Jordan, M. M., Waltz, A. G. Ischemic cerebral edema and the blood-brain barrier. Distributions of pertechnetate, albumin, sodium, and antipyrine in brains of cats after occlusion of the middle cerebral artery. Archives of Neurology. 30, 461-465 (1974).
- Chen, C. H., Toung, T. J., Sapirstein, A., Bhardwaj, A. Effect of duration of osmotherapy on blood-brain barrier disruption and regional cerebral edema after experimental stroke. Journal of Cerebral Blood Flow & Metabolism. 26, 951-958 (2006).
- Boyko, M., et al. Establishment of Novel Technical Methods for Evaluating Brain Edema and Lesion Volume in Stroked Rats: a Standardization of Measurement Procedures. Brain Research. , (2019).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Sifat, A. E., Vaidya, B., Abbruscato, T. J. Blood-Brain Barrier Protection as a Therapeutic Strategy for Acute Ischemic Stroke. AAPS Journal. 19, 957-972 (2017).
- Jiang, X., et al. Blood-brain barrier dysfunction and recovery after ischemic stroke. Progress in Neurobiology. 163-164, 144-171 (2018).
- Belayev, L., Busto, R., Zhao, W., Ginsberg, M. D. Quantitative evaluation of blood-brain barrier permeability following middle cerebral artery occlusion in rats. Brain Research. 739, 88-96 (1996).
- Li, L., Yu, Q., Liang, W. Use of 2,3,5-triphenyltetrazolium chloride-stained brain tissues for immunofluorescence analyses after focal cerebral ischemia in rats. Pathology - Research and Practice. 214, 174-179 (2018).
- Kramer, M., et al. TTC staining of damaged brain areas after MCA occlusion in the rat does not constrict quantitative gene and protein analyses. Journal of Neuroscience Methods. 187, 84-89 (2010).
- Kuts, R., et al. A middle cerebral artery occlusion technique for inducing post-stroke depression in rats. Journal of Visualized Experiments. , e58875 (2019).
- Kuts, R., et al. A Novel Method for Assessing Cerebral Edema, Infarcted Zone and Blood-Brain Barrier Breakdown in a Single Post-stroke Rodent Brain. Frontiers in Neuroscience. 13, 1105 (2019).
- McGarry, B. L., Jokivarsi, K. T., Knight, M. J., Grohn, O. H. J., Kauppinen, R. A. A Magnetic Resonance Imaging Protocol for Stroke Onset Time Estimation in Permanent Cerebral Ischemia. Journal of Visualized Experiments. , e55277 (2017).
- Uluc, K., Miranpuri, A., Kujoth, G. C., Akture, E., Baskaya, M. K. Focal cerebral ischemia model by endovascular suture occlusion of the middle cerebral artery in the rat. Journal of Visualized Experiments. , e1978 (2011).
- Boyko, M., et al. The effect of blood glutamate scavengers oxaloacetate and pyruvate on neurological outcome in a rat model of subarachnoid hemorrhage. Neurotherapeutics. 9, 649-657 (2012).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. , e58875 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. , e3564 (2012).
- Poinsatte, K., et al. Quantification of neurovascular protection following repetitive hypoxic preconditioning and transient middle cerebral artery occlusion in mice. Journal of Visualized Experiments. , e52675 (2015).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (2018)
- Boyko, M., et al. Pyruvate's blood glutamate scavenging activity contributes to the spectrum of its neuroprotective mechanisms in a rat model of stroke. European Journal of Neuroscience. 34, 1432-1441 (2011).
- Collins, T. J. ImageJ for microscopy. Biotechniques. 43, 25-30 (2007).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (1997)
- Kaplan, B., et al. Temporal thresholds for neocortical infarction in rats subjected to reversible focal cerebral ischemia. Stroke. 22, 1032-1039 (1991).
- Kumai, Y., et al. Postischemic gene transfer of soluble Flt-1 protects against brain ischemia with marked attenuation of blood-brain barrier permeability. Journal of Cerebral Blood Flow & Metabolism. 27, 1152-1160 (2007).
- Schuleri, K. H., et al. Characterization of peri-infarct zone heterogeneity by contrast-enhanced multidetector computed tomography: a comparison with magnetic resonance imaging. Journal of the American College of Cardiology. 53, 1699-1707 (2009).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative Stress: A Key Modulator in Neurodegenerative Diseases. Molecules. 24, (2019).
- Di Napoli, M. Caplan's Stroke: A Clinical Approach. Journal of the American Medical Association. 302, 2600-2601 (2009).
- Deb, P., Sharma, S., Hassan, K. M. Pathophysiologic mechanisms of acute ischemic stroke: An overview with emphasis on therapeutic significance beyond thrombolysis. Pathophysiology. 17, 197-218 (2010).
- Simard, J. M., Kent, T. A., Chen, M., Tarasov, K. V., Gerzanich, V. Brain oedema in focal ischaemia: molecular pathophysiology and theoretical implications. Lancet Neurology. 6, 258-268 (2007).
- Klatzo, I. Pathophysiological aspects of brain edema. Acta Neuropathology. 72, 236-239 (1987).
- Yang, Y., Rosenberg, G. A. Blood-brain barrier breakdown in acute and chronic cerebrovascular disease. Stroke. 42, 3323-3328 (2011).
- Lin, T. N., He, Y. Y., Wu, G., Khan, M., Hsu, C. Y. Effect of brain edema on infarct volume in a focal cerebral ischemia model in rats. Stroke. 24, 117-121 (1993).
- Liu, C., et al. Increased blood-brain barrier permeability in contralateral hemisphere predicts worse outcome in acute ischemic stroke after reperfusion therapy. Journal of NeuroInterventional Surgery. 10, 937-941 (2018).
- Boyko, M., et al. Establishment of novel technical methods for evaluating brain edema and lesion volume in stroked rats: A standardization of measurement procedures. Brain Research. 1718, 12-21 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유