需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
测量一组啮齿动物脑样本中的中风后脑水肿、梗塞区和血脑屏障破裂
* 这些作者具有相同的贡献
摘要
此协议描述了在同一组啮齿动物脑样本上测量缺血性脑损伤三个最重要的参数的新技术。仅使用一个大脑样本在道德和经济成本方面非常有利。
摘要
全世界发病率和死亡率最常见的原因之一是缺血性中风。从历史上看,用于刺激缺血性中风的动物模型涉及中脑动脉闭塞(MCAO)。梗塞区、脑水肿和血脑屏障 (BBB) 故障被测量为反映 MCAO 后脑损伤程度的参数。这种方法的一个重大限制是,这些测量通常在不同的大鼠大脑样本中获得,由于大量大鼠需要安乐死以达到适当的样本大小,因此会导致伦理和经济负担。在这里,我们提出了一种方法,通过测量同一组大鼠大脑中的梗塞区、脑水肿和BBB渗透率,准确评估MCAO之后的脑损伤。这种新技术为评估中风的病理生理学提供了更有效的方法。
引言
全世界发病率和死亡率最常见的原因之一是中风。在全球范围内,缺血性中风占所有中风病例的68%,而在美国缺血性中风占中风病例的87%。1,2。据估计,中风的经济负担达到340亿美元,在美国2和450亿欧元在欧盟3。动物中风模型是研究其病理生理学,开发新的评价方法,并提出新的治疗方案4。
缺血性中风发生在一个主要脑动脉的闭塞,通常是中脑动脉或其分支之一5。因此,缺血性中风的模型历来涉及中脑动脉闭塞(MCAO)6,7,8,9,10,11,12。继 MCAO 之后, 神经损伤最常通过测量梗塞区 (IZ) 来评估,使用 2,3,5 三苯甲酸酯氯化物 (TTC) 染色方法13,脑水肿 (BE) 使用 干燥或计算半球体积14,15,16,和血脑屏障(BBB)渗透性光谱技术使用埃文斯蓝色染色17,18,19。
传统的 MCAO 方法在三个大脑测量中每个都使用单独的大脑集。对于大量的样本量,这导致大量的安乐死动物,增加了伦理和财务考虑。减轻这些成本的替代方法将涉及在一组后 MCAO 啮齿动物大脑中测量所有三个参数。
先前曾尝试测量同一大脑样本中的参数组合。同时免疫荧光染色方法20 以及其他分子和生化分析21 已描述后TTC染色在同一大脑样本。我们以前计算过脑半球的体积来评估脑水肿,并进行了TTC染色,以计算同一大脑集15的梗塞区。
在本协议中,我们提出了一种经过改进的 MCAO 技术,通过确定同一组啮齿动物大脑中的 IZ、BE 和 BBB 渗透性来测量缺血性脑损伤。IZ通过TTC染色测量,BE通过计算半球体积来测量,BBB渗透性通过光谱方法19获得。在此协议中,我们使用了经过修改的 MCAO 模型,基于将单滤导管直接插入和固定到内部胡萝卜动脉 (ICA) 和进一步阻断流向中脑动脉 (MCA)22的血液。与传统的MCAO方法16、22相比,这种修改后的方法表明死亡率和发病率有所下降。
这种新方法为测量 MCAO 之后的神经损伤提供了财务健全和道德模型。这种对缺血性脑损伤主要参数的评估将有助于全面研究其病理生理学。
研究方案
下列程序是根据《赫尔辛基宣言》和《欧洲共同体实验动物使用准则》的建议进行的。内盖夫本古里安大学的动物护理委员会也批准了这些实验。
1. 为实验程序准备大鼠
- 选择成年雄性斯普拉格-道利大鼠,没有明示病理学,每只体重在300至350克之间。
- 将所有大鼠在室温下保持在22°C,在实验前有12小时的光和暗周期。
- 确保食物和水是可用的广告利比妥姆。
- 执行下午 6:00 至下午 2:00 之间的所有程序.m.m。
2. 准备大鼠做手术
- 用异氟化麻醉大鼠30分钟(感应4%,保养2%)和24%氧气(1.5升/分钟)。
- 通过确保大鼠没有踏板取出反射来测试大鼠的麻醉水平。
- 将 24 度导管插入尾静脉。
注:不执行血管化的尾部加热。- 把老鼠放在桌子上的姿势。用医用胶带把老鼠的四肢都贴上。
- 手术前将探针放入大鼠直肠进行温度测量。
- 在过程中,保持加热板以支持 37 °C 的核心体温。
- 在老鼠的眼睛里加入软膏以保护。
- 剃光手术区,消毒三种应用10%的波维酮碘,其次是70%的异丙醇。
3. 右侧中脑动脉闭塞
注:MCAO采用修改后的技术,如先前描述的16、22、23,使用麦加里等人描述的仪器24和乌卢埃等人25。
- 用手术钳子解剖颈部腹中线的皮肤和表面筋膜,用弯曲的刀片剪刀。
- 识别肌肉三角形,由ICA、外部胡萝卜动脉(ECA)和普通胡萝卜动脉(CCA)组成。
- 小心地将右CCA和ICA与迷走神经与血管手术的微力分离。
- 揭露正确的 CCA 和 ICA 。使用微型夹子或血管手术的特殊环状物阻止从CCA到ICA的血流。使用显微剪刀在ICA上切口(约1毫米),用于血管手术。
- 直接通过ICA插入单丝导管(4-0尼龙),从右CCA的分叉点约18.5-19毫米进入威利斯圆,直到达到轻微的阻力,以遮挡MCA26。
- 在ICA的分裂之上,在ICA周围展开。
- 对于假操作的对照组,执行尼龙线的插入,而不是步骤3.5和3.616,22。
- 通过腹膜注射管理5 mL的0.9%氯化钠。
- 用缝合关闭伤口,将老鼠带到恢复区。
注意:麻醉结束后几分钟,老鼠会醒来,在笼子里独立移动。 - MCAO后23小时,通过针管27将2%的埃文斯蓝色盐水(4 mL/kg)23,26注入两个手术组的尾静脉。
注:这被用作血脑渗透度示踪器。允许循环60分钟。
4. 确定梗塞区
- 测量IZ在24小时后,MCAO如前所述9,15,18,19,26。
注:体重减轻超过20%或出现癫痫发作或六肢瘫痪的老鼠被排除在实验之外。 - 用20%的氧气和80%的二氧化碳代替受启发的气体混合物,直到大鼠停止自发呼吸,从而对大鼠实施安乐死。
- 用剪刀和手术钳子在肋骨笼下的腹部壁上用5-6厘米的横向切口打开胸部。
- 用剪刀和手术钳沿着肋骨笼的整个长度进行隔膜切口。
- 小心地取代肺部,切开肋骨笼,直至左右两侧的锁骨28。
- 通过心脏左心室注入200 mL的正常盐水。
- 用剪刀刺穿或切入心脏右中庭。
- 使用断头台进行斩首,并收集脑组织。
- 使用虹膜剪刀,从前兆切割到两侧后头骨表面的分离边缘。
- 将嗅灯泡、腹腔表面的神经连接和头骨的鼻孔表面与大脑分开。
- 从头部取出大脑。
- 通过创建 2 毫米厚的水平部分,使用 0.009" 不锈钢、未涂层、单边剃须刀刀片,生成 6 个脑片。
- 在 0.05% TTC 中在 37 °C 下孵化 30 分钟。
- 将脑组织放在显微镜幻灯片上,对分辨率为 1600x1600 dpi 的这 6 个脑片进行光学扫描(例如,参见补充 1)。
- 使用通道混频器功能(图像 + 调整 + 通道混频器) 添加带有照片编辑器的蓝色滤镜(例如 Adobe Photoshop CS2),并将图像保存为 JPEG 文件格式。
注:应用蓝色滤镜后,图像将出现灰度。 - 在 ImageJ 1.37v29、30中打开保存的图像。
注:此计算机程序使用阈值函数来隔离和计算黑色或白色的像素(见图 1)。 - 对于图像的 6 个大脑切片中的每一个,使用主菜单中的"多边形选择"工具,选择并保存每个半球(右侧受伤的 ipsilateral 和左侧未受伤的反面)作为单独的图像文件。
- 通过选择 Image > 调整 + 阈值,使用 ImageJ 软件主菜单中的自动阈值功能设置确定 IZ 的截止值,并测量单个大脑集每个半球的像素数。
注:宏可用于 ImageJ 软件中的此步骤(请参阅代码 补充 2)。 切断是确定哪些像素转换为白色,哪些转换为黑色取决于灰色阴影的关键参数(见 补充 3 和 补充 4 作为示例)。然后,ImageJ 比较白色和黑色像素以确定 IZ。根据染色协议和扫描仪设置,我们使用了 0.220 的恒定截止值。 - 使用益普西拉特尔和反三边脑半球(RICH)方法13、23(见补充5中的示例)对组织肿胀进行IZ校正测量。
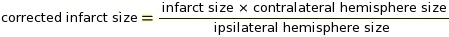
注:梗死大小被评估为反半球的百分比。
5. 脑水肿的确定31
注:使用图像J 1.37v测量 BE32,33。
- 测量是 24 小时后, Mcao 。要计算 BE,请使用来自左右半球体积(单位)的数据。
- 执行分辨率为 1600x1600 dpi 的光学扫描(例如,请参阅补充 1)。
- 选择大脑半球,并设置用 ImageJ 1.37v 确定 BE 的截止点,如上文在 4.17-4.19 节中所述。
- 将 BE 区域作为未受影响的反向半球标准区域的百分比,由 RICH 方法使用以下方程计算(见补充 5中的示例)23、34。

注:BE 的程度被评估为反半球的百分比。
6. BBB 中断的确定
- 测量 MCAO 后 24 小时的 BBB 中断。
- 将左右半球分成六个切片,每个切片放入微中心管中。
- 根据计算4mL中1克脑组织50%三氯乙酸的三氯乙酸,将三氯乙酸中的每一片脑组织同质化。
- 离心机在10,000 x g 20分钟。
- 用 96% 乙醇稀释超纳坦液体 1:3。
- 利用光谱学软件进行发光光谱测量,安装板材,并使用以下参数进行样品读取:荧光强度激发波长为620nm(带宽10nm),发射波长为680nm(带宽10nm)23,35:模组顶部;弗莱什25号;手动 100;摇晃1秒1毫米
注:使用620nm(带宽10nm)和680nm(带宽10nm)的激发波长。23,35
结果
梗塞区测量
一项独立样本T测试表明,与16只假手术大鼠相比,19只接受永久性MCAO的老鼠的大脑梗塞体积显著增加(MCAO=7.49%,±3.57对。 香=0.31%±1.9,t(28.49)=7.56,p<0.01(见图2A)。 数据表示为反半球± SD 的平均百分比。
脑水肿测量
一项独立样本T测试表明,与16只假手术大...
讨论
本议定书的主要目标是证明对缺血损伤的三个主要参数的一致测量:IZ、BE和BBB渗透性。先前在这一领域的研究表明,有可能在同一样本中一起执行其中一个或两个参数。除了这种由三部分组成的方法提供的成本降低外,它还提供了一个更理想的生物伦理模型,限制必须操作并随后实施安乐死的动物数量。与所有病理学技术一样,该方法受到无法动态观察缺血损伤的限制。
在图...
披露声明
作者没有什么可透露的。
致谢
我们感谢马里娜·库舍里亚瓦、马克西姆·克里沃诺索夫、达里娜·亚库门科和叶夫根尼亚·贡查里克,他们支持我们的讨论,并为我们的讨论作出了有益的贡献。获得的数据是鲁斯兰·库茨博士论文的一部分。
材料
| Name | Company | Catalog Number | Comments |
| 2 mL Syringe | Braun | 4606027V | |
| 2% chlorhexidine in 70% alcohol solution | Sigma-Aldrich | 500 cc | Provides general antisepsis of the skin in the operatory field |
| 27 G Needle with Syringe | Braun | 305620 | |
| 3-0 Silk sutures | Henry Schein | 1007842 | |
| 4-0 Nylon suture | 4-00 | ||
| Brain & Tissue Matrices | Sigma-Aldrich | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 183603985447 | |
| Centrifuge Sigma 2-16P | Sigma-Aldrich | Sigma 2-16P | |
| Compact Analytical Balances | Sigma-Aldrich | HR-AZ/HR-A | |
| Digital weighing scale | Sigma-Aldrich | Rs 4,000 | |
| Dissecting scissors | Sigma-Aldrich | Z265969 | |
| Eppendorf pipette | Sigma-Aldrich | Z683884 | |
| Eppendorf tube | Sigma-Aldrich | EP0030119460 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | Model: Infinite 200 PRO multimode reader | Optional. |
| Fluorescence detector | Molecular Devices LLC | VWR cat. # 10822 512 SpectraMax Paradigm Multi Mode Microplate Reader Base Instrument | Optional. |
| Gauze sponges | Fisher | 22-362-178 | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Hemostatic microclips | Sigma-Aldrich | ||
| Horizon-XL | Mennen Medical Ltd | ||
| Infusion cuff | ABN | IC-500 | |
| Micro forceps | Sigma-Aldrich | ||
| Micro scissors | Sigma-Aldrich | ||
| Multiset | Teva Medical | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Operating forceps | Sigma-Aldrich | ||
| Operating scissors | Sigma-Aldrich | ||
| Optical scanner | Canon | Cano Scan 4200F | Resolution 3200 x 6400 dpi |
| Petri dishes | Sigma-Aldrich | P5606 | |
| Purina Chow | Purina | 5001 | Rodent laboratory chow given to rats, mice and hamster is a life-cycle nutrition that has been used in biomedical research for over 5 decades. Provided to rats ad libitum in this experiment. |
| Rat cages | Techniplast | 2000P | Conventional housing for rodents. Cages were used for housing rats throughout the experiment |
| Scalpel blades #11 | Sigma-Aldrich | S2771 | |
| Software | |||
| Adobe Photoshop CS2 for Windows | Adobe | ||
| ImageJ 1.37v | NIH | The source code is freely available. The author, Wayne Rasband (wayne@codon.nih.gov), is at the Research Services Branch, National Institute of Mental Health, Bethesda, Maryland, USA | |
| SPSS Statistics 22 | IBM | ||
| Office 365 ProPlus | Microsoft | - | Microsoft Office Excel |
| Windows 10 | Microsoft | ||
| Reagents | |||
| 2,3,5-Triphenyltetrazolium chloride | Sigma-Aldrich | 298-96-4 | |
| 50% trichloroacetic acid | Sigma-Aldrich | 76-03-9 | |
| Ethanol 96 % | Romical | Flammable liquid | |
| Evans blue 2% | Sigma-Aldrich | 314-13-6 | |
| Isoflurane, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 |
参考文献
- Krishnamurthi, R. V., et al. Global and regional burden of first-ever ischaemic and haemorrhagic stroke during 1990-2010: findings from the Global Burden of Disease Study 2010. Lancet Global Health. 1, 259-281 (2013).
- Benjamin, E. J., et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 135, 146 (2017).
- Wilkins, E., et al. . European cardiovascular disease statistics 2017. , (2017).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Lloyd-Jones, D., et al. Heart disease and stroke statistics--2009 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation. 119, 480-486 (2009).
- Shigeno, T., McCulloch, J., Graham, D. I., Mendelow, A. D., Teasdale, G. M. Pure cortical ischemia versus striatal ischemia. Circulatory, metabolic, and neuropathologic consequences. Surgical Neurology. 24, 47-51 (1985).
- Albanese, V., Tommasino, C., Spadaro, A., Tomasello, F. A transbasisphenoidal approach for selective occlusion of the middle cerebral artery in rats. Experientia. 36, 1302-1304 (1980).
- Hudgins, W. R., Garcia, J. H. Transorbital approach to the middle cerebral artery of the squirrel monkey: a technique for experimental cerebral infarction applicable to ultrastructural studies. Stroke. 1, 107-111 (1970).
- Waltz, A. G., Sundt, T. M., Owen, C. A. Effect of middle cerebral artery occlusion on cortical blood flow in animals. Neurology. 16, 1185-1190 (1966).
- Tamura, A., Graham, D. I., McCulloch, J., Teasdale, G. M. Focal cerebral ischaemia in the rat: 1. Description of technique and early neuropathological consequences following middle cerebral artery occlusion. Journal of Cerebral Blood Flow & Metabolism. 1, 53-60 (1981).
- Aspey, B. S., Cohen, S., Patel, Y., Terruli, M., Harrison, M. J. Middle cerebral artery occlusion in the rat: consistent protocol for a model of stroke. Neuropathology and Applied Neurobiology. 24, 487-497 (1998).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20, 84-91 (1989).
- O'Brien, M. D., Jordan, M. M., Waltz, A. G. Ischemic cerebral edema and the blood-brain barrier. Distributions of pertechnetate, albumin, sodium, and antipyrine in brains of cats after occlusion of the middle cerebral artery. Archives of Neurology. 30, 461-465 (1974).
- Chen, C. H., Toung, T. J., Sapirstein, A., Bhardwaj, A. Effect of duration of osmotherapy on blood-brain barrier disruption and regional cerebral edema after experimental stroke. Journal of Cerebral Blood Flow & Metabolism. 26, 951-958 (2006).
- Boyko, M., et al. Establishment of Novel Technical Methods for Evaluating Brain Edema and Lesion Volume in Stroked Rats: a Standardization of Measurement Procedures. Brain Research. , (2019).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Sifat, A. E., Vaidya, B., Abbruscato, T. J. Blood-Brain Barrier Protection as a Therapeutic Strategy for Acute Ischemic Stroke. AAPS Journal. 19, 957-972 (2017).
- Jiang, X., et al. Blood-brain barrier dysfunction and recovery after ischemic stroke. Progress in Neurobiology. 163-164, 144-171 (2018).
- Belayev, L., Busto, R., Zhao, W., Ginsberg, M. D. Quantitative evaluation of blood-brain barrier permeability following middle cerebral artery occlusion in rats. Brain Research. 739, 88-96 (1996).
- Li, L., Yu, Q., Liang, W. Use of 2,3,5-triphenyltetrazolium chloride-stained brain tissues for immunofluorescence analyses after focal cerebral ischemia in rats. Pathology - Research and Practice. 214, 174-179 (2018).
- Kramer, M., et al. TTC staining of damaged brain areas after MCA occlusion in the rat does not constrict quantitative gene and protein analyses. Journal of Neuroscience Methods. 187, 84-89 (2010).
- Kuts, R., et al. A middle cerebral artery occlusion technique for inducing post-stroke depression in rats. Journal of Visualized Experiments. , e58875 (2019).
- Kuts, R., et al. A Novel Method for Assessing Cerebral Edema, Infarcted Zone and Blood-Brain Barrier Breakdown in a Single Post-stroke Rodent Brain. Frontiers in Neuroscience. 13, 1105 (2019).
- McGarry, B. L., Jokivarsi, K. T., Knight, M. J., Grohn, O. H. J., Kauppinen, R. A. A Magnetic Resonance Imaging Protocol for Stroke Onset Time Estimation in Permanent Cerebral Ischemia. Journal of Visualized Experiments. , e55277 (2017).
- Uluc, K., Miranpuri, A., Kujoth, G. C., Akture, E., Baskaya, M. K. Focal cerebral ischemia model by endovascular suture occlusion of the middle cerebral artery in the rat. Journal of Visualized Experiments. , e1978 (2011).
- Boyko, M., et al. The effect of blood glutamate scavengers oxaloacetate and pyruvate on neurological outcome in a rat model of subarachnoid hemorrhage. Neurotherapeutics. 9, 649-657 (2012).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. , e58875 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. , e3564 (2012).
- Poinsatte, K., et al. Quantification of neurovascular protection following repetitive hypoxic preconditioning and transient middle cerebral artery occlusion in mice. Journal of Visualized Experiments. , e52675 (2015).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (2018)
- Boyko, M., et al. Pyruvate's blood glutamate scavenging activity contributes to the spectrum of its neuroprotective mechanisms in a rat model of stroke. European Journal of Neuroscience. 34, 1432-1441 (2011).
- Collins, T. J. ImageJ for microscopy. Biotechniques. 43, 25-30 (2007).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (1997)
- Kaplan, B., et al. Temporal thresholds for neocortical infarction in rats subjected to reversible focal cerebral ischemia. Stroke. 22, 1032-1039 (1991).
- Kumai, Y., et al. Postischemic gene transfer of soluble Flt-1 protects against brain ischemia with marked attenuation of blood-brain barrier permeability. Journal of Cerebral Blood Flow & Metabolism. 27, 1152-1160 (2007).
- Schuleri, K. H., et al. Characterization of peri-infarct zone heterogeneity by contrast-enhanced multidetector computed tomography: a comparison with magnetic resonance imaging. Journal of the American College of Cardiology. 53, 1699-1707 (2009).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative Stress: A Key Modulator in Neurodegenerative Diseases. Molecules. 24, (2019).
- Di Napoli, M. Caplan's Stroke: A Clinical Approach. Journal of the American Medical Association. 302, 2600-2601 (2009).
- Deb, P., Sharma, S., Hassan, K. M. Pathophysiologic mechanisms of acute ischemic stroke: An overview with emphasis on therapeutic significance beyond thrombolysis. Pathophysiology. 17, 197-218 (2010).
- Simard, J. M., Kent, T. A., Chen, M., Tarasov, K. V., Gerzanich, V. Brain oedema in focal ischaemia: molecular pathophysiology and theoretical implications. Lancet Neurology. 6, 258-268 (2007).
- Klatzo, I. Pathophysiological aspects of brain edema. Acta Neuropathology. 72, 236-239 (1987).
- Yang, Y., Rosenberg, G. A. Blood-brain barrier breakdown in acute and chronic cerebrovascular disease. Stroke. 42, 3323-3328 (2011).
- Lin, T. N., He, Y. Y., Wu, G., Khan, M., Hsu, C. Y. Effect of brain edema on infarct volume in a focal cerebral ischemia model in rats. Stroke. 24, 117-121 (1993).
- Liu, C., et al. Increased blood-brain barrier permeability in contralateral hemisphere predicts worse outcome in acute ischemic stroke after reperfusion therapy. Journal of NeuroInterventional Surgery. 10, 937-941 (2018).
- Boyko, M., et al. Establishment of novel technical methods for evaluating brain edema and lesion volume in stroked rats: A standardization of measurement procedures. Brain Research. 1718, 12-21 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。