Method Article
الموجات فوق الصوتية المركزة التي تحفز فتح الحاجز الدموي الدماغي لاستهداف هياكل الدماغ وتقييم التعديل العصبي الكيميائي الوراثي
In This Article
Summary
يحدد هذا البروتوكول الخطوات اللازمة لتوصيل الجينات من خلال فتح حاجز الدم الدماغي بالموجات فوق الصوتية المركزة (BBB) ، وتقييم التعبير الجيني الناتج ، وقياس نشاط التعديل العصبي للمستقبلات الكيميائية الجينية من خلال الاختبارات النسيجية.
Abstract
يسمح علم الوراثة الكيميائية المستهدف صوتيا (ATAC) بالتحكم غير الجراحي في دوائر عصبية محددة. يحقق ATAC هذا التحكم من خلال مزيج من الموجات فوق الصوتية المركزة (FUS) التي يسببها فتح الحاجز الدموي الدماغي (FUS-BBBO) ، وتوصيل الجينات باستخدام النواقل الفيروسية المرتبطة بالغدي (AAV) ، وتنشيط الإشارات الخلوية باستخدام مستقبلات البروتين المهندسة والكيميائية والروابط المشابهة لها. مع ATAC ، من الممكن تحويل كل من مناطق الدماغ الكبيرة والصغيرة بدقة ملليمتر باستخدام تطبيق واحد للموجات فوق الصوتية غير الباضعة. يمكن أن يسمح هذا النقل لاحقا بتعديل عصبي طويل الأمد وغير جراحي وخالي من الأجهزة في الحيوانات التي تتحرك بحرية باستخدام دواء. نظرا لاستخدام FUS-BBBO و AAVs وعلم الوراثة الكيميائية في متعددة ، يجب أن يكون ATAC أيضا قابلا للتطوير للاستخدام في الأنواع الحيوانية الأخرى. تتوسع هذه الورقة في بروتوكول تم نشره سابقا وتحدد كيفية تحسين توصيل الجينات باستخدام FUS-BBBO إلى مناطق الدماغ الصغيرة باستخدام توجيه التصوير بالرنين المغناطيسي ولكن دون الحاجة إلى جهاز FUS معقد متوافق مع التصوير بالرنين المغناطيسي. يصف البروتوكول أيضا تصميم مكونات استهداف الماوس وتقييد النفس التي يمكن طباعتها 3D بواسطة أي مختبر ويمكن تعديلها بسهولة لأنواع مختلفة أو معدات مخصصة. للمساعدة في التكاثر ، يصف البروتوكول بالتفصيل كيفية استخدام الفقاعات الدقيقة و AAVs وبزل الوريد في تطوير ATAC. أخيرا ، يتم عرض مثال على البيانات لتوجيه التحقيقات الأولية للدراسات التي تستخدم ATAC.
Introduction
أدى استخدام تقنيات التعديل العصبي الخاصة بالدائرة ، مثل علم البصرياتالوراثي 1،2 وعلم الوراثة الكيميائي3،4،5 ، إلى تعزيز فهمنا للحالات النفسية مثل اضطرابات الدائرة العصبية. من الصعب دراسة الدوائر العصبية ويصعب التحكم فيها في علاج اضطرابات الدماغ لأنها عادة ما يتم تحديدها من خلال أنواع معينة من الخلايا ومناطق الدماغ ومسارات الإشارات الجزيئية وتوقيت التنشيط. من الناحية المثالية لكل من التطبيقات البحثية والسريرية ، سيتم ممارسة هذا التحكم بشكل غير جراحي ، ولكن تحقيق كل من التعديل العصبي الدقيق وغير الباضع يمثل تحديا. على سبيل المثال ، في حين أن الأدوية العصبية يمكن أن تصل إلى الدماغ بشكل غير جراحي ، إلا أنها تفتقر إلى الخصوصية المكانية من خلال العمل في جميع أنحاء الدماغ. من ناحية أخرى ، يمكن للتحفيز الكهربائي العميق للدماغ التحكم في مناطق معينة من الدماغ ولكنه يواجه صعوبة في التحكم في أنواع معينة من الخلايا ويتطلب جراحة ووضع الجهاز6.
يوفر علم الوراثة الكيميائية المستهدفصوتيا 7 (ATAC) تعديلا عصبيا بخصوصية مكانية ونوع الخلية والزمانية. فهو يجمع بين ثلاث تقنيات: فتح الحاجز الدموي الدماغي المستحث بالموجات فوق الصوتية المركزة (FUS-BBBO) للاستهداف المكاني ، واستخدام النواقل الفيروسية المرتبطة بالغدي (AAVs) لتوصيل الجينات بشكل غير جراحي تحت سيطرة المروجين من نوع الخلية ، والمستقبلات الكيميائية المهندسة لتعديل الدوائر العصبية المنقولة بشكل انتقائي عن طريق إدارة الدواء. FUS هي تقنية معتمدة من إدارة الغذاء والدواء الأمريكية (FDA) تستفيد من قدرة الموجات فوق الصوتية على التركيز بعمق داخل الأنسجة ، بما في ذلك الدماغ البشري ، بدقة مكانية ملليمترية. في الطاقة العالية ، يتم استخدام FUS للاستئصال المستهدف غير الباضع ، بما في ذلك العلاج المعتمد من إدارة الغذاء والدواء للرعاشالأساسي 8. يجمع FUS-BBBO بين الموجات فوق الصوتية منخفضة الكثافة والفقاعات الدقيقة التي تدار بشكل منهجي ، والتي تتذبذب في الأوعية الدموية عند تركيز الموجات فوق الصوتية ، مما يؤدي إلى فتح موضعي ومؤقت (6-24 ساعة) وقابل للانعكاس ل BBB9. تسمح هذه الفتحة بتوصيل البروتينات9،10 ، والجزيئات الصغيرة 11 ، والنواقل الفيروسية7،12،13،14 إلى الدماغ دون تلف كبير في الأنسجة في القوارض 10 والرئيسيات غير البشرية 15. التجارب السريرية جارية ل FUS-BBBO16,17 ، مما يشير إلى التطبيقات العلاجية المحتملة لهذه التقنية.
كما أن توصيل الجينات الفيروسية باستخدام AAV يتقدم بسرعة في الاستخدام السريري لاضطرابات الجهاز العصبي المركزي ، مع الموافقات التنظيمية الأخيرة لإدارة الغذاء والدواء والاتحاد الأوروبي كمعالم رئيسية. أخيرا ، تستخدم المستقبلات الكيميائيةالجينية 18 ، مثل المستقبلات المصممة التي يتم تنشيطها حصريا بواسطة الأدوية المصممة (DREADDs) ، على نطاق واسع من قبل علماء الأعصاب لتوفير التحكم الدوائي في الإثارة العصبية في الحيوانات المعدلة وراثيا أو المنقولة19,20. DREADDs هي مستقبلات مقترنة بالبروتين G (GPCRs) تم هندستها وراثيا للاستجابة للجزيئات الكيميائية الاصطناعية بدلا من الروابط الداخلية ، بحيث تزيد الإدارة الجهازية لهذه الروابط أو تقلل من استثارة الخلايا العصبية المعبرة عن DREADD. عندما يتم دمج هذه التقنيات الثلاث في ATAC ، يمكن استخدامها للتعديل غير الباضع للدوائر العصبية المختارة بدقة مكانية ونوع الخلية والزمانية.
هنا ، نقوم بتوسيع وتحديث بروتوكول تم نشره مسبقا ل FUS-BBBO11 من خلال تضمين منهجية للاستهداف الدقيق لمناطق الدماغ باستخدام FUS-BBBO في الفئران باستخدام معدات استهداف مطبوعة 3D بسيطة. نعرض أيضا تطبيقا ل FUS-BBBO على ATAC. نعرض الخطوات اللازمة لتسليم AAVs التي تحمل مستقبلات كيميائية وراثية ، وتقييم التعبير الجيني والتعديل العصبي عن طريق الأنسجة. هذه التقنية قابلة للتطبيق بشكل خاص لاستهداف مناطق كبيرة أو متعددة من الدماغ للتعبير الجيني أو التعديل العصبي. على سبيل المثال ، يمكن بسهولة تحويل مساحة واسعة من القشرة باستخدام FUS-BBBO وتعديلها باستخدام علم الوراثة الكيميائي. ومع ذلك ، فإن توصيل الجينات بتقنية بديلة ، الحقن داخل الجمجمة ، يتطلب عددا كبيرا من الحقن الغازية وحج القحف. يمكن توسيع نطاق FUS-BBBO وتطبيقه ، ATAC ، إلى ذات أحجام مختلفة ، حيث تكون مناطق الدماغ أكبر ويصعب استهدافها بشكل غازي.
Protocol
أجريت جميع التجارب بموجب بروتوكول معتمد من قبل اللجنة المؤسسية لرعاية واستخدام الحيوانات التابعة لمعهد كاليفورنيا للتكنولوجيا ، حيث تم الحصول على البيانات في الأصل بواسطة J.O.S.
1. تصميم والطباعة 3D من تسخير الحيوانات وأجهزة توجيه الصور
- استخدم الملفات من موقع مختبر Szablowski على: https://www.szablowskilab.org/downloads للطباعة 3D للمكونات.
- تأكد من أن مادة الطباعة لديها حساسية منخفضة في التصوير بالرنين المغناطيسي ولكن لديها دعم مرئي للتصوير بالرنين المغناطيسي. راجع تفاصيل المواد المستخدمة في قسم المواد والكواشف.
- ضع في اعتبارك تدهور المواد باستخدامات متعددة عن طريق اختبار المواد بشكل متكرر ومراقبة مواقع التآكل التي يجب تعزيزها. تأكد من أن الجدران المطبوعة لا يقل سمكها عن 2 مم.
- استخدم طابعات 3D عالية الدقة لتحسين دقة الاستهداف.
- مواجهة الجاذبية والقوى الأخرى لتجنب انحراف المكونات البلاستيكية المطبوعة 3D من خلال دعم المكونات على طولها وزيادة سمك الجدران المطبوعة 3D إذا لوحظ أي انحناء.
- ضع في اعتبارك الدقة في محاور متعددة بما في ذلك المحاور الأمامية / الخلفية ، والإنسية / الجانبية ، والظهرية / البطنية ، وكذلك الانعراج ، والميل ، والإمالة.
- اختبر دقة الاستهداف عن طريق إجراء FUS-BBBO وتسجيل الانحراف عن الموضع المستهدف.
- في حالة استخدام أنظمة التجسيم الآلية ، قم بتقييم تأثيرات الحركة الديناميكية على مرونة المواد عن طريق تسجيل إجراء استهداف FUS-BBBO على الفيديو ، وتصحيح أي انحرافات عن طريق زيادة سماكة جدران المواد المطبوعة 3D.
2. وصف نظام الموجات فوق الصوتية
- استخدم نظام الموجات فوق الصوتية مع محول صفيف حلقي مكون من ثمانية عناصر (القطر = 25 مم ، النقطة البؤرية الطبيعية = 20 مم ؛ الفتحة (F) = 0.8)) وإقران السكن على الرأس مع هلام الموجات فوق الصوتية منزوع الغازات عن طريق وضع هلام على رأس الفأر حليق.
ملاحظة: كان التردد المركزي لمحول الطاقة المستخدم في دراسة سابقة7 هو 1.5 ميجاهرتز ، وكانت مدة النبضة 10 مللي ثانية ، وكان تردد تكرار النبضة 1 هرتز على 120 ثانية. تمت معايرة الضغوط باستخدام هيدروفون الألياف الضوئية والحفاظ عليها بين 0.36-0.45 ميجا باسكال. افترض 18٪ توهين صوتي من خلال الجمجمة21 ل 1.5 ميغاهيرتز والعظم الجداري. تم وصف مجموعة الشروط المناسبة لفتح BBB الآمن وتسليم AAV في مكان آخر بالتفصيل7،14،22.
3. إعداد الحيوان
- تخدير فأر واحد باستخدام استنشاق الأيزوفلوران بنسبة 2٪ بهواء طبي. تحقق من عمق التخدير عن طريق قرصة اللمس للتأكد من عدم الاستجابة. بعد ذلك ، ضع مرهما للعين لمنع جفاف القرنية باستخدام طرف Q-tip معقم يستخدم مرة واحدة لمنع التلوث المتبادل لأنبوب المرهم.
ملاحظة: يمكن أن يتراوح الإجراء النموذجي ل FUS-BBBO بين 30 دقيقة إلى 2 ساعة ، ويجب الحفاظ على التخدير طوال الوقت. - بعد تخدير الفأر ، اغسل قسطرة نظيفة بمحلول ملحي هيبارين (10 وحدة / مل).
ملاحظة: تحتوي القسطرة المناسبة للفأر 25-35 جم على إبرة 30 جم وأنبوب PE10. - تطهير ذيل الماوس في وقت لاحق مع وسادة الإيثانول 70 ٪. ضع قسطرة الوريد الذيل في وريد الذيل الجانبي وقم بتثبيتها بغراء أنسجة. راقب التدفق العكسي للدم من الوريد الذيل إلى القسطرة لتأكيد وضعها.
- حلق رأس الفأر ثم استخدم كريم إزالة الشعر بعد أن يجف غراء الأنسجة لتقليل احتمالية احتجاز فقاعات الهواء تحت هلام بالموجات فوق الصوتية أثناء التسمية.
- ضع الماوس في عربة التصوير بالرنين المغناطيسي المطبوعة 3D ، وتركيب الأسنان الأمامية على شريط لدغة والرأس داخل مخروط الأنف (الشكل 1 أ).
- حقن ما يصل إلى 10 ميكرولتر يدوكائين تحت الجلد في الموقع الاتصال بقضبان الأذن الحادة. بعد ذلك ، قم بتثبيت القضبان الحادة على الجمجمة وتطبيق كميات آمنة من الضغط ، مع الحرص على عدم الضغط على القصبة الهوائية لأنها تعيق التنفس. راقب التنفس لمدة 30 ثانية للتأكد من أن الحيوان يتنفس بحرية بمعدل 1 / ثانية.
- قم بتوصيل دليل الاستهداف بقضبان الأذن ، وتحقق من التنفس كما في الخطوة 3.6 (الشكل 1 ب) ، واستمر في مراقبة التنفس بصريا طوال العملية كل دقيقة. معدل التنفس المرتفع فوق 1 / ثانية هو أحد مؤشرات فقدان التخدير. استمر في مراقبة استجابة قرصة إصبع القدم كل 5 دقائق عندما لا تكون الفئران في ماسح التصوير بالرنين المغناطيسي أو إذا كان معدل التنفس مرتفعا فوق 1 / ثانية.
- انقل عربة التصوير بالرنين المغناطيسي إلى حامل التصوير بالرنين المغناطيسي ثم داخل تجويف المغناطيس.
ملاحظة: تم تحسين تصميم الجهاز لملف 72 مم داخل التصوير بالرنين المغناطيسي 7T. - الحصول على تسلسل التصوير بالرنين المغناطيسي لتوطين الماوس في الماسح الضوئي.
- حدد تسلسل اللقطة السريعة ذات الزاوية المنخفضة 3D (FLASH) للحصول على الدماغ بالكامل ، باستخدام المعلمات التالية ، وفقا لتعليمات محددة من الشركة المصنعة للأداة. وقت الصدى: 3,9 مللي ثانية, زمن التكرار: 15 مللي ثانية, زاوية نبض الإثارة: 15 درجة, حجم المصفوفة: 130 × 130 × 114, الدقة: 350 × 200 × 200 ميكرومتر لكل فوكسل, المتوسطات: 1, وقت الاستحواذ: 3 دقائق و42 ثانية
- نقل الملفات من نظام التصوير بالرنين المغناطيسي إلى جهاز كمبيوتر يتحكم في نظام FUS.
- افتح تسلسل التصوير في البرنامج لإجراء الاستهداف الموجه بالتصوير بالرنين المغناطيسي ، حيث يجب أن تظهر الصورة كما في الشكل 1 ج.
4. الاستهداف الموجه بالتصوير بالرنين المغناطيسي
ملاحظة: مع استخدام أدلة الاستهداف المصممة خصيصا ، ليس من الضروري وضع محول الموجات فوق الصوتية داخل التصوير بالرنين المغناطيسي ، وليس من الضروري شق الجلد لأداء الاستهداف عن طريق تصفير التركيب النمطي على خطوط bregma و lambda. اتبع الخطوات أدناه لتنفيذ عملية الاستهداف.
- ضع العربة داخل أداة مجسمة. قم بتثبيته في مكانه باستخدام كتلة معدنية بشريط على الوجهين وبالضغط على العربة مقابل وظيفتي دعم للأداة المجسمة.
- انقل صور التصوير بالرنين المغناطيسي إلى جهاز كمبيوتر باستخدام برنامج توجيه FUS قيد التشغيل عن طريق تحديد الملفات في مدير البيانات ، والنقر بزر الماوس الأيمن لإحضار خيارات القائمة ، وتحديد "نقل على الفور".
- افتح برنامج توجيه FUS وقم بتحميل الصورة بالنقر فوق "فتح التسلسل" وتحميل جميع ملفات تسلسل التصوير.
- أعد تنسيق الصورة إلى ثلاثة محاور بالضغط بزر الماوس الأيمن و "إعادة تنسيق".
- قم بتوطين محول الطاقة إلى دليل الاستهداف الدائري (الشكل 1 ج) بالنقر بزر الماوس الأيمن.
- في العرض السهمي ، اضبط الوضع الرأسي لمحول الطاقة الافتراضي لحساب سمك حمام الماء ومبيت محول الطاقة (في هذه الحالة - 8.2 مم لأعلى ، الشكل 1 د).
- أشر إلى المنطقة (المناطق) المراد استهدافها في مخطط المسار ولاحظ الإحداثيات في جدول بيانات (في هذه الحالة - الدماغ المتوسط ، كما في الشكل 1 د).
- اطلب عمق الاستهداف المطلوب (قيمة z في المسار الإلكتروني (الشكل 2) ولاحظ الإحداثيات في جدول بيانات.
- استهدف كل نقطة بالضغط على "إرسال المسار" و "التنفيذ" (الشكل 2).
ملاحظة: يتم ذلك عند وضع حامل ماوس داخل المحركات. ومع ذلك ، يمكن تحقيق نفس الاستهداف بدقة عالية على أداة مجسمة. - لربط إحداثيات التصوير بالرنين المغناطيسي بالإطار التجسيمي ، ضع محول الطاقة المثبت خصيصا فوق دليل الاستهداف وترجم حتى يتمكن كل من مسامير الاستهداف الثلاثة (الشكل 3 ، العنصر أ) من المرور عبر كل من حامل محول الطاقة (الشكل 3 ، العنصر ب) ودليل الاستهداف (الشكل 3 ، العنصر ج). تأكد من أن البراغي ليست تحت الشد أو الإمالة.
- ترجمة محول الطاقة 10.56 مم إلى الأمام في الاتجاه الأمامي / الخلفي حتى يقع في نفس المكان الذي يظهر فيه مركز دليل الاستهداف في التصوير بالرنين المغناطيسي.
- حدد المسافة من مركز محول الطاقة الظاهري (الشكل 3 أ ، العنصر أ) إلى المنطقة المستهدفة (الشكل 3 أ ، العنصر ب) ، وانقل محول الطاقة إلى هذه الإحداثيات باستخدام إطار التجسيم.
- المضي قدما في إعداد محلول الحقن.
5. إعداد محلول الحقن
ملاحظة: محاليل الفقاعات الدقيقة حساسة للغاية للضغط. وبالتالي ، فإن الخلط القوي أو الحقن السريع من خلال الإبر الرفيعة يمكن أن يؤدي إلى انهيار الفقاعات الدقيقة وتقليل فعالية فتح BBB. بالإضافة إلى ذلك ، تكون الفقاعات الدقيقة أخف من الماء ويمكن أن تطفو إلى أعلى الأنبوب أو القسطرة أو المحقنة (الشكل 4) على سبيل المثال ، في حاقن أوتوماتيكي. يوصى بشدة بإعادة تعليق محلول الفقاعات الدقيقة مباشرة قبل كل حقنة.
- اسحب 0.8 مل محلول ملحي باستخدام حقنة في أنبوب سعة 1.5 مل.
- باستخدام حقنة ، أضف 0.1 مل من عامل تباين التصوير بالرنين المغناطيسي في نفس الأنبوب 1.5 مل واخلطه.
- أحضر محلول الفقاعة الدقيقة23,24 غير المنشط إلى درجة حرارة الغرفة.
- قبل التسمية مباشرة ، قم بتنشيط الفقاعات الدقيقة لمدة 45 ثانية في جهاز تنشيط الفقاعات الدقيقة.
- ببطء (أكثر من ~ 3 ثوان) سحب 0.1 مل من الفقاعات الدقيقة باستخدام حقنة 1 مل من السل وإبرة 21 جم من العمق المتوسط للسائل.
- أضف 0.08 مل من الفقاعات الدقيقة إلى محلول عامل التباين والمحلول الملحي المحضر في الخطوة 5.3. تخلط عن طريق النقر باليد لمدة 15 ثانية.
- مع التركيز النهائي ل AAVs هو 0.5-2 × 10 10 جزيئات فيروسية لكل جرام من وزن الجسم (VP / g) ، قم بحقن الشحنة للتسليم (في هذه الحالة AAV9) من خلال إبرة30 G في قسطرة الوريد الذيل ، في حالة ATAC - AAVs التي تحمل مستقبلات كيميائية وراثية ، أو عنصر تحكم سلبي ، مثل AAVs التي تحمل GFP تحت نفس المروج.
- امزج الفقاعات الدقيقة يدويا لمدة 15 ثانية مرة أخرى لتجنب الطفو (الشكل 4).
- بعد ذلك مباشرة ، قم بنضح 200 ميكرولتر من محلول الفقاعات الدقيقة من خلال حقنة بدون إبرة متصلة. سيؤدي عدم وجود إبرة إلى تقليل قوى القص على الفقاعات الدقيقة.
- اقلب المحقنة واخلطها بالضغط على المكبس لأعلى ولأسفل.
- قم بتوصيل إبرة 30 G ، وبينما لا تزال مقلوبة ، ادفع الفقاعات الدقيقة ببطء حتى تظهر القطرات في نهاية الإبرة.
6. إجراء التنويم
- اضبط معلمات insonation: مدة النبض 10 مللي ثانية ، و 120 تكرارا ، كل ثانية ، وضغط 0.30-0.45 ميجا باسكال في الجمجمة.
- قم بإزالة دليل الاستهداف ، وقم بتطبيق جل الموجات فوق الصوتية الذي تم تفريغه على رأس الماوس ، مع التأكد من عدم تكوين فقاعات.
- اخفض محول الطاقة وضعه مباشرة على حامل قضيب الأذن المسطح ، واطلب الإحداثيات في الأدوات المجسمة (الشكل 5).
- حقن محلول AAV (0.5-2 × 1010 VP / g).
- امزج الفقاعات الدقيقة ومحلول عامل التباين بالرنين المغناطيسي لمدة 15 ثانية وحقن 80 ميكرولتر لكل 30 جم من الفأر.
- قم بتطبيق الموجات فوق الصوتية على الفور لمدة 120 ثانية بالضغط على "إرسال" و "تنفيذ".
- إذا تم استهداف أكثر من موقع واحد، انقل محول الطاقة إلى هذا الموقع واضبط استهداف العمق بالأرقام التالية في جدول البيانات من الخطوات 4.7 إلى 4.9. ثم كرر الخطوات 6.5-6.6 لكل موقع insonated.
7. تقييم التصوير بالرنين المغناطيسي لفتح BBB
ملاحظة: تم وصف تقييم التصوير بالرنين المغناطيسي لفتحة BBB بالتفصيل في مكان آخر11. يمكن تصور موقع فتحة BBB كمناطق أكثر إشراقا في الفئران التي تلقت حقنة من عامل تباين Gd المرجح T1.
- بعد تطبيق الموجات فوق الصوتية ، سجل تسلسل التصوير بالرنين المغناطيسي كما في الخطوة 3.10.
- أخرج الماوس من ماسح التصوير بالرنين المغناطيسي ، وضعه في قفص استرداد للسماح بالتعافي من التخدير. راقب الفئران يوميا بحثا عن علامات الضيق أو فقدان الوزن أو نقاط النهاية الإنسانية الأخرى. استشر الموظفين البيطريين وإرشادات IACUC المؤسسية للمضي قدما في أي علاج في حالة حدوث أحداث سلبية غير متوقعة.
8. تحفيز DREADD مع ليجند كيميائي
- اختر مستقبلات كيميائية وراثية. بالنسبة إلى DREADDs ، اختر مستقبل hM3Dq للتنشيط العصبي عبر المسارات المقترنة Gq19 ، أو مستقبل hM4Di لتثبيط النشاط العصبي من خلال المسارات المقترنة Gi / o20 ، أو مستقبل KORD لتنشيط الخلايا العصبية عبر المسارات المقترنة Gs باستخدام Salvinorin-B ligand25.
- قم بإذابة كلوزابين ن أوكسيد (CNO) في محلول ملحي معقم بتركيز 1 مجم / مل. قم بتخزين CNO المقتبس في درجة حرارة -20 درجة مئوية.
- تطبيق CNO 19، أو ليجند كيميائي آخر26،27،28، من خلال الطريق داخل الصفاق بتركيز يتراوح بين 0.3 –10 ملغم/كغم.
- إذا كان سيتم تسجيل آثار CNO على السلوك ، فابدأ في تسجيل النشاط السلوكي في غضون 15-45 دقيقة بعد تناول الدواء لتحقيق أقصى تنشيط ل DREADDs19.
- إذا كان تحليل التنشيط العصبي مطلوبا ، استخدم الفئران للتقييم النسيجي بعد 60-120 دقيقة بعد الحقن.
- انتقل إلى القتل الرحيم من خلال التروية القلبية (انظر القسم 9).
9. التقييم النسيجي للتعبير الجيني والتنشيط الكيميائي الوراثي
ملاحظة: بمجرد تحقيق نقطة النهاية التجريبية (على سبيل المثال ، نهاية الدراسة السلوكية ، والوقت اللازم للتعبير الجيني) ، من الأهمية بمكان تأكيد موقع ووجود التعبير الجيني.
- بعد التنشيط باستخدام الرباط الكيميائي الوراثي ، قم بإجراء نضح القلب للحفاظ على الأنسجة.
- تخدير الفأر بخليط الكيتامين (100 ملغ/كغ) / زيلازين (10 ملغ/كغ) في محلول ملحي معقم من خلال حقن IP. تأكد من التخدير بقرصة إصبع القدم وتأكد من خفض معدل التنفس إلى حوالي 1 / ثانية. توفير الدعم الحراري من خلال وسادة التدفئة حتى تأكيد القتل الرحيم.
- تحضير 10٪ فورمالين مخزن محايد (NBF) و PBS مع 10 وحدات من الهيبارين لكل مل.
ملاحظة: يجب أن تكون المحاليل عند 4 درجات مئوية. - صب كل مخزن مؤقت في أنابيب منفصلة سعة 50 مل وقم بتوصيلها ، وقم بتجهيز مضخة تمعجية متصلة بقسطرة فراشة 25 جم بمحلول PBS / heparin.
- نعلق الأطراف إلى وسادة زرقاء ماصة مع الشريط والتأكد من أن يتم وضع الحيوان في وضع ضعيف على وسادة. تطهير الفراء لتجنب التلوث المتبادل للأعضاء الطرفية في حالة الحاجة إلى جمعها.
- افتح التجويف البريتوني عن طريق شق عرضي ، وكشف الحجاب الحاجز.
- افتح القفص الصدري من خلال قطعتين من المقص الجراحي على طول المحور الأمامي / الخلفي.
- كشف القلب ووضع الإبرة في الحجرة اليسرى (الجانب الأيمن من القلب كما هو موضح مستلق) ووضعها في قسطرة الفراشة في الخطوة 9.1.3.
- قم بعمل شق صغير في البطين الأيمن للسماح بتدفق الدم.
- قم بتشغيل المضخة التمعجية لبدء طرد الدم باستخدام برنامج تلفزيوني / هيبارين.
ملاحظة: إذا لم يتم تنفيذ هذه الخطوة بشكل كاف ، فسوف يتجلط الدم أثناء التثبيت بالفورمالين ويمنع التروية المناسبة. - بعد أن يتم طرد كل الدم ويبدأ برنامج تلفزيوني واضح في الخروج من البطين الأيمن ، قم بتبديل مدخل المضخة التمعجية إلى محلول NBF وابدأ التروية لمدة 25 مل لكل فأر.
- استخراج الدماغ، ووضع في ما لا يقل عن 4 مل من NBF وبعد الإصلاح لمدة 24 ساعة.
- قسم الدماغ باستخدام المقاطع الإكليلية على الاهتزاز باستخدام سمك مقطع 50 ميكرومتر.
- ضع كل قسم في بئر من 24 صفيحة بئر تخزن الأقسام في جميع أنحاء الدماغ.
- تقييم تعبير المستقبلات الكيميائية الجينية المنصهرة مع البروتينات الفلورية (على سبيل المثال ، mCherry أو mCitrine) ، تحت المجهر الفلوري لتحديد الأقسام التي تظهر التعبير لتأكيد الموقع. من المحتمل أن يكون التعبير خافتا.
- أداء المناعية ضد الفلوروفور باستخدام البروتوكول التالي:
- ضع 3 أقسام في 0.5 مل من المحلول الذي يحتوي على 10٪ مصل من مجموعة من الأجسام المضادة الثانوية واحتضانها لمدة 30 دقيقة.
- انقل الأقسام إلى محلول لجسم مضاد أولي عند تخفيف 1: 250 - 1: 1,000 ، باستخدام 1: 500 كنقطة انطلاق.
- احتضان الأقسام بالأجسام المضادة الأولية طوال الليل عند 4 درجات مئوية في صفيحة مجهرية مختومة بغشاء بارافين.
- اغسل الأقسام باستخدام برنامج تلفزيوني ، 3 مرات لمدة 5 دقائق في المرة الواحدة.
- أضف 0.5 مل لكل بئر من محلول الأجسام المضادة الثانوي في مصل 10٪.
- احتضان لمدة 4 ساعات في درجة حرارة الغرفة.
- اغسل الأقسام باستخدام برنامج تلفزيوني ، 3 مرات لمدة 5 دقائق في المرة الواحدة.
- قم بالتركيب على شرائح بوسط تثبيت مائي يحتوي على بقعة نووية (على سبيل المثال ، DAPI).
- قم بتقييم التوطين والانتشار باستخدام مجهر متحد البؤر عن طريق إجراء مسح للبلاط لقسم بأكمله.
- تقييم شدة التعبير عن طريق قياس شدة بكسل مضان في مناطق الدماغ المستهدفة ومقارنتها مع السيطرة المحقونة داخل الجمجمة.
- بدلا من ذلك ، قم بتقييم النسبة المئوية للخلايا العصبية الإيجابية عن طريق حساب الخلايا الملطخة بالمستقبلات الكيميائية الجينية ، مقارنة بالخلايا الإيجابية DAPI ، أو العلامات الخاصة بالخلية.
- تقييم تلف الأنسجة عن طريق إجراء تلطيخ الهيماتوكسيلين على قسم 50 ميكرومتر والتصوير لفقدان الخلايا ، وتراكم حطام الخلايا ، وغيرها من علامات الضرر الجسيم.
- لتقييم خصوصية استهداف الخلايا ، قم بإجراء تلطيخ مناعي مزدوج كما هو موضح أدناه للمستقبل الكيميائي الوراثي وعلامة خاصة بالخلية. ثم قم بإجراء الأعداد الموجبة للخلايا كما في الخطوة 9.8.
- ضع 3 أقسام في 0.5 مل من محلول يحتوي على 10٪ مصل من مجموعة من الأجسام المضادة الثانوية واحتضانها لمدة 30 دقيقة.
- انقل الأقسام إلى محلول لجسم مضاد أولي ضد علامة فلورية لمستقبلات كيميائية وراثية عند تخفيف 1: 250 - 1: 1,000 ، باستخدام 1: 500 كنقطة انطلاق. أضف جسما مضادا أوليا ثانيا من نوع مضيف مختلف يستهدف علامة اهتمام خاصة بالخلية (على سبيل المثال ، CamkIIa).
- احتضان الأقسام بالأجسام المضادة الأولية طوال الليل عند 4 درجات مئوية في صفيحة مجهرية مختومة بغشاء البارافين.
- اغسل الأقسام باستخدام برنامج تلفزيوني ، 3 مرات لمدة 5 دقائق في المرة الواحدة.
- أضف 0.5 مل لكل بئر من محلول الأجسام المضادة الثانوية في مصل 10٪ من الأنواع المضيفة لكلا الجسمين المضادين الثانويين.
ملاحظة: يجب أن يكون لكل جسم مضاد فلوروفور مميز ويجب أن يكون تفاعليا ضد الأجسام المضادة الأولية في الخطوة 9.10.2. - احتضان لمدة 4 ساعات في درجة حرارة الغرفة.
- اغسل الأقسام باستخدام برنامج تلفزيوني ، 3 مرات لمدة 5 دقائق في المرة الواحدة.
- قم بالتثبيت على الشرائح وثبته بوسط تثبيت مائي يحتوي على بقعة نووية.
10. تقييم التنشيط العصبي مع التلوين المناعي ل c-Fos
- قم بإجراء تلطيخ c-Fos كما في النقطة 9.5 من هذا البروتوكول باستخدام جسم مضاد أولي c-Fos وجسم مضاد ثانوي بعلامة فلورية متميزة عن البقعة النووية.
- احسب النسبة المئوية للخلايا الموجبة لكل من c-Fos والبقعة النووية في المنطقة المستهدفة بمستقبل كيميائي.
- تحليل النسبة المئوية للنوى الإيجابية c-Fos في مجموعة من الفئران التي تعبر عن المستقبلات الكيميائية الجينية والمعالجة بالرباط الكيميائي الوراثي أو التحكم في السيارة وفي مجموعة من الفئران البرية التي يتم علاجها برباط كيميائي أو التحكم في السيارة.
النتائج
الخطوة الأولى لتنفيذ بروتوكول ATAC هي استهداف FUS-BBBO لمناطق الدماغ المطلوبة. على سبيل المثال ، باتباع البروتوكول الموصوف ، تم استهداف الحصين باستخدام FUS-BBBO ، وتم حقن عامل التباين و AAV9 الذي يحمل DREADDs في الفئران ، متبوعا بتسلسل التصوير بالرنين المغناطيسي FLASH 3D الذي يكتسب صورا لدماغ الفأر. تم تحقيق تعزيز إشارة T1 في منطقة الحصين (الشكل 6) وفي أجزاء أخرى من الدماغ (الشكل 7). بعد عدة أسابيع ، تم التعبير عن DREADDs داخل منطقة الدماغ المستهدفة. في حين يتم دمج العديد من DREADDs مع مراسل الفلورسنت (مثل mCherry) ، تم العثور على عملية التروية والتثبيت مع الفورمالديهايد لتقليل تألق هذه البروتينات بشكل كبير. أدى التلوين المناعي ضد mCherry أو DREADD إلى اكتشاف أكثر موثوقية للتعبير (الشكل 8) بناء على الخبرة السابقة. في التجارب السابقة ، أظهر ~ 85٪ من الفئران تعبيرا بعد FUS-BBBO7. اختبار بسيط لمستويات كافية من التعبير عن DREADDs هو اختبار وظائفها على المستوى الخلوي. يمكن القيام بذلك ، على سبيل المثال ، عن طريق توفير ليجند كيميائي أو تحكم ملحي ، مثل CNO19 أو deschloroclozapine28 أو غيرها29 ، والانتظار لمدة ساعتين قبل التروية القلبية والتثبيت. ثم تم تلطيخ أقسام الدماغ بشكل مشترك لبروتين c-Fos30 ، مما يشير إلى زيادة نشاط الخلايا العصبية ، و DREADD. اعتبرت التجربة ناجحة ، إذا أظهر موقع الدماغ المستهدف ب DREADDs عددا أكبر بكثير من النوى العصبية الإيجابية c-Fos في المجموعة التي تلقت رباطا كيميائيا عند مقارنتها بالمجموعة التي تلقت محلول ملحي7 أو مقارنة بموقع مقابل لم يخضع ل FUS-BBBO. وتجدر الإشارة إلى أن هناك إمكانية لبعض هذه الروابط لتنشيط الخلايا العصبية بشكل غير محدد دون التعبير عن DREADDs. على سبيل المثال ، ثبت أن CNO يتم استقلابه إلى مستويات منخفضة من كلوزابين في الفئران ، والذي يعبر BBB وينشط DREADDs بقوةعالية 27. ومع ذلك ، فقد ثبت أيضا أنه يرتبط بمواقع غير محددة. كما هو الحال في كل تجربة ، من الأهمية بمكان تضمين جميع الضوابط المناسبة في الدراسات الكيميائيةالوراثية 31. أحد عناصر التحكم الممكنة هو إعطاء الرباط الكيميائي الوراثي للفئران البرية ، دون إجراءات ، لاستبعاد آثار الدواء وحده على الفحص السلوكي أو النسيجي المطلوب. يمكن أن يكون عنصر التحكم الآخر هو تضمين أربع مجموعات: DREADD + ligand ، DREADD + مركبة ، EGFP + ligand ، EGFP + مركبة ، والتي ستفسر أي آثار محتملة لكل من توصيل الجينات باستخدام FUS-BBBO ، والرباط الكيميائي الوراثي.
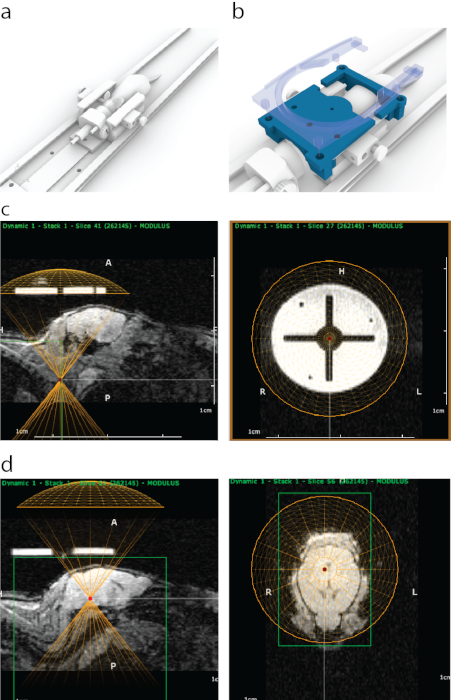
الشكل 1: عملية الاستهداف الموجه بالرنين المغناطيسي ل FUS في ATAC. (أ) وضع الفأرة مع قضبان الأذن ومخروط الأنف ومنصة يمكن وضعها داخل ماسح التصوير بالرنين المغناطيسي. (ب) تم إرفاق دليل مطبوع 3D (أزرق) مرئي في التصوير بالرنين المغناطيسي بنهايات إطار قضيب الأذن ثم تم تثبيته في مكانه بحامل لفائف التصوير بالرنين المغناطيسي السطحية التي تحتوي على أربعة مسامير إضافية (أزرق شبه شفاف). (ج) ظهور الدليل المطبوع 3D في التصوير بالرنين المغناطيسي السهمي (اللوحة اليسرى) ، مع الجزء السفلي من التمثيل الافتراضي لمحول الطاقة المحاذي (نصف الدائرة الصفراء) مع الجزء السفلي من الدليل. تظهر اللوحة اليمنى مظهر الدليل المطبوع 3D على التصوير بالرنين المغناطيسي من العرض الإكليلي. كانت الدائرة الساطعة مصنوعة من مادة دعم متعددة النفاثات لها تباين قوي في التصوير بالرنين المغناطيسي. تم تشكيل الصليب بالبلاستيك. تمثل الدائرة الصفراء موقع محول الطاقة الذي تمت محاذاته بشكل مركز مع الدليل داخل إطار مجسم. (د) لاستهداف هياكل الدماغ ، تم تحريك محول طاقة افتراضي في الاتجاه z فوق الفئران لمطابقة سمك مخروط / غلاف الموجات فوق الصوتية. في هذه الحالة ، بسبب سمك الحمام المائي ، تم تحريك محول الطاقة 8.2 مم فوق الدليل لاستهداف دقيق. تم اختيار هياكل الدماغ باستخدام بيانات التصوير بالرنين المغناطيسي ، ثم تم تدوين إحداثيات التصوير بالرنين المغناطيسي الخاصة بهم وإدخالها في جهاز التجسيم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
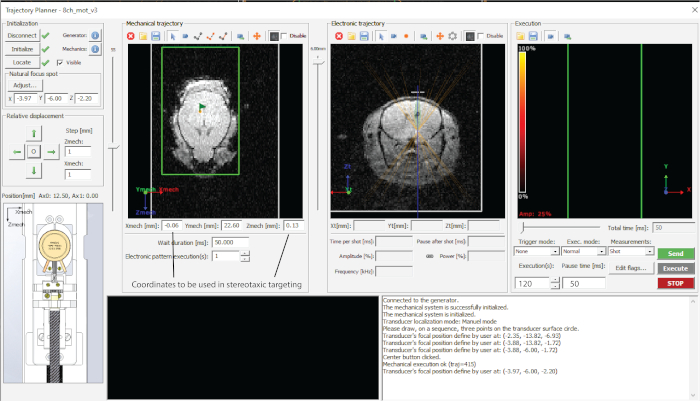
الشكل 2: واجهة البرنامج المستخدم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
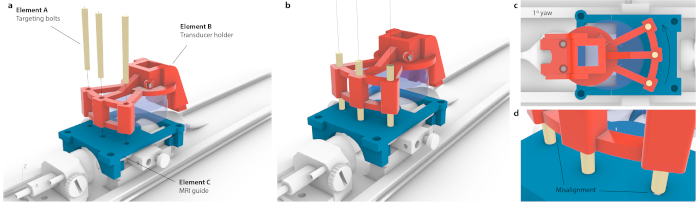
الشكل 3: عملية مطابقة مساحة إحداثيات التصوير بالرنين المغناطيسي مع أداة التجسيم. (أ) تمت محاذاة ثلاثة ثقوب داخل حامل محول الطاقة مع ثلاثة ثقوب داخل دليل التصوير بالرنين المغناطيسي ، وتم إدخال ثلاثة مسامير استهداف مخروطية دون التسبب في ثني المجموعة بأكملها. (ب) من الناحية المثالية ، ستوضع البراغي الثلاثة في وسط الثقوب. (ج) إذا كان هناك أي عدم دقة في المحاذاة ، فلن تتناسب جميع البراغي الثلاثة ، على سبيل المثال ، في حالة الانحراف الصغير غير المحسوس المحتمل بمقدار 1 درجة ، فإن مسمارا واحدا فقط سيكون مناسبا بينما يتم لصق البراغي المقابلة في دليل التصوير بالرنين المغناطيسي. بدلا من ذلك ، يمكن أن يكون هناك ثني مرئي للتجميع بأكمله حيث تم دفع البراغي من خلاله. (د) رؤية موسعة لتركيب المسامير. يجب وضع البراغي بشكل مركز للحصول على أفضل دقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
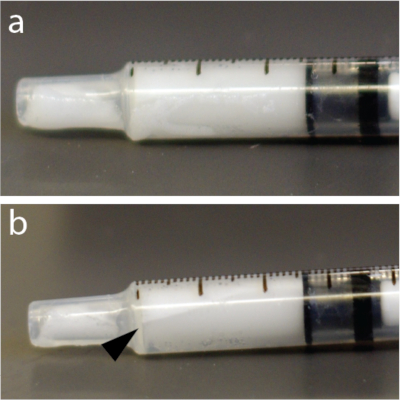
الشكل 4: إعادة التوزيع السريع للفقاعات الدقيقة داخل المحقنة. (أ) تم تصوير حقنة بعد 5 ثوان من الخلط. (ب) وبعد دقيقة واحدة، كانت هناك طبقة واضحة للعيان تظهر بعض الفقاعات مركزة بالقرب من الجزء العلوي من حقنة السل سعة 1 مل. هذا المثال ، على وجه الخصوص ، استخدم محلول الفقاعات الدقيقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
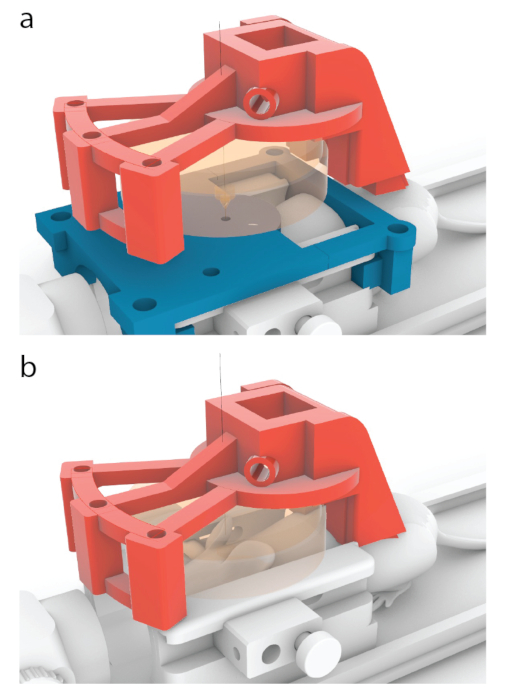
الشكل 5: عملية وضع مركز الترجام فوق مركز موجه التصوير بالرنين المغناطيسي. (أ) في النماذج المبينة في هذه الورقة، صمم الحامل الأحمر بحيث يتحرك بمقدار 10.56 ملم للأمام من الموضع الموضح في الشكل 3 ب إلى الموضع الموضح هنا. (ب) تمت إزالة دليل التصوير بالرنين المغناطيسي الأزرق قبل الصوتنة ، وتم تطبيق هلام الموجات فوق الصوتية بين الماوس ومحول الطاقة (البرتقالي) لضمان مرور الموجات فوق الصوتية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
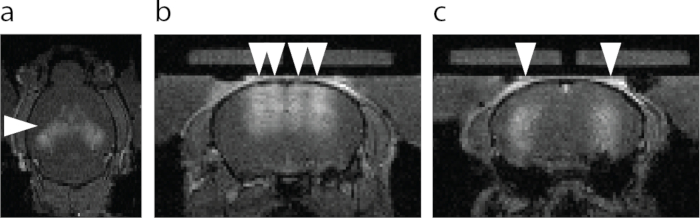
الشكل 6: تصور التصوير بالرنين المغناطيسي لفتحة BBB. (أ) منظر محوري لفتحة BBB. تظهر المنطقة الأكثر إشراقا المخصصة برأس سهم تسرب عامل تباين MRI T1 . (ب) منظر إكليلي للحصين الظهري والقشرة فوق الحصين المستهدفين برؤوس السهام. (ج) منظر إكليلي للحصين المركزي المستهدف برؤوس السهام. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: مثال على استهداف 4 مواقع دماغية باستخدام نظام الاستهداف ثلاثي البراغي الموصوف في هذه الورقة. أظهرت المناطق ذات رؤوس الأسهم BBB مواقع مفتوحة مع انتشار عامل تباين التصوير بالرنين المغناطيسي. تم استهداف المواقع الأربعة على التوالي ، مع ~ 150 ثانية بين كل فتحة BBB ، من الأسفل إلى الأعلى. تم التقاط الصورة في غضون 2 دقيقة بعد افتتاح BBB الأخير. شريط المقياس 2 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
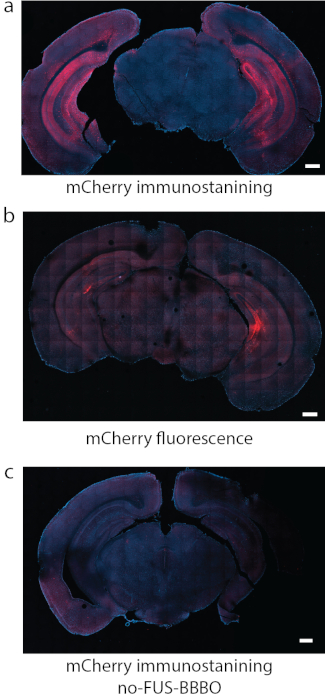
الشكل 8: الكشف عن تعبير DREADD. (أ) التلوين المناعي للفلوروفور المرتبط ب DREADDs ، في هذه الحالة كان mCherry طريقة موثوقة للكشف في بعض الدراسات. (ب) في قسم تمثيلي آخر مع DREADDs التي تستهدف الحصين باستخدام نفس الظروف كما في (أ) ، أنتج مضان mCherry في حد ذاته خلفية قوية وإشارة ضعيفة نسبيا. (ج) كعنصر تحكم سلبي ، تم استخدام فأر تلقى حقنة جهازية من AAV ، لكنه لم يخضع ل FUS-BBBO. لا يمكن العثور على تعبير مهم من خلال mCherry immunostaining. أشرطة المقياس 500 مم. (البيانات في a ، c مقتبسة من7 مع أذونات ، حقوق الطبع والنشر 2020 Nature-Springer). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يتطلب ATAC التنفيذ الناجح للعديد من التقنيات للتعديل العصبي الناجح لدوائر عصبية محددة ، بما في ذلك الاستهداف الدقيق الموجه بالتصوير بالرنين المغناطيسي ، FUS-BBBO ، والتقييم النسيجي للتعبير الجيني. تم تطوير مكونات قابلة للطباعة 3D لتبسيط استهداف هياكل الدماغ الصغيرة باستخدام FUS-BBBO الموجه بالتصوير.
تشكل إدارة الموجات فوق الصوتية المركزة الموجهة بالتصوير بالرنين المغناطيسي (MRIgFUS) عددا من التحديات. أولا ، يحتوي ملف التصوير بالرنين المغناطيسي النموذجي على مساحة محدودة مصممة لاستيعاب عينة فقط وليس أجهزة الموجات فوق الصوتية. تزيد التجاويف الأكبر للتصوير بالرنين المغناطيسي من تكلفة المعدات وتقلل من جودة الصورة ، حيث ترتبط الإشارة بعامل ملء الملف32. وبالتالي ، فإن أي جهاز FUS يوضع أعلى صورة في التصوير بالرنين المغناطيسي سيضر بجودة التصوير. ثانيا ، تصميم الأجهزة المتوافقة مع التصوير بالرنين المغناطيسي أمر صعب ومكلف. يجب أن تكون المواد المتوافقة مع التصوير بالرنين المغناطيسي مغناطيسية ، ولها ميل منخفض لإنشاء تيارات دوامية أثناء تشعيع الترددات الراديوية ، ولها حساسية مغناطيسية منخفضة في المجالات المغناطيسية العالية. في أي مادة موصلة ، فإن إنشاء التيارات الدوامة أو قابليتها المغناطيسية سيؤثر سلبا أيضا على جودة التصوير. أخيرا ، تتميز المواد المتوافقة مع التصوير بالرنين المغناطيسي المتاحة بوحدات ومتانة يونغ أقل من المعادن المستخدمة عادة في إنتاج آلات الاستهداف الدقيقة ، على سبيل المثال ، الإطارات المجسمة. يجب أن تكون المحركات المستخدمة في التعديلات الموضعية متوافقة مع التصوير بالرنين المغناطيسي وتوضع خارج تجويف التصوير بالرنين المغناطيسي نظرا لحجمها. يجب توصيل هذه المحركات على مسافة بمحول الطاقة داخل تجويف التصوير بالرنين المغناطيسي باستخدام مواد متوافقة مع التصوير بالرنين المغناطيسي. أثرت مشكلات تزييف البلاستيك ، وعدم وجود مساحة كافية داخل التجويف لتنفيذ مكونات قوية الحجم ، وعدم كفاية المساحة لتغيير مواضع الاستهداف عبر الدماغ بأكمله على دقة الاستهداف في العمل السابق.
لحل هذه المشاكل ، تم اتخاذ قرار بإجراء التصوير في التصوير بالرنين المغناطيسي وإدارة FUS-BBBO خارج الماسح الضوئي. للسماح بتوجيه التصوير بالرنين المغناطيسي ، تم وضع الفئران داخل تقييد مطبوع 3D يحتوي على دليل استهداف مرئي للتصوير بالرنين المغناطيسي يمكن استخدامه لتوطين هياكل دماغ الفأر في كل من التصوير بالرنين المغناطيسي وفي مساحة إحداثيات التركيب المجسم. نظرا لأن كل من جمجمة الفأر ودليل الاستهداف مرتبطان بقوة بحاملات قضبان الأذن (الشكل 1أ ، ب) ، يمكن استخدام دليل الاستهداف لربط الإحداثيات المكانية داخل صورة التصوير بالرنين المغناطيسي وصفر الأدوات المجسمة. لا يحتوي التقييد على أجزاء متحركة ولا يحتوي على محول طاقة ، مما سمح لنا بجعله قويا وصغيرا بما يكفي ليتناسب مع التصوير بالرنين المغناطيسي وإزالة تداخل الإشارة من إلكترونيات محول الطاقة. تم تجويف المساحة الموجودة داخل دليل الاستهداف حيث أن الدعم المطبوع ثلاثي الأبعاد لبعض المواد مرئي في التصوير بالرنين المغناطيسي (الشكل 1 ج). تم إدخال ثقوب في التجميع لتمكين معايرة التجميع التجسيمي (الشكل 3). تم توصيل محول الطاقة بالموجات فوق الصوتية بحامل قطب كهربائي من بناء مجسم ، وتم إجراء الاستهداف كما هو موضح في القسم 4 (الشكل 1 د). يجب دعم محول الطاقة على طوله عن طريق إسكان قضبان الأذن ، مما يمنع أي انحراف عن مستوى المستوى. يمكن تحقيق الاستهداف في الاتجاه الظهري البطني باستخدام تحولات الطور في مجموعة حلقية.
يتم تحديد دقة الاستهداف العملية من خلال التركيز بالموجات فوق الصوتية وتوهين الجمجمة. تم وصف إجراء FUS-BBBO بالتفصيل للفئران11 وتم تنفيذه في عدد من الكائنات النموذجية الأخرى23،33،34 وفي البشر 16،17. العلاقة بين حجم تركيز الموجات فوق الصوتية تتناسب عكسيا مع التردد ، حيث يمكن أن تؤدي الترددات الأعلى إلى توصيل أكثر دقة. ومع ذلك ، فإن توهين الجمجمة يزداد مع الترددات35 مما قد يؤدي إلى تسخين الجمجمة وتلف المناطق القشرية. تعتمد استراتيجية الاستهداف الدقيقة على موقع الدماغ. تسمح المواقع التي يتناسب فيها الضغط الأقصى بنصف العرض الكامل داخل أنسجة المخ بفتح BBB يمكن التنبؤ به وآمن في العديد من هياكل الدماغ مثل المخطط والدماغ المتوسط والحصين. تشكل المناطق القريبة من قاعدة الدماغ تحديا محددا في الفئران. يقيس دماغ الفأر حوالي 8-10 مم في الاتجاه الظهري البطني ، وهو ما يمكن مقارنته بنصف الحجم الأقصى للعرض الكامل للعديد من محولات الطاقة المتاحة تجاريا. وبالتالي ، يمكن أن يؤدي الاستهداف في الجزء السفلي من الجمجمة إلى انعكاس الموجات فوق الصوتية من العظام والهواء الموجود في قنوات الأذن أو الفم أو القصبة الهوائية مما قد يؤدي إلى أنماط غير متوقعة من الضغوط العالية والمنخفضة36. يمكن لبعض هذه الضغوط عبور عتبة التجويف بالقصور الذاتي والتي ثبت أنها تسبب النزيف وتلف الأنسجة37. لاستهداف المناطق التي تقع بالقرب من قاعدة الجمجمة ، قد يكون من الأفضل استخدام ATAC7 المتقاطع ، حيث يتم استخدام علم الوراثة التقاطعي38 لتقييد التعبير الجيني إلى منطقة أصغر من تلك المستهدفة بحزمة FUS. في المثال المنشور ل ATAC المتقاطع ، تم استهداف معدل وراثيا يعبر عن إنزيم تحرير الجينات (Cre38) في خلايا الدوبامين بالموجات فوق الصوتية في القسم الفرعي من المنطقة التي تحتوي على خلايا الدوبامين. أخيرا ، يمكن استهداف المناطق القشرية باستخدام FUS ، ولكن قد يحدث حيود وانعكاس الموجات فوق الصوتية مما يؤدي إلى ملامح ضغط غير متساوية. لا يغطي هذا البروتوكول استهداف المناطق القشرية لأنه سيعتمد اعتمادا كبيرا على الأنواع المستخدمة. ومع ذلك ، فقد لوحظ بعض استهداف القشرة فوق الحصين 7 (على سبيل المثال ، الشكل 7) مما يشير إلى أنه من الممكن ، على الأقل في الفئران.
يعتمد اختيار المنشط الكيميائي والجرعات على الاحتياجات التجريبية المحددة. أظهر عدد من الدراسات ، بما في ذلك إحدى دراسات المؤلفين7 ، عدم وجود استجابة غير محددة كبيرة39,40 ، في حين أن الجرعات العالية (على سبيل المثال ، 10 مجم / كجم) يمكن أن تنتج آثارا جانبية ، على الأقل في بعض الحالات 41. ومع ذلك ، كما هو الحال مع جميع التجارب السلوكية ، فإن الضوابط المناسبة31 ضرورية بسبب النشاط المحتمل خارج الهدف ل CNO ومستقلباته42. يمكن أن تشمل هذه الضوابط إعطاء CNO والضوابط الملحية للحيوانات التي تعبر عن DREADDs وإعطاء CNO للحيوانات البرية أو في بعض الحالات المحددة مقارنة بين المواقع المماثلة والمقابلة للدماغ التي تعبر ولا تعبر عن المستقبلات الكيميائية الجينية على التوالي. بالإضافة إلى ذلك ، كشفت الأبحاث الحديثة عن عدد من منبهات DREADD الجديدة ذات الخصوصيةالمحسنة 28،29،43. يمكن أيضا استخدام المستقبلات الكيميائية الجينية الأخرى5،25،44 جنبا إلى جنب مع إجراء ATAC.
التقييم النسيجي للتعبير الجيني ضروري بعد الوفاة لكل. يظهر جزء صغير من الحيوانات تعبيرا جينيا ضعيفا بعد FUS-BBBO7. بالإضافة إلى ذلك ، من الضروري إظهار الدقة المكانية وخصوصية التعبير الجيني لأن سوء الاستهداف ممكن. من الجدير بالذكر أن بعض AAVs قد تظهر قدرة تتبع رجعية أو أمامية45 ويمكن أن تسبب انتقالا بعيدا عن الموقع المستهدف بالموجات فوق الصوتية على الرغم من الاستهداف الدقيق بالموجات فوق الصوتية. إذا تم دمج المستقبل الكيميائي الجيني المعبر عنه أو شارك في التعبير عن الفلوروفور ، فقد يكون تصوير الفلوروفور في أقسام الأنسجة كافيا لتقييم التوطين وشدة التعبير. ومع ذلك ، فإن العديد من البروتينات الفلورية تتضرر بسبب عملية تثبيت الأنسجة ، كما أن التلوين المناعي لبروتين mCherry الذي يستخدم بشكل متكرر مع DREADDs أسفر عن إشارة أفضل في الدراسات السابقة7. أخيرا ، نظرا لكثافة الخلايا العصبية في أجزاء معينة من الدماغ (على سبيل المثال ، طبقة الخلايا الحبيبية في الحصين) ، فإن استخدام الفلوروفورات الموضعية نوويا المعبر عنها بموجب IRES ، بدلا من عمليات الاندماج ، لأداء تعداد الخلايا قد يكون مفيدا حيث يمكن تجزئة النوى بسهولة وتلطيخها بالبقع النووية ، مثل DAPI أو TO-PRO-3. لتقييم التعديل العصبي عن طريق تلطيخ c-Fos ، من الضروري إجراء تلطيخ نووي مضاد وحساب نوى c-Fos الموجبة ، بدلا من أي إشارة مضان. في بعض الحالات ، يمكن أن يظهر الحطام الخلوي مضان ويربك قياسات الخلايا الإيجابية.
تشمل قيود توصيل الدواء والجينات باستخدام FUS-BBBO دقة أقل من التسليم بالحقن الغازية داخل الجمجمة والحاجة إلى كميات أكبر من الأدوية المحقونة أو النواقل الفيروسية. بالإضافة إلى ذلك ، في حين أن الحقن المباشر في الدماغ يؤدي إلى توصيل حصري إلى موقع الحقن ، يستخدم FUS-BBBO طريقا وريديا مما يؤدي إلى إمكانية التوصيل إلى الأنسجة المحيطية. تشمل قيود استخدام علم الوراثة الكيميائي للتعديل العصبي نطاقا زمنيا بطيئا ، والذي قد يكون غير كاف لبعض البروتوكولات السلوكية التي تتطلب تغييرات سريعة في شدة التعديل العصبي.
Disclosures
لا يوجد تضارب في المصالح.
Acknowledgements
تم دعم هذا البحث من قبل مؤسسة الدماغ والسلوك ، جائزة NARSAD للباحثين الشباب. تم تصميم العديد من المكونات المطبوعة 3D في الأصل من قبل فابيان رابوسو (العلاج الموجه بالصور ، فرنسا). يشكر المؤلف جون هيث (معهد كاليفورنيا للتكنولوجيا) ومارغريت سويفت (معهد كاليفورنيا للتكنولوجيا) للمساعدة الفنية في إعداد المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| 21-gauge needles (BD) | Fisher Scientific | 14826C | |
| 25-gauge butterfly catheter | Harvard Bioscience | 725966 | |
| 30-gauge needles (BD) | Fisher Scientific | 14826F | |
| Absorbent blue pad | Office Depot | 902406 | |
| Anti-c-Fos antibody | Santa Cruz Biotechnology | SC-253-G | |
| Anti-mCherry antibody | Thermofisher | PA534974 | |
| Bruker Biospec 70/30 | Bruker | custom | includes the RF coils |
| Clozapine-n-oxide | Tocris | 4936 | |
| Custom designed 3D printed mouse harnesses and MRIgFUS targeting components | ImageGuidedTherapy, Szablowski lab | custom | download from szablowskilab.org/downloads |
| Custom MRIgFUS machine | ImageGuidedTherapy | N/A | |
| Definity microbubbles | Lantheus | DE4 | |
| Degassed aquasonic/ultrasound gel | Fisher Scientific | 5067714 | |
| Depilation crème | Nair | n/a | |
| Eight-element annular array transducer | Imasonic Inc. | custom | |
| Ethanol Pads/Alcohol Swabs (70%) (BD) | Office Depot | 599893 | |
| Heparin | Sigma-Aldrich | H3149-25KU | |
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Ketamine | Patterson Veterinary | 07-890-8598 | |
| Neutral buffered formalin (10%) | Sigma-Aldrich | HT501128-4L | |
| Optical fiber hydrophone | Precision Acoustics | ||
| PE10 tubing | Fisher Scientific | NC1513314 | |
| Peristaltic pump | |||
| Phosphate-buffered saline (PBS) | Sigma-Aldrich | 524650-1EA | |
| Prohance contrast agent | Bracco | 0270-1111-04 | |
| Saline | Fisher Scientific | NC9054335 | |
| Secondary antibody, Donkey-anti goat | ThermoFisher | A-11055 | |
| Secondary antibody, Donkey-anti rabbit | ThermoFisher | 84546 | |
| Surgical scissors (straight) | Fisher Scientific | 17467480 | |
| ThermoGuide Software | ImageGuidedTherapy | ||
| Tissue glue (Gluture) | Fisher Scientific | NC9855218 | |
| Tuberculin Syringe (1 mL) (BD) | Fisher Scientific | 14823434 | |
| VeroClear 3D printable material | Stratasys | RGD810 | |
| Vialmix microbubble activation device | Lantheus | VMIX | |
| Vibrating microtome | Compresstome | VF-300 | |
| Xylazine | Sigma-Aldrich | X1251-1G |
References
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
- Zhang, F., Wang, L. -. P., Boyden, E. S., Deisseroth, K. Channelrhodopsin-2 and optical control of excitable cells. Nature Methods. 3, 785-792 (2006).
- Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Roth, B. L. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proceedings of the National Academy of Sciences. 104, 5163-5168 (2007).
- Lerchner, W., et al. Reversible silencing of neuronal excitability in behaving mice by a genetically targeted, ivermectin-gated Cl- channel. Neuron. 54, 35-49 (2007).
- Magnus, C. J., et al. Chemical and genetic engineering of selective ion channel-ligand interactions. Science. 333, 1292-1296 (2011).
- Deeb, W., et al. Proceedings of the fourth annual deep brain stimulation think tank: a review of emerging issues and technologies. Frontiers in Integrative Neuroscience. 10, 38 (2016).
- Szablowski, J. O., Lee-Gosselin, A., Lue, B., Malounda, D., Shapiro, M. G. Acoustically targeted chemogenetics for the non-invasive control of neural circuits. Nature Biomedical Engineering. 2, 475-484 (2018).
- Elias, W. J., et al. A pilot study of focused ultrasound thalamotomy for essential tremor. New England Journal of Medicine. 369, 640-648 (2013).
- Burgess, A., Hynynen, K. Noninvasive and targeted drug delivery to the brain using focused ultrasound. ACS Chemical Neuroscience. 4, 519-526 (2013).
- Kinoshita, M., McDannold, N., Jolesz, F. A., Hynynen, K. Noninvasive localized delivery of Herceptin to the mouse brain by MRI-guided focused ultrasound-induced blood-brain barrier disruption. Proceedings of the National Academy of Sciences U. S. A. 103, 11719-11723 (2006).
- Samiotaki, G., Acosta, C., Wang, S., Konofagou, E. E. Enhanced delivery and bioactivity of the neurturin neurotrophic factor through focused ultrasound-mediated blood-brain barrier opening in vivo. Journal of Cerebral Blood Flow & Metabolism. 35, 611-622 (2015).
- O'Reilly, M. A., Waspe, A. C., Chopra, R., Hynynen, K. MRI-guided disruption of the blood-brain barrier using transcranial focused ultrasound in a rat model. Journal of Visualized Experiments. (61), e3555 (2012).
- Thévenot, E., et al. Targeted delivery of self-complementary adeno-associated virus serotype 9 to the brain, using magnetic resonance imaging-guided focused ultrasound. Human gene Therapy. 23, 1144-1155 (2012).
- Hsu, P. -. H., et al. Noninvasive and targeted gene delivery into the brain using microbubble-facilitated focused ultrasound. PloS One. 8, 58682 (2013).
- Wang, S., Olumolade, O. O., Sun, T., Samiotaki, G., Konofagou, E. E. Noninvasive, neuron-specific gene therapy can be facilitated by focused ultrasound and recombinant adeno-associated virus. Gene Therapy. 22, 104 (2015).
- Downs, M. E., et al. Long-Term Safety of Repeated Blood-Brain Barrier Opening via Focused Ultrasound with Microbubbles in Non-Human Primates Performing a Cognitive Task. PLoS One. 10, 0125911 (2015).
- Lipsman, N., et al. Blood-brain barrier opening in Alzheimer's disease using MR-guided focused ultrasound. Nature Communications. 9, 2336 (2018).
- Carpentier, A., et al. Clinical trial of blood-brain barrier disruption by pulsed ultrasound. Science Translational Medicine. 8, 343 (2016).
- Sternson, S. M., Roth, B. L. Chemogenetic Tools to Interrogate Brain Functions. Annual Reviews Neurosciences. 37, 387-407 (2014).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63, 27-39 (2009).
- Zhu, H., et al. Chemogenetic inactivation of ventral hippocampal glutamatergic neurons disrupts consolidation of contextual fear memory. Neuropsychopharmacology. 39, 1880-1892 (2014).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Noninvasive, transcranial and localized opening of the blood-brain barrier using focused ultrasound in mice. Ultrasound in Medicine & Biology. 33, 95-104 (2007).
- Thévenot, E., et al. Targeted delivery of self-complementary adeno-associated virus serotype 9 to the brain, using magnetic resonance imaging-guided focused ultrasound. Human Gene Therapy. 23, 1144-1155 (2012).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220, 640-646 (2001).
- Yang, F. -. Y., Fu, W. -. M., Chen, W. -. S., Yeh, W. -. L., Lin, W. -. L. Quantitative evaluation of the use of microbubbles with transcranial focused ultrasound on blood-brain-barrier disruption. Ultrasonics Sonochemistry. 15, 636-643 (2008).
- Vardy, E., et al. A New DREADD Facilitates the Multiplexed Chemogenetic Interrogation of Behavior. Neuron. 86, 936-946 (2015).
- Thompson, K. J., et al. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. ACS Pharmacology and Translational Sciences. 1, 61-72 (2018).
- Gomez, J. L., et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357, 503-507 (2017).
- Nagai, Y., et al. Deschloroclozapine: a potent and selective chemogenetic actuator enables rapid neuronal and behavioral modulations in mice and monkeys. bioRxiv. , 854513 (2019).
- Thompson, K. J., et al. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. ACS Pharmacology and Translational Science. 1, 61-72 (2018).
- Bullitt, E. Expression of c-fos-like protein as a marker for neuronal activity following noxious stimulation in the rat. Journal of Comparative Neurology. 296, 517-530 (1990).
- Mahler, S. V., Aston-Jones, G. CNO Evil? Considerations for the use of DREADDs in behavioral neuroscience. Neuropsychopharmacology. 43, 934 (2018).
- Gruber, B., Froeling, M., Leiner, T., Klomp, D. W. J. RF coils: A practical guide for nonphysicists. Journal of Magnetic Resonance Imaging. 48, 590-604 (2018).
- Treat, L. H., McDannold, N., Vykhodtseva, N., Hynynen, K. Transcranial MRI-guided focused ultrasound-induced blood-brain barrier opening in rats. IEEE. 2, 998-1000 (2004).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Feasibility of transcranial, localized drug-delivery in the brain of Alzheimer's-model mice using focused ultrasound. IEEE. 2, 988-991 (2005).
- Cobbold, R. S. . Foundations of Biomedical ultrasound. , (2006).
- Younan, Y., et al. Influence of the pressure field distribution in transcranial ultrasonic neurostimulation. Medical Physics. 40, 082902 (2013).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Targeted disruption of the blood-brain barrier with focused ultrasound: association with cavitation activity. Physics in Medicine and Biology. 51, 793-807 (2006).
- Branda, C. S., Dymecki, S. M. Talking about a Revolution: The Impact of Site-Specific Recombinases on Genetic Analyses in Mice. Developmental Cell. 6, 7-28 (2004).
- Jendryka, M., et al. Pharmacokinetic and pharmacodynamic actions of clozapine-N-oxide, clozapine, and compound 21 in DREADD-based chemogenetics in mice. Scientific Reports. 9, 4522 (2019).
- Manvich, D. F., et al. The DREADD agonist clozapine N-oxide (CNO) is reverse-metabolized to clozapine and produces clozapine-like interoceptive stimulus effects in rats and mice. Scientific Reports. 8, 3840 (2018).
- Martinez, V. K., et al. Off-Target Effects of Clozapine-N-Oxide on the Chemosensory Reflex Are Masked by High Stress Levels. Frontiers in Physiology. 10, 521 (2019).
- Gomez, J. L., et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357, 503-507 (2017).
- Bonaventura, J., et al. High-potency ligands for DREADD imaging and activation in rodents and monkeys. Nature Communications. 10, 1-12 (2019).
- Roth, B. L. DREADDs for Neuroscientists. Neuron. 89, 683-694 (2016).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of Transduction Efficiency, Tropism and Axonal Transport of AAV Serotypes 1, 2, 5, 6, 8 and 9 in the Mouse Brain. PLoS One. 8, 76310 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved