Method Article
Abertura da Barreira Hematoencefálica Induzida por Ultrassom Focalizado para Atingir Estruturas Cerebrais e Avaliar a Neuromodulação Quimiogenética
Neste Artigo
Resumo
Este protocolo delineia as etapas necessárias para a entrega gênica através da abertura da barreira hematoencefálica (BHE) por ultrassom focado, avaliação da expressão gênica resultante e mensuração da atividade neuromoduladora de receptores quimiogenéticos por meio de testes histológicos.
Resumo
A quimiogenética acusticamente direcionada (ATAC) permite o controle não invasivo de circuitos neurais específicos. A ATAC alcança esse controle por meio de uma combinação de abertura da barreira hematoencefálica induzida por ultrassom focalizado (FUS), entrega gênica com vetores virais adenoassociados (AAV) e ativação da sinalização celular com receptores proteicos quimiogenéticos e seus ligantes cognatos. Com o ATAC, é possível transduzir regiões cerebrais grandes e pequenas com precisão milimétrica usando uma única aplicação de ultrassom não invasiva. Essa transdução pode permitir mais tarde uma neuromodulação a longo prazo, não invasiva e livre de dispositivos em animais que se movem livremente usando uma droga. Uma vez que FUS-BBBO, AAVs e quimiogenética têm sido usados em vários animais, o ATAC também deve ser escalável para uso em outras espécies animais. Este artigo expande um protocolo publicado anteriormente e descreve como otimizar a entrega de genes com FUS-BBBO para pequenas regiões cerebrais com orientação por RM, mas sem a necessidade de um dispositivo FUS complicado compatível com RM. O protocolo também descreve o design de componentes de direcionamento e contenção de mouse que podem ser impressos em 3D por qualquer laboratório e podem ser facilmente modificados para diferentes espécies ou equipamentos personalizados. Para auxiliar na reprodutibilidade, o protocolo descreve detalhadamente como as microbolhas, os AAVs e a punção venosa foram utilizados no desenvolvimento da ATAC. Finalmente, um exemplo de dados é mostrado para orientar as investigações preliminares de estudos utilizando ATAC.
Introdução
O uso de tecnologias de neuromodulação circuito-específicas, como a optogenética1,2 e a quimiogenética 3,4,5, tem avançado nossa compreensão das condições psiquiátricas como transtornos do circuito neuronal. Os circuitos neuronais são difíceis de estudar e ainda mais difíceis de controlar no tratamento de distúrbios cerebrais porque são tipicamente definidos por tipos celulares específicos, regiões cerebrais, vias de sinalização molecular e tempo de ativação. Idealmente, tanto para aplicações clínicas quanto de pesquisa, esse controle seria exercido de forma não invasiva, mas alcançar uma neuromodulação precisa e não invasiva é um desafio. Por exemplo, embora as drogas neuroativas possam atingir o cérebro de forma não invasiva, elas carecem de especificidade espacial, agindo em todo o cérebro. Por outro lado, a estimulação elétrica profunda do cérebro pode controlar regiões cerebrais específicas, mas tem dificuldade em controlar tipos celulares específicos e requer cirurgia e colocação de dispositivos6.
A quimiogenética acusticamente direcionada7 (ATAC) fornece neuromodulação com especificidade espacial, celular e temporal. Ele combina três técnicas: abertura da barreira hematoencefálica induzida por ultrassom focalizado (FUS-BBBO) para direcionamento espacial, uso de vetores virais adenoassociados (AAVs) para entregar genes de forma não invasiva sob o controle de promotores específicos do tipo celular e receptores quimiogenéticos projetados para modular circuitos neurais transfectados seletivamente via administração de drogas. O FUS é uma tecnologia aprovada pela FDA que aproveita a capacidade do ultrassom de se concentrar profundamente nos tecidos, incluindo o cérebro humano, com precisão espacial milimétrica. Em alta potência, o USF é usado para ablação direcionada não invasiva, incluindo um tratamento aprovado pela FDA para tremor essencial8. O FUS-BBBO combina ultrassom de baixa intensidade com microbolhas administradas sistemicamente, que oscilam nos vasos sanguíneos no foco do ultrassom, resultando em abertura localizada, temporária (6-24 h) e reversível da BHE9. Essa abertura permite a entrega de proteínas 9,10, pequenas moléculas 11 e vetores virais7,12,13,14 ao cérebro sem danos teciduais significativos em roedores10 e primatas não humanos 15. Ensaios clínicos estão em andamento para o FUS-BBBO16,17, indicando possíveis aplicações terapêuticas dessa técnica.
A entrega de genes virais usando AAV também está avançando rapidamente para o uso clínico para distúrbios do SNC, com as recentes aprovações regulatórias da FDA e da UE como marcos importantes. Finalmente, receptores quimiogenéticos18, como os receptores Designer Activated Exclusive by Designer Drugs (DREADDs), são amplamente utilizados pelos neurocientistas para fornecer controle farmacológico sobre a excitação neuronal em animais transgênicos ou transfectados 19,20. DREADDs são receptores acoplados à proteína G (GPCRs) que foram geneticamente modificados para responder a moléculas quimiogenéticas sintéticas em vez de ligantes endógenos, de modo que a administração sistêmica desses ligantes aumenta ou reduz a excitabilidade dos neurônios que expressam DREADD. Quando essas três tecnologias são combinadas em ATAC, elas podem ser usadas para a modulação não invasiva de circuitos neurais selecionados com precisão espacial, celular e temporal.
Aqui, expandimos e atualizamos um protocolo publicado anteriormente para o FUS-BBBO11 , incluindo metodologia para direcionamento preciso de regiões cerebrais com FUS-BBBO em camundongos usando equipamentos de segmentação impressos em 3D simples. Mostramos, também, uma aplicação do FUS-BBBO à ATAC. Mostramos as etapas necessárias para a liberação de AAVs portadores de receptores quimiogenéticos e a avaliação da expressão gênica e neuromodulação por histologia. Esta técnica é particularmente aplicável para atingir grandes ou múltiplas regiões cerebrais para expressão gênica ou neuromodulação. Por exemplo, uma ampla área de um córtex pode ser facilmente transduzida com FUS-BBBO e modulada usando quimiogenética. No entanto, a liberação gênica com uma técnica alternativa, as injeções intracranianas, exigiria um grande número de injeções invasivas e craniotomias. O FUS-BBBO e sua aplicação, ATAC, podem ser dimensionados para animais de diferentes tamanhos, onde as regiões cerebrais são maiores e mais difíceis de atingir invasivamente.
Protocolo
Todos os experimentos foram conduzidos sob um protocolo aprovado pelo Comitê Institucional de Cuidados e Uso de Animais do Instituto de Tecnologia da Califórnia, onde os dados foram originalmente obtidos por J.O.S.
1. Projeto e impressão 3D de arreios de animais e hardware de orientação de imagem
- Use os arquivos do site do laboratório Szablowski em: https://www.szablowskilab.org/downloads para impressão 3D dos componentes.
- Certifique-se de que o material de impressão tenha baixa suscetibilidade na ressonância magnética, mas tenha um suporte visível por ressonância magnética. Veja os detalhes dos materiais utilizados na seção de materiais e reagentes.
- Contabilizar a degradação do material com múltiplos usos, testando o material repetidamente e observando os locais de desgaste que devem ser reforçados. Certifique-se de que as paredes impressas tenham pelo menos 2 mm de espessura.
- Use impressoras 3D de alta precisão para melhorar a precisão da segmentação.
- Contrarie a gravidade e outras forças para evitar o desvio dos componentes plásticos impressos em 3D, apoiando os componentes ao longo do seu comprimento e aumentando a espessura das paredes impressas em 3D se alguma flexão for observada.
- Considere a precisão em múltiplos eixos, incluindo anterior/posterior, medial/lateral, dorsal/ventral, bem como bocejo, pitch e inclinação.
- Teste a precisão da segmentação realizando o FUS-BBBO e registrando o desvio da posição alvo.
- Se estiver usando sistemas estereotáxicos motorizados, avalie os efeitos do movimento dinâmico na elasticidade do material gravando o procedimento de direcionamento FUS-BBBO em vídeo e corrija quaisquer desvios engrossando as paredes do material impresso em 3D.
2. Descrição do sistema de ultrassom
- Use um sistema de ultrassom com um transdutor de arranjo anular de oito elementos (diâmetro = 25 mm, ponto focal natural = 20 mm; abertura (F) = 0,8)) e acople a carcaça à cabeça com gel de ultrassom desgaseificado aplicando gel na cabeça raspada do mouse.
OBS: A frequência central de um transdutor utilizado em um estudo anterior7 foi de 1,5 MHz, a duração do pulso foi de 10 ms e a frequência de repetição do pulso foi de 1 Hz acima de 120 s. As pressões foram calibradas com hidrofone de fibra óptica e mantidas entre 0,36-0,45 MPa. Suponha 18% de atenuação acústica através do crânio21 para 1,5 MHz e osso parietal. A gama de condições apropriadas para uma abertura segura do BBB e entrega do AAV foi descrita em detalhes 7,14,22.
3. Preparo dos animais
- Anestesiar um camundongo usando inalação de isoflurano a 2% com ar de grau médico. Verifique a profundidade da anestesia por uma pitada de toque para confirmar a falta de resposta. Em seguida, aplique pomada oftálmica para evitar o ressecamento da córnea usando uma ponta q estéril de uso único para evitar a contaminação cruzada do tubo de pomada.
NOTA: O procedimento típico do FUS-BBBO pode variar entre 30 minutos a 2 horas, e a anestesia deve ser mantida durante todo o tempo. - Após anestesiar o camundongo, lavar o cateter limpo com soro fisiológico heparinizado (10 U/ml).
NOTA: Um cateter apropriado para um rato de 25-35 g tem uma agulha de 30 G e tubo PE10. - Em seguida, desinfetar a cauda do rato com almofada de etanol a 70%. Coloque o cateter da veia caudal em uma veia lateral da cauda e fixe-o com uma cola de tecido. Observe um refluxo de sangue da veia da cauda para o cateter para confirmar sua colocação.
- Faça a barba da cabeça do rato e, em seguida, use creme de depilação depois que a cola de tecido secar, a fim de reduzir a possibilidade de bolhas de ar ficarem presas sob gel ultrassônico durante a insonação.
- Coloque o mouse em um carro de ressonância magnética impresso em 3D, montando os dentes da frente em uma barra de mordida e cabeça dentro de um cone nasal (Figura 1a).
- Injetar até 10 μL de lidocaína por via subcutânea no local em contato com as barras auriculares embotadas. Em seguida, prenda as barras embotadas ao crânio e aplique quantidades seguras de pressão, tomando cuidado para não aplicar pressão na traqueia, pois ela impede a respiração. Observe a respiração por 30 s para confirmar que o animal está respirando livremente a uma taxa de 1/s.
- Conecte o guia de direcionamento às barras auriculares, verifique a respiração como na etapa 3.6 (Figura 1b) e continue monitorando a respiração visualmente durante todo o procedimento a cada minuto. Uma frequência respiratória elevada acima de 1/s é uma das indicações de perda da anestesia. Continue monitorando a resposta de pinça dos dedos dos pés a cada 5 minutos quando os camundongos não estiverem no scanner de ressonância magnética ou se a taxa respiratória estiver elevada acima de 1/s.
- Transfira o carro de ressonância magnética para um suporte de ressonância magnética e, em seguida, dentro do furo de um ímã.
NOTA: O design do hardware é otimizado para uma bobina de 72 mm dentro de uma ressonância magnética de 7T. - Adquira uma sequência de ressonância magnética para localizar o mouse no scanner.
- Selecione a sequência 3D fast low angle shot (FLASH) para adquirir a totalidade do cérebro, usando os seguintes parâmetros, de acordo com instruções específicas do fabricante do instrumento. Tempo de eco: 3.9 ms, Tempo de repetição: 15 ms, Ângulo de pulso de excitação: 15°, Tamanho da matriz: 130 x 130 x 114, Resolução: 350 x 200 x 200 μm por voxel, Médias: 1, Tempo de aquisição: 3 min 42s
- Transfira arquivos do sistema MRI para um computador que controla o sistema FUS.
- Abra a sequência de imagens no software para realizar o direcionamento guiado por RM, onde a imagem deve aparecer como na Figura 1c.
4. Direcionamento guiado por ressonância magnética
NOTA: Com o uso de guias de segmentação personalizados, não é necessário colocar transdutor de ultrassom dentro de uma ressonância magnética, nem é necessário incisar a pele para realizar o direcionamento zerando a esteretaxa nas linhas bregma e lambda. Siga as etapas abaixo para executar o processo de segmentação.
- Coloque o carro dentro de um instrumento estereotáxico. Fixe-o no lugar usando um bloco de metal com uma fita dupla face e pressionando o carro contra dois postes de apoio do instrumento estereotáxico.
- Transfira imagens de ressonância magnética para um computador com um software de orientação FUS em execução selecionando arquivos no gerenciador de dados, clicando com o botão direito do mouse para trazer opções de menu e selecionando 'Transferir imediatamente'.
- Abra o software de orientação FUS e carregue a imagem clicando em 'Abrir sequência' e carregando todos os arquivos da sequência de imagens.
- Reformate a imagem em três eixos pressionando o botão direito do mouse e 'Reformatar'.
- Localize o transdutor na guia de direcionamento circular (Figura 1c) clicando com o botão direito do mouse.
- Em vista sagital, ajuste a posição vertical de um transdutor virtual para considerar a espessura do banho-maria e a carcaça do transdutor (neste caso – 8,2 mm para cima, Figura 1d).
- Aponte a(s) área(s) a ser alvo(s) no planejador de trajetória e anote as coordenadas em uma planilha (neste caso – mesencéfalo, como na Figura 1d).
- Disque a profundidade de segmentação desejada (valor z na trajetória eletrônica (Figura 2) e anote as coordenadas em uma planilha.
- Direcione cada um dos pontos pressionando 'Enviar trajetória' e 'Executar' (Figura 2).
NOTA: Isso é feito quando um suporte de mouse é colocado dentro dos motores. No entanto, o mesmo direcionamento pode ser alcançado com alta precisão em um instrumento estereotáxico. - Para correlacionar as coordenadas de uma RM com o quadro estereotáxico, coloque o transdutor montado sob medida sobre uma guia de direcionamento e traduza até que cada um dos três parafusos de mira (Figura 3, elemento A) possa passar tanto pelo suporte do transdutor (Figura 3, elemento B) quanto pela guia de direcionamento (Figura 3, elemento C). Verifique se os parafusos não estão sob tensão ou inclinação.
- Traduzir o transdutor 10,56 mm para frente na direção anterior/posterior até que ele esteja localizado no mesmo local onde um centro de um guia de mira aparece em uma ressonância magnética.
- Determine a distância de um centro do transdutor virtual (Figura 3a, elemento A) à região alvo (Figura 3a, elemento B) e mova o transdutor para essas coordenadas usando um quadro estereotáxico.
- Proceder à preparação da solução de injeção.
5. Preparação da solução injetável
NOTA: As soluções de microbolhas são muito sensíveis à pressão. Consequentemente, a mistura vigorosa ou a injeção rápida através de agulhas finas podem colapsar as microbolhas e reduzir a eficácia da abertura de BBB. Além disso, as microbolhas são mais leves que a água e podem flutuar até o topo de um tubo, cateter ou seringa (Figura 4), por exemplo, em um injetor automático. Recomenda-se vivamente ressuspender a solução de microbolhas imediatamente antes de cada injeção.
- Retirar 0,8 ml de solução salina utilizando uma seringa para um tubo de 1,5 ml.
- Com uma seringa, adicione 0,1 mL de contraste de RM no mesmo tubo de 1,5 mL e misture.
- Levar a solução de microbolhas não ativadas23,24 à temperatura ambiente.
- Logo antes da insonação, ativar microbolhas por 45 s em um dispositivo de ativação de microbolhas.
- Retirar lentamente (mais de ~3 s) 0,1 mL de microbolhas usando uma seringa tuberculínica de 1 mL e uma agulha 21 G da profundidade média de um líquido.
- Adicionar 0,08 ml de microbolhas à solução de contraste e soro fisiológico preparado no passo 5.3. Misture batendo com a mão por 15 s.
- Com a concentração final de AAVs sendo de 0,5-2 x 10 10 partículas virais por grama de peso corporal (VP/g), injetar a carga para entrega (neste caso AAV9) através de agulha de30 G no cateter da veia caudal, no caso de ATAC – AAVs portadores de receptores quimiogenéticos, ou um controle negativo, como AAVs portadores de GFP sob o mesmo promotor.
- Misture as microbolhas manualmente por 15 s novamente para evitar flutuação (Figura 4).
- Imediatamente após, aspirar 200 μL da solução de microbolhas através de uma seringa sem agulha acoplada. A falta de uma agulha reduzirá as forças de cisalhamento nas microbolhas.
- Inverta a seringa e misture pressionando o êmbolo para cima e para baixo.
- Fixe a agulha de 30 G e, ainda invertida, empurre lentamente as microbolhas até que as gotículas apareçam na extremidade de uma agulha.
6. Procedimento de insonação
- Defina os parâmetros para insonação: duração de pulso de 10 ms, 120 repetições, cada s e pressão de 0,30-0,45 MPa no crânio.
- Remova a guia de mira e aplique gel de ultrassom desgaseificado na cabeça do mouse, certificando-se de não formar bolhas.
- Abaixe o transdutor e coloque-o diretamente no suporte da barra auricular e marque as coordenadas nos instrumentos estereotáxicos (Figura 5).
- Injetar a solução de AAV (0,5-2 x 1010 VP/g).
- Misture microbolhas e a solução do agente de contraste MRI por 15 s e injete 80 μL por 30 g de camundongo.
- Aplique imediatamente o ultrassom por 120 s pressionando 'Enviar' e 'Executar'.
- Se mais de um site for direcionado, mova o transdutor para esse site e ajuste a segmentação de profundidade seguindo os números na planilha das etapas 4.7-4.9. Em seguida, repita as etapas 6.5-6.6 para cada site insonado.
7. Avaliação por RM da abertura BBB
NOTA: A avaliação por RM da abertura do BBB foi descrita em detalhes em outra publicação11. A localização da abertura da BHE pode ser visualizada como áreas mais brilhantes em camundongos que receberam uma injeção de um contraste Gd ponderado em T1.
- Após a aplicação do ultrassom, registrar uma sequência de RM como no passo 3.10.
- Remova o mouse do scanner de ressonância magnética e coloque-o em uma gaiola de recuperação para permitir a recuperação da anestesia. Monitore os ratos diariamente em busca de sinais de angústia, perda de peso ou outros desfechos humanos. Consulte a equipe veterinária e as diretrizes institucionais da IACUC para prosseguir com qualquer tratamento caso ocorram eventos adversos inesperados.
8. Estimulação DREADD com ligante quimiogenético
- Escolha um receptor quimiogenético. Para DREADDs, escolher o receptor hM3Dq para ativação neuronal via vias acopladas Gq19, o receptor hM4Di para inibição da atividade neuronal através de vias acopladas Gi/o20, ou o receptor KORD para ativação de neurônios via vias acopladas Gs usando ligante Salvinorin-B25.
- Dissolver clozapina-n-óxido (CNO) em solução salina estéril na concentração de 1 mg/mL. Conservar o CNO aliquotado a -20 °C.
- Administrar CNO 19, ou outro ligante quimiogenético26,27,28, por via intraperitoneal em concentração entre 0,3 –10 mg/kg.
- Se os efeitos do CNO sobre o comportamento devem ser registrados, comece a registrar a atividade comportamental dentro de 15-45 minutos após a administração da droga para atingir a ativação máxima dos DREADDs19.
- Se a análise da ativação neuronal for desejada, use camundongos para avaliação histológica após 60-120 min após a injeção.
- Proceder à eutanásia através de perfusão cardíaca (ver secção 9).
9. Avaliação histológica da expressão gênica e ativação quimiogenética
NOTA: Uma vez que o desfecho experimental (por exemplo, final do estudo comportamental, tempo necessário para a expressão gênica) é alcançado, é fundamental confirmar a localização e a presença da expressão gênica.
- Após a ativação com um ligante quimiogenético, realizar perfusão cardíaca para preservar os tecidos.
- Anestesiar o camundongo com a mistura de Ketamina (100 mg/kg)/Xilazina (10 mg/kg) em solução salina estéril através de uma injeção IP. Confirme a anestesia com uma pinça no dedo do pé e certifique-se de que a frequência respiratória foi reduzida para aproximadamente 1/s. Fornecer suporte térmico através da almofada de aquecimento até à confirmação da eutanásia.
- Preparar formalina tamponada neutra (NBF) a 10% e PBS com 10 unidades de heparina por mL.
NOTA: As soluções devem estar a 4 °C. - Despeje cada tampão em tubos separados de 50 mL e conecte, e ligue uma bomba peristáltica conectada a um cateter borboleta de 25 G com solução de PBS/heparina.
- Fixe os membros a uma almofada azul absorvente com fita adesiva e certifique-se de que o animal é colocado em decúbito dorsal sobre a almofada. Desinfete os pelos para evitar a contaminação cruzada dos órgãos periféricos, caso precisem ser coletados.
- Abrir a cavidade peritoneal por uma incisão transversal, expondo o diafragma.
- Abrir a caixa torácica através de dois cortes de tesoura cirúrgica ao longo do eixo anterior/posterior.
- Expor o coração e colocar a agulha numa câmara esquerda (lado direito do coração visto em decúbito dorsal) e colocar no cateter borboleta no passo 9.1.3.
- Faça uma pequena incisão no ventrículo direito para permitir a saída de sangue.
- Ligue a bomba peristáltica para começar a lavar o sangue com PBS/heparina.
OBS: Se esta etapa não for realizada adequadamente, o sangue coagulará durante a fixação com formalina e impedirá a perfusão adequada. - Depois que todo o sangue for liberado e o PBS claro começar a sair do ventrículo direito, troque a entrada de uma bomba peristáltica por uma solução de NBF e inicie a perfusão por 25 mL por camundongo.
- Extrair o cérebro, colocar em pelo menos 4 mL de NBF e pós-fixação por 24 h.
- Corte o cérebro usando cortes coronais em um vibratomo usando 50 μm de espessura de seção.
- Coloque cada seção em um poço de uma placa de 24 poços armazenando as seções por todo o cérebro.
- Avaliar a expressão dos receptores quimiogenéticos fundidos a proteínas fluorescentes (por exemplo, mCherry ou mCitrino), sob um microscópio fluorescente para identificar os cortes que mostram expressão para confirmar a localização. É provável que a expressão seja fraca.
- Realizar imunomarcação contra o fluoróforo utilizando o seguinte protocolo:
- Colocar 3 secções em 0,5 ml de solução contendo 10% de soro de um hospedeiro de um anticorpo secundário e incubar durante 30 minutos.
- Transfira as seções para uma solução de um anticorpo primário na diluição de 1:250 – 1:1.000, usando 1:500 como ponto de partida.
- Incubar as secções com anticorpo primário durante a noite a 4 °C numa microplaca selada com um filme de parafina.
- Lave as seções com PBS, 3x por 5 min de cada vez.
- Adicionar 0,5 mL por poço da solução de anticorpos secundários em soro a 10%.
- Incubar durante 4 h à temperatura ambiente.
- Lave as seções com PBS, 3x por 5 min de cada vez.
- Monte em lâminas com um meio de montagem aquoso contendo uma mancha nuclear (por exemplo, DAPI).
- Avalie a localização e a propagação usando um microscópio confocal realizando uma varredura de blocos de uma seção inteira.
- Avalie a intensidade da expressão medindo a intensidade do pixel de fluorescência em regiões-alvo do cérebro e compare com um controle injetado intracranialmente.
- Alternativamente, avalie a porcentagem de neurônios positivos contando células coradas contra receptores quimiogenéticos, em comparação com células positivas para DAPI, ou marcadores específicos de células.
- Avaliar o dano tecidual realizando coloração de hematoxilina em corte de 50 μm e imagem para a perda de células, acúmulo de debris celulares e outros sinais de dano grosseiro.
- Para avaliar a especificidade do alvo celular, realizar imunomarcação dupla conforme descrito abaixo para o receptor quimiogenético e um marcador célula-específico. Em seguida, execute contagens de células positivas como na etapa 9.8.
- Colocar 3 secções em 0,5 ml de uma solução contendo 10% de soro de um hospedeiro de um anticorpo secundário e incubar durante 30 minutos.
- Transferir as seções para uma solução de um anticorpo primário contra um marcador fluorescente de um receptor quimiogenético na diluição de 1:250 – 1:1.000, usando 1:500 como ponto de partida. Adicione um segundo anticorpo primário de uma espécie hospedeira diferente que seja direcionado contra um marcador específico de célula de interesse (por exemplo, CamkIIa).
- Incubar as secções com anticorpo primário durante a noite a 4 °C numa microplaca selada com filme de parafina.
- Lave as seções com PBS, 3x por 5 min de cada vez.
- Adicionar 0,5 mL por poço de solução de anticorpos secundários no soro a 10% das espécies hospedeiras de ambos os anticorpos secundários.
NOTA: Cada anticorpo deve ter um fluoróforo distinto e deve ser reativo contra anticorpos primários na etapa 9.10.2. - Incubar durante 4 h à temperatura ambiente.
- Lave as seções com PBS, 3x por 5 min de cada vez.
- Monte em corrediças e fixe com um meio de montagem aquoso contendo uma mancha nuclear.
10. Avaliar a ativação neuronal com imunomarcação para c-Fos
- Realizar a coloração c-Fos como no ponto 9.5 deste protocolo usando um anticorpo primário c-Fos e um anticorpo secundário com uma etiqueta fluorescente distinta da coloração nuclear.
- Conte a porcentagem de células positivas para c-Fos e coloração nuclear na área alvo de um receptor quimiogenético.
- Analisar a porcentagem de núcleos positivos para c-Fos no grupo de camundongos que expressam receptores quimiogenéticos e são tratados com um ligante quimiogenético ou veículo controle e no grupo de camundongos selvagens que são tratados com um ligante quimiogenético ou veículo controle.
Resultados
O primeiro passo da realização do protocolo ATAC é o direcionamento do FUS-BBBO para as regiões cerebrais desejadas. Por exemplo, seguindo o protocolo descrito, o hipocampo foi alvo com FUS-BBBO, e o agente de contraste e AAV9 carregando DREADDs foram injetados nos camundongos, seguido por uma sequência de RM FLASH 3D que adquire imagens do cérebro de camundongos. Um realce do sinal em T1 foi obtido na região hipocampal (Figura 6) e em outras partes do cérebro (Figura 7). Após várias semanas, DREADDs foram expressos dentro da região do cérebro alvo. Enquanto muitos DREADDs são fundidos a um repórter fluorescente (por exemplo, mCherry), o processo de perfusão e fixação com formaldeído foi encontrado para reduzir drasticamente a fluorescência dessas proteínas. A imunomarcação contra mCherry ou DREADD levou a uma detecção mais confiável da expressão (Figura 8) com base na experiência anterior. Em experimentos anteriores, ~85% dos camundongos mostraram expressão após FUS-BBBO7. Um teste simples para níveis suficientes de expressão de DREADDs é testar sua funcionalidade em um nível celular. Isso pode ser feito, por exemplo, fornecendo um ligante quimiogenético ou um controle salino, como CNO 19, descloroclozapina28 ou outros29, e aguardando 2 horas antes de uma perfusão e fixação cardíaca. As seções cerebrais foram então co-imunomarcadas para a proteína c-Fos30, que indica atividade aumentada dos neurônios, e para DREADD. O experimento foi considerado bem-sucedido se o local do cérebro alvo com DREADDs mostrasse um número significativamente maior de núcleos neuronais positivos para c-Fos no grupo que recebeu um ligante quimiogenético quando comparado ao grupo que recebeu solução salina7 ou comparado a um local contralateral que não foi submetido ao FUS-BBBO. É importante ressaltar que há um potencial para que alguns desses ligantes ativem neurônios não especificamente sem expressão de DREADDs. Por exemplo, foi demonstrado que o CNO é metabolizado em baixos níveis de clozapina em camundongos, que atravessa a BHE e ativa DREADDs com alta potência27. No entanto, também foi mostrado para se ligar a locais não específicos. Como em todo experimento, é fundamental incluir todos os controles adequados em estudos quimiogenéticos31. Um possível controle é a administração do ligante quimiogenético em camundongos selvagens, sem procedimentos, para excluir efeitos da droga isoladamente no ensaio comportamental ou histológico desejado. Outro controle poderia ser a inclusão de quatro grupos: DREADD + ligante, DREADD + veículo, EGFP + ligante, EGFP + veículo, o que explicará quaisquer efeitos potenciais tanto da liberação gênica com FUS-BBBO, quanto do ligante quimiogenético.
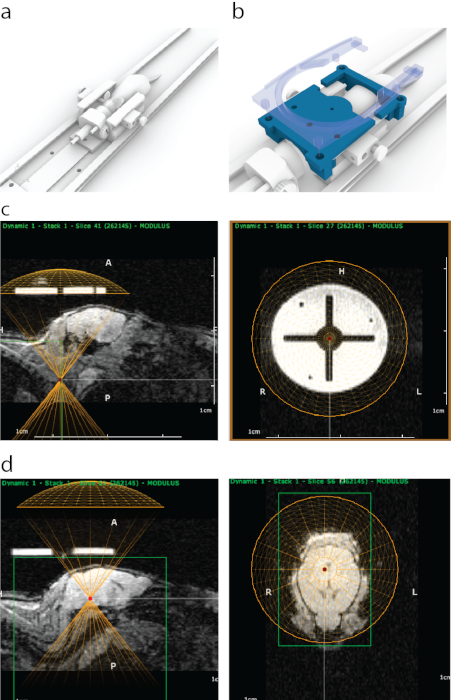
Figura 1: Processo de direcionamento guiado por RM de FUS no ATAC. (a) Colocação do mouse com barras auriculares, um cone nasal e uma plataforma que pode ser encaixada dentro de um scanner de ressonância magnética. (b) Uma guia impressa em 3D (azul) visível na ressonância magnética foi fixada nas extremidades da estrutura da barra auricular e, em seguida, fixada no lugar com um suporte de uma bobina de ressonância magnética de superfície que contém quatro parafusos de encaixe (azul semitransparente). (c) Aparência do guia impresso em 3D em RM sagital (painel esquerdo), com uma parte inferior da representação virtual de um transdutor alinhado (semicírculo amarelo) com a parte inferior do guia. O painel direito mostra a aparência do guia impresso em 3D na RM a partir da visão coronal. O círculo brilhante foi feito de um material de suporte de polijato que tem um forte contraste de ressonância magnética. A cruz foi formada com plástico. Um círculo amarelo representa a localização do transdutor que foi alinhado concêntricamente com a guia dentro de um quadro estereotáxico. (d) Para atingir estruturas cerebrais, um transdutor virtual foi movido na direção z acima dos camundongos para corresponder à espessura de um cone/alojamento de ultrassom. Neste caso, devido à espessura do banho-maria, o transdutor foi movido 8,2 mm acima da guia para uma segmentação precisa. As estruturas cerebrais foram selecionadas usando dados de imagem de RM, e suas coordenadas de RM foram então anotadas e inseridas na máquina estereotáxica. Clique aqui para ver uma versão maior desta figura.
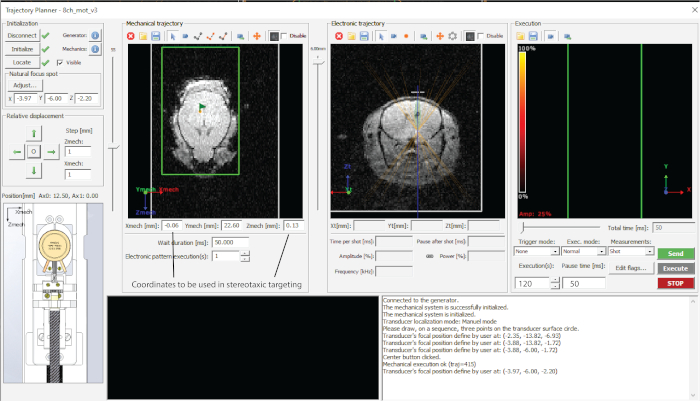
Figura 2: Interface do software utilizado. Clique aqui para ver uma versão maior desta figura.
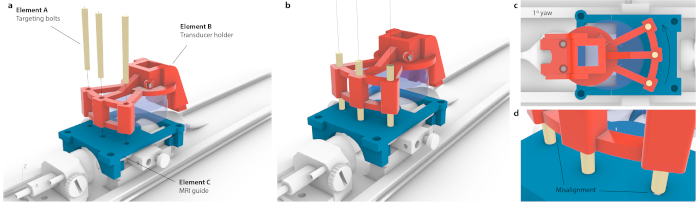
Figura 3: Processo de correspondência do espaço de coordenadas da RM com o instrumento estereotáxico. (a) Três orifícios dentro de um suporte do transdutor foram alinhados com três orifícios dentro da guia de RM, e três parafusos de mira cônicos foram inseridos sem causar flexão em todo o conjunto. (b) Idealmente, todos os três parafusos ficariam no centro dos buracos. (c) Se houver alguma imprecisão no alinhamento, nem todos os três parafusos se encaixariam, por exemplo, no caso de guinada pequena, provavelmente imperceptível de 1°, apenas um parafuso caberia enquanto os parafusos opostos ficariam presos no guia de ressonância magnética. Alternativamente, poderia haver flexão visível de todo o conjunto à medida que os parafusos eram forçados a passar. d) Vista alargada da montagem dos parafusos. Os parafusos devem ser colocados de forma concêntrica para a melhor precisão. Clique aqui para ver uma versão maior desta figura.
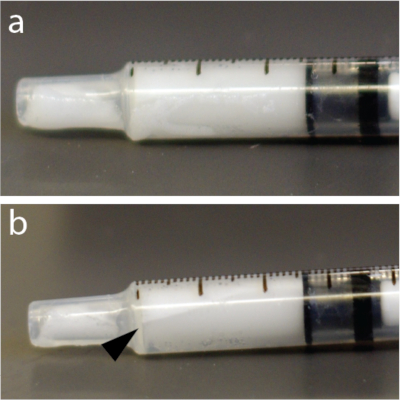
Figura 4: Redistribuição rápida das microbolhas no interior da seringa. (a) A seringa foi fotografada 5 s após a mistura. (b) Um minuto depois, havia uma camada claramente visível mostrando parte do concentrado de bolhas próximo ao topo da seringa de 1 mL de tuberculina. Este exemplo, em particular, usou uma solução de microbolhas. Clique aqui para ver uma versão maior desta figura.
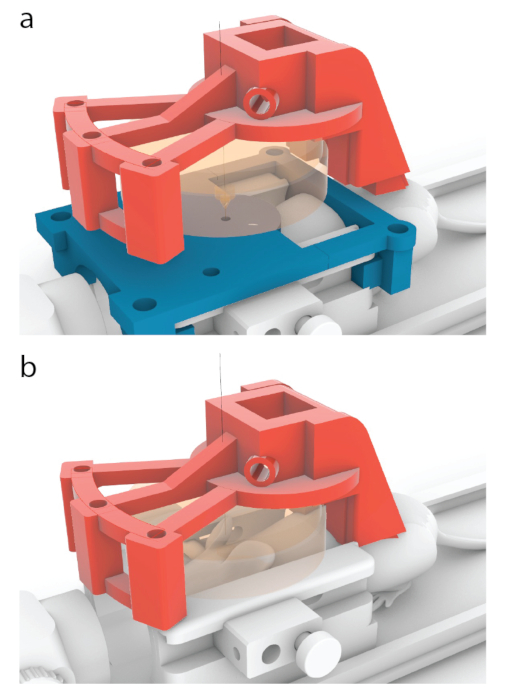
Figura 5: Processo de colocação do centro de um transdutor sobre o centro de um guia de RM. (a) Nos modelos mostrados neste trabalho, o portador vermelho foi projetado para se mover 10,56 mm para frente da posição mostrada na Figura 3b, para uma posição mostrada aqui. (b) O guia de RM azul foi removido antes da sonicação, e um gel de ultrassom foi aplicado entre o camundongo e o transdutor (laranja) para garantir a passagem do ultrassom. Clique aqui para ver uma versão maior desta figura.
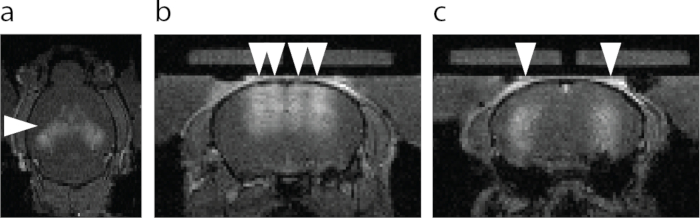
Figura 6: Visualização por RM da abertura da BBB. (a) Vista axial da abertura BBB. A área mais brilhante designada com uma ponta de seta mostra extravasamento de um agente de contraste T1 para RM. (b) Visão coronal do hipocampo dorsal e do córtex acima do hipocampo alvo com FUS-BBBO (cabeças de setas). (c) Visão coronal do hipocampo central alvo de FUS-BBBO (pontas de setas). Clique aqui para ver uma versão maior desta figura.

Figura 7: Exemplo de direcionamento de 4 locais cerebrais usando o sistema de segmentação de três parafusos descrito neste artigo. Áreas com pontas de setas mostraram locais abertos por BBB com difusão de contraste para RM. Os quatro sites foram alvo sucessivamente, com ~150 s entre cada abertura do BBB, de baixo para cima. A imagem foi tirada em até 2 minutos após a última abertura do BBB. A barra de escala é de 2 mm. Clique aqui para ver uma versão maior desta figura.
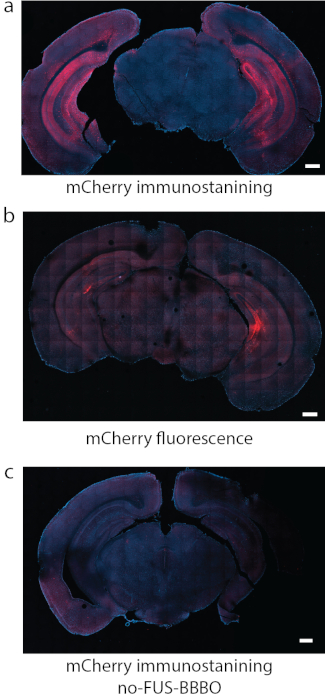
Figura 8: Detecção da expressão DREADD. (a) A imunomarcação para o fluoróforo ligado aos DREADDs, neste caso o mCherry foi um método confiável de detecção em alguns estudos. (b) Em outra seção representativa com DREADDs direcionados para o hipocampo usando as mesmas condições que em (a), a fluorescência de mCherry por si só produziu fundo forte e sinal relativamente fraco. (c) Como controle negativo, foi utilizado um camundongo que recebeu injeção sistêmica de AAV, mas não foi submetido ao FUS-BBBO. Nenhuma expressão significativa pode ser encontrada pela imunomarcação de mCherry. As barras de escala são de 500 mm. (Dados em a, c adaptados de7 com permissões, Copyright 2020 Nature-Springer). Clique aqui para ver uma versão maior desta figura.
Discussão
A ATAC requer a implementação bem-sucedida de várias técnicas para o sucesso da neuromodulação de circuitos neurais específicos, incluindo direcionamento guiado por RM preciso, FUS-BBBO e avaliação histológica da expressão gênica. Componentes imprimíveis em 3D foram desenvolvidos para simplificar a segmentação de pequenas estruturas cerebrais com FUS-BBBO guiado por imagem.
A administração de ultrassom focalizado guiado por RM (MRIgFUS) apresenta uma série de desafios. Primeiro, a bobina de ressonância magnética típica tem espaço limitado que é projetado para acomodar apenas uma amostra e não o hardware de ultrassom. Os furos maiores das RMs aumentam o custo do equipamento e diminuem a qualidade da imagem, pois o sinal está relacionado ao fator de preenchimento de uma bobina32. Consequentemente, qualquer hardware FUS colocado na parte superior de uma imagem animal na ressonância magnética comprometerá a qualidade da imagem. Em segundo lugar, projetar dispositivos compatíveis com ressonância magnética é difícil e caro. Materiais compatíveis com RM precisam ser diamagnéticos, ter baixa propensão a criar correntes parasitas durante a irradiação por radiofrequência e ter baixa suscetibilidade magnética em campos magnéticos altos. Em qualquer material condutor, a criação de correntes parasitas ou sua suscetibilidade magnética também afetará negativamente a qualidade da imagem. Finalmente, os materiais compatíveis com ressonância magnética disponíveis têm módulos e durabilidade de Young mais baixos do que os metais normalmente usados na produção de máquinas de direcionamento preciso, por exemplo, quadros estereotáxicos. Os motores usados para ajustes posicionais precisam ser compatíveis com RM e colocados fora do furo da RM devido ao seu tamanho. Esses motores devem ser conectados a uma distância do transdutor dentro de um furo de ressonância magnética usando materiais compatíveis com ressonância magnética. Problemas de empenamento de plástico, falta de espaço suficiente dentro do furo para implementar componentes de tamanho robusto e espaço insuficiente para mudar as posições de direcionamento em todo o cérebro afetaram a precisão de direcionamento em trabalhos anteriores.
Para resolver esses problemas, optou-se por realizar exames de imagem na RM e administração de FUS-BBBO fora do scanner. Para permitir a orientação por ressonância magnética, os camundongos foram colocados dentro de uma contenção impressa em 3D que tinha um guia de direcionamento visível por ressonância magnética que poderia ser usado para localizar as estruturas cerebrais de camundongos tanto na ressonância magnética quanto no espaço de coordenadas estereotaxadas. Uma vez que tanto o crânio do rato como o guia de mira estão firmemente presos aos suportes da barra auricular (Figura 1a,b), um guia de mira pode ser usado para correlacionar as coordenadas espaciais dentro da imagem de RM e zerar os instrumentos estereotáxicos. A contenção não tem partes móveis e não contém um transdutor, o que nos permitiu torná-lo robusto e suficientemente pequeno para caber dentro de uma ressonância magnética e removeu a interferência de sinal da eletrônica do transdutor. O espaço dentro do guia de direcionamento foi esvaziado, pois o suporte impresso em 3D para alguns materiais é visível na RM (Figura 1c). Furos no conjunto foram introduzidos para permitir a calibração estereotáxica (Figura 3). O transdutor de ultrassom foi acoplado a um porta-eletrodos de um estereotaxa, e o direcionamento foi realizado conforme descrito na seção 4 (Figura 1d). O transdutor deve ser apoiado ao longo de seu comprimento por alojamento de barras auriculares, evitando qualquer desvio do plano plano. O direcionamento na direção dorso-ventral pode ser obtido usando deslocamentos de fase em uma matriz anular.
A precisão prática do direcionamento é determinada pela focalização por ultrassom e atenuação do crânio. O procedimento FUS-BBBO foi descrito em detalhes para ratos 11 e foi implementado em vários outros organismos modelo23,33,34 e em humanos 16,17. A relação entre o tamanho do foco do ultrassom é inversamente proporcional à frequência, onde frequências mais altas podem resultar em entrega mais precisa. No entanto, a atenuação do crânio aumenta com as frequências35, o que pode levar ao aquecimento do crânio e danos às áreas corticais. A estratégia de direcionamento exata dependerá do local do cérebro. Os locais onde uma meia pressão máxima de largura total se encaixa dentro do tecido cerebral permitem a abertura previsível e segura da BBB em muitas estruturas cerebrais, como o estriado, o mesencéfalo e o hipocampo. Regiões próximas à base do cérebro representam um desafio específico em camundongos. O cérebro de camundongos mede aproximadamente 8-10 mm na direção dorso-ventral, o que é comparável ao tamanho máximo da metade da largura total de muitos transdutores disponíveis comercialmente. Consequentemente, o direcionamento para a parte inferior do crânio pode levar à reflexão ultrassonográfica dos ossos e do ar presentes nos canais auditivos, boca ou traqueia, o que pode levar a padrões imprevisíveis de altas e baixas pressões36. Algumas dessas pressões podem ultrapassar um limiar de cavitação inercial que demonstrou causar sangramento e dano tecidual37. Para atingir regiões próximas à base do crânio, pode ser preferível o uso do ATAC7 interseccional, em que a genética interseccional38 é usada para restringir a expressão gênica a uma área menor do que a atingida pelo feixe de USF. No exemplo publicado de ATAC interseccional, um animal transgênico expressando uma enzima de edição gênica (Cre38) em células dopaminérgicas foi alvo de ultrassom na subseção da região que contém células dopaminérgicas. Finalmente, as regiões corticais podem ser alvo de FUS, mas a difração e a reflexão do ultrassom podem ocorrer levando a perfis de pressão desiguais. Este protocolo não abrange o direcionamento de regiões corticais, pois será altamente dependente das espécies utilizadas; no entanto, algum direcionamento do córtex acima do hipocampo 7 (por exemplo, Figura 7) foi observado indicando que, pelo menos em camundongos, isso é possível.
A escolha de um ativador quimiogenético e a dosagem dependerão das necessidades experimentais específicas. Vários estudos, incluindo um dos autores7, não mostraram resposta inespecífica significativa39,40, enquanto doses maiores (por exemplo, 10 mg/kg) podem produzir efeitos colaterais, pelo menos em alguns casos41. No entanto, como em todos os experimentos comportamentais, controles adequados31 são essenciais devido à potencial atividade fora do alvo do CNO e seus metabólitos42. Tais controles poderiam incluir a administração de CNO e controles salinos a animais que expressam DREADDs e a administração de CNO a animais selvagens ou, em alguns casos específicos, uma comparação de sítios ipsi- e contralaterais do cérebro que, respectivamente, expressam e não expressam receptores quimiogenéticos. Além disso, pesquisas recentes revelaram uma série de novos agonistas DREADD com melhora da especificidade28,29,43. Outros receptores quimiogenéticos 5,25,44 também podem ser utilizados em conjunto com o procedimento ATAC.
A avaliação histológica da expressão gênica é necessária post-mortem para todos os animais. Uma pequena fração de animais apresenta expressão gênica pobre após FUS-BBBO7. Além disso, é necessário mostrar a acurácia espacial e a especificidade da expressão gênica, uma vez que o erro de direcionamento é possível. É importante ressaltar que alguns AAVs podem mostrar capacidade de rastreamento retrógrado ou anterógrado45 e podem causar transfecção longe do local alvo da ultrassonografia, apesar do direcionamento preciso por ultrassom. Se o receptor quimiogenético expresso for fundido ou co-expressar um fluoróforo, imagens do fluoróforo em cortes de tecido podem ser suficientes para avaliar a localização e a intensidade da expressão. No entanto, muitas proteínas fluorescentes são danificadas pelo processo de fixação tecidual, e a imunomarcação para a proteína mCherry, que é frequentemente usada com DREADDs, produziu melhor sinal em estudos anteriores7. Finalmente, devido à densidade de neurônios em certas partes do cérebro (por exemplo, camada de células granulares no hipocampo), o uso de fluoróforos localizados nuclearmente expressos sob IRES, em oposição a fusões, para realizar contagens de células pode ser benéfico, uma vez que os núcleos podem ser facilmente segmentados e contracorados com colorações nucleares, como DAPI ou TO-PRO-3. Avaliar a neuromodulação pela coloração c-Fos, realizando contracoloração nuclear e contagem de núcleos c-Fos positivos, ao invés de qualquer sinal de fluorescência, é imperativo. Em alguns casos, os detritos celulares podem mostrar fluorescência e confundir as medidas de células positivas.
As limitações da liberação da droga e do gene com FUS-BBBO incluem resolução mais baixa do que a administração com injeções intracranianas invasivas e a necessidade de maiores quantidades de drogas injetadas ou vetores virais. Além disso, enquanto uma injeção direta no cérebro resulta em entrega exclusiva em um local injetado, o FUS-BBBO usa uma via intravenosa resultando em possível entrega aos tecidos periféricos. As limitações do uso da quimiogenética para neuromodulação incluem uma escala de tempo lenta, que pode ser inadequada para alguns protocolos comportamentais que requerem mudanças rápidas na intensidade da neuromodulação.
Divulgações
Inexistência de conflitos de interesse.
Agradecimentos
Esta pesquisa foi apoiada pela Brain and Behavior Foundation, NARSAD Young Investigator Award. Vários componentes impressos em 3D foram originalmente projetados por Fabien Rabusseau (Image Guided Therapy, França). O autor agradece a John Heath (Caltech) e Margaret Swift (Caltech) pela ajuda técnica na preparação do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 21-gauge needles (BD) | Fisher Scientific | 14826C | |
| 25-gauge butterfly catheter | Harvard Bioscience | 725966 | |
| 30-gauge needles (BD) | Fisher Scientific | 14826F | |
| Absorbent blue pad | Office Depot | 902406 | |
| Anti-c-Fos antibody | Santa Cruz Biotechnology | SC-253-G | |
| Anti-mCherry antibody | Thermofisher | PA534974 | |
| Bruker Biospec 70/30 | Bruker | custom | includes the RF coils |
| Clozapine-n-oxide | Tocris | 4936 | |
| Custom designed 3D printed mouse harnesses and MRIgFUS targeting components | ImageGuidedTherapy, Szablowski lab | custom | download from szablowskilab.org/downloads |
| Custom MRIgFUS machine | ImageGuidedTherapy | N/A | |
| Definity microbubbles | Lantheus | DE4 | |
| Degassed aquasonic/ultrasound gel | Fisher Scientific | 5067714 | |
| Depilation crème | Nair | n/a | |
| Eight-element annular array transducer | Imasonic Inc. | custom | |
| Ethanol Pads/Alcohol Swabs (70%) (BD) | Office Depot | 599893 | |
| Heparin | Sigma-Aldrich | H3149-25KU | |
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Ketamine | Patterson Veterinary | 07-890-8598 | |
| Neutral buffered formalin (10%) | Sigma-Aldrich | HT501128-4L | |
| Optical fiber hydrophone | Precision Acoustics | ||
| PE10 tubing | Fisher Scientific | NC1513314 | |
| Peristaltic pump | |||
| Phosphate-buffered saline (PBS) | Sigma-Aldrich | 524650-1EA | |
| Prohance contrast agent | Bracco | 0270-1111-04 | |
| Saline | Fisher Scientific | NC9054335 | |
| Secondary antibody, Donkey-anti goat | ThermoFisher | A-11055 | |
| Secondary antibody, Donkey-anti rabbit | ThermoFisher | 84546 | |
| Surgical scissors (straight) | Fisher Scientific | 17467480 | |
| ThermoGuide Software | ImageGuidedTherapy | ||
| Tissue glue (Gluture) | Fisher Scientific | NC9855218 | |
| Tuberculin Syringe (1 mL) (BD) | Fisher Scientific | 14823434 | |
| VeroClear 3D printable material | Stratasys | RGD810 | |
| Vialmix microbubble activation device | Lantheus | VMIX | |
| Vibrating microtome | Compresstome | VF-300 | |
| Xylazine | Sigma-Aldrich | X1251-1G |
Referências
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
- Zhang, F., Wang, L. -. P., Boyden, E. S., Deisseroth, K. Channelrhodopsin-2 and optical control of excitable cells. Nature Methods. 3, 785-792 (2006).
- Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Roth, B. L. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proceedings of the National Academy of Sciences. 104, 5163-5168 (2007).
- Lerchner, W., et al. Reversible silencing of neuronal excitability in behaving mice by a genetically targeted, ivermectin-gated Cl- channel. Neuron. 54, 35-49 (2007).
- Magnus, C. J., et al. Chemical and genetic engineering of selective ion channel-ligand interactions. Science. 333, 1292-1296 (2011).
- Deeb, W., et al. Proceedings of the fourth annual deep brain stimulation think tank: a review of emerging issues and technologies. Frontiers in Integrative Neuroscience. 10, 38 (2016).
- Szablowski, J. O., Lee-Gosselin, A., Lue, B., Malounda, D., Shapiro, M. G. Acoustically targeted chemogenetics for the non-invasive control of neural circuits. Nature Biomedical Engineering. 2, 475-484 (2018).
- Elias, W. J., et al. A pilot study of focused ultrasound thalamotomy for essential tremor. New England Journal of Medicine. 369, 640-648 (2013).
- Burgess, A., Hynynen, K. Noninvasive and targeted drug delivery to the brain using focused ultrasound. ACS Chemical Neuroscience. 4, 519-526 (2013).
- Kinoshita, M., McDannold, N., Jolesz, F. A., Hynynen, K. Noninvasive localized delivery of Herceptin to the mouse brain by MRI-guided focused ultrasound-induced blood-brain barrier disruption. Proceedings of the National Academy of Sciences U. S. A. 103, 11719-11723 (2006).
- Samiotaki, G., Acosta, C., Wang, S., Konofagou, E. E. Enhanced delivery and bioactivity of the neurturin neurotrophic factor through focused ultrasound-mediated blood-brain barrier opening in vivo. Journal of Cerebral Blood Flow & Metabolism. 35, 611-622 (2015).
- O'Reilly, M. A., Waspe, A. C., Chopra, R., Hynynen, K. MRI-guided disruption of the blood-brain barrier using transcranial focused ultrasound in a rat model. Journal of Visualized Experiments. (61), e3555 (2012).
- Thévenot, E., et al. Targeted delivery of self-complementary adeno-associated virus serotype 9 to the brain, using magnetic resonance imaging-guided focused ultrasound. Human gene Therapy. 23, 1144-1155 (2012).
- Hsu, P. -. H., et al. Noninvasive and targeted gene delivery into the brain using microbubble-facilitated focused ultrasound. PloS One. 8, 58682 (2013).
- Wang, S., Olumolade, O. O., Sun, T., Samiotaki, G., Konofagou, E. E. Noninvasive, neuron-specific gene therapy can be facilitated by focused ultrasound and recombinant adeno-associated virus. Gene Therapy. 22, 104 (2015).
- Downs, M. E., et al. Long-Term Safety of Repeated Blood-Brain Barrier Opening via Focused Ultrasound with Microbubbles in Non-Human Primates Performing a Cognitive Task. PLoS One. 10, 0125911 (2015).
- Lipsman, N., et al. Blood-brain barrier opening in Alzheimer's disease using MR-guided focused ultrasound. Nature Communications. 9, 2336 (2018).
- Carpentier, A., et al. Clinical trial of blood-brain barrier disruption by pulsed ultrasound. Science Translational Medicine. 8, 343 (2016).
- Sternson, S. M., Roth, B. L. Chemogenetic Tools to Interrogate Brain Functions. Annual Reviews Neurosciences. 37, 387-407 (2014).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63, 27-39 (2009).
- Zhu, H., et al. Chemogenetic inactivation of ventral hippocampal glutamatergic neurons disrupts consolidation of contextual fear memory. Neuropsychopharmacology. 39, 1880-1892 (2014).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Noninvasive, transcranial and localized opening of the blood-brain barrier using focused ultrasound in mice. Ultrasound in Medicine & Biology. 33, 95-104 (2007).
- Thévenot, E., et al. Targeted delivery of self-complementary adeno-associated virus serotype 9 to the brain, using magnetic resonance imaging-guided focused ultrasound. Human Gene Therapy. 23, 1144-1155 (2012).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220, 640-646 (2001).
- Yang, F. -. Y., Fu, W. -. M., Chen, W. -. S., Yeh, W. -. L., Lin, W. -. L. Quantitative evaluation of the use of microbubbles with transcranial focused ultrasound on blood-brain-barrier disruption. Ultrasonics Sonochemistry. 15, 636-643 (2008).
- Vardy, E., et al. A New DREADD Facilitates the Multiplexed Chemogenetic Interrogation of Behavior. Neuron. 86, 936-946 (2015).
- Thompson, K. J., et al. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. ACS Pharmacology and Translational Sciences. 1, 61-72 (2018).
- Gomez, J. L., et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357, 503-507 (2017).
- Nagai, Y., et al. Deschloroclozapine: a potent and selective chemogenetic actuator enables rapid neuronal and behavioral modulations in mice and monkeys. bioRxiv. , 854513 (2019).
- Thompson, K. J., et al. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. ACS Pharmacology and Translational Science. 1, 61-72 (2018).
- Bullitt, E. Expression of c-fos-like protein as a marker for neuronal activity following noxious stimulation in the rat. Journal of Comparative Neurology. 296, 517-530 (1990).
- Mahler, S. V., Aston-Jones, G. CNO Evil? Considerations for the use of DREADDs in behavioral neuroscience. Neuropsychopharmacology. 43, 934 (2018).
- Gruber, B., Froeling, M., Leiner, T., Klomp, D. W. J. RF coils: A practical guide for nonphysicists. Journal of Magnetic Resonance Imaging. 48, 590-604 (2018).
- Treat, L. H., McDannold, N., Vykhodtseva, N., Hynynen, K. Transcranial MRI-guided focused ultrasound-induced blood-brain barrier opening in rats. IEEE. 2, 998-1000 (2004).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Feasibility of transcranial, localized drug-delivery in the brain of Alzheimer's-model mice using focused ultrasound. IEEE. 2, 988-991 (2005).
- Cobbold, R. S. . Foundations of Biomedical ultrasound. , (2006).
- Younan, Y., et al. Influence of the pressure field distribution in transcranial ultrasonic neurostimulation. Medical Physics. 40, 082902 (2013).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Targeted disruption of the blood-brain barrier with focused ultrasound: association with cavitation activity. Physics in Medicine and Biology. 51, 793-807 (2006).
- Branda, C. S., Dymecki, S. M. Talking about a Revolution: The Impact of Site-Specific Recombinases on Genetic Analyses in Mice. Developmental Cell. 6, 7-28 (2004).
- Jendryka, M., et al. Pharmacokinetic and pharmacodynamic actions of clozapine-N-oxide, clozapine, and compound 21 in DREADD-based chemogenetics in mice. Scientific Reports. 9, 4522 (2019).
- Manvich, D. F., et al. The DREADD agonist clozapine N-oxide (CNO) is reverse-metabolized to clozapine and produces clozapine-like interoceptive stimulus effects in rats and mice. Scientific Reports. 8, 3840 (2018).
- Martinez, V. K., et al. Off-Target Effects of Clozapine-N-Oxide on the Chemosensory Reflex Are Masked by High Stress Levels. Frontiers in Physiology. 10, 521 (2019).
- Gomez, J. L., et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357, 503-507 (2017).
- Bonaventura, J., et al. High-potency ligands for DREADD imaging and activation in rodents and monkeys. Nature Communications. 10, 1-12 (2019).
- Roth, B. L. DREADDs for Neuroscientists. Neuron. 89, 683-694 (2016).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of Transduction Efficiency, Tropism and Axonal Transport of AAV Serotypes 1, 2, 5, 6, 8 and 9 in the Mouse Brain. PLoS One. 8, 76310 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados