Method Article
뇌 구조를 표적으로 삼고 화학 유전 학적 신경 조절을 평가하기위한 집중 초음파 유도 혈액 뇌 장벽 개방
요약
이 프로토콜은 집속 초음파 혈액 뇌 장벽(BBB) 개방, 결과 유전자 발현 평가 및 조직학적 검사를 통한 화학 유전 수용체의 신경 조절 활성 측정을 통해 유전자 전달에 필요한 단계를 설명합니다.
초록
ATAC(Acoustically Targeted Chemogenetics)는 특정 신경 회로의 비침습적 제어를 허용합니다. ATAC는 집속 초음파(FUS) 유도 혈액-뇌 장벽 개방(FUS-BBBO), 아데노 관련 바이러스(AAV) 벡터를 사용한 유전자 전달, 엔지니어링된 화학 유전학, 단백질 수용체 및 동족 리간드를 사용한 세포 신호 활성화의 조합을 통해 이러한 제어를 달성합니다. ATAC를 사용하면 단일 비침습적 초음파 응용 프로그램을 사용하여 밀리미터 단위의 정밀도로 크고 작은 뇌 영역을 모두 transduction할 수 있습니다. 이 형질 도입은 나중에 약물을 사용하여 자유롭게 움직이는 동물에서 장기간의 비 침습적 장치없는 신경 조절을 허용 할 수 있습니다. FUS-BBBO, AAV 및 화학 유전학이 여러 동물에서 사용되었기 때문에 ATAC는 다른 동물 종에서도 사용할 수 있도록 확장 가능해야 합니다. 이 논문은 이전에 발표된 프로토콜을 확장하고 복잡한 MRI 호환 FUS 장치가 필요 없이 MRI 유도를 통해 FUS-BBBO를 사용하여 작은 뇌 영역에 유전자 전달을 최적화하는 방법을 간략하게 설명합니다. 또한 이 프로토콜은 모든 실험실에서 3D 프린팅할 수 있고 다양한 종 또는 맞춤형 장비에 맞게 쉽게 수정할 수 있는 마우스 타겟팅 및 구속 구성 요소의 설계를 설명합니다. 재현성을 돕기 위해 프로토콜은 ATAC 개발에서 미세 기포, AAV 및 정맥 천자가 어떻게 사용되었는지 자세히 설명합니다. 마지막으로 ATAC를 활용한 연구의 예비 조사를 안내하는 예제 데이터가 표시됩니다.
서문
광유전학 1,2 및 화학유전학 3,4,5와 같은 회로 특이적 신경 조절 기술의 사용은 신경 회로 장애로서의 정신 상태에 대한 우리의 이해를 발전시켰습니다. 신경 회로는 연구하기 어렵고 일반적으로 특정 세포 유형, 뇌 영역, 분자 신호 전달 경로 및 활성화 시기에 의해 정의되기 때문에 뇌 질환 치료에서 제어하기가 훨씬 더 어렵습니다. 연구 및 임상 응용 모두에 이상적으로 이러한 제어는 비침습적으로 수행되지만 정확하고 비침습적인 신경 조절을 모두 달성하는 것은 어렵습니다. 예를 들어, 신경 활성 약물은 비침습적으로 뇌에 도달할 수 있지만 뇌 전체에 작용하여 공간적 특이성이 부족합니다. 반면, 전기 뇌심부 자극은 특정 뇌 영역을 제어할 수 있지만 특정 세포 유형을 제어하기 어렵고 수술과 장치 배치가 필요하다6.
ATAC(Acoustically Targeted Chemogenetics7)는 공간적, 세포 유형 및 시간적 특이성을 가진 신경 조절을 제공합니다. 공간 표적화를 위한 집속 초음파 유도 혈액뇌장벽 개방(FUS-BBBO), 세포 유형 특이적 프로모터의 제어 하에 유전자를 비침습적으로 전달하기 위한 아데노 관련 바이러스 벡터(AAV) 사용, 약물 투여를 통해 선택적으로 형질감염된 신경 회로를 조절하기 위한 조작된 화학유전학적 수용체의 세 가지 기술을 결합합니다. FUS는 밀리미터 단위의 공간 정밀도로 인간의 뇌를 포함한 조직 깊숙이 초점을 맞추는 초음파의 능력을 활용하는 FDA 승인 기술입니다. 고출력에서 FUS는 본태성 진전에 대한 FDA 승인 치료를 포함하여 비침습적 표적 절제술에 사용된다8. FUS-BBBO는 저강도 초음파와 전신적으로 투여된 미세 기포를 결합하여 초음파 초점에서 혈관에서 진동하여 BBB9의 국부적, 일시적(6-24시간) 및 가역적 개방을 초래합니다. 이러한 개구부는 설치류(10) 및 비인간 영장류(15)에서 심각한 조직 손상 없이 단백질(9,10), 소분자(small molecule)11 및 바이러스 벡터(viral vector)7,12,13,14를 뇌로 전달할 수 있게 한다. FUS-BBBO16,17에 대한 임상 시험이 진행 중이며, 이는 이 기술의 가능한 치료 적용을 나타냅니다.
AAV를 이용한 바이러스 유전자 전달은 최근 FDA 및 EU 규제 승인을 주요 이정표로 삼아 CNS 장애에 대한 임상 사용으로 빠르게 발전하고 있습니다. 마지막으로, 화학유전학적 수용체(chemogenetic receptors)18, 예컨대 디자이너 약물에 의해 독점적으로 활성화된 디자이너 수용체(Designer Receptors Activated Exclusive by Designer Drugs, DREDDs)는 형질전환 또는 형질감염된 동물(transfection된 동물)에서 뉴런 흥분에 대한 약리학적 제어를 제공하기 위해 신경과학자들에 의해 널리 사용된다19,20. DREADD는 내인성 리간드가 아닌 합성 화학유전학적 분자에 반응하도록 유전적으로 조작된 G 단백질 결합 수용체(GPCR)로, 이러한 리간드의 전신 투여가 DREADD 발현 뉴런의 흥분성을 증가시키거나 감소시킵니다. 이 세 가지 기술이 ATAC에 결합되면 공간, 세포 유형 및 시간적 정밀도로 선택된 신경 회로의 비침습적 변조에 사용할 수 있습니다.
여기에서는 간단한 3D 프린팅 표적 장비를 사용하여 마우스에서 FUS-BBBO로 뇌 영역을 정확하게 표적화하는 방법론을 포함하여 FUS-BBBO11 에 대해 이전에 발표된 프로토콜을 확장하고 업데이트합니다. 또한 FUS-BBBO를 ATAC에 적용하는 방법을 보여줍니다. 우리는 화학유전학적 수용체를 운반하는 AAV의 전달과 조직학에 의한 유전자 발현 및 신경 조절의 평가에 필요한 단계를 보여줍니다. 이 기술은 유전자 발현 또는 신경 조절을 위해 크거나 여러 뇌 영역을 표적으로 삼는 데 특히 적용할 수 있습니다. 예를 들어, 피질의 넓은 영역은 FUS-BBBO로 쉽게 형질도입되고 화학유전학을 사용하여 조절될 수 있습니다. 그러나 대체 기술인 두개내 주사를 통한 유전자 전달에는 많은 수의 침습적 주사와 개두술이 필요합니다. FUS-BBBO와 그 응용분야인 ATAC는 뇌 영역이 더 크고 침습적으로 표적으로 삼기 어려운 다양한 크기의 동물로 확장할 수 있습니다.
프로토콜
모든 실험은 캘리포니아 공과대학(California Institute of Technology)의 기관 동물 관리 및 사용 위원회(Institutional Animal Care and Use Committee)에서 승인한 프로토콜에 따라 수행되었으며, 여기서 데이터는 원래 J.O.S.에 의해 획득되었습니다.
1. 동물 마구 및 이미지 안내 하드웨어의 설계 및 3D 프린팅
- Szablowski 연구소 웹 사이트의 파일을 사용하십시오 : https://www.szablowskilab.org/downloads 구성 요소의 3D 프린팅을 위해.
- 인쇄 용지가 MRI에서 민감도가 낮지만 MRI로 볼 수 있는 지지대가 있는지 확인하십시오. 재료 및 시약 섹션에서 사용되는 재료의 세부 정보를 참조하십시오.
- 재료를 반복적으로 테스트하고 보강해야 하는 마모 부위를 관찰하여 여러 용도로 사용되는 재료 열화를 설명합니다. 인쇄된 벽의 두께가 2mm 이상인지 확인합니다.
- 고정밀 3D 프린터를 사용하여 타겟팅 정밀도를 향상시킵니다.
- 중력 및 기타 힘에 대응하여 플라스틱 3D 프린팅 부품의 편차를 방지하기 위해 구성 요소의 길이를 따라 지지하고 굽힘이 관찰되는 경우 3D 프린팅 벽의 두께를 늘립니다.
- 전방/후방, 내측/외측, 등/복부, 요, 피치 및 틸트를 포함한 여러 축의 정밀도를 고려합니다.
- FUS-BBBO를 수행하고 목표 위치로부터의 편차를 기록하여 타겟팅의 정확도를 테스트합니다.
- 전동식 정위 시스템을 사용하는 경우 FUS-BBBO 타겟팅 절차를 비디오에 녹화하여 동적 움직임이 재료 탄성에 미치는 영향을 평가하고 3D 프린팅 재료 벽을 두껍게 하여 편차를 수정합니다.
2. 초음파 시스템 설명
- 8요소 환형 배열 변환기(직경 = 25mm, 자연 초점 = 20mm, 조리개(F) = 0.8)가 있는 초음파 시스템을 사용하고 면도한 마우스 머리에 젤을 도포하여 가스가 제거된 초음파 젤로 하우징을 머리에 결합합니다.
참고: 이전 연구7에서 사용된 변환기의 중심 주파수는 1.5MHz, 펄스 지속 시간은 10ms, 펄스 반복 주파수는 120초 동안 1Hz였습니다. 압력은 광섬유 수중 청음기를 사용하여 보정되었으며 0.36-0.45 MPa 사이로 유지되었습니다. 1.5MHz 및 정수리 뼈에 대해 두개골(21)을 통한 18% 음향 감쇠를 가정합니다. 안전한 BBB 개방 및 AAV 전달에 적합한 조건의 범위는 7,14,22의 다른곳에서 상세히 설명되었다.
3. 동물 준비
- 의료용 공기로 2%의 이소플루란 흡입을 사용하여 마우스 한 마리를 마취합니다. 터치 핀치로 마취 깊이를 확인하여 반응 부족을 확인합니다. 그런 다음 연고 튜브의 교차 오염을 방지하기 위해 일회용 멸균 q-tip을 사용하여 각막 건조를 방지하기 위해 안과용 연고를 바르십시오.
참고: FUS-BBBO의 일반적인 절차는 30분에서 2시간 사이이며 마취는 내내 유지되어야 합니다. - 마우스를 마취한 후 깨끗한 카테터를 헤파린 식염수(10U/ml)로 세척합니다.
참고: 25-35g 마우스에 적합한 카테터에는 30G 바늘과 PE10 튜브가 있습니다. - 이어서, 마우스 꼬리를 70% 에탄올 패드로 소독한다. 꼬리 정맥 카테터를 측면 꼬리 정맥에 놓고 조직 접착제로 고정합니다. 꼬리 정맥에서 카테터로 혈액이 역류하는 것을 관찰하여 배치를 확인하십시오.
- 마우스 머리를 면도한 다음 조직 접착제가 건조된 후 탈모 크림을 사용하여 초음파 젤 아래에 기포가 갇힐 가능성을 줄입니다.
- 마우스를 3D 프린팅 MRI 캐리지에 넣고 앞니를 바이트 바에 장착하고 머리를 노즈콘 안에 넣습니다(그림 1a).
- 무딘 귀 막대와 접촉하는 부위에 최대 10μL 리도카인을 피하 주사합니다. 그런 다음 무딘 막대를 두개골에 고정하고 호흡을 방해하므로 기관에 압력을 가하지 않도록 주의하면서 안전한 양의 압력을 가합니다. 동물이 1/s의 속도로 자유롭게 호흡하고 있는지 확인하기 위해 30초 동안 호흡을 관찰합니다.
- 타겟팅 가이드를 이어바에 연결하고 3.6단계(그림 1b)와 같이 호흡을 확인한 다음 매분 절차 전반에 걸쳐 호흡을 시각적으로 계속 모니터링합니다. 호흡수가 1/s 이상으로 상승하면 마취 상실의 징후 중 하나입니다. 마우스가 MRI 스캐너에 없거나 호흡률이 5/s 이상으로 상승한 경우 1분마다 발가락 꼬집음 반응을 계속 모니터링합니다.
- MRI 캐리지를 MRI 홀더로 옮긴 다음 자석 구멍 내부로 옮깁니다.
알림: 하드웨어 설계는 7T MRI 내부의 72mm 코일에 최적화되어 있습니다. - MRI 시퀀스를 획득하여 스캐너에서 마우스의 위치를 파악합니다.
- 3D 고속 로우 앵글 샷(FLASH) 시퀀스를 선택하여 기기 제조업체의 특정 지침에 따라 다음 매개변수를 사용하여 뇌 전체를 획득합니다. 에코 시간: 3.9 밀리초, 반복 시간: 15 밀리초, 여기 펄스 각도: 15°, 매트릭스 크기: 130 x 130 x 114, 분해능: 복셀당 350 x 200 x 200 μm, 평균: 1, 획득 시간: 3분 42초
- MRI 시스템에서 FUS 시스템을 제어하는 컴퓨터로 파일을 전송합니다.
- 소프트웨어에서 이미징 시퀀스를 열어 MRI 유도 타겟팅을 수행하며, 여기서 이미지는 그림 1c와 같이 나타나야 합니다.
4. MRI 유도 타겟팅
참고: 맞춤형으로 설계된 표적 가이드를 사용하면 MRI 내에 초음파 변환기를 배치할 필요가 없으며 브레그마 및 람다 라인에 스테레오택스를 제로화하여 표적을 수행하기 위해 피부를 절개할 필요가 없습니다. 아래 단계에 따라 타겟팅 프로세스를 수행합니다.
- 캐리지를 정체 기구 안에 놓습니다. 양면 테이프가 있는 금속 블록을 사용하고 캐리지를 정체 기구의 두 지지대에 대고 눌러 제자리에 고정합니다.
- 데이터 관리자에서 파일을 선택하고 마우스 오른쪽 버튼을 클릭하여 메뉴 옵션을 표시한 다음 '즉시 전송'을 선택하여 실행 중인 FUS 안내 소프트웨어가 있는 컴퓨터로 MRI 이미지를 전송합니다.
- FUS 안내 소프트웨어를 열고 '시퀀스 열기'를 클릭하고 이미징 시퀀스의 모든 파일을 로드하여 이미지를 로드합니다.
- 마우스 오른쪽 버튼을 클릭하고 'Reformat'을 눌러 이미지를 세 축으로 다시 포맷합니다.
- 변환기를 원형 타겟팅 가이드(그림 1c)에 맞게 마우스 오른쪽 버튼을 클릭하여 현지화합니다.
- 시상에서 view, 수조와 변환기 하우징의 두께를 고려하여 가상 변환기의 수직 위치를 조정합니다(이 경우 – 위쪽으로 8.2mm, 그림 1d).
- 궤적 플래너에서 타겟팅 할 영역을 가리키고 스프레드 시트의 좌표를 기록하십시오 (이 경우 – 그림 1d와 같이 중뇌).
- 원하는 타겟팅 깊이(전자 궤적의 z-값(그림 2))를 입력하고 스프레드시트의 좌표를 기록합니다.
- 'Send trajectory' 및 'Execute'를 눌러 각 지점을 대상으로 합니다(그림 2).
알림: 이것은 마우스 캐리어가 모터 내부에 배치될 때 수행됩니다. 그러나, 동일한 타겟팅은 입체 악기 상에서 높은 정확도로 달성 될 수있다. - MRI의 좌표와 정위 프레임의 상관 관계를 파악하려면 맞춤형 트랜스듀서를 타겟팅 가이드 위에 놓고 3개의 타겟팅 볼트(그림 3, 요소 A)가 각각 트랜스듀서 홀더(그림 3, 요소 B)와 타겟팅 가이드(그림 3, 요소 C)를 모두 통과할 수 있을 때까지 변환합니다. 볼트가 장력을 받거나 기울어지지 않았는지 확인하십시오.
- MRI에서 표적 가이드의 중심이 나타나는 것과 같은 위치에 위치할 때까지 변환기를 전방/후방 방향으로 10.56mm 앞으로 이동합니다.
- 가상 트랜스듀서의 중심(그림 3a, 요소 A)에서 대상 영역(그림 3a, 요소 B)까지의 거리를 결정하고 스테레오탁스 프레임을 사용하여 트랜스듀서를 이러한 좌표로 이동합니다.
- 주사 용액 준비를 진행하십시오.
5. 주사액 준비
알림: 마이크로버블 용액은 압력에 매우 민감합니다. 결과적으로, 얇은 바늘을 통한 격렬한 혼합 또는 빠른 주입은 미세 기포를 붕괴시키고 BBB 개방의 효능을 감소시킬 수 있습니다. 또한 미세 기포는 물보다 가벼우며 튜브, 카테터 또는 주사기 상단으로 떠오를 수 있습니다(그림 4). 매 주입 직전에 마이크로버블 용액을 재현탁하는 것이 좋습니다.
- 주사기를 사용하여 0.8mL 식염수를 1.5mL 튜브에 빼냅니다.
- 주사기를 사용하여 MRI 조영제 0.1mL를 동일한 1.5mL 튜브에 넣고 혼합합니다.
- 활성화되지 않은 마이크로 버블23,24 용액을 실온으로 가져 오십시오.
- 공명 직전에 마이크로 버블 활성화 장치에서 45초 동안 마이크로 버블을 활성화합니다.
- 천천히(~3초 이상) 액체의 중간 깊이에서 0.1mL 투베르쿨린 주사기와 1G 바늘을 사용하여 21mL의 미세 기포를 빼냅니다.
- 0.08 mL의 마이크로버블을 5.3단계에서 제조된 조영제와 식염수 용액에 넣는다. 손으로 15초 동안 두드려 섞습니다.
- AAV의 최종 농도가 체중 그램당 0.5-2 x 1010 바이러스 입자(VP/g)인 경우, ATAC의 경우 꼬리 정맥 카테터에 30G 바늘을 통해 전달을 위해 화물(이 경우 AAV9)을 주입합니다.
- 부유를 피하기 위해 손으로 15초 동안 다시 미세 기포를 혼합합니다(그림 4).
- 그 직후, 바늘을 부착하지 않고 주사기를 통해 마이크로버블 용액 200μL를 흡인합니다. 바늘이 없으면 미세 기포에 가해지는 전단력이 감소합니다.
- 주사기를 뒤집고 플런저를 위아래로 눌러 혼합합니다.
- 30G 바늘을 부착하고 거꾸로 된 상태에서 바늘 끝에 물방울이 나타날 때까지 미세 기포를 천천히 밀어냅니다.
6. 인소네이션 절차
- 인슨에 대한 매개변수를 설정합니다: 10ms 펄스 지속 시간, 120회 반복, 매 초마다, 두개골에서 0.30-0.45MPa 압력.
- 타겟팅 가이드를 제거하고 기체가 제거된 초음파 젤을 마우스 머리에 바르고 기포가 생기지 않도록 합니다.
- 트랜스듀서를 내려 이어바 홀더의 평평한 곳에 직접 놓고 좌표를 스테레오탁스 기기에 다이얼 입력합니다(그림 5).
- AAV 용액(0.5-2 x 1010 VP/g)을 주입합니다.
- 마이크로버블과 MRI 조영제 용액을 15초 동안 혼합하고 마우스 30g당 80μL를 주입합니다.
- 즉시 '보내기' 및 '실행'을 눌러 120초 동안 초음파를 적용합니다.
- 둘 이상의 사이트가 타겟팅되는 경우 변환기를 해당 사이트로 이동하고 4.7-4.9 단계의 스프레드시트 숫자에 따라 깊이 타겟팅을 조정합니다. 그런 다음 모든 인슨 부위에 대해 6.5-6.6 단계를 반복하십시오.
7. BBB 개방의 MRI 평가
참고: BBB 개구부의 MRI 평가는 다른 곳에서 자세히 설명되었습니다11. BBB 개방 위치는 T1 강조 Gd 조영제를 주사받은 마우스에서 더 밝은 영역으로 시각화할 수 있습니다.
- 초음파 적용 후 3.10단계와 같이 MRI 시퀀스를 기록합니다.
- MRI 스캐너에서 마우스를 제거하고 마취에서 회복할 수 있도록 회복 케이지에 넣습니다. 고통, 체중 감소 또는 기타 인도적 종점의 징후가 있는지 매일 마우스를 모니터링합니다. 예상치 못한 부작용이 발생할 경우 치료를 진행하기 위해 수의사 및 기관 IACUC 지침과 상의하십시오.
8. 화학유전학적 리간드를 이용한 DREADD 자극
- 화학 유전 수용체를 선택하십시오. DREADD의 경우, Gq 결합 경로19를 통한 뉴런 활성화를 위한 hM3Dq 수용체, Gi/o 결합 경로20을 통한 뉴런 활성 억제를 위한 hM4Di 수용체 또는 Salvinorin-B 리간드25를 사용하여 Gs 결합 경로를 통한 뉴런 활성화를 위한 KORD 수용체를 선택하십시오.
- clozapine-n-oxide(CNO)를 멸균 식염수에 1mg/mL 농도로 녹입니다. 분취된 CNO를 -20°C에서 보관한다.
- CNO 19 또는 다른 화학유전학적 리간드26,27,28을 0.3 –10 mg/kg 사이의 농도로 복강내 경로를 통해 투여합니다.
- 행동에 대한 CNO의 영향을 기록해야 하는 경우, 약물 투여 후 15-45분 이내에 행동 활동을 기록하기 시작하여 DREADD의 최대 활성화를 달성한다19.
- 신경 활성화 분석이 필요한 경우 주사 후 60-120 분 후에 조직 학적 평가를 위해 마우스를 사용하십시오.
- 심장 관류를 통한 안락사를 진행하십시오(섹션 9 참조).
9. 유전자 발현 및 화학유전학적 활성화의 조직학적 평가
참고: 실험 종점(예: 행동 연구 종료, 유전자 발현에 필요한 시간)이 달성되면 유전자 발현의 위치와 존재를 확인하는 것이 중요합니다.
- 화학 유전 리간드로 활성화 한 후 조직을 보존하기 위해 심장 관류를 수행하십시오.
- IP 주사를 통해 멸균 식염수에 케타민(100mg/kg)/자일라진(10mg/kg) 혼합물로 마우스를 마취합니다. 발가락 꼬집음으로 마취를 확인하고 호흡률이 약 1/s로 낮아졌는지 확인합니다. 안락사가 확인 될 때까지 가열 패드를 통해 열 지원을 제공하십시오.
- mL당 10단위의 헤파린으로 10% 중성 완충 포르말린(NBF) 및 PBS를 준비합니다.
알림: 용액은 4°C에 있어야 합니다. - 각 버퍼를 별도의 50mL 튜브에 붓고 연결하고 PBS/헤파린 용액으로 25G 나비 카테터에 연결된 연동 펌프를 프라이밍합니다.
- 팔다리를 흡수성 파란색 패드에 테이프로 부착하고 동물이 패드에 앙와위 자세로 놓여 있는지 확인하십시오. 모피를 수집해야 할 경우 말초 장기의 교차 오염을 피하기 위해 모피를 소독하십시오.
- 횡단 절개로 복강을 열어 횡격막을 노출시킵니다.
- 전방 / 후방 축을 따라 수술 용 가위 두 컷을 통해 흉곽을 엽니 다.
- 심장을 노출시키고 바늘을 왼쪽 챔버(누운 자세로 볼 때 심장의 오른쪽)에 놓고 9.1.3단계에서 나비 카테터에 넣습니다.
- 혈액이 유출 될 수 있도록 우심실을 작게 절개하십시오.
- 연동 펌프를 켜서 PBS/헤파린으로 혈액을 씻어내기 시작합니다.
참고: 이 단계를 적절하게 수행하지 않으면 포르말린으로 고정하는 동안 혈액이 응고되어 적절한 관류를 방해합니다. - 모든 혈액이 배출되고 깨끗한 PBS가 우심실에서 나오기 시작하면 연동 펌프의 입구를 NBF 용액으로 전환하고 마우스당 25mL의 관류를 시작합니다.
- 뇌를 추출하고 최소 4mL의 NBF에 넣고 24시간 동안 사후 수정합니다.
- 50μm 단면 두께를 사용하여 비브라톰의 관상 절편을 사용하여 뇌를 절편합니다.
- 각 섹션을 뇌 전체에 섹션을 저장하는 24 웰 플레이트의 우물에 놓습니다.
- 형광 단백질(예를 들어, mCherry 또는 mCitrine)에 융합된 화학유전학적 수용체의 발현을 형광 현미경 하에서 평가하여 발현을 나타내는 부분을 확인하여 위치를 확인하였다. 표정이 흐려질 수 있습니다.
- 다음 프로토콜을 사용하여 형광단에 대한 면역염색을 수행합니다.
- 2차 항체 숙주의 10% 혈청을 함유하는 0.5mL의 용액에 3개의 섹션을 넣고 30분 동안 배양합니다.
- 1:500을 시작점으로 사용하여 1:250 – 1:1,000 희석의 1차 항체 용액으로 절편을 옮깁니다.
- 1차 항체와 함께 절편을 파라핀 필름으로 밀봉된 마이크로플레이트에서 4°C에서 밤새 인큐베이션한다.
- PBS로 섹션을 한 번에 3분 동안 5번 세척합니다.
- 10% 혈청에 2차 항체 용액을 웰당 0.5mL 추가합니다.
- 실온에서 4 시간 동안 배양하십시오.
- PBS로 섹션을 한 번에 3분 동안 5번 세척합니다.
- 핵 염색(예: DAPI)이 포함된 수성 장착 매체를 사용하여 슬라이드에 장착합니다.
- 컨포칼 현미경을 사용하여 전체 섹션의 타일 스캔을 수행하여 위치 파악 및 확산을 평가합니다.
- 표적 뇌 영역에서 형광 픽셀 강도를 측정하여 발현 강도를 평가하고 두개내 주입된 대조군과 비교합니다.
- 또는 DAPI 양성 세포 또는 세포 특이적 마커와 비교하여 화학유전학적 수용체에 대해 염색된 세포를 계수하여 양성 뉴런의 비율을 평가합니다.
- 50μm 절편에서 헤마톡실린 염색을 수행하고 세포 손실, 세포 파편 축적 및 기타 총체적 손상 징후에 대한 이미징을 수행하여 조직 손상을 평가합니다.
- 세포 표적화의 특이성을 평가하기 위해, 화학유전학적 수용체 및 세포-특이적 마커에 대해 하기와 같이 이중 면역염색을 수행한다. 그런 다음 9.8단계에서와 같이 세포 양성 계수를 수행합니다.
- 2차 항체 숙주의 10% 혈청을 함유하는 용액 0.5mL에 3개의 섹션을 넣고 30분 동안 배양합니다.
- 1:500을 시작점으로 사용하여 1:250 – 1:1,000 희석에서 화학유전학적 수용체의 형광 마커에 대한 1차 항체 용액으로 절편을 옮깁니다. 관심 있는 세포 특이적 마커(예: CamkIIa)를 표적으로 하는 다른 숙주 종의 두 번째 1차 항체를 추가합니다.
- 파라핀 필름으로 밀봉된 마이크로플레이트에서 4°C에서 하룻밤 동안 1차 항체와 함께 절편을 인큐베이션한다.
- PBS로 섹션을 한 번에 3분 동안 5번 세척합니다.
- 두 2차 항체의 숙주 종의 10% 혈청에 웰당 0.5mL의 2차 항체 용액을 추가합니다.
참고: 각 항체는 뚜렷한 형광단을 가져야 하며 9.10.2단계에서 1차 항체에 대해 반응해야 합니다. - 실온에서 4 시간 동안 배양하십시오.
- PBS로 섹션을 한 번에 3분 동안 5번 세척합니다.
- 슬라이드에 장착하고 핵 얼룩이 포함된 수성 장착 매체로 고정합니다.
10. c-Fos에 대한 면역염색을 통한 신경 활성화 평가
- 이 프로토콜의 9.5항에서와 같이 c-Fos 1차 항체 및 핵 염색과 구별되는 형광 태그가 있는 2차 항체를 사용하여 c-Fos 염색을 수행합니다.
- 화학유전학적 수용체가 표적으로 하는 영역에서 c-Fos 및 핵 염색 모두에 대해 양성인 세포의 비율을 계산합니다.
- 화학유전학적 수용체를 발현하고 화학유전학적 리간드 또는 비히클 대조군으로 처리된 마우스 그룹 및 화학유전학적 리간드 또는 비히클 대조군으로 처리된 야생형 마우스 그룹에서 c-Fos 양성 핵의 백분율을 분석합니다.
결과
ATAC 프로토콜을 수행하는 첫 번째 단계는 원하는 뇌 영역에 FUS-BBBO를 표적화하는 것입니다. 예를 들어, 설명된 프로토콜에 따라 해마를 FUS-BBBO로 표적으로 삼고 조영제와 DREADD를 운반하는 AAV9를 마우스에 주입한 다음 마우스 뇌의 이미지를 획득하는 FLASH 3D MRI 시퀀스를 주입했습니다. T1 신호 향상은 해마 영역(그림 6)과 뇌의 다른 부분(그림 7)에서 달성되었습니다. 몇 주 후, DREADD는 표적 뇌 영역 내에서 발현되었습니다. 많은 DREADD가 형광 리포터(예: mCherry)에 융합되는 동안 포름알데히드로 관류 및 고정 과정은 이러한 단백질의 형광을 크게 감소시키는 것으로 밝혀졌습니다. mCherry 또는 DREADD에 대한 면역염색은 이전 경험을 바탕으로 발현의 보다 신뢰할 수 있는 검출을 유도했습니다(그림 8). 이전 실험에서, 마우스의 ~85%가 FUS-BBBO7에 따라 발현을 보였다. DREADD의 충분한 발현 수준에 대한 간단한 테스트는 세포 수준에서 기능을 테스트하는 것입니다. 예를 들어, 화학유전학적 리간드 또는 식염수 대조군, 예컨대 CNO19, 데스클로로클로자핀 28, 또는 기타29를 제공하고, 심장 관류 및 고정 전에 2시간을 대기시킴으로써 수행될 수 있다. 그런 다음 뇌 절편을 뉴런의 활성 증가를 나타내는 c-Fos 단백질30과 DREAD에 대해 공동 면역염색했습니다. DREADD를 표적으로 하는 뇌 부위가 식염수7을 투여받은 그룹과 비교했을 때 화학유전학적 리간드를 투여받은 그룹에서 c-Fos 양성인 신경 핵의 수가 유의하게 더 많거나 FUS-BBBO를 받지 않은 반대쪽 부위와 비교했을 때 실험은 성공적인 것으로 간주되었습니다. 주목할 점은, 이러한 리간드 중 일부가 DREADD의 발현 없이 비특이적으로 뉴런을 활성화할 가능성이 있다는 것입니다. 예를 들어, CNO는 생쥐에서 낮은 수준의 클로자핀으로 대사되는 것으로 나타났으며, 이는 BBB를 통과하여 높은 효능의 DREADD를 활성화시킨다27. 그러나 비특정 위치에도 결합하는 것으로 나타났습니다. 모든 실험에서와 마찬가지로, 화학유전학적 연구(31)에 모든 적절한 대조군을 포함시키는 것이 중요하다. 한가지 가능한 대조군은 원하는 행동 또는 조직학적 분석에 대한 약물 단독의 효과를 배제하기 위해 절차 없이 야생형 마우스에 화학유전학적 리간드를 투여하는 것이다. 또 다른 대조군은 4개의 그룹을 포함할 수 있다: DREADD + 리간드, DREADD + 비히클, EGFP + 리간드, EGFP + 비히클, 이는 FUS-BBBO를 이용한 유전자 전달 및 화학유전학적 리간드 둘 다의 임의의 잠재적 효과를 설명할 것이다.
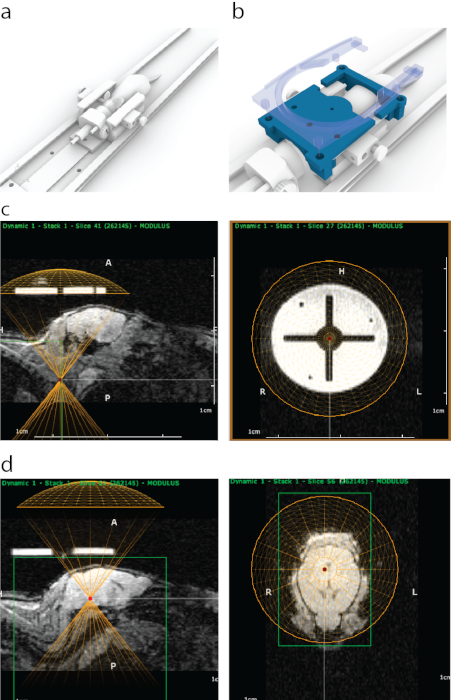
그림 1: ATAC에서 FUS의 MRI 유도 표적화 프로세스. (a) 이어바, 노즈콘 및 MRI 스캐너 내부에 들어갈 수 있는 플랫폼이 있는 마우스 배치. (b) MRI에서 볼 수 있는 3D 프린팅 가이드(파란색)를 이어바 프레임 끝에 부착한 다음 4개의 스냅온 볼트(반투명 파란색)가 포함된 표면 MRI 코일 홀더로 제자리에 고정했습니다. (c) 시상 MRI(왼쪽 패널)에서 3D 프린팅된 가이드의 모양으로, 변환기의 가상 표현의 하단이 가이드의 하단과 정렬(노란색 반원)되어 있습니다. 오른쪽 패널은 MRI에서 3D 프린팅된 가이드의 모습을 관상 보기에서 보여줍니다. 밝은 원은 MRI 대비가 강한 폴리젯 지지체 재료로 만들어졌습니다. 십자가는 플라스틱으로 형성되었습니다. 노란색 원은 입체 프레임 내부의 가이드와 동심원으로 정렬된 변환기 위치를 나타냅니다. (d) 뇌 구조를 표적으로 삼기 위해 가상 변환기를 마우스 위의 z 방향으로 이동하여 초음파 원뿔/하우징의 두께와 일치시켰습니다. 이 경우, 수조의 두께 때문에, 트랜스듀서는 정확한 타겟팅을 위해 가이드 위로 8.2 mm 이동하였다. MRI 영상 데이터를 사용하여 뇌 구조를 선택하고 MRI 좌표를 기록하여 정위 기계에 입력했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
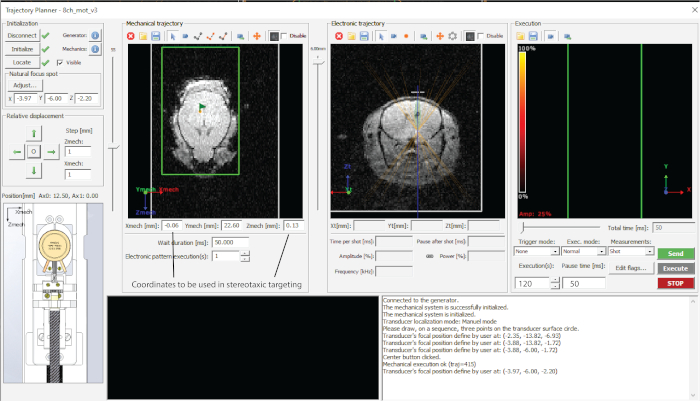
그림 2: 사용된 소프트웨어의 인터페이스. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
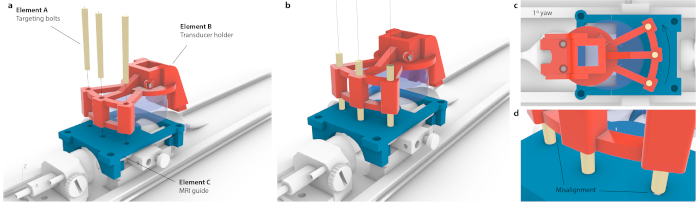
그림 3: MRI 좌표 공간을 정체 기기와 일치시키는 프로세스. (a) 트랜스듀서 홀더 내의 3개의 구멍은 MRI 가이드 내의 3개의 구멍과 정렬되었으며 3개의 원추형 타겟팅 볼트는 전체 어셈블리에 굴곡을 일으키지 않고 삽입되었습니다. (b) 이상적으로는 세 개의 볼트가 모두 구멍의 중앙에 위치합니다. (c) 정렬에 부정확성이 있는 경우 세 개의 볼트가 모두 맞지 않는 경우(예: 1°의 작고 감지할 수 없는 요의 경우 하나의 볼트만 맞고 반대쪽 볼트는 MRI 가이드에 고정됩니다. 또는 볼트가 강제로 통과할 때 전체 어셈블리의 눈에 띄는 굴곡이 있을 수 있습니다. (d) 볼트 피팅의 확대도. 볼트는 최상의 정확도를 위해 동심원으로 배치해야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
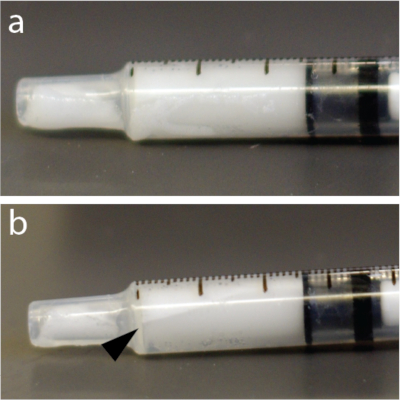
그림 4: 주사기 내 미세 기포의 신속한 재분배. (a) 주사기는 혼합 후 5초 후에 촬영하였다. (b) 1분 후, 1mL 투베르쿨린 주사기 상단 근처에 일부 기포 농축액을 보여주는 명확하게 보이는 층이 있었습니다. 이 예는 특히 마이크로 버블 용액을 사용했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
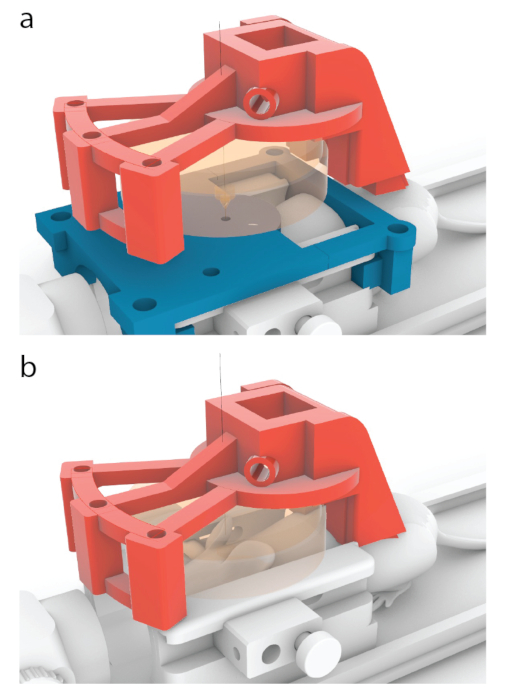
그림 5: 트랜스듀서의 중심을 MRI 가이드의 중심 위에 배치하는 과정. (a) 이 문서에 표시된 모델에서 빨간색 캐리어는 그림 10.56b에 표시된 위치에서 여기에 표시된 위치로 3mm 앞으로 이동하도록 설계되었습니다. (b) 초음파 처리 전에 파란색 MRI 가이드를 제거하고 초음파 통과를 보장하기 위해 마우스와 변환기 (주황색) 사이에 초음파 젤을 적용했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
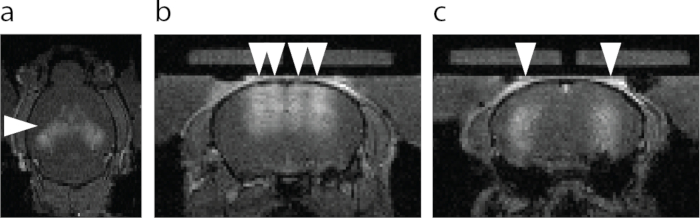
그림 6: BBB 개구부의 MRI 시각화. (a) BBB 개구부의 축 방향 보기. 화살촉으로 지정된 더 밝은 영역은 MRI T1 조영제의 혈관외 유출을 나타냅니다. (b) FUS-BBBO(화살촉)로 표적화된 등쪽 해마와 해마 위 피질의 관상 보기. (c) FUS-BBBO(화살촉)로 표적이 된 중앙 해마의 관상 보기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 이 논문에 설명된 3볼트 표적화 시스템을 사용한 4개의 뇌 부위 표적화 예. 화살촉이 있는 영역은 BBB가 MRI 조영제가 확산된 부위를 열었습니다. 4개의 사이트는 아래에서 위로 각 BBB 개구부 사이에 ~150초를 두고 연속적으로 표적이 되었습니다. 마지막 BBB 개봉 후 2분 이내에 촬영한 이미지입니다. 스케일 바는 2mm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
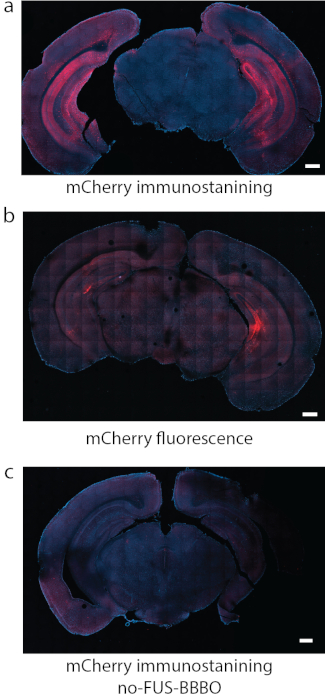
그림 8: DREADD 표현식 감지. (a) DREADD에 부착된 형광단에 대한 면역염색, 이 경우 mCherry는 일부 연구에서 신뢰할 수 있는 검출 방법이었습니다. (b) (a)에서와 동일한 조건을 사용하여 해마를 표적으로 하는 DREADD가 있는 또 다른 대표적인 섹션에서 mCherry의 형광 자체는 강한 배경과 상대적으로 약한 신호를 생성했습니다. (c) 음성 대조군으로 AAV의 전신 주사를 받았지만 FUS-BBBO를 받지 않은 마우스를 사용했습니다. mCherry 면역염색에 의해 유의한 발현을 발견할 수 없습니다. 스케일 바는 500mm입니다(a, c의 데이터는 권한이 있는7 에서 수정됨, Copyright 2020 Nature-Springer). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
ATAC는 정확한 MRI 유도 표적화, FUS-BBBO 및 유전자 발현의 조직학적 평가를 포함하여 특정 신경 회로의 성공적인 신경 조절을 위한 여러 기술의 성공적인 구현이 필요합니다. 3D 프린팅 가능한 구성 요소는 이미징 유도 FUS-BBBO로 작은 뇌 구조의 표적화를 단순화하기 위해 개발되었습니다.
MRI 유도 집속 초음파(MRIgFUS) 관리에는 여러 가지 문제가 있습니다. 첫째, 일반적인 MRI 코일은 초음파 하드웨어가 아닌 표본만 수용하도록 설계된 공간이 제한되어 있습니다. MRI의 더 큰 보어는 신호가 코일(32)의 필 팩터와 관련되기 때문에 장비 비용을 증가시키고 이미지 품질을 감소시킨다. 결과적으로 MRI에서 동물 이미지 상단에 배치된 FUS 하드웨어는 이미징 품질을 저하시킵니다. 둘째, MRI 호환 장치를 설계하는 것은 어렵고 비용이 많이 듭니다. MRI 호환 재료는 반자성이어야 하고, 고주파 조사 중에 와전류를 생성하는 경향이 낮고, 높은 자기장에서 자화율이 낮아야 합니다. 모든 전도성 물질에서 와전류 생성 또는 자화율도 이미징 품질에 부정적인 영향을 미칩니다. 마지막으로, 사용 가능한 MRI 호환 재료는 정밀한 표적 기계(예: 정위 프레임)의 생산에 일반적으로 사용되는 금속보다 영률 및 내구성이 낮습니다. 위치 조정에 사용되는 모터는 MRI와 호환되어야 하며 크기 때문에 MRI 보어 외부에 배치해야 합니다. 이 모터는 MRI 호환 재료를 사용하여 MRI 보어 내부의 변환기에 멀리 떨어져 연결해야 합니다. 플라스틱 뒤틀림 문제, 견고한 크기의 구성 요소를 구현하기 위한 보어 내부의 충분한 공간 부족, 전체 뇌에서 타겟팅 위치를 변경할 수 있는 공간 부족은 이전 작업의 타겟팅 정확도에 영향을 미쳤습니다.
이러한 문제를 해결하기 위해 스캐너 외부에서 MRI 및 FUS-BBBO 관리에서 이미징을 수행하기로 결정했습니다. MRI 안내를 허용하기 위해 마우스는 MRI와 입체 좌표 공간 모두에서 마우스 뇌 구조를 국소화하는 데 사용할 수 있는 MRI 가시 표적 가이드가 있는 3D 프린팅 구속 장치 안에 배치되었습니다. 마우스 두개골과 표적 가이드가 모두 이어 바 홀더에 단단히 부착되어 있기 때문에(그림 1a,b), 표적 가이드를 사용하여 MRI 이미지 내의 공간 좌표를 상호 연관시키고 정위 도구를 영점화할 수 있습니다. 구속 장치에는 움직이는 부품이 없고 트랜스듀서가 포함되어 있지 않아 MRI 내부에 들어갈 수 있을 만큼 견고하고 충분히 작게 만들 수 있었고 트랜스듀서의 전자 장치에서 신호 간섭을 제거할 수 있었습니다. 일부 재료에 대한 3D 프린팅 지지대가 MRI에서 보이기 때문에 타겟팅 가이드 내부의 공간이 비어 있습니다(그림 1c). 스테레오택스 보정을 가능하게 하기 위해 어셈블리에 구멍이 뚫려 있습니다(그림 3). 초음파 트랜스듀서는 스테레오택스의 전극 홀더에 부착되었고, 타겟팅은 섹션 4(도 1d)에 기술된 바와 같이 수행되었다. 변환기는 수평 평면에서 벗어나는 것을 방지하기 위해 이어 바의 하우징으로 길이를 따라 지지되어야 합니다. 등-복부 방향의 표적화는 환형 배열의 위상 변이를 사용하여 달성할 수 있습니다.
실제 표적 정밀도는 초음파 초점과 두개골 감쇠에 의해 결정됩니다. FUS-BBBO 절차는 래트 11에 대해 상세히 기술되어 있으며, 다수의 다른 모델 유기체23,33,34 및 인간 16,17에서 구현되었다. 초음파 초점 크기 사이의 관계는 주파수에 반비례하며, 주파수가 높을수록 더 정확한 전달이 가능할 수 있습니다. 그러나 두개골의 감쇠는 주파수35에 따라 증가하여 두개골 가열 및 피질 영역의 손상을 유발할 수 있습니다. 정확한 타겟팅 전략은 뇌 사이트에 따라 다릅니다. 전폭의 절반 최대 압력이 뇌 조직 내에 맞는 부위는 선조체, 중뇌 및 해마와 같은 많은 뇌 구조에서 예측 가능하고 안전한 BBB 개방을 허용합니다. 뇌 기저부 근처의 영역은 생쥐에서 특정한 문제를 제기합니다. 쥐의 뇌는 등-복부 방향으로 약 8-10mm를 측정하며, 이는 상업적으로 이용 가능한 많은 변환기의 전체 너비 절반 최대 크기와 비슷합니다. 결과적으로, 두개골의 바닥을 표적으로 삼는 것은 외이도, 입 또는 기관에 존재하는 뼈와 공기로부터 초음파 반사를 유도할 수 있으며, 이는 예측할 수 없는 고압 및 저압 패턴을 초래할 수 있다(36). 이러한 압력 중 일부는 출혈 및 조직 손상을 유발하는 것으로 밝혀진 관성 캐비테이션 임계 값을 넘을 수 있습니다37. 두개골의 기저부 근처에 위치하는 영역을 표적으로 삼기 위해, 교차 ATAC(intersectional ATAC)7를 사용하는 것이 바람직할 수 있으며, 여기서 교차 유전학(intersectional genetics)(38)은 유전자 발현을 FUS 빔으로 표적화된 영역보다 더 작은 영역으로 제한하기 위해 사용된다. 공개된 교차 ATAC의 예에서, 도파민성 세포에서 유전자 편집 효소(Cre38)를 발현하는 형질전환 동물은 도파민성 세포를 포함하는 영역의 하위 섹션에서 초음파를 표적으로 삼았습니다. 마지막으로, 피질 영역은 FUS로 표적화 될 수 있지만 초음파의 회절 및 반사가 발생하여 고르지 않은 압력 프로파일이 발생할 수 있습니다. 이 프로토콜은 사용된 종에 크게 의존하기 때문에 피질 영역의 표적화를 다루지 않습니다. 그러나, 해마 7 위의 피질의 일부 표적화(예를 들어, 도 7)는 관찰되었으며, 적어도 마우스에서, 가능하다는 것을 나타낸다.
화학유전학적 활성제의 선택 및 투여량은 특정 실험 요구에 따라 달라집니다. 저자의 연구중 하나를 포함한 다수의 연구7에서는 유의한 비특이적 반응이 나타나지 않았으며39,40, 고용량(예: 10 mg/kg)은 적어도 어떤 경우에는 부작용을 일으킬 수 있다41. 그러나, 모든 행동 실험과 마찬가지로, 적절한 제어(31)는 CNO 및 그 대사산물(42)의 잠재적인 비표적 활성으로 인해 필수적이다. 이러한 대조군에는 DREADD를 발현하는 동물에 대한 CNO 및 식염수 대조군의 투여 및 야생형 동물에 대한 CNO 투여 또는 일부 특정 경우에 각각 화학유전학적 수용체를 발현하거나 발현하지 않는 뇌의 입시 및 반대쪽 부위의 비교가 포함될 수 있습니다. 또한, 최근 연구에서는 특이성이 향상된 다수의 새로운 DREADD 작용제가 밝혀졌다 28,29,43. 다른 화학유전학적 수용체 5,25,44는 또한 ATAC 절차와 함께 사용될 수 있다.
유전자 발현의 조직학적 평가는 모든 동물에 대해 사후에 필요합니다. 소수의 동물은 FUS-BBBO7 이후 불량한 유전자 발현을 보인다. 또한, mis-targeting이 가능하기 때문에 유전자 발현의 공간적 정확성과 특이성을 보여줄 필요가 있다. 참고로, 일부 AAV는 역행 또는 전향 추적 능력(45 )을 보일 수 있으며, 정확한 초음파 표적화에도 불구하고 초음파로 표적화된 부위로부터 멀리 떨어진 곳에서 형질감염을 일으킬 수 있다. 발현된 화학유전학적 수용체가 형광단에 융합되거나 동시 발현되는 경우, 조직 절편에서 형광단의 이미징은 발현의 국소화 및 강도를 평가하기에 충분할 수 있습니다. 그러나 많은 형광 단백질이 조직 고정 과정에 의해 손상되며, DREADD와 함께 자주 사용되는 mCherry 단백질에 대한 면역염색은 이전 연구에서 더 나은 신호를 나타냈다7. 마지막으로, 뇌의 특정 부분(예: 해마의 과립 세포층)에 있는 뉴런의 밀도로 인해, 융합과 달리 IRES에서 발현되는 핵 국소화 형광단을 사용하여 세포 계수를 수행하는 것이 핵이 DAPI 또는 TO-PRO-3과 같은 핵 염색으로 쉽게 분할되고 대조될 수 있기 때문에 유익할 수 있습니다. c-Fos 염색에 의한 신경 조절을 평가하려면 핵 대조 염색을 수행하고 형광 신호가 아닌 c-Fos 양성 핵을 계수하는 것이 필수적입니다. 어떤 경우에는 세포 파편이 형광을 나타내어 양성 세포의 측정을 혼란스럽게 할 수 있습니다.
FUS-BBBO를 사용한 약물 및 유전자 전달의 한계에는 침습적 두개내 주사를 통한 전달보다 해상도가 낮고 더 많은 양의 주사 약물 또는 바이러스 벡터가 필요하다는 것이 포함됩니다. 또한 뇌에 직접 주사하면 주사 부위에 독점적으로 전달되는 반면 FUS-BBBO는 정맥 주사 경로를 사용하여 말초 조직으로 전달할 수 있습니다. 신경 조절을 위한 화학유전학 사용의 한계에는 느린 시간 척도가 포함되며, 이는 신경 조절 강도의 급격한 변화를 필요로 하는 일부 행동 프로토콜에 부적절할 수 있습니다.
공개
이해 상충이 없습니다.
감사의 말
이 연구는 Brain and Behavior Foundation, NARSAD Young Investigator Award의 지원을 받았습니다. 여러 3D 프린팅 구성 요소는 원래 Fabien Rabusseau(Image Guided Therapy, France)가 설계했습니다. 저자는 원고 준비에 기술적인 도움을 준 John Heath(Caltech)와 Margaret Swift(Caltech)에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 21-gauge needles (BD) | Fisher Scientific | 14826C | |
| 25-gauge butterfly catheter | Harvard Bioscience | 725966 | |
| 30-gauge needles (BD) | Fisher Scientific | 14826F | |
| Absorbent blue pad | Office Depot | 902406 | |
| Anti-c-Fos antibody | Santa Cruz Biotechnology | SC-253-G | |
| Anti-mCherry antibody | Thermofisher | PA534974 | |
| Bruker Biospec 70/30 | Bruker | custom | includes the RF coils |
| Clozapine-n-oxide | Tocris | 4936 | |
| Custom designed 3D printed mouse harnesses and MRIgFUS targeting components | ImageGuidedTherapy, Szablowski lab | custom | download from szablowskilab.org/downloads |
| Custom MRIgFUS machine | ImageGuidedTherapy | N/A | |
| Definity microbubbles | Lantheus | DE4 | |
| Degassed aquasonic/ultrasound gel | Fisher Scientific | 5067714 | |
| Depilation crème | Nair | n/a | |
| Eight-element annular array transducer | Imasonic Inc. | custom | |
| Ethanol Pads/Alcohol Swabs (70%) (BD) | Office Depot | 599893 | |
| Heparin | Sigma-Aldrich | H3149-25KU | |
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Ketamine | Patterson Veterinary | 07-890-8598 | |
| Neutral buffered formalin (10%) | Sigma-Aldrich | HT501128-4L | |
| Optical fiber hydrophone | Precision Acoustics | ||
| PE10 tubing | Fisher Scientific | NC1513314 | |
| Peristaltic pump | |||
| Phosphate-buffered saline (PBS) | Sigma-Aldrich | 524650-1EA | |
| Prohance contrast agent | Bracco | 0270-1111-04 | |
| Saline | Fisher Scientific | NC9054335 | |
| Secondary antibody, Donkey-anti goat | ThermoFisher | A-11055 | |
| Secondary antibody, Donkey-anti rabbit | ThermoFisher | 84546 | |
| Surgical scissors (straight) | Fisher Scientific | 17467480 | |
| ThermoGuide Software | ImageGuidedTherapy | ||
| Tissue glue (Gluture) | Fisher Scientific | NC9855218 | |
| Tuberculin Syringe (1 mL) (BD) | Fisher Scientific | 14823434 | |
| VeroClear 3D printable material | Stratasys | RGD810 | |
| Vialmix microbubble activation device | Lantheus | VMIX | |
| Vibrating microtome | Compresstome | VF-300 | |
| Xylazine | Sigma-Aldrich | X1251-1G |
참고문헌
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
- Zhang, F., Wang, L. -. P., Boyden, E. S., Deisseroth, K. Channelrhodopsin-2 and optical control of excitable cells. Nature Methods. 3, 785-792 (2006).
- Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Roth, B. L. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proceedings of the National Academy of Sciences. 104, 5163-5168 (2007).
- Lerchner, W., et al. Reversible silencing of neuronal excitability in behaving mice by a genetically targeted, ivermectin-gated Cl- channel. Neuron. 54, 35-49 (2007).
- Magnus, C. J., et al. Chemical and genetic engineering of selective ion channel-ligand interactions. Science. 333, 1292-1296 (2011).
- Deeb, W., et al. Proceedings of the fourth annual deep brain stimulation think tank: a review of emerging issues and technologies. Frontiers in Integrative Neuroscience. 10, 38 (2016).
- Szablowski, J. O., Lee-Gosselin, A., Lue, B., Malounda, D., Shapiro, M. G. Acoustically targeted chemogenetics for the non-invasive control of neural circuits. Nature Biomedical Engineering. 2, 475-484 (2018).
- Elias, W. J., et al. A pilot study of focused ultrasound thalamotomy for essential tremor. New England Journal of Medicine. 369, 640-648 (2013).
- Burgess, A., Hynynen, K. Noninvasive and targeted drug delivery to the brain using focused ultrasound. ACS Chemical Neuroscience. 4, 519-526 (2013).
- Kinoshita, M., McDannold, N., Jolesz, F. A., Hynynen, K. Noninvasive localized delivery of Herceptin to the mouse brain by MRI-guided focused ultrasound-induced blood-brain barrier disruption. Proceedings of the National Academy of Sciences U. S. A. 103, 11719-11723 (2006).
- Samiotaki, G., Acosta, C., Wang, S., Konofagou, E. E. Enhanced delivery and bioactivity of the neurturin neurotrophic factor through focused ultrasound-mediated blood-brain barrier opening in vivo. Journal of Cerebral Blood Flow & Metabolism. 35, 611-622 (2015).
- O'Reilly, M. A., Waspe, A. C., Chopra, R., Hynynen, K. MRI-guided disruption of the blood-brain barrier using transcranial focused ultrasound in a rat model. Journal of Visualized Experiments. (61), e3555 (2012).
- Thévenot, E., et al. Targeted delivery of self-complementary adeno-associated virus serotype 9 to the brain, using magnetic resonance imaging-guided focused ultrasound. Human gene Therapy. 23, 1144-1155 (2012).
- Hsu, P. -. H., et al. Noninvasive and targeted gene delivery into the brain using microbubble-facilitated focused ultrasound. PloS One. 8, 58682 (2013).
- Wang, S., Olumolade, O. O., Sun, T., Samiotaki, G., Konofagou, E. E. Noninvasive, neuron-specific gene therapy can be facilitated by focused ultrasound and recombinant adeno-associated virus. Gene Therapy. 22, 104 (2015).
- Downs, M. E., et al. Long-Term Safety of Repeated Blood-Brain Barrier Opening via Focused Ultrasound with Microbubbles in Non-Human Primates Performing a Cognitive Task. PLoS One. 10, 0125911 (2015).
- Lipsman, N., et al. Blood-brain barrier opening in Alzheimer's disease using MR-guided focused ultrasound. Nature Communications. 9, 2336 (2018).
- Carpentier, A., et al. Clinical trial of blood-brain barrier disruption by pulsed ultrasound. Science Translational Medicine. 8, 343 (2016).
- Sternson, S. M., Roth, B. L. Chemogenetic Tools to Interrogate Brain Functions. Annual Reviews Neurosciences. 37, 387-407 (2014).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63, 27-39 (2009).
- Zhu, H., et al. Chemogenetic inactivation of ventral hippocampal glutamatergic neurons disrupts consolidation of contextual fear memory. Neuropsychopharmacology. 39, 1880-1892 (2014).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Noninvasive, transcranial and localized opening of the blood-brain barrier using focused ultrasound in mice. Ultrasound in Medicine & Biology. 33, 95-104 (2007).
- Thévenot, E., et al. Targeted delivery of self-complementary adeno-associated virus serotype 9 to the brain, using magnetic resonance imaging-guided focused ultrasound. Human Gene Therapy. 23, 1144-1155 (2012).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220, 640-646 (2001).
- Yang, F. -. Y., Fu, W. -. M., Chen, W. -. S., Yeh, W. -. L., Lin, W. -. L. Quantitative evaluation of the use of microbubbles with transcranial focused ultrasound on blood-brain-barrier disruption. Ultrasonics Sonochemistry. 15, 636-643 (2008).
- Vardy, E., et al. A New DREADD Facilitates the Multiplexed Chemogenetic Interrogation of Behavior. Neuron. 86, 936-946 (2015).
- Thompson, K. J., et al. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. ACS Pharmacology and Translational Sciences. 1, 61-72 (2018).
- Gomez, J. L., et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357, 503-507 (2017).
- Nagai, Y., et al. Deschloroclozapine: a potent and selective chemogenetic actuator enables rapid neuronal and behavioral modulations in mice and monkeys. bioRxiv. , 854513 (2019).
- Thompson, K. J., et al. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. ACS Pharmacology and Translational Science. 1, 61-72 (2018).
- Bullitt, E. Expression of c-fos-like protein as a marker for neuronal activity following noxious stimulation in the rat. Journal of Comparative Neurology. 296, 517-530 (1990).
- Mahler, S. V., Aston-Jones, G. CNO Evil? Considerations for the use of DREADDs in behavioral neuroscience. Neuropsychopharmacology. 43, 934 (2018).
- Gruber, B., Froeling, M., Leiner, T., Klomp, D. W. J. RF coils: A practical guide for nonphysicists. Journal of Magnetic Resonance Imaging. 48, 590-604 (2018).
- Treat, L. H., McDannold, N., Vykhodtseva, N., Hynynen, K. Transcranial MRI-guided focused ultrasound-induced blood-brain barrier opening in rats. IEEE. 2, 998-1000 (2004).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Feasibility of transcranial, localized drug-delivery in the brain of Alzheimer's-model mice using focused ultrasound. IEEE. 2, 988-991 (2005).
- Cobbold, R. S. . Foundations of Biomedical ultrasound. , (2006).
- Younan, Y., et al. Influence of the pressure field distribution in transcranial ultrasonic neurostimulation. Medical Physics. 40, 082902 (2013).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Targeted disruption of the blood-brain barrier with focused ultrasound: association with cavitation activity. Physics in Medicine and Biology. 51, 793-807 (2006).
- Branda, C. S., Dymecki, S. M. Talking about a Revolution: The Impact of Site-Specific Recombinases on Genetic Analyses in Mice. Developmental Cell. 6, 7-28 (2004).
- Jendryka, M., et al. Pharmacokinetic and pharmacodynamic actions of clozapine-N-oxide, clozapine, and compound 21 in DREADD-based chemogenetics in mice. Scientific Reports. 9, 4522 (2019).
- Manvich, D. F., et al. The DREADD agonist clozapine N-oxide (CNO) is reverse-metabolized to clozapine and produces clozapine-like interoceptive stimulus effects in rats and mice. Scientific Reports. 8, 3840 (2018).
- Martinez, V. K., et al. Off-Target Effects of Clozapine-N-Oxide on the Chemosensory Reflex Are Masked by High Stress Levels. Frontiers in Physiology. 10, 521 (2019).
- Gomez, J. L., et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357, 503-507 (2017).
- Bonaventura, J., et al. High-potency ligands for DREADD imaging and activation in rodents and monkeys. Nature Communications. 10, 1-12 (2019).
- Roth, B. L. DREADDs for Neuroscientists. Neuron. 89, 683-694 (2016).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of Transduction Efficiency, Tropism and Axonal Transport of AAV Serotypes 1, 2, 5, 6, 8 and 9 in the Mouse Brain. PLoS One. 8, 76310 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유