Method Article
Fokussierte ultraschallinduzierte Öffnung der Blut-Hirn-Schranke zur gezielten Behandlung von Hirnstrukturen und zur Beurteilung der chemogenetischen Neuromodulation
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Schritte, die für die Genabgabe durch fokussierte Ultraschallöffnung der Blut-Hirn-Schranke (BHS), die Bewertung der resultierenden Genexpression und die Messung der Neuromodulationsaktivität chemogenetischer Rezeptoren durch histologische Tests erforderlich sind.
Zusammenfassung
Die akustisch zielgerichtete Chemogenetik (ATAC) ermöglicht die nicht-invasive Kontrolle spezifischer neuronaler Schaltkreise. ATAC erreicht eine solche Kontrolle durch eine Kombination aus fokussiertem Ultraschall (FUS) induzierter Öffnung der Blut-Hirn-Schranke (FUS-BBBO), Genabgabe mit Adeno-assoziierten viralen (AAV) Vektoren und Aktivierung der zellulären Signalübertragung mit künstlich hergestellten, chemogenetischen Proteinrezeptoren und ihren verwandten Liganden. Mit ATAC ist es möglich, sowohl große als auch kleine Hirnregionen mit einer einzigen nicht-invasiven Ultraschallanwendung millimetergenau zu transduzieren. Diese Transduktion kann später eine langfristige, nicht-invasive, gerätefreie Neuromodulation bei sich frei bewegenden Tieren mit einem Medikament ermöglichen. Da FUS-BBBO, AAVs und Chemogenetik bei mehreren Tieren eingesetzt wurden, sollte ATAC auch für den Einsatz bei anderen Tierarten skalierbar sein. Diese Arbeit erweitert ein zuvor veröffentlichtes Protokoll und skizziert, wie die Genübertragung mit FUS-BBBO in kleine Hirnregionen mit MRT-Kontrolle optimiert werden kann, ohne dass ein kompliziertes MRT-kompatibles FUS-Gerät erforderlich ist. Das Protokoll beschreibt auch das Design von Maus-Targeting- und -Fixierungskomponenten, die von jedem Labor 3D-gedruckt und leicht für verschiedene Spezies oder kundenspezifische Ausrüstung modifiziert werden können. Um die Reproduzierbarkeit zu verbessern, beschreibt das Protokoll im Detail, wie die Mikrobläschen, AAVs und Venenpunktion bei der ATAC-Entwicklung verwendet wurden. Abschließend werden Beispieldaten gezeigt, die als Richtschnur für die Voruntersuchungen von Studien mit ATAC dienen sollen.
Einleitung
Der Einsatz von schaltkreisspezifischen Neuromodulationstechnologien wie Optogenetik 1,2 und Chemogenetik 3,4,5 hat unser Verständnis von psychiatrischen Erkrankungen als neuronale Schaltkreisstörungen erweitert. Neuronale Schaltkreise sind bei der Behandlung von Hirnerkrankungen schwer zu untersuchen und noch schwieriger zu kontrollieren, da sie typischerweise durch bestimmte Zelltypen, Hirnregionen, molekulare Signalwege und den Zeitpunkt der Aktivierung definiert werden. Im Idealfall würde eine solche Kontrolle sowohl für die Forschung als auch für klinische Anwendungen nicht-invasiv durchgeführt, aber es ist eine Herausforderung, sowohl eine präzise als auch eine nicht-invasive Neuromodulation zu erreichen. Während beispielsweise neuroaktive Medikamente das Gehirn nicht-invasiv erreichen können, fehlt es ihnen an räumlicher Spezifität, indem sie im gesamten Gehirn wirken. Auf der anderen Seite kann die elektrische Tiefenhirnstimulation bestimmte Hirnregionen kontrollieren, hat jedoch Schwierigkeiten, bestimmte Zelltypen zu kontrollieren und erfordert eine Operation und die Platzierung eines Geräts6.
Acoustically Targeted Chemogenetics7 (ATAC) bietet Neuromodulation mit räumlicher, zelltypischer und zeitlicher Spezifität. Es kombiniert drei Techniken: fokussierte ultraschallinduzierte Öffnung der Blut-Hirn-Schranke (FUS-BBBO) für räumliches Targeting, Verwendung von Adeno-assoziierten viralen Vektoren (AAVs) zur nicht-invasiven Verabreichung von Genen unter der Kontrolle von zelltypspezifischen Promotoren und modifizierte chemogenetische Rezeptoren, um transfizierte neuronale Schaltkreise selektiv durch Medikamentenverabreichung zu modulieren. FUS ist eine von der FDA zugelassene Technologie, die sich die Fähigkeit von Ultraschall zunutze macht, mit räumlicher Präzision im Millimeterbereich, tief in Gewebe, einschließlich des menschlichen Gehirns, zu fokussieren. Bei hoher Leistung wird FUS für die nicht-invasive gezielte Ablation verwendet, einschließlich einer von der FDA zugelassenen Behandlung des essentiellen Tremors8. FUS-BBBO kombiniert Ultraschall niedriger Intensität mit systemisch verabreichten Mikrobläschen, die in den Blutgefäßen am Ultraschallfokus oszillieren, was zu einer lokalisierten, vorübergehenden (6-24 h) und reversiblen Öffnung der BHS9 führt. Diese Öffnung ermöglicht die Abgabe von Proteinen9,10, kleinen Molekülen 11 und viralen Vektoren7,12,13,14 an das Gehirn ohne signifikante Gewebeschäden bei Nagetieren 10 und nichtmenschlichen Primaten 15. Klinische Studien für FUS-BBBO16,17 sind im Gange, was auf mögliche therapeutische Anwendungen dieser Technik hinweist.
Die Verabreichung viraler Gene mit AAV schreitet auch schnell in die klinische Anwendung bei ZNS-Erkrankungen vor, wobei die jüngsten behördlichen Zulassungen der FDA und der EU wichtige Meilensteine darstellen. Schließlich werden chemogenetische Rezeptoren18, wie z. B. Designerrezeptoren, die ausschließlich durch Designerdrogen aktiviert werden (DREADDs), von Neurowissenschaftlern häufig verwendet, um eine pharmakologische Kontrolle über die neuronale Erregung bei transgenen oder transfizierten Tieren zu gewährleisten19,20. DREADDs sind G-Protein-gekoppelte Rezeptoren (GPCRs), die genetisch so verändert wurden, dass sie auf synthetische chemogenetische Moleküle und nicht auf endogene Liganden reagieren, so dass die systemische Verabreichung dieser Liganden die Erregbarkeit von DREADD-exprimierenden Neuronen erhöht oder verringert. Wenn diese drei Technologien in ATAC kombiniert werden, können sie für die nicht-invasive Modulation ausgewählter neuronaler Schaltkreise mit räumlicher, zelltypischer und zeitlicher Präzision verwendet werden.
Hier erweitern und aktualisieren wir ein zuvor veröffentlichtes Protokoll für FUS-BBBO11 , indem wir eine Methodik für das genaue Targeting von Gehirnregionen mit FUS-BBBO bei Mäusen unter Verwendung einfacher 3D-gedruckter Zielgeräte aufnehmen. Wir zeigen auch eine Anwendung von FUS-BBBO auf ATAC. Wir zeigen Schritte, die für die Verabreichung von AAVs mit chemogenetischen Rezeptoren und die Bewertung der Genexpression und Neuromodulation durch Histologie erforderlich sind. Diese Technik ist besonders anwendbar, um große oder mehrere Gehirnregionen für die Genexpression oder Neuromodulation anzuvisieren. Zum Beispiel kann ein großer Bereich einer Großhirnrinde leicht mit FUS-BBBO transduziert und mittels Chemogenetik moduliert werden. Die Genübertragung mit einer alternativen Technik, der intrakraniellen Injektion, würde jedoch eine große Anzahl invasiver Injektionen und Kraniotomien erfordern. FUS-BBBO und seine Anwendung, ATAC, können auf Tiere unterschiedlicher Größe skaliert werden, bei denen die Gehirnregionen größer und schwieriger invasiv zu erreichen sind.
Protokoll
Alle Experimente wurden nach einem Protokoll durchgeführt, das vom Institutional Animal Care and Use Committee des California Institute of Technology genehmigt wurde, wobei die Daten ursprünglich von J.O.S.
1. Design und 3D-Druck von Tiergeschirr und Bildführungshardware
- Verwenden Sie die Dateien von der Website des Szablowski-Labors unter: https://www.szablowskilab.org/downloads für den 3D-Druck der Komponenten.
- Stellen Sie sicher, dass das Druckmaterial eine geringe Anfälligkeit für MRT aufweist, aber über eine MRT-sichtbare Unterstützung verfügt. Weitere Informationen zu den verwendeten Materialien finden Sie im Abschnitt Materialien und Reagenzien.
- Berücksichtigen Sie den Materialabbau bei mehrfacher Verwendung, indem Sie das Material wiederholt testen und die Verschleißstellen beobachten, die verstärkt werden sollten. Stellen Sie sicher, dass die bedruckten Wände mindestens 2 mm dick sind.
- Verwenden Sie hochpräzise 3D-Drucker, um die Zielgenauigkeit zu verbessern.
- Wirken Sie der Schwerkraft und anderen Kräften entgegen, um eine Abweichung von 3D-gedruckten Kunststoffkomponenten zu vermeiden, indem Sie die Komponenten entlang ihrer Länge stützen und die Dicke der 3D-gedruckten Wände erhöhen, wenn eine Biegung beobachtet wird.
- Berücksichtigen Sie die Präzision in mehreren Achsen, einschließlich anterior/posterior, medial/lateral, dorsal/ventral sowie Gieren, Nicken und Kippen.
- Testen Sie die Genauigkeit der Zielerfassung, indem Sie FUS-BBBO durchführen und die Abweichung von der Zielposition aufzeichnen.
- Wenn Sie motorisierte stereotaktische Systeme verwenden, bewerten Sie die Auswirkungen dynamischer Bewegungen auf die Materialelastizität, indem Sie das FUS-BBBO-Targeting-Verfahren auf Video aufzeichnen, und korrigieren Sie alle Abweichungen, indem Sie die Wände des 3D-gedruckten Materials verdicken.
2. Beschreibung des Ultraschallsystems
- Verwenden Sie ein Ultraschallsystem mit einem Ringarray-Schallkopf mit acht Elementen (Durchmesser = 25 mm, natürlicher Brennpunkt = 20 mm; Blende (F) = 0,8)) und koppeln Sie das Gehäuse mit dem Kopf mit entgastem Ultraschallgel, indem Sie das Gel auf den rasierten Mauskopf auftragen.
ANMERKUNG: Die Mittenfrequenz eines Wandlers, der in einer früheren Studie7 verwendet wurde, betrug 1,5 MHz, die Impulsdauer betrug 10 ms und die Impulswiederholfrequenz betrug 1 Hz über 120 s. Die Drücke wurden mit einem Glasfaserhydrophon kalibriert und zwischen 0,36 und 0,45 MPa gehalten. Gehen Sie von einer akustischen Dämpfung von 18 % durch den Schädel21 für 1,5 MHz und das Scheitelbein aus. Der Bereich der Bedingungen, die für eine sichere BHS-Öffnung und AAV-Abgabe geeignet sind, wurde an anderer Stelle ausführlich beschrieben 7,14,22.
3. Zubereitung von Tieren
- Betäubung einer Maus mit Isofluran-Inhalation bei 2 % mit medizinischer Luft. Überprüfen Sie die Tiefe der Anästhesie, indem Sie sie leicht zusammendrücken, um das fehlende Ansprechen zu bestätigen. Tragen Sie dann eine Augensalbe auf, um das Austrocknen der Hornhaut zu verhindern, indem Sie ein steriles Einweg-Wattestäbchen verwenden, um eine Kreuzkontamination der Salbentube zu verhindern.
HINWEIS: Das typische Verfahren von FUS-BBBO kann zwischen 30 Minuten und 2 Stunden dauern, und die Anästhesie muss durchgehend aufrechterhalten werden. - Nachdem die Maus betäubt wurde, wird ein sauberer Katheter mit heparinisierter Kochsalzlösung (10 U/ml) gewaschen.
HINWEIS: Ein geeigneter Katheter für eine 25-35 g schwere Maus hat eine 30 g Nadel und einen PE10-Schlauch. - Anschließend Mäuseschwanz mit 70%igem Ethanol-Pad desinfizieren. Legen Sie den Schwanzvenenkatheter in eine seitliche Schwanzvene und fixieren Sie ihn mit einem Gewebekleber. Beobachten Sie einen Rückfluss von Blut aus der Schwanzvene in den Katheter, um seine Platzierung zu bestätigen.
- Rasieren Sie den Mäusekopf und verwenden Sie dann nach dem Trocknen des Gewebeklebers eine Enthaarungscreme, um die Möglichkeit zu verringern, dass Luftblasen während der Ultraschallbehandlung unter Ultraschallgel eingeschlossen werden.
- Setzen Sie die Maus in einen 3D-gedruckten MRT-Schlitten, befestigen Sie die Vorderzähne auf einer Beißstange und den Kopf in einer Nase (Abbildung 1a).
- Injizieren Sie bis zu 10 μl Lidocain subkutan an der Stelle, die mit den stumpfen Ohrbügeln in Berührung kommt. Befestigen Sie dann die stumpfen Stäbe am Schädel und üben Sie einen sicheren Druck aus, wobei Sie darauf achten sollten, keinen Druck auf die Luftröhre auszuüben, da dies die Atmung behindert. Beobachten Sie die Atmung 30 Sekunden lang, um zu bestätigen, dass das Tier mit einer Frequenz von 1/s frei atmet.
- Verbinden Sie die Zielführung mit den Ohrstangen, überprüfen Sie die Atmung wie in Schritt 3.6 (Abbildung 1b) und überwachen Sie die Atmung während des gesamten Eingriffs jede Minute. Eine erhöhte Atemfrequenz von über 1/s ist eines der Anzeichen für einen Anästhesieverlust. Überwachen Sie die Zehenkneifreaktion weiterhin alle 5 Minuten, wenn sich die Mäuse nicht im MRT-Scanner befinden oder wenn die Atemfrequenz über 1/s erhöht ist.
- Führen Sie den MRT-Schlitten in eine MRT-Halterung und dann in die Bohrung eines Magneten.
HINWEIS: Das Design der Hardware ist für eine 72-mm-Spule in einem 7T-MRT optimiert. - Erfassen Sie eine MRT-Sequenz, um die Maus im Scanner zu lokalisieren.
- Wählen Sie die FLASH-Sequenz (3D Fast Low Angle Shot) aus, um das gesamte Gehirn zu erfassen, indem Sie die folgenden Parameter gemäß den spezifischen Anweisungen des Geräteherstellers verwenden. Echozeit: 3,9 ms, Wiederholzeit: 15 ms, Anregungsimpulswinkel: 15°, Matrixgröße: 130 x 130 x 114, Auflösung: 350 x 200 x 200 μm pro Voxel, Mittelwerte: 1, Aufnahmezeit: 3 min 42s
- Übertragen Sie Dateien vom MRT-System auf einen Computer, der das FUS-System steuert.
- Öffnen Sie die Bildgebungssequenz in der Software, um ein MRT-gesteuertes Targeting durchzuführen, wobei das Bild wie in Abbildung 1c angezeigt werden sollte.
4. MRT-gesteuertes Targeting
HINWEIS: Bei der Verwendung von kundenspezifischen Zielführungslinien ist es nicht erforderlich, den Ultraschallwandler in einem MRT zu platzieren, und es ist auch nicht erforderlich, die Haut einzuschneiden, um ein Targeting durchzuführen, indem die Stereotaxe auf Bregma- und Lambdalinien auf Null gesetzt wird. Führen Sie die folgenden Schritte aus, um den Targeting-Prozess durchzuführen.
- Platzieren Sie den Schlitten in einem stereotaktischen Instrument. Befestigen Sie es mit einem Metallblock mit doppelseitigem Klebeband und indem Sie den Schlitten gegen zwei Stützpfosten des stereotaktischen Instruments drücken.
- Übertragen Sie MRT-Bilder auf einen Computer mit einer laufenden FUS-Guidance-Software, indem Sie Dateien im Datenmanager auswählen, mit der rechten Maustaste klicken, um Menüoptionen aufzurufen, und "Sofort übertragen" auswählen.
- Öffnen Sie die FUS-Guidance-Software und laden Sie das Bild, indem Sie auf "Sequenz öffnen" klicken und alle Dateien der Bildsequenz laden.
- Formatieren Sie das Bild in drei Achsen um, indem Sie mit der rechten Maustaste klicken und "Neu formatieren" klicken.
- Lokalisieren Sie den Wandler an der kreisförmigen Zielführungslinie (Abbildung 1c), indem Sie mit der rechten Maustaste klicken.
- Passen Sie in der sagittalen Ansicht die vertikale Position eines virtuellen Wandlers an, um die Dicke des Wasserbades und des Wandlergehäuses zu berücksichtigen (in diesem Fall – 8,2 mm aufwärts, Abbildung 1d).
- Zeigen Sie die Bereiche, die anvisiert werden sollen, in den Trajektorienplaner und notieren Sie die Koordinaten in einer Tabelle (in diesem Fall – Mittelhirn, wie in Abbildung 1d).
- Wählen Sie die gewünschte Zieltiefe (Z-Wert in der elektronischen Trajektorie (Abbildung 2) und notieren Sie die Koordinaten in einer Tabelle.
- Zielen Sie jeden der Punkte an, indem Sie auf "Trajektorie senden" und "Ausführen" drücken (Abbildung 2).
HINWEIS: Dies geschieht, wenn ein Mausträger in den Motoren platziert wird. Das gleiche Targeting kann jedoch mit hoher Genauigkeit auf einem stereotaktischen Instrument erreicht werden. - Um die Koordinaten eines MRT mit dem stereotaktischen Rahmen zu korrelieren, platzieren Sie den speziell montierten Schallkopf über einer Zielführung und verschieben Sie ihn, bis jeder der drei Zielbolzen (Abbildung 3, Element A) sowohl durch die Schallkopfhalterung (Abbildung 3, Element B) als auch durch die Zielführung (Abbildung 3, Element C) geführt werden kann. Stellen Sie sicher, dass die Schrauben nicht unter Spannung stehen oder kippen.
- Verschieben Sie den Schallkopf um 10,56 mm nach vorne in anteriore/posteriorer Richtung, bis er sich an der gleichen Stelle befindet, an der auf einem MRT die Mitte einer Zielschablone erscheint.
- Bestimmen Sie den Abstand von einem Mittelpunkt des virtuellen Wandlers (Abbildung 3a, Element A) zum Zielbereich (Abbildung 3a, Element B) und bewegen Sie den Wandler mithilfe eines stereotaktischen Rahmens zu diesen Koordinaten.
- Fahren Sie mit der Herstellung der Injektionslösung fort.
5. Vorbereitung der Injektionslösung
HINWEIS: Die Mikroblasenlösungen sind sehr druckempfindlich. Folglich kann ein kräftiges Mischen oder eine schnelle Injektion durch dünne Nadeln die Mikrobläschen kollabieren lassen und die Wirksamkeit der BHS-Öffnung verringern. Darüber hinaus sind Mikrobläschen leichter als Wasser und können z. B. in einem automatischen Injektor an die Oberseite eines Röhrchens, Katheters oder einer Spritze schwimmen (Abbildung 4). Es wird dringend empfohlen, die Mikrobläschenlösung unmittelbar vor jeder Injektion zu resuspendieren.
- 0,8 ml Kochsalzlösung mit einer Spritze in ein 1,5-ml-Röhrchen entnehmen.
- Geben Sie mit einer Spritze 0,1 ml MRT-Kontrastmittel in dasselbe 1,5-ml-Röhrchen und mischen Sie es.
- Die nicht aktivierte Mikroblase23,24 Lösung auf Raumtemperatur bringen.
- Unmittelbar vor der Beschallung Mikrobläschen für 45 s in einem Mikrobläschen-Aktivierungsgerät aktivieren.
- Ziehen Sie langsam (über ~3 s) 0,1 ml Mikrobläschen mit einer 1-ml-Tuberkulinspritze und einer 21-g-Nadel aus der mittleren Tiefe einer Flüssigkeit ab.
- 0,08 ml Mikrobläschen werden in die in Schritt 5.3 hergestellte Lösung aus Kontrastmittel und Kochsalzlösung gegeben. Durch Klopfen mit der Hand 15 s lang mischen.
- Da die Endkonzentration der AAVs 0,5-2 x 1010 Viruspartikel pro Gramm Körpergewicht (VP/g) beträgt, injizieren Sie die Fracht zur Verabreichung (in diesem Fall AAV9) durch eine 30-G-Nadel in den Schwanzvenenkatheter, im Falle von ATAC – AAVs, die chemogenetische Rezeptoren tragen, oder eine Negativkontrolle, wie z. B. AAVs, die GFP unter demselben Promotor tragen.
- Mischen Sie Mikrobläschen erneut 15 s lang von Hand, um ein Aufschwimmen zu vermeiden (Abbildung 4).
- Unmittelbar danach werden 200 μl der Mikrobläschenlösung durch eine Spritze ohne Nadel abgesaugt. Das Fehlen einer Nadel reduziert die Scherkräfte auf Mikrobläschen.
- Drehen Sie die Spritze um und mischen Sie, indem Sie den Kolben nach oben und unten drücken.
- Befestigen Sie die 30-G-Nadel und drücken Sie die Mikrobläschen langsam heraus, bis Tröpfchen am Ende einer Nadel erscheinen.
6. Ablauf der Beschallung
- Stellen Sie die Parameter für die Beschallung ein: 10 ms Pulsdauer, 120 Wiederholungen, alle s, und 0,30-0,45 MPa Druck am Schädel.
- Entfernen Sie die Zielführung und tragen Sie entgastes Ultraschallgel auf den Mauskopf auf, wobei Sie darauf achten müssen, dass sich keine Blasen bilden.
- Senken Sie den Schallkopf ab, legen Sie ihn direkt auf die flache Ohrbügelhalterung und geben Sie die Koordinaten in die stereotaktischen Instrumente ein (Abbildung 5).
- Injizieren Sie die AAV-Lösung (0,5-2 x 1010 VP/g).
- Mikrobläschen und die MRT-Kontrastmittellösung 15 s lang mischen und 80 μl pro 30 g Maus injizieren.
- Wenden Sie sofort Ultraschall für 120 Sekunden an, indem Sie auf "Senden" und "Ausführen" drücken.
- Wenn mehr als eine Stelle anvisiert wird, verschieben Sie den Messkopf an diese Stelle, und passen Sie die Tiefenzielgenauigkeit nach den Zahlen in der Tabelle aus den Schritten 4.7 bis 4.9 an. Wiederholen Sie dann die Schritte 6.5-6.6 für jede besonierte Stelle.
7. MRT-Auswertung der BHS-Öffnung
ANMERKUNG: Die MRT-Auswertung der BHS-Öffnung wurde an anderer Stelle ausführlich beschrieben11. Die Lage der BHS-Öffnung kann als hellere Bereiche bei Mäusen visualisiert werden, die eine Injektion eines T1-gewichteten Gd-Kontrastmittels erhielten.
- Zeichnen Sie nach der Ultraschallanwendung eine MRT-Sequenz wie in Schritt 3.10 auf.
- Nehmen Sie die Maus aus dem MRT-Scanner und legen Sie sie in einen Aufwachkäfig, um die Erholung aus der Narkose zu ermöglichen. Überwachen Sie die Mäuse täglich auf Anzeichen von Stress, Gewichtsverlust oder andere humane Endpunkte. Konsultieren Sie das Veterinärpersonal und die institutionellen IACUC-Richtlinien, um mit der Behandlung fortzufahren, falls unerwartete unerwünschte Ereignisse auftreten.
8. DREADD-Stimulation mit chemogenetischem Liganden
- Wählen Sie einen chemogenetischen Rezeptor. Für DREADDs wählen Sie den hM3Dq-Rezeptor für die neuronale Aktivierung über Gq-gekoppelte Signalwege19, den hM4Di-Rezeptor für die Hemmung der neuronalen Aktivität über Gi/o-gekoppelte Signalwege20 oder den KORD-Rezeptor für die Aktivierung von Neuronen über Gs-gekoppelte Signalwege unter Verwendung des Salvinorin-B-Liganden25.
- Clozapin-n-oxid (CNO) wird in steriler Kochsalzlösung in einer Konzentration von 1 mg/ml gelöst. Lagern Sie das alizitierte CNO bei -20 °C.
- Verabreichen Sie CNO 19 oder einen anderen chemogenetischen Liganden26,27,28 auf intraperitonealem Weg in einer Konzentration zwischen 0,3 und10 mg/kg.
- Wenn die Auswirkungen von CNO auf das Verhalten aufgezeichnet werden sollen, beginnen Sie mit der Aufzeichnung der Verhaltensaktivität innerhalb von 15-45 Minuten nach der Medikamentenverabreichung, um die maximale Aktivierung von DREADDszu erreichen 19.
- Wenn eine Analyse der neuronalen Aktivierung gewünscht wird, verwenden Sie Mäuse für die histologische Beurteilung nach 60-120 Minuten nach der Injektion.
- Euthanasie durch Herzperfusion (siehe Abschnitt 9).
9. Histologische Bewertung der Genexpression und chemogenetischen Aktivierung
HINWEIS: Sobald der experimentelle Endpunkt (z. B. Ende der Verhaltensstudie, für die Genexpression erforderliche Zeit) erreicht ist, ist es wichtig, den Ort und das Vorhandensein der Genexpression zu bestätigen.
- Nach der Aktivierung mit einem chemogenetischen Liganden ist eine kardiale Perfusion durchzuführen, um das Gewebe zu erhalten.
- Die Maus wird mit einer Mischung aus Ketamin (100 mg/kg) und Xylazin (10 mg/kg) in steriler Kochsalzlösung durch eine IP-Injektion betäubt. Bestätigen Sie die Anästhesie mit einem Kneifen der Zehen und stellen Sie sicher, dass die Atemfrequenz auf ca. 1/s gesenkt wurde. Bieten Sie thermische Unterstützung durch das Heizkissen bis zur Bestätigung der Euthanasie.
- Bereiten Sie 10% neutrales gepuffertes Formalin (NBF) und PBS mit 10 Einheiten Heparin pro ml vor.
HINWEIS: Die Lösungen sollten eine Temperatur von 4 °C haben. - Gießen Sie jeden Puffer in separate 50-ml-Röhrchen und schließen Sie eine Peristaltikpumpe, die an einen 25-G-Schmetterlingskatheter angeschlossen ist, mit PBS/Heparin-Lösung an und entlüften Sie sie.
- Befestigen Sie die Gliedmaßen mit Klebeband an einer saugfähigen blauen Unterlage und stellen Sie sicher, dass das Tier in Rückenlage auf der Unterlage liegt. Desinfizieren Sie das Fell, um eine Kreuzkontamination der peripheren Organe zu vermeiden, falls diese entnommen werden müssen.
- Öffnen Sie die Bauchhöhle durch einen Querschnitt und legen Sie das Zwerchfell frei.
- Öffnen Sie den Brustkorb durch zwei Schnitte einer chirurgischen Schere entlang der vorderen / hinteren Achse.
- Das Herz freilegen und die Nadel in eine linke Kammer (rechte Seite des Herzens in Rückenlage) einführen und in Schritt 9.1.3 in den Schmetterlingskatheter einführen.
- Machen Sie einen kleinen Schnitt in der rechten Herzkammer, um den Blutabfluss zu ermöglichen.
- Schalten Sie die Peristaltikpumpe ein, um das Blut mit PBS/Heparin auszuspülen.
HINWEIS: Wenn dieser Schritt nicht ausreichend durchgeführt wird, gerinnt das Blut während der Fixierung mit Formalin und verhindert eine angemessene Durchblutung. - Nachdem alles Blut ausgeschwemmt ist und klares PBS aus der rechten Herzkammer austritt, schalten Sie den Einlass einer Peristaltikpumpe auf eine NBF-Lösung um und beginnen Sie mit der Perfusion für 25 ml pro Maus.
- Extrahieren Sie das Gehirn, geben Sie es in mindestens 4 ml NBF und postfixieren Sie es 24 Stunden lang.
- Schneiden Sie das Gehirn mit koronalen Schnitten auf einem Vibratom mit einer Schnittdicke von 50 μm.
- Legen Sie jeden Abschnitt in eine Vertiefung einer 24-Well-Platte, in der die Abschnitte im gesamten Gehirn aufbewahrt werden.
- Bewerten Sie die Expression der chemogenetischen Rezeptoren, die mit fluoreszierenden Proteinen (z. B. mCherry oder mCitrin) fusioniert sind, unter einem Fluoreszenzmikroskop, um die Abschnitte zu identifizieren, die die Expression zeigen, um die Position zu bestätigen. Der Ausdruck ist wahrscheinlich schwach.
- Führen Sie eine Immunfärbung gegen den Fluorophor mit dem folgenden Protokoll durch:
- 3 Schnitte in 0,5 ml Lösung geben, die 10% Serum eines Wirts eines sekundären Antikörpers enthält, und 30 Minuten lang inkubieren.
- Die Schnitte werden in eine Lösung eines Primärantikörpers in einer Verdünnung von 1:250 – 1:1.000 überführt, wobei 1:500 als Ausgangspunkt verwendet wird.
- Inkubieren Sie die Schnitte mit Primärantikörpern über Nacht bei 4 °C in einer Mikrotiterplatte, die mit einem Paraffinfilm versiegelt ist.
- Waschen Sie die Partien mit PBS, 3x für jeweils 5 Minuten.
- 0,5 ml der sekundären Antikörperlösung pro Vertiefung in 10%iges Serum geben.
- 4 h bei Raumtemperatur inkubieren.
- Waschen Sie die Partien mit PBS, 3x für jeweils 5 Minuten.
- Montieren Sie sie auf Objektträger mit einem wässrigen Eindeckmedium, das eine Kernfärbung enthält (z. B. DAPI).
- Beurteilen Sie die Lokalisierung und Ausbreitung mit einem konfokalen Mikroskop, indem Sie einen Kachelscan eines gesamten Abschnitts durchführen.
- Bewerten Sie die Intensität der Expression durch Messung der Fluoreszenzpixelintensität in bestimmten Hirnregionen und vergleichen Sie sie mit einer intrakraniell injizierten Kontrolle.
- Alternativ können Sie den Prozentsatz positiver Neuronen bewerten, indem Sie Zellen zählen, die gegen chemogenetische Rezeptoren gefärbt sind, im Vergleich zu DAPI-positiven Zellen oder zellspezifischen Markern.
- Beurteilen Sie die Gewebeschädigung, indem Sie eine Hämatoxylin-Färbung an einem 50-μm-Schnitt durchführen und eine Bildgebung auf den Verlust von Zellen, die Ansammlung von Zelltrümmern und andere Anzeichen einer groben Schädigung durchführen.
- Um die Spezifität des Zell-Targetings zu bewerten, führen Sie eine Doppelimmunfärbung wie unten beschrieben für den chemogenetischen Rezeptor und einen zellspezifischen Marker durch. Führen Sie dann die Zählung der positiven Zellen wie in Schritt 9.8 durch.
- 3 Schnitte in 0,5 ml einer Lösung geben, die 10 % Serum eines Wirts eines sekundären Antikörpers enthält, und 30 Minuten lang inkubieren.
- Die Schnitte werden in eine Lösung eines Primärantikörpers gegen einen Fluoreszenzmarker eines chemogenetischen Rezeptors in einer Verdünnung von 1:250 – 1:1.000 überführt, wobei 1:500 als Ausgangspunkt verwendet wird. Fügen Sie einen zweiten primären Antikörper von einer anderen Wirtsspezies hinzu, der gegen einen zellspezifischen Marker von Interesse (z. B. CamkIIa) gerichtet ist.
- Inkubieren Sie die Schnitte mit Primärantikörpern über Nacht bei 4 °C in einer Mikrotiterplatte, die mit Paraffinfolie versiegelt ist.
- Waschen Sie die Partien mit PBS, 3x für jeweils 5 Minuten.
- 0,5 ml Sekundärantikörperlösung pro Vertiefung in 10%iges Serum der Wirtsspezies beider Sekundärantikörper geben.
ANMERKUNG: Jeder Antikörper sollte einen eindeutigen Fluorophor aufweisen und gegen Primärantikörper in Schritt 9.10.2 reaktiv sein. - 4 h bei Raumtemperatur inkubieren.
- Waschen Sie die Partien mit PBS, 3x für jeweils 5 Minuten.
- Auf Objektträger montieren und mit einem wässrigen Eindeckmedium fixieren, das eine Kernfärbung enthält.
10. Evaluierung der neuronalen Aktivierung mit Immunfärbung für c-Fos
- Die c-Fos-Färbung gemäß Punkt 9.5 dieses Protokolls ist mit einem c-Fos-Primärantikörper und einem Sekundärantikörper mit einer von der Kernfärbung unterschiedenen Fluoreszenzmarkierung durchzuführen.
- Zählen Sie den Prozentsatz der Zellen, die sowohl für c-Fos als auch für die Kernfärbung in dem Bereich positiv sind, auf den ein chemogenetischer Rezeptor abzielt.
- Analyse des Prozentsatzes von c-Fos-positiven Kernen in einer Gruppe von Mäusen, die chemogenetische Rezeptoren exprimieren und mit einem chemogenetischen Liganden oder einer Vehikelkontrolle behandelt werden, und in einer Gruppe von Wildtyp-Mäusen, die mit einem chemogenetischen Liganden oder einer Vehikelkontrolle behandelt werden.
Ergebnisse
Der erste Schritt bei der Durchführung des ATAC-Protokolls ist die Ausrichtung des FUS-BBBO auf die gewünschten Gehirnregionen. Zum Beispiel wurde der Hippocampus nach dem beschriebenen Protokoll mit FUS-BBBO angegriffen und Kontrastmittel und AAV9-tragende DREADDs in die Mäuse injiziert, gefolgt von einer FLASH-3D-MRT-Sequenz, die Bilder des Mäusegehirns aufnimmt. Eine T1-Signalverstärkung wurde in der Hippocampusregion (Abbildung 6) und in anderen Teilen des Gehirns (Abbildung 7) erreicht. Nach mehreren Wochen wurden DREADDs in der Zielhirnregion exprimiert. Während viele DREADDs mit einem fluoreszierenden Reporter (z.B. mCherry) fusioniert sind, wurde festgestellt, dass der Prozess der Perfusion und Fixierung mit Formaldehyd die Fluoreszenz dieser Proteine drastisch reduziert. Die Immunfärbung gegen mCherry oder den DREADD führte zu einem zuverlässigeren Nachweis der Expression (Abbildung 8) auf der Grundlage früherer Erfahrungen. In früheren Experimenten zeigten ~85% der Mäuse eine Expression nach FUS-BBBO7. Ein einfacher Test für eine ausreichende Expression von DREADDs ist die Prüfung ihrer Funktionalität auf zellulärer Ebene. Dies kann beispielsweise durch die Bereitstellung eines chemogenetischen Liganden oder einer Kochsalzkontrolle, wie CNO 19, Deschloroclozapin28 oder andere29, und das Warten von 2 Stunden vor einer kardialen Perfusion und Fixierung erfolgen. Die Hirnschnitte wurden dann für c-Fos-Protein30, das auf eine erhöhte Aktivität von Neuronen hinweist, und für DREADD co-immungefärbt. Das Experiment wurde als erfolgreich angesehen, wenn die Stelle des Gehirns, die mit DREADDs angegriffen wurde, in der Gruppe, die einen chemogenetischen Liganden erhielt, im Vergleich zu der Gruppe, die Kochsalzlösung7 erhielt, oder im Vergleich zu einer kontralateralen Stelle, die nicht FUS-BBBO ausgesetzt war, eine signifikant höhere Anzahl von neuronalen Kernen aufwies, die c-Fos-positiv waren. Bemerkenswert ist, dass einige dieser Liganden das Potenzial haben, Neuronen unspezifisch zu aktivieren, ohne DREADDs zu exprimieren. Zum Beispiel wurde gezeigt, dass CNO bei Mäusen in niedrige Mengen an Clozapin metabolisiert wird, das die BHS überquert und DREADDs mit hoher Potenz aktiviert27. Es wurde jedoch auch gezeigt, dass es an unspezifischen Stellen bindet. Wie bei jedem Experiment ist es wichtig, alle geeigneten Kontrollen in chemogenetische Studien einzubeziehen31. Eine mögliche Kontrolle ist die Verabreichung des chemogenetischen Liganden an Wildtyp-Mäuse ohne Verfahren, um Effekte des Medikaments allein auf den gewünschten Verhaltens- oder histologischen Assay auszuschließen. Eine weitere Kontrolle könnte der Einschluss von vier Gruppen sein: DREADD + Ligand, DREADD + Vehikel, EGFP + Ligand, EGFP + Vehikel, was mögliche Auswirkungen sowohl der Genübertragung mit FUS-BBBO als auch des chemogenetischen Liganden berücksichtigt.
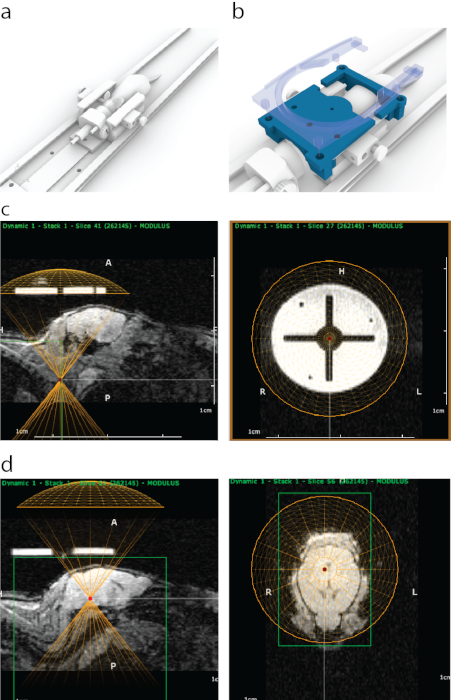
Abbildung 1: Der Prozess des MRT-gesteuerten Targetings von FUS in ATAC. (a) Platzierung der Maus mit Ohrbügeln, einem Nasenkonus und einer Plattform, die in einen MRT-Scanner eingebaut werden kann. (b) Eine 3D-gedruckte Führung (blau), die im MRT sichtbar ist, wurde an den Enden des Ohrbügelrahmens befestigt und dann mit einer Halterung einer Oberflächen-MRT-Spule mit vier Schnappbolzen (halbtransparent blau) befestigt. (c) Erscheinungsbild der 3D-gedruckten Schablone in der sagittalen MRT (linkes Bild), wobei die Unterseite der virtuellen Darstellung eines Schallkopfes (gelber Halbkreis) mit der Unterseite der Schablone ausgerichtet ist. Das rechte Bild zeigt das Erscheinungsbild der 3D-gedruckten Führung im MRT aus der koronalen Ansicht. Der helle Kreis wurde aus einem Polyjet-Trägermaterial hergestellt, das einen starken MRT-Kontrast aufweist. Das Kreuz wurde aus Kunststoff geformt. Ein gelber Kreis stellt die Position des Wandlers dar, die konzentrisch mit der Führung innerhalb eines stereotaktischen Rahmens ausgerichtet wurde. (d) Um Gehirnstrukturen anzuvisieren, wurde ein virtueller Schallkopf in z-Richtung über die Mäuse bewegt, um der Dicke eines Ultraschallkegels / -gehäuses zu entsprechen. In diesem Fall wurde der Wandler aufgrund der Dicke des Wasserbades 8,2 mm über die Führung verschoben, um eine genaue Zielerfassung zu ermöglichen. Die Hirnstrukturen wurden anhand von MRT-Bildgebungsdaten ausgewählt, ihre MRT-Koordinaten wurden dann aufgeschrieben und in die stereotaktische Maschine eingegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
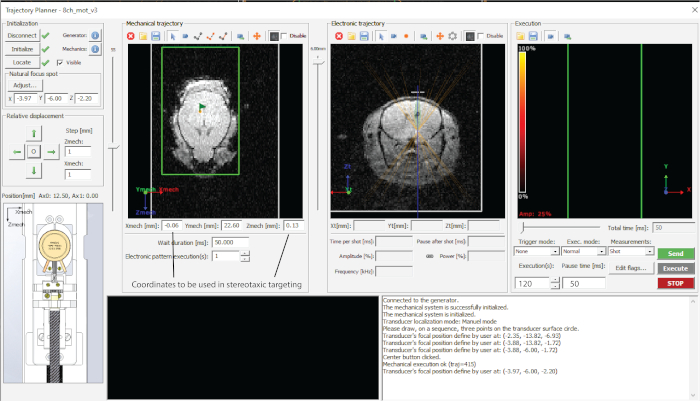
Abbildung 2: Schnittstelle der verwendeten Software. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
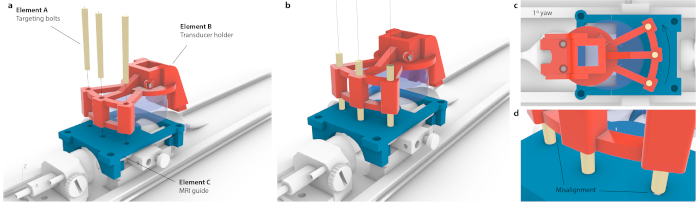
Abbildung 3: Prozess der Anpassung des MRT-Koordinatenraums an das stereotaktische Instrument. (a) Drei Löcher innerhalb eines Schallkopfhalters wurden mit drei Löchern innerhalb der MRT-Führung ausgerichtet, und drei konische Zielschrauben wurden eingesetzt, ohne dass die gesamte Baugruppe durchbiegt wurde. (b) Im Idealfall befinden sich alle drei Schrauben in der Mitte der Löcher. (c) Bei Ungenauigkeiten in der Ausrichtung würden nicht alle drei Schrauben hineinpassen, z. B. bei einer kleinen, wahrscheinlich nicht wahrnehmbaren Gierbewegung von 1° würde nur eine Schraube hineinpassen, während die gegenüberliegenden Schrauben an der MRT-Führung stecken blieben. Alternativ könnte es zu einer sichtbaren Biegung der gesamten Baugruppe kommen, da Schrauben durchgedrückt wurden. (d) Vergrößerte Ansicht der Verschraubung. Die Schrauben sollten konzentrisch platziert werden, um die beste Genauigkeit zu erzielen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
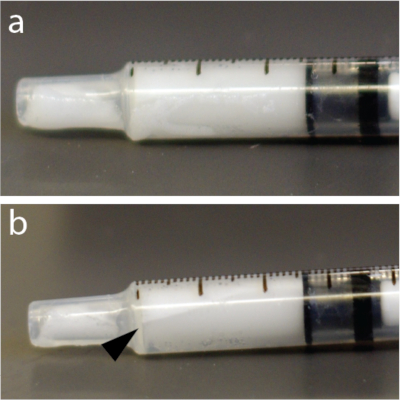
Abbildung 4: Schnelle Umverteilung von Mikrobläschen innerhalb der Spritze. (a) Die Spritze wurde 5 s nach dem Mischen fotografiert. (b) Eine Minute später war eine deutlich sichtbare Schicht zu sehen, die einige der Blasen in der Nähe der Oberseite der 1-ml-Tuberkulinspritze zeigte. In diesem Beispiel wurde insbesondere eine Lösung von Mikrobläschen verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
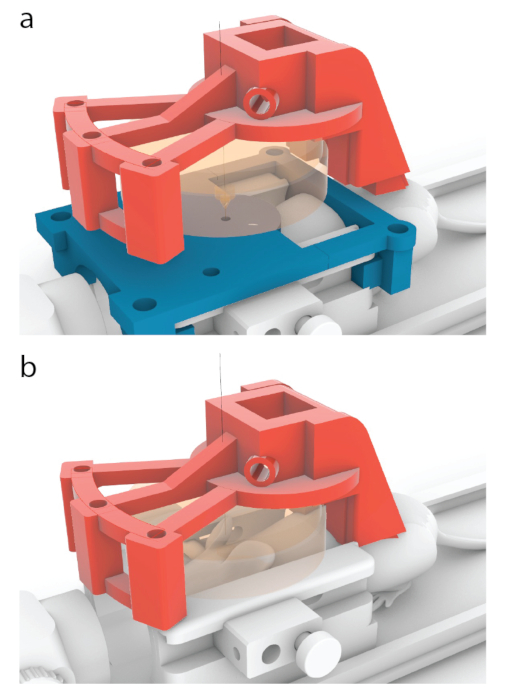
Abbildung 5: Prozess des Platzierens der Mitte eines Schallkopfs über einer Mitte einer MRT-Schablone. (a) Bei den in diesem Artikel gezeigten Modellen ist der rote Träger so konstruiert, dass er sich von der in Abbildung 3b gezeigten Position um 10,56 mm vorwärts zu einer hier gezeigten Position bewegt. (b) Die blaue MRT-Schablone wurde vor der Beschallung entfernt und ein Ultraschallgel wurde zwischen der Maus und dem Schallkopf (orange) aufgetragen, um den Ultraschalldurchgang zu gewährleisten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
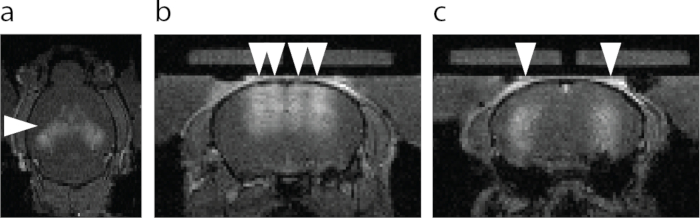
Abbildung 6: MRT-Visualisierung der BHS-Öffnung. a) Axiale Ansicht der BHS-Öffnung. Ein hellerer Bereich, der mit einer Pfeilspitze gekennzeichnet ist, zeigt eine Extravasation eines MRT-T1-Kontrastmittels. (b) Koronale Ansicht des dorsalen Hippocampus und des Kortex oberhalb des Hippocampus mit FUS-BBBO (Pfeilspitzen). (c) Koronale Ansicht des zentralen Hippocampus mit FUS-BBBO (Pfeilspitzen). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Beispiel für das Targeting von 4 Gehirnstellen mit dem in diesem Artikel beschriebenen Drei-Schrauben-Zielsystem. Areale mit Pfeilspitzen zeigten BHS-offene Stellen mit Diffusion eines MRT-Kontrastmittels. Die vier Standorte wurden nacheinander anvisiert, mit ~150 s zwischen jeder BBB-Öffnung, von unten nach oben. Das Bild wurde innerhalb von 2 Minuten nach der letzten BBB-Öffnung aufgenommen. Der Maßstab beträgt 2 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
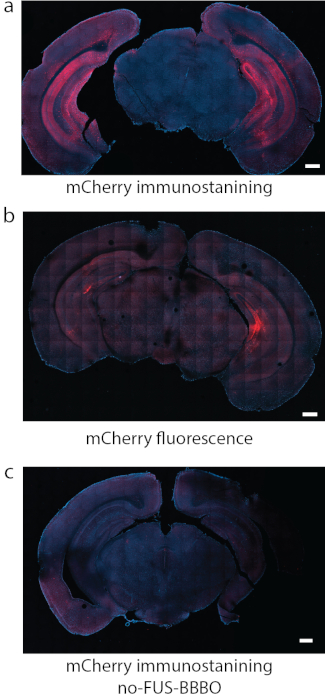
Abbildung 8: Nachweis der DREADD-Expression. (a) Die Immunfärbung für das an DREADDs gebundene Fluorophor, in diesem Fall mCherry, war in einigen Studien eine zuverlässige Nachweismethode. (b) In einem weiteren repräsentativen Abschnitt mit DREADDs, die unter den gleichen Bedingungen wie in (a) auf den Hippocampus gerichtet waren, erzeugte die Fluoreszenz von mCherry allein einen starken Hintergrund und ein relativ schwaches Signal. (c) Als Negativkontrolle wurde eine Maus verwendet, die eine systemische Injektion von AAV erhielt, aber keine FUS-BBBO erhielt. Durch die mCherry-Immunfärbung kann keine signifikante Expression gefunden werden. Maßstabsbalken sind 500 mm. (Daten in a, c adaptiert von7 mit Genehmigungen, Copyright 2020 Nature-Springer). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
ATAC erfordert die erfolgreiche Implementierung mehrerer Techniken für die erfolgreiche Neuromodulation spezifischer neuronaler Schaltkreise, einschließlich präziser MRT-gesteuerter Zielgruppenansprache, FUS-BBBO und histologischer Bewertung der Genexpression. 3D-druckbare Komponenten wurden entwickelt, um das Targeting kleiner Gehirnstrukturen mit bildgebendem FUS-BBBO zu vereinfachen.
Die MRT-gesteuerte Verabreichung von fokussiertem Ultraschall (MRIgFUS) bringt eine Reihe von Herausforderungen mit sich. Erstens hat eine typische MRT-Spule nur begrenzten Platz, der nur für die Aufnahme einer Probe und nicht für die Ultraschall-Hardware ausgelegt ist. Die größeren Bohrungen von MRTs erhöhen die Kosten der Ausrüstung und verringern die Bildqualität, da das Signal mit dem Füllfaktor einer Spule32 zusammenhängt. Folglich beeinträchtigt jede FUS-Hardware, die im MRT auf einem Tierbild platziert wird, die Bildqualität. Zweitens ist die Entwicklung von MRT-kompatiblen Geräten schwierig und teuer. MRT-kompatible Materialien müssen diamagnetisch sein, eine geringe Neigung zur Erzeugung von Wirbelströmen während der Hochfrequenzbefeldung aufweisen und eine geringe magnetische Suszeptibilität bei hohen Magnetfeldern aufweisen. In jedem leitfähigen Material wirkt sich die Erzeugung von Wirbelströmen oder seine magnetische Suszeptibilität ebenfalls negativ auf die Bildqualität aus. Schließlich haben die verfügbaren MRT-kompatiblen Materialien einen niedrigeren Elastizitätsmodul und eine geringere Haltbarkeit als die Metalle, die typischerweise bei der Herstellung von präzisen Zielmaschinen verwendet werden, z. B. stereotaktische Rahmen. Die Motoren, die für die Positionsanpassung verwendet werden, müssen aufgrund ihrer Größe MRT-kompatibel sein und außerhalb der MRT-Bohrung platziert werden. Diese Motoren müssen mit MRT-kompatiblen Materialien in einiger Entfernung mit dem Schallkopf in einer MRT-Bohrung verbunden werden. Probleme mit dem Verziehen von Kunststoffen, der Mangel an ausreichendem Platz in der Bohrung, um Komponenten mit robuster Größe zu implementieren, und unzureichender Platz für wechselnde Zielpositionen im gesamten Gehirn haben die Zielgenauigkeit in früheren Arbeiten beeinträchtigt.
Um diese Probleme zu lösen, wurde die Entscheidung getroffen, die Bildgebung in der MRT und die FUS-BBBO-Verabreichung außerhalb des Scanners durchzuführen. Um eine MRT-Kontrolle zu ermöglichen, wurden die Mäuse in eine 3D-gedruckte Fessel gelegt, die über eine MRT-sichtbare Zielführung verfügte, mit der die Gehirnstrukturen der Maus sowohl im MRT als auch im stereotaxen Koordinatenraum lokalisiert werden konnten. Da sowohl der Mäuseschädel als auch die Zielführung fest mit den Ohrstangenhaltern verbunden sind (Abbildung 1a,b), kann eine Zielführung verwendet werden, um räumliche Koordinaten im MRT-Bild zu korrelieren und die stereotaktischen Instrumente auf Null zu stellen. Die Halterung hat keine beweglichen Teile und enthält keinen Wandler, was es uns ermöglichte, sie sowohl robust als auch klein genug zu machen, um in ein MRT zu passen, und Signalstörungen von der Elektronik des Wandlers zu entfernen. Der Raum im Inneren der Zielschablone wurde ausgehöhlt, da die 3D-gedruckte Stütze für einige Materialien im MRT sichtbar ist (Abbildung 1c). Es wurden Löcher in die Baugruppe eingebracht, um eine Stereotax-Kalibrierung zu ermöglichen (Abbildung 3). Der Ultraschallwandler wurde an einem Elektrodenhalter einer Stereotaxe befestigt, und das Targeting wurde wie in Abschnitt 4 beschrieben (Abbildung 1d) durchgeführt. Der Schallkopf sollte über seine gesamte Länge durch ein Gehäuse von Ohrbügeln gestützt werden, um eine Abweichung von der waagerechten Ebene zu vermeiden. Das Targeting in dorso-ventraler Richtung kann durch Phasenverschiebungen in einem ringförmigen Array erreicht werden.
Die praktische Zielgenauigkeit wird durch Ultraschallfokussierung und Schädeldämpfung bestimmt. Das FUS-BBBO-Verfahren wurde für Ratten 11 detailliert beschrieben und in einer Reihe anderer Modellorganismen23,33,34 und beim Menschen 16,17 implementiert. Das Verhältnis zwischen der Größe des Ultraschallfokus ist umgekehrt proportional zur Frequenz, wobei höhere Frequenzen zu einer präziseren Abgabe führen können. Die Dämpfung des Schädels nimmt jedoch mit Frequenzen35 zu, was zu einer Schädelerwärmung und einer Schädigung der kortikalen Bereiche führen kann. Die genaue Targeting-Strategie hängt von der Gehirnstelle ab. Die Stellen, an denen ein halber Maximaldruck in voller Breite in das Hirngewebe passt, ermöglichen eine vorhersagbare und sichere BHS-Öffnung in vielen Gehirnstrukturen wie dem Striatum, dem Mittelhirn und dem Hippocampus. Regionen in der Nähe der Basis des Gehirns stellen bei Mäusen eine besondere Herausforderung dar. Das Mäusegehirn misst ca. 8-10 mm in dorso-ventraler Richtung, was vergleichbar ist mit der halben Maximalgröße vieler kommerziell erhältlicher Schallköpfe in voller Breite. Folglich kann das Zielen auf die Unterseite des Schädels zu einer Ultraschallreflexion von den Knochen und der Luft in den Gehörgängen, dem Mund oder der Luftröhre führen, was zu unvorhersehbaren Mustern von hohem und niedrigem Druck führen kann36. Einige dieser Drücke können eine Trägheitskavitationsschwelle überschreiten, die nachweislich Blutungen und Gewebeschäden verursacht37. Um Regionen anzuvisieren, die sich in der Nähe der Schädelbasis befinden, kann es bevorzugt sein, intersektionale ATAC7 zu verwenden, wobei intersektionale Genetik38 verwendet wird, um die Genexpression auf einen kleineren Bereich zu beschränken als den, der mit dem FUS-Strahl anvisiert wird. In dem veröffentlichten Beispiel eines intersektionalen ATAC wurde ein transgenes Tier, das ein Gen-Editing-Enzym (Cre38) in dopaminergen Zellen exprimiert, mit Ultraschall in der Untersektion der Region mit dopaminergen Zellen anvisiert. Schließlich können die kortikalen Regionen mit FUS angegriffen werden, aber die Beugung und Reflexion von Ultraschall kann zu ungleichmäßigen Druckprofilen führen. Dieses Protokoll deckt nicht die Ausrichtung auf kortikale Regionen ab, da dies stark von der verwendeten Art abhängt. Es wurde jedoch ein gewisses Targeting des Kortex oberhalb des Hippocampus 7 beobachtet (z. B. Abbildung 7), was darauf hindeutet, dass dies zumindest bei Mäusen möglich ist.
Die Wahl eines chemogenetischen Aktivators und die Dosierung hängen von den spezifischen experimentellen Anforderungen ab. Eine Reihe von Studien, darunter eine der Studien der Autoren7, zeigten kein signifikantes unspezifisches Ansprechen39,40, während höhere Dosen (z. B. 10 mg/kg) zumindest in einigen Fällen Nebenwirkungen hervorrufen können41. Wie bei allen Verhaltensexperimenten sind jedoch geeignete Kontrollen31 aufgrund einer möglichen Off-Target-Aktivität von CNO und seinen Metaboliten42 unerlässlich. Solche Kontrollen könnten die Verabreichung von CNO und Kochsalzkontrollen an Tiere, die DREADDs exprimieren, und die Verabreichung von CNO an Wildtyp-Tiere oder in einigen spezifischen Fällen einen Vergleich von ipsi- und kontralateralen Stellen des Gehirns umfassen, die chemogenetische Rezeptoren exprimieren bzw. nicht. Darüber hinaus ergaben neuere Forschungen eine Reihe neuer DREADD-Agonisten mit verbesserter Spezifität28,29,43. Andere chemogenetische Rezeptoren 5,25,44 können auch in Verbindung mit dem ATAC-Verfahren verwendet werden.
Die histologische Beurteilung der Genexpression ist für jedes Tier post mortem notwendig. Ein kleiner Teil der Tiere zeigt eine schlechte Genexpression nach FUS-BBBO7. Darüber hinaus ist es notwendig, die räumliche Genauigkeit und Spezifität der Genexpression zu zeigen, da ein falsches Targeting möglich ist. Bemerkenswert ist, dass einige AAVs eine retrograde oder anterograde Tracing-Fähigkeit aufweisen können45 und trotz genauer Ultraschall-Targeting eine Transfektion weit entfernt von der mit Ultraschall anvisierten Stelle verursachen können. Wenn der exprimierte chemogenetische Rezeptor mit einem Fluorophor fusioniert ist oder ein Fluorophor mitexprimiert, kann die Bildgebung des Fluorophors in Gewebeschnitten ausreichen, um die Lokalisation und Intensität der Expression zu beurteilen. Viele fluoreszierende Proteine werden jedoch durch den Gewebefixierungsprozess geschädigt, und die Immunfärbung für das mCherry-Protein, das häufig mit DREADDs verwendet wird, lieferte in früheren Studien ein besseres Signal7. Schließlich kann aufgrund der Dichte von Neuronen in bestimmten Teilen des Gehirns (z. B. körnige Zellschicht im Hippocampus) die Verwendung von nudeutlich lokalisierten Fluorophoren, die unter IRES exprimiert werden, im Gegensatz zu Fusionen zur Durchführung von Zellzählungen von Vorteil sein, da Kerne leicht segmentiert und mit Kernfärbungen wie DAPI oder TO-PRO-3 gegengefärbt werden können. Um die Neuromodulation durch c-Fos-Färbung zu bewerten, ist es unerlässlich, eine nukleäre Gegenfärbung durchzuführen und c-Fos-positive Kerne anstelle eines Fluoreszenzsignals zu zählen. In einigen Fällen können Zelltrümmer Fluoreszenz zeigen und die Messungen positiver Zellen verfälschen.
Zu den Einschränkungen der Arzneimittel- und Genverabreichung mit FUS-BBBO gehören eine geringere Auflösung als bei invasiven intrakraniellen Injektionen und die Notwendigkeit größerer Mengen injizierter Medikamente oder viraler Vektoren. Während eine direkte Injektion in das Gehirn zu einer ausschließlichen Verabreichung an eine injizierte Stelle führt, verwendet FUS-BBBO einen intravenösen Weg, der zu einer möglichen Verabreichung an periphere Gewebe führt. Zu den Einschränkungen der Verwendung der Chemogenetik für die Neuromodulation gehört eine langsame Zeitskala, die für einige Verhaltensprotokolle, die schnelle Änderungen der Intensität der Neuromodulation erfordern, unzureichend sein kann.
Offenlegungen
Kein Interessenkonflikt.
Danksagungen
Diese Forschung wurde von der Brain and Behavior Foundation, NARSAD Young Investigator Award, unterstützt. Mehrere 3D-gedruckte Komponenten wurden ursprünglich von Fabien Rabusseau (Image Guided Therapy, Frankreich) entworfen. Der Autor bedankt sich bei John Heath (Caltech) und Margaret Swift (Caltech) für die technische Hilfe bei der Erstellung des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| 21-gauge needles (BD) | Fisher Scientific | 14826C | |
| 25-gauge butterfly catheter | Harvard Bioscience | 725966 | |
| 30-gauge needles (BD) | Fisher Scientific | 14826F | |
| Absorbent blue pad | Office Depot | 902406 | |
| Anti-c-Fos antibody | Santa Cruz Biotechnology | SC-253-G | |
| Anti-mCherry antibody | Thermofisher | PA534974 | |
| Bruker Biospec 70/30 | Bruker | custom | includes the RF coils |
| Clozapine-n-oxide | Tocris | 4936 | |
| Custom designed 3D printed mouse harnesses and MRIgFUS targeting components | ImageGuidedTherapy, Szablowski lab | custom | download from szablowskilab.org/downloads |
| Custom MRIgFUS machine | ImageGuidedTherapy | N/A | |
| Definity microbubbles | Lantheus | DE4 | |
| Degassed aquasonic/ultrasound gel | Fisher Scientific | 5067714 | |
| Depilation crème | Nair | n/a | |
| Eight-element annular array transducer | Imasonic Inc. | custom | |
| Ethanol Pads/Alcohol Swabs (70%) (BD) | Office Depot | 599893 | |
| Heparin | Sigma-Aldrich | H3149-25KU | |
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Ketamine | Patterson Veterinary | 07-890-8598 | |
| Neutral buffered formalin (10%) | Sigma-Aldrich | HT501128-4L | |
| Optical fiber hydrophone | Precision Acoustics | ||
| PE10 tubing | Fisher Scientific | NC1513314 | |
| Peristaltic pump | |||
| Phosphate-buffered saline (PBS) | Sigma-Aldrich | 524650-1EA | |
| Prohance contrast agent | Bracco | 0270-1111-04 | |
| Saline | Fisher Scientific | NC9054335 | |
| Secondary antibody, Donkey-anti goat | ThermoFisher | A-11055 | |
| Secondary antibody, Donkey-anti rabbit | ThermoFisher | 84546 | |
| Surgical scissors (straight) | Fisher Scientific | 17467480 | |
| ThermoGuide Software | ImageGuidedTherapy | ||
| Tissue glue (Gluture) | Fisher Scientific | NC9855218 | |
| Tuberculin Syringe (1 mL) (BD) | Fisher Scientific | 14823434 | |
| VeroClear 3D printable material | Stratasys | RGD810 | |
| Vialmix microbubble activation device | Lantheus | VMIX | |
| Vibrating microtome | Compresstome | VF-300 | |
| Xylazine | Sigma-Aldrich | X1251-1G |
Referenzen
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
- Zhang, F., Wang, L. -P., Boyden, E. S., Deisseroth, K. Channelrhodopsin-2 and optical control of excitable cells. Nature Methods. 3, 785-792 (2006).
- Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Roth, B. L. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proceedings of the National Academy of Sciences. 104, 5163-5168 (2007).
- Lerchner, W., et al. Reversible silencing of neuronal excitability in behaving mice by a genetically targeted, ivermectin-gated Cl- channel. Neuron. 54, 35-49 (2007).
- Magnus, C. J., et al. Chemical and genetic engineering of selective ion channel-ligand interactions. Science. 333, 1292-1296 (2011).
- Deeb, W., et al. Proceedings of the fourth annual deep brain stimulation think tank: a review of emerging issues and technologies. Frontiers in Integrative Neuroscience. 10, 38(2016).
- Szablowski, J. O., Lee-Gosselin, A., Lue, B., Malounda, D., Shapiro, M. G. Acoustically targeted chemogenetics for the non-invasive control of neural circuits. Nature Biomedical Engineering. 2, 475-484 (2018).
- Elias, W. J., et al. A pilot study of focused ultrasound thalamotomy for essential tremor. New England Journal of Medicine. 369, 640-648 (2013).
- Burgess, A., Hynynen, K. Noninvasive and targeted drug delivery to the brain using focused ultrasound. ACS Chemical Neuroscience. 4, 519-526 (2013).
- Kinoshita, M., McDannold, N., Jolesz, F. A., Hynynen, K. Noninvasive localized delivery of Herceptin to the mouse brain by MRI-guided focused ultrasound-induced blood-brain barrier disruption. Proceedings of the National Academy of Sciences U. S. A. 103, 11719-11723 (2006).
- Samiotaki, G., Acosta, C., Wang, S., Konofagou, E. E. Enhanced delivery and bioactivity of the neurturin neurotrophic factor through focused ultrasound-mediated blood-brain barrier opening in vivo. Journal of Cerebral Blood Flow & Metabolism. 35, 611-622 (2015).
- O'Reilly, M. A., Waspe, A. C., Chopra, R., Hynynen, K. MRI-guided disruption of the blood-brain barrier using transcranial focused ultrasound in a rat model. Journal of Visualized Experiments. (61), e3555(2012).
- Thévenot, E., et al. Targeted delivery of self-complementary adeno-associated virus serotype 9 to the brain, using magnetic resonance imaging-guided focused ultrasound. Human gene Therapy. 23, 1144-1155 (2012).
- Hsu, P. -H., et al. Noninvasive and targeted gene delivery into the brain using microbubble-facilitated focused ultrasound. PloS One. 8, 58682(2013).
- Wang, S., Olumolade, O. O., Sun, T., Samiotaki, G., Konofagou, E. E. Noninvasive, neuron-specific gene therapy can be facilitated by focused ultrasound and recombinant adeno-associated virus. Gene Therapy. 22, 104(2015).
- Downs, M. E., et al. Long-Term Safety of Repeated Blood-Brain Barrier Opening via Focused Ultrasound with Microbubbles in Non-Human Primates Performing a Cognitive Task. PLoS One. 10, 0125911(2015).
- Lipsman, N., et al. Blood-brain barrier opening in Alzheimer's disease using MR-guided focused ultrasound. Nature Communications. 9, 2336(2018).
- Carpentier, A., et al. Clinical trial of blood-brain barrier disruption by pulsed ultrasound. Science Translational Medicine. 8, 343(2016).
- Sternson, S. M., Roth, B. L. Chemogenetic Tools to Interrogate Brain Functions. Annual Reviews Neurosciences. 37, 387-407 (2014).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63, 27-39 (2009).
- Zhu, H., et al. Chemogenetic inactivation of ventral hippocampal glutamatergic neurons disrupts consolidation of contextual fear memory. Neuropsychopharmacology. 39, 1880-1892 (2014).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Noninvasive, transcranial and localized opening of the blood-brain barrier using focused ultrasound in mice. Ultrasound in Medicine & Biology. 33, 95-104 (2007).
- Thévenot, E., et al. Targeted delivery of self-complementary adeno-associated virus serotype 9 to the brain, using magnetic resonance imaging-guided focused ultrasound. Human Gene Therapy. 23, 1144-1155 (2012).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220, 640-646 (2001).
- Yang, F. -Y., Fu, W. -M., Chen, W. -S., Yeh, W. -L., Lin, W. -L. Quantitative evaluation of the use of microbubbles with transcranial focused ultrasound on blood-brain-barrier disruption. Ultrasonics Sonochemistry. 15, 636-643 (2008).
- Vardy, E., et al. A New DREADD Facilitates the Multiplexed Chemogenetic Interrogation of Behavior. Neuron. 86, 936-946 (2015).
- Thompson, K. J., et al. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. ACS Pharmacology and Translational Sciences. 1, 61-72 (2018).
- Gomez, J. L., et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357, 503-507 (2017).
- Nagai, Y., et al. Deschloroclozapine: a potent and selective chemogenetic actuator enables rapid neuronal and behavioral modulations in mice and monkeys. bioRxiv. , 854513(2019).
- Thompson, K. J., et al. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. ACS Pharmacology and Translational Science. 1, 61-72 (2018).
- Bullitt, E. Expression of c-fos-like protein as a marker for neuronal activity following noxious stimulation in the rat. Journal of Comparative Neurology. 296, 517-530 (1990).
- Mahler, S. V., Aston-Jones, G. CNO Evil? Considerations for the use of DREADDs in behavioral neuroscience. Neuropsychopharmacology. 43, 934(2018).
- Gruber, B., Froeling, M., Leiner, T., Klomp, D. W. J. RF coils: A practical guide for nonphysicists. Journal of Magnetic Resonance Imaging. 48, 590-604 (2018).
- Treat, L. H., McDannold, N., Vykhodtseva, N., Hynynen, K. Transcranial MRI-guided focused ultrasound-induced blood-brain barrier opening in rats. IEEE. 2, 998-1000 (2004).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Feasibility of transcranial, localized drug-delivery in the brain of Alzheimer's-model mice using focused ultrasound. IEEE. 2, 988-991 (2005).
- Cobbold, R. S. Foundations of Biomedical ultrasound. , Oxford university press. (2006).
- Younan, Y., et al. Influence of the pressure field distribution in transcranial ultrasonic neurostimulation. Medical Physics. 40, 082902(2013).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Targeted disruption of the blood-brain barrier with focused ultrasound: association with cavitation activity. Physics in Medicine and Biology. 51, 793-807 (2006).
- Branda, C. S., Dymecki, S. M. Talking about a Revolution: The Impact of Site-Specific Recombinases on Genetic Analyses in Mice. Developmental Cell. 6, 7-28 (2004).
- Jendryka, M., et al. Pharmacokinetic and pharmacodynamic actions of clozapine-N-oxide, clozapine, and compound 21 in DREADD-based chemogenetics in mice. Scientific Reports. 9, 4522(2019).
- Manvich, D. F., et al. The DREADD agonist clozapine N-oxide (CNO) is reverse-metabolized to clozapine and produces clozapine-like interoceptive stimulus effects in rats and mice. Scientific Reports. 8, 3840(2018).
- Martinez, V. K., et al. Off-Target Effects of Clozapine-N-Oxide on the Chemosensory Reflex Are Masked by High Stress Levels. Frontiers in Physiology. 10, 521(2019).
- Gomez, J. L., et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357, 503-507 (2017).
- Bonaventura, J., et al. High-potency ligands for DREADD imaging and activation in rodents and monkeys. Nature Communications. 10, 1-12 (2019).
- Roth, B. L. DREADDs for Neuroscientists. Neuron. 89, 683-694 (2016).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of Transduction Efficiency, Tropism and Axonal Transport of AAV Serotypes 1, 2, 5, 6, 8 and 9 in the Mouse Brain. PLoS One. 8, 76310(2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten