Method Article
脳構造を標的とし、化学遺伝学的神経調節を評価するための集束超音波誘発血液脳関門開口部
要約
このプロトコルは、集束超音波血液脳関門(BBB)の開口部、結果として生じる遺伝子発現の評価、および組織学的検査による化学遺伝学的受容体の神経調節活性の測定による遺伝子送達に必要なステップを描写します。
要約
音響標的化学遺伝学(ATAC)は、特定の神経回路の非侵襲的制御を可能にします。ATACは、集束超音波(FUS)誘導血液脳関門開口(FUS-BBBO)、アデノ随伴ウイルス(AAV)ベクターによる遺伝子送達、および操作された化学遺伝学的タンパク質受容体およびそれらの同族リガンドによる細胞シグナル伝達の活性化の組み合わせによって、このような制御を実現します。ATACでは、単一の非侵襲的超音波アプリケーションを使用して、大脳領域と小脳領域の両方をミリメートルの精度でトランスデューシングすることが可能です。この形質導入は、後に、薬物を用いて自由に動く動物において、長期の、非侵襲的な、装置なしの神経調節を可能にすることができる。FUS-BBBO、AAV、および化学遺伝学は複数の動物で使用されてきたため、ATACは他の動物種での使用にもスケーラブルである必要があります。この論文では、以前に公開されたプロトコルを拡張し、複雑なMRI互換のFUSデバイスを必要とせずに、MRIガイダンスを使用してFUS-BBBOを使用して小さな脳領域への遺伝子送達を最適化する方法を概説します。このプロトコルでは、任意のラボで3Dプリントでき、さまざまな種やカスタム機器に合わせて簡単に変更できるマウスターゲティングおよび拘束コンポーネントの設計についても説明しています。再現性を高めるために、プロトコルでは、マイクロバブル、AAV、および静脈穿刺がATAC開発でどのように使用されたかを詳細に説明しています。最後に、ATACを利用した研究の予備調査を導くために、データの例が示されています。
概要
光遺伝学1,2や化学遺伝学3,4,5などの回路特異的な神経調節技術の使用は、神経回路障害としての精神状態についての理解を深めました。神経回路は、通常、特定の細胞型、脳領域、分子シグナル伝達経路、および活性化のタイミングによって定義されるため、研究が難しく、脳障害の治療において制御がさらに困難です。理想的には、研究と臨床アプリケーションの両方にとって、そのような制御は非侵襲的に発揮されますが、正確で非侵襲的な神経調節の両方を達成することは困難です。例えば、神経活性薬は非侵襲的に脳に到達することができますが、脳全体に作用することによって空間特異性を欠いています。一方、脳深部電気刺激療法は、特定の脳領域を制御することはできますが、特定の細胞型を制御することが難しく、手術とデバイスの配置が必要です6。
音響標的化学遺伝学7(ATAC)は、空間的、細胞型的、および時間的特異性を備えた神経調節を提供します。これは、空間ターゲティングのための集束超音波誘発血液脳関門開口(FUS-BBBO)、細胞型特異的プロモーターの制御下で遺伝子を非侵襲的に送達するためのアデノ随伴ウイルスベクター(AAV)の使用、および薬物投与を介してトランスフェクトされた神経回路を選択的に調節するための操作された化学遺伝学的受容体の3つの技術を組み合わせたものです。FUSはFDA承認の技術であり、人間の脳を含む組織の深部にミリメートルの空間精度で焦点を合わせる超音波の能力を利用しています。高出力では、FUSは本態性振戦8に対するFDA承認の治療を含む非侵襲的標的アブレーションに使用されます。FUS-BBBOは、低強度超音波と全身投与されたマイクロバブルを組み合わせて、超音波焦点で血管内で振動し、BBB9の局所的で一時的な(6-24時間)および可逆的な開口部をもたらします。この開口部は、げっ歯類10および非ヒト霊長類15において著しい組織損傷なしに、タンパク質9、10、小分子11、およびウイルスベクター7、12、13、14の脳への送達を可能にする。FUS-BBBO16,17の臨床試験が進行中であり、この技術の治療応用の可能性を示しています。
AAVを使用したウイルス遺伝子送達も、最近のFDAおよびEUの規制当局の承認が主要なマイルストーンとして、CNS疾患の臨床使用に急速に進んでいます。最後に、デザイナードラッグによって排他的に活性化されるデザイナー受容体(DREADD)などの化学遺伝学的受容体18は、トランスジェニックまたはトランスフェクトされた動物におけるニューロン興奮に対する薬理学的制御を提供するために神経科学者によって広く使用されています19,20。DREADDは、内因性リガンドではなく合成化学遺伝学的分子に応答するように遺伝子操作されたGタンパク質共役型受容体(GPCR)であり、これらのリガンドを全身投与すると、DREADD発現ニューロンの興奮性が増加または低下します。これら3つの技術をATACに組み合わせると、空間的、細胞型、時間的精度で選択された神経回路の非侵襲的変調に使用できます。
ここでは、単純な3Dプリントされたターゲティング装置を使用して、マウスのFUS-BBBOで脳領域を正確にターゲティングするための方法論を含めることにより、FUS-BBBO11 の以前に公開されたプロトコルを拡張および更新します。また、FUS-BBBOのATACへの応用についても紹介する。化学遺伝学的受容体を有するAAVの送達に必要なステップ、および組織学による遺伝子発現および神経調節の評価を示す。この技術は、遺伝子発現または神経調節のために大きなまたは複数の脳領域を標的とする場合に特に適用可能である。例えば、皮質の広い領域は、FUS-BBBOで容易に形質導入され、化学遺伝学を用いて調節され得る。しかしながら、代替技術である頭蓋内注射による遺伝子送達は、多数の侵襲的注射および開頭を必要とするであろう。FUS-BBBOとそのアプリケーションであるATACは、脳領域が大きく、侵襲的に標的とするのが難しいさまざまなサイズの動物にスケーリングできます。
プロトコル
すべての実験は、カリフォルニア工科大学の施設動物管理および使用委員会によって承認されたプロトコルの下で実施され、データは最初にJ.O.Sによって取得されました。
1.動物用ハーネスと画像誘導ハードウェアの設計と3D印刷
- Szablowskiラボのウェブサイトにあるファイルを使用してください:コンポーネントの3Dプリント https://www.szablowskilab.org/downloads 。
- 印刷物がMRIでの感受性が低いが、MRIで可視のサポートがあることを確認してください。材料・試薬の項で使用した材料の詳細はこちらをご覧ください。
- 材料を繰り返しテストし、補強が必要な摩耗部位を観察することにより、複数の用途による材料の劣化を説明します。印刷された壁の厚さが少なくとも2mmであることを確認してください。
- 高精度の3Dプリンターを使用して、ターゲティングの精度を向上させます。
- 重力やその他の力に対抗して、プラスチック3Dプリントされたコンポーネントの長さに沿ってコンポーネントをサポートし、曲がりが観察された場合は3Dプリントされた壁の厚さを増やすことにより、プラスチック3Dプリントコンポーネントの偏差を回避します。
- 前/後、内側/外側、背側/腹側、ヨー、ピッチ、傾斜を含む複数の軸の精度を考慮します。
- FUS-BBBOを実行し、ターゲット位置からの偏差を記録することにより、ターゲティングの精度をテストします。
- 電動定位固定装置を使用する場合は、FUS-BBBOターゲティング手順をビデオに記録して材料の弾性に対する動的運動の影響を評価し、3Dプリントされた材料の壁を厚くして偏差を修正します。
2.超音波システムの説明
- 8素子環状アレイ探触子(直径= 25 mm、自然焦点= 20 mm、開口部(F)= 0.8)を備えた超音波システムを使用し、剃ったマウスの頭部にゲルを塗布して、脱気した超音波ゲルでハウジングを頭部に結合します。
注:以前の研究7で使用したトランスデューサの中心周波数は1.5MHz、パルス持続時間は10ms、パルス繰り返し周波数は120秒で1Hzでした。圧力は光ファイバハイドロフォンを使用して較正され、0.36〜0.45MPaの間に維持されました。1.5 MHz および頭頂骨の頭蓋骨21 を通る 18% の音響減衰を想定します。安全なBBB開封およびAAV送達に適した条件の範囲は、他の場所で詳細に説明されている7、14、22。
3.動物の準備
- イソフルラン吸入を使用して1匹のマウスを医療グレードの空気で2%で麻酔します。タッチピンチで麻酔の深さを確認し、反応がないことを確認します。次に、軟膏チューブの交差汚染を防ぐために、使い捨ての滅菌qチップを使用して角膜の乾燥を防ぐために眼科用軟膏を塗布します。
注意: FUS-BBBOの一般的な手順は30分から2時間の範囲であり、麻酔は全体を通して維持する必要があります。 - マウスを麻酔した後、清潔なカテーテルをヘパリン化生理食塩水(10 U / ml)で洗浄します。
注意: 25〜35 gのマウスに適したカテーテルには、30 Gの針とPE10チューブがあります。 - 続いてマウステールを70%エタノールパッドで消毒する。尾静脈カテーテルを外側尾静脈に配置し、組織接着剤で固定します。尾静脈からカテーテルへの血液の逆流を観察して、その配置を確認します。
- マウスの頭を剃り、組織の接着剤が乾いたら脱毛クリームを使用して、共鳴中に気泡が超音波ゲルの下に閉じ込められる可能性を減らします。
- マウスを3DプリントされたMRIキャリッジに置き、前歯をバイトバーに取り付け、頭をノーズコーンの内側に置きます(図1a)。
- 鈍いイヤーバーに接触する部位に最大10μLのリドカインを皮下注射します。.次に、鈍いバーを頭蓋骨に固定し、呼吸を妨げるため気管に圧力をかけないように注意しながら、安全な量の圧力をかけます。30秒間呼吸を観察して、動物が1 / sの速度で自由に呼吸していることを確認します。
- ターゲティングガイドをイヤーバーに接続し、手順3.6(図1b)のように呼吸をチェックし、手順全体を通して毎分呼吸を視覚的に監視し続けます。呼吸数が1 / sを超えて上昇することは、麻酔喪失の兆候の1つです。.マウスがMRIスキャナーにいないとき、または呼吸数が1 / sを超えて上昇しているときは、5分ごとにつま先をつまむ反応を監視し続けます。
- MRIキャリッジをMRIホルダーに移し、次に磁石の穴の内側に移します。
注:ハードウェアの設計は、7T MRI内の72mmコイル用に最適化されています。 - MRIシーケンスを取得して、スキャナー内のマウスの位置を特定します。
- 3D高速ローアングルショット(FLASH)シーケンスを選択し、機器メーカーの特定の指示に従って、次のパラメーターを使用して脳全体を取得します。エコー時間: 3.9 ms, 繰り返し時間: 15 ms, 励起パルス角: 15°, マトリックスサイズ: 130 x 130 x 114, 分解能: 350 x 200 x 200 μm/ボクセル, 平均: 1, 取得時間: 3 分 42 秒
- MRIシステムからFUSシステムを制御するコンピュータにファイルを転送します。
- ソフトウェアでイメージングシーケンスを開き、MRIガイドターゲティングを実行すると、 図1cのように画像が表示されます。
4. MRIガイドによるターゲティング
注:カスタム設計のターゲティングガイドを使用すると、超音波トランスデューサをMRI内に配置する必要はなく、ブレグマ線とラムダラインのステレオタックスをゼロにしてターゲティングを実行するために皮膚を切開する必要もありません。以下の手順に従って、ターゲティングプロセスを実行します。
- キャリッジを固定装置内に置きます。両面テープ付きの金属ブロックを使用し、キャリッジを定位固定装置の2つの支柱に押し付けて、所定の位置に固定します。
- データマネージャーでファイルを選択し、右クリックしてメニューオプションを表示し、[すぐに転送]を選択して、実行中のFUSガイダンスソフトウェアを備えたコンピューターにMRI画像を転送します。
- FUSガイダンスソフトウェアを開き、[シーケンスを開く]をクリックして画像をロードし、イメージングシーケンスのすべてのファイルをロードします。
- 右クリックして[再フォーマット]を押して、画像を3つの軸に再フォーマットします。
- 右クリックして、探触子を円形のターゲティングガイド(図1c)に位置付けます。
- 矢状表示では、仮想探触子の垂直位置を調整して、ウォーターバスと探触子ハウジングの厚さを考慮します(この場合、8.2 mm上向き、 図1d)。
- トラジェクトリプランナーでターゲットとする領域をポイントし、スプレッドシート(この場合は、 図1dのように中脳)の座標をメモします。
- 目的のターゲット深度(電子軌道のZ値(図2))をダイヤルし、スプレッドシートの座標をメモします。
- 「軌道を送信」と「実行」を押して、各ポイントをターゲットにします(図2)。
注意: これは、マウスキャリアがモーターの内側に配置されているときに行われます。ただし、定位固定装置でも同じターゲティングを高精度で達成できます。 - MRIの座標を定位固定装置フレームと相関させるには、カスタムマウントの探触子を照準ガイドの上に置き、3本の照準ボルト(図3、要素A)のそれぞれが探触子ホルダー(図3、要素B)と照準ガイド(図3、要素C)の両方を通過できるまで平行移動します。ボルトに張力がかかったり傾いたりしていないことを確認します。
- 探触子を前後方向に10.56 mm前方に移動し、MRIでターゲティングガイドの中心が表示されるのと同じ場所に配置されます。
- 仮想トランスデューサの中心(図3a、素子A)からターゲット領域(図3a、素子B)までの距離を決定し、脳定位固定装置フレームを使用してトランスデューサをこれらの座標に移動します。
- 注射液の調製に進みます。
5.注射液の調製
注:マイクロバブル溶液は圧力に非常に敏感です。その結果、細い針からの激しい混合または急速な注入は、マイクロバブルを崩壊させ、BBB開口部の有効性を低下させる可能性があります。さらに、マイクロバブルは水よりも軽く、自動注射器などのチューブ、カテーテル、またはシリンジの上部に浮かぶ可能性があります(図4)。毎回の注入の直前にマイクロバブル溶液を再懸濁することを強くお勧めします。
- シリンジを使用して0.8 mLの生理食塩水を1.5 mLチューブに引き出します。
- シリンジを使用して、同じ1.5 mLチューブに0.1 mLのMRI造影剤を加えて混合します。
- 活性化されていないマイクロバブル23,24溶液を室温にします。
- 共鳴の直前に、マイクロバブル活性化装置でマイクロバブルを45秒間活性化します。
- 液体の中央の深さから、1 mLのツベルクリンシリンジと21 Gの針を使用して、ゆっくりと(~3秒以上)0.1 mLのマイクロバブルを引き出します。
- ステップ5.3で調製した造影剤と生理食塩水の溶液に0.08 mLのマイクロバブルを加えます。手で15秒間叩いて混ぜます。
- AAVの最終濃度が体重1グラムあたり0.5〜2 x 10 10ウイルス粒子(VP / g)である状態で、ATAC – AAVが化学遺伝学的受容体を運ぶ場合、または同じプロモーターの下でGFPを運ぶAAVなどの陰性対照の場合、30 G針を介して尾静脈カテーテルに配達用の貨物(この場合はAAV9)を注入します。
- 浮遊を避けるために、マイクロバブルを手で15秒間再度混合します(図4)。
- その直後に、針を取り付けていないシリンジを通して200μLのマイクロバブル溶液を吸引する。針がないと、マイクロバブルにかかるせん断力が減少します。
- シリンジを反転させ、プランジャーを上下に押して混合します。
- 30 Gの針を取り付け、反転したまま、針の端に液滴が現れるまでマイクロバブルをゆっくりと押し出します。
6.インソネーション手順
- 共鳴のパラメータを設定します:10ミリ秒のパルス持続時間、120回の繰り返し、毎秒、頭蓋骨での0.30〜0.45MPaの圧力。
- ターゲティングガイドを取り外し、脱気した超音波ゲルをマウスヘッドに塗布し、気泡が形成されないようにします。
- 探触子を下げてイヤーバーホルダーの平らな場所に直接置き、座標を固定装置にダイヤルインします(図5)。
- AAVの溶液を注入します(0.5-2 x 1010 VP / g)。
- マイクロバブルとMRI造影剤溶液を15秒間混合し、マウス30gあたり80μLを注入します。
- 「送信」と「実行」を押して、すぐに120秒間超音波を適用します。
- 複数のサイトをターゲットにしている場合は、トランスデューサーをそのサイトに移動し、手順4.7〜4.9のスプレッドシートの数値に従って深度ターゲットを調整します。次に、すべての共鳴部位に対して手順6.5〜6.6を繰り返します。
7. BBB開口部のMRI評価
注:BBB開口部のMRI評価は、他の場所で詳細に説明されています11。BBB開口部の位置は、T1強調Gd造影剤の注射を受けたマウスにおけるより明るい領域として視覚化することができる。
- 超音波適用後、手順3.10のようにMRIシーケンスを記録します。
- MRIスキャナーからマウスを取り外し、麻酔から回復できるように回復ケージに入れます。苦痛、体重減少、またはその他の人道的なエンドポイントの兆候がないかマウスを毎日監視します。獣医スタッフと機関のIACUCガイドラインに相談して、予期しない有害事象が発生した場合の治療を進めてください。
8. 化学生成リガンドによるDREADD刺激
- 化学遺伝学的受容体を選択してください。DREADDの場合、Gq結合経路19を介したニューロン活性化のためのhM3Dq受容体、Gi/o結合経路20を介したニューロン活動の阻害のためのhM4Di受容体、またはサルビノリンBリガンド25を使用したGs結合経路を介したニューロンの活性化のためのKOND受容体を選択します。
- クロザピン酸化窒素(CNO)を滅菌生理食塩水に1 mg/mLの濃度で溶解します。分注したCNOを-20°Cで保存します。
- CNO 19、または別の化学発生リガンド26,27,28を腹腔内経路で0.3〜10 mg / kgの濃度で投与します。.
- 行動に対するCNOの効果を記録する場合は、薬物投与後15〜45分以内に行動活動の記録を開始して、DREADDの最大活性化を達成します19。
- ニューロン活性化の分析が必要な場合は、注射後60〜120分後の組織学的評価にマウスを使用してください。
- 心臓灌流による安楽死に進みます(セクション9を参照)。
9. 遺伝子発現と化学遺伝学的活性化の組織学的評価
注:実験エンドポイント(例えば、行動研究の終了、遺伝子発現に必要な時間)が達成されたら、遺伝子発現の位置と存在を確認することが重要です。
- 化学遺伝学的リガンドで活性化した後、組織を保存するために心臓灌流を行います。
- IP注射により、滅菌生理食塩水中のケタミン(100 mg / kg)/キシラジン(10 mg / kg)混合物でマウスを麻酔します。.つま先をつまんで麻酔を確認し、呼吸数が約1 / sに低下していることを確認します。安楽死が確認されるまで、加熱パッドを介して熱サポートを提供します。
- 10%中性緩衝ホルマリン(NBF)およびPBSを1mLあたり10単位のヘパリンで調製します。
注意: 溶液は4°Cである必要があります。 - 各バッファーを別々の50 mLチューブに注ぎ、PBS/ヘパリン溶液で25 Gバタフライカテーテルに接続されたペリスタルティックポンプを接続し、プライミングします。
- 手足をテープで吸収性の青いパッドに取り付け、動物がパッドの仰臥位に置かれていることを確認します。毛皮を消毒して、末梢臓器を収集する必要がある場合に備えて、末梢臓器の相互汚染を回避します。
- 横切開で腹腔を開き、横隔膜を露出させます。
- 前/後軸に沿って外科用ハサミの2つのカットを通して胸郭を開きます。
- 心臓を露出させ、針を左側のチャンバー(仰臥位で見た心臓の右側)に配置し、手順9.1.3でバタフライカテーテルに配置します。
- 血液の流出を可能にするために右心室に小さな切開を行います。
- 蠕動ポンプをオンにして、PBS /ヘパリンで血液を洗い流し始めます。
注意: この手順が適切に実行されない場合、ホルマリンによる固定中に血液が凝固し、適切な灌流が妨げられます。 - すべての血液が洗い流され、透明なPBSが右心室から出始めたら、蠕動ポンプの入口をNBF溶液に切り替え、マウスあたり25 mLの灌流を開始します。
- 脳を抽出し、少なくとも4 mLのNBFに入れ、24時間後修正します。
- 50μmの切片厚さを使用してビブラトーム上の冠状切片を使用して脳を切片化します。
- 各切片を脳全体の切片を保管する24ウェルプレートのウェルに入れる。
- 蛍光タンパク質に融合した化学遺伝学的受容体(例えば、mCherryまたはmCitrine)の発現を評価し、蛍光顕微鏡下で発現を示す切片を同定し、位置を確認する。表情は薄暗くなりそうです。
- 以下のプロトコルを使用して、蛍光色素に対する免疫染色を行います。
- 二次抗体の宿主の10%血清を含む0.5 mLの溶液に3つの切片を入れ、30分間インキュベートします。
- 切片を1:250 – 1:1,000希釈で一次抗体の溶液に移し、1:500を出発点とします。
- 一次抗体を含む切片をパラフィンフィルムで密封したマイクロプレート中で4°Cで一晩インキュベートします。
- 切片をPBSで3回、一度に5分間洗浄します。
- 二次抗体溶液のウェルあたり0.5 mLを10%血清中に加えます。
- 室温で4時間インキュベートします。
- 切片をPBSで3回、一度に5分間洗浄します。
- 核染色剤を含む水性封入剤(DAPIなど)でスライドにマウントします。
- 共焦点顕微鏡を使用して、断面全体のタイルスキャンを実行して、局在化と広がりを評価します。
- 標的脳領域の蛍光ピクセル強度を測定することにより発現強度を評価し、頭蓋内注射されたコントロールと比較します。
- あるいは、DAPI陽性細胞または細胞特異的マーカーと比較して、化学遺伝学的受容体に対して染色された細胞をカウントすることによって、陽性ニューロンのパーセントを評価する。
- 50 μmの切片でヘマトキシリン染色を行い、細胞の喪失、細胞破片の蓄積、およびその他の肉眼的損傷の兆候をイメージングすることにより、組織の損傷を評価します。
- 細胞ターゲティングの特異性を評価するために、化学遺伝学的受容体と細胞特異的マーカーについて後述するように二重免疫染色を行う。次に、手順 9.8 と同様に細胞陽性カウントを実行します。
- 二次抗体の宿主の10%血清を含む溶液0.5 mLに3つの切片を入れ、30分間インキュベートします。
- 切片を化学遺伝学的受容体の蛍光マーカーに対する一次抗体の溶液に移し、1:250〜1:1,000希釈で、1:500を出発点として使用します。目的の細胞特異的マーカー(CamkIIaなど)を標的とする別の宿主種由来の第2の一次抗体を追加します。
- 一次抗体を含む切片をパラフィンフィルムで密封したマイクロプレート中で4°Cで一晩インキュベートします。
- 切片をPBSで3回、一度に5分間洗浄します。
- 二次抗体溶液のウェルあたり0.5 mLを、両方の二次抗体の宿主種の10%血清に加えます。
注:各抗体は異なる蛍光色素を持ち、ステップ9.10.2の一次抗体に対して反応性がある必要があります。 - 室温で4時間インキュベートします。
- 切片をPBSで3回、一度に5分間洗浄します。
- スライドにマウントし、核染色を含む水性封入剤で固定します。
10. c-Fosの免疫染色による神経細胞の活性化評価
- このプロトコルのポイント9.5のように、核染色とは異なる蛍光タグを持つc-Fos一次抗体と二次抗体を使用してc-Fos染色を実行します。
- 化学遺伝学的受容体の標的となる領域のc-Fosと核染色の両方に陽性の細胞の割合を数えます。
- 化学遺伝学的受容体を発現し、化学遺伝学的リガンドまたはビヒクルコントロールで処理されたマウスのグループ、および化学遺伝学的リガンドまたはビヒクルコントロールで処理された野生型マウスのグループにおけるc-Fos陽性核の割合を分析します。
結果
ATACプロトコルを実行する最初のステップは、FUS-BBBOを所望の脳領域にターゲティングすることである。例えば、記載されたプロトコルに従って、海馬をFUS-BBBOで標的とし、造影剤およびAAV9を担持したDREADDをマウスに注射し、続いてマウスの脳の画像を取得するFLASH 3D MRIシーケンスを投与した。T1シグナルの増強は、海馬領域(図6)および脳の他の部分(図7)で達成されました。数週間後、DREADDは標的脳領域内で発現しました。多くのDREADDは蛍光レポーター(mCherryなど)に融合されていますが、ホルムアルデヒドによる灌流と固定のプロセスにより、これらのタンパク質の蛍光が大幅に減少することがわかりました。mCherryまたはDREADDに対する免疫染色は、以前の経験に基づいて、発現のより信頼性の高い検出につながりました(図8)。以前の実験では、マウスの~85%がFUS-BBBO7後に発現を示しました。DREADDの十分なレベルの発現の簡単なテストは、細胞レベルでそれらの機能をテストすることです。それは、例えば、CNO19、デスクロロクロザピン28、またはその他29などの化学発生的リガンドまたは生理食塩水コントロールを提供し、心臓灌流および固定の前に2時間待つことによって行うことができる。次に、脳切片を、ニューロンの活動が高まっていることを示すc-Fosタンパク質30とDREADDについて共免疫染色しました。DREADDを標的とした脳の部位が、生理食塩水7を投与された群と比較して、またはFUS-BBBOを受けなかった対側部位と比較して、化学遺伝学的リガンドを投与された群でc-Fos陽性のニューロン核の数が有意に多かった場合、実験は成功したと見なされました。注目すべきことに、これらのリガンドのいくつかは、DREADDの発現なしにニューロンを非特異的に活性化する可能性があります。例えば、CNOはマウスにおいて低レベルのクロザピンに代謝されることが示されており、これはBBBを通過し、高い効力でDREADDを活性化する27。しかし、非特異的な場所に結合することも示されました。すべての実験と同様に、化学遺伝学的研究にすべての適切なコントロールを含めることが重要です31。1つの可能な対照は、野生型マウスへの化学発生リガンドの投与であり、手順なしで、所望の行動学的または組織学的アッセイに対する薬物単独の効果を排除する。別の対照は、4つのグループを含めることができます:DREADD +リガンド、DREADD +ビヒクル、EGFP +リガンド、EGFP +ビヒクル、これはFUS-BBBOによる遺伝子送達と化学発生リガンドの両方の潜在的な影響を説明します。
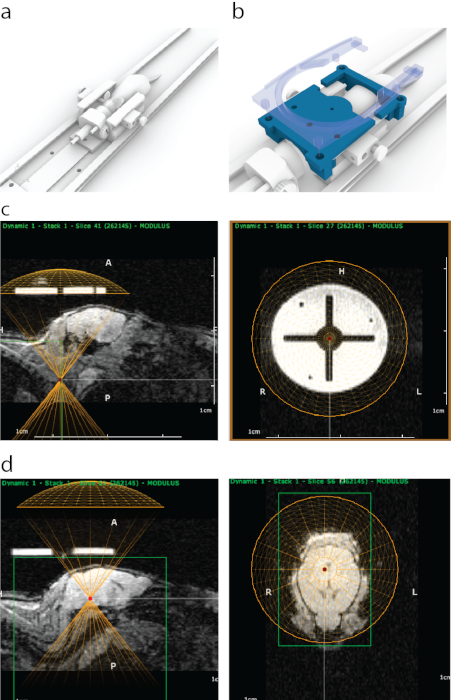
図1:ATACにおけるFUSのMRI誘導ターゲティングのプロセス。 (a)イヤーバー、ノーズコーン、MRIスキャナー内に収まるプラットフォームを備えたマウスの配置。(b)MRIで見える3Dプリントガイド(青)をイヤーバーフレームの端に取り付け、4本のスナップオンボルト(半透明の青)を含む表面MRIコイルのホルダーで所定の位置に固定しました。(c)矢状MRIでの3Dプリントされたガイドの外観(左パネル)、ガイドの下部と位置合わせされたトランスデューサーの仮想表現の下部(黄色の半円)。右パネルは、コロナビューからのMRI上の3Dプリントガイドの外観を示しています。明るい円は、MRIコントラストの強いポリジェットサポート材料でできていました。十字架はプラスチックで形成されました。黄色の円は、定位固定装置フレーム内のガイドと同心円状に位置合わせされたトランスデューサの位置を表します。(d)脳構造を標的とするために、仮想トランスデューサを、超音波コーン/ハウジングの厚さに一致するようにマウスの上のz方向に移動させた。この場合、ウォーターバスの厚さのため、正確なターゲティングのためにトランスデューサーをガイドから8.2 mm上に移動しました。MRI画像データを用いて脳の構造を選択し、そのMRI座標を書き留めて定位固定装置に入力しました。 この図の拡大版を表示するには、ここをクリックしてください。
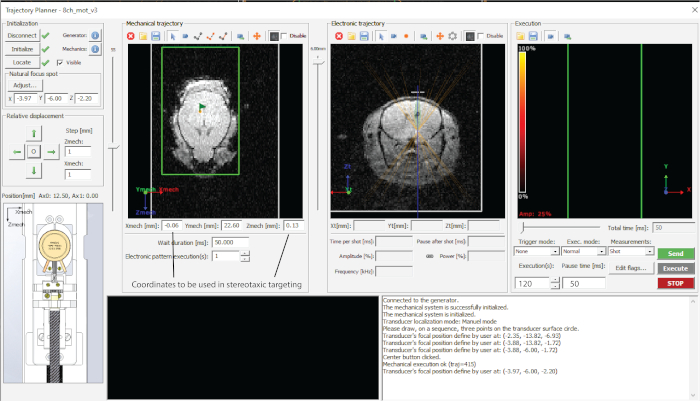
図2:使用するソフトウェアのインターフェース。この図の拡大版を表示するには、ここをクリックしてください。
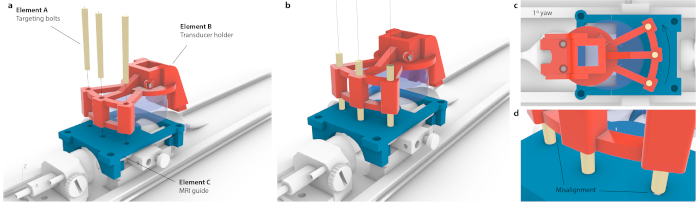
図3:MRI座標空間を定位固定装置に一致させるプロセス。(a)探触子ホルダー内の3つの穴をMRIガイド内の3つの穴に位置合わせし、アセンブリ全体に屈曲を引き起こさずに3本の円錐形のターゲットボルトを挿入しました。(b)理想的には、3本のボルトすべてが穴の中心に配置されます。(c)位置合わせに不正確さがある場合、3本のボルトすべてが収まるわけではありません(たとえば、1°の小さな、おそらく知覚できないヨーの場合、反対側のボルトがMRIガイドに詰まっている間、1本のボルトだけが収まります。あるいは、ボルトが押し込まれたときにアセンブリ全体が目に見える屈曲がある可能性があります。(d)ボルト継手の拡大図。最高の精度を得るには、ボルトを同心円状に配置する必要があります。 この図の拡大版を表示するには、ここをクリックしてください。
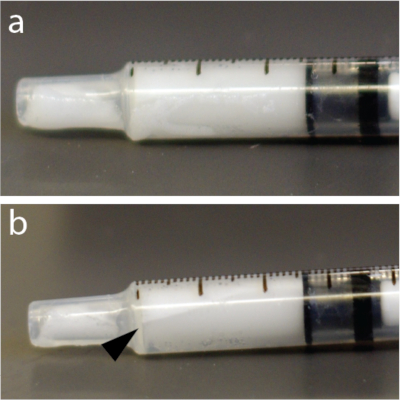
図4:シリンジ内のマイクロバブルの迅速な再分布。 (a)シリンジは混合後5秒で撮影した。(b)1分後、1 mLツベルクリンシリンジの上部近くに気泡の濃縮物の一部を示すはっきりと見える層がありました。本実施例は、特に、マイクロバブルの溶液を用いた。 この図の拡大版を表示するには、ここをクリックしてください。
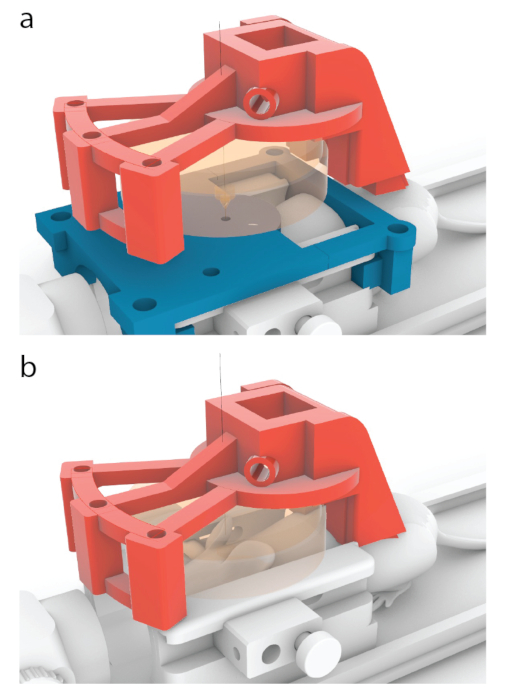
図5:トランスデューサの中心をMRIガイドの中心に配置するプロセス。 (a)この論文に示すモデルでは、赤いキャリアは、 図3bに示す位置からここに示す位置に10.56mm前方に移動するように設計されています。(b)超音波処理の前に青色のMRIガイドを取り外し、超音波の通過を確実にするためにマウスとトランスデューサー(オレンジ色)の間に超音波ゲルを適用した。 この図の拡大版を表示するには、ここをクリックしてください。
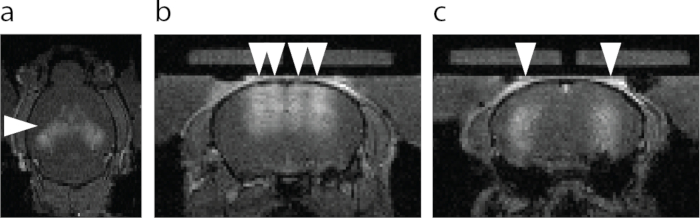
図6:BBB開口部のMRIによる可視化。(a)BBB開口部の軸方向図。矢印で示されたより明るい領域は、MRIT1 造影剤の血管外漏出を示す。(b)FUS-BBBO(矢じり)を標的とした背側海馬と海馬上の皮質の冠状図。(c)FUS-BBBOを標的とした中央海馬のコロナ状図(矢じり)。 この図の拡大版を表示するには、ここをクリックしてください。

図7:本論文で説明した3ボルトターゲティングシステムを使用した4つの脳部位のターゲティングの例。矢じりのある領域は、MRI造影剤の拡散を伴うBBBの開口部を示した。4つのサイトは、下から上に、各BBB開口部の間に~150秒で連続してターゲットが付けられました。画像は、最後のBBBオープニングから2分以内に撮影されました。スケールバーは2mmです。 この図の拡大版を表示するには、ここをクリックしてください。
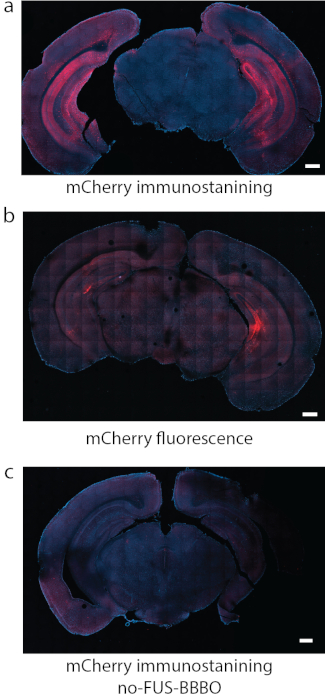
図8:DREADD発現の検出。 (a)DREADDに付着した蛍光色素の免疫染色(この場合はmCherry)は、いくつかの研究で信頼できる検出方法でした。(b)(a)と同じ条件で海馬を標的としたDREADDの別の代表的なセクションでは、mCherryの蛍光自体が強いバックグラウンドと比較的弱いシグナルを生成しました。(c)陰性対照として、AAVの全身注射を受けたが、FUS-BBBOを受けなかったマウスを使用した。mCherry免疫染色では有意な発現は見られません。スケールバーは500mmです(a、cのデータは7 から許可を得て、Copyright 2020 Nature-Springer)。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ATACでは、正確なMRIガイド下ターゲティング、FUS-BBBO、遺伝子発現の組織学的評価など、特定の神経回路の神経調節を成功させるためのいくつかの技術の実装を成功させる必要があります。3Dプリント可能なコンポーネントは、イメージング誘導FUS-BBBOで小さな脳構造のターゲティングを簡素化するために開発されました。
MRIガイド下集束超音波(MRIgFUS)投与は、多くの課題をもたらします。まず、一般的なMRIコイルは、超音波ハードウェアではなく標本のみを収容するように設計された限られたスペースを持っています。MRIのより大きなボアは、信号がコイル32のフィルファクタに関連するので、機器のコストを増加させ、画質を低下させる。その結果、MRIで動物の画像の上部に配置されたFUSハードウェアは、画像品質を低下させます。第二に、MRI対応デバイスの設計は困難で費用がかかります。MRI対応材料は、反磁性であり、高周波照射時に渦電流が発生する傾向が低く、高磁場での磁化率が低い必要があります。導電性材料では、渦電流の発生またはその磁化率も画像品質に悪影響を及ぼします。最後に、利用可能なMRI互換材料は、固定装置フレームなどの精密ターゲティングマシンの製造に通常使用される金属よりもヤング率と耐久性が低くなっています。位置調整に使用されるモーターは、MRIに対応し、そのサイズのためにMRIボアの外側に配置する必要があります。これらのモーターは、MRI互換材料を使用して、MRIボア内のトランスデューサーに距離を置いて接続する必要があります。塑性反りの問題、堅牢なサイズのコンポーネントを実装するためのボア内の十分なスペースの欠如、および脳全体のターゲティング位置を変更するための不十分な余地が、以前の研究のターゲティング精度に影響を与えました。
これらの問題を解決するために、MRIでのイメージングとスキャナー外でのFUS-BBBO投与を行うことを決定しました。MRIガイダンスを可能にするために、マウスは、MRIとステレオタックス座標空間の両方でマウスの脳構造を局在化するために使用できるMRI可視ターゲティングガイドを備えた3Dプリントされた拘束具内に配置されました。マウスの頭蓋骨とターゲティングガイドの両方がイヤーバーホルダーにしっかりと取り付けられているため(図1a、b)、ターゲティングガイドを使用してMRI画像内の空間座標を相関させ、定位固定装置をゼロにすることができます。拘束装置には可動部品がなく、トランスデューサも含まれていないため、MRI内に収まる堅牢性と小型化を実現し、トランスデューサの電子機器からの信号干渉を排除しました。一部の材料の3DプリントされたサポートがMRIに表示されるため、ターゲティングガイド内のスペースはくり抜かれています(図1c)。定位固定装置キャリブレーションを可能にするために、アセンブリに穴が導入されました(図3)。超音波トランスデューサをステレオタックスの電極ホルダーに取り付け、セクション4(図1d)で説明したようにターゲティングを実行しました。トランスデューサーは、レベルプレーンからの逸脱を防ぐために、イヤーバーのハウジングによってその長さに沿って支持されるべきです。背腹方向のターゲティングは、環状アレイの位相シフトを使用して達成できます。
実用的なターゲティング精度は、超音波フォーカシングと頭蓋骨の減衰によって決まります。FUS−BBBO手順は、ラット11について詳細に記載されており、他の多くのモデル生物23、33、34およびヒト16、17において実施されている。超音波の焦点サイズの関係は周波数に反比例し、周波数が高いほどより正確な送達が可能になります。ただし、頭蓋骨の減衰は周波数35で増加し、頭蓋骨の加熱と皮質領域の損傷につながる可能性があります。正確なターゲティング戦略は、脳の部位によって異なります。全幅半最大圧力が脳組織内に収まる部位は、線条体、中脳、海馬などの多くの脳構造において予測可能で安全なBBB開口部を可能にする。脳の基部近くの領域は、マウスに特定の課題をもたらします。マウスの脳は背腹方向に約8〜10mmの大きさで、これは多くの市販のトランスデューサーの全幅半値サイズに匹敵します。その結果、頭蓋骨の底部を標的にすることは、外耳道、口、または気管に存在する骨および空気からの超音波反射をもたらし、高圧および低圧の予測不可能なパターンをもたらし得る36。これらの圧力のいくつかは、出血および組織損傷を引き起こすことが示されている慣性キャビテーション閾値を超える可能性がある37。頭蓋骨の基部近くに位置する領域を標的とするために、交差遺伝学38が、FUSビームで標的とされる領域よりも小さい領域に遺伝子発現を制限するために使用される交差ATAC7を使用することが好ましい場合がある。交差ATACの公表された例では、ドーパミン作動性細胞において遺伝子編集酵素(Cre38)を発現するトランスジェニック動物が、ドーパミン作動性細胞を含む領域のサブセクションにおいて超音波で標的化されている。最後に、皮質領域をFUSで標的にすることができますが、超音波の回折と反射が発生し、不均一な圧力プロファイルにつながる可能性があります。このプロトコルは、使用される種に大きく依存するため、皮質領域の標的化をカバーしていません。しかしながら、海馬7の上の皮質のいくらかの標的化(例えば、図7)が観察されており、少なくともマウスにおいて、可能であることを示す。
化学遺伝学的活性化剤の選択および投与量は、特定の実験的ニーズに依存する。著者の研究7の1つを含む多くの研究は、有意な非特異的反応を示さなかったが39,40、高用量(例えば、10 mg / kg)は、少なくとも場合によっては副作用を引き起こす可能性があります41。しかしながら、全ての行動実験と同様に、CNOおよびその代謝産物42の潜在的なオフターゲット活性のために、適切な対照31が不可欠である。このような対照には、DREADDを発現する動物へのCNOおよび生理食塩水対照の投与、および野生型動物へのCNOの投与、または特定の場合には、それぞれ化学遺伝学的受容体を発現する脳の同側部位と対側部位の比較が含まれます。さらに、最近の研究では、特異性が向上した多くの新しいDREADDアゴニストが明らかになりました28,29,43。他の化学遺伝学的受容体5、25、44もATAC手順と併せて使用することができる。
遺伝子発現の組織学的評価は、すべての動物について死後必要です。ごく一部の動物は、FUS-BBBO7後に遺伝子発現不良を示します。また、ミスターゲティングが可能なため、遺伝子発現の空間的精度や特異性を示す必要があります。注目すべきことに、一部のAAVは逆行性または順行性のトレース能力を示す可能性があり45 、正確な超音波ターゲティングにもかかわらず、超音波の標的部位から遠く離れたトランスフェクションを引き起こす可能性があります。発現された化学遺伝学的受容体がフルオロフォアに融合または共発現する場合、組織切片におけるフルオロフォアのイメージングは、局在および発現強度を評価するのに十分であり得る。しかし、多くの蛍光タンパク質は組織固定プロセスによって損傷を受けており、DREADDで頻繁に使用されるmCherryタンパク質の免疫染色は、以前の研究でより良いシグナルをもたらしました7。最後に、脳の特定の部分(海馬の顆粒状細胞層など)のニューロンの密度により、融合とは対照的に、IRES下で発現された核局在蛍光団を使用して細胞カウントを行うことは、核を容易にセグメント化し、DAPIやTO-PRO-3などの核染色で対比染色できるため、有益である可能性があります。c-Fos染色による神経調節を評価するには、核対比染色を行い、蛍光シグナルではなくc-Fos陽性核をカウントすることが不可欠です。場合によっては、細胞の破片が蛍光を示し、陽性細胞の測定値を混乱させる可能性があります。
FUS-BBBOによる薬物および遺伝子送達の限界には、侵襲的頭蓋内注射による送達よりも分解能が低いこと、および大量の注射薬物またはウイルスベクターが必要であることが含まれる。さらに、脳への直接注射は注射部位への排他的送達をもたらすが、FUS-BBBOは静脈内経路を使用するため、末梢組織への送達が可能である。神経調節のために化学遺伝学を使用することの制限には、遅いタイムスケールが含まれ、これは神経調節の強度の急速な変化を必要とするいくつかの行動プロトコルには不十分である可能性がある。
開示事項
利益相反はありません。
謝辞
この研究は、Brain and Behavior Foundation, NARSAD Young Investigator Awardの支援を受けた。いくつかの3Dプリントされたコンポーネントは、もともとファビアン・ラビュソー(画像誘導療法、フランス)によって設計されました。著者は、原稿の準備に技術的な支援をしてくれたジョン・ヒース(カリフォルニア工科大学)とマーガレット・スウィフト(カリフォルニア工科大学)に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 21-gauge needles (BD) | Fisher Scientific | 14826C | |
| 25-gauge butterfly catheter | Harvard Bioscience | 725966 | |
| 30-gauge needles (BD) | Fisher Scientific | 14826F | |
| Absorbent blue pad | Office Depot | 902406 | |
| Anti-c-Fos antibody | Santa Cruz Biotechnology | SC-253-G | |
| Anti-mCherry antibody | Thermofisher | PA534974 | |
| Bruker Biospec 70/30 | Bruker | custom | includes the RF coils |
| Clozapine-n-oxide | Tocris | 4936 | |
| Custom designed 3D printed mouse harnesses and MRIgFUS targeting components | ImageGuidedTherapy, Szablowski lab | custom | download from szablowskilab.org/downloads |
| Custom MRIgFUS machine | ImageGuidedTherapy | N/A | |
| Definity microbubbles | Lantheus | DE4 | |
| Degassed aquasonic/ultrasound gel | Fisher Scientific | 5067714 | |
| Depilation crème | Nair | n/a | |
| Eight-element annular array transducer | Imasonic Inc. | custom | |
| Ethanol Pads/Alcohol Swabs (70%) (BD) | Office Depot | 599893 | |
| Heparin | Sigma-Aldrich | H3149-25KU | |
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Ketamine | Patterson Veterinary | 07-890-8598 | |
| Neutral buffered formalin (10%) | Sigma-Aldrich | HT501128-4L | |
| Optical fiber hydrophone | Precision Acoustics | ||
| PE10 tubing | Fisher Scientific | NC1513314 | |
| Peristaltic pump | |||
| Phosphate-buffered saline (PBS) | Sigma-Aldrich | 524650-1EA | |
| Prohance contrast agent | Bracco | 0270-1111-04 | |
| Saline | Fisher Scientific | NC9054335 | |
| Secondary antibody, Donkey-anti goat | ThermoFisher | A-11055 | |
| Secondary antibody, Donkey-anti rabbit | ThermoFisher | 84546 | |
| Surgical scissors (straight) | Fisher Scientific | 17467480 | |
| ThermoGuide Software | ImageGuidedTherapy | ||
| Tissue glue (Gluture) | Fisher Scientific | NC9855218 | |
| Tuberculin Syringe (1 mL) (BD) | Fisher Scientific | 14823434 | |
| VeroClear 3D printable material | Stratasys | RGD810 | |
| Vialmix microbubble activation device | Lantheus | VMIX | |
| Vibrating microtome | Compresstome | VF-300 | |
| Xylazine | Sigma-Aldrich | X1251-1G |
参考文献
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
- Zhang, F., Wang, L. -. P., Boyden, E. S., Deisseroth, K. Channelrhodopsin-2 and optical control of excitable cells. Nature Methods. 3, 785-792 (2006).
- Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Roth, B. L. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proceedings of the National Academy of Sciences. 104, 5163-5168 (2007).
- Lerchner, W., et al. Reversible silencing of neuronal excitability in behaving mice by a genetically targeted, ivermectin-gated Cl- channel. Neuron. 54, 35-49 (2007).
- Magnus, C. J., et al. Chemical and genetic engineering of selective ion channel-ligand interactions. Science. 333, 1292-1296 (2011).
- Deeb, W., et al. Proceedings of the fourth annual deep brain stimulation think tank: a review of emerging issues and technologies. Frontiers in Integrative Neuroscience. 10, 38 (2016).
- Szablowski, J. O., Lee-Gosselin, A., Lue, B., Malounda, D., Shapiro, M. G. Acoustically targeted chemogenetics for the non-invasive control of neural circuits. Nature Biomedical Engineering. 2, 475-484 (2018).
- Elias, W. J., et al. A pilot study of focused ultrasound thalamotomy for essential tremor. New England Journal of Medicine. 369, 640-648 (2013).
- Burgess, A., Hynynen, K. Noninvasive and targeted drug delivery to the brain using focused ultrasound. ACS Chemical Neuroscience. 4, 519-526 (2013).
- Kinoshita, M., McDannold, N., Jolesz, F. A., Hynynen, K. Noninvasive localized delivery of Herceptin to the mouse brain by MRI-guided focused ultrasound-induced blood-brain barrier disruption. Proceedings of the National Academy of Sciences U. S. A. 103, 11719-11723 (2006).
- Samiotaki, G., Acosta, C., Wang, S., Konofagou, E. E. Enhanced delivery and bioactivity of the neurturin neurotrophic factor through focused ultrasound-mediated blood-brain barrier opening in vivo. Journal of Cerebral Blood Flow & Metabolism. 35, 611-622 (2015).
- O'Reilly, M. A., Waspe, A. C., Chopra, R., Hynynen, K. MRI-guided disruption of the blood-brain barrier using transcranial focused ultrasound in a rat model. Journal of Visualized Experiments. (61), e3555 (2012).
- Thévenot, E., et al. Targeted delivery of self-complementary adeno-associated virus serotype 9 to the brain, using magnetic resonance imaging-guided focused ultrasound. Human gene Therapy. 23, 1144-1155 (2012).
- Hsu, P. -. H., et al. Noninvasive and targeted gene delivery into the brain using microbubble-facilitated focused ultrasound. PloS One. 8, 58682 (2013).
- Wang, S., Olumolade, O. O., Sun, T., Samiotaki, G., Konofagou, E. E. Noninvasive, neuron-specific gene therapy can be facilitated by focused ultrasound and recombinant adeno-associated virus. Gene Therapy. 22, 104 (2015).
- Downs, M. E., et al. Long-Term Safety of Repeated Blood-Brain Barrier Opening via Focused Ultrasound with Microbubbles in Non-Human Primates Performing a Cognitive Task. PLoS One. 10, 0125911 (2015).
- Lipsman, N., et al. Blood-brain barrier opening in Alzheimer's disease using MR-guided focused ultrasound. Nature Communications. 9, 2336 (2018).
- Carpentier, A., et al. Clinical trial of blood-brain barrier disruption by pulsed ultrasound. Science Translational Medicine. 8, 343 (2016).
- Sternson, S. M., Roth, B. L. Chemogenetic Tools to Interrogate Brain Functions. Annual Reviews Neurosciences. 37, 387-407 (2014).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63, 27-39 (2009).
- Zhu, H., et al. Chemogenetic inactivation of ventral hippocampal glutamatergic neurons disrupts consolidation of contextual fear memory. Neuropsychopharmacology. 39, 1880-1892 (2014).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Noninvasive, transcranial and localized opening of the blood-brain barrier using focused ultrasound in mice. Ultrasound in Medicine & Biology. 33, 95-104 (2007).
- Thévenot, E., et al. Targeted delivery of self-complementary adeno-associated virus serotype 9 to the brain, using magnetic resonance imaging-guided focused ultrasound. Human Gene Therapy. 23, 1144-1155 (2012).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220, 640-646 (2001).
- Yang, F. -. Y., Fu, W. -. M., Chen, W. -. S., Yeh, W. -. L., Lin, W. -. L. Quantitative evaluation of the use of microbubbles with transcranial focused ultrasound on blood-brain-barrier disruption. Ultrasonics Sonochemistry. 15, 636-643 (2008).
- Vardy, E., et al. A New DREADD Facilitates the Multiplexed Chemogenetic Interrogation of Behavior. Neuron. 86, 936-946 (2015).
- Thompson, K. J., et al. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. ACS Pharmacology and Translational Sciences. 1, 61-72 (2018).
- Gomez, J. L., et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357, 503-507 (2017).
- Nagai, Y., et al. Deschloroclozapine: a potent and selective chemogenetic actuator enables rapid neuronal and behavioral modulations in mice and monkeys. bioRxiv. , 854513 (2019).
- Thompson, K. J., et al. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. ACS Pharmacology and Translational Science. 1, 61-72 (2018).
- Bullitt, E. Expression of c-fos-like protein as a marker for neuronal activity following noxious stimulation in the rat. Journal of Comparative Neurology. 296, 517-530 (1990).
- Mahler, S. V., Aston-Jones, G. CNO Evil? Considerations for the use of DREADDs in behavioral neuroscience. Neuropsychopharmacology. 43, 934 (2018).
- Gruber, B., Froeling, M., Leiner, T., Klomp, D. W. J. RF coils: A practical guide for nonphysicists. Journal of Magnetic Resonance Imaging. 48, 590-604 (2018).
- Treat, L. H., McDannold, N., Vykhodtseva, N., Hynynen, K. Transcranial MRI-guided focused ultrasound-induced blood-brain barrier opening in rats. IEEE. 2, 998-1000 (2004).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Feasibility of transcranial, localized drug-delivery in the brain of Alzheimer's-model mice using focused ultrasound. IEEE. 2, 988-991 (2005).
- Cobbold, R. S. . Foundations of Biomedical ultrasound. , (2006).
- Younan, Y., et al. Influence of the pressure field distribution in transcranial ultrasonic neurostimulation. Medical Physics. 40, 082902 (2013).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Targeted disruption of the blood-brain barrier with focused ultrasound: association with cavitation activity. Physics in Medicine and Biology. 51, 793-807 (2006).
- Branda, C. S., Dymecki, S. M. Talking about a Revolution: The Impact of Site-Specific Recombinases on Genetic Analyses in Mice. Developmental Cell. 6, 7-28 (2004).
- Jendryka, M., et al. Pharmacokinetic and pharmacodynamic actions of clozapine-N-oxide, clozapine, and compound 21 in DREADD-based chemogenetics in mice. Scientific Reports. 9, 4522 (2019).
- Manvich, D. F., et al. The DREADD agonist clozapine N-oxide (CNO) is reverse-metabolized to clozapine and produces clozapine-like interoceptive stimulus effects in rats and mice. Scientific Reports. 8, 3840 (2018).
- Martinez, V. K., et al. Off-Target Effects of Clozapine-N-Oxide on the Chemosensory Reflex Are Masked by High Stress Levels. Frontiers in Physiology. 10, 521 (2019).
- Gomez, J. L., et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357, 503-507 (2017).
- Bonaventura, J., et al. High-potency ligands for DREADD imaging and activation in rodents and monkeys. Nature Communications. 10, 1-12 (2019).
- Roth, B. L. DREADDs for Neuroscientists. Neuron. 89, 683-694 (2016).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of Transduction Efficiency, Tropism and Axonal Transport of AAV Serotypes 1, 2, 5, 6, 8 and 9 in the Mouse Brain. PLoS One. 8, 76310 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved