Method Article
聚焦超声诱导血脑屏障打开,用于靶向大脑结构和评估化学遗传神经调控
摘要
该协议描述了通过聚焦超声血脑屏障(BBB)开放进行基因传递所需的步骤,评估产生的基因表达以及通过组织学测试测量化学遗传受体的神经调控活性。
摘要
声学靶向化学遗传学(ATAC)允许对特定神经回路进行无创控制。ATAC通过聚焦超声(FUS)诱导的血脑屏障开放(FUS-BBBO),腺相关病毒(AAV)载体的基因传递以及工程化的化学遗传学蛋白质受体及其同源配体激活细胞信号传导的组合来实现这种控制。使用ATAC,可以使用单个无创超声应用以毫米精度转导大型和小型大脑区域。这种转导后来可以在使用药物的自由移动的动物中进行长期、非侵入性、无装置神经调控。由于FUS-BBBO,AAV和化学遗传学已在多种动物中使用,因此ATAC也应该可扩展以用于其他动物物种。本文扩展了先前发表的协议,并概述了如何在MRI引导下使用FUS-BBBO优化基因传递到小大脑区域,但不需要复杂的MRI兼容FUS设备。该协议还描述了小鼠靶向和约束组件的设计,这些组件可以由任何实验室3D打印,并且可以轻松针对不同的物种或定制设备进行修改。为了提高可重复性,该协议详细描述了微泡、AAV 和静脉穿刺如何在 ATAC 开发中使用。最后,展示了一个示例数据,以指导使用ATAC的研究的初步调查。
引言
使用电路特异性神经调控技术,如光遗传学1,2和化学遗传学3,4,5,促进了我们对精神疾病作为神经元回路疾病的理解。神经元回路在治疗脑部疾病时很难研究,甚至更难控制,因为它们通常由特定的细胞类型、大脑区域、分子信号通路和激活时间定义。理想情况下,对于研究和临床应用,这种控制将是无创的,但实现精确和非侵入性神经调控具有挑战性。例如,虽然神经活性药物可以无创地到达大脑,但它们通过作用于整个大脑而缺乏空间特异性。另一方面,电深脑刺激可以控制特定的大脑区域,但难以控制特定的细胞类型,需要手术和设备放置6。
声学靶向化学遗传学7 (ATAC) 为神经调控提供空间、细胞类型和时间特异性。它结合了三种技术:聚焦超声诱导血脑屏障开放(FUS-BBBO)进行空间靶向,使用腺相关病毒载体(AAV)在细胞类型特异性启动子的控制下无创地递送基因,以及工程化学遗传受体通过药物管理选择性地调节转染的神经回路。FUS是FDA批准的技术,它利用超声波的能力以毫米的空间精度聚焦在包括人脑在内的组织深处。在高功率下,FUS用于无创靶向消融术,包括FDA批准的特发性震颤治疗8。FUS-BBBO将低强度超声与全身施用的微泡相结合,微泡在超声焦点处在血管中振荡,导致BBB9的局部,暂时(6-24小时)和可逆开放。该开口允许将蛋白质9,10、小分子 11 和病毒载体7,12,13,14 输送到大脑,而不会在啮齿动物 10 和非人灵长类动物 15 中造成明显的组织损伤。FUS-BBBO16,17的临床试验正在进行中,表明该技术可能用于治疗。
使用AAV的病毒基因递送也正在迅速进入中枢神经系统疾病的临床应用,最近的FDA和欧盟监管批准是重要的里程碑。最后,化学遗传受体18,例如仅由设计药物激活的设计受体(DREADDs),被神经科学家广泛用于对转基因或转染动物的神经元兴奋进行药理学控制19,20。DREADD是G蛋白偶联受体(GPCR),其经过基因工程改造以响应合成化学遗传分子而不是内源性配体,使得这些配体的全身给药增加或降低表达DREADD的神经元的兴奋性。当这三种技术结合到ATAC中时,它们可用于对选定的神经回路进行无创调节,具有空间,细胞类型和时间精度。
在这里,我们扩展和更新了先前发表的FUS-BBBO11 协议,包括使用简单的3D打印靶向设备在小鼠中使用FUS-BBBO准确靶向大脑区域的方法。我们还展示了FUS-BBBO在ATAC中的应用。我们展示了递送携带化学遗传受体的AAV所必需的步骤,以及通过组织学评估基因表达和神经调控。该技术特别适用于靶向大或多个大脑区域进行基因表达或神经调控。例如,皮层的广阔区域可以很容易地用FUS-BBBO转导,并使用化学遗传学进行调节。然而,使用替代技术(颅内注射)进行基因传递将需要大量的侵入性注射和开颅术。FUS-BBBO及其应用ATAC可以扩展到不同大小的动物,其中大脑区域更大,更难侵入性靶向。
研究方案
所有实验均根据加州理工学院机构动物护理和使用委员会批准的协议进行,数据最初由J.O.S获得。
1. 动物背带和图像引导硬件的设计与3D打印
- 使用Szablowski实验室网站上的文件: https://www.szablowskilab.org/downloads 用于组件的3D打印。
- 确保打印材料在 MRI 中的敏感性较低,但具有 MRI 可见的支持。请参阅材料和试剂部分所用材料的详细信息。
- 通过反复测试材料并观察应加固的磨损部位,考虑多种用途的材料降解。确保打印壁厚至少为 2 毫米。
- 使用高精度3D打印机提高定位精度。
- 抵消重力和其他力,以避免塑料3D打印组件的偏差,方法是沿其长度支撑组件,并在观察到任何弯曲时增加3D打印壁的厚度。
- 考虑多个轴的精度,包括前/后、内侧/侧、背/腹,以及偏航、俯仰和倾斜。
- 通过执行FUS-BBBO并记录与目标位置的偏差来测试目标的准确性。
- 如果使用电动立体定位系统,通过在视频上记录FUS-BBBO定位程序来评估动态运动对材料弹性的影响,并通过加厚3D打印材料壁来纠正任何偏差。
2. 超声系统说明
- 使用带有八晶片环形阵列探头(直径= 25 mm,自然焦点= 20 mm;孔径(F)= 0.8)的超声系统,并通过将凝胶涂在剃光的小鼠头上,用脱气超声凝胶将外壳耦合到头部。
注意:先前研究7中使用的换能器中心频率为1.5 MHz,脉冲持续时间为10 ms,脉冲重复频率在120 s内为1 Hz。使用光纤水听器校准压力并保持在0.36-0.45MPa之间。假设 1.5 MHz 和顶骨通过颅骨21 的声学衰减为 18%。适合安全BBB打开和AAV输送的条件范围已在其他地方详细描述7,14,22。
3. 动物制备
- 用医用级空气以2%的异氟醚吸入麻醉一只小鼠。通过触摸捏合检查麻醉深度以确认无反应。然后,使用一次性无菌q-tip涂抹眼药膏以防止角膜干燥,以防止软膏管交叉污染。
注意:FUS-BBBO的典型程序可能在30分钟到2小时之间,并且必须始终保持麻醉。 - 小鼠麻醉后,用肝素化盐水(10U / ml)清洗干净的导管。
注意:适用于25-35 g小鼠的导管具有30 G针和PE10管。 - 随后用70%乙醇垫消毒小鼠尾巴。将尾静脉导管置于侧尾静脉中,并用组织胶固定。观察血液从尾静脉回流到导管以确认其位置。
- 剃掉小鼠头部,然后在组织胶干燥后使用脱毛膏,以减少在超声过程中气泡被超声凝胶捕获的可能性。
- 将鼠标放在3D打印的MRI托架中,将门牙安装在咬杆上,并将头部安装在鼻锥内(图1a)。
- 在接触钝耳杆的部位皮下注射多达 10 μL 利多卡因。然后,将钝的杆固定在颅骨上并施加安全的压力,注意不要对气管施加压力,因为它会阻碍呼吸。观察呼吸 30 秒,以确认动物以 1/s 的速度自由呼吸。
- 将定位指南连接到耳杆,按照步骤3.6(图1b)检查呼吸,并在整个过程中每分钟继续目视监测呼吸。呼吸频率升高超过1/s是麻醉丧失的指征之一。当小鼠不在MRI扫描仪中或呼吸频率升高到1 / s以上时,每5分钟继续监测一次脚趾捏反应。
- 将 MRI 托架转移到 MRI 支架中,然后在磁铁孔内。
注意:硬件设计针对 7T MRI 内的 72 mm 线圈进行了优化。 - 获取MRI序列以定位扫描仪中的鼠标。
- 根据仪器制造商的具体说明,使用以下参数选择3D快速低角度拍摄(FLASH)序列以获取整个大脑。回波时间: 3.9 毫秒, 重复时间: 15 毫秒, 激发脉冲角: 15°, 矩阵尺寸: 130 x 130 x 114, 分辨率: 350 x 200 x 200 μm/体素, 平均值: 1, 采集时间: 3 分 42 秒
- 将文件从MRI系统传输到控制FUS系统的计算机。
- 在软件中打开成像序列以执行MRI引导的靶向,其中图像应如图 1c所示。
4. 磁共振引导的靶向
注意:使用定制设计的靶向指南,无需在MRI中放置超声换能器,也无需通过对前膛和λ线进行零立体税来切开皮肤以执行靶向。请按照以下步骤执行定位流程。
- 将托架放在立体定位仪器内。使用带有双面胶带的金属块将其固定到位,并将托架压在立体定位仪器的两个支撑柱上。
- 通过在数据管理器中选择文件,右键单击以显示菜单选项,然后选择"立即传输",将MRI图像传输到具有正在运行的FUS指导软件的计算机。
- 打开 FUS 引导软件并通过单击"打开序列"并加载成像序列的所有文件来加载图像。
- 通过按右键单击和"重新格式化"将图像重新格式化为三个轴。
- 通过右键单击将传感器定位到圆形瞄准导轨(图1c)。
- 在矢状视图中,调整虚拟换能器的垂直位置,以考虑水浴和换能器外壳的厚度(在本例中 – 向上8.2 mm, 图1d)。
- 在轨迹规划器中指向要定位的区域,并在电子表格中记下坐标(在本例中为中脑,如图 1d 所示)。
- 拨入所需的目标深度(电子轨迹中的z值(图2)并在电子表格中记下坐标。
- 通过按"发送轨迹"和"执行"来定位每个点(图2)。
注意:这是在电机内放置鼠标托架时完成的。然而,在立体定位仪器上可以高精度地实现相同的靶向。 - 要将MRI的坐标与立体定位框架相关联,请将定制安装的换能器放在瞄准导轨上并平移,直到三个瞄准螺栓(图3,元件A)中的每一个都可以穿过换能器支架(图3,元件B)和瞄准导轨(图3,元件C)。确定螺栓没有受到拉力或倾斜。
- 将换能器向前/后方向平移 10.56 mm,直到它位于 MRI 上出现目标指南中心的同一位置。
- 确定从虚拟换能器中心(图3a,晶片A)到目标区域(图3a,晶片B)的距离,并使用立体定位框将换能器移动到这些坐标。
- 继续制备注射液。
5. 注射液制备
注意:微气泡溶液对压力非常敏感。因此,剧烈混合或通过细针快速注射会破坏微气泡并降低BBB打开的功效。此外,微气泡比水轻,可以漂浮到管子、导管或注射器的顶部(图 4),例如在自动注射器中。强烈建议在每次注射前立即重悬微泡溶液。
- 使用注射器将 0.8 mL 盐水抽出到 1.5 mL 管中。
- 使用注射器将 0.1 mL MRI 造影剂加入同一 1.5 mL 管中并混合。
- 将未活化的微气泡23,24溶液置于室温。
- 在谐振之前,在微气泡激活装置中激活微气泡 45 秒。
- 使用1 mL结核菌素注射器和21 G针头从液体的中间深度缓慢(超过~3秒)取出0.1 mL微泡。
- 将0.08mL微泡加入步骤5.3制备的造影剂和生理盐水溶液中。用手敲击混合 15 秒。
- AAV的最终浓度为每克体重0.5-2 x10 10 个病毒颗粒(VP / g),将货物通过30G针注射到尾静脉导管中,如果是ATAC – AAV携带化学遗传受体的AAV,或阴性对照,例如在同一启动子下携带GFP的AAV。
- 再次用手混合微气泡15秒以避免漂浮(图4)。
- 之后,立即通过注射器吸出 200 μL 微气泡溶液,无需连接针头。缺少针头会降低微气泡上的剪切力。
- 倒置注射器并通过上下按压柱塞进行混合。
- 连接 30 G 针头,在仍然倒置的情况下,慢慢推出微气泡,直到针头末端出现液滴。
6. 谐振程序
- 设置谐振参数:10 ms脉冲持续时间,120次重复,每秒一次,颅骨压力0.30-0.45 MPa。
- 取下靶向指南,并在鼠标头上涂抹脱气超声凝胶,确保没有气泡。
- 降低换能器并将其直接放在平坦的耳杆支架上,然后将坐标拨入立体定位仪器(图 5)。
- 注入AAV溶液(0.5-2 x 1010 VP / g)。
- 将微泡和MRI造影剂溶液混合15秒,每30g小鼠注入80μL。
- 立即按"发送"和"执行"进行120秒的超声波应用。
- 如果针对多个位点,请将传感器移动到该位点,并按照步骤4.7-4.9中的电子表格中的数字调整深度定位。然后对每个音效部位重复步骤6.5-6.6。
7. BBB开口的MRI评估
注意:BBB开口的MRI评估已在别处详细描述11。BBB开口的位置可以可视化为接受T1加权Gd造影剂注射的小鼠的较亮区域。
- 超声应用后,按照步骤3.10记录MRI序列。
- 从MRI扫描仪中取出鼠标,并将其放在恢复笼中,以便从麻醉中恢复。每天监测小鼠是否有痛苦、体重减轻或其他人道终点的迹象。如果发生意外不良事件,请咨询兽医人员和IACUC机构指南,以进行任何治疗。
8. 使用化学遗传配体进行 DREADD 刺激
- 选择化学遗传受体。对于 DREADD,选择 hM3Dq 受体通过 Gq 偶联途径19 激活神经元,选择 hM4Di 受体通过 Gi/o 偶联途径20 抑制神经元活性,或选择 KORD 受体,使用 Salvinorin-B 配体25 通过 Gs 偶联途径激活神经元。
- 将氯氮平-n-氧化物 (CNO) 溶解在浓度为 1 mg/mL 的无菌盐水中。将等分的CNO储存在-20°C。
- 通过腹膜内途径以0.3 – 10mg / kg的浓度施用CNO19或其他化学遗传配体26,27,28。
- 如果要记录CNO对行为的影响,请在给药后15-45分钟内开始记录行为活动,以实现DREADDs的最大激活19。
- 如果需要分析神经元活化,请在注射后60-120分钟后使用小鼠进行组织学评估。
- 通过心脏灌注进行安乐死(见第9节)。
9. 基因表达和化学遗传活化的组织学评价
注意:一旦达到实验终点(例如,行为研究结束,基因表达所需的时间),确认基因表达的位置和存在至关重要。
- 用化学遗传配体激活后,进行心脏灌注以保存组织。
- 通过IP注射在无菌盐水中用氯胺酮(100mg / kg)/甲苯噻嗪(10mg / kg)混合物麻醉小鼠。用脚趾捏住确认麻醉,并确保呼吸频率已降低到大约 1/s。通过加热垫提供热支持,直到确认安乐死。
- 准备 10% 中性缓冲福尔马林 (NBF) 和 PBS,每毫升含 10 单位肝素。
注意:溶液应在4°C。 - 将每个缓冲液倒入单独的 50 mL 管中并连接,并使用 PBS/肝素溶液将蠕动泵连接到 25 G 蝶形导管。
- 用胶带将四肢固定在吸收性蓝色垫上,并确保将动物仰卧放在垫子上。对毛皮进行消毒,以避免在需要收集外周器官时交叉污染。
- 通过横向切口打开腹膜腔,露出横膈膜。
- 通过沿前轴/后轴的两截手术剪刀打开胸腔。
- 暴露心脏并将针头放在左腔室(仰卧位的心脏右侧)中,并在步骤9.1.3中放入蝶形导管中。
- 在右心室做一个小切口,让血液流出。
- 打开蠕动泵,开始用PBS/肝素冲洗血液。
注意:如果此步骤未充分执行,则在用福尔马林固定期间血液会凝结并阻止适当的灌注。 - 在所有血液被冲洗掉并且清除PBS开始从右心室流出后,将蠕动泵的入口切换到NBF溶液,并开始每只小鼠25mL的灌注。
- 提取大脑,放入至少 4 mL 的 NBF 中,固定后 24 小时。
- 使用50μm切片厚度的振动切片机上的冠状切片对大脑进行切片。
- 将每个部分放入一个 24 孔板的孔中,存储整个大脑中的切片。
- 在荧光显微镜下评估与荧光蛋白(例如mCherry或mCitrine)融合的化学遗传受体的表达,以识别显示表达的部分以确认位置。表情可能很暗淡。
- 使用以下方案对荧光团进行免疫染色:
- 将 3 段放入含有 10% 二抗宿主血清的 0.5 mL 溶液中,孵育 30 分钟。
- 以1:500为起点,以1:250 – 1:1,000稀释度将切片转移到一抗溶液中。
- 将切片与一抗在4°C下在用石蜡膜密封的微孔板中孵育过夜。
- 用PBS清洗切片,一次3次,每次5分钟。
- 在 10% 血清中每孔加入 0.5 mL 的二抗溶液。
- 在室温下孵育4小时。
- 用PBS清洗切片,一次3次,每次5分钟。
- 使用含有核染色的水性封片剂(例如 DAPI)安装在载玻片上。
- 使用共聚焦显微镜通过对整个切片进行切片扫描来评估定位和扩散。
- 通过测量目标大脑区域的荧光像素强度来评估表达强度,并与颅内注射对照进行比较。
- 或者,通过计数化学遗传受体染色的细胞与DAPI阳性细胞或细胞特异性标记物相比,评估阳性神经元的百分比。
- 通过在 50 μm 切片上进行苏木精染色并成像细胞丢失、细胞碎片积聚和其他严重损伤迹象来评估组织损伤。
- 为了评估细胞靶向的特异性,请对化学遗传受体和细胞特异性标志物进行双重免疫染色,如下所述。然后,如步骤9.8所示进行细胞阳性计数。
- 将 3 段放入含有 10% 二抗宿主血清的 0.5 mL 溶液中,孵育 30 分钟。
- 以1:250 – 1:1,000稀释度将切片转移到针对化学遗传受体荧光标志物的一抗溶液中,以1:500为起点。添加来自不同宿主物种的第二种一抗,靶向感兴趣的细胞特异性标志物(例如CamkIIa)。
- 将切片与一抗在4°C下在用石蜡膜密封的微孔板中孵育过夜。
- 用PBS清洗切片,一次3次,每次5分钟。
- 在两种二抗宿主种的 10% 血清中每孔加入 0.5 mL 二抗溶液。
注意:每种抗体应具有不同的荧光团,并且应与步骤9.10.2中的一抗具有反应性。 - 在室温下孵育4小时。
- 用PBS清洗切片,一次3次,每次5分钟。
- 安装在载玻片上,并用含有核染色的水性封片剂固定。
10. 通过免疫染色评估 c-Fos 的神经元活化
- 使用c-Fos一抗和具有不同于核染色的荧光标签的二抗进行本协议第9.5点中的c-Fos染色。
- 计算化学遗传受体靶向区域中c-Fos和核染色阳性的细胞百分比。
- 分析表达化学遗传受体并用化学遗传配体或载体对照处理的小鼠组以及用化学遗传配体或载体对照处理的野生型小鼠组中c-Fos阳性细胞核的百分比。
结果
执行ATAC协议的第一步是将FUS-BBBO靶向所需的大脑区域。例如,按照所描述的方案,用FUS-BBBO靶向海马体,并将造影剂和携带DREADD的AAV9注射到小鼠中,然后进行FLASH 3D MRI序列以获取小鼠大脑的图像。在海马区域(图6)和大脑的其他部位(图7)实现了T1信号增强。几周后,DREADD在目标大脑区域内表达。虽然许多DREADD与荧光报告基因(例如mCherry)融合,但发现用甲醛灌注和固定的过程会大大降低这些蛋白质的荧光。根据先前的经验,针对mCherry或DREADD的免疫染色可以更可靠地检测表达(图8)。在以前的实验中,~85%的小鼠在FUS-BBBO7之后表现出表达。对DREADD表达水平的简单测试是在细胞水平上测试它们的功能。例如,可以通过提供化学遗传配体或盐水对照(例如CNO19,去氯氮平28或其他29)并在心脏灌注和固定前等待2小时来完成。然后对脑切片进行c-Fos蛋白30和DREADD共免疫染色,c-Fos蛋白30表明神经元活动增强。如果与接受盐水7的组相比,与接受盐水7 的组相比,与未接受FUS-BBBO的对侧位点相比,接受化学遗传配体的组中c-Fos阳性的神经元核数量显着增加,则该实验被认为是成功的。值得注意的是,其中一些配体有可能非特异性地激活神经元而不表达DREADD。例如,CNO已被证明在小鼠中代谢为低水平的氯氮平,其穿过BBB并以高效激活DREADDs27。然而,它也被证明与非特异性位置结合。与每个实验一样,在化学遗传学研究中包括所有适当的对照至关重要31.一种可能的对照是向野生型小鼠施用化学遗传配体,无需程序,以排除单独药物对所需行为或组织学测定的影响。另一个对照可以包括四组:DREADD +配体,DREADD +载体,EGFP +配体,EGFP +载体,这将解释FUS-BBBO基因传递和化学遗传配体的任何潜在影响。
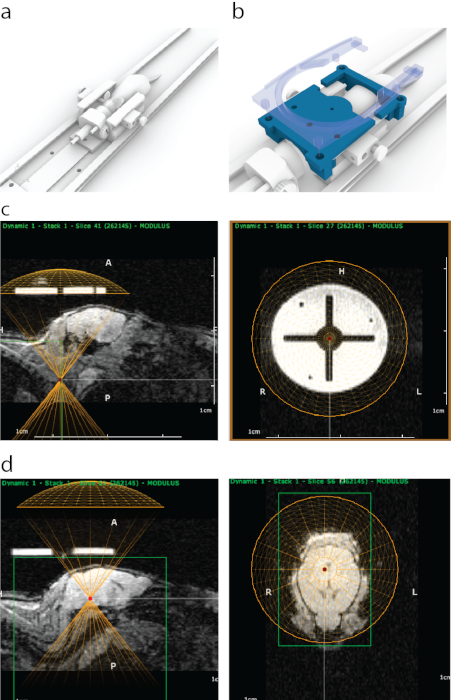
图 1:在 ATAC 中 MRI 引导下靶向 FUS 的过程。 (a) 用耳杆、鼻锥和可安装在MRI扫描仪内的平台放置鼠标。(b)在MRI中可见的3D打印导轨(蓝色)连接到耳杆框架的末端,然后用包含四个卡扣螺栓(半透明蓝色)的表面MRI线圈支架固定到位。(c)矢状MRI中3D打印指南的外观(左图),换能器的虚拟表示的底部与指南底部对齐(黄色半圆)。右图从冠状视图显示了MRI上3D打印指南的外观。明亮的圆圈由具有强烈MRI对比度的多晶喷气支撑材料制成。十字架是用塑料形成的。黄色圆圈表示与立体定位框架内的导轨同心对齐的换能器位置。(d)为了靶向大脑结构,在小鼠上方的z方向上移动虚拟换能器以匹配超声锥体/外壳的厚度。在这种情况下,由于水浴的厚度,探头在导轨上方移动了8.2毫米,以便准确瞄准。使用MRI成像数据选择大脑结构,然后将其MRI坐标写下来并输入立体定位机器。 请点击此处查看此图的大图。
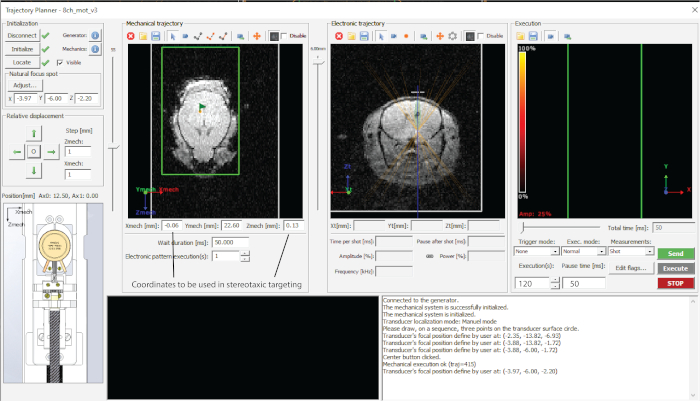
图 2:所用软件的界面。请点击此处查看此图的大图。
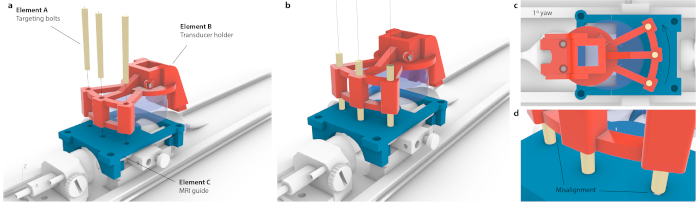
图3:将MRI坐标空间与立体定位仪器匹配的过程。(a) 传感器支架内的三个孔与MRI导轨内的三个孔对齐,并插入三个锥形瞄准螺栓,而不会对整个组件造成弯曲。(b) 理想的情况是,所有三个螺栓都位于孔的中心。(c) 如果对齐有任何不精确之处,并非所有三个螺栓都适合,例如,在 1° 的小、可能难以察觉的偏航的情况下,只有一个螺栓可以安装,而相反的螺栓将卡在 MRI 导轨上。或者,当螺栓被迫通过时,整个组件可能会有明显的弯曲。(d) 螺栓安装的放大视图。螺栓应同心放置以获得最佳精度。 请点击此处查看此图的大图。
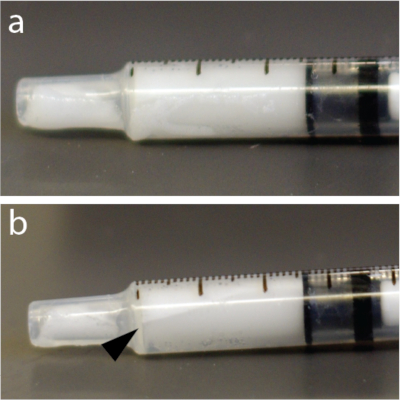
图4:注射器内微气泡的快速重新分布。 (a)注射器在混合后5秒被拍照。(b)一分钟后,在1毫升结核菌素注射器顶部附近有一个清晰可见的层,显示一些气泡浓缩物。这个例子特别使用了微气泡溶液。 请点击此处查看此图的大图。
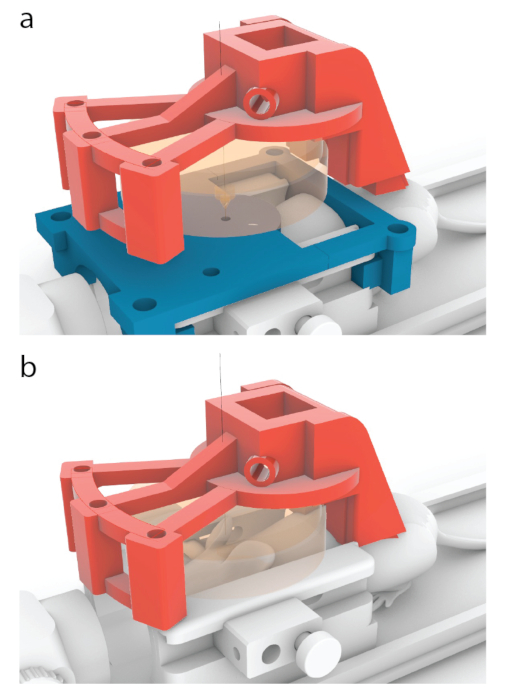
图 5:将换能器中心放在 MRI 导板中心上的过程。 (a)在本文所示的模型中,红色载体设计为从 图3b所示的位置向前移动10.56毫米,到此处显示的位置。(b)超声处理前取下蓝色MRI导板,并在小鼠和换能器之间应用超声凝胶(橙色),以确保超声通过。 请点击此处查看此图的大图。
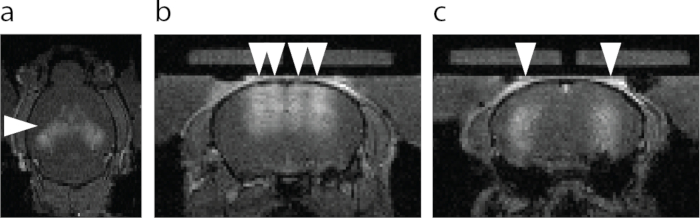
图 6:BBB 开口的 MRI 可视化。(a) BBB开口的轴视图。用箭头指定的较亮区域显示 MRI T1 造影剂的外渗。(b) 以FUS-BBBO(箭头)为目标的海马背侧和海马体上方皮层的冠状视图。(c) 以FUS-BBBO(箭头)为目标的中央海马体的日冕视图。 请点击此处查看此图的大图。

图 7:使用本文描述的三螺栓靶向系统靶向 4 个大脑位点的示例。带有箭头的区域显示BBB打开的部位,MRI造影剂的扩散。四个位点连续被瞄准,每个BBB开口之间从底部到顶部之间有~150秒。图像是在最后一次BBB打开后2分钟内拍摄的。比例尺为 2 毫米。 请点击此处查看此图的大图。
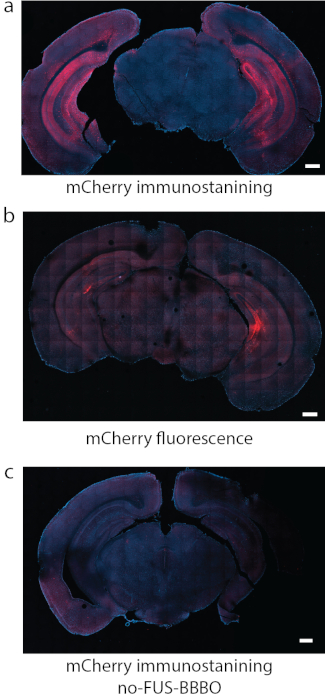
图 8:DREADD 表达式的检测。 (a)附着在DREADD上的荧光团的免疫染色,在这种情况下,mCherry是某些研究中一种可靠的检测方法。(b)在另一个代表性的部分中,使用与(a)相同的条件靶向海马体的DREADDs,mCherry的荧光本身产生强背景和相对较弱的信号。(c)作为阴性对照,使用接受全身注射AAV但没有进行FUS-BBBO的小鼠。mCherry免疫染色未发现显著表达。比例尺为 500 毫米(数据在 a、c 中改编自7 具有权限,版权所有 2020 Nature-Springer)。 请点击此处查看此图的大图。
讨论
ATAC需要成功实施多种技术才能成功神经调控特定的神经回路,包括精确的MRI引导靶向,FUS-BBBO和基因表达的组织学评估。开发了3D打印组件,以简化成像引导的FUS-BBBO对小脑结构的靶向。
MRI引导下聚焦超声(MRIgFUS)给药带来了许多挑战。首先,典型的MRI线圈空间有限,设计为仅容纳标本而不是超声硬件。MRI的较大孔径增加了设备成本并降低了图像质量,因为信号与线圈32的填充因子有关。因此,在MRI中放置在动物图像顶部的任何FUS硬件都会影响成像质量。其次,设计MRI兼容设备既困难又昂贵。MRI兼容材料需要具有抗磁性,在射频照射期间产生涡流的倾向性较低,并且在高磁场中具有低磁化率。在任何导电材料中,涡流的产生或其磁化率也会对成像质量产生负面影响。最后,与通常用于生产精确瞄准机(例如立体定位框架)的金属相比,可用的MRI兼容材料具有更低的杨氏模量和耐用性。用于位置调整的电机需要与MRI兼容,并且由于其尺寸而放置在MRI孔之外。这些电机必须使用MRI兼容材料与MRI孔内的换能器保持一定距离的连接。塑料翘曲、孔内缺乏足够的空间来实现坚固尺寸的组件以及改变整个大脑目标位置的空间不足等问题影响了先前工作中的目标准确性。
为了解决这些问题,决定在扫描仪之外进行MRI成像和FUS-BBBO管理。为了允许MRI引导,小鼠被放置在3D打印的约束装置内,该约束装置具有MRI可见的靶向指南,可用于定位MRI和立体图坐标空间中的小鼠大脑结构。由于小鼠头骨和靶向指南都牢固地连接到耳杆支架上(图1a,b),因此可以使用靶向指南来关联MRI图像中的空间坐标并将立体定位仪器归零。约束装置没有活动部件,也不包含换能器,这使我们能够使其既坚固又足够小,可以安装在MRI中,并消除了换能器电子设备的信号干扰。瞄准指南内的空间已被掏空,因为在MRI中可以看到对某些材料的3D打印支持(图1c)。在组件中引入了孔以实现立体测量校准(图3)。将超声换能器连接到立体定向的电极支架上,并如第4节所述进行靶向(图1d)。换能器应沿其长度由耳条外壳支撑,防止与水平平面的任何偏差。背腹方向的目标可以通过环形阵列中的相移来实现。
实际瞄准精度由超声聚焦和颅骨衰减决定。FUS-BBBO程序已经详细描述了大鼠11,并且已经在许多其他模式生物23,33,34和人类16,17中实施。超声焦点大小之间的关系与频率成反比,其中更高的频率可以导致更精确的传输。然而,颅骨的衰减随着频率35的增加而增加,这可能导致颅骨发热和皮质区域的损伤。确切的定位策略将取决于大脑部位。全宽半最大压力适合脑组织内的部位允许在许多大脑结构(如纹状体、中脑和海马体)中实现可预测和安全的 BBB 开放。靠近大脑底部的区域对小鼠构成了特定的挑战。小鼠大脑在背腹方向的尺寸约为8-10毫米,这与许多市售换能器的全宽半最大尺寸相当。因此,瞄准颅骨底部会导致耳道、口腔或气管中存在的骨骼和空气的超声波反射,从而导致不可预测的高压和低压模式36.其中一些压力可以超过惯性空化阈值,该阈值已被证明会导致出血和组织损伤37。对于位于颅底附近的靶向区域,可能优选使用交叉ATAC7,其中交叉遗传学38用于将基因表达限制在比FUS束靶向的区域更小的区域。在已发表的交叉ATAC示例中,在多巴胺能细胞中表达基因编辑酶(Cre38)的转基因动物已在含有多巴胺能细胞的区域的亚切片中用超声靶向。最后,可以用FUS靶向皮质区域,但超声波的衍射和反射可能会导致压力曲线不均匀。该协议不包括皮质区域的靶向,因为它将高度依赖于使用的物种;然而,已经观察到海马体7上方的皮层的一些靶向(例如,图7),表明至少在小鼠中,这是可能的。
化学遗传激活剂和剂量的选择将取决于具体的实验需求。许多研究,包括作者的研究之一7,显示没有显着的非特异性反应39,40,而较高剂量(例如,10mg / kg)会产生副作用,至少在某些情况下41。然而,与所有行为实验一样,由于CNO及其代谢物42的潜在脱靶活性,适当的对照31是必不可少的。这些控制可能包括对表达DREADD的动物施用CNO和盐水对照,对野生型动物施用CNO,或者在某些特定情况下比较分别表达和不表达化学遗传受体的大脑同侧和对侧位点。此外,最近的研究揭示了许多新的DREADD激动剂,其特异性有所提高28,29,43。其他化学遗传学受体5,25,44也可以与ATAC程序结合使用。
基因表达的组织学评估对于每只动物来说都是必要的。一小部分动物在FUS-BBBO7后表现出较差的基因表达。此外,有必要显示基因表达的空间准确性和特异性,因为错误靶向是可能的。值得注意的是,一些AAV可能显示出逆行或顺行追踪能力45 ,并且尽管超声靶向准确,但仍可能导致远离超声靶向部位的转染。如果表达的化学遗传受体与荧光团融合或共表达,则组织切片中的荧光团成像可能足以评估表达的定位和强度。然而,许多荧光蛋白被组织固定过程破坏,并且经常与DREADD一起使用的mCherry蛋白的免疫染色在以前的研究中产生了更好的信号7。最后,由于大脑某些部位(例如,海马体中的颗粒细胞层)神经元的密度,使用在IRES下表达的核定位荧光团而不是融合进行细胞计数可能是有益的,因为细胞核可以很容易地分割并用核染色剂复染,例如DAPI或TO-PRO-3。为了通过c-Fos染色评估神经调控,必须进行核复染并计数c-Fos阳性细胞核,而不是任何荧光信号。在某些情况下,细胞碎片可以显示荧光并混淆阳性细胞的测量。
FUS-BBBO的药物和基因递送的局限性包括分辨率低于侵入性颅内注射递送,以及需要大量注射药物或病毒载体。此外,虽然直接注射到大脑中会导致专用递送到注射部位,但FUS-BBBO使用静脉内途径,导致可能递送到外周组织。使用化学遗传学进行神经调控的局限性包括缓慢的时间尺度,这可能不足以满足某些需要快速改变神经调控强度的行为方案。
披露声明
无利益冲突。
致谢
这项研究得到了大脑和行为基金会,NARSAD青年研究员奖的支持。几个3D打印组件最初由Fabien Rabusseau(法国图像引导疗法)设计。作者感谢John Heath(加州理工学院)和Margaret Swift(加州理工学院)在准备手稿方面的技术帮助。
材料
| Name | Company | Catalog Number | Comments |
| 21-gauge needles (BD) | Fisher Scientific | 14826C | |
| 25-gauge butterfly catheter | Harvard Bioscience | 725966 | |
| 30-gauge needles (BD) | Fisher Scientific | 14826F | |
| Absorbent blue pad | Office Depot | 902406 | |
| Anti-c-Fos antibody | Santa Cruz Biotechnology | SC-253-G | |
| Anti-mCherry antibody | Thermofisher | PA534974 | |
| Bruker Biospec 70/30 | Bruker | custom | includes the RF coils |
| Clozapine-n-oxide | Tocris | 4936 | |
| Custom designed 3D printed mouse harnesses and MRIgFUS targeting components | ImageGuidedTherapy, Szablowski lab | custom | download from szablowskilab.org/downloads |
| Custom MRIgFUS machine | ImageGuidedTherapy | N/A | |
| Definity microbubbles | Lantheus | DE4 | |
| Degassed aquasonic/ultrasound gel | Fisher Scientific | 5067714 | |
| Depilation crème | Nair | n/a | |
| Eight-element annular array transducer | Imasonic Inc. | custom | |
| Ethanol Pads/Alcohol Swabs (70%) (BD) | Office Depot | 599893 | |
| Heparin | Sigma-Aldrich | H3149-25KU | |
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Ketamine | Patterson Veterinary | 07-890-8598 | |
| Neutral buffered formalin (10%) | Sigma-Aldrich | HT501128-4L | |
| Optical fiber hydrophone | Precision Acoustics | ||
| PE10 tubing | Fisher Scientific | NC1513314 | |
| Peristaltic pump | |||
| Phosphate-buffered saline (PBS) | Sigma-Aldrich | 524650-1EA | |
| Prohance contrast agent | Bracco | 0270-1111-04 | |
| Saline | Fisher Scientific | NC9054335 | |
| Secondary antibody, Donkey-anti goat | ThermoFisher | A-11055 | |
| Secondary antibody, Donkey-anti rabbit | ThermoFisher | 84546 | |
| Surgical scissors (straight) | Fisher Scientific | 17467480 | |
| ThermoGuide Software | ImageGuidedTherapy | ||
| Tissue glue (Gluture) | Fisher Scientific | NC9855218 | |
| Tuberculin Syringe (1 mL) (BD) | Fisher Scientific | 14823434 | |
| VeroClear 3D printable material | Stratasys | RGD810 | |
| Vialmix microbubble activation device | Lantheus | VMIX | |
| Vibrating microtome | Compresstome | VF-300 | |
| Xylazine | Sigma-Aldrich | X1251-1G |
参考文献
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
- Zhang, F., Wang, L. -. P., Boyden, E. S., Deisseroth, K. Channelrhodopsin-2 and optical control of excitable cells. Nature Methods. 3, 785-792 (2006).
- Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Roth, B. L. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proceedings of the National Academy of Sciences. 104, 5163-5168 (2007).
- Lerchner, W., et al. Reversible silencing of neuronal excitability in behaving mice by a genetically targeted, ivermectin-gated Cl- channel. Neuron. 54, 35-49 (2007).
- Magnus, C. J., et al. Chemical and genetic engineering of selective ion channel-ligand interactions. Science. 333, 1292-1296 (2011).
- Deeb, W., et al. Proceedings of the fourth annual deep brain stimulation think tank: a review of emerging issues and technologies. Frontiers in Integrative Neuroscience. 10, 38 (2016).
- Szablowski, J. O., Lee-Gosselin, A., Lue, B., Malounda, D., Shapiro, M. G. Acoustically targeted chemogenetics for the non-invasive control of neural circuits. Nature Biomedical Engineering. 2, 475-484 (2018).
- Elias, W. J., et al. A pilot study of focused ultrasound thalamotomy for essential tremor. New England Journal of Medicine. 369, 640-648 (2013).
- Burgess, A., Hynynen, K. Noninvasive and targeted drug delivery to the brain using focused ultrasound. ACS Chemical Neuroscience. 4, 519-526 (2013).
- Kinoshita, M., McDannold, N., Jolesz, F. A., Hynynen, K. Noninvasive localized delivery of Herceptin to the mouse brain by MRI-guided focused ultrasound-induced blood-brain barrier disruption. Proceedings of the National Academy of Sciences U. S. A. 103, 11719-11723 (2006).
- Samiotaki, G., Acosta, C., Wang, S., Konofagou, E. E. Enhanced delivery and bioactivity of the neurturin neurotrophic factor through focused ultrasound-mediated blood-brain barrier opening in vivo. Journal of Cerebral Blood Flow & Metabolism. 35, 611-622 (2015).
- O'Reilly, M. A., Waspe, A. C., Chopra, R., Hynynen, K. MRI-guided disruption of the blood-brain barrier using transcranial focused ultrasound in a rat model. Journal of Visualized Experiments. (61), e3555 (2012).
- Thévenot, E., et al. Targeted delivery of self-complementary adeno-associated virus serotype 9 to the brain, using magnetic resonance imaging-guided focused ultrasound. Human gene Therapy. 23, 1144-1155 (2012).
- Hsu, P. -. H., et al. Noninvasive and targeted gene delivery into the brain using microbubble-facilitated focused ultrasound. PloS One. 8, 58682 (2013).
- Wang, S., Olumolade, O. O., Sun, T., Samiotaki, G., Konofagou, E. E. Noninvasive, neuron-specific gene therapy can be facilitated by focused ultrasound and recombinant adeno-associated virus. Gene Therapy. 22, 104 (2015).
- Downs, M. E., et al. Long-Term Safety of Repeated Blood-Brain Barrier Opening via Focused Ultrasound with Microbubbles in Non-Human Primates Performing a Cognitive Task. PLoS One. 10, 0125911 (2015).
- Lipsman, N., et al. Blood-brain barrier opening in Alzheimer's disease using MR-guided focused ultrasound. Nature Communications. 9, 2336 (2018).
- Carpentier, A., et al. Clinical trial of blood-brain barrier disruption by pulsed ultrasound. Science Translational Medicine. 8, 343 (2016).
- Sternson, S. M., Roth, B. L. Chemogenetic Tools to Interrogate Brain Functions. Annual Reviews Neurosciences. 37, 387-407 (2014).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63, 27-39 (2009).
- Zhu, H., et al. Chemogenetic inactivation of ventral hippocampal glutamatergic neurons disrupts consolidation of contextual fear memory. Neuropsychopharmacology. 39, 1880-1892 (2014).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Noninvasive, transcranial and localized opening of the blood-brain barrier using focused ultrasound in mice. Ultrasound in Medicine & Biology. 33, 95-104 (2007).
- Thévenot, E., et al. Targeted delivery of self-complementary adeno-associated virus serotype 9 to the brain, using magnetic resonance imaging-guided focused ultrasound. Human Gene Therapy. 23, 1144-1155 (2012).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220, 640-646 (2001).
- Yang, F. -. Y., Fu, W. -. M., Chen, W. -. S., Yeh, W. -. L., Lin, W. -. L. Quantitative evaluation of the use of microbubbles with transcranial focused ultrasound on blood-brain-barrier disruption. Ultrasonics Sonochemistry. 15, 636-643 (2008).
- Vardy, E., et al. A New DREADD Facilitates the Multiplexed Chemogenetic Interrogation of Behavior. Neuron. 86, 936-946 (2015).
- Thompson, K. J., et al. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. ACS Pharmacology and Translational Sciences. 1, 61-72 (2018).
- Gomez, J. L., et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357, 503-507 (2017).
- Nagai, Y., et al. Deschloroclozapine: a potent and selective chemogenetic actuator enables rapid neuronal and behavioral modulations in mice and monkeys. bioRxiv. , 854513 (2019).
- Thompson, K. J., et al. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. ACS Pharmacology and Translational Science. 1, 61-72 (2018).
- Bullitt, E. Expression of c-fos-like protein as a marker for neuronal activity following noxious stimulation in the rat. Journal of Comparative Neurology. 296, 517-530 (1990).
- Mahler, S. V., Aston-Jones, G. CNO Evil? Considerations for the use of DREADDs in behavioral neuroscience. Neuropsychopharmacology. 43, 934 (2018).
- Gruber, B., Froeling, M., Leiner, T., Klomp, D. W. J. RF coils: A practical guide for nonphysicists. Journal of Magnetic Resonance Imaging. 48, 590-604 (2018).
- Treat, L. H., McDannold, N., Vykhodtseva, N., Hynynen, K. Transcranial MRI-guided focused ultrasound-induced blood-brain barrier opening in rats. IEEE. 2, 998-1000 (2004).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Feasibility of transcranial, localized drug-delivery in the brain of Alzheimer's-model mice using focused ultrasound. IEEE. 2, 988-991 (2005).
- Cobbold, R. S. . Foundations of Biomedical ultrasound. , (2006).
- Younan, Y., et al. Influence of the pressure field distribution in transcranial ultrasonic neurostimulation. Medical Physics. 40, 082902 (2013).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Targeted disruption of the blood-brain barrier with focused ultrasound: association with cavitation activity. Physics in Medicine and Biology. 51, 793-807 (2006).
- Branda, C. S., Dymecki, S. M. Talking about a Revolution: The Impact of Site-Specific Recombinases on Genetic Analyses in Mice. Developmental Cell. 6, 7-28 (2004).
- Jendryka, M., et al. Pharmacokinetic and pharmacodynamic actions of clozapine-N-oxide, clozapine, and compound 21 in DREADD-based chemogenetics in mice. Scientific Reports. 9, 4522 (2019).
- Manvich, D. F., et al. The DREADD agonist clozapine N-oxide (CNO) is reverse-metabolized to clozapine and produces clozapine-like interoceptive stimulus effects in rats and mice. Scientific Reports. 8, 3840 (2018).
- Martinez, V. K., et al. Off-Target Effects of Clozapine-N-Oxide on the Chemosensory Reflex Are Masked by High Stress Levels. Frontiers in Physiology. 10, 521 (2019).
- Gomez, J. L., et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357, 503-507 (2017).
- Bonaventura, J., et al. High-potency ligands for DREADD imaging and activation in rodents and monkeys. Nature Communications. 10, 1-12 (2019).
- Roth, B. L. DREADDs for Neuroscientists. Neuron. 89, 683-694 (2016).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of Transduction Efficiency, Tropism and Axonal Transport of AAV Serotypes 1, 2, 5, 6, 8 and 9 in the Mouse Brain. PLoS One. 8, 76310 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。