A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الجمع بين التهجين الفلوري المتعدد في الموقع مع الكيمياء الهيستولوجية المناعية الفلورية على أقسام دماغ الفأر الطازجة المجمدة أو الثابتة
In This Article
Summary
يصف هذا البروتوكول طريقة للجمع بين التهجين الفلوري في الموقع (FISH) والكيمياء الهيستولوجية المناعية الفلورية (IHC) في كل من أقسام دماغ الفأر المجمدة والثابتة الطازجة ، بهدف تحقيق إشارة FISH متعددة العلامات و IHC مضان. استهدفت المدينة العالمية للخدمات الإنسانية البروتينات السيتوبلازمية والأغشية المرفقة.
Abstract
التهجين الفلوري في الموقع (FISH) هو تقنية جزيئية تحدد الوجود والتوزيع المكاني لنسخ الحمض النووي الريبي المحددة داخل الخلايا. عادة ما يتطلب التنميط الظاهري الكيميائي العصبي للخلايا العصبية المحددة وظيفيا وضع علامات متزامنة مع أجسام مضادة متعددة (استهداف البروتين) باستخدام الكيمياء الهيستولوجية المناعية (IHC) وتحسين التهجين في الموقع (استهداف الحمض النووي الريبي) ، جنبا إلى جنب. يمكن تحقيق "توقيع كيميائي عصبي" لتوصيف خلايا عصبية معينة ، لكن العوامل المعقدة تشمل الحاجة إلى التحقق من أهداف FISH و IHC قبل الجمع بين الطرق ، والعدد المحدود من الحمض النووي الريبي والبروتينات التي يمكن استهدافها في وقت واحد داخل نفس قسم الأنسجة.
هنا نصف بروتوكولا ، باستخدام كل من مستحضرات دماغ الفأر الطازجة المجمدة والثابتة ، والتي تكتشف العديد من mRNAs والبروتينات في نفس قسم الدماغ باستخدام RNAscope FISH متبوعا بتلطيخ مناعي مضان ، على التوالي. نستخدم الطريقة المدمجة لوصف نمط التعبير عن mRNAs منخفضة الوفرة (على سبيل المثال ، مستقبلات الجالانين 1) و mRNAs عالية الوفرة (على سبيل المثال ، ناقل الجلايسين 2) ، في نوى جذع الدماغ المناعية المحددة كيميائيا.
تمتد الاعتبارات الرئيسية لوضع العلامات البروتينية في اتجاه مجرى اختبار FISH إلى ما هو أبعد من تحضير الأنسجة وتحسين وضع العلامات على مسبار FISH. على سبيل المثال ، وجدنا أن خصوصية ربط الأجسام المضادة ووضع العلامات يمكن أن تتأثر بشكل ضار بخطوة البروتياز داخل فحص مسبار FISH. تحفز البروتياز الانقسام المائي لروابط الببتيد ، مما يسهل دخول مسبار FISH إلى الخلايا ، ومع ذلك قد يهضم أيضا البروتين المستهدف من قبل اختبار IHC اللاحق ، مما ينتج عنه ارتباط خارج الهدف. الموقع تحت الخلوي للبروتين المستهدف هو عامل آخر يساهم في نجاح IHC بعد فحص مسبار FISH. لاحظنا أن خصوصية IHC يجب الاحتفاظ بها عندما يكون البروتين المستهدف مرتبطا بالغشاء ، في حين أن IHC الذي يستهدف البروتين السيتوبلازمي يتطلب استكشاف الأخطاء وإصلاحها على نطاق واسع. أخيرا ، وجدنا أن التعامل مع الأنسجة المجمدة الثابتة المثبتة على الشريحة أكثر صعوبة من الأنسجة المجمدة الطازجة ، ولكن جودة IHC كانت أفضل بشكل عام مع الأنسجة المجمدة الثابتة ، عند دمجها مع RNAscope.
Introduction
عادة ما يتم تحديد البروتينات و mRNAs التي تحدد المجموعات الفرعية للخلايا العصبية كيميائيا بمزيج من الكيمياء الهيستولوجية المناعية (IHC) و / أو التهجين في الموقع (ISH) ، على التوالي. يسهل الجمع بين تقنيات ISH و IHC توصيف أنماط التوطين المشترك الفريدة للخلايا العصبية الوظيفية (الترميز الكيميائي العصبي) من خلال زيادة قدرة وضع العلامات المتعددة إلى أقصى حد.
تتمتع طرق ISH الفلورية (FISH) ، بما في ذلك RNAscope ، بحساسية وخصوصية أعلى مقارنة بطرق الكشف عن الحمض النووي الريبي السابقة مثل ISH المشع و ISH الكروموجيني غير المشع. يتيح FISH تصور نسخ mRNA المفردة كبقع ملطخة مثقوبة1. علاوة على ذلك ، يسمح اختبار RNAscope بتسمية عدد متزايد من أهداف الحمض النووي الريبي في وقت واحد ، باستخدام علامات فلوروفور مختلفة. على الرغم من هذه المزايا ، قد تؤثر القيود التقنية على عدد الفلوروفورات / الكروموجينات التي يمكن استخدامها في تجربة واحدة. وتشمل هذه توافر مجموعات مرشحات المجهر. تتفاقم هذه الاعتبارات عندما يستخدم التحديد الكيميائي العصبي FISH و IHC مجتمعين ، مقارنة باستخدام كل تقنية على حدة ، لأن الخطوات المتأصلة المثلى لطريقة واحدة قد تكون ضارة بالأخرى.
أظهر التطبيق السابق ل FISH جنبا إلى جنب مع IHC التعبير عن أهداف خلوية محددة في الأورام اللمفاوية للخلايا البائيةالبشرية 2 ، وأجنة الفرخ3 ، وأجنة الزرد4 ، وشبكية العين5 للفأر ، وخلايا الأذن الداخليةللفأر 6. في هذه الدراسات ، كان تحضير الأنسجة إما بارافين مثبت بالفورمالين مضمنا (FFPE) 2،3،5 أو حامل كامل طازج4،6. طبقت دراسات أخرى RNAscope كروموجينيك على مستحضرات دماغ الفئران والفئران الثابتة7،8،9. على وجه الخصوص ، Baleriola et al.8 وصفوا مستحضرين مختلفين للأنسجة ل ISH-IHC مجتمعة. أقسام دماغ الفأر الثابتة وأقسام الدماغ البشري FFPE. في منشور حديث ، قمنا بدمج FISH و IHC الفلوري على أقسام مجمدة طازجة ، لتصور mRNA منخفض الوفرة في وقت واحد (مستقبلات الجالانين 1 ، GalR1) ، mRNA عالي الوفرة (ناقل الجلايسين 2 ، GlyT2) وناقل الأسيتيل كولين الحويصلي (vAChT) بروتين10 في تكوين شبكي جذع الدماغ.
نواة الجهاز الانفرادي (NTS) هي منطقة دماغية رئيسية تشارك في الوظيفة اللاإرادية. تقع هذه المجموعة غير المتجانسة من الخلايا العصبية في الدماغ الخلفي ، وتتلقى وتدمج عددا كبيرا من الإشارات اللاإرادية ، بما في ذلك تلك التي تنظم التنفس. يحتوي NTS على العديد من المجموعات العصبية ، والتي قد تتميز ظاهريا بنمط التعبير عن أهداف mRNA بما في ذلك GalR1 و GlyT2 وعلامات البروتين لإنزيم التيروزين هيدروكسيلاز (TH) وعامل النسخ Paired-like homeobox 2b (Phox2b).
يوصي مالك RNAscope بتحضير الأنسجة المجمدة الطازجة ، ولكن الأنسجة المحضرة عن طريق تثبيت نضح الدم عبر القلب الحيواني بالكامل ، جنبا إلى جنب مع الحماية بالتبريد على المدى الطويل (التخزين عند -20 درجة مئوية) لأقسام الأنسجة المجمدة الثابتة ، أمر شائع في العديد من المختبرات. ومن ثم ، سعينا إلى وضع بروتوكولات ل FISH بالاشتراك مع المدينة العالمية للخدمات الإنسانية باستخدام مستحضرات الأنسجة الطازجة المجمدة والثابتة. هنا ، نقدم أقسام الدماغ المجمدة الطازجة والمجمدة: (1) بروتوكول ل FISH المشترك و IHC الفلوري (2) وصف لجودة mRNA وعلامات البروتين المنتجة ، عند استخدام كل مستحضر (3) وصف لتعبير GalR1 و GlyT2 في NTS.
كشفت دراستنا أنه عند دمجها مع منهجية RNAscope ، تباين نجاح IHC في المستحضرات الطازجة المجمدة والمجمدة الثابتة ، وكان يعتمد على توطين البروتينات المستهدفة داخل الخلية. في أيدينا ، كان وضع العلامات على البروتين المرتبط بالغشاء ناجحا دائما. في المقابل، تطلب IHC للبروتين السيتوبلازمي استكشاف الأخطاء وإصلاحها حتى في الحالات التي تم فيها التعبير عن البروتين السيتوبلازمي بشكل مفرط في معدل وراثيا (Phox2b-GFP)11. أخيرا ، بينما يتم التعبير عن GalR1 في الخلايا العصبية غير الكاتيكولامينية في NTS ، فإن تعبير GlyT2 غائب في NTS.
Protocol
يمكن العثور على ملخص لخطوات المعالجة المسبقة للأنسجة في الشكل 1. تم تنفيذ جميع الإجراءات وفقا للجنة رعاية والأخلاقيات بجامعة نيو ساوث ويلز وفقا للمبادئ التوجيهية لاستخدام ورعاية للأغراض العلمية (المجلس الوطني الأسترالي للصحة والبحوث الطبية).
1. إعداد عينة من أنسجة المخ المجمدة الطازجة
- التروية عبر القلب
- تحضير الهيبارين (2500 وحدة / لتر) 0.1 M العازلة الفوسفات (PB) ، درجة الحموضة 7.5. اصنع ملاطا إيثانول الثلج الجاف عن طريق خلط الثلج الجاف مع الإيثانول. ستكون درجة حرارة هذا حوالي -72 درجة مئوية وسيتم استخدامه للتجميد الفوري للأنسجة المحصودة.
- القتل الرحيم للبالغين C57BL / 6 و Phox2b-GFP11 (معرف قاعدة بيانات معلوماتية جينوم الماوس MGI: 5776545) عن طريق التخدير باستخدام بنتوباربيتال الصوديوم (70 مجم / كجم ، i.p.) ، باستخدام مقياس إبرة 27.5 بوصة.
تنبيه: بنتوباربيتال هو باربيتورات. وهو شديد السمية في الجرعات العالية وقد يسبب الوفاة عن طريق توقف التنفس. استشر إرشادات الرعاية الصحية المحلية والقانونية وسلامة المواد قبل الاستخدام. - كشف القلب وقنية البطين الأيسر بإبرة سحب (مقياس 23 بوصة). إجراء التروية عبر القلب مع الهيبارين 0.1 M PB حتى يزول الدم (2-3 دقائق) بمعدل تدفق 11-13 مل / دقيقة. تحديد تطهير الدم من خلال مراقبة لون الكبد والاندفاع من الأذين الأيمن12.
- اعزل الدماغ عن تجويف الجمجمة ، وقم بتضمينه على الفور في مركب درجة حرارة القطع المثلى (OCT) في رقائق كريومولد أو رقائق الألومنيوم وضعه على حمام الإيثانول المثلج الجاف. قم بتخزين الأنسجة المدمجة المجمدة في حاوية محكمة الإغلاق عند -80 درجة مئوية لمدة تصل إلى 3 أشهر.
- تقسيم الأنسجة الطازجة المجمدة
- اضبط درجة حرارة cryostat على -20 درجة مئوية. اترك الأنسجة المضمنة في OCT وظرف cryostat في cryostat لمدة ~ 30 دقيقة للسماح بالتوازن مع درجة الحرارة الجديدة.
ملاحظة: الحفاظ على الأنسجة المجمدة في جميع الأوقات; انقل الأنسجة من الفريزر -80 درجة مئوية إلى كريوستات على الثلج الجاف. - ثبت المنديل في ظرف التبريد المبرد مسبقا باستخدام مركب OCT. في هذا البروتوكول ، تم تركيب كتل الأنسجة على ظرف في الطائرة الإكليلية.
ملاحظة: قم بقص OCT الزائد من الأنسجة ، باستخدام شفرة حلاقة ، لتقليل كمية OCT التي يتم قطعها بواسطة cryostat ونقلها لاحقا إلى الشريحة الزجاجية. - قطع مقاطع إكليلية بسمك 14 ميكرومتر وتركيبها على شرائح مجهرية زجاجية مشحونة.
- قم بتسخين الشرائح إلى درجة حرارة الغرفة قبل تركيب الأقسام. بمجرد تركيب القسم ، احتفظ بالشرائح في مربع شرائح في جهاز التبريد.
- إذا كانت هناك حاجة إلى تركيب أكثر من قسم واحد على شريحة واحدة ، فقم بتدفئة المنطقة للقسم الثاني عن طريق وضع إصبع على الجانب الآخر من الشريحة لمدة 5-10 ثوان للمساعدة في التصاق القسم بالشريحة. لن يعلق قسم الأنسجة الباردة على شريحة باردة. يجب أن تلتصق الأقسام بالشرائح المسطحة ؛ سيؤدي الطي إلى سقوطها من الشرائح أثناء خطوات الغسيل.
- إذا لوحظت تشققات في الأقسام ، فقم بزيادة درجة حرارة cryostat بمقدار 1-5 درجة مئوية لتجنب ذلك. من المهم بشكل خاص وضع أقسام الأنسجة على مقربة من بعضها البعض على نفس الشريحة. هذا سيمنع إهدار مجسات وكواشف FISH أثناء الفحص.
- قم بتخزين أقسام المناديل المثبتة على شرائح زجاجية في حاوية محكمة الغلق عند -80 درجة مئوية لمدة تصل إلى 6 أشهر.
ملاحظة: احتفظ بالأقسام مجمدة في جميع الأوقات وتجنب دورات الذوبان بالتجميد ، لمنع تدهور الحمض النووي الريبي. انقل صندوق الشرائح من داخل cryostat إلى الفريزر -80 درجة مئوية على الثلج الجاف.
- اضبط درجة حرارة cryostat على -20 درجة مئوية. اترك الأنسجة المضمنة في OCT وظرف cryostat في cryostat لمدة ~ 30 دقيقة للسماح بالتوازن مع درجة الحرارة الجديدة.
- تثبيت الأنسجة الطازجة المجمدة
- في اليوم الذي سيتم فيه إجراء فحص مسبار FISH ، قم بإعداد 4٪ بارافورمالدهيد (PFA) في 0.1 M PB ، pH 7.5 (محلول PFA 4٪). قم بالترشيح عن طريق المرور عبر ورق الترشيح (الدرجة 1: 11 ميكرومتر ، جدول المواد) في قمع Buchner أو مرشح البوتقة.
تنبيه: PFA ضار وسام عن طريق ملامسة الجلد أو استنشاقه. يجب تنفيذ جميع الإجراءات باستخدام محلول PFA في خزانة غطاء الدخان. يجب التخلص من نفايات محلول PFA بعناية باتباع بروتوكولات السلامة المؤسسية. - قم بتبريد محلول PFA 4٪ إلى 4 درجات مئوية. انقل المنديل المثبت على الشريحة من الفريزر -80 درجة مئوية في الثلج الجاف واغمره على الفور في المثبت المبرد مسبقا لمدة 15 دقيقة.
ملاحظة: من المهم ألا تتجاوز خطوة التثبيت هذه 15 دقيقة لأن التثبيت الزائد سيؤدي إلى وضع علامات خلفية غير محددة.
- في اليوم الذي سيتم فيه إجراء فحص مسبار FISH ، قم بإعداد 4٪ بارافورمالدهيد (PFA) في 0.1 M PB ، pH 7.5 (محلول PFA 4٪). قم بالترشيح عن طريق المرور عبر ورق الترشيح (الدرجة 1: 11 ميكرومتر ، جدول المواد) في قمع Buchner أو مرشح البوتقة.
- جفاف الأنسجة الطازجة المجمدة
- تجفيف أقسام الأنسجة عن طريق غمر الشرائح بتركيزات متدرجة من الإيثانول. في جرة كوبلين ، اغمر أولا في 50٪ ، ثم 70٪ وأخيرا الإيثانول المطلق ، لمدة 5 دقائق لكل منهما في درجة حرارة الغرفة. كرر حضانة الإيثانول المطلقة النهائية مرة ثانية.
- قم بتجفيف الشرائح في الهواء ، وحدد مجموعة الأقسام باستخدام قلم حاجز كاره للماء ، مما يضمن تقليل المساحة الداخلية إلى الحد الأدنى.
ملاحظة: تأكد من أن الشريحة الزجاجية جافة تماما قبل رسم الحاجز الكارهة للماء. يجب أن يحيط الحاجز الكارهة للماء بأقسام الأنسجة تماما دون فجوات ويجب أن يكون جافا قبل المعالجة الإضافية.
2. إعداد عينة من أنسجة المخ المجمدة الثابتة
- تثبيت التروية عبر القلب
- القتل الرحيم للفئران عن طريق التخدير باستخدام بنتوباربيتال الصوديوم (70 مجم / كجم ، i.p) متبوعا بالتروية عبر القلب ، أولا بمحلول 0.1 M PB ثم 4٪ PFA. ثبت مع 10 دقائق من التروية عند 11-13 مل / دقيقة.
- عزل الدماغ عن تجويف الجمجمة بعد تثبيت التروية والغمر طوال الليل في محلول PFA 4٪ ، عند 4 درجات مئوية.
- تقسيم الأنسجة من الأنسجة الثابتة
- شطف الدماغ في محلول ملحي معقم 0.1 M الفوسفات المخزن (PBS) قبل إزالة الطبقات السحائية ، بمساعدة المجهر تشريح ، باستخدام ملقط دقيق.
- قطع الدماغ بدقة إلى كتل (فصل جذع الدماغ عن الدماغ الأمامي قبل تقسيم الاهتزاز) باستخدام مصفوفة الدماغ (جدول المواد). على وجه التحديد ، قطع جذع الدماغ ذيليا عند الارتباك الهرمي وتشريح المخيخ. وبالمثل ، قطع الدماغ الأمامي على الفور rostral إلى chiasm البصرية.
- ثبت المنديل على ظرف ميكروتوم مهتز باستخدام cyanoacrylate وقم بتضمينه في محلول أجار 2٪.
- قطع أقسام الأنسجة بسمك 30 ميكرومتر باستخدام ميكروتوم اهتزازي وتخزين المقاطع المقطوعة في محلول واقي من التبريد (30٪ سكروز خال من RNase ، 30٪ إيثيلين جلايكول ، 1٪ بولي فينيل بيروليدون (PVP-40) ، في 0.1 M PB ، درجة الحموضة 7.4). يمكن تخزين أقسام الأنسجة في مادة واقية من البرد عند -20 درجة مئوية لمدة تصل إلى 6 أشهر.
- تحضير الأقسام الثابتة قبل FISH
- في يوم FISH ، اغسل الأجزاء العائمة الحرة ثلاث مرات ، لمدة 10 دقائق لكل غسلة ، لإزالة محلول الحماية من التبريد. للغسيل ، ضع الأقسام في 0.1 متر PBS في لوحة زراعة خلية 12 بئرا وحركها على شاكر منصة دوارة (90-100 دورة في الدقيقة).
- بعد الغسيل ، استخدم فرشاة الرسم لتركيب أقسام على شرائح مجهرية زجاجية وجفف في الهواء لمدة 2 ساعة على الأقل.
ملاحظة: يجب أن تلتصق الأقسام بشكل مسطح على الشرائح لأن أي طيات واضحة ستؤدي إلى فصلها أثناء الغسيل. - باستخدام قلم حاجز كاره للماء ، ارسم حاجزا حول الأقسام لتقييد كواشف FISH بالأقسام. مرة أخرى ، من المهم تقليل المساحة الداخلية للمخطط المرسوم بقلم الحاجز.
نقطة الانهيار المحتملة: يمكن تخزين الأقسام في درجة حرارة الغرفة ، طوال الليل ، لمواصلة الفحص في اليوم التالي.
3. فحص الأسماك
ملاحظة: ينطبق باقي البروتوكول على كل من الأنسجة الطازجة المجمدة والمجمدة.
- تحضير الكواشف والأدوات لخطوات التهجين والتضخيم.
- اضبط حاضنة الطاولة وحمام مائي على 40 درجة مئوية.
- قم بإعداد غرفة مرطبة ومحمية من الضوء لاحتضان الشرائح. يمنع الترطيب جفاف الأنسجة - توجد الشرائح بشكل آمن فوق خزان رطب. من الناحية المثالية ، الغرفة مصنوعة من البوليسترين شديد التحمل ، وهي مقاومة للضوء ومحكمة الإغلاق للحفاظ على جو بخار الماء المشبع. يعتمد إغلاق الغرفة على الحد الأدنى من الاحتكاك لتجنب الحركة. استخدمنا صندوق شرائح مبطن بمناديل مختبرية مبللة (جدول المواد) في الأسفل. ضع صندوق الشريحة داخل الحاضنة لتسخينه مسبقا إلى 40 درجة مئوية.
- قم بتسخين 50x Wash Buffer (جدول المواد) والمجسات إلى 40 درجة مئوية لمدة 10 دقائق ، باستخدام حمام مائي ، ثم تبرد إلى درجة حرارة الغرفة.
- تحضير 1 لتر من 1x Wash Buffer من تركيز المخزون 50x.
- تحضير خليط المسبار (جدول المواد): المسبار C1 جاهز للاستخدام بتركيز المخزون بينما يتم شحن مجسات C2 و C3 بتركيز 50x وتتطلب تخفيفا مع المادة المخففة المتوفرة في المجموعة.
ملاحظة: يمكن تخزين مخاليط المسبار في درجة حرارة 4 درجات مئوية لمدة تصل إلى 6 أشهر.
- علاج الأنزيم البروتيني
- احتضان الأقسام مع Protease III (جدول المواد) في درجة حرارة الغرفة لمدة 30 دقيقة.
ملاحظة: تأكد من أن البروتياز الثالث وكواشف الحضانة في العمليات النهائية (خليط المسبار ، محاليل التضخيم ، العازلة المانعة وأمصال الأجسام المضادة) تغطي الأقسام بالكامل. يمكن استخدام طرف ماصة لنشر الكاشف على القسم لتغطية المنطقة بأكملها داخل الحاجز الكارهة للماء. - اغسل الشرائح مرتين باستخدام 0.1 متر PBS ، لمدة 2 دقيقة في كل مرة ، في طبق بتري بلاستيكي مربع كبير. هنا تم استخدام طبق فحص حيوي مربع 245 مم × 245 مم (جدول المواد). امسك من جانب واحد من الطبق وقم بإمالته برفق 3-5 مرات. بعد الغسيل ، نفض الغبار الزائد 0.1 متر PBS من الشريحة وأضف الكاشف التالي على الفور. لا تدع أقسام الأنسجة تجف.
ملاحظة: أثناء كل غسلة ، يتم غمر الشرائح في محلول في درجة حرارة الغرفة. هذا هو سير العمل لجميع خطوات الغسيل اللاحقة. تزيح المقاطع الثابتة بسمك 30 ميكرومتر من الشرائح بسهولة أكبر من المقاطع التي يبلغ سمكها 14 ميكرومتر ، وتكون لطيفة أثناء الغسيل.
- احتضان الأقسام مع Protease III (جدول المواد) في درجة حرارة الغرفة لمدة 30 دقيقة.
- التهجين والتضخيم
- بعد غسل محلول البروتياز ، ضع الشرائح في الغرفة الرطبة والمدفأة. احتضان الأقسام بخليط مسبار (جدول المواد) لمدة 2 ساعة عند 40 درجة مئوية داخل حاضنة منضدة.
ملاحظة: تأكد من وجود أقسام 2 على الأقل مخصصة لتحقيقات التحكم الإيجابية والسلبية لتقييم جودة عينة الحمض النووي الريبي والنفاذية المثلى. تستهدف مجسات التحكم الإيجابي جينات التدبير المنزلي. هنا ، كانت هذه مزيجا من الحمض النووي الريبي الذي يستهدف يوبيكويتين سي (UBC ؛ وفرة عالية) ، إيزوميراز الببتيد بروبيل B (PPIB ؛ وفرة معتدلة) وبوليميراز الحمض النووي الريبي 2a (POLR2A ؛ وفرة منخفضة). تستهدف مجسات التحكم السلبية جين اختزال 4-هيدروكسي-تتراهيدروديبيكولينات البكتيري (DapB) ، والذي عادة ما يكون غائبا في عينات دماغ الفئران. تشير إشارة DapB الإيجابية إلى إشارة غير محددة و / أو تلوث بكتيري للعينة. - بعد التهجين مع خليط المسبار ، تتكون خطوات تضخيم الإشارة من الحضانة مع Amp 1-FL (30 دقيقة) ، ثم مع Amp 2-FL (15 دقيقة) ، تليها Amp 3-FL (30 دقيقة) وأخيرا Amp 4-FL (15 دقيقة) - كل منها عند 40 درجة مئوية. باستخدام زجاجات القطارة المتوفرة ، قم بتغطية أقسام الأنسجة بمحلول التضخيم. انتقل إلى فحص IHC بعد خطوة التضخيم الأخيرة.
- شطف الشرائح مع Wash Buffer مرتين لمدة 2 دقيقة بين تهجين المسبار وكل خطوة تضخيم.
- بعد غسل محلول البروتياز ، ضع الشرائح في الغرفة الرطبة والمدفأة. احتضان الأقسام بخليط مسبار (جدول المواد) لمدة 2 ساعة عند 40 درجة مئوية داخل حاضنة منضدة.
4. فحص المدينة العالمية للخدمات الإنسانية
- خطوة حظر المدينة العالمية للخدمات الإنسانية
- لمنع الارتباط غير النوعي للأجسام المضادة ، احتضان الأقسام لمدة 1 ساعة في درجة حرارة الغرفة بمحلول مانع يحتوي على 10٪ مصل حصان طبيعي ، 0.3٪ Tween20 in 1x TBSm (50 mM Tris-Cl ، درجة الحموضة 7.5 ، 150 مللي مول كلوريد الصوديوم ، 0.05٪ ميرثيولات) بعد فحص FISH. قم بإعداد الأجسام المضادة الأولية في مخزن مؤقت للتخفيف يحتوي على 1x TBSm و 5٪ مصل حصان عادي و 0.1٪ Tween20. يتم سرد موردي الأجسام المضادة الأولية في جدول المواد.
- الكيمياء الهيستولوجية المناعية
- قم بإزالة المخزن المؤقت الزائد عن طريق تحريك الشريحة واحتضان الأقسام بالأجسام المضادة الأولية طوال الليل عند 4 درجات مئوية.
- اغسل الشرائح 3 مرات (5 دقائق لكل منها) باستخدام 1x TBSm واحتضانها بجسم مضاد ثانوي في مادة مخففة تحتوي على 1x TBSm و 1٪ مصل حصان طبيعي و 0.1٪ Tween20 لمدة ساعتين في درجة حرارة الغرفة. يتم سرد الأجسام المضادة الثانوية المستخدمة في هذا البروتوكول في جدول المواد.
- اغسل الشرائح 3 مرات باستخدام 1x TBSm (5 دقائق لكل منها) قبل الانزلاق مع وسط التثبيت مع أو بدون DAPI (جدول المواد).
5. التصوير
- افحص التلوين المناعي تحت مجهر التألق المصحوب بكاميرا (انظر جدول المواد للحصول على التفاصيل). احصل على صور تمثيلية بتكبير 20x واحفظها كملفات TIFF.
- تصدير الصور التمثيلية إلى برنامج معالجة الصور (جدول المواد) لضبط السطوع / التباين لزيادة الوضوح وعكس العرض الحقيقي.
6. اختياري: التحليل الكمي للنصوص المستهدفة
ملاحظة: هذه مقالة طرق ولم يتم توفير النتائج الكمية. طريقة القياس الكمي المعروضة هنا مصدرها Dereli et al.10.
- احصل على صور من مناطق الاهتمام كما هو موضح في 5.1 وقم بتطبيق نفس إعدادات المجهر والكاميرا (مثل وقت التعرض وشدة الضوء) على جميع الصور من نفس الفلوروفور.
- ارسم الملامح العصبية باستخدام برنامج تحليل الصور (جدول المواد).
- قم بمحاذاة الأقسام بالإشارة إلى مستوى Bregma وفقا لأطلس الدماغ التجسيمي13.
- قم بتطبيق نفس السطوع والتباين على جميع صور نفس الفلوروفور. ضع في اعتبارك فقط الخلايا العصبية ذات النوى الملطخة ب DAPI.
- احسب يدويا عدد خلايا mRNA ، والتعبير عن البروتين ، و mRNA / mRNA ، والبروتين / البروتين ، وخلايا التعبير المشترك mRNA / البروتين داخل المنطقة محل الاهتمام.
- لتقليل التحيز في النتائج التجريبية ، اجعل الشخص الذي يحدد النتائج التجريبية أعمى عن المجموعات التجريبية.
- تطبيق تصحيح أبركرومبي14 على إجمالي عدد الخلايا باستخدام معادلة أبيركومبي التالية:
عدد الخلايا المصححة = عدد الخلايا اليدوي × سمك المقطع / (سمك المقطع + الحجم النووي)
على سبيل المثال ، بالنسبة للمقاطع التي يبلغ سمكها 14 ميكرومتر ، يتم حساب متوسط العرض النووي ليكون 7.7 ± 0.3 ميكرومتر ومتوسط سمك المقطع 14 ± 1 ميكرومتر بناء على 30 خلية و 10 أقسام على التوالي في 510. وفقا لمعادلة أبركرومبي ، سيكون عدد الخلايا المصححة هو عدد الخلايا اليدوي × 14 / (14 + 7.7).

الشكل 1: سير العمل المتوازي لخطوات المعالجة المسبقة للأنسجة لكل من الأنسجة الثابتة الطازجة المجمدة والبارافورمالدهايد. يتم عرض خطوات معالجة الأنسجة الطازجة المجمدة في المربعات الحمراء المحددة ، بينما يتم عرض خطوات معالجة الأنسجة الثابتة بارافورمالدهايد (PFA) في المربعات الزرقاء المحددة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
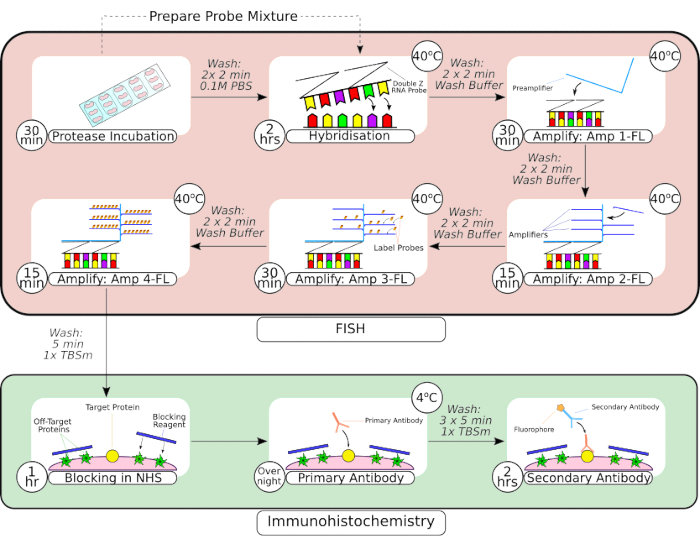
الشكل 2: ملخص مسبار FISH المشترك وإجراء الكيمياء الهيستولوجية المناعية. بعد المعالجة المسبقة للأنسجة ، يتم تطويق الأنسجة المثبتة على الشريحة باستخدام قلم حاجز كاره للماء ، كما هو موضح في الإطار الأول ، ويتم تحضينها في محلول بروتياز في درجة حرارة الغرفة. بعد الغسيل ، يتم نقل الأنسجة إلى حاضنة منضدة للتهجين لمدة 2 ساعة قبل خطوات التضخيم المتسلسلة. يستخدم نظام التهجين في الموقع تصميم "مسبار Z" الخاص ، ومضخمات أولية ومكبرات صوت كما هو موضح في الإطارات 3-66. بمجرد خضوع الأنسجة لمعالجة مسبار FISH ، يتم غسلها قبل حجبها بمصل الحصان العادي. يتم إجراء حضانة الأجسام المضادة الأولية بين عشية وضحاها عند 4 درجات مئوية لزيادة ارتباط الأجسام المضادة بالمستضد. تم تنفيذ حضانة الأجسام المضادة الثانوية (2 ساعة) في درجة حرارة الغرفة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
هنا ، نحدد طريقة للجمع بين FISH المتعدد مع IHC الفلوري لتوطين تعبير mRNA ل GalR1 و GlyT2 باستخدام الأنسجة الثابتة الطازجة المجمدة وبارافورمالدهايد على التوالي في NTS الفأر. يتم عرض خط أنابيب لمعالجة الأنسجة وإجراءات FISH و IHC الموضحة في الطرق في الشكل 1 والشكل 2. يقدم ?...
Discussion
في علوم الأعصاب ، يتم استخدام FISH و IHC بشكل روتيني للتحقيق في التنظيم المكاني والأهمية الوظيفية ل mRNA أو البروتينات داخل المجموعات السكانية الفرعية العصبية. يعزز البروتوكول الموصوف في هذه الدراسة القدرة على الكشف المتزامن عن mRNAs والبروتينات في أقسام الدماغ. مكن فحص FISH-IHC المشترك متعدد الإرس?...
Acknowledgements
تم تمويل هذا العمل من قبل منحة مشروع اكتشاف مجلس البحوث الأسترالي DP180101890 ومنحة مشروع مؤسسة ريبيكا إل كوبر للبحوث الطبية PG2018110
Materials
| Name | Company | Catalog Number | Comments |
| ANIMALS | |||
| C57BL/6 mouse | Australian BioResources, Moss Vale | MGI: 2159769 | |
| Phox2b-eGFP mouse | Australian BioResources, Moss Vale | MGI: 5776545 | |
| REAGENTS | |||
| Cyanoacrylate | Loctite | ||
| Ethylene Glycol | Sigma-Aldrich | 324558 | |
| Heparin-Sodium | Clifford Hallam Healthcare | 1070760 | Consult local veterinary supplier or pharmacy. |
| Lethabarb (Sodium Pentabarbitol) Euthanasia Injection | Virbac (Australia) Pty Ltd | N/A | Consult a veterinarian for local pharmaceutical regulations regarding Sodium Pentabarbitol |
| Molecular grade agarose powder | Sigma Aldrich | 5077 | |
| OCT Compound, 118mL | Scigen Ltd | 4586 | |
| Paraformaldehyde, prilled, 95% | Sigma-Aldrich | 441244-1KG | |
| Polyvinylpyrrolidone, average mol wt 40,000 (PVP-40) | Sigma-Aldrich | PVP40 | |
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | With or without DAPI |
| RNAscope Multiplex Fluorescent Reagent Kit (up to 3-plex capability) | Advanced Cell Diagnostics, Inc. (ACD Bio) | ADV320850 | Includes 50x Wash buffer and Protease III |
| RNase Away | Thermo-Fisher Scientific | 7003 | |
| Tris(hydroxymethyl)aminomethane | Sigma-Aldrich | 252859 | |
| Tween-20, for molecular biology | Sigma-Aldrich | P9416 | |
| EQUIPMENT | |||
| Benchtop incubator | Thermoline scientific micro incubator | Model: TEI-13G | |
| Brain Matrix, Mouse, 30g Adult, Coronal, 1mm | Ted Pella | 15050 | |
| Cryostat | Leica | CM1950 | |
| Drawing-up needle (23 inch gauge) | BD | 0288U07 | |
| Hydrophobic Barrier Pen | Vector labs | H-4000 | |
| Kimtech Science Kimwipes Delicate Task Wipes | Kimberley Clark Professional | 34120 | |
| Olympus BX51 | Olympus | BX-51 | |
| Peristaltic pump | Coleparmer Masterflex | L/S Series | |
| Retiga 2000R Digital Camera | QImaging | RET-2000R-F-CLR | colour camera |
| SuperFrost Plus Glass Slides (White) | Thermo-Fisher Scientific | 4951PLUS4 | |
| Vibrating Microtome (Vibratome) | Leica | VT1200S | |
| Whatman qualitative filter paper, Grade 1, 110 mm diameter | Merck | WHA1001110 | |
| SOFTWARES | |||
| CorelDRAW | Corel Corporation | Version 7 | |
| FIJI (ImageJ Distribution) | Open Source/GNU General Public Licence (GPL) | N/A | ImageJ 2.x: Rueden, C. T.; Schindelin, J. & Hiner, M. C. et al. (2017), "ImageJ2: ImageJ for the next generation of scientific image data", BMC Bioinformatics 18:529, PMID 29187165, doi:10.1186/s12859-017-1934-z and Fiji: Schindelin, J.; Arganda-Carreras, I. & Frise, E. et al. (2012), "Fiji: an open-source platform for biological-image analysis", Nature methods 9(7): 676-682, PMID 22743772, doi:10.1038/nmeth.2019 |
| PRIMARY ANTIBODIES | |||
| Anti-Tyrosine Hydroxylase Antibody | Millipore Sigma | AB1542 | Sheep polyclonal (1:1000 dilution), RRID: AB_90755 |
| Anti-Tyrosine Hydroxylase Antibody, clone LNC1 | Millipore Sigma | MAB318 | Mouse monoclonal (1:1000 dilution), RRID: AB_2201528 |
| Anti-Vesicular Acetylcholine Transporter (VAchT) Antibody | Sigma-Aldrich | ABN100 | Goat polyclonal (1:1000 dilution), RRID: AB_2630394 |
| GFP Antibody | Novus Biologicals | NB600-308 | Rabbit polyclonal (1:1000 dilution), RRID: AB_10003058 |
| Phox2b Antibody (B-11) | Santa Cruz Biotechnology | sc-376997 | Mouse monoclonal (1:1000 dilution), RRID: AB_2813765 |
| SECONDARY ANTIBODIES | |||
| Alexa Fluor 488 AffiniPure Donkey Anti-Rabbit IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Ms, Rat, Shp Sr Prot) | Jackson ImmunoResearch | 711-545-152 | Donkey anti-Rabbit (1:400 dilution), RRID: AB_2313584 |
| AMCA AffiniPure Donkey Anti-Sheep IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 713-155-147 | Donkey anti-Sheep (1:400 dilution), RRID: AB_AB_2340725 |
| Cy5 AffiniPure Donkey Anti-Goat IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 705-175-147 | Donkey anti-Goat (1:400 dilution), RRID: AB_2340415 |
| Cy5 AffiniPure Donkey Anti-Mouse IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Rb, Rat, Shp Sr Prot) | Jackson ImmunoResearch | 715-175-151 | Donkey anti-Mouse (1:400 dilution), RRID: AB_2619678 |
| Cy5 AffiniPure Donkey Anti-Sheep IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 713-175-147 | Donkey anti-Sheep (1:400 dilution), RRID: AB_2340730 |
| RNASCOPE PROBES | |||
| Galanin Receptor 1 oligonucleotide probe | ACDBio | 448821-C1 | targets bp 482 - 1669 (Genebank ref: NM_008082.2) |
| Glycine transporter 2 oligonucleotide probe | ACDBio | 409741-C3 | targets bp 925 - 2153 (Genebank ref: NM_148931.3) |
| Phox2b oligonucleotide probe | ACDBio | 407861-C2 | targets bp 1617 - 2790 (Genebank ref: NM_008888.3) |
References
- Wang, F., et al. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Annese, T., et al. RNAscope dual ISH-IHC technology to study angiogenesis in diffuse large B-cell lymphomas. Histochemistry and Cell Biology. 153 (3), 185-192 (2020).
- Morrison, J. A., McKinney, M. C., Kulesa, P. M. Resolving in vivo gene expression during collective cell migration using an integrated RNAscope, immunohistochemistry and tissue clearing method. Mechanisms of Development. 148, 100-106 (2017).
- Gross-Thebing, T., Paksa, A., Raz, E. Simultaneous high-resolution detection of multiple transcripts combined with localization of proteins in whole-mount embryos. BMC Biology. 12, 55 (2014).
- Stempel, A. J., Morgans, C. W., Stout, J. T., Appukuttan, B. Simultaneous visualization and cell-specific confirmation of RNA and protein in the mouse retina. Molecular Vision. 20, 1366-1373 (2014).
- Kersigo, J., et al. A RNAscope whole mount approach that can be combined with immunofluorescence to quantify differential distribution of mRNA. Cell and Tissue Research. 374 (2), 251-262 (2018).
- Grabinski, T. M., Kneynsberg, A., Manfredsson, F. P., Kanaan, N. M. A method for combining RNAscope in situ hybridization with immunohistochemistry in thick free-floating brain sections and primary neuronal cultures. PLoS One. 10 (3), 0120120 (2015).
- Baleriola, J., Jean, Y., Troy, C., Hengst, U. Detection of axonally localized mRNAs in brain sections using high-resolution in situ hybridization. Journal of Visualized Experiments. (100), e52799 (2015).
- Fe Lanfranco, M., Loane, D. J., Mocchetti, I., Burns, M. P., Villapol, S. Combination of fluorescent in situ hybridization (FISH) and immunofluorescence imaging for detection of cytokine expression in microglia/macrophage cells. Bio-Protocol. 7 (22), (2017).
- Dereli, A. S., Yaseen, Z., Carrive, P., Kumar, N. N. Adaptation of respiratory-related brain regions to long-term hypercapnia: focus on neuropeptides in the RTN. Frontiers in Neuroscience. 13, 1343 (2019).
- Lazarenko, R. M., et al. Acid sensitivity and ultrastructure of the retrotrapezoid nucleus in Phox2b-EGFP transgenic mice. Journal of Comparative Neurology. 517 (1), 69-86 (2009).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Paxinos, G., Franklin, K. B. . The mouse brain in stereotaxic coordinates. , (2004).
- Abercrombie, M. Estimation of nuclear population from microtome sections. Anatomical Records. 94, 239-247 (1946).
- Kerr, N., et al. The generation of knock-in mice expressing fluorescently tagged galanin receptors 1 and 2. Molecular and Cellular Neurosciences. 68, 258-271 (2015).
- Kachidian, P., Pickel, V. M. Localization of tyrosine hydroxylase in neuronal targets and efferents of the area postrema in the nucleus tractus solitarii of the rat. Journal of Comparative Neurology. 329 (3), 337-353 (1993).
- Stornetta, R. L., et al. Expression of Phox2b by brainstem neurons involved in chemosensory integration in the adult rat. Journal of Neuroscience. 26 (40), 10305-10314 (2006).
- Gilmor, M. L., et al. Expression of the putative vesicular acetylcholine transporter in rat brain and localization in cholinergic synaptic vesicles. Journal of Neuroscience. 16 (7), 2179-2190 (1996).
- Fisher, J. M., Sossin, W., Newcomb, R., Scheller, R. H. Multiple neuropeptides derived from a common precursor are differentially packaged and transported. Cell. 54 (6), 813-822 (1988).
- Towle, A. C., Lauder, J. M., Joh, T. H. Optimization of tyrosine-hydroxylase immunocytochemistry in paraffin sections using pretreatment with proteolytic-enzymes. Journal of Histochemistry and Cytochemistry. 32 (7), 766-770 (1984).
- Biancardi, V., et al. Mapping of the excitatory, inhibitory, and modulatory afferent projections to the anatomically defined active expiratory oscillator in adult male rats. Journal of Comparative Neurology. 529 (4), 853-884 (2021).
- Matthews, D. W., et al. Feedback in the brainstem: an excitatory disynaptic pathway for control of whisking. Journal of Comparative Neurology. 523 (6), 921-942 (2015).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Shi, S. R., Key, M. E., Kalra, K. L. Antigen retrieval in formalin-fixed, paraffin-embedded tissues: an enhancement method for immunohistochemical staining based on microwave oven heating of tissue sections. Journal of Histochemistry and Cytochemistry. 39 (6), 741-748 (1991).
- Yamashita, S., Katsumata, O. Heat-induced antigen retrieval in immunohistochemistry: mechanisms and applications. Methods in Molecular Biology. 1560, 147-161 (2017).
- Yamashita, S., Okada, Y. Mechanisms of heat-induced antigen retrieval: analyses in vitro employing SDS-PAGE and immunohistochemistry. Journal of Histochemistry and Cytochemistry. 53 (1), 13-21 (2005).
- Yamashita, S. Heat-induced antigen retrieval: mechanisms and application to histochemistry. Progress in Histochemistry and Cytochemistry. 41 (3), 141-200 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved