Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Сочетание мультиплексной флуоресцентной гибридизации in situ с флуоресцентной иммуногистохимией на свежезамороженных или фиксированных срезах мозга мышей
В этой статье
Резюме
В этом протоколе описывается метод сочетания флуоресцентной гибридизации in situ (FISH) и флуоресцентной иммуногистохимии (IHC) как в свежезамороженных, так и в фиксированных срезах мозга мышей с целью получения мультиметочного FISH и флуоресцентного сигнала IHC. ИГХ нацелен на цитоплазматические и мембранные присоединенные белки.
Аннотация
Флуоресцентная гибридизация in situ (FISH) — это молекулярный метод, который определяет наличие и пространственное распределение специфических транскриптов РНК в клетках. Нейрохимическое фенотипирование функционально идентифицированных нейронов обычно требует одновременного мечения несколькими антителами (белком-мишенью) с использованием иммуногистохимии (ИГХ) и оптимизации гибридизации in situ (таргетная РНК) в тандеме. Может быть достигнута «нейрохимическая сигнатура» для характеристики конкретных нейронов, однако осложняющие факторы включают необходимость верификации мишеней FISH и IHC перед объединением методов, а также ограниченное количество РНК и белков, которые могут быть нацелены одновременно в пределах одного и того же участка ткани.
Здесь мы опишем протокол, использующий как свежезамороженные, так и фиксированные препараты мозга мышей, который обнаруживает несколько мРНК и белков в одном и том же участке мозга с помощью РНК-скопа FISH с последующим флуоресцентным иммуноокрашиванием, соответственно. Мы используем комбинированный метод для описания паттерна экспрессии мРНК с низкой распространенностью (например, рецептор галанина 1) и мРНК с высокой распространенностью (например, транспортер глицина 2) в иммуногистохимически идентифицированных ядрах ствола мозга.
Основные соображения по маркировке белков после анализа FISH выходят за рамки подготовки тканей и оптимизации маркировки зондов FISH. Например, мы обнаружили, что на связывание антител и специфичность маркировки может отрицательно влиять стадия протеазы в анализе FISH-зонда. Протеазы катализируют гидролитическое расщепление пептидных связей, облегчая проникновение FISH-зонда в клетки, однако они также могут переваривать белок, на который нацелен последующий анализ ИГХ, вызывая нецелевое связывание. Субклеточное расположение целевого белка является еще одним фактором, способствующим успеху ИГХ после FISH-анализа. Мы наблюдали, что специфичность ИГХ сохраняется, когда белок-мишень связан с мембраной, в то время как ИГХ, нацеленная на цитоплазматический белок, требует обширного устранения неполадок. Наконец, мы обнаружили, что работа с фиксированной замороженной тканью, установленной на предметном стекле, более сложной, чем со свежезамороженной тканью, однако качество ИГХ было в целом лучше с фиксированной замороженной тканью в сочетании с РНК-скопом.
Введение
Белки и мРНК, которые нейрохимически определяют субпопуляции нейронов, обычно идентифицируются с помощью комбинации иммуногистохимии (ИГХ) и/или гибридизации in situ (ISH) соответственно. Сочетание ISH с методами ИГХ облегчает характеризацию паттернов колокализации, уникальных для функциональных нейронов (нейрохимическое кодирование), максимизируя способность мультиплексного мечения.
Флуоресцентные методы ISH (FISH), включая RNAscope, обладают более высокой чувствительностью и специфичностью по сравнению с более ранними методами детектирования РНК, такими как радиоактивный ISH и нерадиоактивный хромогенный ISH. FISH позволяет визуализировать одиночные транскрипты мРНК в виде точечных пятен1. Кроме того, анализ РНК-скопа позволяет одновременно маркировать увеличенное количество мишеней РНК, используя различные метки флуорофора. Несмотря на эти преимущества, технические ограничения могут повлиять на количество флуорофоров/хромогенов, которые могут быть использованы в одном эксперименте. К ним относятся наличие комплектов фильтров для микроскопов; Такие соображения усугубляются, когда нейрохимическая идентификация использует комбинированные FISH и IHC, по сравнению с использованием каждого метода по отдельности, поскольку неотъемлемые шаги, оптимальные для одного метода, могут быть вредными для другого.
Предыдущее применение FISH в сочетании с ИГХ продемонстрировало экспрессию специфических клеточных мишеней в В-клеточных лимфомах человека2, эмбрионах цыплят3, эмбрионах рыбок данио4, сетчатке мыши5 и клетках внутреннего уха мыши6. В этих исследованиях ткань препарировалась либо с помощью фиксированного формалином парафина (FFPE)2,3,5, либо свежего целого монтировки 4,6. В других исследованиях применяли хромогенный РНК-скоп на фиксированных препаратах мозга мышей и крыс 7,8,9. В частности, Baleriola et al.8 описаны два различных тканевых препарата для комбинированного ISH-IHC; фиксированные участки мозга мыши и секции мозга человека FFPE. В недавней публикации мы объединили FISH и флуоресцентный ИГХ на свежезамороженных срезах, чтобы одновременно визуализировать мРНК с низкой распространенностью (рецептор галанина 1, GalR1), мРНК с высокой распространенностью (транспортер глицина 2, GlyT2) и везикулярный транспортер ацетилхолина (vAChT) белка10 в ретикулярной формации ствола мозга.
Ядро солитарного тракта (НТС) является основной областью мозга, участвующей в вегетативной функции. Расположенная в заднем мозге, эта гетерогенная популяция нейронов получает и интегрирует огромное количество вегетативных сигналов, в том числе и тех, которые регулируют дыхание. NTS содержит несколько нейронных популяций, которые могут быть фенотипически охарактеризованы паттерном экспрессии мишеней мРНК, включая GalR1 и GlyT2, а также белковых маркеров фермента тирозингидроксилазы (TH) и транскрипционного фактора Paired-like homeobox 2b (Phox2b).
Владелец РНКаскопа рекомендует свежезамороженные препараты тканей, но ткани, приготовленные путем транскардиальной перфузионной фиксации цельного животного, наряду с длительной криозащитой (хранение при -20 °C) фиксированных замороженных срезов ткани, распространены во многих лабораториях. Таким образом, мы стремились разработать протоколы для FISH в сочетании с ИГХ с использованием свежезамороженных и фиксированных замороженных тканевых препаратов. Здесь мы приводим свежезамороженные и фиксированные замороженные срезы мозга: (1) протокол комбинированного FISH и флуоресцентного ИГХ, (2) описание качества маркировки мРНК и белков, получаемых при использовании каждого препарата, (3) описание экспрессии GalR1 и GlyT2 в NTS.
Наше исследование показало, что в сочетании с методологией РНК-скопа успех ИГХ варьировался в свежезамороженных и фиксированных замороженных препаратах и зависел от локализации белков-мишеней в клетке. В наших руках мембранно-связанное мечение белков всегда было успешным. В отличие от этого, ВПХ для цитоплазматического белка требовала устранения неполадок даже в тех случаях, когда цитоплазматический белок был чрезмерно экспрессирован у трансгенного животного (Phox2b-GFP)11. Наконец, в то время как GalR1 экспрессируется в некатехоламингических нейронах в NTS, экспрессия GlyT2 отсутствует в NTS.
протокол
Краткое описание этапов предварительной обработки тканей можно найти на рисунке 1. Все процедуры проводились в соответствии с Комитетом по уходу за животными и этике Университета Нового Южного Уэльса в соответствии с руководством по использованию и уходу за животными в научных целях (Австралийский национальный совет по здравоохранению и медицинским исследованиям).
1. Пробоподготовка свежезамороженных тканей головного мозга
- Транскардиальная перфузия
- Приготовьте гепаринизированный (2500 Ед/л) 0,1 М фосфатный буфер (ФБ), рН 7,5. Приготовьте суспензию этанола из сухого льда, смешав сухой лед с этанолом. Он будет иметь температуру примерно −72 °C и будет использоваться для немедленного замораживания собранной ткани.
- Усыпляют взрослых мышей C57BL/6 и Phox2b-GFP11 (Mouse Genome Informatics Database ID MGI:5776545) путем обезболивания пентобарбиталом натрия (70 мг/кг, в/в) с помощью 27,5-дюймового игольчатого калибра.
ВНИМАНИЕ: Пентобарбитал является барбитуратом. Он остро токсичен в высоких дозах и может вызвать смерть от остановки дыхания. Перед использованием ознакомьтесь с местными рекомендациями по здравоохранению, правовым нормам и правилам безопасности материалов. - Обнажите сердце и канюлируйте левый желудочек с помощью иглы (23-дюймового калибра). Проводят транскардиальную перфузию гепаринизированным 0,1 М ПБ до очищения крови (2-3 минуты) со скоростью потока 11-13 мл/мин. Определяют очищение крови, контролируя окраску печени и эффузат из правого предсердия12.
- Изолируйте мозг от полости черепа, немедленно поместите его в компаунд с оптимальной температурой резки (OCT) в криомолд или алюминиевую фольгу и поместите в ванну с этанолом с сухим льдом. Храните замороженную встроенную ткань в герметичном контейнере при температуре -80 °C до 3 месяцев.
- Секционирование свежезамороженных тканей
- Установите температуру криостата на -20 °C. Оставьте ткань, внедренную в ОКТ, и криостатный патрон в криостате на ~30 минут, чтобы обеспечить равновесие к новой температуре.
ПРИМЕЧАНИЕ: Всегда держите ткань в замороженном виде; транспортируйте ткань из морозильной камеры с температурой -80 °C в криостат на сухом льду. - Закрепите ткань на предварительно охлажденном патроне криостата с помощью ОКТ-компаунда. В этом протоколе тканевые блоки устанавливались на патрон в корональной плоскости.
ПРИМЕЧАНИЕ: Удалите излишки ОКТ с ткани с помощью бритвенного лезвия, чтобы свести к минимуму количество ОКТ, срезаемого криостатом и впоследствии переносимого на предметное стекло. - Вырежьте корональные срезы толщиной 14 мкм и установите их на предметные стекла для микроскопии.
- Перед монтажом секций нагрейте слайды до комнатной температуры. После того, как секция будет смонтирована, храните салазки в слайд-боксе в криостате.
- Если на одном предметном стекле необходимо установить более одной секции, согрейте область для второй секции, положив палец на противоположную сторону предметного стекла на 5-10 секунд, чтобы облегчить прилегание секции к предметному стеклу. Срез холодной ткани не будет прикреплен к холодному предметному стеклу. Секции должны прилегать к слайдам ровно; Складывание приведет к тому, что они упадут с направляющих во время стирки.
- Если на участках замечены трещины, увеличьте температуру криостата на 1-5 °C, чтобы этого избежать. Особенно важно расположить срезы тканей в непосредственной близости друг от друга на одном предметном стекле. Это предотвратит потерю FISH-зондов и реагентов во время анализа.
- Срезы тканей, прикрепленные к предметным стеклам, храните в герметичном контейнере при температуре -80 °C до 6 месяцев.
ПРИМЕЧАНИЕ: Всегда держите секции замороженными и избегайте циклов замораживания, чтобы предотвратить деградацию РНК. Транспортируйте слайд-бокс из криостата в морозильную камеру с температурой -80 °C на сухом льду.
- Установите температуру криостата на -20 °C. Оставьте ткань, внедренную в ОКТ, и криостатный патрон в криостате на ~30 минут, чтобы обеспечить равновесие к новой температуре.
- Фиксация свежезамороженных тканей
- В день проведения зондового анализа FISH приготовьте 4% параформальдегид (PFA) в 0,1 M PB, pH 7,5 (4% раствор PFA). Фильтруют, пропуская фильтровальную бумагу (класс 1: 11 мкм, таблица материалов) в воронку Бюхнера или тигельный фильтр.
ВНИМАНИЕ: PFA вреден и токсичен при контакте с кожей или вдыхании. Все процедуры с раствором PFA следует проводить в вытяжном шкафу. Отходы раствора PFA следует утилизировать тщательно в соответствии с институциональными протоколами безопасности. - Охладите 4% раствор PFA до 4 °C. Транспортируйте задвиженную ткань из морозильной камеры с температурой -80 °C в сухом льду и сразу же погрузите ее в предварительно охлажденный фиксатор на 15 минут.
ПРИМЕЧАНИЕ: Важно, чтобы этот этап фиксации не превышал 15 минут, так как чрезмерная фиксация приведет к неспецифической фоновой маркировке.
- В день проведения зондового анализа FISH приготовьте 4% параформальдегид (PFA) в 0,1 M PB, pH 7,5 (4% раствор PFA). Фильтруют, пропуская фильтровальную бумагу (класс 1: 11 мкм, таблица материалов) в воронку Бюхнера или тигельный фильтр.
- Обезвоживание свежезамороженных тканей
- Обезвоживайте срезы тканей, погружая предметные стекла в дифференцированные концентрации этанола. В банку Coplin сначала погрузите 50%, затем 70% и, наконец, абсолютный этанол на 5 минут каждый при комнатной температуре. Повторите окончательную абсолютную инкубацию этанола во второй раз.
- Высушите горки на воздухе и очертите группу секций с помощью гидрофобной барьерной ручки, убедившись, что внутренняя площадь сведена к минимуму.
ПРИМЕЧАНИЕ: Убедитесь, что предметное стекло полностью высохло, прежде чем рисовать гидрофобный барьер. Гидрофобный барьер должен окружать участки ткани полностью без зазоров и должен быть сухим перед дальнейшей обработкой.
2. Пробоподготовка фиксированной замороженной ткани головного мозга
- Фиксация транскардиальной перфузии
- Эвтаназию мышей обезболивали пентобарбиталом натрия (70 мг/кг, в/м) с последующей транскардиальной перфузией, сначала 0,1 М ПБ, затем 4% раствором ПФА. Закрепите 10-минутной перфузией со скоростью 11-13 мл/мин.
- Изолируют мозг от полости черепа после перфузионной фиксации и погружают на ночь в 4% раствор PFA при температуре 4 °C.
- Срезы фиксированных тканей
- Промыть мозг в стерильном 0,1 М фосфатно-солевом буфере (PBS) перед удалением менингеальных слоев с помощью препарирующего микроскопа с помощью тонких щипцов.
- Разрежьте мозг точно на блоки (отделите ствол мозга от переднего мозга перед разделением вибратомы) с помощью матрицы мозга (таблица материалов). В частности, разрежьте ствол мозга каудально в месте пирамидной декуссации и рассеките мозжечок. Точно так же разрезают передний мозг непосредственно рострально к зрительной хиазме.
- Закрепите ткань на вибрирующем патроне микротома с помощью цианоакрилата и поместите в 2% раствор агара.
- Срезы тканей толщиной 30 мкм вырезать с помощью вибрирующего микротома и хранить срезы в растворе криопротектора (30% безРНКазная сахароза, 30% этиленгликоль, 1% поливинилпирролидон (ПВП-40), в 0,1 М ПБ, рН 7,4). Срезы тканей можно хранить в криопротекторе при температуре -20 °C до 6 месяцев.
- Подготовка фиксированных секций перед FISH
- В день FISH промойте свободно плавающие участки три раза, по 10 минут на каждую стирку, чтобы удалить раствор криопротектора. Для промывки помещают срезы в 0,1 м PBS в 12-луночную планшет для культивирования клеток и перемешивают на вращающемся платформенном шейкере (90 - 100 об/мин).
- После мытья используйте кисть, чтобы закрепить срезы на предметных стеклах для микроскопии и высушить на воздухе не менее 2 часов.
ПРИМЕЧАНИЕ: Секции должны плотно прилегать к направляющим, так как любые выраженные складки приведут к их отсоединению во время стирки. - Используя гидрофобную барьерную ручку, нарисуйте барьер вокруг секций, чтобы ограничить реагенты FISH секциями. Опять же, важно свести к минимуму внутреннюю площадь контура, нарисованного барьерной ручкой.
ВОЗМОЖНАЯ ТОЧКА РАЗРЫВА: Срезы можно хранить при комнатной температуре в течение ночи, чтобы продолжить анализ на следующий день.
3. Анализ РЫБЫ
ПРИМЕЧАНИЕ: Остальная часть протокола относится как к свежезамороженным, так и к фиксированным замороженным тканям.
- Подготовьте реагенты и инструменты для этапов гибридизации и амплификации.
- Установите настольный инкубатор и водяную баню на 40 °C.
- Подготовьте увлажненную, защищенную от света камеру для инкубации предметных стекол. Увлажнение предотвращает пересыхание тканей – предметные стекла надежно расположены над влажным резервуаром. В идеале камера изготовлена из сверхпрочного полистирола, она светонепроницаема и воздухонепроницаема для поддержания насыщенной атмосферы водяного пара. Закрытие камеры основано на минимальном трении, чтобы избежать движения. Мы использовали слайд-бокс, выстланный влажными лабораторными салфетками (Таблица материалов) внизу. Поместите слайд-бокс внутрь инкубатора, чтобы он прогрелся до 40 °C.
- Нагрейте буфер для промывки 50x (таблица материалов) и зонды до 40 °C в течение 10 минут на водяной бане, затем остудите до комнатной температуры.
- Приготовьте 1 л 1x Wash Buffer из 50-кратной концентрации бульона.
- Подготовка смеси зондов (Таблица материалов): зонд C1 готов к использованию при концентрации на складе, в то время как зонды C2 и C3 поставляются с концентрацией 50x и требуют разбавления разбавителем, входящим в комплект.
ПРИМЕЧАНИЕ: Смеси зондов можно хранить при температуре 4 °C до 6 месяцев.
- Лечение протеазой
- Инкубируйте срезы с Protease III (таблица материалов) при комнатной температуре в течение 30 минут.
ПРИМЕЧАНИЕ: Убедитесь, что протеаза III и инкубационные реагенты в последующих процессах (смесь зондов, растворы для амплификации, блокирующий буфер и сыворотки антител) полностью покрывают участки. Наконечник пипетки можно использовать для распределения реагента по участку, чтобы покрыть всю площадь внутри гидрофобного барьера. - Дважды промойте предметные стекла 0,1 м PBS, каждый раз по 2 минуты, в большой пластиковой квадратной чашке Петри. Здесь использовалась квадратная чашка для биопроб размером 245 мм х 245 мм (Таблица материалов). Возьмите с одной стороны блюда и осторожно наклоните 3-5 раз. После промывки смахните излишки 0,1 М PBS с предметного стекла и сразу же добавьте следующий реагент. Не допускайте высыхания срезов ткани.
ПРИМЕЧАНИЕ: Во время каждой стирки предметные стекла погружаются в раствор комнатной температуры. Это рабочий процесс для всех последующих этапов стирки. Фиксированные секции толщиной 30 мкм легче смещаются с предметных стекол, чем секции толщиной 14 мкм, будьте осторожны во время стирки.
- Инкубируйте срезы с Protease III (таблица материалов) при комнатной температуре в течение 30 минут.
- Гибридизация и амплификация
- Смыв раствор протеазы, поместите предметные стекла в увлажненную, предварительно прогретую камеру. Инкубируйте срезы с зондовой смесью (таблица материалов) в течение 2 часов при температуре 40 °C в настольном инкубаторе.
ПРИМЕЧАНИЕ: Убедитесь, что для положительных и отрицательных контрольных зондов отведено не менее 2 секций для оценки качества образца РНК и оптимальной пермеабилизации. Положительные контрольные зонды нацелены на гены, отвечающие за ведение домашнего хозяйства; В данном случае это был коктейль из РНК, нацеленных на убиквитин С (UBC; высокая распространенность), пептидилпропилизомеразу B (PPIB; умеренное распространение) и РНК-полимеразу 2a (POLR2A; низкое распространение). Отрицательные контрольные зонды нацелены на бактериальный ген 4-гидрокси-тетрагидродипиколинатредуктазы (DapB), который обычно отсутствует в образцах мозга мышей. Положительный сигнал DapB указывает на неспецифический сигнал и/или бактериальное загрязнение образца. - После гибридизации с зондовой смесью этапы усиления сигнала состоят из инкубации с усилителем 1-FL (30 минут), затем с усилителем 2-FL (15 минут), затем с усилителем 3-FL (30 минут) и, наконец, с усилителем 4-FL (15 минут) - каждый при 40 °C. С помощью прилагаемых флаконов-капельниц покройте участки тканей раствором для амплификации. Приступайте к анализу ИГХ после последнего этапа амплификации.
- Промывайте предметные стекла буфером для промывки дважды в течение 2 минут между гибридизацией зонда и каждым этапом амплификации.
- Смыв раствор протеазы, поместите предметные стекла в увлажненную, предварительно прогретую камеру. Инкубируйте срезы с зондовой смесью (таблица материалов) в течение 2 часов при температуре 40 °C в настольном инкубаторе.
4. Анализ ИГХ
- Шаг блокировки IHC
- Чтобы предотвратить неспецифическое связывание антител, инкубируют срезы в течение 1 ч при комнатной температуре с блокирующим раствором, содержащим 10% нормальной лошадиной сыворотки, 0,3% Tween20 в 1x TBSm (50 мМ Tris-Cl, рН 7,5, 150 мМ NaCl, 0,05% мертиолят) после анализа FISH. Готовят первичные антитела в буфере для разведения, содержащем 1x TBSm, 5% нормальной лошадиной сыворотки и 0,1% Tween20. Основные поставщики антител перечислены в Таблице материалов.
- Иммуногистохимия
- Удалите излишки блокирующего буфера, щелкнув предметным стеклом, и инкубируйте срезы с первичными антителами в течение ночи при 4 °C.
- Промойте предметные стекла 3 раза (по 5 минут каждый) с 1 TBSm и инкубируйте со вторичными антителами в разбавителе, содержащем 1x TBSm, 1% нормальной лошадиной сыворотки и 0,1% Tween20 в течение 2 часов при комнатной температуре. Вторичные антитела, используемые в этом протоколе, перечислены в таблице материалов.
- Промойте предметные стекла 3 раза с помощью 1x TBSm (5 минут каждая) перед нанесением покрытия монтажным средством с DAPI (таблица материалов) или без него.
5. Визуализация
- Исследуйте иммуноокрашивание под эпифлуоресцентным микроскопом, оснащенным камерой (подробности см. в таблице материалов ). Получайте репрезентативные изображения с 20-кратным увеличением и сохраняйте их в виде файлов TIFF.
- Экспортируйте репрезентативные изображения в программное обеспечение для обработки изображений (таблица материалов) для регулировки яркости/контрастности для повышения четкости и отражения истинного рендеринга.
6. НЕОБЯЗАТЕЛЬНО: Количественный анализ целевых транскриптов
ПРИМЕЧАНИЕ: Это статья о методах, и количественные результаты не предоставляются. Метод количественной оценки, представленный здесь, взят из Dereli et al.10. См.
- Получите изображения из областей интереса, как описано в 5.1, и примените одни и те же настройки микроскопа и камеры (например, время экспозиции и интенсивность света) ко всем изображениям одного и того же флуорофора.
- Постройте график профилей нейронов с помощью программного обеспечения для анализа изображений (Таблица материалов).
- Выровняйте срезы по уровню Брегмы в соответствии со стереотаксическим атласом мозга13.
- Примените одинаковую яркость и контрастность ко всем изображениям одного и того же флуорофора. Рассматривайте только нейроны с DAPI-окрашенными ядрами.
- Вручную подсчитайте количество мРНК, экспрессирующих белки, мРНК/мРНК, белок/белок и коэкспрессирующих мРНК/белок клеток в интересующей области.
- Чтобы уменьшить систематическую ошибку в экспериментальных результатах, сделайте так, чтобы человек, оценивающий результаты эксперимента, был слеп к экспериментальным группам.
- Примените поправку Аберкромби14 к общему количеству ячеек с помощью следующего уравнения Аберкомби:
Скорректированное количество ячеек = ручное количество ячеек x толщина сечения / (толщина сечения + размер ядра)
Например, для срезов толщиной 14 мкм средняя ширина ядра составляет 7,7 ± 0,3 мкм, а средняя толщина сечения составляет 14 ± 1 мкм из расчета 30 клеток и 10 секций соответственно у 5животных10. Согласно уравнению Аберкромби, скорректированное количество клеток будет ручным подсчетом клеток x 14/(14+7,7).

Рисунок 1: Параллельный рабочий процесс этапов предварительной обработки тканей как для свежезамороженных, так и для параформальдегидных фиксированных тканей. Этапы обработки свежезамороженных тканей отображаются в красных рамках, в то время как этапы обработки фиксированных тканей из параформальдегида (PFA) отображаются в синих рамках. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
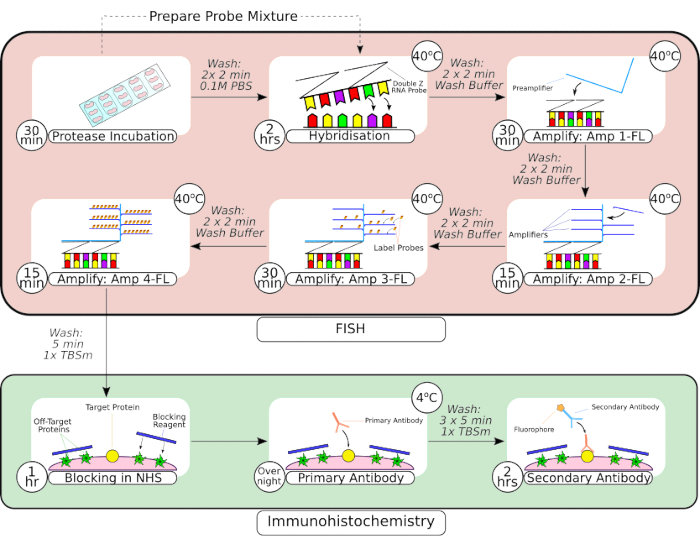
Рисунок 2: Краткое описание комбинированной процедуры FISH-зонда и иммуногистохимии. После предварительной обработки ткани ткань, установленную на предметном стекле, обматывают с помощью гидрофобного барьерного пера, как показано на первом кадре, и инкубируют в растворе протеазы при комнатной температуре. После промывки ткань переносят в настольный инкубатор для гибридизации на 2 часа перед последовательными этапами амплификации. В системе гибридизации in situ используется запатентованная конструкция Z-зонда, предусилители и усилители, как показано на кадрах 3-66. После того, как ткань прошла обработку FISH-зондом, ее промывают перед блокировкой обычной лошадиной сывороткой. Первичную инкубацию антител проводят в течение ночи при 4 °C для максимального связывания антитело-антиген. Инкубацию вторичных антител (2 часа) проводили при комнатной температуре. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Результаты
В данной работе мы описываем метод комбинирования мультиплексного FISH с флуоресцентным ИГХ для локализации экспрессии мРНК для GalR1 и GlyT2 с использованием свежезамороженных и параформальдегидных фиксированных тканей соответственно в NTS мыши. Конвейер процедур обработки тканей, FISH и IHC, ?...
Обсуждение
В нейронауках FISH и IHC обычно используются для исследования пространственной организации и функциональной значимости мРНК или белков в субпопуляциях нейронов. Протокол, описанный в этом исследовании, повышает способность к одновременному обнаружению мРНК и белков в отделах мозга. Наш ...
Благодарности
Эта работа была профинансирована грантом Австралийского исследовательского совета Discovery Project DP180101890 и грантом проекта Фонда медицинских исследований Ребекки Л. Купер PG2018110
Материалы
| Name | Company | Catalog Number | Comments |
| ANIMALS | |||
| C57BL/6 mouse | Australian BioResources, Moss Vale | MGI: 2159769 | |
| Phox2b-eGFP mouse | Australian BioResources, Moss Vale | MGI: 5776545 | |
| REAGENTS | |||
| Cyanoacrylate | Loctite | ||
| Ethylene Glycol | Sigma-Aldrich | 324558 | |
| Heparin-Sodium | Clifford Hallam Healthcare | 1070760 | Consult local veterinary supplier or pharmacy. |
| Lethabarb (Sodium Pentabarbitol) Euthanasia Injection | Virbac (Australia) Pty Ltd | N/A | Consult a veterinarian for local pharmaceutical regulations regarding Sodium Pentabarbitol |
| Molecular grade agarose powder | Sigma Aldrich | 5077 | |
| OCT Compound, 118mL | Scigen Ltd | 4586 | |
| Paraformaldehyde, prilled, 95% | Sigma-Aldrich | 441244-1KG | |
| Polyvinylpyrrolidone, average mol wt 40,000 (PVP-40) | Sigma-Aldrich | PVP40 | |
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | With or without DAPI |
| RNAscope Multiplex Fluorescent Reagent Kit (up to 3-plex capability) | Advanced Cell Diagnostics, Inc. (ACD Bio) | ADV320850 | Includes 50x Wash buffer and Protease III |
| RNase Away | Thermo-Fisher Scientific | 7003 | |
| Tris(hydroxymethyl)aminomethane | Sigma-Aldrich | 252859 | |
| Tween-20, for molecular biology | Sigma-Aldrich | P9416 | |
| EQUIPMENT | |||
| Benchtop incubator | Thermoline scientific micro incubator | Model: TEI-13G | |
| Brain Matrix, Mouse, 30g Adult, Coronal, 1mm | Ted Pella | 15050 | |
| Cryostat | Leica | CM1950 | |
| Drawing-up needle (23 inch gauge) | BD | 0288U07 | |
| Hydrophobic Barrier Pen | Vector labs | H-4000 | |
| Kimtech Science Kimwipes Delicate Task Wipes | Kimberley Clark Professional | 34120 | |
| Olympus BX51 | Olympus | BX-51 | |
| Peristaltic pump | Coleparmer Masterflex | L/S Series | |
| Retiga 2000R Digital Camera | QImaging | RET-2000R-F-CLR | colour camera |
| SuperFrost Plus Glass Slides (White) | Thermo-Fisher Scientific | 4951PLUS4 | |
| Vibrating Microtome (Vibratome) | Leica | VT1200S | |
| Whatman qualitative filter paper, Grade 1, 110 mm diameter | Merck | WHA1001110 | |
| SOFTWARES | |||
| CorelDRAW | Corel Corporation | Version 7 | |
| FIJI (ImageJ Distribution) | Open Source/GNU General Public Licence (GPL) | N/A | ImageJ 2.x: Rueden, C. T.; Schindelin, J. & Hiner, M. C. et al. (2017), "ImageJ2: ImageJ for the next generation of scientific image data", BMC Bioinformatics 18:529, PMID 29187165, doi:10.1186/s12859-017-1934-z and Fiji: Schindelin, J.; Arganda-Carreras, I. & Frise, E. et al. (2012), "Fiji: an open-source platform for biological-image analysis", Nature methods 9(7): 676-682, PMID 22743772, doi:10.1038/nmeth.2019 |
| PRIMARY ANTIBODIES | |||
| Anti-Tyrosine Hydroxylase Antibody | Millipore Sigma | AB1542 | Sheep polyclonal (1:1000 dilution), RRID: AB_90755 |
| Anti-Tyrosine Hydroxylase Antibody, clone LNC1 | Millipore Sigma | MAB318 | Mouse monoclonal (1:1000 dilution), RRID: AB_2201528 |
| Anti-Vesicular Acetylcholine Transporter (VAchT) Antibody | Sigma-Aldrich | ABN100 | Goat polyclonal (1:1000 dilution), RRID: AB_2630394 |
| GFP Antibody | Novus Biologicals | NB600-308 | Rabbit polyclonal (1:1000 dilution), RRID: AB_10003058 |
| Phox2b Antibody (B-11) | Santa Cruz Biotechnology | sc-376997 | Mouse monoclonal (1:1000 dilution), RRID: AB_2813765 |
| SECONDARY ANTIBODIES | |||
| Alexa Fluor 488 AffiniPure Donkey Anti-Rabbit IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Ms, Rat, Shp Sr Prot) | Jackson ImmunoResearch | 711-545-152 | Donkey anti-Rabbit (1:400 dilution), RRID: AB_2313584 |
| AMCA AffiniPure Donkey Anti-Sheep IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 713-155-147 | Donkey anti-Sheep (1:400 dilution), RRID: AB_AB_2340725 |
| Cy5 AffiniPure Donkey Anti-Goat IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 705-175-147 | Donkey anti-Goat (1:400 dilution), RRID: AB_2340415 |
| Cy5 AffiniPure Donkey Anti-Mouse IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Rb, Rat, Shp Sr Prot) | Jackson ImmunoResearch | 715-175-151 | Donkey anti-Mouse (1:400 dilution), RRID: AB_2619678 |
| Cy5 AffiniPure Donkey Anti-Sheep IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 713-175-147 | Donkey anti-Sheep (1:400 dilution), RRID: AB_2340730 |
| RNASCOPE PROBES | |||
| Galanin Receptor 1 oligonucleotide probe | ACDBio | 448821-C1 | targets bp 482 - 1669 (Genebank ref: NM_008082.2) |
| Glycine transporter 2 oligonucleotide probe | ACDBio | 409741-C3 | targets bp 925 - 2153 (Genebank ref: NM_148931.3) |
| Phox2b oligonucleotide probe | ACDBio | 407861-C2 | targets bp 1617 - 2790 (Genebank ref: NM_008888.3) |
Ссылки
- Wang, F., et al. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Annese, T., et al. RNAscope dual ISH-IHC technology to study angiogenesis in diffuse large B-cell lymphomas. Histochemistry and Cell Biology. 153 (3), 185-192 (2020).
- Morrison, J. A., McKinney, M. C., Kulesa, P. M. Resolving in vivo gene expression during collective cell migration using an integrated RNAscope, immunohistochemistry and tissue clearing method. Mechanisms of Development. 148, 100-106 (2017).
- Gross-Thebing, T., Paksa, A., Raz, E. Simultaneous high-resolution detection of multiple transcripts combined with localization of proteins in whole-mount embryos. BMC Biology. 12, 55 (2014).
- Stempel, A. J., Morgans, C. W., Stout, J. T., Appukuttan, B. Simultaneous visualization and cell-specific confirmation of RNA and protein in the mouse retina. Molecular Vision. 20, 1366-1373 (2014).
- Kersigo, J., et al. A RNAscope whole mount approach that can be combined with immunofluorescence to quantify differential distribution of mRNA. Cell and Tissue Research. 374 (2), 251-262 (2018).
- Grabinski, T. M., Kneynsberg, A., Manfredsson, F. P., Kanaan, N. M. A method for combining RNAscope in situ hybridization with immunohistochemistry in thick free-floating brain sections and primary neuronal cultures. PLoS One. 10 (3), 0120120 (2015).
- Baleriola, J., Jean, Y., Troy, C., Hengst, U. Detection of axonally localized mRNAs in brain sections using high-resolution in situ hybridization. Journal of Visualized Experiments. (100), e52799 (2015).
- Fe Lanfranco, M., Loane, D. J., Mocchetti, I., Burns, M. P., Villapol, S. Combination of fluorescent in situ hybridization (FISH) and immunofluorescence imaging for detection of cytokine expression in microglia/macrophage cells. Bio-Protocol. 7 (22), (2017).
- Dereli, A. S., Yaseen, Z., Carrive, P., Kumar, N. N. Adaptation of respiratory-related brain regions to long-term hypercapnia: focus on neuropeptides in the RTN. Frontiers in Neuroscience. 13, 1343 (2019).
- Lazarenko, R. M., et al. Acid sensitivity and ultrastructure of the retrotrapezoid nucleus in Phox2b-EGFP transgenic mice. Journal of Comparative Neurology. 517 (1), 69-86 (2009).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Paxinos, G., Franklin, K. B. . The mouse brain in stereotaxic coordinates. , (2004).
- Abercrombie, M. Estimation of nuclear population from microtome sections. Anatomical Records. 94, 239-247 (1946).
- Kerr, N., et al. The generation of knock-in mice expressing fluorescently tagged galanin receptors 1 and 2. Molecular and Cellular Neurosciences. 68, 258-271 (2015).
- Kachidian, P., Pickel, V. M. Localization of tyrosine hydroxylase in neuronal targets and efferents of the area postrema in the nucleus tractus solitarii of the rat. Journal of Comparative Neurology. 329 (3), 337-353 (1993).
- Stornetta, R. L., et al. Expression of Phox2b by brainstem neurons involved in chemosensory integration in the adult rat. Journal of Neuroscience. 26 (40), 10305-10314 (2006).
- Gilmor, M. L., et al. Expression of the putative vesicular acetylcholine transporter in rat brain and localization in cholinergic synaptic vesicles. Journal of Neuroscience. 16 (7), 2179-2190 (1996).
- Fisher, J. M., Sossin, W., Newcomb, R., Scheller, R. H. Multiple neuropeptides derived from a common precursor are differentially packaged and transported. Cell. 54 (6), 813-822 (1988).
- Towle, A. C., Lauder, J. M., Joh, T. H. Optimization of tyrosine-hydroxylase immunocytochemistry in paraffin sections using pretreatment with proteolytic-enzymes. Journal of Histochemistry and Cytochemistry. 32 (7), 766-770 (1984).
- Biancardi, V., et al. Mapping of the excitatory, inhibitory, and modulatory afferent projections to the anatomically defined active expiratory oscillator in adult male rats. Journal of Comparative Neurology. 529 (4), 853-884 (2021).
- Matthews, D. W., et al. Feedback in the brainstem: an excitatory disynaptic pathway for control of whisking. Journal of Comparative Neurology. 523 (6), 921-942 (2015).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Shi, S. R., Key, M. E., Kalra, K. L. Antigen retrieval in formalin-fixed, paraffin-embedded tissues: an enhancement method for immunohistochemical staining based on microwave oven heating of tissue sections. Journal of Histochemistry and Cytochemistry. 39 (6), 741-748 (1991).
- Yamashita, S., Katsumata, O. Heat-induced antigen retrieval in immunohistochemistry: mechanisms and applications. Methods in Molecular Biology. 1560, 147-161 (2017).
- Yamashita, S., Okada, Y. Mechanisms of heat-induced antigen retrieval: analyses in vitro employing SDS-PAGE and immunohistochemistry. Journal of Histochemistry and Cytochemistry. 53 (1), 13-21 (2005).
- Yamashita, S. Heat-induced antigen retrieval: mechanisms and application to histochemistry. Progress in Histochemistry and Cytochemistry. 41 (3), 141-200 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены