このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マルチプレックス蛍光 In Situ ハイブリダイゼーションと蛍光免疫組織化学の融合による新鮮、凍結、または固定マウスの脳切片の結合(英語)
要約
このプロトコルはmultilabel FISHおよび蛍光性のIHC信号を達成することを目標に、新しい凍結および固定マウス頭脳セクションの蛍光性in situ の交配(魚)および蛍光性のimmunohistochemistry (IHC)を、結合するための方法を記述する。IHCは細胞質および膜結合タンパク質を標的としました。
要約
蛍光 in situ ハイブリダイゼーション(FISH)は、細胞内の特定のRNA転写物の存在と空間分布を同定する分子技術です。機能的に同定されたニューロンの神経化学的表現型決定には、通常、免疫組織化学(IHC)を用いた複数の抗体(標的タンパク質)による同時標識と、 in situ ハイブリダイゼーション(標的RNA)の最適化が必要です。特定のニューロンを特徴づける「神経化学的特徴」は達成される可能性がありますが、複雑な要因には、方法を組み合わせる前にFISHとIHCの標的を検証する必要があること、および同じ組織切片内で同時に標的とする可能性のあるRNAとタンパク質の数が限られていることが含まれます。
ここでは、新鮮な凍結マウス脳調製物と固定マウス脳調製物の両方を使用して、RNAscope FISHとそれに続く蛍光免疫染色を使用して、同じ脳切片内の複数のmRNAとタンパク質をそれぞれ検出するプロトコルについて説明します。免疫組織化学的に同定された脳幹核において、少量のmRNA(ガラニン受容体1など)と高存在量のmRNA(グリシントランスポーター2など)の発現パターンを記述するために、組み合わせた方法を使用します。
FISHアッセイの下流におけるタンパク質ラベリングに関する重要な考慮事項は、組織調製やFISHプローブラベリングの最適化にとどまりません。例えば、抗体の結合と標識の特異性は、FISHプローブアッセイ内のプロテアーゼステップによって悪影響を受ける可能性があることがわかりました。プロテアーゼは、ペプチド結合の加水分解による切断を触媒し、FISHプローブの細胞内への侵入を促進しますが、その後のIHCアッセイで標的とされたタンパク質を消化し、オフターゲット結合を生じさせる可能性もあります。標的タンパク質の細胞内位置も、FISHプローブアッセイ後のIHCの成功に寄与する要因です。標的タンパク質が膜結合している場合、IHC特異性は維持されるのに対し、細胞質タンパク質を標的とするIHCには広範なトラブルシューティングが必要であることが観察されました。最後に、スライドマウントされた固定凍結組織の取り扱いは、新鮮な凍結組織よりも難しいことがわかりましたが、RNAscopeと組み合わせると、固定凍結組織のIHC品質が全体的に向上しました。
概要
ニューロンの亜集団を神経化学的に定義するタンパク質およびmRNAは、通常、免疫組織化学(IHC)および/または in situ ハイブリダイゼーション(ISH)の組み合わせでそれぞれ同定されます。ISHとIHC技術を組み合わせることで、マルチプレックス標識能力を最大化することにより、機能性ニューロンに特有の共局在パターンの特性評価(神経化学的コーディング)が容易になります。
RNAscopeを含む蛍光ISH(FISH)法は、放射性ISHや非放射性発色性ISHなどの以前のRNA検出法と比較して、より高い感度と特異性を備えています。FISHは、単一のmRNA転写産物を点状染色スポットとして可視化することができます1。さらに、RNAscopeアッセイでは、異なる蛍光色素タグを用いて、一度により多くのRNAターゲットを標識することができます。これらの利点にもかかわらず、技術的な制限により、1回の実験で使用できる蛍光色素/発色剤の数に影響を与える可能性があります。これらには、顕微鏡フィルターセットの可用性が含まれます。神経化学的同定でFISHとIHCを組み合わせて使用する場合、一方の方法に最適な固有のステップが他方の方法に悪影響を与える可能性があるため、各手法を単独で使用する場合と比較して、このような考慮事項は複雑になります。
IHCと組み合わせたFISHの以前の適用では、ヒトB細胞リンパ腫2、ニワトリ胚3、ゼブラフィッシュ胚4、マウス網膜5、およびマウス内耳細胞6で特異的な細胞標的の発現が実証されています。これらの研究では、組織調製はホルマリン固定パラフィン包埋(FFPE)2,3,5または新鮮なホールマウント4,6のいずれかでした。他の研究では、固定されたマウスおよびラットの脳調製物に発色RNAスコープを適用しました7,8,9。特に、Baleriola et al.図8には、ISH-IHCを組み合わせた2つの異なる組織調製物が記載されていた。マウスの脳のセクションとFFPEのヒトの脳のセクションを修正しました。最近の論文では、FISHと蛍光IHCを新鮮凍結切片で組み合わせ、脳幹網様体中の低存在量mRNA(ガラニン受容体1、GalR1)、高存在量mRNA(グリシントランスポーター2、GlyT2)、小胞性アセチルコリントランスポーター(vAChT)タンパク質10を同時に可視化しました。
孤立路核(NTS)は、自律神経機能に関与する主要な脳領域です。後脳に位置するこの不均一なニューロン集団は、呼吸を調節するものを含む膨大な数の自律神経信号を受信して統合します。NTSはいくつかのニューロン集団を有しており、GalR1およびGlyT2を含むmRNA標的の発現パターン、および酵素チロシンヒドロキシラーゼ(TH)および転写因子ペア様ホメオボックス2b(Phox2b)のタンパク質マーカーによって表現型的に特徴付けられる可能性がある。
RNAscopeの所有者は、新鮮な凍結組織調製物を推奨していますが、固定凍結組織切片の長期凍結保護(-20°Cでの保存)とともに、全動物経心灌流固定によって調製された組織は、多くの研究室で一般的です。そこで、新鮮凍結および固定凍結組織調製物を用いたIHCと組み合わせたFISHのプロトコールの確立を目指しました。ここでは、新鮮な凍結および固定凍結された脳切片を提供します:(1)FISHと蛍光IHCを組み合わせたプロトコル、(2)各調製物を利用する場合に生成されるmRNAおよびタンパク質標識の品質の説明、(3)NTSにおけるGalR1およびGlyT2の発現の説明。
私たちの研究は、RNAscopeの方法論と組み合わせた場合、IHCの成功は、新鮮な凍結製剤と固定凍結製剤で異なり、細胞内の標的タンパク質の局在に依存することが明らかになりました。私たちの手では、膜結合タンパク質のラベリングは常に成功していました。対照的に、細胞質タンパク質のIHCは、トランスジェニック動物(Phox2b-GFP)で細胞質タンパク質が過剰発現している場合でもトラブルシューティングが必要でした11。最後に、GalR1はNTSの非カテコールアミン作動性ニューロンで発現しているが、GlyT2の発現はNTSでは存在しない。
プロトコル
組織の前処理ステップの概要を 図1に示します。すべての手順は、科学目的での動物の使用とケアに関するガイドライン(オーストラリア国立保健医療研究評議会)に従って、ニューサウスウェールズ大学の動物管理および倫理委員会に準拠して実施されました。
1. 新鮮凍結脳組織の試料作製
- 経心灌流
- ヘパリン処理(2500 U/L)0.1 Mリン酸緩衝液(PB)、pH 7.5を調製します。ドライアイスとエタノールを混合してドライアイスエタノールスラリーを作ります。これは約-72°Cの温度を持ち、採取された組織の即時凍結に使用されます。
- 成体C57BL/6およびPhox2b-GFP11(マウスゲノムインフォマティクスデータベースID MGI:5776545)マウスを、27.5インチのニードルゲージを使用してペントバルビタールナトリウム(70 mg/kg、i.p.)で麻酔することにより安楽死させる。
注意:ペントバルビタールはバルビツール酸です。.高用量では急性毒性があり、呼吸停止により死に至る可能性があります。使用する前に、地域の医療、法律、および物質安全ガイドラインを参照してください。 - 心臓を露出させ、左心室を描画針(23インチゲージ)でカニューレ挿入します。11〜13 mL / minの流量で血液が透明になるまで(2〜3分)、ヘパリン処理された0.1 M PBで経心灌流を実行します。.肝臓の色と右心房からの滲出液を監視して、血液の浄化を決定します12。
- 頭蓋腔から脳を分離し、すぐに極低温またはアルミホイルの最適切削温度コンパウンド(OCT)に埋め込み、ドライアイスエタノール浴に置きます。凍結包埋組織は、-80°Cの密閉容器に入れて最大3ヶ月間保管してください。
- 新鮮凍結組織の切片化
- クライオスタット温度を-20°Cに設定します。 OCT包埋組織とクライオスタットチャックをクライオスタットに~30分間放置し、新しい温度に平衡化させます。
注意: 組織は常に凍結してください。組織を-80°Cの冷凍庫からドライアイス上のクライオスタットに輸送します。 - OCTコンパウンドを使用して、組織を事前に冷却したクライオスタットチャックに固定します。このプロトコルでは、組織ブロックを冠状面のチャックに取り付けました。
注:カミソリの刃を使用して組織から余分なOCTをトリミングし、クライオスタットによって切断され、その後スライドガラスに転写されるOCTの量を最小限に抑えます。 - 厚さ14 μmの冠状切片を切断し、荷電ガラス顕微鏡スライドに取り付けます。
- セクションを取り付ける前に、スライドを室温まで温めてください。切片を取り付けたら、スライドをクライオスタットのスライドボックスに保管します。
- 1つのスライドに複数のセクションを取り付ける必要がある場合は、スライドの反対側に指を5〜10秒間置いて、セクションがスライドに接着しやすくして、2番目のセクションの領域を温めます。コールドティッシュセクションはコールドスライドに取り付けられません。セクションはスライドに平らに接着する必要があります。折りたたむと、洗浄ステップ中にスライドから脱落します。
- 切片に亀裂が見られる場合は、クライオスタットの温度を1〜5°C上げて、これを回避してください。組織切片を同じスライド上に互いに近接して配置することが特に重要です。これにより、アッセイ中のFISHプローブと試薬の浪費を防ぐことができます。
- スライドガラスに取り付けた組織切片は、-80°Cの密閉容器に入れて最大6ヶ月間保管してください。
注:RNAの分解を防ぐために、切片は常に凍結し、凍結融解サイクルを避けてください。スライドボックスをクライオスタット内からドライアイスで-80°Cの冷凍庫に運びます。
- クライオスタット温度を-20°Cに設定します。 OCT包埋組織とクライオスタットチャックをクライオスタットに~30分間放置し、新しい温度に平衡化させます。
- 新鮮凍結組織の固定
- FISHプローブアッセイを実施する日に、0.1 M PB、pH 7.5(4% PFA溶液)中の4%パラホルムアルデヒド(PFA)を調製します。濾紙(グレード1:11μm、 材料表)をブフナー漏斗またはるつぼフィルターに通してろ過します。
注意:PFAは、皮膚への接触または吸入により有害で有毒です。PFA溶液を用いたすべての手順は、ドラフトキャビネットで実施する必要があります。PFA溶液廃棄物は、制度上の安全プロトコルに従って慎重に廃棄する必要があります。 - 4% PFA溶液を4°Cまで冷却します。 スライドマウントした組織を-80°Cの冷凍庫からドライアイスに入れて輸送し、すぐに予冷した固定液に15分間浸します。
注:この固定ステップは、過剰固定により非特異的なバックグラウンドラベリングが発生するため、15分を超えないことが重要です。
- FISHプローブアッセイを実施する日に、0.1 M PB、pH 7.5(4% PFA溶液)中の4%パラホルムアルデヒド(PFA)を調製します。濾紙(グレード1:11μm、 材料表)をブフナー漏斗またはるつぼフィルターに通してろ過します。
- 新鮮凍結組織の脱水
- スライドを段階的な濃度のエタノールに浸すことにより、組織切片を脱水します。コプリンジャーに、最初に50%、次に70%、最後に無水エタノールに室温でそれぞれ5分間浸します。最後の絶対エタノールインキュベーションを2回目に繰り返します。
- スライドを風乾し、疎水性バリアペンを使用してセクションの輪郭を描き、内部の面積が最小限に抑えられるようにします。
注意: 疎水性バリアを引く前に、スライドガラスが完全に乾いていることを確認してください。疎水性バリアは、組織切片を隙間なく完全に囲む必要があり、さらに処理する前に乾燥させる必要があります。
2. 固定凍結脳組織の試料作製
- 経心灌流固定術
- ペントバルビタールナトリウム(70 mg / kg、i.p)で麻酔をかけた後、最初に0.1 M PBで経心灌流し、次に4%PFA溶液でマウスを安楽死させます。11〜13 mL / minで10分間の灌流で固定します。
- 灌流固定後に頭蓋腔から脳を分離し、4%PFA溶液に4°Cで一晩浸します。
- 固定組織の組織切片化
- 解剖顕微鏡の助けを借りて、細かい鉗子を使用して髄膜層を除去する前に、滅菌された0.1 Mリン酸緩衝生理食塩水(PBS)で脳をすすぎます。
- 脳マトリックス(材料表)を使用して、脳を正確にブロックに切断します(ビブラトーム切片を作成する前に、脳幹を前脳から分離します)。具体的には、錐体脱落部で脳幹を尾側に切断し、小脳を解剖します。同様に、前脳を視交叉のすぐ吻側で切断します。
- シアノアクリレートを使用して組織を振動ミクロトームチャックに固定し、2%寒天溶液に埋め込みます。
- 振動ミクロトームを用いて厚さ30 μmの組織切片を切断し、切断した切片を凍結保護液(30%RNase遊離スクロース、30%エチレングリコール、1%ポリビニルピロリドン(PVP-40)、0.1 M PB、pH 7.4)で保存します。組織切片は、-20°Cの凍結保護剤で最大6ヶ月間保存できます。
- FISH前の固定切片の準備
- FISHの日に、フリーフローティングセクションを3回、1回の洗浄で10分間洗浄し、凍結保護液を除去します。洗浄するには、切片を 0.1 M PBS の 12 ウェル細胞培養プレートに入れ、回転式プラットフォームシェーカー (90 - 100 rpm) で撹拌します。
- 洗浄後、絵筆を使用してガラス顕微鏡スライドに切片をマウントし、少なくとも2時間風乾します。
注意: セクションは、顕著な折り目があると洗浄中に剥がれるため、スライドに平らに接着する必要があります。 - 疎水性バリアペンを使用して、切片の周囲にバリアを描き、FISH試薬を切片に制限します。繰り返しになりますが、バリアペンで描かれたアウトラインの内部領域を最小限に抑えることが重要です。
可能なブレークポイント:切片を室温で一晩保存し、翌日アッセイを継続することができます。
3. FISHアッセイ
注:プロトコルの残りの部分は、新鮮な凍結組織と固定凍結組織の両方に適用されます。
- ハイブリダイゼーションおよび増幅ステップ用の試薬および機器を準備します。
- 卓上インキュベーターとウォーターバスを40°Cに設定します。
- スライドをインキュベートするための加湿された遮光チャンバーを準備します。加湿は組織の乾燥を防ぎます-スライドは湿ったリザーバーの上にしっかりと配置されます。理想的には、チャンバーは頑丈なポリスチレンでできており、飽和した水蒸気雰囲気を維持するために耐光性と気密性があります。チャンバーの閉鎖は、動きを避けるために最小限の摩擦に依存しています。下部にウェットティッシュ(材料表)を並べたスライドボックスを使用しました。スライドボックスをインキュベーター内に置き、40°Cに予熱します。
- 50x Wash Buffer(材料表)とプローブをウォーターバスで40°Cに10分間温め、室温まで冷却します。
- 50倍のストック濃度から1 Lの1x Wash Bufferを調製します。
- プローブ混合物の調製(材料表):C1 プローブはストック濃度ですぐに使用できますが、C2 および C3 プローブは 50 倍の濃度で出荷されるため、キットに付属の希釈液で希釈する必要があります。
注:プローブ混合物は、4°Cで最大6か月間保存できます。
- プロテアーゼ治療
- 切片をプロテアーゼIII(材料表)とともに室温で30分間インキュベートします。
注:下流プロセス(プローブ混合物、増幅溶液、ブロッキングバッファー、抗体血清)のプロテアーゼIIIおよびインキュベーション試薬が切片を完全に覆っていることを確認してください。ピペットチップを使用して試薬を切片に広げ、疎水性バリアの内側の領域全体を覆うことができます。 - スライドを0.1 M PBSで2回、毎回2分間、大きなプラスチック製の正方形のペトリ皿で洗浄します。ここでは、245 mm x 245 mm角のバイオアッセイディッシュを使用しました(材料表)。皿の片側から持ち、3〜5回静かに傾けます。洗浄後、余分な 0.1 M PBS をスライドからはじき取り、すぐに次の試薬を添加します。組織切片を乾燥させないでください。
注:各洗浄中、スライドは室温の溶液に浸されます。これは、後続のすべての洗浄ステップのワークフローです。厚さ30μmの固定切片は、厚さ14μmの切片よりもスライドから外れやすく、洗浄中は穏やかです。
- 切片をプロテアーゼIII(材料表)とともに室温で30分間インキュベートします。
- ハイブリダイゼーションと増幅
- プロテアーゼ溶液を洗い流した後、スライドを加湿し、予熱したチャンバーに入れます。プローブ混合物(材料表)で切片をベンチトップインキュベーター内で40°Cで2時間インキュベートします。
注:サンプルの RNA の品質と最適な透過処理を評価するために、ポジティブコントロールプローブとネガティブコントロールプローブ用に少なくとも 2 つのセクションを確保してください。ポジティブコントロールプローブは、ハウスキーピング遺伝子を標的としています。ここでは、ユビキチンC(UBC;高存在量)、ペプチジルプロピルイソメラーゼB(PPIB;中程度の存在量)、およびRNAポリメラーゼ2a(POLR2A;低存在量)を標的とするRNAのカクテルです。ネガティブコントロールプローブは、マウスの脳サンプルには通常存在しない細菌の4-ヒドロキシ-テトラヒドロジピコリン酸レダクターゼ(DapB)遺伝子を標的としています。正のDapBシグナルは、サンプルの非特異的シグナルおよび/または細菌汚染を示します。 - プローブ混合物とのハイブリダイゼーションに続いて、シグナル増幅ステップは、Amp 1-FL(30 分)、次に Amp 2-FL(15 分)、続いて Amp 3-FL(30 分)、最後に Amp 4-FL(15 分)でそれぞれ 40 °C でインキュベーションします。 付属のスポイトボトルを使用して、組織切片を増幅液で覆います。最後の増幅ステップに続いてIHCアッセイに進みます。
- プローブハイブリダイゼーションと各増幅ステップの間に、Wash Bufferで2分間スライドを2回すすぎます。
- プロテアーゼ溶液を洗い流した後、スライドを加湿し、予熱したチャンバーに入れます。プローブ混合物(材料表)で切片をベンチトップインキュベーター内で40°Cで2時間インキュベートします。
4. IHCアッセイ
- IHCブロッキングステップ
- 抗体の非特異的結合を防ぐため、FISHアッセイ後、切片を1x TBSm(50 mM Tris-Cl、pH 7.5、150 mM NaCl、0.05%メルチオレート)中の10%正常ウマ血清、0.3%Tween20を含むブロッキング溶液と室温で1時間インキュベートします。1x TBSm、5%正常ウマ血清、0.1%Tween20を含む希釈バッファーで一次抗体を調製します。一次抗体のサプライヤーは、 材料表に記載されています。
- 免疫組織化学
- スライドをフリックして余分なブロッキングバッファーを除去し、一次抗体で切片を4°Cで一晩インキュベートします。
- 1x TBSmでスライドを3回(各5分)洗浄し、1x TBSm、1%の正常ウマ血清、0.1%のTween20を含む希釈液中の二次抗体とともに室温で2時間インキュベートします。このプロトコルで使用される二次抗体は、 材料表にリストされています。
- 1x TBSm(各5分)でスライドを3回洗浄してから、DAPI(材料表)の有無にかかわらず封入剤でカバースリップします。
5. イメージング
- カメラを装備した落射蛍光顕微鏡で免疫染色を調べます(詳細は 資料表 を参照)。20倍の倍率で代表的な画像を取得し、TIFFファイルとして保存します。
- 代表的な画像を画像処理ソフトウェア(材料表)にエクスポートして明るさ/コントラストを調整し、明瞭さを高め、実際のレンダリングを反映します。
6. オプション:標的転写産物の定量分析
注:これはメソッドの記事であり、定量的な結果は提供されていません。ここで紹介する定量化の方法は、Dereli et al.10.
- 5.1で説明したように関心領域から画像を取得し、同じ蛍光色素のすべての画像に同じ顕微鏡とカメラの設定(露光時間や光強度など)を適用します。
- 画像解析ソフトウェア(Table of Materials)を使用してニューロンのプロファイルをプロットします。
- 脳定位固定装置アトラス13に従ってブレグマレベルを参照してセクションを揃えます。
- 同じ蛍光色素のすべての画像に同じ明るさとコントラストを適用します。DAPI染色された核を持つニューロンのみを考慮してください。
- 関心領域内のmRNA、タンパク質発現、mRNA/mRNA、タンパク質/タンパク質、mRNA/タンパク質共発現細胞の数を手動でカウントします。
- 実験結果の偏りを減らすには、実験結果を定量化する人に実験群を盲検化してもらいます。
- 次のアバコンビー式を使用して、アバクロンビー補正14 を合計細胞数に適用します。
補正された細胞数 = 手動細胞数 x 切片の厚さ / (切片の厚さ + 核サイズ)
例えば、厚さ14μmの切片の場合、5匹の動物における30個の細胞および10個の切片に基づいて、平均核幅は7.7±0.3μm、平均切片の厚さは14±1μmと計算される。アバクロンビーの式によると、補正された細胞数は、手動細胞数 x 14/(14+7.7)になります。

図1:新鮮凍結組織とパラホルムアルデヒド固定組織の両方の組織前処理ステップの並列ワークフロー。 新鮮凍結組織の処理ステップは赤枠のボックスで囲まれ、パラホルムアルデヒド(PFA)固定組織の処理ステップは青色の枠で囲まれたボックスに表示されます。 この図の拡大版をご覧になるには、ここをクリックしてください。
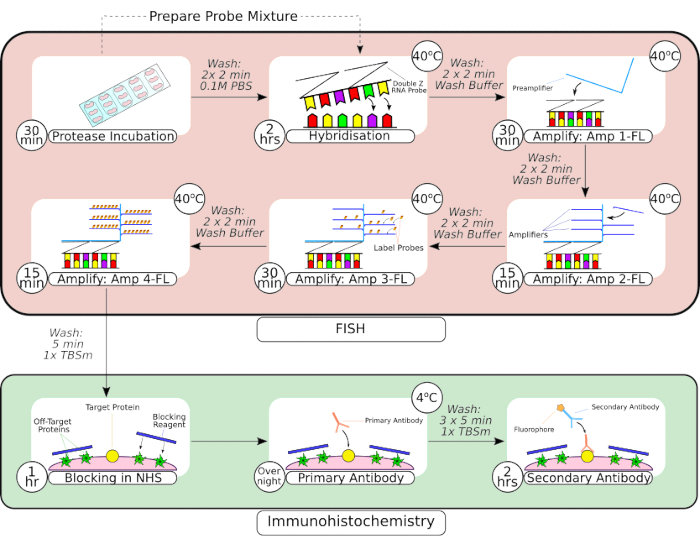
図2:FISHプローブと免疫組織化学を組み合わせた手順の概要。 組織の前処理に続いて、スライドに取り付けられた組織を、最初のフレームに見られるように、疎水性バリアペンを使用して取り囲み、室温でプロテアーゼ溶液中でインキュベートします。洗浄後、組織を卓上インキュベーターに移し、ハイブリダイゼーションのために2時間、その後、逐次増幅ステップを踏む。 in situ ハイブリダイゼーションシステムは、フレーム3〜6に見られるように、独自の「Zプローブ」設計、プリアンプ、およびアンプを利用しています。組織がFISHプローブ処理を受けたら、通常の馬血清でブロッキングする前に洗浄します。一次抗体のインキュベーションは、抗体と抗原の結合を最大化するために、4°Cで一晩行われます。二次抗体のインキュベーション(2時間)は室温で行った。 この図の拡大版をご覧になるには、ここをクリックしてください。
結果
ここでは、マルチプレックスFISHと蛍光IHCを組み合わせて、マウスNTSでそれぞれ新鮮凍結およびパラホルムアルデヒド固定組織を使用して、GalR1およびGlyT2のmRNA発現を局在化させる方法の概要を説明します。図 1 および 図2に、これらの方法で説明した組織処理、FISHおよびIHC手順のパイプラインを示します。 表1 に、各図で使用したFISH?...
ディスカッション
神経科学では、FISHとIHCは、ニューロン亜集団内のmRNAまたはタンパク質の空間的構成と機能的意義を調査するために日常的に使用されています。この研究で記述されているプロトコルは頭脳セクションのmRNAsそして蛋白質の同時検出のための容量を高める。マルチプレックスFISH-IHCアッセイの組み合わせにより、新鮮な凍結脳製剤と固定脳製剤の両方において、NTSの異なるニューロン亜集団の?...
謝辞
この研究は、オーストラリア研究評議会のディスカバリープロジェクト助成金DP180101890およびレベッカLクーパー医学研究財団プロジェクト助成金PG2018110によって資金提供されました
資料
| Name | Company | Catalog Number | Comments |
| ANIMALS | |||
| C57BL/6 mouse | Australian BioResources, Moss Vale | MGI: 2159769 | |
| Phox2b-eGFP mouse | Australian BioResources, Moss Vale | MGI: 5776545 | |
| REAGENTS | |||
| Cyanoacrylate | Loctite | ||
| Ethylene Glycol | Sigma-Aldrich | 324558 | |
| Heparin-Sodium | Clifford Hallam Healthcare | 1070760 | Consult local veterinary supplier or pharmacy. |
| Lethabarb (Sodium Pentabarbitol) Euthanasia Injection | Virbac (Australia) Pty Ltd | N/A | Consult a veterinarian for local pharmaceutical regulations regarding Sodium Pentabarbitol |
| Molecular grade agarose powder | Sigma Aldrich | 5077 | |
| OCT Compound, 118mL | Scigen Ltd | 4586 | |
| Paraformaldehyde, prilled, 95% | Sigma-Aldrich | 441244-1KG | |
| Polyvinylpyrrolidone, average mol wt 40,000 (PVP-40) | Sigma-Aldrich | PVP40 | |
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | With or without DAPI |
| RNAscope Multiplex Fluorescent Reagent Kit (up to 3-plex capability) | Advanced Cell Diagnostics, Inc. (ACD Bio) | ADV320850 | Includes 50x Wash buffer and Protease III |
| RNase Away | Thermo-Fisher Scientific | 7003 | |
| Tris(hydroxymethyl)aminomethane | Sigma-Aldrich | 252859 | |
| Tween-20, for molecular biology | Sigma-Aldrich | P9416 | |
| EQUIPMENT | |||
| Benchtop incubator | Thermoline scientific micro incubator | Model: TEI-13G | |
| Brain Matrix, Mouse, 30g Adult, Coronal, 1mm | Ted Pella | 15050 | |
| Cryostat | Leica | CM1950 | |
| Drawing-up needle (23 inch gauge) | BD | 0288U07 | |
| Hydrophobic Barrier Pen | Vector labs | H-4000 | |
| Kimtech Science Kimwipes Delicate Task Wipes | Kimberley Clark Professional | 34120 | |
| Olympus BX51 | Olympus | BX-51 | |
| Peristaltic pump | Coleparmer Masterflex | L/S Series | |
| Retiga 2000R Digital Camera | QImaging | RET-2000R-F-CLR | colour camera |
| SuperFrost Plus Glass Slides (White) | Thermo-Fisher Scientific | 4951PLUS4 | |
| Vibrating Microtome (Vibratome) | Leica | VT1200S | |
| Whatman qualitative filter paper, Grade 1, 110 mm diameter | Merck | WHA1001110 | |
| SOFTWARES | |||
| CorelDRAW | Corel Corporation | Version 7 | |
| FIJI (ImageJ Distribution) | Open Source/GNU General Public Licence (GPL) | N/A | ImageJ 2.x: Rueden, C. T.; Schindelin, J. & Hiner, M. C. et al. (2017), "ImageJ2: ImageJ for the next generation of scientific image data", BMC Bioinformatics 18:529, PMID 29187165, doi:10.1186/s12859-017-1934-z and Fiji: Schindelin, J.; Arganda-Carreras, I. & Frise, E. et al. (2012), "Fiji: an open-source platform for biological-image analysis", Nature methods 9(7): 676-682, PMID 22743772, doi:10.1038/nmeth.2019 |
| PRIMARY ANTIBODIES | |||
| Anti-Tyrosine Hydroxylase Antibody | Millipore Sigma | AB1542 | Sheep polyclonal (1:1000 dilution), RRID: AB_90755 |
| Anti-Tyrosine Hydroxylase Antibody, clone LNC1 | Millipore Sigma | MAB318 | Mouse monoclonal (1:1000 dilution), RRID: AB_2201528 |
| Anti-Vesicular Acetylcholine Transporter (VAchT) Antibody | Sigma-Aldrich | ABN100 | Goat polyclonal (1:1000 dilution), RRID: AB_2630394 |
| GFP Antibody | Novus Biologicals | NB600-308 | Rabbit polyclonal (1:1000 dilution), RRID: AB_10003058 |
| Phox2b Antibody (B-11) | Santa Cruz Biotechnology | sc-376997 | Mouse monoclonal (1:1000 dilution), RRID: AB_2813765 |
| SECONDARY ANTIBODIES | |||
| Alexa Fluor 488 AffiniPure Donkey Anti-Rabbit IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Ms, Rat, Shp Sr Prot) | Jackson ImmunoResearch | 711-545-152 | Donkey anti-Rabbit (1:400 dilution), RRID: AB_2313584 |
| AMCA AffiniPure Donkey Anti-Sheep IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 713-155-147 | Donkey anti-Sheep (1:400 dilution), RRID: AB_AB_2340725 |
| Cy5 AffiniPure Donkey Anti-Goat IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 705-175-147 | Donkey anti-Goat (1:400 dilution), RRID: AB_2340415 |
| Cy5 AffiniPure Donkey Anti-Mouse IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Rb, Rat, Shp Sr Prot) | Jackson ImmunoResearch | 715-175-151 | Donkey anti-Mouse (1:400 dilution), RRID: AB_2619678 |
| Cy5 AffiniPure Donkey Anti-Sheep IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 713-175-147 | Donkey anti-Sheep (1:400 dilution), RRID: AB_2340730 |
| RNASCOPE PROBES | |||
| Galanin Receptor 1 oligonucleotide probe | ACDBio | 448821-C1 | targets bp 482 - 1669 (Genebank ref: NM_008082.2) |
| Glycine transporter 2 oligonucleotide probe | ACDBio | 409741-C3 | targets bp 925 - 2153 (Genebank ref: NM_148931.3) |
| Phox2b oligonucleotide probe | ACDBio | 407861-C2 | targets bp 1617 - 2790 (Genebank ref: NM_008888.3) |
参考文献
- Wang, F., et al. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Annese, T., et al. RNAscope dual ISH-IHC technology to study angiogenesis in diffuse large B-cell lymphomas. Histochemistry and Cell Biology. 153 (3), 185-192 (2020).
- Morrison, J. A., McKinney, M. C., Kulesa, P. M. Resolving in vivo gene expression during collective cell migration using an integrated RNAscope, immunohistochemistry and tissue clearing method. Mechanisms of Development. 148, 100-106 (2017).
- Gross-Thebing, T., Paksa, A., Raz, E. Simultaneous high-resolution detection of multiple transcripts combined with localization of proteins in whole-mount embryos. BMC Biology. 12, 55 (2014).
- Stempel, A. J., Morgans, C. W., Stout, J. T., Appukuttan, B. Simultaneous visualization and cell-specific confirmation of RNA and protein in the mouse retina. Molecular Vision. 20, 1366-1373 (2014).
- Kersigo, J., et al. A RNAscope whole mount approach that can be combined with immunofluorescence to quantify differential distribution of mRNA. Cell and Tissue Research. 374 (2), 251-262 (2018).
- Grabinski, T. M., Kneynsberg, A., Manfredsson, F. P., Kanaan, N. M. A method for combining RNAscope in situ hybridization with immunohistochemistry in thick free-floating brain sections and primary neuronal cultures. PLoS One. 10 (3), 0120120 (2015).
- Baleriola, J., Jean, Y., Troy, C., Hengst, U. Detection of axonally localized mRNAs in brain sections using high-resolution in situ hybridization. Journal of Visualized Experiments. (100), e52799 (2015).
- Fe Lanfranco, M., Loane, D. J., Mocchetti, I., Burns, M. P., Villapol, S. Combination of fluorescent in situ hybridization (FISH) and immunofluorescence imaging for detection of cytokine expression in microglia/macrophage cells. Bio-Protocol. 7 (22), (2017).
- Dereli, A. S., Yaseen, Z., Carrive, P., Kumar, N. N. Adaptation of respiratory-related brain regions to long-term hypercapnia: focus on neuropeptides in the RTN. Frontiers in Neuroscience. 13, 1343 (2019).
- Lazarenko, R. M., et al. Acid sensitivity and ultrastructure of the retrotrapezoid nucleus in Phox2b-EGFP transgenic mice. Journal of Comparative Neurology. 517 (1), 69-86 (2009).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Paxinos, G., Franklin, K. B. . The mouse brain in stereotaxic coordinates. , (2004).
- Abercrombie, M. Estimation of nuclear population from microtome sections. Anatomical Records. 94, 239-247 (1946).
- Kerr, N., et al. The generation of knock-in mice expressing fluorescently tagged galanin receptors 1 and 2. Molecular and Cellular Neurosciences. 68, 258-271 (2015).
- Kachidian, P., Pickel, V. M. Localization of tyrosine hydroxylase in neuronal targets and efferents of the area postrema in the nucleus tractus solitarii of the rat. Journal of Comparative Neurology. 329 (3), 337-353 (1993).
- Stornetta, R. L., et al. Expression of Phox2b by brainstem neurons involved in chemosensory integration in the adult rat. Journal of Neuroscience. 26 (40), 10305-10314 (2006).
- Gilmor, M. L., et al. Expression of the putative vesicular acetylcholine transporter in rat brain and localization in cholinergic synaptic vesicles. Journal of Neuroscience. 16 (7), 2179-2190 (1996).
- Fisher, J. M., Sossin, W., Newcomb, R., Scheller, R. H. Multiple neuropeptides derived from a common precursor are differentially packaged and transported. Cell. 54 (6), 813-822 (1988).
- Towle, A. C., Lauder, J. M., Joh, T. H. Optimization of tyrosine-hydroxylase immunocytochemistry in paraffin sections using pretreatment with proteolytic-enzymes. Journal of Histochemistry and Cytochemistry. 32 (7), 766-770 (1984).
- Biancardi, V., et al. Mapping of the excitatory, inhibitory, and modulatory afferent projections to the anatomically defined active expiratory oscillator in adult male rats. Journal of Comparative Neurology. 529 (4), 853-884 (2021).
- Matthews, D. W., et al. Feedback in the brainstem: an excitatory disynaptic pathway for control of whisking. Journal of Comparative Neurology. 523 (6), 921-942 (2015).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Shi, S. R., Key, M. E., Kalra, K. L. Antigen retrieval in formalin-fixed, paraffin-embedded tissues: an enhancement method for immunohistochemical staining based on microwave oven heating of tissue sections. Journal of Histochemistry and Cytochemistry. 39 (6), 741-748 (1991).
- Yamashita, S., Katsumata, O. Heat-induced antigen retrieval in immunohistochemistry: mechanisms and applications. Methods in Molecular Biology. 1560, 147-161 (2017).
- Yamashita, S., Okada, Y. Mechanisms of heat-induced antigen retrieval: analyses in vitro employing SDS-PAGE and immunohistochemistry. Journal of Histochemistry and Cytochemistry. 53 (1), 13-21 (2005).
- Yamashita, S. Heat-induced antigen retrieval: mechanisms and application to histochemistry. Progress in Histochemistry and Cytochemistry. 41 (3), 141-200 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved