Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Multipleks Floresan In Situ Hibridizasyonun Floresan İmmünohistokimya ile Taze Dondurulmuş veya Sabit Fare Beyin Kesitlerinde Birleştirilmesi
Bu Makalede
Özet
Bu protokol, çok etiketli FISH ve floresan IHC sinyali elde etmek amacıyla hem taze dondurulmuş hem de sabit fare beyin bölümlerinde floresan in situ hibridizasyon (FISH) ve floresan immünohistokimyasını (IHC) birleştirmek için bir yöntemi açıklar. IHC, sitoplazmik ve membrana bağlı proteinleri hedefledi.
Özet
Floresan in situ hibridizasyon (FISH), hücreler içindeki spesifik RNA transkriptlerinin varlığını ve uzamsal dağılımını tanımlayan moleküler bir tekniktir. Fonksiyonel olarak tanımlanmış nöronların nörokimyasal fenotiplemesi genellikle immünohistokimya (IHC) kullanılarak çoklu antikorlarla (hedefleme proteini) eşzamanlı etiketlemeyi ve in situ hibridizasyonun (RNA'yı hedefleme) birlikte optimizasyonunu gerektirir. Belirli nöronları karakterize etmek için bir "nörokimyasal imza" elde edilebilir, ancak karmaşık faktörler arasında, yöntemleri birleştirmeden önce FISH ve IHC hedeflerini doğrulama ihtiyacı ve aynı doku bölümü içinde aynı anda hedeflenebilecek sınırlı sayıda RNA ve protein bulunur.
Burada, hem taze dondurulmuş hem de sabit fare beyni preparatlarını kullanan, sırasıyla RNAscope FISH ve ardından floresan immün boyama kullanarak aynı beyin bölümündeki birden fazla mRNA'yı ve proteini tespit eden bir protokolü açıklıyoruz. İmmünohistokimyasal olarak tanımlanmış beyin sapı çekirdeklerinde düşük bolluklu mRNA'ların (örneğin, galanin reseptörü 1) ve yüksek bolluklu mRNA'ların (örneğin, glisin taşıyıcı 2) ekspresyon modelini tanımlamak için kombine yöntemi kullanıyoruz.
FISH tahlilinin çıkış yönündeki protein etiketlemesi için temel hususlar, doku hazırlığı ve FISH prob etiketlemesinin optimizasyonunun ötesine uzanır. Örneğin, antikor bağlanmasının ve etiketleme özgüllüğünün, FISH prob tahlili içindeki proteaz adımından zararlı bir şekilde etkilenebileceğini bulduk. Proteazlar, peptit bağlarının hidrolitik bölünmesini katalize ederek FISH probunun hücrelere girişini kolaylaştırır, ancak aynı zamanda sonraki IHC testi tarafından hedeflenen proteini sindirerek hedef bağlanma üretebilirler. Hedeflenen proteinin hücre altı yerleşimi, FISH prob testini takiben IHC başarısına katkıda bulunan bir başka faktördür. Hedeflenen protein membrana bağlandığında IHC özgüllüğünün korunduğunu gözlemledik, oysa IHC sitoplazmik proteini hedefleyen kapsamlı sorun giderme gerektirdi. Son olarak, slayta monte edilmiş sabit donmuş dokuların işlenmesinin taze donmuş dokudan daha zor olduğunu gördük, ancak IHC kalitesi, RNAscope ile birleştirildiğinde sabit donmuş doku ile genel olarak daha iyiydi.
Giriş
Nöronların alt popülasyonlarını nörokimyasal olarak tanımlayan proteinler ve mRNA'lar genellikle sırasıyla immünohistokimya (IHC) ve/veya in situ hibridizasyon (ISH) kombinasyonu ile tanımlanır. ISH'nin IHC teknikleriyle birleştirilmesi, multipleks etiketleme kapasitesini en üst düzeye çıkararak fonksiyonel nöronlara özgü kolokalizasyon modellerinin karakterizasyonunu (nörokimyasal kodlama) kolaylaştırır.
RNAscope dahil olmak üzere floresan ISH (FISH) yöntemleri, radyoaktif ISH ve radyoaktif olmayan kromojenik ISH gibi önceki RNA tespit yöntemlerine kıyasla daha yüksek duyarlılık ve özgüllüğe sahiptir. FISH, tek mRNA transkriptlerinin noktasal lekeli noktalar olarak görselleştirilmesini sağlar1. Ayrıca, RNAscope testi, farklı florofor etiketleri kullanılarak bir seferde artan sayıda RNA hedefinin etiketlenmesine izin verir. Bu avantajlara rağmen, teknik sınırlamalar tek bir deneyde kullanılabilecek florofor/kromojen sayısını etkileyebilir. Bunlar arasında mikroskop filtre setlerinin mevcudiyeti; Bu tür düşünceler, nörokimyasal tanımlama, her bir tekniği ayrı ayrı kullanmaya kıyasla, kombine FISH ve IHC kullandığında, bir yöntem için en uygun doğal adımlar diğerine zarar verebileceğinden, daha da artar.
IHC ile kombine edilen FISH'in önceki uygulaması, insan B hücreli lenfomalarda2, civciv embriyolarında3, zebra balığı embriyolarında4, fare retina5 ve fare iç kulak hücrelerinde6 spesifik hücresel hedeflerin ekspresyonunu göstermiştir. Bu çalışmalarda, doku hazırlığı ya formalinle sabitlenmiş parafin gömülü (FFPE)2,3,5 ya da taze bütün montaj 4,6 idi. Diğer çalışmalar, sabit fare ve sıçan beyin preparatlarıüzerinde kromojenik RNAscope uyguladı 7,8,9. Özellikle, Baleriola ve ark.8 kombine ISH-IHC için iki farklı doku preparatı tanımladı; sabit fare beyni bölümleri ve FFPE insan beyni bölümleri. Yakın tarihli bir yayında, beyin sapı retiküler oluşumunda düşük bolluklu mRNA (galanin reseptörü 1, GalR1), yüksek bolluklu mRNA (glisin taşıyıcı 2, GlyT2) ve veziküler asetilkolin taşıyıcı (vAChT) proteini10'u aynı anda görselleştirmek için taze dondurulmuş bölümlerde FISH ve floresan IHC'yi birleştirdik.
Soliter sistemin (NTS) çekirdeği, otonomik fonksiyonda yer alan önemli bir beyin bölgesidir. Arka beyinde bulunan bu heterojen nöron popülasyonu, solunumu düzenleyenler de dahil olmak üzere çok sayıda otonomik sinyal alır ve entegre eder. NTS, GalR1 ve GlyT2 ve tirozin hidroksilaz (TH) enzimi için protein belirteçleri ve transkripsiyon faktörü Eşleştirilmiş benzeri homeobox 2b (Phox2b) dahil olmak üzere mRNA hedeflerinin ekspresyon modeli ile fenotipik olarak karakterize edilebilen birkaç nöronal popülasyonu barındırır.
RNAscope sahibi, taze donmuş doku preparatlarını önermektedir, ancak sabit donmuş doku bölümlerinin uzun süreli kriyoproteksiyonu (-20 ° C'de depolama) ile birlikte tüm hayvan transkardiyal perfüzyon fiksasyonu ile hazırlanan doku birçok laboratuvarda yaygındır. Bu nedenle, taze dondurulmuş ve sabit dondurulmuş doku preparatları kullanarak IHC ile kombinasyon halinde FISH için protokoller oluşturmaya çalıştık. Burada, taze dondurulmuş ve sabit donmuş beyin bölümleri sağlıyoruz: (1) kombine FISH ve floresan IHC için bir protokol (2) her preparat kullanılırken üretilen mRNA ve protein etiketlemesinin kalitesinin bir açıklaması (3) NTS'de GalR1 ve GlyT2 ekspresyonunun bir açıklaması.
Çalışmamız, RNAscope metodolojisi ile birleştirildiğinde, IHC başarısının taze dondurulmuş ve sabit dondurulmuş preparatlarda değiştiğini ve hedef proteinlerin hücre içindeki lokalizasyonuna bağlı olduğunu ortaya koymuştur. Bizim elimizde, membrana bağlı protein etiketlemesi her zaman başarılıydı. Buna karşılık, sitoplazmik protein için IHC, sitoplazmik proteinin transgenik bir hayvanda (Phox2b-GFP) aşırı eksprese edildiği durumlarda bile sorun gidermeyi gerektirdi11. Son olarak, NTS'de katekolaminerjik olmayan nöronlarda GalR1 eksprese edilirken, NTS'de GlyT2 ekspresyonu yoktur.
Protokol
Doku ön işleme adımlarının bir özeti Şekil 1'de bulunabilir. Tüm prosedürler, New South Wales Üniversitesi Hayvan Bakımı ve Etik Kurulu'na uygun olarak, hayvanların bilimsel amaçlarla kullanımı ve bakımı için yönergelere (Avustralya Ulusal Sağlık ve Tıbbi Araştırma Konseyi) uygun olarak gerçekleştirilmiştir.
1. Taze donmuş beyin dokusunun örnek hazırlanması
- Transkardiyal Perfüzyon
- Heparinize (2500 U/L) 0.1 M fosfat tamponu (PB), pH 7.5 hazırlayın. Kuru buzu etanol ile karıştırarak kuru buz etanol bulamacı yapın. Bu, yaklaşık -72 °C'lik bir sıcaklığa sahip olacak ve hasat edilen dokunun hemen dondurulması için kullanılacaktır.
- Yetişkin C57BL / 6 ve Phox2b-GFP11 (Fare Genom Bilişim veritabanı kimliği MGI: 5776545) fareleri, 27.5 inçlik bir iğne ölçer kullanarak sodyum pentobarbital (70 mg / kg, ip) ile uyuşturarak ötenazi yapın.
DİKKAT: Pentobarbital bir barbitürattır. Yüksek dozlarda akut toksiktir ve solunum durması ile ölüme neden olabilir. Kullanmadan önce yerel sağlık, yasal ve malzeme güvenliği yönergelerine bakın. - Kalbi açığa çıkarın ve sol ventrikülü bir çekme iğnesi (23 inç ölçü) ile kanüle edin. Kan 11-13 mL / dak akış hızında temizlenene kadar (2-3 dakika) heparinize 0.1 M PB ile transkardiyal perfüzyon gerçekleştirin. Karaciğerin renklenmesini ve sağ atriyumdan gelen effusatı izleyerek kan temizliğini belirleyin12.
- Beyni kafatası boşluğundan izole edin, hemen bir kriyokalıp veya alüminyum folyo içindeki Optimal Kesme Sıcaklığı Bileşiğine (OCT) gömün ve kuru buz etanol banyosuna yerleştirin. Donmuş gömülü dokuyu hava geçirmez bir kapta - 80 °C'de 3 aya kadar saklayın.
- Taze donmuş dokunun kesitlenmesi
- Kriyostat sıcaklığını -20 °C'ye ayarlayın. Yeni sıcaklığa dengelenmeye izin vermek için OCT gömülü dokuyu ve bir kriyostat aynasını kriyostatta ~ 30 dakika bırakın.
NOT: Dokuyu her zaman donmuş halde tutun; dokuyu -80 °C dondurucudan kuru buz üzerindeki kriyostata taşıyın. - OCT bileşiği kullanarak dokuyu önceden soğutulmuş kriyostat aynasına sabitleyin. Bu protokolde doku blokları koronal düzlemde aynaya monte edildi.
NOT: Kriyostat tarafından kesilen ve daha sonra cam slayta aktarılan OCT miktarını en aza indirmek için bir tıraş bıçağı kullanarak dokudaki fazla OCT'yi kesin. - 14 μm kalınlığında koronal kesitler kesin ve bunları yüklü cam mikroskopi slaytlarına monte edin.
- Bölümleri monte etmeden önce slaytları oda sıcaklığına ısıtın. Bölüm monte edildikten sonra, slaytları kriyostattaki bir slayt kutusunda saklayın.
- Bir kızağa birden fazla bölümün monte edilmesi gerekiyorsa, bölümün kızağa yapışmasına yardımcı olmak için sürgünün karşı tarafına parmağınızı koyarak 5-10 saniye boyunca ikinci bölümün alanını ısıtın. Soğuk doku bölümü soğuk bir slayta bağlanmaz. Bölümler slaytlara düz bir şekilde yapışmalıdır; Katlama, yıkama adımları sırasında kızaklardan düşmelerine neden olur.
- Bölümlerde çatlaklar fark edilirse, bunu önlemek için kriyostat sıcaklığını 1-5 °C artırın. Doku kesitlerini aynı slayt üzerinde birbirine yakın yerleştirmek özellikle önemlidir. Bu, test sırasında FISH problarının ve reaktiflerinin israfını önleyecektir.
- Cam slaytlara monte edilmiş doku bölümlerini hava geçirmez bir kapta -80 °C'de 6 aya kadar saklayın.
NOT: RNA bozulmasını önlemek için bölümleri her zaman donmuş halde tutun ve donma çözülme döngülerinden kaçının. Slayt kutusunu kriyostatın içinden kuru buz üzerinde -80 °C dondurucuya taşıyın.
- Kriyostat sıcaklığını -20 °C'ye ayarlayın. Yeni sıcaklığa dengelenmeye izin vermek için OCT gömülü dokuyu ve bir kriyostat aynasını kriyostatta ~ 30 dakika bırakın.
- Taze donmuş dokunun fiksasyonu
- FISH prob testinin yapılacağı gün, 0.1 M PB, pH 7.5 (%4 PFA çözeltisi) içinde %4 paraformaldehit (PFA) hazırlayın. Bir Buchner hunisi veya pota filtresinde filtre kağıdından (Sınıf 1: 11 μm, Malzeme Tablosu) geçirerek filtreleyin.
DİKKAT: PFA, cilt teması veya solunması durumunda zararlı ve toksiktir. PFA çözeltisi ile yapılan tüm işlemler bir davlumbaz kabininde yapılmalıdır. PFA çözeltisi atıkları, kurumsal güvenlik protokollerine uygun olarak dikkatli bir şekilde imha edilmelidir. - %4 PFA çözeltisini 4 °C'ye soğutun. Kızağa monte edilmiş mendili -80 °C dondurucudan kuru buzda taşıyın ve hemen 15 dakika boyunca önceden soğutulmuş fiksatife daldırın.
NOT: Bu sabitleme adımının 15 dakikayı geçmemesi önemlidir, çünkü aşırı sabitleme spesifik olmayan arka plan etiketlemesine neden olur.
- FISH prob testinin yapılacağı gün, 0.1 M PB, pH 7.5 (%4 PFA çözeltisi) içinde %4 paraformaldehit (PFA) hazırlayın. Bir Buchner hunisi veya pota filtresinde filtre kağıdından (Sınıf 1: 11 μm, Malzeme Tablosu) geçirerek filtreleyin.
- Taze donmuş dokunun dehidrasyonu
- Slaytları kademeli etanol konsantrasyonlarına daldırarak doku bölümlerini kurutun. Bir Coplin kavanozunda, her biri oda sıcaklığında 5 dakika boyunca önce %50, sonra %70 ve son olarak mutlak etanole daldırın. Son mutlak etanol inkübasyonunu ikinci kez tekrarlayın.
- Slaytları havayla kurutun ve hidrofobik bir bariyer kalemi kullanarak bölüm grubunun ana hatlarını çizerek iç alanın minimumda tutulmasını sağlayın.
NOT: Hidrofobik bariyeri çizmeden önce cam sürgünün tamamen kuru olduğundan emin olun. Hidrofobik bariyer, doku bölümlerini boşluksuz olarak tamamen çevrelemeli ve daha fazla işlemden önce kuru olmalıdır.
2. Sabit donmuş beyin dokusunun örnek hazırlanması
- Transkardiyal perfüzyon fiksasyonu
- Fareleri sodyum pentobarbital (70 mg / kg, ip) ile uyuşturarak ötenazi yapın, ardından önce 0.1 M PB veya% 4 PFA çözeltisi ile transkardiyal perfüzyon uygulayın. 11-13 mL / dk'da 10 dakikalık perfüzyon ile sabitleyin.
- Perfüzyon fiksasyonunu takiben beyni kafatası boşluğundan izole edin ve gece boyunca 4 ° C'de% 4 PFA çözeltisine daldırın.
- Sabit dokunun doku kesiti
- Meningeal tabakaları çıkarmadan önce beyni steril 0.1 M fosfat tamponlu salin (PBS) ile durulayın, ince forseps kullanarak diseksiyon mikroskobu yardımıyla.
- Bir beyin matrisi (Malzeme Tablosu) kullanarak beyni hassas bir şekilde bloklara ayırın (vibratom kesitinden önce beyin sapını ön beyinden ayırın). Spesifik olarak, beyin sapını piramidal dekussasyonda kaudal olarak kesin ve beyinciği disekesin. Benzer şekilde, ön beyni hemen optik kiazmaya doğru kesin.
- Dokuyu siyanoakrilat kullanarak titreşimli bir mikrotom aynasına sabitleyin ve% 2 agar çözeltisine gömün.
- Titreşimli bir mikrotom kullanarak 30 μm kalınlığında doku kesitleri kesin ve kesilen kesitleri kriyoprotektan solüsyonunda saklayın (%30 RNaz içermeyen sükroz, %30 etilen glikol, %1 polivinilpirolidon (PVP-40), 0,1 M PB, pH 7,4). Doku kesitleri kriyoprotektan içinde -20 °C'de 6 aya kadar saklanabilir.
- FISH öncesi sabit bölümlerin hazırlanması
- FISH gününde, kriyoprotektan solüsyonu çıkarmak için serbest yüzen bölümleri yıkama başına 10 dakika boyunca üç kez yıkayın. Yıkamak için, bölümleri 0.1 M PBS'ye 12 oyuklu bir hücre kültürü plakasına yerleştirin ve dönen bir platform çalkalayıcı (90 - 100 rpm) üzerinde çalkalayın.
- Yıkadıktan sonra, bölümleri cam mikroskopi slaytlarına monte etmek için bir boya fırçası kullanın ve en az 2 saat havayla kurutun.
NOT: Belirgin kıvrımlar yıkama sırasında ayrılmalarına neden olacağından, bölümler kızakların üzerine düz bir şekilde yapışmalıdır. - Hidrofobik bir bariyer kalemi kullanarak, FISH reaktiflerini bölümlerle sınırlamak için bölümlerin etrafına bir bariyer çizin. Bir kez daha, bariyer kalemi ile çizilen anahattın iç alanını en aza indirmek önemlidir.
OLASI KIRILMA NOKTASI: Bölümler, ertesi gün teste devam etmek için gece boyunca oda sıcaklığında saklanabilir.
3. BALIK tahlili
NOT: Protokolün geri kalanı hem taze donmuş hem de sabit donmuş doku için geçerlidir.
- Reaktifleri ve aletleri hibridizasyon ve amplifikasyon adımları için hazırlayın.
- Bir tezgah üstü inkübatör ve su banyosunu 40 °C'ye ayarlayın.
- Slaytları inkübe etmek için nemlendirilmiş, ışık korumalı bir oda hazırlayın. Nemlendirme, dokuların kurumasını önler - slaytlar nemli bir rezervuarın üzerine güvenli bir şekilde yerleştirilir. İdeal olarak, hazne ağır hizmet tipi polistirenden yapılmıştır, doymuş bir su buharı atmosferini korumak için ışık geçirmez ve hava geçirmezdir. Odanın kapatılması, hareketi önlemek için minimum sürtünmeye dayanır. Altta ıslak laboratuvar mendilleri (Malzeme Tablosu) ile kaplı bir slayt kutusu kullandık. 40 °C'ye ısıtmak için kaydırma kutusunu inkübatörün içine yerleştirin.
- 50x Yıkama Tamponunu (Malzeme Tablosu) ve probları su banyosunu kullanarak 10 dakika boyunca 40 °C'ye ısıtın, ardından oda sıcaklığına soğutun.
- 50x stok konsantrasyonundan 1 L 1x Yıkama Tamponu hazırlayın.
- Prob karışımını hazırlayın (Malzeme Tablosu): C1 probu stok konsantrasyonunda kullanıma hazırdır, C2 ve C3 probları ise 50x konsantrasyonda gönderilir ve kitte verilen seyreltici ile seyreltilmesi gerekir.
NOT: Prob karışımları 4 °C'de 6 aya kadar saklanabilir.
- Proteaz tedavisi
- Bölümleri Proteaz III (Malzeme Tablosu) ile oda sıcaklığında 30 dakika inkübe edin.
NOT: Proteaz III ve inkübasyon reaktiflerinin sonraki proseslerde (prob karışımı, amplifikasyon solüsyonları, bloke edici tampon ve antikor serumları) bölümleri tamamen kapladığından emin olun. Hidrofobik bariyerin içindeki tüm alanı kaplayacak şekilde reaktifi bölüme yaymak için bir pipet ucu kullanılabilir. - Slaytları 0.1 M PBS ile iki kez, her seferinde 2 dakika boyunca, büyük bir plastik kare Petri kabında yıkayın. Burada 245 mm x 245 mm kare biyotahlil kabı kullanılmıştır (Malzeme Tablosu). Çanağın bir tarafından tutun ve 3-5 kez hafifçe eğin. Yıkamalardan sonra, slayttan fazla 0,1 M PBS'yi hafifçe vurun ve hemen bir sonraki reaktifi ekleyin. Doku bölümlerinin kurumasına izin vermeyin.
NOT: Her yıkama sırasında slaytlar oda sıcaklığında çözeltiye daldırılır. Bu, sonraki tüm yıkama adımları için iş akışıdır. Sabit 30 μm kalınlığındaki bölümler, 14 μm kalınlığındaki bölümlere göre slaytlardan daha kolay çıkar, yıkama sırasında nazik olun.
- Bölümleri Proteaz III (Malzeme Tablosu) ile oda sıcaklığında 30 dakika inkübe edin.
- Hibridizasyon ve amplifikasyon
- Proteaz çözeltisini yıkadıktan sonra, slaytları nemlendirilmiş, önceden ısıtılmış odaya yerleştirin. Bölümleri prob karışımı (Malzeme Tablosu) ile tezgah üstü bir inkübatör içinde 40 °C'de 2 saat inkübe edin.
NOT: Numune RNA kalitesini ve optimum geçirgenliği değerlendirmek için pozitif ve negatif kontrol probları için ayrılmış en az 2 bölüm olduğundan emin olun. Pozitif kontrol probları, ev tutma genlerini hedef alır; burada bunlar, ubikitin C (UBC; yüksek bolluk), peptidilpropil izomeraz B (PPIB; orta bolluk) ve RNA polimeraz 2a'yı (POLR2A; düşük bolluk) hedefleyen bir RNA kokteyliydi. Negatif kontrol probları, normalde fare beyni örneklerinde bulunmayan bakteriyel 4-hidroksi-tetrahidrodipikolinat redüktaz (DapB) genini hedefler. Pozitif DapB sinyali, numunenin spesifik olmayan sinyalini ve/veya bakteriyel kontaminasyonunu gösterir. - Prob karışımı ile hibridizasyonun ardından, sinyal amplifikasyon adımları, her biri 40 °C'de Amp 1-FL (30 dakika), ardından Amp 2-FL (15 dakika), ardından Amp 3-FL (30 dakika) ve son olarak Amp 4-FL (15 dakika) ile inkübasyondan oluşur. Sağlanan damlalıklı şişeleri kullanarak, doku bölümlerini amplifikasyon solüsyonu ile örtün. Son amplifikasyon adımını takiben IHC testine geçin.
- Slaytları, prob hibridizasyonundan her amplifikasyon adımına 2 dakika boyunca iki kez Yıkama Tamponu ile durulayın.
- Proteaz çözeltisini yıkadıktan sonra, slaytları nemlendirilmiş, önceden ısıtılmış odaya yerleştirin. Bölümleri prob karışımı (Malzeme Tablosu) ile tezgah üstü bir inkübatör içinde 40 °C'de 2 saat inkübe edin.
4. IHC Testi
- IHC engelleme adımı
- Antikorların spesifik olmayan bağlanmasını önlemek için, FISH testini takiben 1x TBSm'de %10 normal at serumu, %0.3 Tween20 (50 mM Tris-Cl, pH 7.5, 150 mM NaCl, %0.05 mertiolat) içeren bloke edici solüsyon ile bölümleri oda sıcaklığında 1 saat inkübe edin. 1x TBSm,% 5 normal at serumu ve% 0.1 Tween20 içeren bir seyreltme tamponunda birincil antikorlar hazırlayın. Birincil antikor tedarikçileri Malzeme Tablosunda listelenmiştir.
- İmmünohistokimya
- Slaytı hafifçe vurarak fazla bloke edici tamponu çıkarın ve bölümleri gece boyunca 4 °C'de birincil antikorlarla inkübe edin.
- Slaytları 3 kez (her biri 5 dakika) 1x TBSm ile yıkayın ve 1x TBSm,% 1 normal at serumu ve% 0.1 Tween20 içeren seyreltici içinde ikincil antikor ile oda sıcaklığında 2 saat inkübe edin. Bu protokolde kullanılan sekonder antikorlar Malzeme Tablosunda listelenmiştir.
- DAPI'li veya DAPI'siz (Malzeme Tablosu) montaj ortamı ile lamel yapmadan önce slaytları 1x TBSm (her biri 5 dakika) ile 3 kez yıkayın.
5. Görüntüleme
- İmmün boyamayı bir kamera ile donatılmış bir epifloresan mikroskobu altında inceleyin (ayrıntılar için Malzeme Tablosuna bakın). 20x büyütmede temsili görüntüler elde edin ve TIFF dosyaları olarak kaydedin.
- Netliği artırmak ve gerçek işlemeyi yansıtmak için parlaklık/kontrast ayarı için temsili görüntüleri bir görüntü işleme yazılımına (Malzeme Tablosu) aktarın.
6. İSTEĞE BAĞLI: Hedef transkriptlerin nicel analizi
NOT: Bu bir yöntem makalesidir ve nicel sonuçlar verilmemiştir. Burada sunulan niceleme yöntemi Dereli ve ark.'dan alınmıştır.10.
- 5.1'de açıklandığı gibi ilgilenilen bölgelerden görüntüler elde edin ve aynı floroforun tüm görüntülerine aynı mikroskop ve kamera ayarlarını (pozlama süresi ve ışık yoğunluğu gibi) uygulayın.
- Bir görüntü analiz yazılımı kullanarak nöronal profilleri çizin (Malzeme Tablosu).
- Kesitleri stereotaksik beyin atlasına göre Bregma seviyesine göre hizalayın13.
- Aynı floroforun tüm görüntülerine aynı parlaklığı ve kontrastı uygulayın. Sadece DAPI ile boyanmış çekirdekleri olan nöronları düşünün.
- İlgilenilen bölgedeki mRNA, protein eksprese eden, mRNA/mRNA, protein/protein ve mRNA/protein koeksprese eden hücrelerin sayısını manuel olarak sayın.
- Deneysel sonuçlardaki yanlılığı azaltmak için, deneysel sonuçları ölçen kişinin deney gruplarına kör olmasını sağlayın.
- Aşağıdaki Abercombie denklemini kullanarak toplam hücre sayılarına Abercrombie düzeltmesi14 uygulayın:
Düzeltilmiş hücre sayısı = manuel hücre sayısı x kesit kalınlığı / (kesit kalınlığı + nükleer boyut)
Örneğin, 14 μm kalınlığındaki kesitler için, 5 hayvanda 30 hücre ve 10 kesite göre ortalama nükleer genişlik 7,7 ± 0,3 μm ve ortalama kesit kalınlığı 14 ± 1 μm olarak hesaplanır10. Abercrombie denklemine göre, düzeltilmiş hücre sayısı manuel hücre sayısı x 14/(14+7.7) olacaktır.

Şekil 1: Hem taze dondurulmuş hem de paraformaldehit ile sabitlenmiş doku için doku ön işleme adımlarının paralel iş akışı. Taze dondurulmuş doku için işlem adımları kırmızı çerçeveli kutularda görüntülenirken, paraformaldehit (PFA) sabit doku için olanlar mavi çerçeveli kutularda görüntülenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
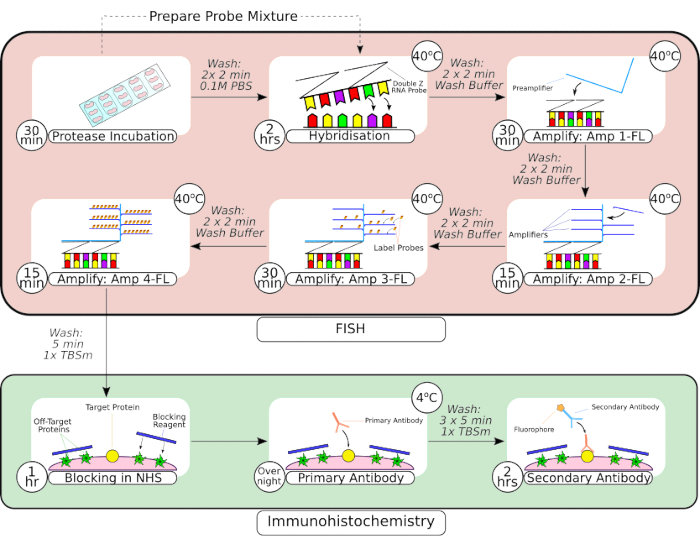
Şekil 2: Kombine FISH probu ve immünohistokimya prosedürünün özeti. Doku ön işlemesini takiben, slayta monte edilmiş doku, ilk karede görüldüğü gibi hidrofobik bir bariyer kalemi kullanılarak çevrelenir ve oda sıcaklığında bir proteaz çözeltisi içinde inkübe edilir. Yıkamaların ardından doku, sıralı amplifikasyon adımlarından önce 2 saat boyunca hibridizasyon için bir tezgah üstü inkübatöre aktarılır. Yerinde hibridizasyon sistemi, 3-66 karelerinde görüldüğü gibi tescilli bir 'Z probu' tasarımı, ön amplifikatörler ve amplifikatörler kullanır. Doku FISH prob işlemine tabi tutulduktan sonra, normal at serumu ile bloke edilmeden önce yıkanır. Birincil antikor inkübasyonu, antikor-antijen bağlanmasını en üst düzeye çıkarmak için gece boyunca 4 °C'de gerçekleştirilir. İkincil antikor inkübasyonu (2 saat) oda sıcaklığında gerçekleştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Burada, fare NTS'sinde sırasıyla taze dondurulmuş ve paraformaldehit sabit dokuları kullanarak GalR1 ve GlyT2 için mRNA ekspresyonunu lokalize etmek için multipleks FISH'i floresan IHC ile birleştirmek için bir yöntemi özetliyoruz. Yöntemlerde açıklanan doku işleme, FISH ve IHC prosedürlerinin bir boru hattı Şekil 1 ve Şekil 2'de gösterilmektedir. Tablo 1 , her şekilde kullanılan FISH probu ve antikor kombinasyonlarının bi...
Tartışmalar
Sinirbilimde, FISH ve IHC, nöronal alt popülasyonlar içindeki mRNA veya proteinlerin uzamsal organizasyonunu ve işlevsel önemini araştırmak için rutin olarak kullanılır. Bu çalışmada açıklanan protokol, beyin bölümlerinde mRNA'ların ve proteinlerin aynı anda saptanması için kapasiteyi arttırır. Kombine multipleks FISH-IHC testimiz, hem taze dondurulmuş hem de sabit beyin preparatlarında NTS'deki farklı nöronal alt popülasyonların fenotipik olarak tanımlanmasını sağladı. Sabit donmuş dok...
Teşekkürler
Bu çalışma, Avustralya Araştırma Konseyi Keşif Projesi hibe DP180101890 ve Rebecca L Cooper Tıbbi Araştırma Vakfı proje hibe PG2018110
Malzemeler
| Name | Company | Catalog Number | Comments |
| ANIMALS | |||
| C57BL/6 mouse | Australian BioResources, Moss Vale | MGI: 2159769 | |
| Phox2b-eGFP mouse | Australian BioResources, Moss Vale | MGI: 5776545 | |
| REAGENTS | |||
| Cyanoacrylate | Loctite | ||
| Ethylene Glycol | Sigma-Aldrich | 324558 | |
| Heparin-Sodium | Clifford Hallam Healthcare | 1070760 | Consult local veterinary supplier or pharmacy. |
| Lethabarb (Sodium Pentabarbitol) Euthanasia Injection | Virbac (Australia) Pty Ltd | N/A | Consult a veterinarian for local pharmaceutical regulations regarding Sodium Pentabarbitol |
| Molecular grade agarose powder | Sigma Aldrich | 5077 | |
| OCT Compound, 118mL | Scigen Ltd | 4586 | |
| Paraformaldehyde, prilled, 95% | Sigma-Aldrich | 441244-1KG | |
| Polyvinylpyrrolidone, average mol wt 40,000 (PVP-40) | Sigma-Aldrich | PVP40 | |
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | With or without DAPI |
| RNAscope Multiplex Fluorescent Reagent Kit (up to 3-plex capability) | Advanced Cell Diagnostics, Inc. (ACD Bio) | ADV320850 | Includes 50x Wash buffer and Protease III |
| RNase Away | Thermo-Fisher Scientific | 7003 | |
| Tris(hydroxymethyl)aminomethane | Sigma-Aldrich | 252859 | |
| Tween-20, for molecular biology | Sigma-Aldrich | P9416 | |
| EQUIPMENT | |||
| Benchtop incubator | Thermoline scientific micro incubator | Model: TEI-13G | |
| Brain Matrix, Mouse, 30g Adult, Coronal, 1mm | Ted Pella | 15050 | |
| Cryostat | Leica | CM1950 | |
| Drawing-up needle (23 inch gauge) | BD | 0288U07 | |
| Hydrophobic Barrier Pen | Vector labs | H-4000 | |
| Kimtech Science Kimwipes Delicate Task Wipes | Kimberley Clark Professional | 34120 | |
| Olympus BX51 | Olympus | BX-51 | |
| Peristaltic pump | Coleparmer Masterflex | L/S Series | |
| Retiga 2000R Digital Camera | QImaging | RET-2000R-F-CLR | colour camera |
| SuperFrost Plus Glass Slides (White) | Thermo-Fisher Scientific | 4951PLUS4 | |
| Vibrating Microtome (Vibratome) | Leica | VT1200S | |
| Whatman qualitative filter paper, Grade 1, 110 mm diameter | Merck | WHA1001110 | |
| SOFTWARES | |||
| CorelDRAW | Corel Corporation | Version 7 | |
| FIJI (ImageJ Distribution) | Open Source/GNU General Public Licence (GPL) | N/A | ImageJ 2.x: Rueden, C. T.; Schindelin, J. & Hiner, M. C. et al. (2017), "ImageJ2: ImageJ for the next generation of scientific image data", BMC Bioinformatics 18:529, PMID 29187165, doi:10.1186/s12859-017-1934-z and Fiji: Schindelin, J.; Arganda-Carreras, I. & Frise, E. et al. (2012), "Fiji: an open-source platform for biological-image analysis", Nature methods 9(7): 676-682, PMID 22743772, doi:10.1038/nmeth.2019 |
| PRIMARY ANTIBODIES | |||
| Anti-Tyrosine Hydroxylase Antibody | Millipore Sigma | AB1542 | Sheep polyclonal (1:1000 dilution), RRID: AB_90755 |
| Anti-Tyrosine Hydroxylase Antibody, clone LNC1 | Millipore Sigma | MAB318 | Mouse monoclonal (1:1000 dilution), RRID: AB_2201528 |
| Anti-Vesicular Acetylcholine Transporter (VAchT) Antibody | Sigma-Aldrich | ABN100 | Goat polyclonal (1:1000 dilution), RRID: AB_2630394 |
| GFP Antibody | Novus Biologicals | NB600-308 | Rabbit polyclonal (1:1000 dilution), RRID: AB_10003058 |
| Phox2b Antibody (B-11) | Santa Cruz Biotechnology | sc-376997 | Mouse monoclonal (1:1000 dilution), RRID: AB_2813765 |
| SECONDARY ANTIBODIES | |||
| Alexa Fluor 488 AffiniPure Donkey Anti-Rabbit IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Ms, Rat, Shp Sr Prot) | Jackson ImmunoResearch | 711-545-152 | Donkey anti-Rabbit (1:400 dilution), RRID: AB_2313584 |
| AMCA AffiniPure Donkey Anti-Sheep IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 713-155-147 | Donkey anti-Sheep (1:400 dilution), RRID: AB_AB_2340725 |
| Cy5 AffiniPure Donkey Anti-Goat IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 705-175-147 | Donkey anti-Goat (1:400 dilution), RRID: AB_2340415 |
| Cy5 AffiniPure Donkey Anti-Mouse IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Rb, Rat, Shp Sr Prot) | Jackson ImmunoResearch | 715-175-151 | Donkey anti-Mouse (1:400 dilution), RRID: AB_2619678 |
| Cy5 AffiniPure Donkey Anti-Sheep IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 713-175-147 | Donkey anti-Sheep (1:400 dilution), RRID: AB_2340730 |
| RNASCOPE PROBES | |||
| Galanin Receptor 1 oligonucleotide probe | ACDBio | 448821-C1 | targets bp 482 - 1669 (Genebank ref: NM_008082.2) |
| Glycine transporter 2 oligonucleotide probe | ACDBio | 409741-C3 | targets bp 925 - 2153 (Genebank ref: NM_148931.3) |
| Phox2b oligonucleotide probe | ACDBio | 407861-C2 | targets bp 1617 - 2790 (Genebank ref: NM_008888.3) |
Referanslar
- Wang, F., et al. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Annese, T., et al. RNAscope dual ISH-IHC technology to study angiogenesis in diffuse large B-cell lymphomas. Histochemistry and Cell Biology. 153 (3), 185-192 (2020).
- Morrison, J. A., McKinney, M. C., Kulesa, P. M. Resolving in vivo gene expression during collective cell migration using an integrated RNAscope, immunohistochemistry and tissue clearing method. Mechanisms of Development. 148, 100-106 (2017).
- Gross-Thebing, T., Paksa, A., Raz, E. Simultaneous high-resolution detection of multiple transcripts combined with localization of proteins in whole-mount embryos. BMC Biology. 12, 55 (2014).
- Stempel, A. J., Morgans, C. W., Stout, J. T., Appukuttan, B. Simultaneous visualization and cell-specific confirmation of RNA and protein in the mouse retina. Molecular Vision. 20, 1366-1373 (2014).
- Kersigo, J., et al. A RNAscope whole mount approach that can be combined with immunofluorescence to quantify differential distribution of mRNA. Cell and Tissue Research. 374 (2), 251-262 (2018).
- Grabinski, T. M., Kneynsberg, A., Manfredsson, F. P., Kanaan, N. M. A method for combining RNAscope in situ hybridization with immunohistochemistry in thick free-floating brain sections and primary neuronal cultures. PLoS One. 10 (3), 0120120 (2015).
- Baleriola, J., Jean, Y., Troy, C., Hengst, U. Detection of axonally localized mRNAs in brain sections using high-resolution in situ hybridization. Journal of Visualized Experiments. (100), e52799 (2015).
- Fe Lanfranco, M., Loane, D. J., Mocchetti, I., Burns, M. P., Villapol, S. Combination of fluorescent in situ hybridization (FISH) and immunofluorescence imaging for detection of cytokine expression in microglia/macrophage cells. Bio-Protocol. 7 (22), (2017).
- Dereli, A. S., Yaseen, Z., Carrive, P., Kumar, N. N. Adaptation of respiratory-related brain regions to long-term hypercapnia: focus on neuropeptides in the RTN. Frontiers in Neuroscience. 13, 1343 (2019).
- Lazarenko, R. M., et al. Acid sensitivity and ultrastructure of the retrotrapezoid nucleus in Phox2b-EGFP transgenic mice. Journal of Comparative Neurology. 517 (1), 69-86 (2009).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Paxinos, G., Franklin, K. B. . The mouse brain in stereotaxic coordinates. , (2004).
- Abercrombie, M. Estimation of nuclear population from microtome sections. Anatomical Records. 94, 239-247 (1946).
- Kerr, N., et al. The generation of knock-in mice expressing fluorescently tagged galanin receptors 1 and 2. Molecular and Cellular Neurosciences. 68, 258-271 (2015).
- Kachidian, P., Pickel, V. M. Localization of tyrosine hydroxylase in neuronal targets and efferents of the area postrema in the nucleus tractus solitarii of the rat. Journal of Comparative Neurology. 329 (3), 337-353 (1993).
- Stornetta, R. L., et al. Expression of Phox2b by brainstem neurons involved in chemosensory integration in the adult rat. Journal of Neuroscience. 26 (40), 10305-10314 (2006).
- Gilmor, M. L., et al. Expression of the putative vesicular acetylcholine transporter in rat brain and localization in cholinergic synaptic vesicles. Journal of Neuroscience. 16 (7), 2179-2190 (1996).
- Fisher, J. M., Sossin, W., Newcomb, R., Scheller, R. H. Multiple neuropeptides derived from a common precursor are differentially packaged and transported. Cell. 54 (6), 813-822 (1988).
- Towle, A. C., Lauder, J. M., Joh, T. H. Optimization of tyrosine-hydroxylase immunocytochemistry in paraffin sections using pretreatment with proteolytic-enzymes. Journal of Histochemistry and Cytochemistry. 32 (7), 766-770 (1984).
- Biancardi, V., et al. Mapping of the excitatory, inhibitory, and modulatory afferent projections to the anatomically defined active expiratory oscillator in adult male rats. Journal of Comparative Neurology. 529 (4), 853-884 (2021).
- Matthews, D. W., et al. Feedback in the brainstem: an excitatory disynaptic pathway for control of whisking. Journal of Comparative Neurology. 523 (6), 921-942 (2015).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Shi, S. R., Key, M. E., Kalra, K. L. Antigen retrieval in formalin-fixed, paraffin-embedded tissues: an enhancement method for immunohistochemical staining based on microwave oven heating of tissue sections. Journal of Histochemistry and Cytochemistry. 39 (6), 741-748 (1991).
- Yamashita, S., Katsumata, O. Heat-induced antigen retrieval in immunohistochemistry: mechanisms and applications. Methods in Molecular Biology. 1560, 147-161 (2017).
- Yamashita, S., Okada, Y. Mechanisms of heat-induced antigen retrieval: analyses in vitro employing SDS-PAGE and immunohistochemistry. Journal of Histochemistry and Cytochemistry. 53 (1), 13-21 (2005).
- Yamashita, S. Heat-induced antigen retrieval: mechanisms and application to histochemistry. Progress in Histochemistry and Cytochemistry. 41 (3), 141-200 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır