需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
将多重荧光 原 位杂交与荧光免疫组化相结合,对新鲜冷冻或固定的小鼠脑切片进行研究
摘要
该协议描述了一种在新鲜冷冻和固定小鼠脑切片中结合荧光 原 位杂交(FISH)和荧光免疫组织化学(IHC)的方法,目的是实现多标记FISH和荧光IHC信号。IHC 靶向细胞质和膜附着蛋白。
摘要
荧光 原位 杂交 (FISH) 是一种分子技术,用于识别细胞内特定 RNA 转录本的存在和空间分布。功能鉴定神经元的神经化学表型分析通常需要使用免疫组织化学 (IHC) 同时使用多种抗体(靶向蛋白)进行标记,并同时优化 原位 杂交(靶向 RNA)。可以实现表征特定神经元的"神经化学特征",但复杂因素包括需要在组合方法之前验证 FISH 和 IHC 靶标,以及可能在同一组织切片中同时靶向的 RNA 和蛋白质数量有限。
在这里,我们描述了一种使用新鲜冷冻和固定小鼠脑制剂的方案,该方案使用RNAscope FISH检测同一脑切片中的多个mRNA和蛋白质,然后分别进行荧光免疫染色。我们使用组合方法来描述免疫组织化学鉴定的脑干核中低丰度 mRNA(例如甘丙肽受体 1)和高丰度 mRNA(例如甘氨酸转运蛋白 2)的表达模式。
FISH检测下游蛋白质标记的关键考虑因素超出了组织制备和FISH探针标记的优化。例如,我们发现抗体结合和标记特异性可能会受到FISH探针检测中蛋白酶步骤的不利影响。蛋白酶催化肽键的水解裂解,促进 FISH 探针进入细胞,但它们也可能消化随后的 IHC 测定靶向的蛋白质,产生脱靶结合。靶蛋白的亚细胞位置是 FISH 探针检测后促成 IHC 成功的另一个因素。我们观察到,当靶蛋白与膜结合时,IHC特异性得以保留,而靶向细胞质蛋白的IHC需要大量的故障排除。最后,我们发现与新鲜冷冻组织相比,载玻片固定冷冻组织的处理更具挑战性,但是当与RNAscope结合使用时,固定冷冻组织的IHC质量总体上更好。
引言
神经化学定义神经元亚群的蛋白质和 mRNA 通常分别通过免疫组织化学 (IHC) 和/或 原位 杂交 (ISH) 的组合进行鉴定。将 ISH 与 IHC 技术相结合,通过最大限度地提高多重标记能力,促进了功能神经元特有的共定位模式(神经化学编码)的表征。
与早期的RNA检测方法(如放射性ISH和非放射性显色ISH)相比,包括RNAscope在内的荧光ISH(FISH)方法具有更高的灵敏度和特异性。FISH 可将单个 mRNA 转录本可视化为点状染色斑点1。此外,RNAscope检测允许使用不同的荧光团标签一次标记更多数量的RNA靶标。尽管有这些优点,但技术限制可能会影响可用于单个实验的荧光基团/显色剂的数量。其中包括显微镜滤光片组的可用性;与单独使用每种技术相比,当神经化学鉴定联合使用 FISH 和 IHC 时,这些考虑会更加复杂,因为一种方法的最佳固有步骤可能对另一种方法有害。
先前FISH联合IHC的应用已经证明了在人B细胞淋巴瘤2、鸡胚胎3、斑马鱼胚胎4、小鼠视网膜5和小鼠内耳细胞6中特异性细胞靶点的表达。在这些研究中,组织制备是福尔马林固定石蜡包埋 (FFPE)2,3,5 或新鲜的全镶嵌 4,6。其他研究将显色RNAscope应用于固定的小鼠和大鼠脑制剂7,8,9。特别是,Baleriola 等人。8 描述了用于联合 ISH-IHC 的两种不同组织制剂;固定小鼠脑切片和FFPE人脑切片。在最近的一篇出版物中,我们将 FISH 和荧光 IHC 结合在新鲜冷冻切片上,同时可视化脑干网状结构中的低丰度 mRNA(甘丙肽受体 1,GalR1)、高丰度 mRNA(甘氨酸转运蛋白 2,GlyT2)和囊泡乙酰胆碱转运蛋白 (vAChT) 蛋白10。
孤束核 (NTS) 是参与自主神经功能的主要大脑区域。这种异质的神经元群位于后脑,接收并整合了大量的自主神经信号,包括调节呼吸的信号。NTS 包含多个神经元群,其表型特征可能是 mRNA 靶标的表达模式,包括 GalR1 和 GlyT2,以及酪氨酸羟化酶 (TH) 和转录因子配对样同源盒 2b (Phox2b) 的蛋白质标记物。
RNAscope所有者推荐新鲜的冷冻组织制剂,但通过全动物经心灌注固定制备的组织,以及固定冷冻组织切片的长期冷冻保护(在-20°C下储存)在许多实验室中很常见。因此,我们试图使用新鲜冷冻和固定冷冻组织制剂建立FISH与IHC联合使用的方案。在这里,我们提供了新鲜冷冻和固定冷冻的脑切片:(1)FISH和荧光IHC联合的方案(2)使用每种制剂时产生的mRNA和蛋白质标记的质量的描述(3)描述NTS中GalR1和GlyT2的表达。
我们的研究表明,当与RNAscope方法结合使用时,IHC的成功率在新鲜冷冻和固定冷冻制剂中各不相同,并且取决于细胞内靶蛋白的定位。在我们手中,膜结合蛋白标记总是成功的。相比之下,即使在细胞质蛋白在转基因动物中过表达的情况下,细胞质蛋白的 IHC 也需要进行故障排除 (Phox2b-GFP)11。最后,虽然 GalR1 在 NTS 的非儿茶酚胺能神经元中表达,但 GlyT2 在 NTS 中不存在表达。
研究方案
组织预处理步骤的摘要见 图1。所有程序均按照新南威尔士大学动物护理和伦理委员会根据科学目的使用和护理动物的指南(澳大利亚国家健康与医学研究委员会)进行。
1.新鲜冷冻脑组织的样品制备
- 经心灌注
- 制备肝素化 (2500 U/L) 0.1 M 磷酸盐缓冲液 (PB),pH 7.5。通过将干冰与乙醇混合制成干冰乙醇浆。这将具有大约-72°C的温度,并将用于立即冷冻收获的组织。
- 使用27.5英寸针规,通过用戊巴比妥钠(70mg / kg,ip)麻醉,对成年C57BL / 6和Phox2b-GFP11(小鼠基因组信息学数据库ID MGI:5776545)小鼠实施安乐死。
注意:戊巴比妥是一种巴比妥类药物。它在高剂量下具有急性毒性,并可能因呼吸停止而死亡。使用前请查阅当地的医疗保健、法律和材料安全指南。 - 暴露心脏并用拉针(23 英寸规格)插管左心室。用肝素化的0.1M PB进行心内灌注,直到血液以11-13mL / min的流速清除(2-3分钟)。通过监测肝脏的颜色和右心房的渗出物来确定血液清除情况12.
- 将大脑与颅腔隔离,立即将其嵌入冷冻成型或铝箔中的最佳切割温度化合物(OCT)中,并将其置于干冰乙醇浴上。将冷冻的包埋组织储存在-80°C的密闭容器中长达3个月。
- 新鲜冷冻组织的切片
- 将低温恒温器温度设置为-20°C。 将 OCT 包埋的组织和低温恒温器卡盘留在低温恒温器中 ~30 分钟,以使其平衡到新温度。
注意:始终保持组织冷冻;将组织从-80°C冰箱运送到干冰上的低温恒温器。 - 使用OCT化合物将组织固定到预冷的低温恒温器卡盘上。在该协议中,将组织块安装在冠状平面的卡盘上。
注意:使用剃须刀片从组织中修剪多余的 OCT,以尽量减少低温恒温器切割并随后转移到载玻片上的 OCT 量。 - 切割14μm厚的冠状切片,并将它们安装在带电玻璃显微镜载玻片上。
- 在安装部分之前,将载玻片加热至室温。安装该部分后,将载玻片保存在低温恒温器的载玻片盒中。
- 如果需要在一张载玻片上安装多个部分,请将手指放在载玻片的另一侧 5-10 秒,以加热第二部分的区域,以帮助该部分粘附在载玻片上。冷组织切片不会附着在冷载玻片上。各部分应平贴在载玻片上;折叠会导致它们在洗涤步骤中从载玻片上脱落。
- 如果在截面中发现裂纹,请将低温恒温器温度提高 1-5 °C 以避免这种情况。在同一载玻片上,将组织切片彼此靠近放置尤为重要。这将防止在测定过程中浪费FISH探针和试剂。
- 将安装在载玻片上的组织切片储存在-80°C的密封容器中长达6个月。
注意:始终保持切片冷冻,避免冻融循环,以防止RNA降解。将载玻片盒从低温恒温器内部运送到干冰上的-80°C冰箱。
- 将低温恒温器温度设置为-20°C。 将 OCT 包埋的组织和低温恒温器卡盘留在低温恒温器中 ~30 分钟,以使其平衡到新温度。
- 固定新鲜冷冻组织
- 在进行FISH探针测定的当天,在0.1M PB,pH 7.5(4%PFA溶液)中制备4%多聚甲醛(PFA)。通过布氏漏斗或坩埚过滤器中的滤纸(1 级:11 μm, 材料表)进行过滤。
注意:PFA对皮肤接触或吸入有害且有毒。所有使用PFA溶液的程序都应在通风柜中进行。PFA溶液废物应按照机构安全规程小心处理。 - 将4%PFA溶液冷却至4°C。 将载玻片安装的组织从-80°C冰箱中运输在干冰中,并立即将其浸入预冷的固定剂中15分钟。
注意:重要的是,此固定步骤不要超过 15 分钟,因为过度固定会导致非特异性背景标记。
- 在进行FISH探针测定的当天,在0.1M PB,pH 7.5(4%PFA溶液)中制备4%多聚甲醛(PFA)。通过布氏漏斗或坩埚过滤器中的滤纸(1 级:11 μm, 材料表)进行过滤。
- 新鲜冷冻组织的脱水
- 通过将载玻片浸入分级浓度的乙醇中来脱水组织切片。在 Coplin 罐中,首先浸入 50% 中,然后浸入 70% 中,最后浸入无水乙醇中,在室温下各浸泡 5 分钟。第二次重复最后的无水乙醇孵育。
- 风干载玻片,并使用疏水阻隔笔勾勒出一组截面,确保内部区域保持在最小值。
注意: 在绘制疏水屏障之前,请确保载玻片完全干燥。疏水屏障应完全包围组织切片,没有间隙,并且在进一步加工之前必须干燥。
2.固定冷冻脑组织的样品制备
- 经心灌注固定术
- 通过用戊巴比妥钠(70mg / kg,ip)麻醉小鼠,然后进行心内灌注,先用0.1M PB麻醉,然后用4%PFA溶液麻醉小鼠。以 11-13 mL/min 的速度灌注 10 分钟固定。
- 灌注固定后将大脑与颅腔分离,并在4°C下浸没在4%PFA溶液中过夜。
- 固定组织的组织切片
- 在解剖显微镜的帮助下,使用细镊子在去除脑膜层之前,在无菌0.1M磷酸盐缓冲盐水(PBS)中冲洗大脑。
- 使用脑矩阵(材料表)将大脑精确地切成块(在振动切片机切片之前将脑干与前脑分开)。具体来说,在锥体凹陷处切开脑干尾部并解剖小脑。同样,切开前脑,立即到视交叉的喙部。
- 使用氰基丙烯酸酯将组织固定在振动切片机卡盘上,并嵌入2%琼脂溶液中。
- 使用振动切片机切割30μm厚的组织切片,并将切片储存在冷冻保护剂溶液(30%无RNase蔗糖,30%乙二醇,1%聚乙烯吡咯烷酮(PVP-40))中,在0.1M PB,pH 7.4中)。组织切片可以在-20°C的冷冻保护剂中储存长达6个月。
- 在FISH之前准备固定部分
- 在 FISH 当天,洗涤自由漂浮部分 3 次,每次洗涤 10 分钟,以去除冷冻保护剂溶液。为了洗涤,将切片置于 12 孔细胞培养板中的 0.1 M PBS 中,并在旋转平台振荡器上搅拌 (90 - 100 rpm)。
- 洗涤后,用画笔将切片安装在玻璃显微镜载玻片上并风干至少 2 小时。
注意: 这些部分应平放在载玻片上,因为任何明显的褶皱都会导致它们在洗涤过程中脱落。 - 使用疏水性阻隔笔,在切片周围画一个屏障,将FISH试剂限制在切片上。同样,最小化用障碍笔绘制的轮廓的内部区域是很重要的。
可能的断点:切片可以在室温下储存过夜,以便在第二天继续测定。
3. FISH测定
注:协议的其余部分适用于新鲜冷冻和固定冷冻组织。
- 准备用于杂交和扩增步骤的试剂和仪器。
- 将台式培养箱和水浴设置为40°C。
- 准备一个加湿、避光的室来孵育载玻片。加湿可防止组织干燥 - 载玻片牢固地位于潮湿的储液器上方。理想情况下,腔室由重型聚苯乙烯制成,它是防光和气密的,以保持饱和的水蒸气气氛。腔室的关闭依靠最小的摩擦来避免移动。我们在底部使用了一个衬有湿实验室湿巾(材料表)的幻灯片盒。将载玻片盒放入培养箱内,将其预热至40°C。
- 使用水浴将50x洗涤缓冲液(材料表)和探针加热至40°C10分钟,然后冷却至室温。
- 从 50 倍原液浓度中制备 1 L 1x 洗涤缓冲液。
- 制备探针混合物(材料表):C1 探针可在储备浓度下使用,而 C2 和 C3 探针以 50x 浓度发货,需要用试剂盒中提供的稀释剂稀释。
注意:探针混合物可以在4°C下储存长达6个月。
- 蛋白酶处理
- 将切片与蛋白酶 III(材料表)在室温下孵育 30 分钟。
注:确保下游工艺中的蛋白酶III和孵育试剂(探针混合物、扩增溶液、封闭缓冲液和抗体血清)完全覆盖切片。移液管吸头可用于将试剂扩散到切片上,以覆盖疏水屏障内的整个区域。 - 用0.1M PBS洗涤载玻片两次,每次2分钟,在一个大的塑料方形培养皿中。这里使用一个 245 mm x 245 mm 的方形生物测定皿(材料表)。从盘子的一侧握住,轻轻倾斜 3-5 次。洗涤后,从载玻片上轻弹多余的 0.1 M PBS,并立即加入下一个试剂。不要让组织切片干燥。
注意:在每次洗涤过程中,将载玻片浸入室温下的溶液中。这是所有后续洗涤步骤的工作流程。固定的 30 μm 厚切片比 14 μm 厚的切片更容易从载玻片上脱落,在洗涤过程中要轻柔。
- 将切片与蛋白酶 III(材料表)在室温下孵育 30 分钟。
- 杂交和扩增
- 洗掉蛋白酶溶液后,将载玻片放入加湿的预热室中。在台式培养箱内,将切片与探针混合物(材料表)在40°C下孵育2小时。
注:确保至少留出 2 个部分用于阳性和阴性对照探针,以评估样品 RNA 质量和最佳透化。阳性对照探针靶向管家基因;在这里,这些是靶向泛素C(UBC;高丰度)、肽基丙基异构酶B(PPIB;中等丰度)和RNA聚合酶2a(POLR2A;低丰度)的RNA混合物。阴性对照探针靶向细菌 4-羟基-四氢双吡啶甲酸还原酶 (DapB) 基因,该基因通常在小鼠脑样本中不存在。阳性 DapB 信号表示样品存在非特异性信号和/或细菌污染。 - 与探针混合物杂交后,信号放大步骤包括与Amp 1-FL(30分钟),然后与Amp 2-FL(15分钟)孵育,然后是Amp 3-FL(30分钟),最后是Amp 4-FL(15分钟) - 每个在40°C下。 使用提供的滴管瓶,用扩增溶液覆盖组织切片。在最后一个扩增步骤后进行IHC测定。
- 在探针杂交和每个扩增步骤之间用洗涤缓冲液冲洗载玻片两次,持续 2 分钟。
- 洗掉蛋白酶溶液后,将载玻片放入加湿的预热室中。在台式培养箱内,将切片与探针混合物(材料表)在40°C下孵育2小时。
4. 免疫组化检测
- IHC 阻断步骤
- 为了防止抗体的非特异性结合,在室温下将切片与含有10%正常马血清,0.3%吐温20的封闭溶液在1x TBSm(50mM Tris-Cl,pH 7.5,150mM NaCl,0.05%硫醇酸盐)中孵育1小时。在含有 1x TBSm、5% 正常马血清和 0.1% 吐温 20 的稀释缓冲液中制备一抗。一抗供应商列在 材料表中。
- 免疫组化
- 通过轻弹载玻片除去多余的封闭缓冲液,并将切片与一抗在4°C下孵育过夜。
- 用 1x TBSm 洗涤载玻片 3 次(每次 5 分钟),并在室温下与含有 1x TBSm、1% 正常马血清和 0.1% 吐温 20 的稀释剂中的二抗一起孵育 2 小时。该方案中使用的二抗列在 材料表中。
- 用 1x TBSm(每次 5 分钟)洗涤载玻片 3 次,然后用含或不含 DAPI(材料表)的封固剂盖玻片。
5. 影像学检查
- 在配备相机的落射荧光显微镜下检查免疫染色(详见 材料表 )。以 20 倍放大倍率采集具有代表性的图像并另存为 TIFF 文件。
- 将具有代表性的图像导出到图像处理软件(材料表)中进行亮度/对比度调整,以提高清晰度并反映真实的渲染。
6. 可选:靶转录本的定量分析
注意:这是一篇方法文章,未提供定量结果。这里介绍的定量方法来源于Dereli 等人。10.
- 如5.1所述从感兴趣区域获取图像,并将相同的显微镜和相机设置(例如曝光时间和光强度)应用于同一荧光团的所有图像。
- 使用图像分析软件(材料表)绘制神经元图谱。
- 根据立体定位脑图谱13 参考 Bregma 水平对齐各部分。
- 将相同的亮度和对比度应用于同一荧光团的所有图像。仅考虑具有DAPI染色细胞核的神经元。
- 手动计数感兴趣区域内 mRNA、蛋白表达、mRNA/mRNA、蛋白/蛋白和 mRNA/蛋白共表达细胞的数量。
- 为了减少实验结果的偏差,让量化实验结果的人对实验组不知情。
- 使用以下 Abercombie 方程将 Abercrombie 校正14 应用于总细胞计数:
校正细胞计数 = 手动细胞计数 x 切片厚度 / (切片厚度 + 细胞核大小)
例如,对于14μm厚的切片,基于5只动物的30个细胞和10个切片,计算出平均细胞核宽度为7.7±0.3μm,平均切片厚度为14±1μm。根据 Abercrombie 方程,校正后的细胞计数将是手动细胞计数 x 14/(14+7.7)。

图 1:新鲜冷冻和多聚甲醛固定组织的组织预处理步骤的并行工作流程。 新鲜冷冻组织的处理步骤显示在红色轮廓框中,而多聚甲醛 (PFA) 固定组织的处理步骤显示在蓝色轮廓框中。 请点击这里查看此图的较大版本.
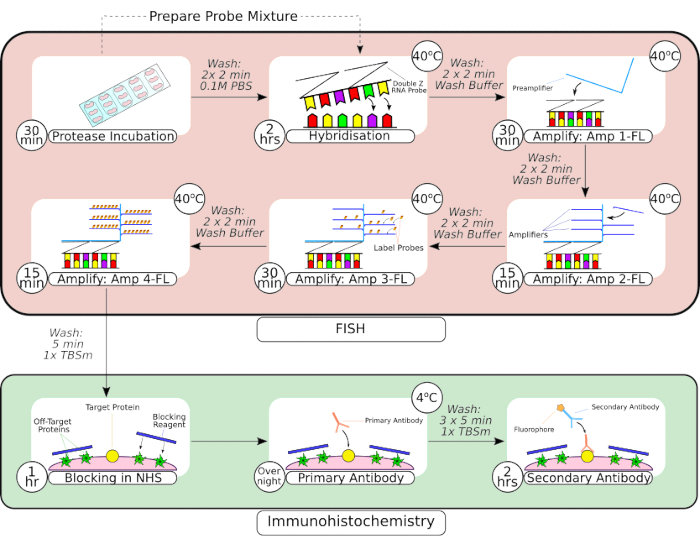
图 2:FISH 探针和免疫组化联合程序的总结。 在组织预处理之后,使用疏水屏障笔将载玻片安装的组织包围,如第一帧所示,并在室温下在蛋白酶溶液中孵育。洗涤后,将组织转移到台式培养箱中进行杂交 2 小时,然后进行连续扩增步骤。 原位 杂交系统采用专有的"Z 探头"设计、前置放大器和放大器,如图 3-6 6所示。一旦组织经过FISH探针处理,在用正常马血清封闭之前对其进行洗涤。一抗孵育在4°C下过夜,以最大限度地提高抗体 - 抗原结合。二抗孵育(2小时)在室温下进行。 请点击这里查看此图的较大版本.
结果
在这里,我们概述了一种将多重 FISH 与荧光 IHC 相结合的方法,以分别使用新鲜冷冻和多聚甲醛固定组织在小鼠 NTS 中定位 GalR1 和 GlyT2 的 mRNA 表达。图 1 和 图2显示了方法中描述的组织处理、FISH和IHC程序的流程。 表1 总结了每个图中使用的FISH探针和抗体组合。
对照探针与目标探针同时进行常规检测,以确保工作流程?...
讨论
在神经科学中,FISH 和 IHC 通常用于研究神经元亚群中 mRNA 或蛋白质的空间组织和功能意义。本研究中描述的方案增强了同时检测脑切片中mRNA和蛋白质的能力。我们的多重 FISH-IHC 联合检测能够在新鲜冷冻和固定脑制剂中对 NTS 中不同的神经元亚群进行表型鉴定。固定冷冻组织制剂中的 FISH-IHC 产生了可靠的 IHC 结果。例如,低丰度和高丰度 mRNA(分别为 GalR1 和 GlyT2)和 IHC(靶向酪氨酸羟化酶)的多?...
致谢
这项工作由澳大利亚研究委员会发现项目资助DP180101890和Rebecca L Cooper医学研究基金会项目资助PG2018110
材料
| Name | Company | Catalog Number | Comments |
| ANIMALS | |||
| C57BL/6 mouse | Australian BioResources, Moss Vale | MGI: 2159769 | |
| Phox2b-eGFP mouse | Australian BioResources, Moss Vale | MGI: 5776545 | |
| REAGENTS | |||
| Cyanoacrylate | Loctite | ||
| Ethylene Glycol | Sigma-Aldrich | 324558 | |
| Heparin-Sodium | Clifford Hallam Healthcare | 1070760 | Consult local veterinary supplier or pharmacy. |
| Lethabarb (Sodium Pentabarbitol) Euthanasia Injection | Virbac (Australia) Pty Ltd | N/A | Consult a veterinarian for local pharmaceutical regulations regarding Sodium Pentabarbitol |
| Molecular grade agarose powder | Sigma Aldrich | 5077 | |
| OCT Compound, 118mL | Scigen Ltd | 4586 | |
| Paraformaldehyde, prilled, 95% | Sigma-Aldrich | 441244-1KG | |
| Polyvinylpyrrolidone, average mol wt 40,000 (PVP-40) | Sigma-Aldrich | PVP40 | |
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | With or without DAPI |
| RNAscope Multiplex Fluorescent Reagent Kit (up to 3-plex capability) | Advanced Cell Diagnostics, Inc. (ACD Bio) | ADV320850 | Includes 50x Wash buffer and Protease III |
| RNase Away | Thermo-Fisher Scientific | 7003 | |
| Tris(hydroxymethyl)aminomethane | Sigma-Aldrich | 252859 | |
| Tween-20, for molecular biology | Sigma-Aldrich | P9416 | |
| EQUIPMENT | |||
| Benchtop incubator | Thermoline scientific micro incubator | Model: TEI-13G | |
| Brain Matrix, Mouse, 30g Adult, Coronal, 1mm | Ted Pella | 15050 | |
| Cryostat | Leica | CM1950 | |
| Drawing-up needle (23 inch gauge) | BD | 0288U07 | |
| Hydrophobic Barrier Pen | Vector labs | H-4000 | |
| Kimtech Science Kimwipes Delicate Task Wipes | Kimberley Clark Professional | 34120 | |
| Olympus BX51 | Olympus | BX-51 | |
| Peristaltic pump | Coleparmer Masterflex | L/S Series | |
| Retiga 2000R Digital Camera | QImaging | RET-2000R-F-CLR | colour camera |
| SuperFrost Plus Glass Slides (White) | Thermo-Fisher Scientific | 4951PLUS4 | |
| Vibrating Microtome (Vibratome) | Leica | VT1200S | |
| Whatman qualitative filter paper, Grade 1, 110 mm diameter | Merck | WHA1001110 | |
| SOFTWARES | |||
| CorelDRAW | Corel Corporation | Version 7 | |
| FIJI (ImageJ Distribution) | Open Source/GNU General Public Licence (GPL) | N/A | ImageJ 2.x: Rueden, C. T.; Schindelin, J. & Hiner, M. C. et al. (2017), "ImageJ2: ImageJ for the next generation of scientific image data", BMC Bioinformatics 18:529, PMID 29187165, doi:10.1186/s12859-017-1934-z and Fiji: Schindelin, J.; Arganda-Carreras, I. & Frise, E. et al. (2012), "Fiji: an open-source platform for biological-image analysis", Nature methods 9(7): 676-682, PMID 22743772, doi:10.1038/nmeth.2019 |
| PRIMARY ANTIBODIES | |||
| Anti-Tyrosine Hydroxylase Antibody | Millipore Sigma | AB1542 | Sheep polyclonal (1:1000 dilution), RRID: AB_90755 |
| Anti-Tyrosine Hydroxylase Antibody, clone LNC1 | Millipore Sigma | MAB318 | Mouse monoclonal (1:1000 dilution), RRID: AB_2201528 |
| Anti-Vesicular Acetylcholine Transporter (VAchT) Antibody | Sigma-Aldrich | ABN100 | Goat polyclonal (1:1000 dilution), RRID: AB_2630394 |
| GFP Antibody | Novus Biologicals | NB600-308 | Rabbit polyclonal (1:1000 dilution), RRID: AB_10003058 |
| Phox2b Antibody (B-11) | Santa Cruz Biotechnology | sc-376997 | Mouse monoclonal (1:1000 dilution), RRID: AB_2813765 |
| SECONDARY ANTIBODIES | |||
| Alexa Fluor 488 AffiniPure Donkey Anti-Rabbit IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Ms, Rat, Shp Sr Prot) | Jackson ImmunoResearch | 711-545-152 | Donkey anti-Rabbit (1:400 dilution), RRID: AB_2313584 |
| AMCA AffiniPure Donkey Anti-Sheep IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 713-155-147 | Donkey anti-Sheep (1:400 dilution), RRID: AB_AB_2340725 |
| Cy5 AffiniPure Donkey Anti-Goat IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 705-175-147 | Donkey anti-Goat (1:400 dilution), RRID: AB_2340415 |
| Cy5 AffiniPure Donkey Anti-Mouse IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Rb, Rat, Shp Sr Prot) | Jackson ImmunoResearch | 715-175-151 | Donkey anti-Mouse (1:400 dilution), RRID: AB_2619678 |
| Cy5 AffiniPure Donkey Anti-Sheep IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 713-175-147 | Donkey anti-Sheep (1:400 dilution), RRID: AB_2340730 |
| RNASCOPE PROBES | |||
| Galanin Receptor 1 oligonucleotide probe | ACDBio | 448821-C1 | targets bp 482 - 1669 (Genebank ref: NM_008082.2) |
| Glycine transporter 2 oligonucleotide probe | ACDBio | 409741-C3 | targets bp 925 - 2153 (Genebank ref: NM_148931.3) |
| Phox2b oligonucleotide probe | ACDBio | 407861-C2 | targets bp 1617 - 2790 (Genebank ref: NM_008888.3) |
参考文献
- Wang, F., et al. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Annese, T., et al. RNAscope dual ISH-IHC technology to study angiogenesis in diffuse large B-cell lymphomas. Histochemistry and Cell Biology. 153 (3), 185-192 (2020).
- Morrison, J. A., McKinney, M. C., Kulesa, P. M. Resolving in vivo gene expression during collective cell migration using an integrated RNAscope, immunohistochemistry and tissue clearing method. Mechanisms of Development. 148, 100-106 (2017).
- Gross-Thebing, T., Paksa, A., Raz, E. Simultaneous high-resolution detection of multiple transcripts combined with localization of proteins in whole-mount embryos. BMC Biology. 12, 55 (2014).
- Stempel, A. J., Morgans, C. W., Stout, J. T., Appukuttan, B. Simultaneous visualization and cell-specific confirmation of RNA and protein in the mouse retina. Molecular Vision. 20, 1366-1373 (2014).
- Kersigo, J., et al. A RNAscope whole mount approach that can be combined with immunofluorescence to quantify differential distribution of mRNA. Cell and Tissue Research. 374 (2), 251-262 (2018).
- Grabinski, T. M., Kneynsberg, A., Manfredsson, F. P., Kanaan, N. M. A method for combining RNAscope in situ hybridization with immunohistochemistry in thick free-floating brain sections and primary neuronal cultures. PLoS One. 10 (3), 0120120 (2015).
- Baleriola, J., Jean, Y., Troy, C., Hengst, U. Detection of axonally localized mRNAs in brain sections using high-resolution in situ hybridization. Journal of Visualized Experiments. (100), e52799 (2015).
- Fe Lanfranco, M., Loane, D. J., Mocchetti, I., Burns, M. P., Villapol, S. Combination of fluorescent in situ hybridization (FISH) and immunofluorescence imaging for detection of cytokine expression in microglia/macrophage cells. Bio-Protocol. 7 (22), (2017).
- Dereli, A. S., Yaseen, Z., Carrive, P., Kumar, N. N. Adaptation of respiratory-related brain regions to long-term hypercapnia: focus on neuropeptides in the RTN. Frontiers in Neuroscience. 13, 1343 (2019).
- Lazarenko, R. M., et al. Acid sensitivity and ultrastructure of the retrotrapezoid nucleus in Phox2b-EGFP transgenic mice. Journal of Comparative Neurology. 517 (1), 69-86 (2009).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Paxinos, G., Franklin, K. B. . The mouse brain in stereotaxic coordinates. , (2004).
- Abercrombie, M. Estimation of nuclear population from microtome sections. Anatomical Records. 94, 239-247 (1946).
- Kerr, N., et al. The generation of knock-in mice expressing fluorescently tagged galanin receptors 1 and 2. Molecular and Cellular Neurosciences. 68, 258-271 (2015).
- Kachidian, P., Pickel, V. M. Localization of tyrosine hydroxylase in neuronal targets and efferents of the area postrema in the nucleus tractus solitarii of the rat. Journal of Comparative Neurology. 329 (3), 337-353 (1993).
- Stornetta, R. L., et al. Expression of Phox2b by brainstem neurons involved in chemosensory integration in the adult rat. Journal of Neuroscience. 26 (40), 10305-10314 (2006).
- Gilmor, M. L., et al. Expression of the putative vesicular acetylcholine transporter in rat brain and localization in cholinergic synaptic vesicles. Journal of Neuroscience. 16 (7), 2179-2190 (1996).
- Fisher, J. M., Sossin, W., Newcomb, R., Scheller, R. H. Multiple neuropeptides derived from a common precursor are differentially packaged and transported. Cell. 54 (6), 813-822 (1988).
- Towle, A. C., Lauder, J. M., Joh, T. H. Optimization of tyrosine-hydroxylase immunocytochemistry in paraffin sections using pretreatment with proteolytic-enzymes. Journal of Histochemistry and Cytochemistry. 32 (7), 766-770 (1984).
- Biancardi, V., et al. Mapping of the excitatory, inhibitory, and modulatory afferent projections to the anatomically defined active expiratory oscillator in adult male rats. Journal of Comparative Neurology. 529 (4), 853-884 (2021).
- Matthews, D. W., et al. Feedback in the brainstem: an excitatory disynaptic pathway for control of whisking. Journal of Comparative Neurology. 523 (6), 921-942 (2015).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Shi, S. R., Key, M. E., Kalra, K. L. Antigen retrieval in formalin-fixed, paraffin-embedded tissues: an enhancement method for immunohistochemical staining based on microwave oven heating of tissue sections. Journal of Histochemistry and Cytochemistry. 39 (6), 741-748 (1991).
- Yamashita, S., Katsumata, O. Heat-induced antigen retrieval in immunohistochemistry: mechanisms and applications. Methods in Molecular Biology. 1560, 147-161 (2017).
- Yamashita, S., Okada, Y. Mechanisms of heat-induced antigen retrieval: analyses in vitro employing SDS-PAGE and immunohistochemistry. Journal of Histochemistry and Cytochemistry. 53 (1), 13-21 (2005).
- Yamashita, S. Heat-induced antigen retrieval: mechanisms and application to histochemistry. Progress in Histochemistry and Cytochemistry. 41 (3), 141-200 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。